一种负载脂溶性药物的T细胞及其方法和应用
文献发布时间:2023-06-19 13:48:08
技术领域
本发明涉及纳米医学技术领域,尤其涉及T细胞负载脂溶性药物的方法及其应用。
背景技术
肿瘤的发病率今年呈现上升趋势,通过化疗方法治疗肿瘤依然是目前的主流治疗方案。化疗药物虽然在临床上被广泛使用,但是肿瘤细胞容易对其产生耐受,并且脂溶性化疗药物的溶解度问题也限制了化疗药物对肿瘤进程的控制。现有技术中,难溶性药物在体内吸收度低,通过制备前药或成盐的方式改善溶解度则会增加成本或改变药效。
对此,现有技术中还有采用细胞负载的方案,例如Gu等人通过利用药物的氨基,将药物通过成酰胺反应连接到细胞上;Tang等人通过制备蛋白凝胶,再利用CD45蛋白将凝胶通过酰胺键负载在T细胞上,同时限制其内吞;Li等人通过将蜂毒素多肽连接到巨噬细胞表面等,为细胞治疗提供了基本的研究方法。而通过化学键将药物或者蛋白药物连接到细胞上会对细胞功能造成不同程度的损伤。Feng等人通过LPS的与细胞膜上的CD14和Toll-likereceptor 4(TLR4)受体结合,其方法虽然比较温和,但是连接效率并不理想,受体的表达量会因为细胞受到不同的刺激而发生改变。除此之外,通过化学修饰和配体受体结合的方法容易导致修饰上的药物被细胞降解。
发明内容
为解决现有技术中难溶性化学药物的给药问题,本发明提供以T细胞负载脂溶性药物的方法及其应用,根据相似相溶原理,通过一步法将脂溶性药物修饰在细胞膜表面以及通过细胞内吞作用,将采用T细胞对脂溶性药物进行负载。
为实现上述目的,本发明采取的技术方案为:
本发明第一方面提供T细胞负载脂溶性药物的方法,包括如下步骤:
(1)将脂溶性药物溶解于DMSO中,得到溶液I;
(2)将步骤(1)得到的溶液I添加到T细胞溶液中,孵育;
(3)将孵育后的细胞溶液静置后离心、洗涤,即可得到负载有脂溶性药物的T细胞,
所述脂溶性药物优选为脂溶性阿霉素。
所述T细胞优选为Jurkat细胞。
进一步地,步骤(1)中,溶液I中所述脂溶性药物的浓度为1-20mg/L。例如2mg/L、3mg/L、4mg/L、5mg/L、6mg/L、7mg/L、8mg/L、9mg/L、10mg/L、11mg/L、12mg/L、13mg/L、14mg/L、15mg/L、16mg/L、17mg/L、18mg/L、19mg/L、20mg/L。
在某些具体的实施方式中,溶液I中所述脂溶性药物的浓度为1mg/L、5mg/L、10mg/L、15mg/L、20mg/L或它们之间任意的浓度。
进一步地,步骤(2)中,所述混合溶液中所述脂溶性药物的浓度为1-150μg/mL。
在某些具体的实施方式中,所述所述混合溶液中所述脂溶性药物的浓度为1μg/mL、10μg/mL、50μg/mL、100μg/mL、150μg/mL或它们之间任意的浓度。
进一步地,步骤(2)中,所述孵育为37℃孵育1-6h。例如1h、2h、3h、4h、5h、6h。
进一步地,步骤(3)中,所述离心为1000rpm离心3min。
进一步地,步骤(3)中,所述洗涤为磷酸盐缓冲溶液洗涤。
本发明第二方面提供由上述方法制备的负载脂溶性药物的T细胞,所述脂溶性药物为脂溶性阿霉素,所述脂溶性药物大部分包裹在所述T细胞的表面,随着时间的推移会被细胞进一步内吞。所述T细胞优选为Jurkat细胞。所述脂溶性药物优选为脂溶性阿霉素。
本发明第三方面提供上述负载脂溶性药物的T细胞在制备治疗癌症的药物中的应用。
进一步地,所述癌症为肺癌,优选为A549原位癌。
本发明第四方面提供T细胞作为脂溶性药物载体,用于制备抗肿瘤药物的用途。
本发明第四方面提供上述负载脂溶性药物的Jurkat细胞在制备提高受试者对阿霉素敏感度的产品中的应用。
上述技术方案具有如下优点或者有益效果:
本发明提供一种细胞载药方法,通过相似相溶原理将脂溶性药物分子负载于T细胞(Jurkat细胞)。本发明通过一步法将脂溶性药物分子与Jurkat细胞膜融合同时被其内吞制备负载脂溶性药物的Jurkat细胞,该方法简单,高效且稳定。本发明意外地发现,脂溶性药物仅仅通过与T细胞的共同孵育,即可基于相似相容原理,与脂溶性的细胞膜相容,并吸附,同时基于细胞的内吞作用,获得负载脂溶性药物的T细胞。更重要的是负载于T细胞后会对T细胞产生影响,在24小时左右会导致T细胞的活性消失。该意外发现大大避免了由于T细胞摄入带来的免疫风暴等副作用的风险。另外,本发明还意外发现在给药过程中以及与肿瘤细胞或组织相互作用中,T细胞与脂溶性抗肿瘤药物是相互作用的。T细胞不仅仅作为脂溶性药物的载体,依赖归巢效应使抗肿瘤药物快速达到抗肿瘤位点,更重要的是,抗肿瘤药物还会对T细胞产生刺激,使其大量产生微管,而大量的微管进一步促进了抗肿瘤药物在肿瘤细胞中的分布,进一步提高了药效。此外本发明还具有以下优点:①T细胞为人体来源的免疫细胞,安全性高;②本发明提供的制备方法可以改善纳米药物或者细胞制剂对于实体瘤的渗透难题;③本发明提供的载药策略成本低,而制备方法非常简单,杜绝了连接剂以及连接反应对细胞的伤害,为细胞的存活率提供了保障,该制备方法简便易行,便于操作推广。
本发明还进一步提供上述方法制备的负载阿霉素的Jurkat细胞及其应用,本发明提供的负载阿霉素的Jurkat细胞,首次实现阿霉素与治疗性T细胞的连接,具有以下优点:①脂溶性阿霉素可以与Jurkat细胞膜融合同时被细胞内吞,提高载药量;②阿霉素能够刺激促进Jurkat细胞产生更多的微管,实现阿霉素在细胞间的再分布;③Jurkat细胞作为人体细胞,安全性高,且由于肿瘤归巢效应,可以主动聚集到肿瘤部位。④负载阿霉素的Jurkat细胞可以利用Jurkat细胞的肿瘤趋向性,将其聚集于肺部的非小细胞肺癌部位,高效杀伤A549细胞。
附图说明
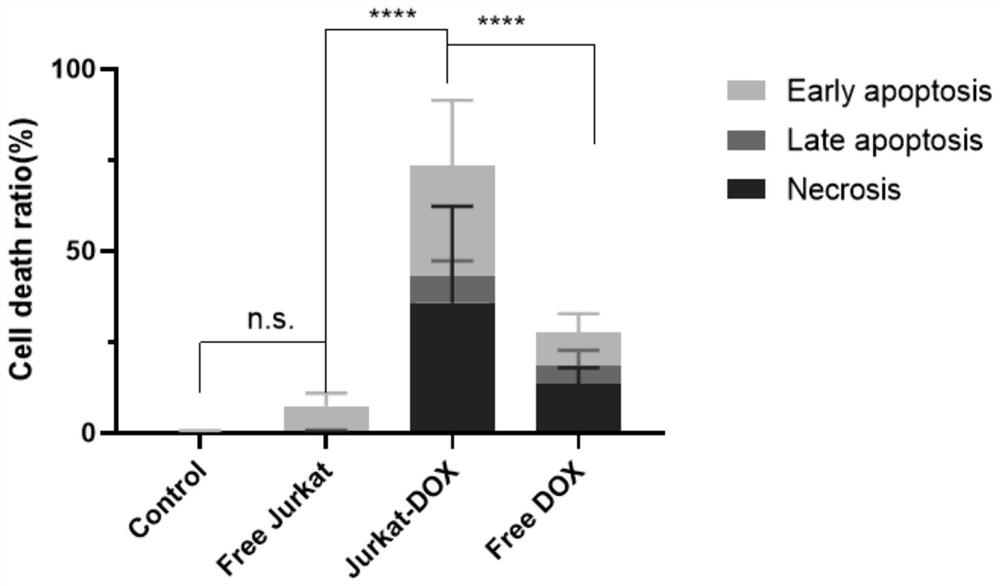
图1是实施例1中Jurkat细胞载药诱导细胞凋亡的统计结果图(其中,(control为空白对照组,Free Jurkat为不装载DOX的Jurkat细胞组,Free DOX为游离药物组,Jurkat-DOX为载药的Jurkat细胞组)。
图2是实施例1中Jurkat细胞载药对A549原位瘤的治疗效果图(其中,Saline空白对照组,Free Jurkat为不装载DOX的Jurkat细胞组,Free DOX为游离药物组Jurkat-DOX为载药的Jurkat细胞组)。
图3为DOX负载于Jurkat细胞后激光共聚焦成像结果。
图4为载DOX后不同时间点的细胞活力对比。
具体实施方式
下述实施例仅仅是本发明的一部分实施例,而不是全部的实施例。因此,以下提供的本发明实施例中的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明的实施例,本领域技术人员在没有作出创造性劳动的前提下所获得的所有其他实施例,都属于本发明的保护范围。
下述实施例中,阿霉素简写为DOX。下述实施例中,所采用的试剂、仪器、测试方法等若无特别指出均为本领域常规所用。
实施例1:负载阿霉素的Jurkat细胞Jurkat-DOX的制备
本实施例中,负载阿霉素的Jurkat细胞Jurkat-DOX细胞通过以下步骤制备:
①将DOX溶于DMSO中,浓度为5mg/mL;
②将Jurkat细胞加入步骤(1)得到的溶液,使DOX的浓度控制在20μg/mL,37℃孵育3小时;
③1000转,离心3分钟,磷酸盐缓冲溶液(PBS)洗三遍。即得负载阿霉素的Jurkat细胞Jurkat-DOX细胞。
实施例2负载阿霉素的Jurkat细胞诱导肿瘤细胞凋亡实验
用流式细胞仪,通过Annexin V-647/PI试剂盒,分析Jurkat细胞载DOX之后诱导细胞凋亡的结果,具体操作按照试剂盒说明书进行。具体如下:.悬浮细胞离心(2000rpm离心5min)收集;贴壁细胞用不含EDTA的胰酶消化收集(注:胰酶消化时间不易过长,否则容易引起假阳性);2.用PBS洗涤细胞二次(2000rpm离心5min)收集1~5×105细胞;3.加入500μL的Binding Buffer悬浮细胞;4.加入5μL Annexin V-647混匀后,加入5μL PropidiumIodide,混匀;5.室温、避光、反应5~15min;6.在1hour内,进行流式细胞仪的检测,激发波长按仪器说明进行设置Ex=647nm。分别为空白对照组(control),不装载DOX的Jurkat细胞组(Free Jurkat),游离药物组(Free DOX)以及载药的Jurkat细胞组(Jurkat-DOX)。
实验结果见图1,从图中可以看出,Jurkat细胞装载了DOX之后诱导细胞凋亡的效果明显强于游离药物组,且不装载DOX的Jurkat细胞几乎没有诱导细胞凋亡的能力,说明了T细胞与脂溶性抗肿瘤药物协同作用,实现了显著的诱导A549凋亡的效果。
实施例3负载阿霉素的Jurkat细胞的抗肿瘤动物实验
图2所示为细胞载DOX对于A549原位瘤的治疗效果。建立A549原位肿瘤模型2周后开始给药。4周后用Micro-CT观察裸鼠的肿瘤进程。所用的检测系统为Micro-CT成像系统Bruker skyscan 1278。先将动物用水合氯醛进行麻醉,等动物进入深度麻醉之后,进行Micro-CT拍摄,拍摄过程按照仪器说明操作。
实验组分为空白对照组(Saline),不装载DOX的Jurkat细胞组(Free Jurkat),游离药物组(Free DOX)以及载药的Jurkat细胞组(Jurkat-DOX)。从图2中可以看出,Jurkat细胞装载了DOX之后能有效抑制A549原位瘤的生长,视野范围内,肺部轮廓清晰,而FreeJurkat组和Free DOX组肺部大面积已经被肿瘤侵占,肺部轮廓不清晰。所以可知,Jurkat-DOX可以有效抑制A549原位瘤的生长。
实施例4药物与T细胞相互作用
将实施例1制备获得的DOX负载于Jurkat细胞,15-18小时之后用奥林巴斯激光共聚焦(Olympus FV 3000)成像,细胞核用hoechst染色(绿色),激发波长346,DOX为红色,激发波长488。
实验结果见图3其中右上图为左图的放大图,右下图为右上图的进一步放大图。右上图箭头所指位置为细胞核,而右下图箭头所指位置为DOX,红色的DOX还没有完全进入细胞,此时的任然可以观察到完整的细胞形态,细胞仍然有活力。并且用即将进入细胞核的趋势,随着时间延长,红色的DOX将于绿色的细胞核重叠,DOX发挥其抗肿瘤作用,裂解细胞核DNA,细胞死亡,失去活性。
为验证负载DOX后细胞活力是否下降,并最终导致细胞死亡,采用细胞活力试剂盒进行检测。细胞活力在某种程度上可反映细胞的健康状态。使用碧云天发光法细胞活力检测试剂盒来评估上述Jurkat细胞活力。该试剂盒的原理是通过化学发光法测定细胞内ATP含量来表征活细胞数目,ATP是最重要的能量分子,也是具有代谢活性细胞的重要标志性分子,它与活细胞数目成良好的线性关系。该试剂盒,借助ATP依赖的萤光素酶催化的萤光素发光反应,ATP可以通过测定化学发光来进行定量从而反映细胞活力。
实验结果见图4,载DOX后在12小时以内,细胞活力都基本保持在70%以上,随着时间的延长,细胞活力开始降低,到达24小时时,负载DOX的Jurkat细胞活力显著下降,说明DOX开始进入细胞核并发挥毒性作用。
通常T细胞注射后会在机体内引起免疫风暴等副作用,而在本发明的技术方案中,申请人发现Jurkat细胞负载阿霉素后,24h之内,药物并未完全分散至细胞核,使细胞能够保持一定的活性,24h之后,药物大部分进入细胞核,同时细胞失去活性,即死亡。而将负载阿霉素的Jurkat细胞注射体内后,其到达肿瘤部位在15min中内就可以完成。因此将Jurkat细胞负载阿霉素后,24h之内将其注入体内,既可以利用T细胞自然归巢的特点将其富集于肿瘤部位,同时避免了免疫风暴等副作用,从而产生协同作用,增强对肿瘤细胞的杀伤性。
以上所述仅为本发明的优选实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书及附图内容所作的等效变换,或直接或间接运用在其他相关的技术领域,均同理包括在本发明的专利保护范围内。
