一种用于环境新冠病毒检测的表位印迹传感器及制备方法
文献发布时间:2024-01-17 01:28:27
技术领域
本发明涉及印迹传感器技术领域,具体涉及一种用于环境新冠病毒检测的表位印迹传感器及制备方法。
背景技术
以新冠病毒(SARA-CoV-2)为代表的病原微生物感染和传播已对人类健康构成威胁,并对全球社会和经济带来了严重影响,开发快速可靠的检测方法,对于防止进一步感染,控制大流行具有十分重要的意义。SARS-CoV-2病毒可在体外环境存活较长时间,尤其是在作为粪便等受纳介质的污水中,含有包括SARA-CoV-2等病原微生物,不但能够反映病原微生物的流行和发展,还能提供早期预警,因此,对污水中的SARS-CoV-2进行检测是必要的。
常用的SARS-CoV-2检测手段,如核酸检测和抗体-抗原检测多应用于临床,在环境检测中普遍存在价格昂贵、过程复杂、速度较慢、稳定性差等问题。污水环境中介质复杂,干扰物质较多,需要开发一种高特异性、简单、快速的检测方法。分子印迹电化学传感器是模拟抗原-抗体的合成材料涂层装置,具有简单、高特异性和快速的特点,可实现污水中SARS-CoV-2的检测。
表位印迹在蛋白质印迹中占据很大优势,已成为改善蛋白质印迹的替代方案。表位是蛋白质结构中的一小段片段(即短氨基酸片段),使用表位充当活性位点,即表位应位于蛋白质表面,并可能与相应的受体存在相互作用。
表位印迹克服了蛋白质印迹中面临的主要问题,如蛋白质构象易变、不利于洗脱等。表位肽缺乏二级结构或三级结构,有助于稳定,能耐印迹聚合物的合成条件,并且更容易从聚合物基质中去除,因此得到了广泛的应用。此外,表位肽比蛋白质便宜,可定制合成,因此在用于识别的印迹材料中更具有吸引力。
发明内容
因此,本发明提供一种用于环境新冠病毒检测的表位印迹传感器及制备方法。
本发明的技术方案是:一种表位印迹传感器,所述表位印迹传感器采用半胱氨酸修饰的新冠N蛋白序列作为模板分子、以Au电极为基底电极、采用东莨菪亭为单体的电聚合法制备得到。
说明:通过使用表位充当活性位点,即表位应位于蛋白质表面,并可能与相应的受体存在相互作用;表位印迹克服了蛋白质印迹中面临的主要问题,如蛋白质构象易变、不利于洗脱等;通过东莨菪亭聚合溶液与模板分子的亲和力较强,二者结合效果较好;通过将电极浸入聚合溶液,以电极电压作为驱动力使其反应生成聚合物,后洗脱模板分子得电活性聚合膜或非电活性聚合膜,操作简单能极大地提升传感器的性能。
进一步地,所述表位印迹传感器的制备方法包括以下步骤:
S1、表位模板分子的预吸附与自组装单层的形成:
S1-1、将半胱氨酸修饰肽以1mg:1ml的比例溶解在PBS-TCEP缓冲液中,搅拌溶解,得到新冠N蛋白表位肽溶液,放置在4℃条件中备用;
采用三电极体系,Au电极作为工作电极、AgCl/Ag作为参比电极,铂丝电极作为对电极;并将Au电极进行预处理;
S1-2、以7μl:993μl的比例,将新冠N蛋白表位肽溶液加入到PBS-TCEP缓冲液中,然后将预处理后的Au电极放入其中,并在室温下孵育放置5~65min,
S1-3、孵育完成后,用蒸馏水冲洗预处理Au电极表面,得到自组装单层Au电极备用;
S2、表位印迹传感器的制备
以2mg:19mL的比例,将东莨菪亭溶解在0.1M的氯化钠溶液中得到混合液,然后加入占混合液体积分数5%的无水乙醇,得到聚合溶液;
将步骤S1-3得到的Au电极放入聚合溶液,采用多步安培法将东莨菪亭沉积在Au电极表面,
沉积方法为:在0v下沉积5s、0.7v下沉积1s,记为一个周期,进行10~40个脉冲周期;用循环伏安法和差分脉冲伏安法进行验证聚合是否成功;
然后通过时间-电流法将Au电极在PBS中0.9v下放置30s,将模板分子去除,结束后将Au电极取出,用蒸馏水反复清洗多次去除表面残留的新冠N蛋白表位肽;得到表位印迹传感器。
说明:通过上述制备方法,首先对表位模板进行预吸附,使其形成自组装单层,由于新冠N蛋白表位肽电活性较弱,因此额外添加电活性物质[Fe(CN)6]
进一步地,步骤S1-1中,所述Au电极预处理方法为:将Au电极在含氧化铝粉末的麓皮上打磨至光滑,之后依次在乙醇、蒸馏水中超声30s,然后将电极置于0.05mol/L[Fe(CN)
说明:通过上述预处理方法,能够去除金表面的杂质以及氧化层,进而保证金电极表面应用的纯净度与稳定性,确保反应的准确度。
进一步地,将预处理后的Au电极保存在质量分数为70%H
说明:通过上述对金电极的保存,能够避免金与外界接触,影响其稳定性与表面性质。
进一步地,步骤S1-1及S1-2中所述PBS-TCEP缓冲液为将PBS缓冲液与TCEP混合得到;其中PBS-TCEP缓冲液中TCEP的浓度为5mM。
说明:通过PBS缓冲液与TCEP混合,TCEP具有还原合成肽中的半胱氨酸残基、半胱氨酸特异性标签标记以及含半胱氨酸化合物的修饰的作用;可以防止蛋白质样品的氧化,PBS缓冲液溶解保护试剂的作用,通过二者的配合作用,能够促进位模板的预吸附自组装单层。
进一步地,PBS缓冲液的配制方法为:将71.6g的Na
说明:由于PBS缓冲液具有盐平衡、可调整的适宜pH缓冲作用,抑制某些酶的催化过程等的作用,其可以使新冠N蛋白表位肽的存放更加稳定。
进一步地,还包括对步骤S1-2中所述孵育时间的确定,确定方法为:将步骤S1-3得到的自组装单层Au电极在浓度为5mM的[Fe(CN)
说明:通过上述以[Fe(CN)
进一步地,还包括对步骤S2中所述脉冲周期个数的确定,确定方法为:在10~40个脉冲周期中,根据循环伏安法和差分脉冲伏安法找到峰电流变化最大值对应的脉冲周期循环个数,即为最优脉冲周期个数。
说明:循环次数是影响聚东莨菪亭膜厚度的重要影响因素,聚合膜过厚会导致传感器上的表位肽难以去除,形成的印迹空穴较少;膜过薄,可能在模板去除后,能特异性识别模板的空穴位点减少,印迹空穴选择性变差;通过上述峰电流变化最大值设定,表明此时形成的印迹空穴最多即为最优。
进一步地,将所述表位印迹传感器应用于水环境中新冠病毒的检测,检测方法为:取待检测水样,过0.22μm的滤膜,然后将表位印迹传感器放入水中样孵育放置50min,随后利用DPV测量氧化还原峰电流的响应变化值。
说明:通过上述方式能够较为科学的对实际水样中的新冠病毒的N蛋白进行检测。
进一步地,判断所述表位印迹传感器是否可用于污水环境中新冠N蛋白的检测;判断方法为:通过加标法计算确定新冠N蛋白回收率,然后通过重复实验计算RSD相对标准偏差,RSD=回收率结果的标准偏差/算数平均值*100%;判断回收率是否大于1且RDS值小于10%,是则说明表位印迹传感器可用于污水环境中新冠N蛋白的检测;否则说明不适用。
说明:通过上述判断方法,能够有效判断表位印迹传感器是否能够应用于实际水样中新冠N蛋白的检测使用。
本发明的有益效果是:
(1)本发明能够通过使用表位充当活性位点,即表位应位于蛋白质表面,并可能与相应的受体存在相互作用;表位印迹克服了蛋白质印迹中面临的主要问题,如蛋白质构象易变、不利于洗脱等;通过东莨菪亭聚合溶液与模板分子的亲和力较强,二者结合效果较好;以铁氰化钾/亚铁氰化钾为电活性探针,通过分析模板分子与印迹位点上结合后,探针分子在印迹传感器表面的扩散情况引起峰电流的变化,对制备的传感器进行选择性和抗干扰性性能进行评价;通过将电极浸入聚合溶液,以电极电压作为驱动力使其反应生成聚合物,后洗脱模板分子得电活性聚合膜或非电活性聚合膜,操作简单,能提升传感器的性能。
(2)本发明通过制备方法,首先对表位模板进行预吸附,使其形成自组装单层,由于表位序列中的半胱氨酸上巯基侧链对金具有较高的亲和力,能够促进表位多肽在金电极上的吸附,实现模板分子在共价键作用力下形成单层点位膜,加强模板分子的吸附,通过东莨菪亭单体以及沉积方法进行聚合,能够提高沉积聚合效果,采用半胱氨酸修饰肽的表位印迹,具有构象比较稳定、且易于洗脱的优点,有利于新冠N蛋白表位肽的脱除,从而得到表位印迹传感器。
(3)本发明通过PBS缓冲液与TCEP混合,TCEP具有还原合成肽中的半胱氨酸残基、半胱氨酸特异性标签标记以及含半胱氨酸化合物的修饰的作用;可以防止蛋白质样品的氧化,PBS缓冲液溶解保护试剂的作用,通过二者的配合作用,能够促进位模板的预吸附自组装单层。
附图说明
图1是本发明表位印迹传感器的SEM图;
图2是本发明表位印迹传感器的选择性峰电流信号变化图;
图3是本发明表位印迹传感器的抗干扰性峰电流信号变化图;
图4是本发明表位印迹传感器对新冠N蛋白的线性峰电流信号变化图;
图5是本发明表位印迹传感器对新冠N蛋白的选择性峰电流信号变化图;
图6是本发明表位印迹传感器的实际应用峰电流信号变化图;
图7是本发明表位印迹传感器最优脉冲周期峰电流信号变化图;
图8是本发明表位印迹传感器最优孵育时间峰电流信号变化图;
图9是本发明循环伏安法和差分脉冲伏安法进行聚合验证的氧化还原峰电流图。
具体实施方式
下面结合具体实施方式来对本发明进行更进一步详细的说明,以更好地体现本发明的优势。
实施例1:
一种用于环境新冠病毒检测的表位印迹传感器,所述表位印迹传感器采用半胱氨酸修饰的新冠N蛋白序列(GSNQNGERSGARS-Cysteine)作为模板分子、以Au电极为基底、采用东莨菪亭为单体的电聚合法电极制备得到;
所述表位印迹传感器的制备方法包括以下步骤:
S1、表位模板的预吸附与自组装单层的形成:
S1-1、将半胱氨酸修饰肽以1mg:1ml的比例溶解在PBS-TCEP缓冲液中,搅拌溶解,得到新冠N蛋白表位肽溶液,放置在4℃条件中备用;
采用三电极体系,Au电极作为工作电极、AgCl/Ag作为参比电极,铂丝电极作为对电极;并将Au电极进行预处理;
Au电极预处理方法为:将Au电极在含氧化铝粉末的麓皮上打磨至光滑,之后依次在乙醇、蒸馏水中超声30s,然后将电极置于0.05mol/L[Fe(CN)
将预处理后的Au电极保存在质量分数为70%H
S1-2、以7μl:993μl的比例,将新冠N蛋白表位肽溶液加入到PBS-TCEP缓冲液中,然后将预处理后的Au电极放入其中,并在室温下孵育放置60min,
S1-3、孵育完成后,用蒸馏水冲洗预处理Au电极表面,得到自组装单层Au电极备用;
孵育时间的确定:将步骤S1-3得到的自组装单层Au电极在浓度为5mM的[Fe(CN)
S2、表位印迹传感器的制备
以2mg:19mL的比例,将东莨菪亭溶解在0.1M的氯化钠溶液中得到混合液,然后加入占混合液体积分数5%的无水乙醇,得到聚合溶液;
将步骤S3-1得到的Au电极放入聚合溶液,采用多步安培法将东莨菪亭沉积在Au电极表面,
脉冲周期个数确定:根据循环伏安法和差分脉冲伏安法找到峰电流变化最大值对应的脉冲周期循环个数,即为最优脉冲周期个数;如图8所示,确认25脉冲周期为最优;
沉积方法为:在0v下沉积5s、0.7v下沉积1s,记为一个周期,进行25个脉冲周期;用循环伏安法和差分脉冲伏安法进行验证聚合是否成功;结果如图9所示,在金电极(a)上预结合了表位后(曲线b),氧化还原峰电流急剧下降,这表明非电活性的表位结合在金电极上后,阻碍了[Fe(CN)
然后通过时间-电流法将Au电极在PBS中0.9v下放置30s,将模板分子去除,结束后将Au电极取出,用蒸馏水反复清洗多次去除表面残留的多肽;得到表位印迹传感器。
步骤S1-1中所述PBS-TCEP缓冲液为将PBS缓冲液与TCEP混合得到;其中PBS-TCEP缓冲液中TCEP的浓度为5mM;
PBS缓冲液的配制方法为:将71.6g的Na
实施例2
本实施例与实施例1不同之处在于,一种表位印迹传感器在实际水样中的应用,其应用方法为:取待检测水样,过0.22μm的滤膜,然后以0.1ng:1ml的比例,向待检测水样中加入新冠N蛋白;将表位印迹传感器放入水中样孵育放置50min,随后利用DPV测量氧化还原峰电流的响应变化值。
实施例3
本实施例与实施例2不同之处在于,判断所述表位印迹传感器是否可用于污水环境中新冠N蛋白的检测;通过加标法计算确定新冠N蛋白回收率,然后通过重复实验计算RSD相对标准偏差,RSD=回收率结果的标准偏差/算数平均值*100%;判断回收率是否大于1且RDS值小于10%,是则说明表位印迹传感器可用于污水环境中新冠N蛋白的检测;否则说明不适用。
实验例
一、电化学性能测试
由于新冠N蛋白表位肽电活性较弱,因此实验中需要额外添加电活性物质作氧化还原反应探针,5mmol/L的[Fe(CN)6]
当聚合膜中形成空穴时,探针能进入电极表面发生反应,电子传荷阻抗减小,而靶分子与印迹空穴再结合后,传荷阻抗增大;传感器的性能检测用差分脉冲法(DPV)来记录峰电流变化;
循环伏安测试条件为电位-0.2~0.6v,扫描速率100mv/s;DPV的测试条件在电位0~0.6v,脉冲振幅50mv,脉冲周期0.5s,脉冲宽度0.05s,脉冲增量0.004v下进行;EIS测试在开路电压0.23v,频率范围为0.1~106Hz下进行;
结果如图1,利用场发射扫描电子显微镜对表位印迹传感器进行形貌表征,表位印迹传感器的表面形貌,观察到印迹传感器表面较粗糙疏松,凹凸不平,这可能与洗脱模板分子后留下的印迹空腔有关,表明印迹聚合物成功修饰在电极表面上。
二、表位印迹的选择性
如图2,研究了表位印迹传感器对新冠N蛋白表位和相似片段的选择性,根据序列比对结果,将SARS-COV(DNNQNGGRNGARP)即图2中DNN、MERS序列(NTNLSRGRGR)即图2中NTN和O157:H7(TGVDAAAQAA)即图2中TGV作为竞争性肽;
在优化条件下,表位印迹传感器对0.05μM新冠N蛋白表位肽的峰电流信号(GSNQNGERSGARS-Cysteine)变化最强,是其他干扰肽段的5倍以上,这表明所制备的表位印迹传感器对模板表位肽的吸附有较好的选择性,不受其他结构类似物的干扰;这证实了通过表位印迹法产生了与靶分子互补的识别位点,在表位溶液中表现出较高的特异性。
三、表位印迹传感器在水环境中的抗干扰性测试
单一干扰物存在时表位印迹传感器识别新冠N蛋白的抗干扰性,即将印迹传感器分别与50mg/l的牛血清蛋白、5mg/L葡萄糖、0.1mg/ml抗性基因NDM-1、1mg/L HA和0.35mg/ml NaCl孵育10min,采用DPV方法记录孵前后峰电流的变化表示表位印迹传感器的抗干扰性,
如图3,分别在0.05uM的表位肽、5mg/L的葡萄糖即图3中Glucose、0.35mg/L的NaCl、1mg/L的HA、50mg/L的BSA和0.1mg/L的NDM-1中研究干扰物对Peptide-MIP的影响,结果显示,在表位肽溶液中,Peptide-MIP的峰电流响应变化了33.4uA,这分别是葡萄糖、NaCl、HA、BSA、NDM-1溶液中的10.4、18、4、2、20倍,这一结果进一步证明了表位印迹传感器具有很好的抗干扰性。
四、表位印迹传感器对新冠N蛋白的线性和选择性
蛋白质表位由蛋白质表面上的氨基酸残基组成,以表位为模板,克服了蛋白质印迹过程中构象的不稳定性,理论上更有利于提高分子印记的识别能力将表位印迹传感器与0.01~0.5ng/mL的新冠N蛋白反应一段时间后,记录DPV峰电流变化,研究了表位印迹传感器对新冠N蛋白的线性表位印迹传感器对新冠N蛋白的吸附;
如图4,在新冠N蛋白浓度为0.01ng/mL~0.5ng/mL的新冠N蛋白浓度范围内,表位印迹传感器的峰电流响应信号随浓度升高而升高;在0.01~0.06ng/mL的范围内随着新冠N蛋白浓度的增加,峰电流差变化呈现出线性变化(y=2.154×10-4x+9.527×10-6,R2=0.94),在0.1~0.5ng/mL范围内呈现出线性变化(y=3.683×10-5x+1.641×10-5,R2=0.99),检出限为6.96pg/mL(S/N=3)。
五、表位印迹传感器对蛋白的特异性
实验以脱脂奶粉、酪蛋白、鸡卵清蛋白和牛血清蛋白为竞争性蛋白,研究表位印迹传感器对新冠N蛋白的特异性识别。在上述优化条件下,表位印迹传感器和0.1ng/mL的竞争蛋白溶液孵育后,用DPV检测孵育前后探针的氧化还原峰电流变化。非印迹传感器NIP的孵育与印迹传感器MIP步骤一样;分别将表位印迹传感器置于0.1ng/mL的上述蛋白溶液中,孵育50min后,利用DPV研究孵育前后氧化还原峰电流的响应变化。
如图5,发现表位印迹传感器在新冠N蛋白溶液中的响应信号变化最大(20.3μA),即认为特异性较好,其余对比分别是鸡卵清蛋白即图5中的(OVA)、酪蛋白即图5中的(Casein)、脱脂奶粉即图5中的(SMP)和牛血清蛋白即图5中的(BSA)需要在每一项后面补充对应的英文的6.96、7.19、8.38、3.35倍。与NIP相比,表位印迹传感器的电流响应分别是NIP的6.71、5.40、3.94、4.72、4.35倍,这与表位印迹传感器上的印迹空穴有关。
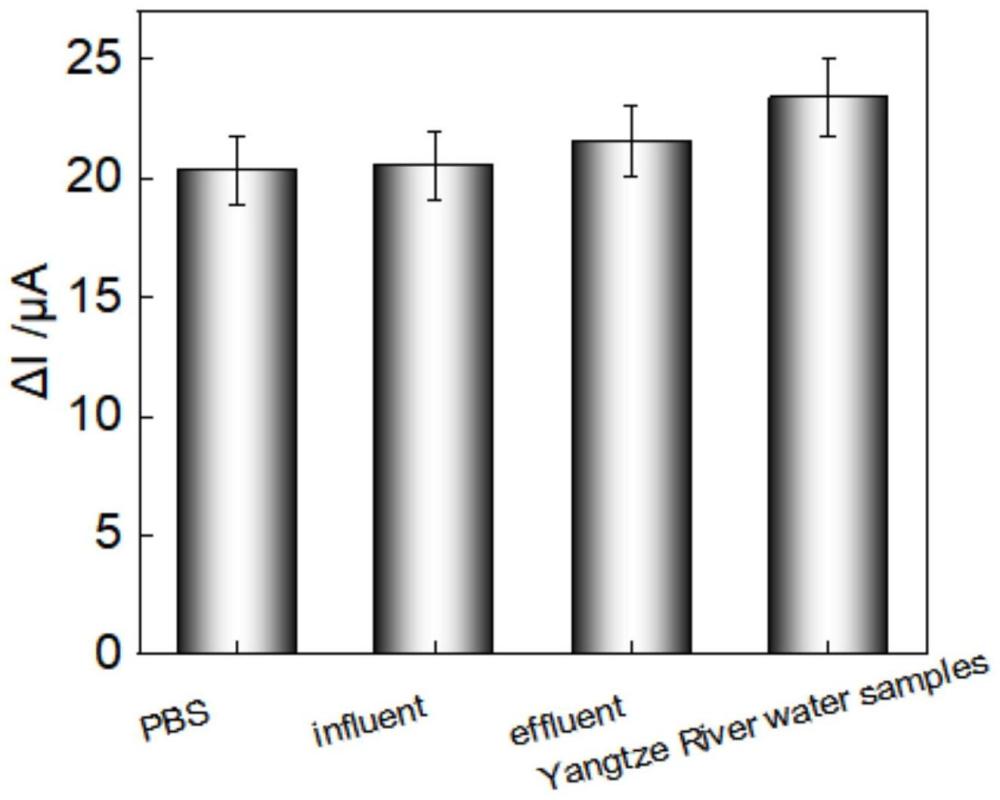
六、表位印迹传感器在实际水样中的应用
研究表位印迹传感器对来自污水厂进水、出水、和长江水样;如实施例2、实施例3的方式检测表位印迹传感器与水样孵育前后的峰电流差,实验结果如图6所示,PBS、在进水、出水和长江水样中均检测到新冠N蛋白,且其回收率在102%~120%范围内,RDS在3.11%~5.60%之间,这表明,该传感器适用于污水环境中新冠N蛋白的检测。
- 一种用于诺氟沙星分子印迹电化学传感器的修饰电极及其制备方法
- 一种检测罗丹明B的聚集诱导发光-分子印迹荧光传感器的制备方法及应用
- 一种用于检测酪胺的碳点-分子印迹聚合物试纸条及其制备方法和应用
- 一种用于三聚氰胺检测的溶胶凝胶分子印迹微球的制备方法
- 一种用于检测阿特拉津的电化学适配体传感器及其制备和检测方法
- 一种可用于检测新冠病毒刺突蛋白的分子印迹微型电化学生物传感器及其制备方法和应用
- 一种可用于检测新冠病毒刺突蛋白的表面分子印迹电化学生物传感器及其制备方法和应用
