基于血液的肿瘤突变负荷预测非小细胞肺癌的总存活
文献发布时间:2023-06-19 12:02:28
技术领域
本披露内容总体上涉及用于治疗非小细胞肺癌患者的方法,所述方法基于使用基于血液的肿瘤突变负荷来预测用德瓦鲁单抗(Durvalumab)和/或曲美木单抗(tremelimumab)和/或化疗剂治疗的患者的总存活。本披露内容还涉及基于与对免疫疗法的敏感性或抗性相关的循环肿瘤DNA中的突变进行鉴定来治疗非小细胞肺癌患者的方法。
背景技术
具有高治疗前肿瘤突变负荷(“TMB”)的非小细胞肺癌(“NSCLC”)患者在用免疫检查点抑制剂治疗后已显示出改善的结果(Yarchoan等人,N.Engl.J.Med.[新英格兰医学杂志]377(25):2500-01(2017);Snyder等人,N.Engl.J.Med.[新英格兰医学杂志]371(23):2189-99(2014);Le等人,Science[科学]357(6349):409-13(2017);Rizvi等人,Science[科学]348(6230):124-28(2015);Rizvi等人,J.Clin.Oncol.[临床肿瘤学杂志]36(7):633-41(2018);Hellmann等人,Cancer Cell[癌细胞]33(5):843-52(2018);Carbone等人,N.Engl.J.Med.[新英格兰医学杂志]376(25):2415-26(2017);Hellmann等人,N.Engl.J.Med.[新英格兰医学杂志]378(22):2093-104(2018))。在血液中测量TMB也已经成为丰富对PD-1/L1疗法有应答的NSCLC患者的有前途的新方法(Gandara等人,Ann.Oncol.[肿瘤学年鉴]28(增刊5):v460-v496(2017);Planchard等人,Ann.Oncol.[肿瘤学年鉴]29(增刊4):iv192-iv237(2018))。报告显示,在一线和二线环境中具有高血液TMB(“bTMB”)的NSCLC患者具有改善的无进展存活和应答率。然而,组织TMB(“tTMB”)或bTMB与用抗PD-1/L1抗体治疗的NSCLC患者的总存活之间的相关性尚未显示。
发明内容
本披露内容提供一种在有需要的患者中预测癌症治疗成功的方法,其包括确定患者的肿瘤突变负荷(TMB),其中高TMB预测治疗成功。
本披露内容还提供一种在有需要的患者中治疗癌症的方法,其包括:(a)确定患者的TMB;(b)确定TMB是高还是低;以及(c)如果TMB高则治疗或继续治疗,或者如果TMB低则不治疗或中止治疗。
本披露内容还提供一种在有需要的患者中预测癌症治疗成功的方法,其包括确定所述患者是否在含富含AT的相互作用结构域的蛋白1A基因(ARID1A)中具有体细胞突变,其中体细胞突变预测治疗成功。
本披露内容还提供一种在有需要的患者中治疗癌症的方法,其包括:(a)确定所述患者是否在丝氨酸/苏氨酸激酶11基因(STK11)、Kelch样ECH相关蛋白1基因(KEAP1)、含富含AT的相互作用结构域的蛋白1A基因(ARID1A)或K-Ras基因中的至少一个中具有体细胞突变;以及(b)如果患者在丝氨酸/苏氨酸激酶11基因(STK11)、Kelch样ECH相关蛋白1基因(KEAP1)、含富含AT的相互作用结构域的蛋白1A基因(ARID1A)或K-Ras基因中的至少一个中具有体细胞突变,则治疗或继续治疗。
本披露内容的其他特征和优点将根据具体实施方式和权利要求书变得明显。
附图说明
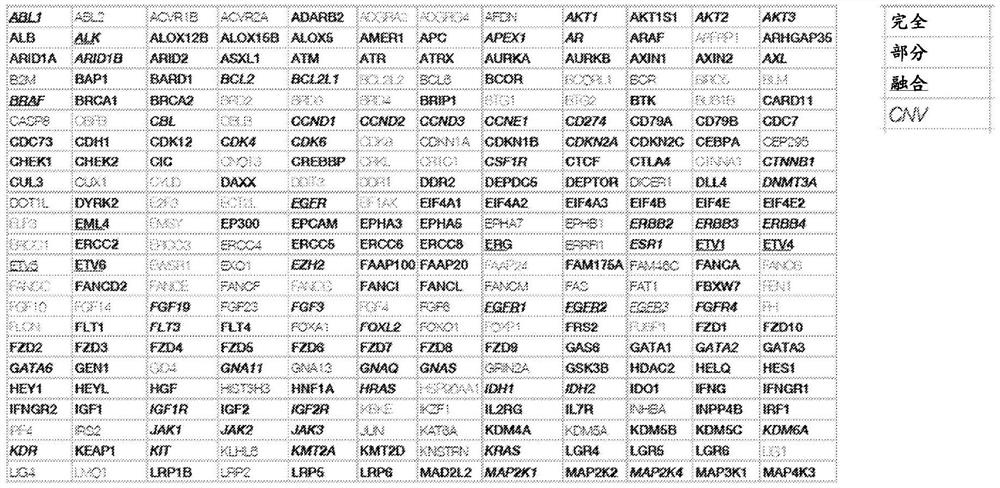
图1显示包括在TMB分析中的基因列表。
图2显示用德瓦鲁单抗(D)相对于化疗(CT)或德瓦鲁单抗和曲美木单抗(D+T)相对于化疗(CT)治疗的肿瘤细胞(TC)具有PD-L1表达≥25%的患者的总存活。
图3显示用德瓦鲁单抗相对于化疗或德瓦鲁单抗和曲美木单抗相对于化疗治疗的肿瘤细胞(TC)具有PD-L1表达≥25%的患者的无进展存活(PFS)。
图4显示主要分析群体。使用Cox比例风险模型进行分析,其中采用治疗项和感兴趣的亚组协变量。根据性别、年龄、免疫细胞PD-L1表达、组织学、吸烟史和种族分亚组。使用事后分析进行根据性能状态的亚组分析。*CI显示为97.54%。
图5显示MYSTIC研究中两种TMB测量工具的相关性。相关图基于具有匹配的血液和组织TMB数据的352名患者。使用线性回归来估计参考线。
图6A-6C显示ITT和血液和组织TMB可评价群体的总存活。
图7显示跨血液TMB截止值的总存活分析。
图8显示血液TMB≥16和<16mut/Mb的患者的总存活率。
图9显示维恩(Venn)图,其指示基于血液TMB和PD-L1的患者亚群的重叠。*百分比由意向治疗群体计算(所有随机化患者;N=1118)。
图10显示血液TMB≥20和<20mut/Mb的患者的总存活率。
图11显示血液TMB≥20和<20mut/Mb的患者的无进展存活(PFS)。
图12A-12B显示血液TMB≥10和<10mut/Mb的患者的总存活率。
图13显示TMB算法。
图14显示用德瓦鲁单抗和曲美木单抗(D+T)相对于化疗(CT)治疗的肿瘤细胞(TC)具有PD-L1表达≥50%的患者的总存活(OS)。
图15显示用德瓦鲁单抗和曲美木单抗(D+T)相对于化疗(CT)治疗的肿瘤细胞(TC)具有PD-L1表达≥1%的患者的总存活(OS)。
图16显示组合高bTMB或肿瘤细胞(TC)<1%提高患病率且降低功效。
图17显示组合高bTMB或肿瘤细胞(TC)≥25%提高患病率且降低功效。
图18显示MYSTIC研究中患者的KEAP1、STK11和ARID1A基因突变的患病率。(943名可评价的)患者中的324名在3个基因KEAP1、STK11或ARID1A中的一个中具有突变。
图19显示根据组织学和治疗的突变患病率。与鳞状组织学相比,STK11和KEAP1突变在非鳞状组织学患者中更为普遍。STK11、KEAP1和ARID1A突变患病率在治疗组之间是平衡的。
图20显示根据bTMB状态的突变患病率。
图21显示根据PD-L1表达的突变患病率。
图22显示根据患者的突变状态,使用德瓦鲁单抗和曲美木单抗(德瓦鲁单抗+曲美木单抗)、德瓦鲁单抗单一疗法(德瓦鲁单抗)或化疗的客观应答率。
图23显示针对KEAP1m相对于KEAP1wt,用德瓦鲁单抗和曲美木单抗、德瓦鲁单抗单一疗法或化疗治疗的所有突变可评价患者的总存活。每组包括用德瓦鲁单抗和曲美木单抗、德瓦鲁单抗单一疗法或化疗治疗的患者;m=突变阳性;mOS=中位总存活;wt=野生型。
图24显示针对KEAP1m相对于KEAP1wt,用德瓦鲁单抗单一疗法相对于化疗或德瓦鲁单抗+曲美木单抗相对于化疗治疗的患者的总存活。
图25显示在所有突变可评价患者中STK11m与STK11wt的总存活。每组包括用德瓦鲁单抗和曲美木单抗、德瓦鲁单抗单一疗法或化疗治疗的患者。
图26显示针对STK11m相对于STK11wt,用德瓦鲁单抗单一疗法相对于化疗或德瓦鲁单抗+曲美木单抗相对于化疗治疗的患者的总存活。
图27显示在所有突变可评价患者中STK11m/KEAP1m和STK11m/KRASm相对于野生型的总存活。每组包括用德瓦鲁单抗和曲美木单抗、德瓦鲁单抗单一疗法或化疗治疗的患者。
图28显示在所有突变可评价患者中ARID1Am和ARID1Awt的总存活。每组包括用德瓦鲁单抗和曲美木单抗、德瓦鲁单抗单一疗法或化疗治疗的患者。
图29显示针对ARID1Am相对于ARID1wt,用德瓦鲁单抗单一疗法相对于化疗或德瓦鲁单抗+曲美木单抗相对于化疗治疗的患者的总存活。
具体实施方式
本披露内容总体上涉及用于治疗非小细胞肺癌患者的方法,所述方法基于使用基于血液的肿瘤突变负荷来预测用德瓦鲁单抗和/或曲美木单抗和/或化疗剂治疗的患者的总存活。本披露内容还涉及基于与对免疫疗法的敏感性或抗性相关的循环肿瘤DNA(ctDNA)中的突变进行鉴定来治疗非小细胞肺癌患者的方法。
本披露内容至少部分地基于通过bTMB对独特患者子集的鉴定。如本文所述,对于德瓦鲁单抗与曲美木单抗组合治疗,bTMB比PD-L1表达水平更能预测总存活。在一些实施例中,对于德瓦鲁单抗单一疗法治疗+/-化疗剂,bTMB也比PD-L1表达水平更能预测总存活。在进一步的实施例中,对于德瓦鲁单抗治疗与曲美木单抗+/-化疗剂组合治疗,bTMB比PD-L1表达水平更能预测总存活。
如根据本披露内容所使用的,除非另外指出,否则所有技术和科学术语应被理解为具有与本领域普通技术人员通常理解的相同含义。除非上下文另有要求,否则单数术语应包括复数形式,并且复数术语应包括单数形式。
在一些实施例中,本文提供一种在有需要的患者中预测癌症治疗成功的方法,其包括确定患者的肿瘤突变负荷(TMB),其中高TMB预测治疗成功。
“肿瘤突变负荷”或“TMB”是指在肿瘤中发现的突变的数量。TMB在不同肿瘤类型之间有所不同。一些肿瘤类型比其他类型具有更高的突变率。TMB可通过本领域已知的各种工具测量。在某些实施例中,这些工具是基础医学和监护健康测量工具。如本文所述,发现对特定基因集合中潜在的新抗原编码突变的评价与德瓦鲁单抗与曲美木单抗组合治疗相关。确定肿瘤是否具有高水平或低水平的肿瘤突变负荷可以通过与具有相似肿瘤的参照群体比较并确定表达的中值或平均水平来确定。在一些实施例中,高TMB被定义为≥12至≥20个突变/兆碱基(mut/Mb)。在其他实施例中,高TMB被定义为≥16个突变/兆碱基(mut/Mb)。在其他实施例中,高TMB被定义为≥20个突变/兆碱基(mut/Mb)。
如本文所用,术语“MYSTIC”是指研究NCT02453282,其为与NSCLC中的标准护理相比,德瓦鲁单抗连同或不连同曲美木单抗的III期开放标签一线治疗研究。
在一些实施例中,方法包括用德瓦鲁单抗治疗。如本文所用,术语“德瓦鲁单抗”是指选择性结合PD-L1并阻断PD-L1与PD-1和CD80受体结合的抗体,如在美国专利号9,493,565(称为“2.14H9OPT”)中披露的,将其通过引用以其全文并入本文。德瓦鲁单抗的片段可结晶(Fc)结构域在IgG1重链的恒定结构域中含有三重突变,该三重突变减少与负责介导抗体依赖性细胞介导的细胞毒性(“ADCC”)的补体成分C1q和Fcγ受体的结合。德瓦鲁单抗可以在体外解除PD-L1介导的对人T细胞活化的抑制,并且经由T细胞依赖性机制在异种移植物模型中抑制肿瘤生长。
在一些实施例中,本文披露的方法包括用曲美木单抗治疗。如本文所用,术语“曲美木单抗”是指选择性结合CTLA-4多肽的抗体,如在美国专利号8,491,895(称为“克隆11.2.1”)中披露的,将其通过引用以其全文并入本文。曲美木单抗对人CTLA-4具有特异性,与相关的人蛋白质无交叉反应性。曲美木单抗阻断CTLA-4的抑制作用,因此增强T细胞活化。曲美木单抗显示最小的与Fc受体的特异性结合,不诱导天然杀伤(NK)ADCC活性,并且在板结合聚集后不传递抑制信号。
在一些实施例中,本文披露的方法包括用包含abraxane、卡铂、吉西他滨、顺铂、培美曲塞或紫杉醇中的至少一种的化疗剂治疗。在一些实施例中,化疗剂包括abraxane+卡铂、吉西他滨+顺铂、吉西他滨+卡铂、培美曲塞+卡铂、培美曲塞+顺铂或紫杉醇+卡铂。
在一些实施例中,本文披露的方法包括用德瓦鲁单抗、曲美木单抗和化疗剂治疗。在其他实施例中,本文披露的方法包括用德瓦鲁单抗和化疗剂治疗。在其他实施例中,本文披露的方法包括用德瓦鲁单抗治疗。
在一些实施例中,患者在丝氨酸/苏氨酸激酶11基因(STK11)、Kelch样ECH相关蛋白1基因(KEAP1)、含富含AT的相互作用结构域的蛋白1A基因(ARID1A)或K-Ras基因中的至少一个中具有体细胞突变。STK11和KEAP1突变状态对转移性非小细胞肺癌(mNSCLC)患者的OS具有预测性。在一些实施例中,与具有野生型STK11或KEAP1 mNSCLC的患者相比,STK11或KEAP1 mNSCLC中的突变对较短OS具有预测性。在一些实施例中,ARID1A中的突变用作预测接受德瓦鲁单抗+曲美木单抗治疗的患者中OS改善的生物标记物。
术语“ARID1A”包括“全长”未加工的ARID1A以及在细胞中加工产生的任何形式的ARID1A。该术语还包括ARID1A的天然存在的变体,例如剪接变体或等位基因变体。
术语“KEAP1”包括“全长”未加工的KEAP1以及在细胞中加工产生的任何形式的KEAP1。该术语还包括KEAP1的天然存在的变体,例如剪接变体或等位基因变体。
术语“STK11”包括“全长”未加工的STK11以及在细胞中加工产生的任何形式的STK11。该术语还包括STK11的天然存在的变体,例如剪接变体或等位基因变体。
术语“K-Ras”包括“全长”未加工的K-Ras以及在细胞中加工产生的任何形式的K-Ras。该术语还包括K-Ras的天然存在的变体,例如剪接变体或等位基因变体。
在一些实施例中,本文披露了在有需要的患者中治疗癌症的方法,该方法包括:
(a)确定所述患者的TMB;
(b)确定TMB是高还是低;以及
(c)如果TMB高则治疗或继续治疗,或者如果TMB低则不治疗或中止治疗。
确定TMB是否高可能随肿瘤类型而变化。确定肿瘤是否具有高水平或低水平的肿瘤突变负荷可以通过与具有相似肿瘤的参照群体比较并确定表达的中值或平均水平来确定。在一些实施例中,将TMB的水平分为低(1-5个突变/mb)、中等(6-15个突变/mb)和高(≥16个突变/mb)。
在一些实施例中,治疗的成功由与标准护理相比OS的增加来确定。“标准护理”(SOC)和“基于铂的化疗”是指包含abraxane、卡铂、吉西他滨、顺铂、培美曲塞或紫杉醇中的至少一种的化疗治疗。在一些实施例中,SOC包括abraxane+卡铂、吉西他滨+顺铂、吉西他滨+卡铂、培美曲塞+卡铂、培美曲塞+顺铂或紫杉醇+卡铂。
如文中所用,总存活(“OS”)是指从治疗日期到因任何原因导致的死亡日期的时间段有。OS可以指一段时间(例如12个月、18个月、24个月等)内的总生存。
在一些实施例中,本文提供一种在有需要的患者中预测癌症治疗成功的方法,其包括确定患者是否在含富含AT的相互作用结构域的蛋白1A基因(ARID1A)中具有体细胞突变,其中体细胞突变预测治疗成功。
在一些实施例中,本文提供了一种在有需要的患者中治疗癌症的方法,其包括:(a)确定所述患者是否在丝氨酸/苏氨酸激酶11基因(STK11)、Kelch样ECH相关蛋白1基因(KEAP1)、含富含AT的相互作用结构域的蛋白1A基因(ARID1A)或K-Ras基因中的至少一个中具有体细胞突变;以及(b)如果患者在丝氨酸/苏氨酸激酶11基因(STK11)、Kelch样ECH相关蛋白1基因(KEAP1)、含富含AT的相互作用结构域的蛋白1A基因(ARID1A)或K-Ras基因中的至少一个中具有体细胞突变,则治疗或继续治疗。
术语“患者”旨在包括人和非人动物、特别是哺乳动物。
在一些实施例中,本文披露的方法涉及治疗受试者的肿瘤障碍和/或癌症障碍。在一些实施例中,癌症选自黑素瘤、乳腺癌、胰腺癌、肺癌(例如非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC))、肝细胞癌、胆管癌或胆道癌、胃癌、食管癌、头颈癌、肾癌、宫颈癌、结肠直肠癌或尿道上皮膀胱癌。
如本文所用,术语“治疗(treatment或treat)”是指治疗性治疗。需要治疗的那些包括患有癌症的受试者。在一些实施例中,本文披露的方法可以用于治疗肿瘤。在其他实施例中,肿瘤的治疗包括抑制肿瘤生长、促进肿瘤减小、或既抑制肿瘤生长又促进肿瘤减小。
如本文所用的术语“施用(administration或administering)”是指通过任何适当的途径提供、接触和/或递送一种或多种化合物以实现所需效果。施用可以包括但不限于口服、舌下、肠胃外(例如,静脉内、皮下、皮内、肌内、关节内、动脉内、滑膜内、胸骨内、鞘内、病灶内或颅内注射)、透皮、局部、颊、直肠、阴道、鼻、眼、经由吸入以及植入物。
如本文所用,术语“药物组合物”或“治疗性组合物”是指当适当地向受试者施用时能够诱导所需治疗效果的化合物或组合物。在一些实施例中,本披露内容提供了药物组合物,其包含药学上可接受的载体和治疗有效量的至少一种本披露内容的抗体。
在不限制本披露内容的情况下,以下出于说明目的描述了本披露内容的多个实施例。
实例
以下实例示例了本披露内容的具体实施例及其各种用途。阐述它们仅出于解释目的并且不应以任何方式解释为限制本发明的范围。
本文所述的MYSTIC研究是3期研究,其比较了连同或不连同曲美木单抗的德瓦鲁单抗与基于铂的化疗作为转移性NSCLC的一线治疗。
患者
患有IV期NSCLC的成年患者是符合条件的,条件是他们先前没有接受过晚期/转移性NSCLC的全身治疗,具有东部合作肿瘤小组表现状态0-1,根据实体瘤应答评价标准1.1版(RECIST v1.1)的可测量的疾病(Chaft等人,Cancer Res.[癌症研究]78(13增刊)(摘要CT113)(2018)),和随机化之前已知肿瘤PD-L1表达状态。排除具有致敏性EGFR突变或ALK重排的患者和具有症状性、不稳定脑转移的患者。
研究设计和治疗
将患者以1∶1∶1的比例随机化,根据PD-L1 TC≥25%相比于<25%和组织学分层为每4周接受德瓦鲁单抗20mg/kg,每4周接受德瓦鲁单抗20mg/kg加曲美木单抗1mg/kg(最多4剂),或接受4-6个周期的基于铂的双重化疗。患者继续治疗直至客观疾病进展(根据RECIST v1.1),发生需要中止治疗的不良事件(AE)或撤回同意书。
终点和评估
主要终点为免疫治疗组与化疗组相比的总存活(OS;从随机分组到因任何原因导致死亡的时间),和德瓦鲁单抗加曲美木单抗组与化疗组相比的无进展存活(PFS;从随机分组到根据盲法独立中心审查[BICR]的客观疾病进展或死亡的时间),均在PD-L1 TC≥25%的患者中进行。在PD-L1 TC≥25%的患者中评估主要终点。次要终点包括德瓦鲁单抗与化疗相比的PFS,两种免疫疗法组与化疗相比的客观应答率(ORR)和应答持续时间(DOR)(均在PD-L1 TC≥25%的患者中进行),以及安全性和耐受性。还确定了包括TMB在内的生物标记物与临床结果之间关系的研究。
使用VENTANA PD-L1(SP263)免疫组织化学(IHC)测定法(Ventana MedicalSystems,美国亚利桑那州土桑)(Rebelatto等人,Diagn.Pathol.[诊断病理学]11(1):95(2016))在中心实验室使用多个截止值评估PD-L1表达。允许在筛选前3个月内获得的肿瘤样品。在Dako PD-L1 IHC 22C3 pharmDx和VENTANA PD-L1(SP263)IHC测定之间的动态范围内证明了强大的分析一致性(Hirsch等人,J.Thorac.Oncol.[胸肿瘤学期刊]12(2):208-22(2017);Ratcliffe等人,Clin.Cancer Res.[临床癌症研究]23(14):3585-91(2017))。
使用RECIST v1.1通过BICR评估肿瘤应答,前48周每6周进行成像,然后每8周进行成像,直到确认疾病进展。随访患者的存活情况。根据美国国立癌症研究所不良事件通用术语标准4.03版对AE进行分级。
使用由500个基因构成的GuardantOMNI下一代测序平台(Guardant Health,美国加利福尼亚州红木城)评价血液TMB(图1)。图1中所示的所有基因是TMB的潜在标识符,并且每个基因或基因组合的相关性将随患者而变化。
OMNI TMB算法结合了体细胞单核苷酸变异(SNV)、短插入/缺失(indel)、拷贝数扩增和融合,并被优化以计算具有低无细胞循环肿瘤DNA含量的血液样品的TMB(MerckSharp&Dohme.
统计学分析
需要约1092名患者(包括480名PD-L1 TC≥25%的患者)以获得231起PFS事件用于德瓦鲁单抗加曲美木单抗和化疗组的主要PFS分析,以及225起OS事件用于各治疗组比较的主要OS分析。
基于意向治疗(ITT)分析功效,包括所有随机化患者或基于PD-L1表达或TMB水平的该群体的子集。安全性分析包括接受至少一剂研究治疗的所有患者(治疗群体)。为了将I型错误控制在5%(双侧),在终点、分析群体和治疗方案中使用具有门控策略的分级多重测试程序。使用针对组织学调整的分层对数秩检验进行主要PFS分析,使用Cox比例风险模型估计风险比(HR)和99.5%置信区间(CI)。使用类似的方法进行主要OS分析,使用双侧97.54%和98.77%Ci估计HR,分别用于比较德瓦鲁单抗和德瓦鲁单抗加曲美木单抗与化疗。使用卡普兰-梅尔(Kaplan-Meier)方法生成存活曲线。
对于对PD-L1 TC≥1%和ITT群体进行的二次分析,还针对PD-L1表达状态对分层进行了调整(TC≥25%相对于TC<25%)。使用逻辑回归模型计算用于比较治疗组之间ORR的优势比和95%CI,针对与PFS和OS相同的因素进行调整。使用未分层的对数秩检验进行预先指定的TMB分析,使用Cox比例风险模型估计HR和95%Ci。
结果
在1118名随机分组的患者中,1092名(97.7%)患者接受至少一剂研究治疗(369名接受德瓦鲁单抗,371名接受德瓦鲁单抗加曲美木单抗,352名接受化疗)。在化疗组中,对于鳞状和非鳞状组织学患者,最常见的方案分别是吉西他滨加卡铂(49.5%)和培美曲塞加卡铂(54.5%)。共488名患者的PD-L1 TC≥25%(主要分析群体;43.6%的随机分组患者)。PD-L1 TC≥25%的患者的基线人口统计学资料和疾病特征通常与ITT群体一致并在治疗组之间保持平衡。
在PD-L1 TC≥25%的患者中,德瓦鲁单抗组中25名、德瓦鲁单抗加曲美木单抗组中18名、化疗组中1名仍在进行研究治疗。在这些患者中,德瓦鲁单抗组中5名和德瓦鲁单抗加曲美木单抗组中1名经治疗而进展,德瓦鲁单抗加曲美木单抗组中5名接受曲美木单抗再治疗。停止研究治疗后,德瓦鲁单抗组中73名(44.8%)患者,德瓦鲁单抗加曲美木单抗组中61名(37.4%)患者以及化疗组中95名(58.6%)患者接受了后续全身癌症治疗。在这些患者中,德瓦鲁单抗组的73名患者中有10名(13.7%)、德瓦鲁单抗加曲美木单抗组的61名患者中有5名(8.2%)、化疗组的95名患者中有64名(67.4%)接受了免疫治疗。
1.功效
OS的中位随访期为30.2个月(范围:0.3-37.2)。在PD-L1 TC≥25%的患者中,与化疗相比,德瓦鲁单抗和德瓦鲁单抗加曲美木单抗在统计学上没有显著改善OS。德瓦鲁单抗组的中位OS为16.3个月,化疗组的中位OS为12.9个月(死亡HR,0.76;97.54%CI,0.56-1.02;P=0.036)(图2)。德瓦鲁单抗组的24个月OS率为38.3%(95%CI,30.7-45.7),化疗组为22.7%(16.5-29.5)。与化疗组相比,用德瓦鲁单抗治疗的大多数计划患者亚组的OS数值改善(图4)。德瓦鲁单抗加曲美木单抗的中位OS为11.9个月,24个月OS率为35.4%(95%CI,28.1-42.8)(与化疗组相比,死亡HR,0.85;98.77%CI,0.61-1.17;P=0.202)(图2)。ITT群体和通过不同PD-L1表达水平(TC<1%,≥1%,≥25-49%和≥50%)定义的亚组中的OS如表1所示。
表1:ITT群体和PD-L1表达亚组中的总存活。
*ITT群体包括所有随机分组的患者。
PFS的中位随访时间为10.6个月(范围,0-18)。德瓦鲁单抗组和化疗组之间(次要终点;图3)或德瓦鲁单抗加曲美木单抗与化疗组之间(主要终点;图3)的PFS无统计学显著差异。德瓦鲁单抗加曲美木单抗组的中位PFS为3.9个月(95%CI,2.8-5.0),化疗组为5.4(4.6-5.8)(疾病进展或死亡HR,1.05;99.5%CI,0.72-1.53;P=0.705);德瓦鲁单抗加曲美木单抗组的12个月PFS发生率为25.8%(95%CI,18.9-33.1),化疗组为14.3%(8.4-21.7)。
在PD-L1 TC≥25%的患者中,德瓦鲁单抗组的ORR为35.6%,德瓦鲁单抗加曲美木单抗组为34.4%,化疗组为37.7%(表2)。免疫疗法组中未达到中位DOR,而化疗组为4.4个月。免疫疗法治疗组中更多的患者在12个月时保持应答(德瓦鲁单抗组、德瓦鲁单抗加曲美木单抗组和化疗组分别为61.3%、54.9%和18.0%)(表2)。
表2:PD-L1 TC≥25%患者的肿瘤应答总结。
主要分析群体。*根据RECIST v1.1通过盲法独立中心审查的ORR定义为具有至少1次访视应答为完全应答或部分应答的患者的数量(%)。
分别来自1118名随机分组的患者中的809名(72%)和460名(41%)的血液和组织预处理样品可评价TMB。TMB值与PD-L1表达水平不相关(血液:斯皮尔曼ρ=0.05,斯皮尔曼r=0.01;组织:斯皮尔曼ρ=0.09,斯皮尔曼r=0.06)。在具有匹配的样品的患者中(n=352;31%随机分组的患者),bTMB与tTMB相关(斯皮尔曼ρ=0.6,斯皮尔曼r=0.7;图5)。bTMB和tTMB可评估群体中的基线特征与ITT群体一致并且在治疗组之间保持平衡。TMB可评价群体中的OS与三个治疗组中的ITT群体一致(图6A-6C)。相对于化疗,随着德瓦鲁单抗加曲美木单抗组的bTMB阈值增加,死亡HR逐渐提高(图7-8)。基于德瓦鲁单抗加曲美木单抗组的临床相关效应大小和患者群体派生的受益,选择血液TMB≥20mut/Mb进行进一步分析。就上下文而言,基于在NSCLC中使用纳武单抗加伊匹单抗的先前试验中显示可预测PFS和应答的阈值,研究tTMB≥10mut/Mb(Hellmann等人,N.Engl.J.Med.[新英格兰医学杂志]378(22):2093-104(2018);Ready等人,J.Clin.Oncol.[临床肿瘤学杂志]37(12):992-1000(2019))。在高于10mut/Mb的tTMB阈值的进一步分析受到小样品量的限制。在bTMB≥20mut/Mb或tTMB≥10的患者中,有吸烟史和鳞状组织学的患者比例高于相应的较低TMB亚组。bTMB≥20mut/Mb群体和PD-L1 TC≥25%群体之间的重叠最小(9%随机分组的患者;图9)。
与化疗组相比,对于德瓦鲁单抗加曲美木单抗组,血液TMB≥20mut/Mb与OS改善相关(中位数,21.9和10.0个月;未调整的死亡HR,0.49[95%CI,0.32-0.74];图10);对于德瓦鲁单抗加曲美木单抗组,24个月OS率为48.1%(95%CI,35.5-59.7),而化疗组为19.4%(11.0-29.5)。相比之下,在bTMB<20mut/Mb的患者中,与化疗组相比,德瓦鲁单抗加曲美木单抗组的OS没有改善(中位数,8.5相对于11.6个月;未调整的死亡HR,1.16[95%CI,0.93-1.45];图10)。与化疗组相比,德瓦鲁单抗加曲美木单抗组的血液TMB≥20mut/Mb而非bTMB<20mut/Mb也与改善的PFS(图11)和ORR(表3)相关。
表3:血液TMB≥20mut/Mb和<20mut/Mb患者的肿瘤应答分析。
主要分析群体。*根据RECIST v1.1通过盲法独立中心审查的ORR定义为具有至少1次访视应答为完全应答或部分应答的患者的数量(%)。应答包括未确认的应答。
对于仅接受德瓦鲁单抗的bTMB≥20mut/Mb患者,中位OS为12.6个月(相对于化疗组,未调整的死亡HR,0.72;95%CI,0.50-1.05)。相对于德瓦鲁单抗组,德瓦鲁单抗加曲美木单抗组的死亡HR为0.74(95%CI,0.48-1.11;图10),这支持曲美木单抗的额外贡献。
与化疗组相比,两个免疫疗法组中的组织TMB≥10mut/Mb而非tTMB<10mut/Mb与数值更长的OS相关。德瓦鲁单抗加曲美木单抗组的中位OS为16.6个月,德瓦鲁单抗组为18.6个月,化疗组为11.9个月。与化疗组相比,德瓦鲁单抗加曲美木单抗组的死亡HR为0.72(95%CI,0.48-1.09),与化疗组相比,德瓦鲁单抗组为0.70(0.47-1.06)(图12A-12B)。
两种基于血液的算法显示与化疗组相比,D+T的结果得到改善(V2和V3;见图13)。选择V2算法是因为其比V3更简单,尽管两者都显示出类似的预测潜力。
无论使用的切割点如何,对于MYSTIC中的D+T,TMB比PD-L1表达水平更能预测OS。这与高PD-L1表达不相关,因此用bTMB鉴定了独特患者子集(图9)。另外,bTMB和PD-L1表达的组合增加了患者患病率,但降低了效果大小(图16和17)。
2.安全性
德瓦鲁单抗的中位实际治疗持续时间为16.0周(范围,0.4-148.6);在组合组中,德瓦鲁单抗和曲美木单抗分别为16.0周(0.6-161.3)和12.0周(0.6-32.0);化疗为17.9周(1.1-137.4)。
研究者认为与治疗相关的所有等级AE(TRAE)分别在用德瓦鲁单抗、德瓦鲁单抗加曲美木单抗和化疗治疗的患者中的54.2%、60.1%和83.0%中发生。德瓦鲁单抗组(14.9%)和德瓦鲁单抗加曲美木单抗组(22.9%)的≥3级TRAE的发生率低于化疗组(33.8%),德瓦鲁单抗组中具有导致中断的TRAE的患者较少(分别地,5.4%相比于13.2%和9.4%)。德瓦鲁单抗组中2名患者(0.5%)、德瓦鲁单抗加曲美木单抗组中6名患者(1.6%)、化疗组中3名患者(0.9%)出现治疗相关死亡。PD-L1 TC≥25%主要分析群体和bTMB≥20mut/Mb群体的安全性与总体安全群体一致。
德瓦鲁单抗组中13.6%患者、德瓦鲁单抗加曲美木单抗组中28.3%患者、化疗组中3.4%患者报告了免疫介导的AE。在分别为4.1%、10.8%和0.6%的患者中,这些事件3级或4级。
本研究中使用德瓦鲁单抗加曲美木单抗时,分析确定最佳OS受益的bTMB阈值≥20mut/Mb,以及在PFS和应答方面均有临床意义的改善。
本实例研究了所选突变和存活结果之间的关联。使用GuardantOMNI平台分析来自基线血浆样品的循环肿瘤DNA。样品来自1003名患者(89.7%的ITT群体)。943个样品可评估突变。在STK11、KEAP1或ARID1A或KRAS中具有或不具有非同义体细胞突变的患者中分析存活结果。
该研究表明,具有转移性NSCLC(“mNSCLC”)和丝氨酸/苏氨酸激酶11基因(STK11)或Kelch样ECH相关蛋白1基因(KEAP1)突变的患者与没有相应突变的患者相比,治疗组中观察到的结果较差。在接受D+T的患者中,与含富含AT的相互作用结构域的蛋白1A野生型基因(ARID1wt)相比,含富含AT的相互作用结构域的蛋白1A基因突变(ARID1Am)与存活益处相关。
在突变可评估的群体中,STK11m、KEAP1m和ARID1Am频率分别为16%、18%和12%(19%、20%和11%[非鳞状];7%、13%和15%[鳞状])(图18-21)。在治疗组中,具有STK11m或KEAP1m的mNSCLC患者的中位OS(“mOS”)短于具有STK11wt的mNSCLC患者(D,10.3相比于13.3个月;D+T,4.4相比于11.3个月;CT,6.7相比于13.1个月)或具有KEAP1wt的mNSCLC的患者(D,7.6相比于14.6个月;D+T,9.2相比于11.3个月;CT,6.3相比于13.3个月)(图22-27)。在D+T组中,具有ARID1Am的mNSCLC患者的mOS长于具有ARID1Awt的mNSCLC患者(D,8.6相比于13.7个月;D+T,23.2相比于9.8个月;CT,10.6相比于12.4个月)(图28-29)。
本说明书中提及的全部专利和出版物通过引用以相同的程度并入本文,如同每份单独的专利和出版物具体地且个别地指出通过引用并入。在本申请的任何部分中的任何参考文献的引用或标识不应被解释为承认这样的参考文献可用作针对本发明的现有技术。
- 基于血液的肿瘤突变负荷预测非小细胞肺癌的总存活
- 一种基于多种血液肿瘤突变基因检测用污物收纳装置
