一种芝麻蒴腐病病原菌的鉴定方法
文献发布时间:2023-06-19 18:46:07
技术领域
本发明涉及芝麻生产研究技术领域,具体是涉及一种芝麻蒴腐病病原菌的鉴定方法。
背景技术
芝麻,隶属于胡麻科胡麻属,是世界上最古老的油料作物之一,也是我国四大油料作物之一,用途广泛。芝麻在全世界有60多个国家种植,主要分布在亚洲和非洲,中国是继印度、苏丹、缅甸之后的第四大芝麻生产国,平均单产达到1400.7kg/hm2,居四大主产国之首。近几年,芝麻产区病害的发生导致我国芝麻产量不稳,年度间产量差异较大,进而影响到我国芝麻产业的稳定和正常发展。
芝麻蒴腐病是芝麻生产上的重要病害之一,近几年,芝麻蒴腐病在我国芝麻产区均有不同程度发生,尤其是河南、辽宁、吉林、内蒙古等省区发生严重。蒴腐病一般在7月份芝麻进入盛花期开始发病,8月上中旬达到发病高峰,发病严重时造成蒴果被深褐色或黑色病斑包裹,感病蒴果果皮薄而小、变形、坏死、变硬,顶部偶有裂口,导致种子不成熟、籽粒瘦瘪,降低芝麻产量和品质。现阶段国内外还未见有关芝麻蒴腐病的研究报道,对致病菌、发病规律还不清楚,这对病害的预测预报和防治工作造成障碍。因此,明确引起芝麻蒴腐病的病原菌及其生物学特性,对于该病的防治具有重要意义。
发明内容
针对现有技术存在的不足,本发明实施例的目的在于提供一种芝麻蒴腐病病原菌的鉴定方法,以解决上述背景技术中的问题。
为实现上述目的,本发明提供如下技术方案:
一种芝麻蒴腐病病原菌的鉴定方法,鉴定方法步骤如下:
步骤1:采集感病蒴果材料与菌株获取方法,采集芝麻感病蒴果,通过组织分离法获得病原菌菌株,对病原菌进行了形态鉴定;
步骤2:鉴定结果与结果分析,经柯赫氏法则对病菌的致病性进行验证,分析病菌的rDNA-ITS和EF-1α基因序列特征;
步骤3:得出结论并进行讨论,A.alternata的培养基为V8和PDA培养基;链格孢菌菌丝生长适宜温度为25~30℃,温度为28℃;适宜菌丝生长的pH值在5~8之间,碳源为葡萄糖,氮源为蛋白胨。
作为本发明进一步的方案,所述步骤1包括如下步骤:
步骤11:芝麻蒴腐病病原菌鉴定;
步骤12:芝麻蒴腐病病原菌生物学特性研究,将ZMHJ-12病原菌活化后于菌落边缘取直径5mm菌饼,接种到培养基平板中央,每皿1片,每处理重复4皿,28℃恒温培养箱中培养7d,采用十字交叉法测量菌落直径,并观察菌落的形态特征;
步骤13:数据分析,利用DPS软件对试验数据进行单因子方差分析,采用Duncan氏新复极差法进行差异显著性检测。
作为本发明进一步的方案,所述步骤11包括以下步骤:
步骤111:田间症状调查及病样采集,田间记录发病症状,将样本带回实验室进一步分离以及鉴定;
步骤112:病原菌分离纯化,采用组织分离法对病原菌进行分离以及纯化,取病健交界处组织,切取1-2cm正方小块,2%次氯酸钠表面消毒2min,用无菌水清洗3次,置于PDA培养基上,25℃培养。待病菌分生孢子产生后,在高倍体视镜下从PDA培养基上用接种针挑取单孢,获得纯化菌株,编号为ZMHJ-12;
步骤113:病原菌形态学鉴,将纯化的菌株接种于PDA培养基上25℃培养,观察记录菌落的颜色、形态、表面特征、生长速度以及边缘生长状况,在电子显微镜下观察孢子的类型、着生方式、大小、颜色以及分生孢子梗的特征;
步骤114:病原菌致病力测定,采用柯赫氏法则对分离所得病原物进行回接验证,将分离的病菌转接到PDA培养基上,置于25℃恒温培养箱培养5~7d,直至菌丝长满培养皿并产生大量孢子时,在培养皿中加入少量无菌水,用牙刷将培养皿上的菌丝体洗下,收集到消毒烧杯中,经2层纱布过滤后,用红细胞计数法将病菌孢子悬液浓度调节为2.5×10
步骤115:病原菌分子生物学鉴定,选取15个代表性菌株进行病原菌鉴定,将菌株于PDA培养基培养,离心后用滤纸过滤回收菌丝体。用Gentra公司的puregene DNA提取试剂盒提取DNA,选择真菌rDNA ITS区域通用引物ITS1(5’-TCCGTAGGTGAACCTGCGG-3’)和ITS4(5’-TCCTCCGCTTATTGATATGC-3’)、EF-1a基因序列特异性引物EF-1aF(5’-CATCGAGAAGTTCGAGAAGG-3’)、EF-1aR(5’-TACTTGAAGGAACCCTTACC-3’),进行ITS区域PCR扩增,测序结果经过GenBank数据库进行同源比对分析。
作为本发明进一步的方案,所述步骤114还包括采用室内盆栽试验对分离菌株进行致病力测定,供试菌株ZMHJ-12。待盆栽芝麻植株生长至盛花期时,采用喷雾法,对植株进行喷雾直至径流,共接种10盆,每盆1株,接种后保湿,以喷施等量无菌水为对照。
作为本发明进一步的方案,所述步骤2包括如下步骤:
步骤21:芝麻蒴腐病病原的分离与鉴定;
步骤22:芝麻蒴腐病生物学特性研究;
步骤23:温度对菌丝生长的影响,芝麻蒴腐病病原菌ZMHJ12菌丝适宜生长范围在20~30℃;
步骤24:pH对菌丝生长的影响,在酸性的环境下,适合芝麻蒴腐病菌ZMHJ12生长;
步骤25:碳氮源对菌丝生长的影响,芝麻蒴腐病病原菌ZMHJ12菌丝生长氮源为葡萄糖,芝麻蒴腐病病原菌ZMHJ12氮源为蛋白胨;
步骤26:光照对菌丝生长的影响,研究不同光照条件下芝麻蒴腐病病原菌ZMHJ12的菌落差异。
作为本发明进一步的方案,所述步骤21包括以下步骤:
步骤211:田间症状调查;
步骤212:致病性测定,蒴果表面出现褐色或深褐色斑点,随着病变的发展,病斑面积逐渐增大,25d整个果实呈深褐色或黑色,病果果皮薄而小、变形、坏死以及变硬,顶部有裂口;
步骤213:病原菌形态特征,病原菌在PDA平板上培养,菌落初为白色,质地致密,之后菌落中心颜色逐渐加深呈橄榄色,菌落背面外缘白色,中间为黑褐色至黑色,菌丝白色丰富,分生孢子梗多分枝,棕色至黑色,菌丝有间隔;
步骤214:利用引物ITS1/ITS4和EF1-728F/EF1-986R对分离的15个菌株进行PCR扩增,得到相同的序列,参照Martínez-Culebras方法校对后,将序列号提交至GenBank(MW700316和MW418181),利用BLAST进行同源比对。
作为本发明进一步的方案,所述步骤22包括以下步骤:
步骤221:培养基对芝麻蒴腐病菌菌丝生长的影响,芝麻蒴腐病病原菌ZMHJ12在11种培养基上均能生长但差异显著,最适合ZMHJ12生长的培养基为V8和PDA。
综上所述,本发明实施例与现有技术相比具有以下有益效果:
通过组织分离法获得病原菌菌株,对病原菌进行了形态鉴定,经柯赫氏法则对病菌的致病性进行验证,分析其rDNA-ITS和EF-1α基因序列特征,以期明确芝麻蒴腐病的致病菌,为芝麻蒴腐病的发病规律及防控措施的制定提供理论依据。
为更清楚地阐述本发明的结构特征和功效,下面结合附图与具体实施例来对本发明进行详细说明。
附图说明
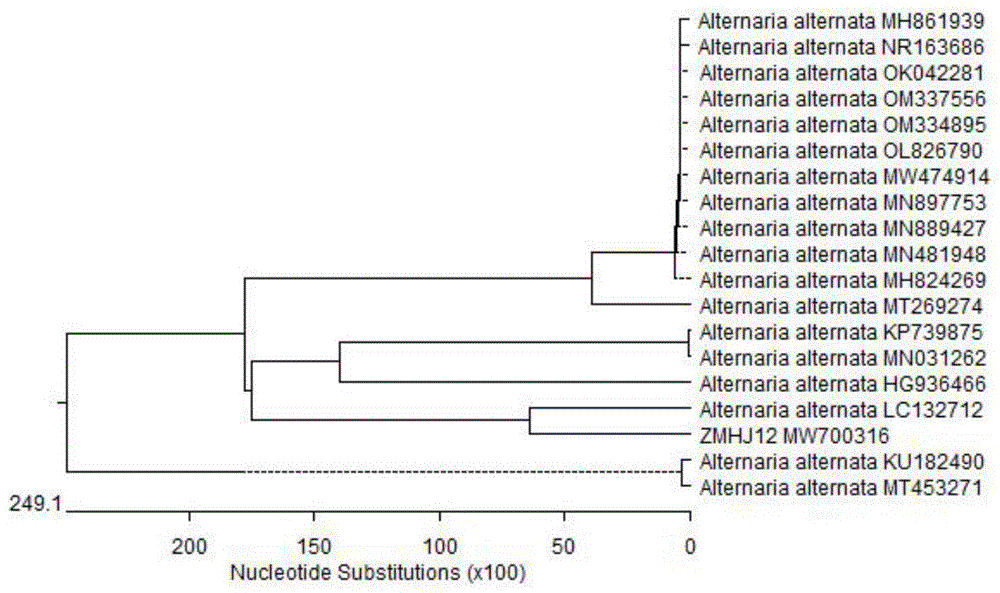
图1为发明实施例中芝麻蒴腐病菌株ZMHJ12的rDNA-ITS序列构建系统发育树。
图2为发明实施例中温度对芝麻蒴腐病ZMHJ12菌丝生长的影响。
图3为发明实施例中pH对芝麻蒴腐病ZMHJ12菌丝生长的影响。
图4为发明实施例中碳源对芝麻蒴腐病病原菌ZMHJ12菌丝生长的影响。
图5为发明实施例中氮源对芝麻蒴腐病病原菌ZMHJ12菌丝生长的影响。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
以下结合具体实施例对本发明的具体实现进行详细描述。
在一个实施例中,一种芝麻蒴腐病病原菌的鉴定方法,参见图1~图5,包括一种芝麻蒴腐病病原菌的鉴定方法,鉴定方法步骤如下:
步骤1:采集感病蒴果材料与菌株获取方法,采集芝麻感病蒴果,通过组织分离法获得病原菌菌株,对病原菌进行了形态鉴定;
步骤2:鉴定结果与结果分析,经柯赫氏法则对病菌的致病性进行验证,分析病菌的rDNA-ITS和EF-1α基因序列特征;
步骤3:得出结论并进行讨论,A.alternata的最适培养基为V8和PDA培养基;链格孢菌菌丝生长适宜温度为25~30℃,最适温度为28℃;适宜菌丝生长的pH在5~8之间,pH6最适菌丝生长;最适碳源为葡萄糖,氮源为蛋白胨;光照条件对菌丝生长影响没有显著差异。
进一步的,参见图1~图5,所述步骤1包括如下步骤:
步骤11:芝麻蒴腐病病原菌鉴定;
步骤12:芝麻蒴腐病病原菌生物学特性研究,将ZMHJ-12病原菌活化后于菌落边缘取直径5mm菌饼,接种到培养基平板中央,每皿1片,每处理重复4皿,28℃恒温培养箱中培养7d,采用十字交叉法测量菌落直径,并观察菌落的形态特征;
步骤13:数据分析,利用DPS软件对试验数据进行单因子方差分析,采用Duncan氏新复极差法进行差异显著性检测。
进一步的,参见图1~图5,所述步骤11包括以下步骤:
步骤111:田间症状调查及病样采集,田间记录发病症状,将样本带回实验室进一步分离以及鉴定;
步骤112:病原菌分离纯化,采用组织分离法对病原菌进行分离以及纯化,取病健交界处组织,切取1-2cm正方小块,2%次氯酸钠表面消毒2min,用无菌水清洗3次,置于PDA培养基上,25℃培养。待病菌分生孢子产生后,在高倍体视镜下从PDA培养基上用接种针挑取单孢,获得纯化菌株,编号为ZMHJ-12;
步骤113:病原菌形态学鉴,将纯化的菌株接种于PDA培养基上25℃培养,观察记录菌落的颜色、形态、表面特征、生长速度以及边缘生长状况,在电子显微镜下观察孢子的类型、着生方式、大小、颜色以及分生孢子梗的特征;
步骤114:病原菌致病力测定,采用柯赫氏法则对分离所得病原物进行回接验证,将分离的病菌转接到PDA培养基上,置于25℃恒温培养箱培养5~7d,直至菌丝长满培养皿并产生大量孢子时,在培养皿中加入少量无菌水,用牙刷将培养皿上的菌丝体洗下,收集到消毒烧杯中,经2层纱布过滤后,用红细胞计数法将病菌孢子悬液浓度调节为2.5×10
步骤115:病原菌分子生物学鉴定,选取15个代表性菌株进行病原菌鉴定,将菌株于PDA培养基培养,离心后用滤纸过滤回收菌丝体。用Gentra公司的puregene DNA提取试剂盒提取DNA,选择真菌rDNA ITS区域通用引物ITS1(5’-TCCGTAGGTGAACCTGCGG-3’)和ITS4(5’-TCCTCCGCTTATTGATATGC-3’)、EF-1a基因序列特异性引物EF-1aF(5’-CATCGAGAAGTTCGAGAAGG-3’)、EF-1aR(5’-TACTTGAAGGAACCCTTACC-3’),进行ITS区域PCR扩增,测序结果经过GenBank数据库进行同源比对分析。
进一步的,参见图1~图5,所述步骤114还包括采用室内盆栽试验对分离菌株进行致病力测定,供试菌株ZMHJ-12。待盆栽芝麻植株生长至盛花期时,采用喷雾法,对植株进行喷雾直至径流,共接种10盆,每盆1株,接种后保湿,以喷施等量无菌水为对照。
进一步的,参见图1~图5,所述步骤2包括如下步骤:
步骤21:芝麻蒴腐病病原的分离与鉴定;
步骤22:芝麻蒴腐病生物学特性研究;
步骤23:温度对菌丝生长的影响,芝麻蒴腐病病原菌ZMHJ12菌丝适宜生长范围在20~30℃,最适温度为28℃;
步骤24:pH对菌丝生长的影响,在酸性的环境下,适合芝麻蒴腐病菌ZMHJ12生长,pH6是最适菌丝生长的环境;
步骤25:碳氮源对菌丝生长的影响,芝麻蒴腐病病原菌ZMHJ12菌丝生长最佳氮源为葡萄糖,芝麻蒴腐病病原菌ZMHJ12最适氮源为蛋白胨;
步骤26:光照对菌丝生长的影响,不同光照条件下芝麻蒴腐病病原菌ZMHJ12的菌落生长没有显著差异。
进一步的,参见图1~图5,所述步骤21包括以下步骤:
步骤211:田间症状调查;
步骤212:致病性测定,蒴果表面出现褐色或深褐色斑点,随着病变的发展,病斑面积逐渐增大,25d整个果实呈深褐色或黑色,病果果皮薄而小、变形、坏死以及变硬,顶部有裂口;
步骤213:病原菌形态特征,病原菌在PDA平板上培养,菌落初为白色,质地致密,之后菌落中心颜色逐渐加深呈橄榄色,菌落背面外缘白色,中间为黑褐色至黑色,菌丝白色丰富,分生孢子梗多分枝,棕色至黑色,菌丝有间隔;
步骤214:利用引物ITS1/ITS4和EF1-728F/EF1-986R对分离的15个菌株进行PCR扩增,得到相同的序列,参照Martínez-Culebras方法校对后,将序列号提交至GenBank(MW700316和MW418181),利用BLAST进行同源比对。
进一步的,参见图1~图5,所述步骤22包括以下步骤:
步骤221:培养基对芝麻蒴腐病菌菌丝生长的影响,芝麻蒴腐病病原菌ZMHJ12在11种培养基上均能生长但差异显著,最适合ZMHJ12生长的培养基为V8和PDA。
在本实施例中,1材料与方法,
1.1芝麻蒴腐病病原菌鉴定
1.1.1田间症状调查及病样采集
采集感病芝麻蒴果,种植芝麻品种为辽芝8号,田间记录发病症状,将样本带回实验室进一步分离、鉴定。
1.1.2病原菌分离纯化
采用组织分离法对病原菌进行分离、纯化。取病健交界处组织,切取1-2cm正方小块,2%次氯酸钠表面消毒2min,用无菌水清洗3次,置于PDA培养基上,25℃培养。待病菌分生孢子产生后,在高倍体视镜下从PDA培养基上用接种针挑取单孢,获得纯化菌株,编号为ZMHJ-12。
1.1.3病原菌形态学鉴定
对纯化的菌株进行形态学鉴定。将纯化的菌株接种于PDA培养基上25℃培养,观察记录菌落的颜色、形态、表面特征、生长速度、边缘生长状况。在电子显微镜下观察孢子的类型、着生方式、大小、颜色、分生孢子梗的特征等。
1.1.4病原菌致病力测定
参照枣黑斑病接种鉴定方法,采用柯赫氏法则对分离所得病原物进行回接验证。将分离的病菌转接到PDA培养基上,置于25℃恒温培养箱培养5~7d,直至菌丝长满培养皿并产生大量孢子时,在培养皿中加入少量无菌水,用牙刷将培养皿上的菌丝体洗下,收集到消毒烧杯中,经2层纱布过滤后,用红细胞计数法将病菌孢子悬液浓度调节为2.5×10
采用室内盆栽试验对分离菌株进行致病力测定,供试品种‘辽芝8号’,供试菌株ZMHJ-12。待盆栽芝麻植株生长至盛花期时,采用喷雾法,对植株进行喷雾直至径流,共接种10盆,每盆1株,接种后保湿,以喷施等量无菌水为对照。接种7d后观察记录芝麻蒴果的发病情况,并比较从发病蒴果上再次分离到的病原菌与原接种菌的培养性状和形态特征是否一致。
1.1.5病原菌分子生物学鉴定
选取15个代表性菌株进行病原菌鉴定,将菌株于PDA培养基培养,离心后用滤纸过滤回收菌丝体。用Gentra公司的puregene DNA提取试剂盒提取DNA。选择真菌rDNA ITS区域通用引物ITS1(5’-TCCGTAGGTGAACCTGCGG-3’)和ITS4(5’-TCCTCCGCTTATTGATATGC-3’)、EF-1a基因序列特异性引物EF-1aF(5’-CATCGAGAAGTTCGAGAAGG-3’)、EF-1aR(5’-TACTTGAAGGAACCCTTACC-3’),进行ITS区域PCR扩增,测序结果在GenBank数据库进行同源比对分析,利用DNAStar软件构建聚类分析树状图,分析该菌与同属其它菌株的亲缘关系,以确定其分类地位。
1.2芝麻蒴腐病病原菌生物学特性研究
将ZMHJ-12病原菌活化后于菌落边缘取直径5mm菌饼,接种到培养基平板中央,每皿1片,每处理重复4皿,28℃恒温培养箱中(温度处理除外)培养7d,采用十字交叉法测量菌落直径,并观察菌落的形态特征。
设5种培养条件,每种条件下设不同处理,具体见下表:
表1:病原菌培养处理试验设计
1.3数据分析
利用DPS软件对试验数据进行单因子方差分析,采用Duncan氏新复极差法进行差异显著性检测。
2结果与分析
2.1芝麻蒴腐病病原的分离与鉴定
2.1.1田间症状调查
田间芝麻蒴腐病主要危害芝麻蒴果,感病蒴果表面出现黑色点状斑点,后不断扩大,渐变成不规则病斑,部分病斑连接成斑块,病斑黑色或深褐色,后期病斑包裹整个蒴果,蒴果表皮变硬,表皮绒毛消失,部分果实开裂,开裂的蒴果种子呈黑褐色,失去商品价值,产量损失严重。
2.1.2致病性测定
用分离得到的菌株ZMHJ12于芝麻盛花期喷雾接种,接种10d后接种植株表现出与田间相似的症状,而未接种的对照植株仍无症状。接种芝麻蒴果症状表现为:蒴果表面出现褐色或深褐色斑点,随着病变的发展,病斑面积逐渐增大,25d整个果实呈深褐色或黑色,病果果皮薄而小、变形、坏死、变硬,顶部偶有裂口。
2.1.3病原菌形态特征
病原菌在PDA平板上培养,菌落初为白色,质地致密,之后菌落中心颜色逐渐加深呈橄榄色,菌落背面外缘白色,中间为黑褐色至黑色,菌丝白色丰富。分生孢子梗多分枝,棕色至黑色,菌丝有间隔。分生孢子呈链状、褐色、倒卵形或椭圆形,横隔1~6个,纵隔或斜隔0~4个,大小12.5~45×6.5~14.5μm。分生孢子梗有隔片,浅棕色至橄榄色,直径22~60μm×2~4μm。分离的菌株形态特征符合Alternaria alternata(Simmons2007)的描述。
2.1.4病原菌分子鉴定
利用引物ITS1/ITS4和EF1-728F/EF1-986R对分离的15个菌株进行PCR扩增,得到相同的序列,参照Martínez-Culebras方法校对后,将序列号提交至GenBank(MW700316和MW418181)。利用BLAST进行同源比对,结果表明菌株ITS基因序列与Alternaria alternata的相似度高达100%。构建系统发育树,芝麻蒴腐病菌株ZMHJ12和Alternaria alternata(LC132712)同源性100%,因此确定芝麻蒴腐病病原菌为Alternaria alternata。
2.2芝麻蒴腐病生物学特性研究
2.2.1培养基对芝麻蒴腐病菌菌丝生长的影响
芝麻蒴腐病病原菌ZMHJ12在11种培养基上均能生长但差异显著,结果(表2)显示最适合ZMHJ12生长的培养基为V8、PDA,培养7d菌丝直径分别为63.88、62.54mm,显著高于其他处理,在WA培养基上生长最慢,培养7d后菌丝直径仅为3.1mm。同时,ZMHJ12在V8、PDA上气生菌丝发达,菌丝生长紧密,中部有明显凸起;在Czapek、MLPCA和WA培养基上菌丝较稀疏;在OA、SDA、EMA、ZMZA PCA、PSA培养基上菌丝紧实,但气生菌丝不发达。综合ZMHJ12在11种培养基上的生长情况,V8、PDA培养基为芝麻蒴腐病病原菌的理想培养基。
表2不同培养基对ZMHJ12菌丝生长的影响
注:表中同列数据后不同小写字母表示差异显著(a=0.05),菌落直径和菌落日生长量单位为mm,下表同。
2.3温度对菌丝生长的影响
由图3可见,温度过高与过低均不利于芝麻蒴腐病病原菌ZMHJ12菌丝生长,在5~35℃范围内,高于40℃菌丝停止生长。不同温度处理间菌落直径均存在显著影响,最适生长温度为28℃,平均菌落直径为67.44mm,其次为30℃和25℃,菌落直径为63.24、61.97mm;在20℃以下35℃以上,菌丝生长缓慢,在5℃以下40℃以上对菌丝生长不利。芝麻蒴腐病病原菌ZMHJ12菌丝适宜生长范围在20~30℃,最适温度为28℃。
2.4pH对菌丝生长的影响
由图4可见,芝麻蒴腐病病原菌ZMHJ12在pH为3~12时均能生长,pH 6时菌丝生长最好,培养7d平均菌落直径为75.5mm;其次为pH5时,平均菌落直径为62.29mm,显著高于pH3~4和pH 7~12处理。pH 3~4的过酸环境明显抑制其生长,菌落直径为35.19和43.2mm;pH7~12的碱性条件下对菌丝生长有明显的抑制作用,菌落直径为57.15~25.94mm。芝麻蒴腐病病原菌ZMHJ12菌丝生长的适宜。上述表明在偏酸的环境下,更适合芝麻蒴腐病菌ZMHJ12生长,pH6是最适菌丝生长的环境。
2.5碳氮源对菌丝生长的影响
芝麻蒴腐病病原菌ZMHJ12可以利用多种碳源。当碳源为葡萄糖时,菌落直径最大,菌落直径为53.67mm,显著高于其它处理;其次为麦芽糖、果糖、甘露醇、木糖和蔗糖,菌落直径在46.54~49.16mm;可溶性淀粉、山梨糖和半乳糖上生长较慢,菌落直径在35.28~44.51mm。结果表明:芝麻蒴腐病病原菌ZMHJ12菌丝生长最佳氮源为葡萄糖。
芝麻蒴腐病病原菌ZMHJ12可以利用多种氮源,最适合其菌丝生长的氮源为蛋白胨,显著高于其它处理,菌落直径53.47mm;其次为苯丙氨酸、氯化铵处理的,菌落直径为51.48和47.6mm;硫酸铵和牛肉浸膏处理的菌丝生长最慢,菌落直径为18.17和12.96mm。结果表明:芝麻蒴腐病病原菌ZMHJ12最适氮源为蛋白胨。
2.6光照对菌丝生长的影响
不同光照条件下芝麻蒴腐病病原菌ZMHJ12的菌落生长没有显著差异,均表现为菌落正面橄榄色,有白色气生菌丝,边缘整齐,菌落背面黑色。结果表明光照对菌丝生长没有显著影响。
表3不同光照对芝麻蒴腐病病原菌ZMHJ12菌丝生长的影响
3结论与讨论
芝麻蒴腐病发病较为普遍,在芝麻主产区河南、辽宁、吉林、内蒙古等地均有发生,国内外尚无对该病的研究。本研究采用形态学、分子生物学和致病性鉴定方法,利用ITS序列和AF-la序列相结合的方式,确定引起芝麻蒴腐病病原菌为链格孢菌Alternariaalternata。有研究记载,链格孢菌可引起新疆枣果黑斑病,其侵染症状与芝麻蒴腐病的症状相似,这也佐证了本文的研究结论。链格孢菌种类繁多,我国记载的链格孢真菌有123个种及变种,划分为28个组群。有研究表明,并且链格孢菌所产生的毒素能够在部分农业产品中检测出,链格孢引起的病害具有潜在的食品安全问题[17],因此有必要对该菌进行更细致的研究。
本试验研究结果表明,A.alternata的最适培养基为V8和PDA培养基;链格孢菌菌丝生长适宜温度为25~30℃,最适温度为28℃;适宜菌丝生长的pH在5~8之间,pH 6最适菌丝生长;最适碳源为葡萄糖,氮源为蛋白胨;光照条件对菌丝生长影响没有显著差异。这个结果与刘行风等针对引起西瓜叶斑病的链格孢菌的研究结果基本相同,但其最适pH为8~9,与本研究的pH 5~6的结论存在差异,这可能与不同地域的环境、寄主、田间管理水平等因素有关。
本文通过对芝麻蒴腐病病原菌鉴定及生物学特性研究,明确了引起芝麻蒴腐病的病原菌为链格孢Alternaria alternata,阐明了病菌Alternaria alternata生长和环境条件的关系,为解释芝麻蒴腐病的发生、发展规律提供了重要依据,也为人工接种鉴定芝麻品种的抗病性明确了病菌生长最适条件;同时也为该病害的最佳防治药剂选择提供一定的理论基础。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
