低频引入突变的酶切打断建库方法和试剂盒
文献发布时间:2023-06-19 13:49:36
技术领域
本申请涉及高通量测序文库构建技术领域,具体而言,涉及一种低频引入突变的酶切打断建库方法和试剂盒。
背景技术
目前,高通量测序已在辅助诊断方面有不可替代的作用。高通量测序的建库环节是高通测序过程中的重要环节,为了未来更好的在临床方向的应用,通常在建库自动化和成本控制两个重要方面进行控制和优化。以前文库构建的打断一般是用超声打断的方式进行,但这种方式有两个明显的缺点,一个是打断成本过高,另一个是不利于自动化操作。
当前,解决上述两个问题的方案通常是利用酶切建库的方法,酶切建库可以更好的整合到自动化的操作中,且由于不需要超声打断,这部分成本也可以节省。虽然酶切建库可以解决超声打断的部分弊端,但也会引入很多点突变(SNP)和双方向假融合位点序列(Dual Stranded Artifact sequence,https://doi.org/10.1101/2020.01.30.927491)。由于酶切建库的核心思想是利用一种产生缺口的酶和一种聚合酶共同作用实现打断,只是实现了打断的目的,对引入突变的问题没有充分考虑。
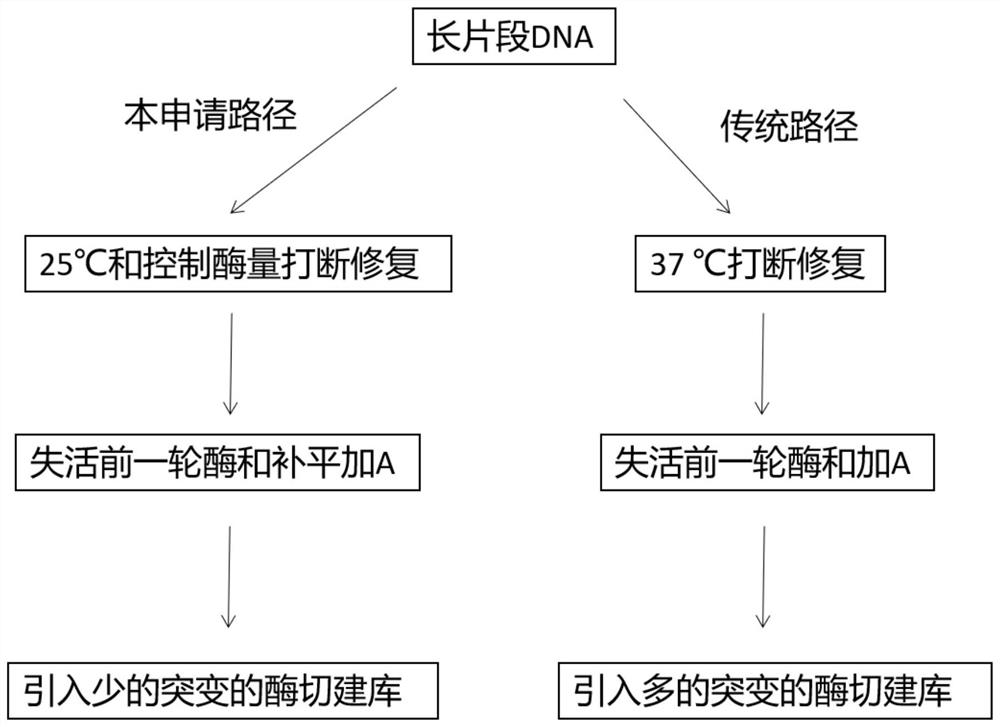
一般的酶切打断方式主要有两种,一种是由一种酶切出缺口,之后用T7内切酶把这个缺口对面的序列切断(US8703462B2),这种打断方式是能打断DNA,并且也很少引入突变,但是由于此种打断方式DNA损失严重,在效率上甚至还不如超声打断的方式,并且打断的长度不集中,也没有很好的得到应用。另一种打断方式是利用一种酶切出缺口,再用另一种聚合酶进行连置换的方式对DNA片段化,这种方式已经存在了很多年(Methods inenzymology,152,330-335 1987-01-01),并且最近也不断有相似的专利出现。例如,US2019/0153453 A1是利用Nt.CviPII或NciI,Nt.CviPII或NciI是一种限制性内切酶的突变体,只能切割双链的一条链,搭配大肠杆菌聚合酶(20U)完成打断。CN111763664B也是相识的原理,都能实现DNA片段的打断,其大肠杆菌聚合酶的用量为0.05-1.0U/μL。可以理解,这些DNA打断方式,如图1所示,都是第一步产生缺口,第二步是经过常温聚合酶从缺口进行链置换的打断,第三步高温失活打断酶的同时末端加A。
由于以前在酶切打断时没有人重视酶切打断的引入突变问题,酶切过程中存在着大量的反复打断过程,由于链置换过程中会不断的引入突变,所以当第一次链置换的时候引入杂合突变,在后续的反复打断和链置换过程中另一个条链也被置换成突变的序列,所以经过长时间的打断,就会引入纯合的突变,如图2所示,经过多轮打断不可避免的产生大量的SNP突变。同样的道理,由于基因组上存在比较近的反向重复序列,在打断的过程中,由于在链置换的过程中有单链状态存在,所以反向重复区域会形成自己互补结构,这样自己会形成局部互补驱动链置换过程,这种结构在后续的打断和链置换过程中会形成颠倒的假的融合形式(https://doi.org/10.1101/2020.01.30.927491),如图3所示,这种形式如果大量引入,会影响融合突变的准确检出。一般融合的发生也是有一段重复序列导致,重复序列被转座酶识别发生片段错接,准确的融合突变和SNP检测有重要的临床意义,但是酶切打断会大量的产生SNP和假的融合突变,所以目前虽然酶切建库比较节省成本和适应自动化,但是由于引入大量的突变也限制了酶切打断的大规模应用。
目前,应用者对酶切打断的效率都比较认可,因为和超声打断相比,其节省成本,且效率比较高。但影响酶切打断大规模应用的因素主要是酶切会引入大量突变,在检测体细胞突变时酶切建库引入的突变会影响检测这些突变的准确性。
发明内容
本申请旨在提供一种低频引入突变的酶切打断建库方法和试剂盒,以解决现有技术中酶切建库引入较多突变的技术问题。
为了实现上述目的,根据本申请的一个方面,提供了一种低频引入突变的酶切打断建库方法。该酶切打断建库方法包括DNA酶切片段化和补平加A、接头连接、PCR扩增和文库纯化的步骤,其中,DNA酶切片段化和补平加A步骤中,通过控制常温DNA聚合酶的用量控制反复切割和链置换。
进一步地,DNA酶切片段化和补平加A步骤中,常温DNA聚合酶的用量为0.001~0.045U/μL;优选的,常温DNA聚合酶为选自大肠杆菌聚合酶I、Klenow大片段或Bst DNA聚合酶中的一种或多种。
进一步地,DNA酶切片段化和补平加A步骤中,耐热DNA聚合酶的用量为0.05~0.2U/μL;优选的,耐热DNA聚合酶为Taq DNA聚合酶。
进一步地,DNA酶切片段化和补平加A步骤中,常温DNA聚合酶的反应温度为25~32℃;优选为25℃;优选的,常温DNA聚合酶的灭活温度为65℃;优选的,常温DNA聚合酶的反应时间为25~30min;优选的,常温DNA聚合酶的灭活反应时间为25~30min。
进一步地,DNA酶切片段化和补平加A步骤中,打断酶溶液包括T4 GP32 0.01~0.03μg/μL、DNaseI 0.004~0.01U/μL、Klenow DNA聚合酶0.001~0.045U/μL、Taq DNA聚合酶0.05~0.2U/μL和50%甘油;优选的,打断酶溶液包括T4 GP32 0.01μg/μL、DNase I0.004U/μL、Klenow DNA聚合酶0.045U/μL、Taq DNA聚合酶0.2U/μL和50%甘油。
进一步地,DNA酶切片段化和补平加A步骤中,所用的打断酶缓冲液包括Tris-HCl10mM、NaCl 30mM、MgCl
进一步地,酶切打断建库方法包括:取打断酶缓冲液和打断酶溶液混合得到打断体系,向打断体系中加入待打断的DNA样本,25~32℃反应25~30min,然后65℃反应25~30min。
根据本发明的另一个方面,提供一种低频引入突变的酶切打断建库试剂盒。该试剂盒包括打断酶溶液和打断酶缓冲液:打断酶溶液包括常温DNA聚合酶,常温DNA聚合酶的反应终浓度为0.001~0.045U/μL;更优选的,常温DNA聚合酶为选自大肠杆菌聚合酶I、Klenow大片段或Bst DNA聚合酶中的一种或多种;优选的,打断酶溶液还包括耐热DNA聚合酶,耐热DNA聚合酶的反应终浓度为0.05~0.2U/μL;更优选的,耐热DNA聚合酶为Taq DNA聚合酶。
进一步地,打断酶溶液包括T4 GP32 0.01μg/μL、DNaseI 0.004U/μL、Klenow DNA聚合酶0.001~0.045U/μL、Taq DNA聚合酶0.05~0.2U/μL和50%甘油;优选的,打断酶溶液包括T4 GP32 0.01μg/μL、DNase I 0.004U/μL、Klenow DNA聚合酶0.045U/μL、Taq DNA聚合酶0.2U/μL和50%甘油。
进一步地,DNA酶切片段化和补平加A步骤中,所用的打断酶缓冲液包括Tris-HCl10mM、NaCl 30mM、MgCl
应用本申请的技术方案,除了保证打断的效率和稳定性,同时也避免了由于打断引入大量的突变导致影响酶切打断在NGS测序过程中的应用,做到打断水平和超声相当的水平,使本申请的酶切打断能够在临床检测过程中得到很好的应用。
附图说明
构成本申请的一部分的说明书附图用来提供对本申请的进一步理解,本申请的示意性实施例及其说明用于解释本申请,并不构成对本申请的不当限定。在附图中:
图1示出了酶切打断,补平和加A的流程示意图;
图2示出了多轮酶切后产生纯合突变的示意图;
图3示出了多轮酶切后产生顺序颠倒的假融合突变的示意图;
图4示出了如何精确控制各环节降低酶切建库的突变引入;
图5示出了不同阶段酶量对引入假融合突变的影响;
图6示出了不同的温度对引入假融合突变的影响;
图7示出了100ng投入量6个循环的文库产出;
图8示出了不同的酶切方案与超声打断在引入SNP突变的对比;
图9示出了不同建库方案引入回文错接的比率。
具体实施方式
需要说明的是,在不冲突的情况下,本申请中的实施例及实施例中的特征可以相互组合。下面将参考附图并结合实施例来详细说明本申请。
术语解释:
单碱基多态性(SNP):单核苷酸多态性主要是指在基因组水平上由单个核苷酸的变异所引起的DNA序列多态性。
融合基因:所谓融合基因,是指将两个或多个基因的编码区首尾相连.置于同一套调控序列(包括启动子、增强子、核糖体结合序列、终止子等)控制之下,构成的嵌合基因。
双方向假融合位点序列(Dual Stranded Artifact sequence):由酶切导致的反向互补序列的附近序列方向反转的一种象限,类似一种假的融合位点,实质不是真的融合,只是酶切导致的错误序列反转产物。
在二代测序过程中,为了能够实现测序上机,除了cfDNA或符合二代建库的片段化样本,都要打断成200~400bp的片段再进行文库构建。传统的建库过程中,DNA的打断一般会用超声的方式打断,超声打断的好处是打断的片段长度适中,同时很少引入突变,所以超声打断被广泛应用,但是超声也问题,一个是超声的仪器和耗材的成本比较高,还有就是超声的方式很难和自动化整合到一起。所以很多人想到了用酶切打断的方式来解决成本过高和适应自动化的方案。
本申请的发明人研究发现,酶切打断DNA除了有效打断,酶量和反应温度是两个关键的因素,在25~32℃之间,可以明显减缓打断的速度,从而减少突变的引入量,且在25℃时明显要比在37℃时少。在第一步打断的过程中要控制聚合酶的量,使打断不要反复多次引入过多的SNP和假的融合突变。发明人通过测试发现,控制第一步的打断酶量和在合适的反应条件(例如,25℃条件反应),甚至此步骤只需打断和部分链置换反应,通过第二步高温聚合酶反应弥补第一步中未完成的链置换反应,由于第二步已经把打断酶失活,此步骤可以弥补未完成的链置反应,第二步骤的酶量增加不会引入过多的突变,详细的逻辑如图4所示。本申请的路径通过两个条件来控制引入少的突变,第一个条件是控制第一个打断反应的酶量,控制此步骤的聚合酶量,此步骤的酶可以是大肠杆菌聚合酶I或Klenow大片段或Bst DNA聚合酶等常温聚合酶,浓度在0.001~0.045U/μL范围,DNase I的使用浓度可以在0.01~0.05U/μL范围。此步骤的控制就是避免过度反复切割和链置换导致引入过多的突变。相对应的,如果把聚合酶浓度调高(传统的方案),对应引入的突变明显增多,如图5所示方案一至方案三在引入假融合突变时相对传统方案要明显减少,对比方案四是传统方案,会引入大量的假融合突变(详见实施例1)。在后续的高温失活第一步的打断酶的同时,此步骤会多加普通Taq酶完成第一步没有完成的链置换过程和加A过程,此步骤的酶浓度在0.05~0.2U/μL范围。同时反应温度方面,本发明人测试时发现,25℃要明显优于更高的反应温度,如图6所示,25℃~32℃的第一步反应温度明显要好于37℃的温度,25℃反应温度可以引入更少的假的融合突变(详见实施例2)。因此,控制第一步的酶量和第一步反应温度的共同目的是控制反应速度,避免过度打断导致的由于反复酶切大量引入突变。
酶切建库除了可以解决超声打断建库成本和更适应自动化外,酶切的建库效率也明显高于超声打断建库。虽然酶切建库效率要高于超声打断建库,但是不是效率越高越好,并且有的酶切建库效率也不高。例如:如图7-9所示,采用Vazmye公司(简称V公司)的产品进行酶切建库,文库产量极高,但同时引入突变最多;Kapa公司(简称K公司)的建库产品进行DNA打断都是在第一步完成的,所以引入的突变也特别多。也有更依赖第二步打断的产品,如Swift公司(简称S公司)的产品,主要是的链置换是在高温条件下完成,如文章《Fragmentation Through Polymerization(FTP):A new method to fragment DNA fornext-generation sequencing》(PLOS ONE|https://doi.org/10.1371/journal.pone.0210374April 1,2019)所述,虽然引入突变比K和V公司的产品要低很多,但是还是没有本申请方案的更低,同时S公司的建库效率很低,不能很好的发挥酶切高效建库的优势。
根据本发明一种典型的实施方式,提供一种低频引入突变的酶切打断建库方法。该酶切打断建库方法包括DNA酶切片段化和补平加A、接头连接、PCR扩增和文库纯化的步骤,其中,DNA酶切片段化和补平加A步骤中,通过控制常温DNA聚合酶的用量控制反复切割和链置换。应用本申请的技术方案,除了保证打断的效率和稳定性,同时也避免了由于打断引入大量的突变导致影响酶切打断在NGS测序过程中的应用,做到打断水平和超声相当的水平,使本申请的酶切打断能够在临床检测过程中得到很好的应用。
在本发明一典型的实施方式中,DNA酶切片段化和补平加A步骤中,常温DNA聚合酶的用量为0.001~0.045U/μL,例如,0.001、0.005U/μL、0.01U/μL、0.015U/μL、0.02U/μL、0.025U/μL、0.03U/μL、0.035U/μL、0.04U/μL、0.045U/μL;优选的,常温DNA聚合酶为选自大肠杆菌聚合酶I、Klenow大片段或Bst DNA聚合酶中的一种或多种。DNA酶切片段化和补平加A步骤中,耐热DNA聚合酶的用量为0.05~0.2U/μL,例如,0.05U/μL、0.06U/μL、0.07U/μL、0.08U/μL、0.09U/μL、0.1U/μL、0.12U/μL、0.14U/μL、0.15U/μL、0.17U/μL、0.18U/μL;优选的,耐热DNA聚合酶为Taq DNA聚合酶。
在本发明一典型的实施方式中,DNA酶切片段化和补平加A步骤中,常温DNA聚合酶的反应温度为25~32℃,例如,26℃、27℃、28℃、29℃、30℃、31℃;优选为25℃;优选的,常温DNA聚合酶的灭活温度为65℃;优选的,常温DNA聚合酶的反应时间为25~30min;优选的,常温DNA聚合酶的灭活反应时间为25~30min。
在本发明一典型的实施方式中,DNA酶切片段化和补平加A步骤中,打断酶溶液包括T4 GP32 0.01~0.03μg/μL、DNaseI 0.004~0.01U/μL、Klenow DNA聚合酶0.001~0.045U/μL、Taq DNA聚合酶0.05~0.2U/μLU/μL和50%甘油;优选的,打断酶溶液包括T4GP32 0.01μg/μL、DNase I 0.004U/μL、Klenow DNA聚合酶0.045U/μL、Taq DNA聚合酶0.2U/μL和50%甘油。
在本申请一实施例中,DNA酶切片段化和补平加A步骤中,所用的打断酶缓冲液包括Tris-HCl 5~15mM、NaCl 20~40mM、MgCl
在本发明一实施方式中,酶切打断建库方法包括:取打断酶缓冲液和打断酶溶液混合得到打断体系,向打断体系中加入待打断的DNA样本,25~32℃反应25~30min,然后65℃反应25~30min。
根据本发明的另一种典型的实施方式,提供一种低频引入突变的酶切打断建库试剂盒。该试剂盒包括打断酶溶液和打断酶缓冲液:打断酶溶液包括常温DNA聚合酶,常温DNA聚合酶的反应终浓度为0.001~0.045U/μL,例如,0.001、0.005U/μL、0.01U/μL、0.015U/μL、0.02U/μL、0.025U/μL、0.03U/μL、0.035U/μL、0.04U/μL、0.045U/μL;更优选的,常温DNA聚合酶为选自大肠杆菌聚合酶I、Klenow大片段或Bst DNA聚合酶中的一种或多种;优选的,打断酶溶液还包括耐热DNA聚合酶,耐热DNA聚合酶的反应终浓度为0.05~0.2U/μL,例如,0.05U/μL、0.06U/μL、0.07U/μL、0.08U/μL、0.09U/μL、0.1U/μL、0.12U/μL、0.14U/μL、0.15U/μL、0.17U/μL、0.18U/μL;更优选的,耐热DNA聚合酶为Taq DNA聚合酶。
在本发明一典型的实施方式中,打断酶溶液包括T4 GP32 0.01μg/μL、DNaseI0.004U/μL、Klenow DNA聚合酶0.001~0.045U/μL、Taq DNA聚合酶0.05~0.2U/μL和50%甘油;优选的,打断酶溶液包括T4 GP32 0.01μg/μL、DNase I 0.004U/μL、Klenow DNA聚合酶0.045U/μL、Taq DNA聚合酶0.2U/μL和50%甘油。
在本申请一实施例中,DNA酶切片段化和补平加A步骤中,所用的打断酶缓冲液包括Tris-HCl 10mM、NaCl 30mM、MgCl
综上所述,本申请主要的创新点在于通过两步反应酶量控制和温度控制实现高效建库的同时,还能控制突变的引入水平和超声打断相同。本申请可以充分发挥酶切打断的节省打断DNA成本、更适合自动化和高效建库的同时,避免过多突变的引入,实现在临床样本低频SNP和融合突变的检测,相较其它发明酶切产品,本申请解决了由于酶切引入过多突变干扰临床样本的真实突变检测的技术问题。
下面将结合具体的实施例来进一步说明本申请的有益效果。
需要说明的是,以下实施例仅是示例性说明,并不限定本申请的方法仅能采用如下方法。具体流程简述如下:
本申请的建库过程可以简要概括:FFPE DNA或gDNA经过酶切片段化和补平加A---接头连接---PCR扩增---文库纯化。
实施例1
打断环节控制聚合酶量会降低酶切引入突变的影响
方案一:打断试剂盒组成:1倍缓冲液组成和浓度:Tris-HCl 10mM、NaCl 30mM、MgCl
方案二:打断试剂盒组成:1倍缓冲液组成和浓度:Tris-HCl 10mM、NaCl 30mM、MgCl
方案三:打断试剂盒组成:1倍缓冲液组成和浓度:Tris-HCl 10mM、NaCl 30mM、MgCl
方案四:打断试剂盒组成:1倍缓冲液组成和浓度:Tris-HCl 10mM、NaCl 30mM、MgCl
方案之间的区别见表1:
表1
具体操作步骤如下:
步骤一:DNA片段化及修复加A
1.1取出打断酶buffer(上述1倍缓冲液)常温融解,混合均匀,置于冰上备用。
1.2取出打断酶(上述反应酶)置于冰上,混合均匀,瞬时离心备用。
1.3按照下表2,在冰上配制片段化Master Mix(乘以反应数,并多配制10%富余量):
表2
1.4混合均匀,瞬时离心放置冰上备用。
1.5在已标记的0.2mL PCR管中,分别加入总量为100ng gDNA,并置于冰上。如gDNA不足40μL,可用Nuclease Free Water补足至40μL。
1.6向置于冰上的每个PCR管中加入10μL片段化Master Mix,配制为50μL终体积的反应混合液,见表3。
表3
注意:为避免时间差异引起的片段化不均一,此加样步骤务必在冰上进行。
1.7混合均匀,瞬时离心使全部反应液置于PCR管底部。
1.8在PCR仪上启动反应程序Cycling Program I,待温度稳定至25℃时将反应管放进PCR仪,进行如表4的反应程序:
表4
注意:热盖温度设置为70℃。
步骤二:接头连接
2.1取出T4 DNA Ligation Buffer(NEB)常温融解,混合均匀,置于冰上备用。
2.2取出T4 DNA Ligase(NEB)置于冰上,混合均匀,瞬时离心备用。
2.3从PCR仪上取出步骤一PCR反应管,置于冰上,按照下表5进行反应体系配制:
表5
2.4混合均匀,瞬时离心使全部反应液置于PCR管底部。
表6
2.5在PCR仪上启动反应程序Cycling Program III(如表6所示的反应程序),等温度稳定至20℃时将反应管放进PCR仪。
步骤三:连接产物纯化
3.1提前将
3.2向步骤二连接反应产物中加入40μL
3.3将PCR管瞬时离心后放置于磁力架上5min至液体完全澄清,使用移液器吸取移弃上清。
3.4沿PCR管侧壁缓慢加入150μL 80%乙醇,注意勿扰动磁珠,静置30s,使用移液器吸取移弃上清。
3.5重复步骤3.4一次。
3.6将PCR管瞬时离心后放置于磁力架上,使用10μL吸头移去少量残留乙醇,注意勿吸到磁珠。
3.7打开PCR管盖,并于室温静置约2~3min,至乙醇挥发完全。
3.8从磁力架上移出PCR管,向PCR管中加入20μL Nuclease Free Water,带磁珠进入下一步PCR扩增。
步骤四:PCR扩增
4.1取出2 X HiFi PCR Master Mix(纳昂达)和104102货号(纳昂达)通用扩增引物置于冰上自然融解,混合均匀,瞬时离心备用。
4.2按照下表7在置于冰上的0.2mL PCR管中进行反应体系配制:
表7
4.3将PCR管放置在PCR仪中启动如下表8程序(Cycling Program IV):
表8
步骤五:扩增文库纯化
5.1根据引物类型进行扩增产物纯化。加入50μL
5.2将PCR管瞬时离心后放置于磁力架上5min至液体完全澄清,使用移液器吸取移弃上清。
5.3沿PCR管侧壁缓慢加入150μL 80%乙醇,注意勿扰动磁珠,静置30s,使用移液器吸取移弃上清。
5.4重复步骤5.3一次。
5.5将PCR管瞬时离心后放置于磁力架上,使用10μL吸头移去少量残留乙醇,注意勿吸到磁珠。
5.6打开PCR管管盖,并于室温静置约5min,至乙醇挥发完全。
5.7移出PCR管,向PCR管中加入30μL TE Solution,涡旋振荡混匀,室温孵育5min。
5.8将PCR管瞬时离心后放置于磁力架上2min至液体完全澄清,使用移液器小心将上清转移至一个新的0.2mL PCR管中进行保存,注意勿吸到磁珠。
实施例1实验结果总结,通过方案一至方案四对比,本申请测试发现第一步的酶(例如:大肠杆菌聚合酶I或Klenow大片段或Bst DNA聚合酶等常温聚合酶)浓度在0.001-0.045U/μL范围较为合适。此步骤的控制就是避免过度反复切割和链置换导致的引入过多的突变,相对应的,如果把聚合酶浓度调高(传统的方案),对应引入的突变明显增多,如图5所示方案一至方案三在引入假融合突变时相对传统方案要明显减少,对比方案四是传统方案,会引入大量的假融合突变。在后续的高温失活第一步的打断酶的同时,第二步会多加普通Taq酶完成第一步没有完成的链置换过程和加A过程,此步骤的酶浓度在0.05~0.1U/μL范围。如图5所示,不同功能的酶量对引入突变的影响,从结果上看方案一至方案三明显好于方案四,方案一至方案三是本申请的优化方案,方案四是模拟其它主要专利的方案结果。
实施例2
酶切打断时的温度控制对酶切引入突变的影响
本方案的流程步骤和实施例1相同,唯一的区别是打断温度不同,打断温度分别测试了25℃,28℃,32℃和37℃,主要的试剂组成用本申请的优化方案(方案二),与实施例1的区别主要在下面表,即第一步酶切的反应温度,除此之外,其它步骤完全相同。
表9
实验结果发现,在测试25℃、28℃、32℃和37℃的反应条件下,在25~32℃在引入突变时明显少于37℃反应,见图6,这个优化在检测融合时消除酶切产生的背景分析到真实融合突变意义重大。
实施例3
对比市面上的主要竞品试剂盒的数据表现
本申请在优化出方案时,也分别购买了下列产品进行了对比测试,具体竞品名称和货号如下表10:
表10
本实施例选择的三个代表性产品和本公司超声打断的建库方案进行对比,分别按照各自说明书操作,用100ng的标准品进行打断建库,KAPA公司的打断方案是在同一个条件下打断完成,即在37℃一步完成所以的打断和链置换过程;Vazyme公司的产品虽然是打断、链置换和加A是在两步完成,但是由于只注重产量,导致过度打断,文库产偏最高,同时引入的SNP和假的融合突变也最多,如图7-9所示数据。Swift公司打断虽然没有过度打断,但是文库产量也很低,说明第一步的聚合酶的量不能太多。同时Swift公司的突变引入也多于本申请的优化方案。本申请的技术方案的打断效率明显高于超声打断,同时引入突变水平也控制的比其它公司的打断方案要低很多。如图7-9所示,图7展示的是投入100ng DNA,按照各自的说明书操作,扩增6个循环的文库产量,本申请方案在产量方面明显优于超声打断和S公司的文库产量。在引入SNP突变方面,如图8所示,本申请方案是最接近超声打断方案的一种酶切建库方案,V公司和K公司产品在引入大量的SNP突变。同样在引入假的融合突变方面,本申请方案也和超声打断接近,V和K公司的产品在引入假融合突变的方面也很高,如图9所示。
综上所述,本申请优化了一种酶切打断试剂盒,解决了样本打断的问题,与超声打断对比,解决了超声打断的高成本和不适应自动化问题,本申请保证打断效率的同时,重点优化控制突变的引入水平,主要通过控制打断时的酶量和打断温度,使打断在能完成的同时不过度打断导致的引入大量突变。本发明人测试发现在打断时大肠杆菌聚合酶I或Klenow大片段或Bst DNA聚合酶等常温聚合酶,浓度在0.001~0.045U/μL范围。在后续的高温失活第一步的打断酶的同时,多加普通Taq酶完成第一步没有完成的链置换过程和加A过程,此步骤的酶浓度在0.05~0.1U/μL范围,打断温度控制在25~32℃会比较有利于避免大量突变的引物。本申请解决了困扰酶切打断能够大规模应用的核心问题,大量引物非真实的突变,本申请通过优化控制的突变的引物,使得本申请的方案可以解决低频突变样本的检测,比如大量的临床样本FFPE样本的检测。
以上所述仅为本申请的优选实施例而已,并不用于限制本申请,对于本领域的技术人员来说,本申请可以有各种更改和变化。凡在本申请的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本申请的保护范围之内。
