肾细胞癌生物标志物及其应用
文献发布时间:2023-06-19 10:25:58
技术领域
本发明涉及生物医药技术领域,更具体地说,它涉及肾细胞癌生物标志物及其应用。
背景技术
肾细胞癌(RCC)是世界范围内常见的癌症,约占成人恶性肿瘤的2-3%。据报道,2017年美国约有63990例RCC新发病例,超过14400例肾癌相关死亡病例。在中国,RCC的发病率呈上升趋势,2014年约有68300例新发RCC,25600例肾癌相关死亡。转移播散是影响RCC预后的最重要因素。原发转移患者的5年生存率约为10%,非转移和晚期转移患者的5年生存率为70%~90%。初诊时,近60%的患者为局部癌,20%为远处转移。RCC的转移扩散主要发生在骨、肺、肝或脑。RCC的转移是其发病率高、预后差的原因。80%以上的RCC患者在确诊远处转移后存活时间不足5年。
因此,了解RCC发生、发展特别是转移的作用机制,并进行适当的干预,对于提高RCC的临床诊治水平、延长病人的生存时间具有非常重要的意义。然而,目前临床上尚无理想的分子指标来评估RCC患者预后及发生转移的风险。因此,寻找新型的RCC转移及预后标志物是当前丞待解决的热点问题。
发明内容
为了弥补现有技术的不足,本发明通过高科技生物技术筛选出在肾细胞癌组织及其转移癌组织中呈现差异表达的分子标志物,通过检测分子标志物的表达水平,与参照水平进行对比,来判断肾细胞癌患者发生转移的风险以及预后评估。同时,该生物标志物可以作为肾细胞癌的特异性分子靶标,应用于肾细胞癌的精准治疗。
为实现上述目的,本发明提供了如下技术方案:肾细胞癌生物标志物,作为转移标志物,用于诊断和/或评估肾细胞癌预后及发生转移的风险;或者,作为肾细胞癌的特异性分子靶标,应用于肾细胞癌的治疗;所述生物标志物包括THBS2、SCGB1A1、NKX2-1、COL11A1、DCN、COL1A1和SFTPB中的一种或者多种。当THBS2、SCGB1A1、NKX2-1、COL11A1、DCN、COL1A1和/或SFTPB表达上调时,肾细胞癌患者有发生转移以及预后不良的潜在风险。
一种通过测序技术、核酸杂交技术、核酸扩增技术检测样本中THBS2、SCGB1A1、NKX2-1、COL11A1、DCN、COL1A1和/或SFTPB基因的表达水平的检测试剂;所述检测试剂选自特异性识别THBS2、SCGB1A1、NKX2-1、COL11A1、DCN、COL1A1和/或SFTPB的探针;或者,所述检测试剂选自特异性扩增THBS2、SCGB1A1、NKX2-1、COL11A1、DCN、COL1A1和/或SFTPB的引物;或者,所述检测试剂选自特异性分析THBS2、SCGB1A1、NKX2-1、COL11A1、DCN、COL1A1和/或SFTPB的芯片。
核酸测序技术的示例性非限制性实例包括但不限于链终止子(Sanger)测序和染料终止子测序。本领域的普通技术人员将认识到,由于RNA在细胞中不太稳定并且在实验中更易受到核酸酶攻击,因此在测序前通常将RNA逆转录成DNA。
核酸测序技术的另一示例性非限制性实例包括下一代测序(深度测序/高通量测序),高通量测序技术是一种基于单分子簇的边合成边测序技术,基于专有的可逆终止化学反应原理。测序时将基因组的DNA的随机片段附着到光学透明的玻璃表面,这些DNA片段经过延伸和桥式扩增后,在玻璃表面形成数以亿计的簇,每个簇是具有数千份相同模板的单分子簇,然后利用带荧光基团的四种特殊脱氧核糖核苷酸,通过可逆性的边合成边测序技术对待测的模板DNA进行测序。
核酸杂交技术的示例性非限制性实例包括但不限于原位杂交(ISH)、微阵列和Southern或Northern印迹。原位杂交(ISH)是一种使用标记的互补DNA或RNA链作为探针以定位组织一部分或切片(原位)或者如果组织足够小则为整个组织(全组织包埋ISH)中的特异性DNA或RNA序列的杂交。DNA ISH可用于确定染色体的结构。RNA ISH用于测量和定位组织切片或全组织包埋内的mRNA和其他转录本。通常对样本细胞和组织进行处理以原位固定靶转录本,并增加探针的进入。探针在高温下与靶序列杂交,然后将多余的探针洗掉。分别使用放射自显影、荧光显微术或免疫组织化学,对组织中用放射、荧光或抗原标记的碱基标记的探针进行定位和定量。ISH也可使用两种或更多种通过放射性或其他非放射性标记物标记的探针,以同时检测两种或更多种转录本。
将Southern和Northern印迹分别用于检测特异性DNA或RNA序列。使从样本中提取的DNA或RNA断裂,在基质凝胶上通过电泳分离,然后转移到膜滤器上。使滤器结合的DNA或RNA与和所关注的序列互补的标记探针杂交。检测结合到滤器的杂交探针。该程序的一种变化形式是反向Northern印迹,其中固定到膜的底物核酸为分离的DNA片段的集合,而探针是从组织提取并进行了标记的RNA。
本发明可在检测前或同时地对核酸(例如,ncRNA)进行扩增。核酸扩增技术的示例性非限制性实例包括但不限于:聚合酶链式反应(PCR)、逆转录聚合酶链式反应(RT-PCR)、转录介导的扩增(TMA)、连接酶链式反应(LCR)、链置换扩增(SDA)和基于核酸序列的扩增(NASBA)。本领域的普通技术人员将认识到,某些扩增技术(例如,PCR)需要在扩增前将RNA逆转录成DNA(例如,RT-PCR),而其他扩增技术则直接扩增RNA(例如,TMA和NASBA)。
通常,PCR使用变性、引物对与相反链的退火以及引物延伸的多个循环,以指数方式增加靶核酸序列的拷贝数;RT-PCR则将逆转录酶(RT)用于从mRNA制备互补的DNA(cDNA),然后将cDNA通过PCR扩增以产生DNA的多个拷贝;TMA在基本上恒定的温度、离子强度和pH的条件下自身催化地合成靶核酸序列的多个拷贝,其中靶序列的多个RNA拷贝自身催化地生成另外的拷贝,TMA任选地包括使用阻断,部分、终止部分和其他修饰部分,以改善TMA过程的灵敏度和准确度;LCR使用与靶核酸的相邻区域杂交的两组互补DNA寡核苷酸。DNA寡核苷酸在热变性、杂交和连接的重复多个循环中通过DNA连接酶共价连接,以产生可检测的双链连接寡核苷酸产物;SDA使用以下步骤的多个循环:引物序列对与靶序列的相反链进行退火,在存在dNTPαS下进行引物延伸以产生双链半硫代磷酸化的(hemiphosphorothioated)引物延伸产物,半修饰的限制性内切酶识别位点进行的核酸内切酶介导的切刻,以及从切口3'端进行的聚合酶介导引的物延伸以置换现有链并产生供下一轮引物退火、切刻和链置换的链,从而引起产物的几何扩增。
作为优选,所述特异性扩增THBS2、SCGB1A1、NKX2-1、COL11A1、DCN、COL1A1和/或SFTPB的引物序列如SEQ ID NO.1-14所示。
作为优选,一种体外检测THBS2、SCGB1A1、NKX2-1、COL11A1、DCN、COL1A1和/或SFTPB表达水平的相关产品,所述相关产品包括基因芯片或试剂盒。
作为优选,所述芯片包括固相载体以及附着于其上的特异性识别THBS2、SCGB1A1、NKX2-1、COL11A1、DCN、COL1A1和/或SFTPB的探针。
作为非限制性实施例,所述固相载体可采用基因芯片领域的各种常用材料,例如但不限于尼龙膜,经活性基团(如醛基、氨基等)修饰的玻片或硅片、未修饰的玻片、塑料片等。
本发明芯片的制备可采用本领域已知的生物芯片的常规制造方法。例如,如果固相载体采用的是修饰玻片或硅片,探针的5’端含有氨基修饰的聚dT串,可将寡核苷酸探针配制成溶液,然后采用点样仪将其点在修饰玻片或硅片上,排列成预定的序列或阵列,然后通过放置过夜来固定,就可得到本发明的基因芯片。
作为优选,所述试剂盒包括特异性扩增THBS2、SCGB1A1、NKX2-1、COL11A1、DCN、COL1A1和/或SFTPB的引物、特异性识别THBS2、SCGB1A1、NKX2-1、COL11A1、DCN、COL1A1和/或SFTPB的探针、或特异性分析THBS2、SCGB1A1、NKX2-1、COL11A1、DCN、COL1A1和/或SFTPB的芯片。
作为优选,所述试剂盒还包括容器、使用说明书、阳性对照物、阴性对照物和赋形剂中的一种或多种。所述赋形剂包括缓冲剂、助剂或溶剂。
药物组合物,包括THBS2、SCGB1A1、NKX2-1、COL11A1、DCN、COL1A1和/或SFTPB的抑制剂。
作为优选,所述抑制剂能够降低THBS2、SCGB1A1、NKX2-1、COL11A1、DCN、COL1A1和/或SFTPB的表达水平;或者,所述抑制剂为干扰RNA。所述抑制剂为可以降低THBS2、SCGB1A1、NKX2-1、COL11A1、DCN、COL1A1和/或SFTPB水平的任何试剂。作为非限制性的实施例,包括:shRNA(小发夹RNA)、小干扰RNA(siRNA)、dsRNA、微小RNA、反义核酸,或能表达或形成所述shRNA、小干扰RNA、dsRNA、微小RNA、反义核酸的构建物。
术语“差异分子标志物表达”和“差异表达”可互换使用,指相对于其在正常对象中的表达,或相对于其在对特定治疗不同地应答的或具有不同的预后的患者中的表达,其表达在患有特定疾病的对象中被激活为较高或较低水平的分子标志物。该术语还包括其表达在相同的疾病的不同的阶段被激活为较高或较低水平的分子标志物。还要理解的是差异表达分子标志物可在核酸水平或蛋白水平上被激活或被抑制,或可经受选择性剪接以产生不同的多肽产物。这种差异可通过包括mRNA水平、微小RNA水平、lncRNA水平、反义转录物水平或蛋白表面表达、分泌或多肽的其他划分的多种改变来证实。差异分子标志物表达可包括两个或更多个基因之间或其基因产物之间的表达的比较;或两个或更多个基因之间或其基因产物之间的表达的比率的比较;或甚至相同基因的两个不同加工的产物的比较,其在正常对象和患病对象之间是不同的;或在相同疾病的不同阶段是不同的。差异表达包括例如在正常细胞和病态细胞之间或在经历不同的疾病事件或疾病阶段的细胞之间,在分子标志物中瞬时表达模式或细胞表达模式中的定量和定性的差异。
当分子标志物在个体中指示异常进程、疾病或其他病症或作为异常进程、疾病或其他病症的标志时,该分子标志物与在个体中指示正常进程、无疾病或其他病症或作为正常进程、无疾病或其他病症的标志的分子标志物的表达水平或值相比较,通常被描述为过表达的或低表达的。“上调”、“上调的”、“过表达”、“过表达的”可互换使用,指大于在健康或正常个体中通常检测到的分子标志物的值或水平(或值或水平的范围)的生物样品中的分子标志物的值或水平。该术语还可指大于在特定疾病的不同阶段可检测到的分子标志物的值或水平(或值或水平的范围)的生物样品中的分子标志物的值或水平。
“下调”、“下调的”、“低表达”、“低表达的”可互换使用,指小于在健康或正常个体中通常检测到的分子标志物的值或水平(或值或水平的范围)的生物样品中的分子标志物的值或水平。该术语还可指小于在特定疾病的不同阶段可检测到的分子标志物的值或水平(或值或水平的范围)的生物样品中的分子标志物的值或水平。
在本发明中,用于本文所描述的试剂、工具和/或说明书可于试剂盒中提供。例如,试剂盒可包含用于确定关于癌症患者的适当治疗的试剂、工具和说明书。所述试剂盒可包括用于从患者收集组织样品的试剂,例如通过活检来收集,和用于处理该组织的试剂。试剂盒还可包括用于进行分子标志物表达分析的一种或多种试剂,例如用于进行RT-PCR、qPCR、RNA印迹等以确定患者的样品中的分子标志物的表达水平的试剂。例如,所述试剂盒中可包括用于进行RT-PCR的引物,用于进行RNA印迹分析的探针。还可包括用于测定的适当的缓冲液。还可包括这些测定中的任何一种所需的检测试剂。
本文所表征的试剂盒还可包括描述如何进行用于测量分子标志物表达的测定的说明卡。说明卡还可包括如何确定参考组群的说明,包括如何确定参考组群中分子标志物的表达水平和如何集合表达数据以建立用于与试验患者相比较的参考。说明卡还可包括用于测定试验患者中的分子标志物表达和用于将该表达水平与参考组群中的表达相比较从而确定用于受试者的适当的化学治疗的说明。
试剂盒中包括的信息材料可以是与本文所描述的方法和/或用于本文所描述的方法的试剂的用途相关的描述的、指导的、销售的或其他的材料。例如,试剂盒的信息材料可包含联系信息,例如,物理地址、电子邮件地址、网站或电话号码,其中试剂盒的使用者可获得有关进行基因表达分析和解析结果的大量信息,尤其当应用于可能对特定治疗剂具有阳性应答的人类时。
上述所述肾细胞癌转移标志物、上述所述的检测试剂、上述所述的相关产品或上述所述的药物组合物在制备诊断和/或评估和/或治疗肾细胞癌上的用途。
本发明通过检测肾细胞癌患者组织中THBS2、SCGB1A1、NKX2-1、COL11A1、DCN、COL1A1和SFTPB的表达水平,可以对肾细胞癌患者是否发生转移以及预后做出判断,准确率达93%以上。因此,检测肾细胞癌患者组织中THBS2等分子生物标志物可以评估肾细胞癌患者的病情进展、转移及预后,可以及时对症进行相关治疗,提高患者的生存时间和生存质量,具有较大的经济价值和社会效益。
附图说明
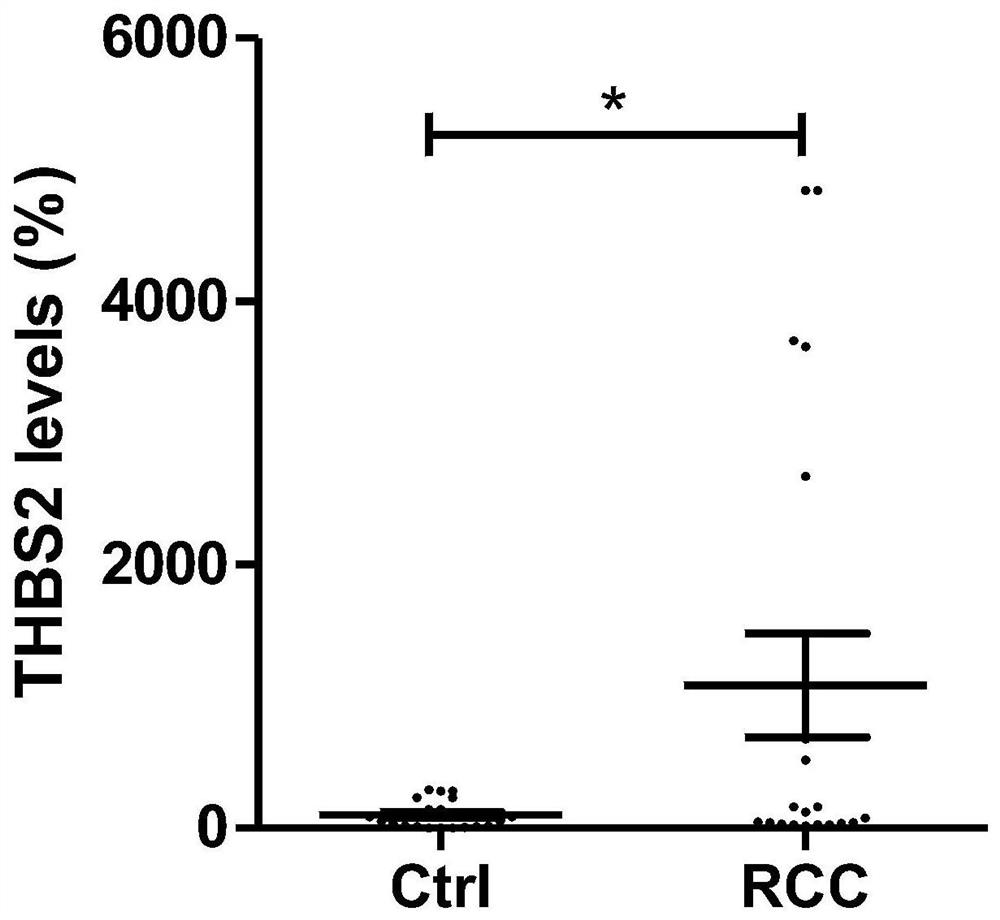
图1为血小板反应蛋白2(THBS2)在RCC组织中的表达显著高于癌旁正常组织;
图2为分泌素蛋白1A1(SCGB1A1)在RCC组织中的表达显著高于癌旁正常组织;
图3为NKX同源框-1(NKX2-1)在RCC组织中的表达显著高于癌旁正常组织;
图4为Ⅺ型胶原α1链(COL11A1)在RCC组织中的表达显著高于癌旁正常组织;
图5为核心蛋白聚糖(DCN)在RCC组织中的表达显著高于癌旁正常组织;
图6为I型胶原α1链(COL1A1)在RCC组织中的表达显著高于癌旁正常组织;
图7为肺表面活性蛋白B(SFTPB)在RCC组织中的表达显著高于癌旁正常组织;
图8为血小板反应蛋白2(THBS2)在RCC转移组织中的表达显著高于RCC组织;
图9为分泌素蛋白1A1(SCGB1A1)在RCC转移组织中的表达显著高于RCC组织;
图10为NKX同源框-1(NKX2-1)在RCC转移组织中的表达显著高于RCC组织;
图11为Ⅺ型胶原α1链(COL11A1)在RCC转移组织中的表达显著高于RCC组织;
图12为核心蛋白聚糖(DCN)在RCC转移组织中的表达显著高于RCC组织;
图13为I型胶原α1链(COL1A1)在RCC转移组织中的表达显著高于RCC组织;
图14为肺表面活性蛋白B(SFTPB)在RCC转移组织中的表达显著高于RCC组织;
图15为血小板反应蛋白2(THBS2)高表达与RCC患者预后不良密切相关;
图16为分泌素蛋白1A1(SCGB1A1)高表达与RCC患者预后不良密切相关;
图17为NKX同源框-1(NKX2-1)高表达与RCC患者预后不良密切相关;
图18为Ⅺ型胶原α1链(COL11A1)高表达与RCC患者预后不良密切相关;
图19为核心蛋白聚糖(DCN)高表达与RCC患者预后不良密切相关;
图20为I型胶原α1链(COL1A1)高表达与RCC患者预后不良密切相关;
图21为肺表面活性蛋白B(SFTPB)高表达与RCC患者预后不良密切相关。
具体实施方式
以下结合具体实例对上述方案做进一步说明。应理解,这些实例是用于说明本发明而不限于限制本发明的范围。实例中采用的实施条件可以根据具体厂家的条件做进一步调整,未注明的实施条件通常为常规实验中的条件。
实施例1.制备预测RCC患者转移和预后的试剂盒(50次反应)
1.Trizol:50ml;
2.氯仿:20ml;
3.异丙醇:30ml;
4.75%乙醇;60ml;
5.DEPC水:10ml;
6.Oligo(dT)引物的混合物:100ul;
7.200U/ul M-MLV逆转录酶:50ul;
8.SYBR qPCR Mix:500ul;
9.10uM目的基因特异性引物(其序列如SEQ NO:1-14所示):各100ul;
10.10uM内参基因β-actin特异性引物(其序列如SEQ NO:15-16所示):各100ul。
实施例2.组织样本分子标志物的检测与分析
1.收集待测的RCC组织、癌旁正常组织以及远端转移的RCC组织,生理盐水清洗干净后放入液氮中冻存。
2.组织RNA抽提:在研钵中加入液氮,将组织剪碎后在液氮中研磨粉碎,取100mg组织加入1ml Trizol中,混匀。室温放置5分钟,加入200uL/管的氯仿,剧烈震荡混匀15秒。12000转/分钟离心15分钟。小心吸取上层水相到新的Ep管中,加入等体积的异丙醇,颠倒混匀,室温放置5分钟,12000转/分钟离心10分钟。小心弃去上清液,加入75%乙醇,混匀后8000转/分钟离心8分钟。去上清,等干燥后加入DEPC水溶解RNA。用酶标仪检测RNA的浓度和纯度。OD260/OD280比值在1.8-2.0之间表明RNA纯度很好。
3.逆转录:利用南京诺唯赞生物科技公司的逆转录试剂盒(R233)进行逆转录,步骤如下:在离心管中配制如下混合液:4×gDNA wiper Mix 4ul、Oligo(dT)23VN(10μM)1ul、模板RNA 1pg-1ug,加DEPC水至20ul。混匀后42℃孵育2分钟。然后加入5×HiScript IISelect qRT SuperMix 4ul混匀后50℃温育15分钟,然后85℃孵育5秒钟。得到的cDNA放于-80℃冻存或者进行实时定量PCR。
4.实时定量PCR:PCR引物由苏州金唯智生物科技有限公司合成,引物序列为SEQNO:1-14,以及内参基因β-actin的引物序列,引物序列为SEQ NO:15-16。引物序列如下:
THBS2:
正向引物:5'-CGTGGACAATGACCTTGTTG-3'(SEQ ID NO.1)
反向引物:5'-GCCATCGTTGTCATCATCAG-3'(SEQ ID NO.2)
SCGB1A1:
正向引物:5'-TTCAGCGTGTCATCGAAACCC-3'(SEQ ID NO.3)
反向引物:5'-ACAGTGAGCTTTGGGCTATTTTT-3'(SEQ ID NO.4)
NKX2-1:
正向引物:5'-ATGTACCGGGACGACTTGGAA-3'(SEQ ID NO.5)
反向引物:5'-CAATGCCTGTCAGGGCTAGAA-3'(SEQ ID NO.6)
COL11A1:
正向引物:5'-TGGTGATCAGAATCAGAAGTTCG-3'(SEQ ID NO.7)
反向引物:5'-AGGAGAGTTGAGAATTGGGAATC-3'(SEQ ID NO.8)
DCN:
正向引物:5'-ATGAAGGCCACTATCATCCTCC-3'(SEQ ID NO.9)
反向引物:5'-GTCGCGGTCATCAGGAACTT-3'(SEQ ID NO.10)
COL1A1:
正向引物:5'-GAGGGCCAAGACGAAGACATC-3'(SEQ ID NO.11)
反向引物:5'-CAGATCACGTCATCGCACAAC-3'(SEQ ID NO.12)
SFTPB:
正向引物:5'-TGGAGCAAGCATTGCAGTG-3'(SEQ ID NO.13)
反向引物:5'-ACTCTTGGCATAGGTCATCGG-3'(SEQ ID NO.14)
β-actin:
正向引物:5'-CACCATTGGCAATGAGCGGTTCC-3'(SEQ ID NO.15)
反向引物:5'-GTAGTTTCGTGGATGCCACAGG-3'(SEQ ID NO.16)
实时定量PCR其他试剂为南京诺唯赞生物科技公司的ChamQ Universal SYBRqPCR Master Mix(Q711-02),具体步骤如下:在qPCR管中配制如下混合液:2XChamQUniversal SYBR qPCR Master Mix 10ul、10uM上游引物1ul、10uM下游引物1ul、模板cDNA4ul、H2O 4ul。以上混匀后离心数秒使之沉聚于管底。PCR程序包括如下步骤:
a.预变性:95℃30秒;
b.变性:95℃10秒;
c.退火/延伸:60℃30秒;
d.重复b和c步骤,共计40个循环
e.溶解曲线分析:95℃15秒、60℃60秒、95℃15秒。
5.统计学分析:实时定量PCR结果按照2-ΔΔCt计算基因的相对表达量。利用非参数t检验进行分析。采用KM PLOTTER数据库(https://kmplot.com)对基因表达与RCC预后进行分析。Kaplan-Meier法绘制生存曲线,Log-rank法比较组间生存差异。P<0.05示差异有统计学意义。
6.结果:对RCC组织和癌旁正常组织的实时定量PCR结果如图1-7所示,与癌旁正常组织相比,血小板反应蛋白2(THBS2)、分泌素蛋白1A1(SCGB1A1)、NKX同源框-1(NKX2-1)、Ⅺ型胶原α1链(COL11A1)、核心蛋白聚糖(DCN)、I型胶原α1链(COL1A1)和肺表面活性蛋白B(SFTPB)在RCC组织中的表达均显著上调,其上调倍数分别为10.864倍、2.804倍、1.834倍、1.919倍、1.891倍、2.672倍和2.236倍,差异均具有统计学意义(P<0.01,P<0.05)。此外,我们还检测了以上7个基因在RCC组织和RCC转移组织中的表达差异,结果如图8-14所示。与RCC组织相比,THBS2、SCGB1A1、NKX2-1、COL11A1、DCN、COL1A1和SFTPB在RCC组织中的表达均显著上调,其上调倍数分别为2.199倍、35.682倍、11.973倍、3.788倍、1.383倍、1.025倍和100.610倍,差异均具有统计学意义(P<0.01,P<0.05)。最后,我们还对THBS2等基因在RCC中的表达与预后的关联性进行了分析,如图15-21所示,发现RCC患者THBS2、SCGB1A1、NKX2-1、COL11A1、DCN、COL1A1和SFTPB的高表达均与RCC患者预后不良密切相关(均P<0.01)。以上实验结果说明,通过检测肾细胞癌患者组织中THBS2、SCGB1A1、NKX2-1、COL11A1、DCN、COL1A1和SFTPB的表达水平,可以对肾细胞癌患者是否发生转移以及预后做出判断,准确率达93%以上。因此,检测肾细胞癌患者组织中THBS2等分子生物标志物可以评估肾细胞癌患者的病情进展、转移及预后,可以及时对症进行相关治疗,提高患者的生存时间和生存质量,具有较大的经济价值和社会效益。
上述实施例的说明只是用于理解本发明的方法及其核心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也将落入本发明权利要求的保护范围内。
- 肾细胞癌生物标志物及其应用
- 一种生物标志物、预测肾细胞癌的复发和死亡风险的方法
