确定配体与受体之间的相互作用的样品保持器组件
文献发布时间:2023-06-19 18:37:28
本申请是分案申请,其原申请的国际申请号为PCT/EP2019/070925,国际申请日为2019年08月02日,中国国家申请号为201980047443.7,进入中国国家阶段的进入日为2021年01月15日,发明名称为“确定配体与受体之间的相互作用的方法”。
技术领域
本公开涉及一种确定第一配体(例如测试化合物)与受体(例如靶分子)之间的相互作用的方法。本公开还涉及一种用于所述方法的样品保持器组件。
背景技术
在药物开发中使用生物传感器来产生结合动力学数据,在化合物优化过程中这些数据可用于进一步了解结构-动力学关系。动力学信息通常通过基于微流体的生物传感器平台(例如表面等离振子共振(SPR))推导出,因为优化的流控技术和高采样速率允许准确描述分子结合和解离过程。关于扩展解离过程的信息最终可提供增强化合物功效和安全性的可能性,并因此在与相应的药代动力学特征相关联时可有助于确保治疗成功。
所有光学生物传感器平台都遵循相同的指导原则:将一个相互作用伴侣(通常是药物靶蛋白、寡核苷酸或甚至整个细胞)附着到生物传感器表面。随后用含有测试化合物的溶液挑战该经修饰的表面,以获得直接的结合信息,或研究在与细胞系统一起工作时结合的生物学后果。这种测定配置称为直接结合测定(DBA)。
表面等离子体共振(SPR)和光波导器(OWG)利用了倏逝波现象,因此能够测量与传感器表面的分子质量变化成比例的折射率变化。相反,生物层干涉测量法(BLI)通过分析干涉图样来工作,该干涉图样分析能够监视与传感器直接接触的层的有效光学厚度的变化。所有平台的共同点是能够对结合相互作用进行时间解析测量,尤其是在使用基于微流体的系统时。由于光学生物传感器系统不需要对所用试剂进行任何标记,因此它们通常被称为无标记技术,旨在减少可能因标记靶标或化合物而引入的测定伪像的数量。
基于微流体的生物传感器平台的一个共同特性是需要进行两个单独的实验。首先,使传感器表面与分析物接触。由此测量反应,反应的速率在最简单的情况下为结合速率常数k
这种类型的生物传感具有许多缺点,特别是当目标分子是膜蛋白时。据估计,所有获批的药物靶标中约60%是膜蛋白。特别是对于膜蛋白,成功率低至约30%。
许多药物靶标,尤其是膜蛋白,与传感器表面的固定不相容。因此,必须对靶标进行消耗大量时间和资源的修饰。
由于信号幅度与固定的靶标的数量成正比,因此它们需要表面上的高密度的药物靶标。
这些系统仅能够检测表面的净变化。因此,它们无法看到平衡时的结合和解结合动力学。
这些传感器平台提供的传感器表面的数量非常有限。SPR系统通常具有3-4个独立的传感器表面。这意味着如果靶标出现故障,则传感器会“丢失”。除了传感器的成本外,该设备无法记录该特定表面的任何其他数据。这极大地限制了通量。
在开始新的运行之前,传感器表面必须不含任何测试化合物。对于驻留时间长的化合物,这可能造成困难,并且表面再生往往限制了通量。
灵敏度受到生物传感器平台的技术特性的限制。
减轻靶标固定所带来的问题的一种方法是将药物靶标保持在溶液中。固定了所谓的工具化合物而不是固定靶标,而悬浮的靶标已知以特定方式与所述工具化合物相互作用。将测试化合物添加到仪器外的靶标上,以使靶分子和测试化合物分子反应,然后将所得溶液注入到经固定的工具化合物上方。该技术通常称为溶液抑制测定(ISA)。因此,通过研究不同浓度的测试化合物如何影响靶标与工具化合物的结合,可以确定测试化合物与药物靶标的平衡解离常数K
与DBA不同,无标记技术的配置无法与ISA组合来测量结合动力学,即结合速率常数k
Anal.Chem.(2015),87,4100-4103公开了基于单分子的ISA(SMM-ISA),其允许以高灵敏度进行溶液抑制测定。对于该方法,靶标不固定在表面上,而是固定在悬浮的自由扩散的脂质体中/上,该脂质体在其脂质环境中携带有荧光染料。在表面上固定有能够结合靶标的工具化合物。用全内反射荧光(TIRF)显微镜使经修饰的表面成像。TIRF会产生激发光的倏逝场,该场只会激发接近表面(几百纳米)的脂质体。通过使脂质体的浓度保持较低,能够使与表面结合和从表面解离的单个脂质体成像。与上述常规方法相比,单分子测定法的高灵敏度使得工具化合物与药物靶标的亲和力低了几个数量级。另外,含靶标的脂质体的浓度可以比常规ISA中低几个数量级。
但是,在有关SMM-ISA的第一份报告中,只能确定靶标与固定在表面上的工具化合物之间的结合动力学,而不能确定靶标与测试化合物之间的关键相互作用的动态动力学参数(结合速率常数k
Langmuir,2015,31(39),pp 10774–10780公开了使用全内反射荧光显微镜表征CXCR3(一种参与炎症反应的GPCR)及其两种趋化因子配体CXCL10和CXCL11之间的动力学。含GPCR的天然囊泡的脂质膜的荧光标记而非该膜蛋白本身的荧光标记,以及相应配体在表面的固定化,使得能够使用单分子平衡波动分析来确定溶液中受体与配体之间的解离常数。使得CXCR3与趋化因子配体CXCL10和CXCL11之间的相互作用在停滞液体条件下进行。
J.Am.Chem.Soc.,2011,133,14852-14855公开了由单个结合事件的平衡波动分析得到的配体与膜受体结合的动力学。使用停滞液体条件,并通过微孔格式的TIRF显微镜随时间监测每个结合和解离事件。
本公开的目的是克服或至少减轻上述一些问题。此外,本公开的目的是提供迄今已知技术未提供的优点和/或方面。
发明内容
本公开提供了一种确定第一配体与受体之间的相互作用的方法,
所述方法包括以下处理步骤序列:
a)提供不含第一配体且包含浓度为C
b)使所述第一溶液与用第二配体功能化的测试孔壁接触,同时记录在时间间隔t
c)向所述第一溶液中加入不含所述受体且包含浓度为C
重要的是,本文所述方法中结合事件数的记录发生在添加包含第一配体的测试溶液的过程中,即步骤c),并且可以在添加第一配体之后不久在第二溶液到达平衡之前开始。这与停滞状态相反,在停滞状态中,仅在添加第一配体并且第一配体与受体之间的结合已达到平衡或准平衡之后才记录结合事件。因此,本文描述的方法使用非停滞条件,例如非停滞液体条件。结果,在所述第一配体与所述受体之间的结合达到平衡之前,确定所述第一配体与所述受体之间的相互作用。本文描述的方法的显著优点在于,不需要等待第一配体和受体达到或基本达到平衡,那样会使测量总时间更长。相反,本文描述的方法允许在进行测量时快速处理。显然这在筛选应用中特别有利。
应理解的是,步骤b)中记录结合事件是可选的。在一个实例中,步骤b)中不记录结合事件,或者在步骤c)之前记录,例如刚好在步骤c)之前记录步骤b)中的结合事件。因此,提供了本文所述的方法,其中步骤b)为:
b)使所述第一溶液与用第二配体功能化的测试孔壁接触,同时记录或不记录在时间间隔t
本文所述方法的另一个优点是第二配体与受体之间的结合动力学不必是已知的或已确定的。
时间间隔t
在一个实例中,记录第二配体与受体之间的结合事件,直到第一配体与受体的结合达到平衡为止。在另一个实例中,记录第二配体与受体之间的结合事件,直到第一配体与受体的结合达到平衡时和之后。
应理解的是,本文所述的方法可以以下方式进行:受体与第二配体之间的结合事件的记录在步骤b)和c)之间不中断,即以连续的方式进行记录。此外,时间间隔t
本文所述的平衡结合可以是处于准平衡的结合,即接近平衡或基本上处于平衡的结合。
本文描述的方法可以进一步包括步骤d):
d)基于步骤b)和c)中记录的结合事件确定第一配体与受体之间的相互作用。
在本文中,第一配体可以是测试化合物。术语“第一配体”和“测试化合物”可以互换使用。此外,在本文中,术语“受体”可以是靶标,例如药物靶标。术语“受体”和“靶标”可以互换使用。此外,在本文中,第二配体可以是工具化合物。术语“第二配体”和“工具化合物”可以互换使用。
本文描述的方法的处理步骤序列可以在多个测试孔的每一个中完全执行。
每个方法步骤可以在每个测试孔中同时进行,即第一步可以在每个测试孔中同时进行,然后每个后续步骤可以在每个测试孔中同时进行。作为选择,方法步骤可以在测试孔中在不同时间执行。
可以在添加第一配体之前和之后记录与测试壁结合的受体的数量。针对多个测试孔,这些记录的结合事件可以相加起来。如本文所述,可以在时间间隔t
此外,可以对所述测试溶液中的多种不同浓度C
e)在所述测试溶液中的递增浓度C
重要的是,本文所述方法的测试溶液不含受体,并被添加到第一溶液中。因此,在将测试溶液添加到第一溶液中之前,不允许第一配体和受体反应。这些特征将本文所述的方法与溶液抑制测定法(ISA)区分开,在ISA中测试溶液既包含受体又包含测试化合物,使得它们可以在添加至功能化表面之前反应。
本文所述的测试孔壁可以是单个测试孔或多个测试孔的测试孔底壁。用面向测试孔内部的第二配体对测试孔壁进行功能化,由此将第二配体固定。测试孔壁的功能化可以使用本领域已知的技术进行。例如,可以用食人鱼溶液处理测试孔壁,然后对测试孔壁进行功能化。
受体可以原样使用或与载体结合使用。受体和/或载体可以是经标记的或未经标记的。标记可以包括荧光团。在一个实例中,提供了一种包含荧光团的载体。受体与载体的组合允许在对受体结构没有或基本上没有负面影响的情况下固定所述受体。另外,载体可以为受体提供代表或模仿其天然环境的环境,尤其是在它是膜受体时。经固定的受体在所选的溶剂、或载体、或载体与溶剂的组合中可以是可溶的或基本可溶的。
可用于固定受体的载体的实例包括但不限于以下至少一种:脂质体,脂质体,树状分子(dendrimer),单枝状分子(dendrone),络合镧系元素,量子点,纳米金刚石,脂质盘。
第一配体和第二配体可以相同或不同。因此,与要求受体与表面结合的第二配体的解离速率已知或已测量的方法相反,第一和第二配体可以彼此不同。
受体可以是药物受体。例如,受体可以包含凝血酶或由凝血酶组成。另外地或可替代地,第一配体和/或第二配体可以是药物。例如,药物可以是美拉加群(melagatran)。
本文所述方法的步骤b)和/或步骤c)可包括使用显微镜。通常,使用显微镜来记录受体与第二配体之间的结合事件数是合适的。可以与本公开的方法组合使用的合适技术的实例包括图像分析、表面等离子体共振(SPR)、全内反射荧光(TIRF)、波导成像、干涉量法散射、光场显微镜检、落射荧光显微镜检、激光扫描显微镜检、轨道扫描显微镜检、局部增强显微镜检、结构光照明显微镜检、RESOLFT显微镜检、空间调制照明、遍在定位显微镜检和/或X射线显微镜检。
本文所述的方法可以允许和/或包括确定第一配体的观测速率常数k
速率常数k
等式1:k
被第一配体结合的受体不能再与第二配体结合或与经固定的第二配体不同地结合。单位时间的结合事件数表示为α(t)且由下面的等式2给出。
等式2:α(t)=k
应理解的是,C
在添加浓度为C
如以下等式3所示,C
等式3:C
在等式3和4中,β(t)表示在时刻t时与第一配体复合的受体的比例。β(t)的值可以为0至1,即0<β(t)<1。可以如以下等式4所示确定β(t)。
等式4:β(t)=C
如本文所述,C
等式5中描述了第一配体的平衡解离常数K
等式5:
K
等式6:K
占用比是受体-配体复合物的量除以受体的初始量,如等式7所示,其中[配体受体]是在平衡时与受体结合的第一配体的浓度,[总受体]是受体的初始浓度。
等式7:占用比=[配体受体]/[总受体]
占用比也可以如等式8所示来表示,其中[配体]是结合反应达到平衡时游离的第一配体的浓度,K
等式8:占用比=[配体]/([配体]+K
当在多个测试孔中执行本发明的方法时,它们可以形成样品保持器组件的一部分,例如微孔滴定板。因此,样品保持器组件可以包括微孔滴定板或由微孔滴定板组成。这种样品保持器组件允许以节省时间和成本的方式进行大量实验。此外,在多个测试孔中执行该方法允许增加灵敏度,因为可以将在测试孔中记录的结合事件数相加,从而提供更多的数据点。
有利地,使用本文所述的多个测试孔允许避免所谓的配体耗尽;当配体太少而受体结合点太多而使配体消耗光时,可能发生配体耗尽。为了避免配体耗尽,应降低受体浓度。然而这会导致较差的信号强度,因为结合测定中的信号强度通常与受体浓度成比例。在本文描述的方法中使用多个测试孔,这因允许将来自若干测试孔的数据点相加而补偿了差的信号强度。
已经发现TIRF是与本文描述的方法组合使用的合适技术。因此,提供了一种如本文所述的方法,其中样品保持器组件被配置为与全内反射荧光(TIRF)显微镜检组合使用,并且包括:
-包括多个无底测试孔的样品保持板;
-底板,所述底板通过连接元件(例如粘合剂)等材料连接至所述样品保持板,从而形成所述多个测试孔的孔底壁,
所述连接元件(例如粘合剂)等材料的折射率N
传统上,TIRF源从样品保持器组件的底板下方提供。对于多个孔,这将是耗时的,因为TIRF源随后必须四处移动。或者,可以将TIRF源放置成使得光束遍布整个底板传播。但是,这还要求光束不泄漏到例如测试孔底壁中。另外,当放在一起时,连接元件(例如粘合剂)应当能够可靠且快捷地连接至样品保持器组件的壁,并且还能够承受添加至样品保持器孔中的诸如溶液和试剂等化学物质。
例如,连接元件可以是粘合剂。有利地,本文所述的粘合剂可以是UV可固化的和/或耐缓冲溶液的。UV固化性允许将功能化的测试孔壁方便快捷地连接到样品保持板的壁上。对缓冲溶液的耐性防止功能化的测试孔壁从样品保持板脱离。
粘合剂可包含来自以下至少一种的硅烷:烷基硅烷,氨基硅烷,环氧基硅烷,含水硅烷(hydrosil),巯基硅烷,甲基丙烯酸硅烷。
为了使来自TIRF源的光束遍布整个底板传播且不泄漏到相邻的介质(例如样品支持底板)中,应选择粘合剂使其折射率N
因此,本发明提供了一种本文所述的方法,其中样品保持器组件与TIRF源组合,该TIRF源被配置为向孔底壁中提供光束,使得光束遍布整个孔底壁传播,从而在多个孔中产生倏逝场。
样品保持器组件可以预先制备以适于预期的应用。例如,可以通过针对特定应用的表面修饰来制备样品保持器组件底板,然后借助于本文所述的连接元件将其连接到样品保持器组件的其余部分。
此外,本公开提供了本文所述的方法在不改变第二配体的情况下评估两种或更多种不同的第一配体与受体之间的结合动力学的应用。
本公开还提供一种配置成与TIRF显微镜检组合使用的样品保持器组件,其包括:
-包括多个无底测试孔的样品保持板;
-底板,所述底板通过如连接元件(例如粘合剂)等材料连接至所述样品保持板,从而形成所述多个测试孔的孔底壁,
所述粘合剂的折射率N
本文公开的样品保持器组件可以与TIRF源组合,该TIRF源被配置为向孔底壁中提供光束,使得光束遍布整个孔底壁传播,从而在多个孔中产生倏逝场。
附图说明
图1是显示出在添加美拉加群之前和之后,脂质体固定的凝血酶的结合事件数随时间变化的图。
图2是显示出添加至脂质体固定的凝血酶的美拉加群的剂量响应曲线的图。
图3是显示出观测结合速率k
图4是显示出在单个测试孔中在添加美拉加群之前和之后脂质体固定的凝血酶的结合事件数随时间变化的图。
图5是显示出在两个测试孔中在添加美拉加群之前和之后脂质体固定的凝血酶的结合事件数随时间变化的图。
图6是显示出在100个测试孔中在添加美拉加群之前和之后脂质体固定的凝血酶的结合事件数随时间变化的图。
图7是包括多个测试孔的微孔滴定板的横截面视图,所述测试孔包括通过粘合剂连接至所述微孔滴定板的功能化底板。
具体实施方式
图7示出了样品保持器组件100的横截面,其包括:具有多个无底测试孔2的样品保持板1,通过粘合剂4连接到样品保持板1的底板3,从而形成了所述多个孔2的孔底壁5。粘合剂的折射率N
如本文所说明的,可以选择粘合剂4以使TIRF光束遍布整个孔底壁传播而不泄漏到诸如底板等相邻介质中。因此,在底板附近产生了倏逝波,其可用于检测本文所述的结合事件。
孔底壁5可以用本文所述的工具化合物功能化。
其他事项
本公开提供了以下事项。
一种确定第一配体与受体之间的相互作用的方法,
所述方法包括以下处理步骤序列:
a)提供不含所述第一配体且包含浓度为C
b)使所述第一溶液与用第二配体功能化的测试孔壁接触,同时记录在时间间隔t
c)向所述第一溶液中加入不含所述受体且包含浓度为C
如第1项所述的方法,其中,所述处理步骤序列在多个测试孔的每一个中完全执行。
如第1项或第2项所述的方法,其中,对所述测试溶液中的多种不同浓度C
如第1项或第2项所述的方法,其进一步包括步骤d):
d)在所述测试溶液中在递增浓度C
如前述任一项所述的方法,其中,所述受体与载体结合以提供经固定的受体,所述载体为例如:脂质体、树状分子、单枝状分子、络合镧系元素、量子点、纳米金刚石、或脂质盘。
如前述任一项所述的方法,其中,所述载体包括荧光团。
如前述任一项所述的方法,其中,第一配体和第二配体相同或不同。
如前述任一项所述的方法,其中,
受体是药物受体;和/或
第一配体和/或第二配体是药物。
如前述任一项所述的方法,其中,步骤b)和/或步骤c)包括使用显微镜。
如前述任一项所述的方法,其包括确定第一配体的观测速率常数k
如第2-10项中任一项所述的方法,其中,所述多个测试孔形成样品保持器组件的一部分,例如微孔滴定板的一部分。
如第11中所述的方法,其中,所述样品保持器组件被配置为与全内反射荧光(TIRF)显微镜检组合使用,并且包括:
-包括多个无底测试孔(2)的样品保持板(1);
-底板(3),所述底板(3)通过粘合剂(4)连接至所述样品保持板(1),从而形成所述多个测试孔(2)的孔底壁(5),
所述粘合剂(4)的折射率(N
如第10-12项中任一项所述的方法,其中,所述粘合剂(4)是UV可固化的和/或耐缓冲溶液的。
一种配置成与TIRF显微镜检组合使用的样品保持器组件(100),其包括:
-包括多个无底测试孔(2)的样品保持板(1);
-底板(3),所述底板(3)通过粘合剂(4)连接至所述样品保持板(1),从而形成所述多个测试孔(2)的孔底壁(5),
所述粘合剂(4)的折射率(N
如第11项所述的方法或第14项所述的样品保持器组件(100),其中,所述样品保持器组件(100)与TIRF源组合,所述TIRF源被配置为向所述孔底壁(5)中提供光束,使得所述光束遍布整个孔底壁(5)传播,从而在所述多个孔(2)中产生倏逝场。
实施例
缩写
CHES N-环己基-2-氨基乙磺酸
HBS Hepes缓冲溶液
HEPES (4-(2-羟乙基)-1-哌嗪乙磺酸)
LED 发光二极管
NHS N-羟基琥珀酰亚胺
ml 微升
L 升
LOD 检测下限
nm 纳米
nM 纳摩
mg 毫克
ml 毫升
mM 毫摩
PBS 磷酸盐缓冲液
PEG4 聚乙二醇,即H-(O-CH
PC 磷脂酰胆碱
PEG 聚乙二醇
PLL-g-PEG 聚-L-赖氨酸接枝的PEG
RT 室温
sec 秒
UV 紫外线
V/V 体积百分比
材料和方法
所有脂质均购自Avanti Polar Lipids。
Pll-g-PEG(11354-X=200-2000-3.5%)和PLL-g-PEG-生物素(11835-X=200-3400-3.5%)购自Nanosoft Polymers。
凝血酶结合肽是由ThermoFisher Scientific按照客户规格合成的。美拉加群购自SantaCruz Biotechnology。
Dymax 3025是Dymax Corporation的产品。
如果没有另外说明,所有其他化学品均购自Sigma。所有化学品均适合分子生物学目的。
制备脂质体
为了获得直径约100nm的脂质体,首先将所需的脂质溶解在氯仿中并混合。将总共5mg 2-油酰基-1-棕榈酰基-sn-甘油-3-磷酸胆碱、0.01mg 1,2-二油酰基-sn-甘油-3-磷酸乙醇胺-N-二苯并环辛基和0.005mg 1,2-二棕榈酰基-sn-甘油-3-磷酸乙醇胺-N-(丽丝胺若丹明B磺酰基)混合在一起。将脂质混合物真空干燥过夜。在轻轻搅拌下,将干燥的脂质在1ml HBS(150mM NaCl,20mM/L HEPES,pH 7.2)中水化。通过孔径为100nm的PC膜将脂质悬浮液挤出11次。用544nm处的光吸收来确定脂质体的浓度,并将脂质体溶液的浓度调节至2.5mg/ml。这等于约30nM的脂质体浓度。
制备蛋白质
为了通过点击化学将凝血酶固定在脂质体上,通过NHS偶联将叠氮基引入凝血酶。因此,将100μL 2mg/ml的人凝血酶与200μL高盐PBS缓冲液(10mM Na
蛋白质的固定
将1.5μL凝血酶-叠氮基与48.5μL冰冷的pH 8.5的CHES缓冲液(20mM CHES,150mMNaCl)混合,然后加入50μL脂质体溶液。将该混合物在冰上储存至少30分钟。将10μL反应混合物用990μL冰冷的pH 8.5的CHES缓冲液(20mM CHES,150mM NaCl)稀释。
表面的预处理
将厚度为0.17mm的玻璃板在基底食人鱼溶液中于373开温育30分钟。将清洁的玻璃板用水冲洗并干燥。向UV固化性粘合剂(Dymax 3025)中补充约1%(v/v)(3-氨丙基)-三乙氧基硅烷。将粘合剂混合物薄薄地铺在无底微孔板的下侧。将玻璃板放置在无底微孔板上,这样形成了底部。粘合剂完全铺开后,根据制造商的说明进行固化。固化后,在微孔板的每个孔中加入10μL含1mg/ml PLL-g-PEG和1mg/mlPLL-g-PEG-生物素的溶液。在轻轻的轨道搅拌下将板温育至少1h。温育后,将每个孔用HBS缓冲液洗涤10次。每个洗涤步骤的稀释比至少为1:10。洗涤后,向每个孔中加入10μL含100μg/mL中性亲和素的溶液。在轻轻的轨道搅拌下将其温育至少4小时。如前所述洗涤所有孔,并向所有孔中加入10μL含10μg/ml与生物素连接的凝血酶结合肽(GVGPRSFKLPGLA-Aib-SGFK-PEG
最后,如前所述洗涤微孔板,每个孔中的残留缓冲液体积为30μL。
显微镜设置
单分子显微镜基于尼康Ti-E镜座。使用LED白光源作为落射荧光光源。物镜是60倍APO TIRF物镜。用HAMAMA TSU Orca-FLASH 4.0V2 sCMOS相机记录图像。样品台是动力化的并配备有微孔保持器。
在显微镜的顶部安装有液体处理机器人(Andrew,Andrew Alliance)。
美拉加群稀释序列
从1.6μM/L开始,对美拉加群进行8次1:3序列稀释。用于系列稀释的缓冲液为pH9.5的CHES缓冲液(20mM CHES,150mM NaCl)。
实施例1
将包含384个孔的微孔板置于显微镜下的微孔板支架中。随后开始进行完全自动化的测量。
单分子测量包括在每个孔中的以下步骤:
1.将如上所述准备的合适的微孔置于物镜上,并调整物镜使其焦平面位于微孔的内表面。
2.用70μL pH 9.5的CHES缓冲液(20mM/L CHES,150mM/L NaCl)洗涤孔。
3.将5μL含CHES缓冲剂和附着有凝血酶的脂质体的溶液添加到孔中,并混合孔内容物。
4.以10sec
5.采集20秒后,添加5μL包含适当浓度的美拉加群和CHES缓冲剂的溶液,并快速混合孔内容物(<0.5秒)。
6.继续采集图像数据,直到记录了901帧。
对每个设计的美拉加群浓度重复步骤1至6三次。测试了八种美拉加群浓度,即200nM,66.7nM,22.2nM,7.4nM,2.5nM,0.8nM,0.3nM和0.1nM。对于每种测试的美拉加群浓度,在每个孔中完全进行上述步骤1-6。在每个孔中同时进行每个方法步骤,即在每个孔中同时执行步骤1,然后在每个孔中同时执行每个后续步骤。
分析所记录的图像数据以确定每个孔中新结合的脂质体的数量。第一步,检测每个孔中形状与参照物相似的所有对象。
在第二步中,确定了哪些对象结合到了表面。分析了对象的移动性来作为其结合至表面的指示。如果移动性低于阈值(对象在两个连续帧之间的移动距离不超过一个像素(此处为215-304nm)),则认为该对象是不动的,因此是结合至表面的。记录结合的脂质体的数量,即结合事件数。分别在添加美拉加群之前和之后将所有孔的结合事件数相加,以提供累积结合事件数。这是针对每种美拉加群浓度进行的。
如图1所示,相对于时间绘制了在添加美拉加群之前和之后结合的脂质体的累积数。在图A中,美拉加群浓度为200nM,凝血酶浓度为15pM。在图1中,t
在添加测试化合物美拉加群之前,观察到脂质体与表面的结合速率是随时间恒定的。相对于时间绘制结合事件的累积数,结果得到了线性函数,其中斜率等于结合速率。在注入和混合测试化合物的过程中,与表面的结合速率增加。在短暂的平衡时间后,将结合速率再次归一化。在此混合期间获取的数据未用于分析。如本文所述分析了结合事件的累积数,并求出观测结合速率常数k
计算初始斜率与最终斜率之比。这对每种美拉加群浓度重复3次。该比率等于在各自浓度下美拉加群对凝血酶的占用比。然后根据下面的等式计算平衡解离常数K
占用比=[美拉加群]
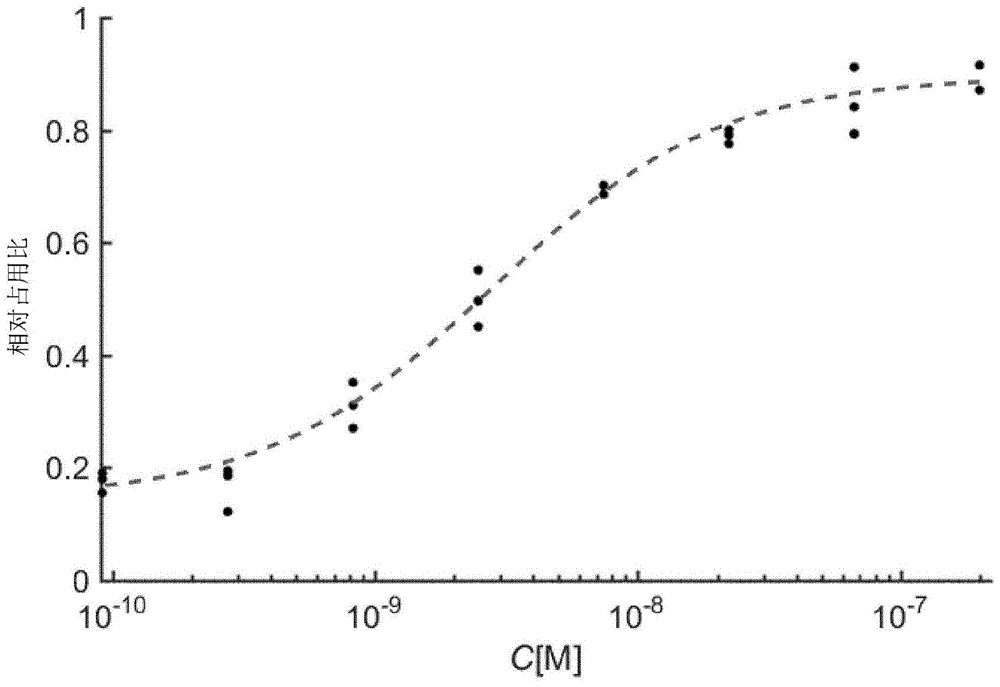
由剂量响应曲线提供平衡解离常数K
图3显示了观测结合速率常数k
由于平衡解离常数K
结论是,本文描述的方法允许确定测试化合物的k
实施例2
在本实施例中,在2个孔的每个孔中以及在100个孔的每个孔中,在单个孔中完全执行实施例1中描述的方法步骤。凝血酶浓度为1pM。美拉加群浓度为7.4nM。
首先,在单个孔中进行实验。将结合事件数相对于时间作图,如图4所示。由于结合事件数少,因此无法可靠地拟合观测速率常数k
可以得出结论,通过在多个孔中进行所述方法步骤并且在将记录的添加测试化合物之前和之后孔的结合事件数相加,可以增强本文所述的方法的灵敏度。
还得出结论,本文描述的方法允许可靠地测量低受体浓度(例如低于对应于集总平均法的LOD的最低浓度的受体浓度)的观测速率常数k
参考文献
1.Geschwindner,S.,Dekker,N.,Horsefield,R.,
2.Motulsky,H.J.,and Mahan,L.C.(1984).The kinetics of competitiveradioligand binding predicted by the law of mass action.Mol.Pharmacol.25,1–9.
3.Schiele,F.,Ayaz,P.,and Fernández-Montalván,A.(2015).A universalhomogeneous assay for high-throughput determination of bindingkinetics.Anal.Biochem.468,42–49.
4.Gunnarsson,A.,Snijder,A.,Hicks,J.,Gunnarsson,J.,
5.Ola Wahlsten,Anders Gunnarsson,Lisa Simonsson
6.Gunnarsson,A.,Dexlin,L.,Wallin,P.;Svedhem,S.,
