一种用于检测单增李斯特菌的荧光淬灭型生物传感器及其制备方法
文献发布时间:2024-01-17 01:17:49
技术领域
本发明属于食品检测技术领域,具体涉及一种用于检测单增李斯特菌的荧光淬灭型生物传感器及其制备方法。
背景技术
单增李斯特菌是一种能导致侵袭性李斯特菌病的食源性致病菌,受污染的即食食品是人类李斯特菌病的高风险来源。自20世纪80年代以来,单增李斯特菌对食品行业产生了巨大的经济影响,人类李斯特菌病的暴发与受污染食品的关联一直被卫生部门所关注。目前单增李斯特菌的检测方法有免疫磁珠、数字PCR、生物传感器等,多数因成本较高而未能广泛推广。国标法和实时荧光PCR法是应用最普遍的两种方法。国标法(GB 4789.30-2016)检测单增李斯特菌需分离纯化菌株,根据生化试验判别,结果准确,但至少需4d时间能出结果,这种方法在食品生产实时监测中具有局限性。实时荧光PCR法(SN/T1870-2016)检测单增李斯特菌不需分离菌株,利用分子生物技术,检测速度快,但其最低检出限量与不同类型食品中扩增效果鲜见比较和报道。新兴的荧光生物探针的检测方法因其成本低、操作简便、响应快、稳定性高等优点,被广泛应用于靶标物质的测定。其中,荧光共振能量转移(FRET,Förster resonance energy transfer)作为一种非辐射能量跃迁,通过分子间的电偶极相互作用,将供体激发态能量转移到受体激发态,在荧光探针检测技术中被广泛应用。硅纳米颗粒(silicon-containing nanoparticles,SNPs)的相应研究较少,其常由含硅的偶联剂进行催化还原制备而得。基于荧光共振能量转移的方法大多通过缩短供体与受体之间的距离来实现,例如,利用偶联在微生物菌体表面上的比率型荧光探针位置上靠近来进行能量转移。比率型荧光探针因其具有高灵敏度、操作简单、对目标物的响应时间短等优势。当前,需要选择合适的可作为能量供体的第一荧光探针,并选择合适的可作为能量受体的第二荧光探针,来组成有效的FRET型荧光淬灭型生物传感器,但由于双适配体夹心的方式失败率较高,需要使用新的核酸适配体来组合使用,很容易出现菌体表面全被其中一种荧光探针占满致使另一荧光探针无法使用。
发明内容
针对现有的食品中单增李斯特菌的检测技术存在检测难度大、耗时长、灵敏度低的问题,本发明提供一种用于检测单增李斯特菌的荧光淬灭型生物传感器,同时提供用于检测单增李斯特菌的荧光淬灭型生物传感器的制备方法。
一种用于检测单增李斯特菌的荧光淬灭型生物传感器,按体积比1:2由作为能量供体的荧光探针和作为能量受体的淬灭探针混合均匀制成;
所述荧光探针为第一适配体修饰的硅纳米颗粒;
所述淬灭探针为第二适配体修饰的金纳米粒子;
所述第一适配体的DNA序列如SEQ ID No:1所示,所述第一适配体的5’端用羧基进行修饰;
所述第二适配体的DNA序列如SEQ ID NO:2所示,所述第二适配体的5’端用巯基进行修饰;
所述荧光淬灭型生物传感器用于检测单增李斯特菌的线性拟合系数为0.98154,检出限为19.27CFU/mL。
一种用于检测单增李斯特菌的荧光淬灭型生物传感器的制备操作步骤如下:
(1)制备第一活化混合液
按体积比1:1,将浓度10mM的1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐和浓度5mM的N-羟基琥珀酰亚胺混合,得到第一活化混合液;
(2)制备第二活化混合液
在3-(2-甲酰乙基)膦盐酸盐中加入纯水,得到终浓度2.867g/L的3-(2-甲酰乙基)膦盐酸盐溶液,即第二活化混合液;
(3)制备荧光探针
在1mL N-(β-氨乙基-γ-氨丙基)甲基二甲氧基硅烷中加入6mL去离子水;再加入8.0mg 阿米酚,连续搅拌30min;在200℃下加热6h,冷却至室温;加入纯水稀释20倍,得到反应液;将500uL反应液和250uL第一活化混合液涡旋混合,以180rpm、室温条件下摇床孵育30min;再加入160uL体积浓度10umol/L的第一适配体溶液涡旋混合,以180rpm、室温条件下摇床孵育2.5h,制得荧光探针,4℃包裹锡纸避光保存;
所述第一适配体溶液中的第一适配体的DNA序列如SEQ ID No:1所示,所述第一适配体的5’端用羧基进行修饰;
(4)制备淬灭探针
(4.1)将1mL 质量浓度1%的四氯金酸溶液加入到100mL蒸馏水中,煮沸;快速加入2.5mL 质量浓度1%的柠檬酸三钠溶液,继续煮沸15min,自然冷却至室温,得到金纳米粒子溶液;
(4.2)将100μL 体积浓度10μM的第二适配体溶液,在95℃条件下水浴5min,在4℃条件下冷却5min,得到退火溶液;在退火溶液中加入10μL质量体积浓度2.867g/L的3-(2-甲酰乙基)膦盐酸盐溶液,在室温条件下,静置反应30min,得到反应液;在反应液中加入1mL金纳米粒子溶液,在37℃条件下孵育12h,转速12000rpm条件下离心20min,去除上清液,得到沉淀;
所述第二适配体溶液中的第二适配体的DNA序列如SEQ ID NO:2所示,所述第二适配体的5’端用巯基进行修饰;
(4.3)在沉淀中加入400μL质量浓度0.1M、pH值7.4的PBS溶液,4℃保存包裹锡纸避光保存,制得淬灭探针;
(5)制备生物传感器
按体积比1:1.5将所述荧光探针和所述淬灭探针混合,制得荧光淬灭型生物传感器;
当硅纳米颗粒的荧光发射波长从520nm偏移至525nm,表示荧光淬灭型生物传感器中第一适配体成功修饰到硅纳米颗粒上,当金纳米粒子的紫外吸收波长从522nm偏移至527nm,表示荧光淬灭型生物传感器中第二适配体成功修饰到金纳米粒子上。
本发明的有益技术效果体现在以下方面:
1.经验证,本发明制备的荧光淬灭型生物传感器具有较高的线性拟合程度(相关系数高达0.98154)与较低的检出限(低至19.27CFU/mL),当前现有技术的线性拟合程度普遍范围在0.90-0.99;同时,与传统技术(链置换反应法、PCR扩增法、ELISA试剂盒法)相比,它们的检出时间长达12h-3d不等,对部分常见模式菌株的特异性交叉,而本荧光淬灭型生物传感器具备较低的检出时间(仅需要35min)、较好的特异性(对常见模式菌株金黄色葡萄球菌、大肠杆菌等),例如,传统的链置换反应是利用DNA分子杂交的自由能差异,以一条单链DNA置换出杂交DNA双螺旋结构中的目标单链,由于单链DNA上带负电荷的磷酸基团对双链DNA具有分子内静电排斥作用,导致链置换反应效率相对较低。此外,对于双适配体夹心的生物传感器,现有技术通常采用相同的两个适配体来进行夹心处理,这种方式造成其中一个探针迅速占满细菌的菌体表面,进而无法实现另一个探针吸附至菌体表面;而在本发明荧光淬灭型生物传感器中的一个探针使用已有的公知的核酸适配体,另一个则使用本发明筛选出来的新的核酸适配体,由于核酸适配体的结合性质至今尚未研究清楚,从已有的公开的核酸适配体进行有效的挑选及组合配对的难度甚大。
2.经测试,在标准环境下建立的线性回归方程可以直接应用到LB肉汤样品的检测中,无需重新培养细菌来建立标准曲线,只需将已经建立好的线性回归方程直接应用即可,节约时间,适合应急环境下快速估算常见样品中单增李斯特菌的初步浓度。例如,在LB肉汤样品中,在LB肉汤中人工接种单增李斯特菌的环境下,荧光淬灭型生物传感器测得的单增李斯特菌的浓度为3.82*10
3.综合来说,本申请选择第一适配体修饰的硅纳米颗粒与第二适配体修饰的金纳米粒子组成荧光淬灭型传感器,这是两种不同类型的探针首次进行组合使用,从数以万计的类似量子点或纳米颗粒选择合适的配对荧光探针需要付出很大的创造性劳动,同时现有技术中并未公开硅纳米颗粒/金纳米粒子应用到食源性单增李斯特菌的检测,由于原有的硅纳米颗粒用于小分子芦丁的检测,能否应用到细菌的检测中无法得知,不仅需要考虑到硅纳米颗粒/金纳米粒子之间是否发生络合反应或者与单增李斯特菌的外表面发生螯合,而且将上述硅纳米颗粒/金纳米粒子组合成荧光淬灭型生物传感器还需要考虑能否发生有效的FRET效应,需要考虑到硅纳米颗粒与金纳米粒子之间荧光发射-紫外吸收的重叠交叉程度;此外,是否会出现其中一个适配体完全占满菌体表面,硅纳米颗粒与第一适配体之间共价偶联,金纳米粒子与第二适配体之间共价偶联,以及两种探针之间的使用浓度与体积比例等等多种复杂因素的考虑,这是现有技术中并未公开,也是本领域相应公知常识无法得到技术启示。
附图说明
图1为本发明中用于检测单增李斯特菌的荧光淬灭型生物传感器的应用原理图。
图2为本发明中荧光探针与第一适配体共价偶联前后的荧光光谱图。
图3为本发明中淬灭探针与第二适配体共价偶联前后的紫外吸收图。
图4为本发明中不同浓度单增李斯特菌的荧光光谱图。
图5为本发明中单增李斯特菌的标准曲线图。
图6为本发明中单增李斯特菌的特异性检测图。
图7为本发明中自来水样品的标准曲线图。
图8为本发明中鸡蛋样品的标准曲线图。
图9为本发明中奶酪样品的标准曲线图。
具体实施方式
下面结合具体实施例对本发明进一步进行描述。
除有定义外,以下实施例中所用的技术和科学术语具有与本发明所属领域技术人员普遍理解的相同含义。
以下实施例中所用的原材料如无特殊说明,均为常规生化试剂;所述实验方法,如无特殊说明,均为常规方法;以下实施例中的定量试验,如无特殊说明,均设置三次重复实验,结果取平均值;以下实施例中的%,如无特别说明,均为质量百分含量。
以下实施例中,使用的适配体采购自生工生物工程(上海)股份有限公司;使用的1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐、N-羟基琥珀酰亚胺、盐酸胍、万古霉素、抗坏血酸钠及3-氨丙基三甲氧基硅烷采购自上海阿拉丁生化科技股份有限公司;使用的500Da透析袋采购自上海源叶生物科技有限公司;如无特别说明,使用的其他原料均采购自国药集团化学试剂有限公司。
需要提醒的是,本发明使用的PBS磷酸盐缓冲液为0.1M、pH值7.4的无菌PBS缓冲液。
需要提醒的是,本发明使用的所有的菌种均采购自美国模式培养物集存库(ATCC),
其中单增李斯特菌的编号为ATCC 43251,其中金黄色葡萄球菌的编号为ATCC29213,其中沙门氏菌的编号为ATCC 14028,其中大肠杆菌的编号为ATCC 25922,其中阪崎克罗诺杆菌的编号为ATCC29544,其中铜绿假单胞菌的编号为ATCC 15442。此外,上述菌株通过合肥希玥生物科技有限公司进行境外代理采购。
需要提醒的是,本发明所使用的仪器设备、原料试剂或方法步骤,均确保在无菌条件下进行处理。
需要提醒的是,本发明未提及的仪器设备、原料试剂或方法步骤,对于本领域技术人员来说属于常规或公知的技术方法,在本申请中不在赘述,可以参考如下的论文资料(yuwei Ren, Lulu Cao, Xiyan Zhang, Rui Jiao, Dexin Ou, Yang Wang, DanfengZhang,Yizhong Shen, Na Ling, Yingwang Ye,A novel fluorescence resonanceenergy transfer (FRET)-based paper sensor with smartphone for quantitativedetectionof Vibrio parahaemolyticus,Food Control,Volume 145,2023,109412,ISSN0956-7135,https://doi.org/10.1016/j.foodcont.2022.109412.)。
实施例1
一种用于检测单增李斯特菌的荧光淬灭型生物传感器的制备操作步骤如下:
(1)制备第一活化混合液
按体积比1:1,将浓度10mM的1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐和浓度5mM的N-羟基琥珀酰亚胺混合,得到第一活化混合液。
(2)制备第二活化混合液
在3-(2-甲酰乙基)膦盐酸盐中加入纯水,得到终浓度2.867g/L的3-(2-甲酰乙基)膦盐酸盐溶液,即第二活化混合液。
(3)制备荧光探针
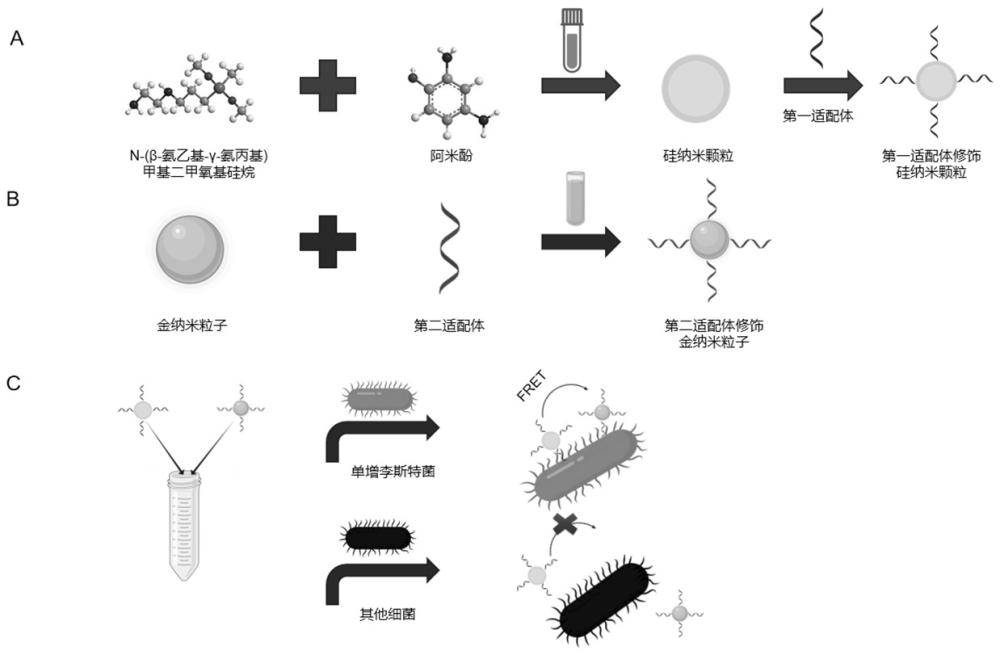
参见图1中的A,在1mL N-(β-氨乙基-γ-氨丙基)甲基二甲氧基硅烷中加入6mL去离子水;再加入8.0mg 阿米酚,连续搅拌30min;在200℃下加热6h,冷却至室温;加入纯水稀释20倍,得到反应液;将500uL反应液和250uL第一活化混合液涡旋混合,以180rpm、室温条件下摇床孵育30min;再加入160uL体积浓度10umol/L的第一适配体溶液涡旋混合,以180rpm、室温条件下摇床孵育2.5h,制得荧光探针,4℃包裹锡纸避光保存。
第一适配体溶液中的第一适配体的DNA序列如SEQ ID No:1所示,第一适配体的5’端用羧基进行修饰。
(4)制备淬灭探针
参见图1中的B,具体操作如下:
(4.1)将1mL 质量浓度1%的四氯金酸溶液加入到100mL蒸馏水中,煮沸;快速加入2.5mL 质量浓度1%的柠檬酸三钠溶液,继续煮沸15min,停止煮沸,自然冷却至室温,得到金纳米粒子溶液。
(4.2)将100μL 体积浓度10μM的第二适配体溶液在95℃条件下水浴5min,在4℃条件下冷却5min,得到退火溶液;在退火溶液中加入10μL质量体积浓度2.867g/L的3-(2-甲酰乙基)膦盐酸盐溶液,在室温条件下,静置反应30min,得到反应液;在反应液中加入1mL 金纳米粒子溶液,在37℃条件下孵育12h,转速12000rpm条件下离心20min,去除上清液,得到沉淀。
第二适配体溶液中的第二适配体的DNA序列如SEQ ID NO:2所示,第二适配体的5’端用巯基进行修饰。
(4.3)在沉淀中加入400μL质量浓度0.1M、pH值7.4的PBS溶液,4℃保存包裹锡纸避光保存,制得淬灭探针;
(5)制备生物传感器
按体积比1:1.5将所述荧光探针和所述淬灭探针混合,制得荧光淬灭型生物传感器;
参见图2,图2中的曲线A为未进行第一适配体修饰的硅纳米颗粒荧光发射波长图,图2中的曲线B为第二适配体修饰的硅纳米颗粒荧光发射波长图,当硅纳米颗粒的荧光发射波长从520nm偏移至525nm,表示荧光淬灭型生物传感器中第一适配体成功修饰到硅纳米颗粒上。
参见图3,图3中的曲线A为未进行第二适配体修饰的金纳米粒子紫外吸收图,图3中的曲线B为第二适配体饰的金纳米粒子紫外吸收图,当金纳米粒子的紫外吸收波长从522nm偏移至526nm,表示荧光淬灭型生物传感器中第二适配体成功修饰到金纳米粒子上。
实施例2
用实施例1制备的荧光淬灭型生物传感器检测单增李斯特菌
参见图1中的C,具体检测操作步骤如下:
(1)线性回归方程建立:制备不含菌的待测样品的待测溶液,设置为空白对照待测溶液,并对空白对照待测溶液进行人工污染单增李斯特菌,设置呈线性梯度稀释的含菌待测溶液。
按体积比1:1将荧光淬灭型生物传感器分别与空白对照待测溶液、含菌待测溶液混合,孵育35min,得到孵育液。
在激发波长435nm下,测定孵育液在525nm发射波长下荧光强度,其中空白对照待测溶液的荧光强度记为F
(2)待测样品中单增李斯特菌的检测:制备待测样品的待测溶液,按体积比1:1将荧光淬灭型生物传感器与待测溶液混合,孵育35min,得到孵育液;在激发波长430nm下测定孵育液在525nm发射波长下荧光强度。
根据得到的荧光强度比值F
实验时,选择PBS缓冲液作为空白对照待测溶液,同时,将单增李斯特菌的菌液离心后使用PBS缓冲液清洗三次,然后使用PBS缓冲液进行重悬及梯度稀释,制作浓度分别为3.9*10
本发明制备的荧光淬灭型生物传感器,其中荧光探针在525nm具有一明显荧光发射峰,同时,位于525nm处的荧光强度值F与位于525nm处的荧光强度值F
同时,参见图4,从上到下的荧光光谱曲线,分别为:图4中的0号曲线表示菌浓度为0CFU/mL的荧光光谱曲线(空白对照待测溶液)、图4中的3号曲线表示菌浓度为3.9*10
为了增加对真实食品样品的检测,选择LB肉汤样品进行测试:
需要提醒的是,为了验证按照上述的标准曲线是否可以有效应用于干扰环境(LB肉汤)下的测定,故分别进行人工定量染菌及LB肉汤样品中探针检测的菌数量之间的差异,以获知即使在真实样品中,本发明所建立的荧光淬灭型生物传感器可有效在有高蛋白等营养物质的影响下进行检测。
需要说明的是,本实施例2涉及的LB肉汤采购青岛高科技工业园海博生物技术有限公司,其成分(g/L)如下:胰蛋白胨 10.0g/L、酵母浸粉 5.0g/L、氯化钠10.0g/L,pH 7.0±0.1。
实验时,在1mL的LB肉汤中人工接种单增李斯特菌,其中接种后单增李斯特菌的终浓度为3.9*10
试验结果表明,经计算,在LB肉汤样品中人工接种单增李斯特菌的环境下,荧光淬灭型生物传感器测得的单增李斯特菌的浓度为3.82*10
此外,进行特异性检测试验:
将单增李斯特菌分别更换成金黄色葡萄球菌、沙门氏菌、大肠杆菌、阪崎克罗诺杆菌、铜绿假单胞菌;并分别制作浓度为3.9*10
结合图6可以看出,加入金黄色葡萄球菌、沙门氏菌、大肠杆菌、阪崎克罗诺杆菌、铜绿假单胞菌后的含菌待测溶液,其荧光强度比值F/F
实施例3
用实施例1制备的荧光淬灭型生物传感器检测真实食品样品中的单增李斯特菌。
(1)检测自来水样品
自来水:取自校内厕所的自来水管,取时自来水的温度为15℃。
荧光淬灭型生物传感器对自来水中单增李斯特菌的可视化检测操作步骤如下:
制备自来水溶液:在1mL的自来水中人工接种单增李斯特菌,得到单增李斯特菌的终浓度分别为3.9*10
制备被检测液:按照体积1:1将比率荧光探针与五份自来水溶液分别混合,孵育35min,得到五份被检测液;
对被检测液进行检测:
将五份被检测液通过红绿蓝三色图像仪分别测定在激发波长435nm下避光产生的图像,将所述图像进行红绿蓝色值的读取;
选择以读取的红绿蓝色值中五份红色值与蓝色值之间的比值作为纵坐标,并以被检测液的菌浓度的对数值作为横坐标,绘制标准曲线,根据线性回归方程得到相关系数与检出限。
同等条件下,将不接种的自来水作为空白对照检测液,其中单增李斯特菌的浓度为0CFU/mL。
利用微型荧光光谱设备(台湾光宏有限公司生产的UV紫外光设备,型号为泰溢)对得到的五份被检测液分别进行435nm激发处理,并利用RGB红绿蓝三色图像仪(荷兰Admesy公司生产的在线测试色度计,型号为Hyperion)对激发处理的五份被检测液分别的图像进行RGB红绿蓝三色色值的分析;最后,以其中红色值与蓝色值之间的比值作为纵坐标,并以五份被检测液的菌浓度的对数值作为横坐标,绘制标准曲线,根据得到线性回归方程得到相关系数与检出限。
自来水溶液:
参见图7中的A,从左到右(“0”、“3”、“4”、“5”、“6”、“7”)分别为:菌浓度为0CFU/mL的检测图像(空白对照检测液)、菌浓度为3.9*10
对于自来水溶液,其读取的红绿蓝色值中红色值与蓝色值之间的比值大于1.26时,自来水中未检出单增李斯特菌;所述比值小于1.26时,自来水中含有单增李斯特菌,将比值带入所述线性回归方程中即可得到自来水溶液中单增李斯特菌的浓度。
取自校内厕所的自来水管的自来水的检测结果为单增李斯特菌的浓度为0CFU/mL。
(2)检测鸡蛋样品
鸡蛋:采购自校内超市,采购时鸡蛋贮存在4℃的冰箱内,生产产商为温氏食品集团股份有限公司,其品牌为“温氏天露鲜鸡蛋”,其商品编码为65280985486,其产地为江苏盐城。
荧光淬灭型生物传感器对鸡蛋中单增李斯特菌的可视化检测操作步骤如下:
制备鸡蛋溶液:在1mL的鸡蛋蛋清中人工接种单增李斯特菌,得到单增李斯特菌的终浓度分别为3.9*10
制备被检测液:按照体积1:1将比率荧光探针与五份鸡蛋溶液分别混合,孵育35min,得到五份被检测液;
对被检测液进行检测:
将五份被检测液通过红绿蓝三色图像仪分别测定在激发波长435nm下避光产生的图像,将所述图像进行红绿蓝色值的读取;
选择以读取的红绿蓝色值中五份红色值与蓝色值之间的比值作为纵坐标,并以被检测液的菌浓度的对数值作为横坐标,绘制标准曲线,根据线性回归方程得到相关系数与检出限。
同等条件下,将不接种的鸡蛋作为空白对照检测液,其中单增李斯特菌的浓度为0CFU/mL。
利用微型荧光光谱设备(台湾光宏有限公司生产的UV紫外光设备,型号为泰溢)对得到的五份被检测液分别进行435nm激发处理,并利用RGB红绿蓝三色图像仪(荷兰Admesy公司生产的在线测试色度计,型号为Hyperion)对激发处理的五份被检测液分别的图像进行RGB红绿蓝三色色值的分析;最后,以其中红色值与蓝色值之间的比值作为纵坐标,并以五份被检测液的菌浓度的对数值作为横坐标,绘制标准曲线,根据得到线性回归方程得到相关系数与检出限。
鸡蛋溶液:
参见图8中的A,从左到右(“0”、“3”、“4”、“5”、“6”、“7”)分别为:菌浓度为0CFU/mL的检测图像(空白对照检测液)、菌浓度为3.9*10
对于鸡蛋溶液,其读取的红绿蓝色值中红色值与蓝色值之间的比值大于1.20时,鸡蛋中未检出单增李斯特菌;所述比值小于1.20时,鸡蛋中含有单增李斯特菌,将比值带入所述线性回归方程中即可得到鸡蛋溶液中单增李斯特菌的浓度。
取自鸡蛋的检测结果为单增李斯特菌的浓度为0CFU/mL。
(3)检测奶酪样品
奶酪:采购自校内超市,采购时奶酪贮存在4℃的冰箱内,生产产商为三只松鼠股份有限公司,其品牌为“小鹿蓝蓝冻干奶酪块原味”,其营养成分如下:每100g中能量为2279kJ,蛋白质为14.3g,脂肪为32.1g,碳水化合物为49.9g,钠为430mg,钙为437mg。
荧光淬灭型生物传感器对奶酪中单增李斯特菌的可视化检测操作步骤如下:
制备奶酪溶液:在奶酪中接种单增李斯特菌,其接种量为3.9*10
制备被检测液:按照体积1:1将比率荧光探针与五份奶酪溶液分别混合,孵育35min,得到五份被检测液;
对被检测液进行检测:
将五份被检测液通过红绿蓝三色图像仪分别测定在激发波长435nm下避光产生的图像,将所述图像进行红绿蓝色值的读取;
选择以读取的红绿蓝色值中五份红色值与蓝色值之间的比值作为纵坐标,并以被检测液的菌浓度的对数值作为横坐标,绘制标准曲线,根据线性回归方程得到相关系数与检出限。
同等条件下,将不接种的奶酪作为空白对照检测液,其中单增李斯特菌的浓度为0CFU/mL。
利用微型荧光光谱设备(台湾光宏有限公司生产的UV紫外光设备,型号为泰溢)对得到的五份被检测液分别进行435nm激发处理,并利用RGB红绿蓝三色图像仪(荷兰Admesy公司生产的在线测试色度计,型号为Hyperion)对激发处理的五份被检测液分别的图像进行RGB红绿蓝三色色值的分析;最后,以其中红色值与蓝色值之间的比值作为纵坐标,并以五份被检测液的菌浓度的对数值作为横坐标,绘制标准曲线,根据得到线性回归方程得到相关系数与检出限。
奶酪溶液:
参见图9中的A,从左到右(“0”、“3”、“4”、“5”、“6”、“7”)分别为:菌浓度为0CFU/mL的检测图像(空白对照检测液)、菌浓度为3.9*10
对于奶酪溶液,其读取的红绿蓝色值中红色值与蓝色值之间的比值大于1.20时,奶酪中未检出单增李斯特菌;所述比值小于1.20时,奶酪中含有单增李斯特菌,将比值带入所述线性回归方程中即可得到奶酪溶液中单增李斯特菌的浓度。
取自奶酪的检测结果为单增李斯特菌的浓度为0CFU/mL。
本领域的技术人员容易理解,以上实施例1仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 一种利用荧光淬灭方法检测油脂中过氧化值的方法
- 一种用于单增李斯特菌快速检测的荧光生物传感器构建方法
- 一种用于单增李斯特菌荧光RAA检测的引物和探针序列及其应用
