神经损伤治疗用药剂缓释片材
文献发布时间:2024-01-17 01:17:49
本案是申请日为
技术领域
本发明涉及神经损伤治疗用药剂缓释片材(以下,有时简记为“本发明片材”。)。更具体而言,涉及含有对神经损伤具有治疗效果的药剂且将该药剂缓慢放出的片材及其制造方法等。
背景技术
末梢神经损伤大致分为损伤部的连续性中断的不连续性损伤、和卡压性神经障碍(腕管综合征等)等在损伤部的神经具有连续性的有连续性神经损伤。作为针对不连续性损伤的治疗法,可以选择直接缝合、自体神经移植等。另一方面,作为针对有连续性神经损伤的治疗法,则可以选择神经剥离术、保存治疗。至今,作为针对末梢神经损伤具有再生效果的装备,进行了人工神经的开发,但其只能针对不连续性神经损伤使用。另外,这些仅单纯地将损伤部的缺损连接,不具有促进神经轴索再生的效果。如果在末梢神经损伤后至恢复为止需要长时间,则肌肉组织发生不可逆的变化,因此促进神经轴索再生成为重要课题。另外,如上所述,人工神经只能应对在缺损存在于损伤部的神经损伤,尚不存在针对患者数最多的有连续性神经损伤的装备。因此,在医疗现场需要对有连续性神经损伤和不连续性神经损伤均能够应用并且对神经损伤的治疗有效的工具。
作为本发明片材所含的药剂之一,有维生素B12。为了使神经系统正常发挥功能,维生素B12是重要的,已知缺乏维生素B12会引起被称作“脊髓亚急性联合变性(subacutecombined degeneration of the spinal cord)”的全身性神经障碍(非专利文献1)。本发明的发明人报道了如下的内容:100nM以上浓度的甲钴胺促进神经突起生长和神经元的生存;这些效果由作为有关甲基化的反应的甲基化循环所介导;甲钴胺通过甲基化循环使Erk1/2和Akt的活性增大;以及在大鼠坐骨神经损伤模型中甲钴胺的高用量连续给药使神经再生和功能恢复提高(非专利文献2)。
专利文献1中记载了包含水溶性玻璃纤维和聚己内酯等生物相容性结合材料的、用于埋入体内的柔软的片状生物降解性复合材料。记载了为了促进治愈而将该柔软的片状生物降解性复合材料卷绕在组织的缺陷区域的周围来使用,以及用于防止外科手术后形成粘连。另外,记载了该生物降解性复合材料能够用作神经移植片材的代替物,被设想应用于不连续性神经损伤,但不具有促进神经轴索再生的效果。
作为本发明片材能够含有的药剂,除此以外还有痘苗病毒接种兔炎症皮肤提取物(以下称作“本发明提取物”。)或其分离物。关于本发明提取物或含有本发明提取物的制剂,已知涉及非常多方面的作用和效果,但是对于含有其的神经损伤治疗用片材目前尚未得知。
作为本发明片材所含的药剂,还可以列举神经成长因子(nerve growth factor:NGF)、脑源神经营养因子(brain-derived neurotrophic factor:BDNF)等。这些与神经营养因子-3(neurotrophin-3:NT-3)等同属于神经营养因子家族(神经营养因子家族),是由各种细胞、例如神经细胞(神经元)、神经胶质细胞等(小胶质细胞、星状细胞、少突胶质细胞等)所产生的分泌性蛋白质。神经营养因子显示神经细胞的生存维持、神经突起的增生促进、神经传递物质的合成促进等作用。NGF在神经元投射的靶细胞(神经元或肌肉等)合成、分泌,经由神经元的轴索末端的TrkA受体接收,逆行性地搬运至细胞体而发挥功能。NGF在末梢神经系统中特异性作用于感觉神经元(背根神经节的小型细胞)、交感神经节后神经元,在中枢神经系统中特异性作用于向大脑皮质或海马投射的前脑基底部胆碱能神经元。已知BDNF以海马为中心偏置存在于中枢神经系统,如神经细胞的生存、维持、神经突起的形态调节、突触的功能调节、神经可塑性的控制等在神经系统显示各种生理活性。然而,对于含有这些神经营养因子的神经损伤治疗用片材目前尚未得知。
现有技术文献
专利文献
专利文献1:日本特表2005-528145号公报
非专利文献
非专利文献1:Scalabrino et al.,Lab.Invest.,62(1990),297-304
非专利文献2:Okada et al.,Experimental Neurology,222(2010),191-203
发明内容
发明要解决的技术问题
本发明的课题在于提供一种神经损伤治疗用药剂缓释片材,其能够将损伤部位的药剂浓度长期维持在适当高度,并且即使埋入在神经损伤部位的周围部,也不会带来如对神经造成不良影响的刺激,而促进神经再生。
用于解决技术问题的技术方案
为了解决上述课题,本发明包括以下各发明。此外,在后面阐述有关这些发明更为详细的内容。
[1]一种药剂缓释片材,其包括由含有神经损伤治疗用药剂和生物相容性聚合物的纳米纤维形成的无纺布。
[2]如上述[1]所述的药剂缓释片材,其中,药剂为维生素B12。
[3]如上述[1]所述的药剂缓释片材,其中,药剂为痘苗病毒接种兔炎症皮肤提取物或其分离物。
[4]如上述[1]所述的药剂缓释片材,其中,药剂为神经营养因子。
[5]如上述[4]所述的药剂缓释片材,其中,神经营养因子为NGF或BDNF。
[6]如上述[1]~[5]中任一项所述的药剂缓释片材,其中,生物相容性聚合物为生物降解性脂肪族聚酯或聚丙烯酰胺衍生物。
[7]如上述[6]所述的药剂缓释片材,其中,生物降解性脂肪族聚酯选自聚己内酯或其共聚物、聚乳酸或其共聚物、聚乙醇酸或其共聚物、以及它们的混合物。
[8]如上述[6]所述的药剂缓释片材,其中,聚丙烯酰胺衍生物选自聚(N-异丙基丙烯酰胺)或其共聚物、聚(2-羟基乙基甲基丙烯酰胺)或其共聚物、N-异丙基丙烯酰胺和2-羟基乙基甲基丙烯酰胺的共聚物、以及它们的混合物。
[9]如上述[1]~[8]中任一项所述的药剂缓释片材,其中,片材的杨氏模量为100kPa~100MPa。
[10]如上述[1]~[9]中任一项所述的药剂缓释片材,其中,片材的重量为1mg/cm
[11]一种药剂缓释片材,其中,片材包括由含有药剂和生物相容性聚合物的纳米纤维形成的无纺布,杨氏模量为100kPa~100MPa,重量为1mg/cm
[12]如上述[11]所述的药剂缓释片材,其中,药剂为维生素B12。
[13]如上述[11]所述的药剂缓释片材,其中,药剂为痘苗病毒接种兔炎症皮肤提取物或其分离物。
[14]如上述[11]所述的药剂缓释片材,其中,药剂为神经营养因子。
[15]如上述[14]所述的药剂缓释片材,其中,神经营养因子为NGF或BDNF。
[16]如上述[11]~[15]中任一项所述的药剂缓释片材,其中,生物相容性聚合物为生物降解性脂肪族聚酯或聚丙烯酰胺衍生物。
[17]如上述[16]所述的药剂缓释片材,其中,生物降解性脂肪族聚酯选自聚己内酯或其共聚物、聚乳酸或其共聚物、聚乙醇酸或其共聚物、以及它们的混合物。
[18]如上述[16]所述的药剂缓释片材,其中,聚丙烯酰胺衍生物选自聚(N-异丙基丙烯酰胺)或其共聚物、聚(2-羟基乙基甲基丙烯酰胺)或其共聚物、N-异丙基丙烯酰胺和2-羟基乙基甲基丙烯酰胺的共聚物、以及它们的混合物。
[19]如上述[1]~[18]中任一项所述的药剂缓释片材,其还含有透明质酸。
[20]一种药剂缓释片材的制造方法,其包括以下工序(1)和(2):
(1)制备包含药剂、生物相容性聚合物和溶剂的溶液的工序;和
(2)将该溶液提供给静电纺丝法进行纺丝,形成无纺布的工序。
[21]一种药剂缓释片材的制造方法,其包括以下工序(1)和(2):
(1)制备包含药剂、生物相容性聚合物、溶剂和透明质酸的溶液的工序;和
(2)将该溶液提供给静电纺丝法进行纺丝,形成无纺布的工序。
[22]一种药剂缓释片材的制造方法,其包括以下工序(1)、(2)和(3):
(1)制备包含药剂、生物相容性聚合物、溶剂和透明质酸的溶液的工序;
(2)将该溶液提供给静电纺丝法进行纺丝,形成无纺布的工序;和
(3)在无纺布涂敷透明质酸的工序。
[23]如上述[20]~[22]中任一项所述的药剂缓释片材的制造方法,其中,生物相容性聚合物为生物降解性脂肪族聚酯或聚丙烯酰胺衍生物。
[24]如上述[23]所述的制造方法,其中,生物降解性脂肪族聚酯选自聚己内酯或其共聚物、聚乳酸或其共聚物、聚乙醇酸或其共聚物、以及它们的混合物。
[25]如上述[23]所述的制造方法,其中,聚丙烯酰胺衍生物选自聚(N-异丙基丙烯酰胺)或其共聚物、聚(2-羟基乙基甲基丙烯酰胺)或其共聚物、N-异丙基丙烯酰胺和2-羟基乙基甲基丙烯酰胺的共聚物、以及它们的混合物。
[26]一种药剂缓释片材的制造方法,其包括以下工序(1)和(2):
(1)制备包含药剂、聚己内酯或其共聚物、选自TEF(2,2,2-三氟乙醇)、HFIP(1,1,1,3,3,3-六氟-2-丙醇)、氯仿和DMF(N,N-二甲基甲酰胺)中的溶剂的溶液的工序;和
(2)在电压10~30kV、流速0.1~1m/h、针尺寸18~24G的条件下将(1)中制备的溶液提供给静电纺丝法进行纺丝,在电极面形成无纺布的工序。
[27]如上述[26]所述的制造方法,其中,聚己内酯或其共聚物的重均分子量为1000~300000,每1分子的支链数为1~8,并且包含0~50摩尔%的DL-丙交酯。
[28]如上述[20]~[27]中任一项所述的制造方法,其中,药剂为维生素B12。
[29]如上述[20]~[27]中任一项所述的制造方法,其中,药剂为痘苗病毒接种兔炎症皮肤提取物或其分离物。
[30]如上述[20]~[27]中任一项所述的制造方法,其中,药剂为神经营养因子。
[31]如上述[30]所述的制造方法,其中,神经营养因子为NGF或BDNF。
[32]一种神经损伤的治疗方法,其包括:对需要治疗的患者应用包括由纳米纤维形成的无纺布的药剂缓释片材,该纳米纤维含有具有神经损伤治疗效果的药剂和生物相容性聚合物。
[33]如上述[32]所述的方法,其中,药剂为维生素B12。
[34]如上述[32]所述的治疗方法,其中,药剂为痘苗病毒接种兔炎症皮肤提取物或其分离物。
[35]如上述[32]所述的治疗方法,其中,药剂为神经营养因子。
[36]如上述[35]所述的治疗方法,其中,神经营养因子为NGF或BDNF。
[37]如上述[32]~[36]中任一项所述的治疗方法,其中,生物相容性聚合物为生物降解性脂肪族聚酯或聚丙烯酰胺衍生物。
[38]如上述[37]所述的治疗方法,其中,生物降解性脂肪族聚酯选自聚己内酯或其共聚物、聚乳酸或其共聚物、聚乙醇酸或其共聚物、以及它们的混合物。
[39]如上述[37]所述的治疗方法,其中,聚丙烯酰胺衍生物选自聚(N-异丙基丙烯酰胺)或其共聚物、聚(2-羟基乙基甲基丙烯酰胺)或其共聚物、N-异丙基丙烯酰胺和2-羟基乙基甲基丙烯酰胺的共聚物、以及它们的混合物。
[40]如上述[32]~[39]中任一项所述的治疗方法,其中,片材的杨氏模量为100kPa~100MPa。
[41]如上述[32]~[40]中任一项所述的治疗方法,其中,片材的重量为1mg/cm
[42]如上述[32]~[41]中任一项所述的治疗方法,其中,通过埋入神经损伤部位的周围部来进行应用。
[43]维生素B12在药剂缓释片材的制造中的使用,其中,该药剂缓释片材包括由含有具有神经损伤治疗效果的药剂和生物相容性聚合物的纳米纤维形成的无纺布。
[44]痘苗病毒接种兔炎症皮肤提取物或其分离物在药剂缓释片材的制造中的使用,其中,该药剂缓释片材包括由含有具有神经损伤治疗效果的药剂和生物相容性聚合物的纳米纤维形成的无纺布。
[45]神经营养因子在药剂缓释片材的制造中的使用,该药剂缓释片材包括由含有具有神经损伤治疗效果的药剂和生物相容性聚合物的纳米纤维形成的无纺布。
[46]如上述[45]所述的使用,其中,神经营养因子为NGF或BDNF。
[47]如上述[43]~[46]中任一项所述的使用,其中,生物相容性聚合物为生物降解性脂肪族聚酯或聚丙烯酰胺衍生物。
[48]如上述[47]所述的使用,其中,生物降解性脂肪族聚酯选自聚己内酯或其共聚物、聚乳酸或其共聚物、聚乙醇酸或其共聚物、以及它们的混合物。
[49]如上述[47]所述的使用,其中,聚丙烯酰胺衍生物选自聚(N-异丙基丙烯酰胺)或其共聚物、聚(2-羟基乙基甲基丙烯酰胺)或其共聚物、N-异丙基丙烯酰胺和2-羟基乙基甲基丙烯酰胺的共聚物、以及它们的混合物。
[50]如上述[43]~[49]中任一项所述的使用,其中,片材的杨氏模量为100kPa~100MPa。
[51]如上述[43]~[50]中任一项所述的使用,其中,片材的重量为1mg/cm
发明的效果
根据本发明,能够提供神经损伤治疗用药剂缓释片材及其制造方法等,该神经损伤治疗用药剂缓释片材通过埋入损伤部位的周围部来应用,并且将该部位的药剂浓度长期维持在适当高度,从而能够促进神经再生。
附图说明
图1是表示用扫描型电子显微镜(SEM)观察所制作的聚己内酯片材的结果的图。
图2是表示用SEM观察所制作的聚(N-异丙基丙烯酰胺)片材的结果的图。
图3是表示用SEM观察所制作的聚(NIPAAm-co-HMAAm)片材的结果的图。
图4是表示用SEM观察所制作的含有磁性纳米颗粒的聚己内酯片材的结果的图。
图5是表示用SEM观察所制作的涂敷透明质酸的聚己内酯片材的结果的图。
图6是用SEM观察所制作的含有本发明提取物的聚己内酯片材的结果的图。
图7是表示用SEM观察所制作的3种含有维生素B12的本发明片材的结果的图。
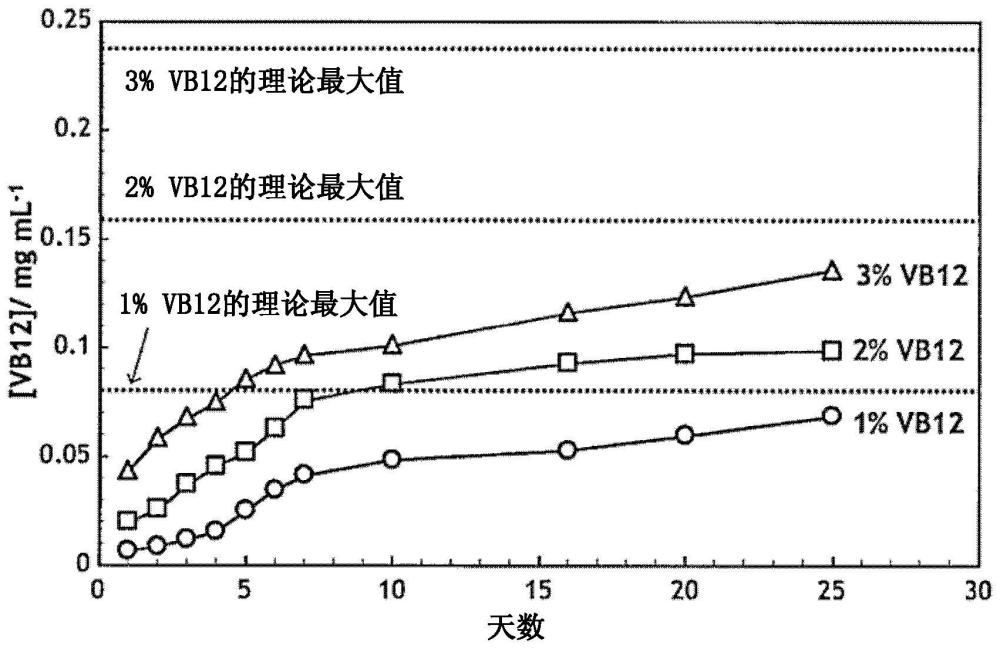
图8是表示确认所制作的3种含有维生素B12的本发明片材的缓释性的结果的图。
图9是表示在使用大鼠坐骨神经压迫损伤模型评价含有维生素B12的本发明片材的药效的实验中,在术后第6周测定维生素B12血中浓度的结果的图。
图10是表示在使用大鼠坐骨神经压迫损伤模型评价含有维生素B12的本发明片材的药效的实验中,在术后第6周测定坐骨神经功能指数(SFI,sciatic function index)来评价运动功能的结果的图。
图11是表示在使用大鼠坐骨神经压迫损伤模型评价含有维生素B12的本发明片材的药效的实验中,在术后第6周进行冯弗雷纤维丝试验(von Frey filament test)来评价感觉功能的结果的图。
图12是表示在使用大鼠坐骨神经压迫损伤模型评价含有本发明提取物的本发明片材的药效的实验中,在术后第3周进行冯弗雷纤维丝试验来评价感觉功能的结果的图。
图13是表示在使用大鼠坐骨神经压迫损伤模型评价含有维生素B12的本发明片材的药效的实验中,在术后第6周进行电生理学评价的结果的图,(A)表示复合肌肉动作电位(CMAP,Compound muscle action potential)的结果,(B)表示终末潜伏期(TL,Terminallatency)的结果,(C)表示神经传导速度(NCV,Nerve conduction velocity)的结果。
图14是表示在使用大鼠坐骨神经压迫损伤模型评价含有维生素B12的本发明片材的药效的实验中,在术后第6周收集坐骨神经,利用作为髓鞘的指标的抗髓鞘碱性蛋白(MBP,Myelin Basic Protein)抗体进行免疫染色的结果的图。
图15是表示在使用大鼠坐骨神经压迫损伤模型评价含有维生素B12的本发明片材的药效的实验中,在术后第6周进行组织学评价的结果的图,(A)为总轴索数的结果,(B)为MBP阳性轴索数/总轴索数的结果。
图16是表示在使用大鼠坐骨神经缺损模型评价含有维生素B12的本发明片材对利用神经再生诱导管(Nerve Regeneration Conduits;NRC)接合的神经的药效的实验中,在术后第12周进行冯弗雷纤维丝试验来评价感觉功能的结果的图。
图17是表示在使用大鼠坐骨神经缺损模型评价含有维生素B12的本发明片材对利用NRC接合的神经的药效的实验中,在术后第12周进行电生理学评价(TL)的结果的图。
图18是表示在使用大鼠坐骨神经缺损模型评价含有维生素B12的本发明片材对利用NRC接合的神经的药效的实验中,在术后第12周进行电生理学评价(NCV)的结果的图。
具体实施方式
本发明提供神经损伤治疗用药剂缓释片材。本发明的药剂缓释片材包括由含有维生素B12等药剂和生物降解性脂肪族聚酯等生物相容性聚合物的纳米纤维形成的无纺布,通过埋入神经损伤部位的周围部来利用。作为使本发明的药剂缓释片材含有的药剂,只要是具有神经损伤治疗效果的药剂即可,能够选自维生素B12、痘苗病毒接种组织提取物或其分离物、NGF、BDNF等的神经营养因子等,通过使这些药剂对神经损伤部位发挥作用从而促进神经的再生,能够有效地治疗神经损伤。此外,本发明的药剂缓释片材还包括:除上述药剂以外还含有透明质酸的药剂缓释片材。
本发明片材的适应对象疾病为神经损伤。本发明的药剂缓释片材具有神经再生促进作用,因此,从有连续性神经损伤和不连续性神经损伤均能够作为治疗对象的方面考虑非常有用。作为有连续性神经损伤,例如可以列举卡压性神经障碍(神经由于周围组织受到压迫的状态)。另外,对于神经缝合后的神经(在神经损伤后进行直接缝合的状态)、神经剥离术后的神经、神经移植术后的神经(对具有缺损的神经损伤部进行神经移植以其使具有连续性的状态)的再生促进,本发明的药剂缓释片材也是有效的。另外,对于不连续性神经损伤,通过将本发明药剂缓释片材单独或与人工神经并用等,也具有促进治疗的效果。
作为使本发明片材含有的药剂的维生素B12中,包括钴胺素及其衍生物。具体而言,可以列举甲钴胺、氰钴胺、羟钴胺素、亚硫酸钴胺(sulfitocobalamin)、腺苷钴胺或这些的盐,均能够适合用作本发明的缓释剂的有效成分。其中,优选甲钴胺、氰钴胺、羟钴胺素或这些的盐,更优选甲钴胺或其盐。维生素B12的含量以最终浓度计优选为约1%~约30%,更优选为约2%~约10%。
本发明片材包括由含有药剂和生物相容性聚合物的纳米纤维形成的无纺布。纳米纤维是指直径为约10nm~约1000nm且长度为直径的100倍以上的纤维状物质。作为本发明所使用的生物相容性聚合物,可以列举生物降解性脂肪族聚酯和聚丙烯酰胺衍生物等。作为优选的生物降解性脂肪族聚酯,例如可以列举聚己内酯、聚乳酸、聚乙醇酸、聚甘油酸、聚羟基烷酸、聚丁二酸丁二醇酯、这些的共聚物、这些的衍生物等。从柔软性等观点考虑,更优选列举选自聚己内酯或其共聚物、聚乳酸或其共聚物、聚乙醇酸或其共聚物、以及它们的混合物的生物降解性脂肪族聚酯。作为上述共聚物的例子,可以列举聚乳酸-聚己内酯共聚物、聚(ε-己内酯-co-DL-丙交酯)等。另外,作为聚丙烯酰胺衍生物,例如可以列举聚(N-异丙基丙烯酰胺)或其共聚物、聚(2-羟基乙基甲基丙烯酰胺)或其共聚物、或者它们的混合物等。作为上述共聚物的例子,可以列举聚(N-异丙基丙烯酰胺)、N-异丙基丙烯酰胺和2-羟基乙基甲基丙烯酰胺的共聚物等。
另外,作为上述纳米纤维,只要含有上述生物相容性聚合物的至少1种即可,也可以为上述生物相容性聚合物以外的生物相容性聚合物和这些上述生物相容性聚合物的共聚物。另外,也可以为含有多种上述生物相容性聚合物的共聚物。在这些情况下,共聚的形式可以为嵌段共聚、无规共聚、交替共聚或接枝共聚中的任意种。
关于构成本发明药剂缓释片材的片材,其杨氏模量优选为约100kMPa~约100MPa,更优选为约1MPa~约50MPa。能够由基于利用市售的拉伸试验器(例如,EZ-S500N(岛津制作所制)等)获得的测定值的应力-变形曲线来求得杨氏模量。片材的重量优选为1mg/cm
本发明片材通过埋入神经损伤部位的周围部来使用。本发明片材成型为具有柔软性的形态,因此能够适当选择使用方式。具体而言,例如对于周围剥离而神经露出的状态的神经损伤部位,优选卷绕本发明片材或以覆盖的方式留置。之后,使周围组织恢复原样并缝合皮肤。通过本发明片材成型为柔软的形态,即使留置于神经损伤部位,也不带来对神经或周围组织造成不良影响的刺激。所以,本发明片材能够埋入神经损伤部位的周围部使用。而且,在损伤部位的处置后也无需取出。此外,本发明片材优选进行灭菌处理后使用。灭菌方法优选选择不分解药剂、不损及片材的形状和物性的方法。例如可以列举放射线灭菌、等离子体灭菌等。
能够通过制备含有维生素B12等药剂和生物降解性脂肪族聚酯等生物相容性聚合物的溶液,将该溶液作为原料并利用静电纺丝法、自组装法、相分离法等公知纺丝方法制作纳米纤维,利用公知方法形成无纺布,由此制造本发明片材。含有维生素B12等药剂和生物降解性脂肪族聚酯等生物相容性聚合物的溶液(原料溶液)的制备中能够使用适当的溶剂。用于原料溶液的溶剂在纺丝工序被除去从而不会残留在无纺布中。作为用于原料溶液的溶剂,可以列举TEF、HFIP、氯仿、DMF等。优选列举TEF等。
生物降解性脂肪族聚酯中也可以含有用于赋予柔软性的单体成分,以使无纺布具有所要求的柔软性。作为这样的单体成分,例如可以列举DL-丙交酯、D-丙交酯、L-丙交酯、D-乳酸、L-乳酸等。用于赋予柔软性的单体成分的含量优选根据所使用的生物相容性聚合物的种类、用于赋予柔软性的单体成分的种类和所要求的柔软性水准,根据情况进行设定。另外,能够通过调整生物相容性聚合物的分子量或使聚合物分子具有支链结构,来提高无纺布的柔软性。优选根据所使用的生物相容性聚合物的种类来适当设定分子量和支链数。
在生物相容性聚合物中例如作为生物降解性脂肪族聚酯使用聚己内酯或其共聚物、利用静电纺丝法制造片材的情况下,优选利用包括以下工序(1)和(2)的制造方法。
(1)制备包含药剂、聚己内酯或其共聚物、以及选自TEF、HEIP、氯仿和DMF中的溶剂的溶液的工序;和
(2)在电压10~30kV、流速0.1~1mL/h、针尺寸18~24G的条件下将(1)中制备的溶液提供给静电纺丝法进行纺丝,在电极面形成无纺布的工序。
工序(1)中使用的聚己内酯或其共聚物优选为重均分子量1000~300000、每1分子的支链数1~8、DL-丙交酯含量0~50摩尔%。更优选为重均分子量10000~100000、每1分子的支链数2~7、DL-丙交酯含量20~45摩尔%的聚己内酯共聚物,更加优选为重均分子量30000~600000、每1分子的支链数3~6、DL-丙交酯含量30~45摩尔%的聚己内酯共聚物。所使用的溶剂优选为TEF。
工序(2)中,将工序(1)中制备的溶液(原料溶液)提供给静电纺丝法进行纺丝,在电极面形成无纺布。静电纺丝法的条件优选为电压10~30kV、流速0.1~1mL/h、针尺寸18~24G。更优选为电压10~15kV、流速0.3~0.7mL/h、针尺寸22~24G。
在生物相容性聚合物中作为聚丙烯酰胺衍生物例如使用聚(N-异丙基丙烯酰胺)或其共聚物、或者N-异丙基丙烯酰胺和2-羟基乙基甲基丙烯酰胺的共聚物、利用静电纺丝法制造片材的情况下,优选利用包括以下工序(1)和(2)的制造方法。
(1)制备包含药剂、聚(N-异丙基丙烯酰胺)或其共聚物或者N-异丙基丙烯酰胺和2-羟基乙基甲基丙烯酰胺的共聚物、以及选自TEF、HEIP、氯仿和DMF中的溶剂的溶液的工序;和
(2)在电压10~30kV、流速0.1~1mL/h、针尺寸18~24G的条件下将(1)中制备的溶液提供给静电纺丝法进行纺丝,在电极面形成无纺布的工序。
工序(2)中,将工序(1)中制备的溶液(原料溶液)提供给静电纺丝法进行纺丝,在电极面形成无纺布。静电纺丝法的条件优选为电压10~30kV、流速0.1~1mL/h、针尺寸18~24G。更优选的电压和流速为电压10~20kV、流速0.3~1mL/h。
本发明片材还包括:除维生素B12等药剂以外还含有透明质酸的片材。透明质酸既可以在工序(1)中向溶液添加,也可以将工序(2)中形成的无纺布浸渍于透明质酸来进行涂敷。
通过如上所述的制造方法,能够制造包括由包含药剂和生物相容性聚合物的纳米纤维形成的无纺布的本发明片材,本发明片材的杨氏模量为100kPa~100MPa,重量为1mg/cm
能够在本发明片材中含有的维生素B12、神经营养因子之类的药剂既可以通过适当的公知方法制造,也可以购买市售药剂。另外,透明质酸也同样,既可以通过适当的公知方法制造,也可以购买市售的透明质酸。
能够在本发明片材中含有的本发明提取物是含有从接种痘苗病毒并使其发痘的动物的炎症组织提取和分离的非蛋白性的活性物质的提取物。
本发明提取物能够通过如下操作得到:接种痘苗病毒,将发痘的炎症组织破碎,添加提取溶剂,除去组织片后,进行除蛋白处理,使其吸附于吸附剂,然后将有效成分洗脱。即,例如为如下的工序。
(A)收集接种痘苗病毒并使其发痘的兔、小鼠等的皮肤组织等,将发痘组织破碎,加入水、苯酚水、生理盐水或苯酚加甘油水等提取溶剂后,通过过滤或离心分离,得到提取液(滤液或上清液)。
(B)将上述提取液调整为酸性的pH并加热,进行除蛋白处理。接着,将除蛋白后的溶液调整为碱性并加热后,进行过滤或离心分离。
(C)使所得到的滤液或上清液成为酸性,使其吸附于活性炭、高岭土等吸附剂。
(D)在上述吸附剂中加入水等提取溶剂,调整为碱性的pH,将吸附成分洗脱,由此得到痘苗病毒接种炎症组织提取物。然后,也能够根据希望,通过适当将洗脱液在减压下蒸发干燥固化或冻结干燥,得到干燥固化物。
作为用于接种痘苗病毒得到炎症组织的动物,能够使用兔、牛、马、绵羊、山羊、猴、大鼠、小鼠等感染痘苗病毒的各种动物,作为炎症组织,优选兔的炎症皮肤组织。兔只要是属于兔目即可,可以使用任何兔子。作为例子,有:穴兔(Oryctolagus cuniculus)、家兔(驯养的穴兔)、野兔(日本野兔)、鼠兔和雪兔等。其中,适合使用家兔。在日本,有从过去被饲养的作为家畜或实验用动物而频繁使用的称为家养兔(イエウサギ)的兔,这也是家兔的别称。在家兔中存在多个品种(breed),能够优选使用称为日本白色种和新西兰白色种(新西兰白)的品种。
痘苗病毒(vaccinia virus)可以是任意株的痘苗病毒。作为例子,可以列举李斯特(Lister)株、大连(Dairen)株、池田(Ikeda)株、EM-63株、纽约市公众卫生局(New YorkCity Board of Health)株等。
本发明提取物在制造时为液体,因此也能够通过适当浓缩、稀释制成所要求的浓度的提取物,进行冻结干燥。另外,还能够通过对本发明提取物进行分离来得到神经损伤的治疗效果更高的分离物并将其用于本发明片材。
此外,本发明提取物的更具体的制造方法记载于例如国际公开WO2016/194816号公报的段落号[0024]~[0027]、[0031]等中。
通过本发明,能够提供用于治疗不属于现有人工神经的应用对象的有连续性神经损伤的药剂缓释片材。有连续性神经损伤在末梢神经损伤中患者数最多,因此可认为本发明的贡献度非常高。另外,针对不连续性神经损伤,也能够将本发明片材单独使用或者与人工神经并用。本发明片材通过埋入神经损伤部位的周围部来使用。因此,不需要通过连续投予高用量的药剂来使血中的药剂浓度上升,而能够通过在局部将药剂持续地放出来促进神经再生。此外,本发明片材使用生物相容性聚合物成型,因此在神经损伤的处置后也无需取出。并且,能够成型为非常柔软的形态,因此即使埋入神经损伤部位的周围部也不会带来对神经造成不良影响的刺激,非常容易使用。另外,使用人工神经时需要手术用显微镜,本发明片材单独使用时还具有不需要手术用显微镜、操作非常简便的利点。即,本发明片材由于兼备有效性和安全性并且便利性高,非常有用。
实施例
下面,通过实施例详细说明本发明,但本发明不限于此。
〔实施例1:含有维生素B12的片材等的制作〕
(1)聚己内酯片材等的制作
向聚己内酯900mg加入4.5mL的HEIP,进行超声波处理3小时,由此制备分散溶液(聚合物溶液浓度为20wt%)。
接着,边利用5mL注射器以1.0mL/h的速度将该分散溶液全部送出,边施加20kV的电压。在铺有铝箔的金属基盘上使纺丝的纤维叠层而捕集,制作聚己内酯片材(所使用的注射器针:22G,注射器-金属基盘距离:13cm)。
如图1的扫描型电子显微镜(SEM)观察图像所示,制造了包括由纳米纤维形成的无纺布的聚己内酯片材。
同样,关于使用聚(N-异丙基丙烯酰胺)、N-异丙基丙烯酰胺和2-羟基乙基甲基丙烯酰胺的共聚物(以下,“聚(NIPAAm-co-HMAAm)”)的纤维片材,也同样制作(参照图2和图3)。
(2)含有磁性纳米颗粒的聚己内酯片材的制作
向聚己内酯900mg和包含γ―Fe
接着,边利用5mL注射器以1.0mL/h的速度将该分散溶液全部送出,边施加20kV的电压。在铺有铝箔的金属基盘上使纺丝的纤维叠层而捕集,制作含有磁性纳米颗粒的聚(NIPAAm-co-HMAAm)片材(所使用的注射器针:22G,磁性纳米颗粒相对于片材的含量为30%)。如图4的扫描型电子显微镜(SEM)观察图像所示,制造了包括由纳米纤维形成的无纺布的含有磁性纳米颗粒的聚己内酯片材。
(3)涂敷透明质酸的聚己内酯片材的制作
将透明质酸128mg溶解于纯水2.5mL中,制备5wt%的透明质酸溶液。将实施例1(1)中制作的聚己内酯片浸渍于透明质酸溶液,静置24小时。进行冻结干燥72小时,制作涂敷透明质酸的聚己内酯片材。在图5中表示由所制作的涂敷透明质酸的聚己内酯片材的扫描型电子显微镜(SEM)观察图像。
(4)含有维生素B12的片材的制作
在6mL的TEF中溶解600mg的聚(ε-己内酯-co-DL-丙交酯)和甲钴胺(Sigma公司制)。作为聚(ε-己内酯-co-DL-丙交酯)自制重均分子量为40000、支链数为4/分子、ε-己内酯与DL-丙交酯的摩尔比为60︰40的物质来使用。甲钴胺分别溶解6.5mg、13mg或20mg使其以最终浓度计为1%、2%或3%,制备3种溶液。接着利用静电纺丝法制造纳米纤维,将其形成为网眼状,制作无纺布。具体而言,从24G的针以0.5mL/h的流速挤出溶液,施加12kV的电压进行纺丝,在电极面使纳米纤维堆积从而捕捉,由此制作无纺布。
如图7的扫描型电子显微镜(SEM)观察图像所示,制造了包括由纳米纤维形成的无纺布的含有维生素B12的片材。该片材的厚度为约300μm,重量为约10mg/cm
同样操作,作为药剂,对NGF和BDNF,也制作了分别含有NGF和BDNF的片材。
(5)含有本发明提取物的片材的制作
向聚己内酯900mg和本发明提取物冻结干燥粉末270mg中加入4.5mL的HEIP,进行超声波处理3小时,由此制备分散溶液(聚合物溶液浓度20wt%)。
接着,边利用5mL注射器以0.5mL/h的速度将该分散溶液全部送出,边施加20kV的电压。在铺有铝箔的金属基盘上使纺丝的纤维叠层而捕集,制作含有本发明提取物的片材(所使用的注射器针:18G,本发明提取物相对于片材的载持量为30%)。在图6中表示所制作的含有本发明提取物的聚己内酯片材的扫描型电子显微镜(SEM)观察图像。
〔实施例2:含有维生素B12的片材等的缓释性的确认〕
向管中加入3mL的PBS,在其中浸渍10mg的片材并在37℃保温,经时性地采样并测定维生素B12浓度。每1次的样品量设为100μL,维生素B12浓度通过紫外可视吸光度测定法测定。
将结果示于图8。3种片材均显示直至第25日的缓释性。考虑理论最大值时,可以认为所含甲钴胺量越多,缓释期间越长。此外,虽然图中未示出,但是确认到3种片材在其后也经过长达8周(至第56日)显示缓释性。
同样操作,对于含有本发明提取物、NGF或BDNF的片材也分别确认了药剂的缓释性。
〔实施例3:使用大鼠坐骨神经压迫损伤模型的药效评价〕
1.制作大鼠坐骨神经压迫损伤模型
全部动物实验得到了大阪大学动物实验设施的伦理委员会的承认而进行。使用6周龄的雄性Wistar系大鼠(体重约200g)。全部手术用咪达唑仑(midazolam,2mg/kg)、布托啡诺(butorphanol,2.5mg/kg)、美托咪定(medetomidine,0.15mg/kg)的混合麻醉药实施深镇静后进行。在清洁操作下将左坐骨神经展开,在距离坐骨切痕5mm远的位置用镊子施加压迫损伤。压迫时间设为10秒,压迫次数设为3次,压迫操作的间隔设为10秒。用4-0尼龙缝合筋膜和皮肤。实验大鼠分类为以下5组。即,设为:对坐骨神经不施加压迫损伤仅进行展开的假对照(sham)组、对坐骨神经不施加压迫损伤仅进行展开并移植不含甲钴胺的片材的CTR片材(CTR sheet)组、施加压迫损伤而不进行治疗的未治疗(untreated)组、施加压迫损伤并移植含有甲钴胺的片材(实施例1中制作的含有3%甲钴胺的片材)的MeCbl片材(MeCblsheet)组、施加压迫损伤并将甲钴胺全身给药(1mg/kg/day)的MeCbl泵(MeCbl pump)组。甲钴胺的全身给药通过将微型渗透泵(osmotic minipump)(Model 2ML2;Alzet,Cuperitino,CA,USA)留置于背部皮下来进行。全部手术由同一手术人员进行。
对于作为药剂含有本发明提取物的片材,也同样进行研究。实验大鼠分类为以下4组。即,设为:对坐骨神经不施加压迫损伤仅进行展开的假对照组、对坐骨神经不施加压迫损伤仅进行展开并移植不含本发明提取物的片材的CTR片材组、施加压迫损伤而不进行治疗的未治疗组、施加压迫损伤并移植含有本发明提取物的片材(实施例1中制作的含有本发明提取物的片材)的NTP片材(NTP sheet)组。
对于作为药剂含有NGF或BDNF的片材,也同样向对坐骨神经施加了压迫损伤的模型大鼠进行了移植。
2.评价项目和实验方法
(1)维生素B12血中浓度
在术后6周时,在麻醉镇静下从大鼠左心室收集1mL的血液。将所收集的血液以800×g离心分离20分,回收上清液。血中维生素B12浓度测定委托BML公司(东京)。
(2)运动功能和感觉功能评价
为了评价运动功能,在术后6周的时间点测定坐骨神经功能指数(SFI,sciaticfunction index)。为了测定SFI,在大鼠的后足粘上油墨,使大鼠在放置于40cm见方的水平台上的办公用纸(office paper)上行走,记录足印(foot print)。计测以下项目,计算SFI。SFI=0表示正常,SFI=-100表示功能下降。另外,在术后过程出现足趾坏死、缺损的个体除外。SFI由以下数学式计算。各项目如下所示。
SFI=-38*((EPL-NPL)/NPL+109.5*((ETS-NTS)/NTS)+13.3*((EITS-NITS)-8
EPL:experimental print length(实验足印长度)
NPL:normal print length(正常足印长度)
ETS:experimental toe spread(实验足趾宽度)
NTS:normal toe spread(正常足趾宽度)
EIT:experimental intermediary toe spread(实验中间足趾宽度)
NIT:normal intermediary toe spread(正常中间足趾宽度)
为了评价感觉功能,在术后6周的时间点利用冯弗雷纤维丝(0.008g-26g;TouchTest,North Coast Medical Inc,Gilroy,CA,USA)测定机械刺激后爪退缩阈值(mechanical hind paw withdrawal threshold)。使在金属网上行走,对足底部中央施加压力直至纤维丝开始弯曲为止,记录出现逃避行动的值。
(3)电生理学评价
对术后经过3周或6周的大鼠用麻醉药实施镇静,在手术台使其为腹卧位。展开左坐骨神经和左胫骨前肌。用双极电极刺激坐骨神经近位,测定复合肌肉动作电位(CMAP,Compound muscle action potential)和终末潜伏期(TL,Terminal latency)。用双极电极分别刺激坐骨神经压迫损伤部的近位侧和远位侧,从各测定值计算神经传导速度(NCV,Nerve conduction velocity)。测定和评价中使用了AD Instruments Power Lab 2/26、Stimulus isolater、Bio Amp和Chart&Scope software(均为AD Instruments,Bel laVista,NSW,Australis)。
(4)组织学评价
对术后经过6周的大鼠用麻醉药实施镇静,收集左坐骨神经,用4%PFA固定5日并用20%蔗糖固定24小时后,进行冻结包埋。将包埋的组织在神经短轴方向上以5μm厚度切片后放置于载玻片。干燥1小时后,用95%甲醇固定30分。封闭后使1次抗体在4℃反应一夜。使二次抗体在室温反应1小时,用DAPI对核进行标记。一次抗体使用作为轴索的指标的anti-neurofilament 200(NF200)antibody produced in rabbit(1:1000;102M4784,SIGMA)和作为髓鞘的指标的Anti-Myelin Basic Protein(MBP)Mouse mAb(1︰1000;NE1018,CALIOCHEM)。二次抗体使用Alexa 488_labeled goat anti-rabbit IgG antibody(1︰1000;Lifetechnologies)和Alexa 568_labeled goat anti-mouse IgG antibody(1︰1000;Lif etechnologies)。评价总轴索数、MBP阳性轴索数/总轴索数。
〔实施例4:使用大鼠坐骨神经缺损模型的药效评价〕
1.制作大鼠坐骨神经缺损模型
使用6周龄的雄性Wistar系大鼠(体重约200g)。全部手术在用咪达唑仑(2mg/kg)、布托啡诺(2.5mg/kg)、美托咪定(0.15mg/kg)的混合麻醉药实施深镇静后进行。在清洁操作下将左坐骨神经张开,在距离坐骨切痕5mm远的位置和从该位置进一步远10mm的位置切断坐骨神经,制作10mm的缺损模型。
实验大鼠分类为以下4组。(i)神经再生诱导管+MeCbl片材组;以将坐骨神经断端分别引入直径1.5mm×长度12mm的神经再生诱导管的两端各1mm的方式用10-0尼龙进行缝合,在其周围将宽度10mm×长度14mm的含有甲钴胺的片材以覆盖的方式留置。(ii)神经再生诱导管组;以将坐骨神经断端分别引入神经再生诱导管的两端各1mm的方式用10-0尼龙进行缝合。(iii)自体移植片组;将切断的坐骨神经反转并用10-0尼龙进行缝合。(iv)假对照组;仅进行坐骨神经的展开。将筋膜和皮肤用4-0尼龙进行缝合。全部手术由同一手术人员进行。
对于作为药剂含有本发明提取物、NGF或BDNF的片材,也同样向坐骨神经缺损模型大鼠进行了移植。
2.评价项目和实验方法
(1)感觉功能评价
为了评价感觉功能,在术后12周的时间点与实施例3-2(2)同样测定机械刺激后爪退缩阈值(mechanical hind paw withdrawal threshold)。
(2)电生理学评价
在术后12周的时间点与实施例3-2(3)同样计算TL和NCV。
(3)组织学评价
对术后经过12周的大鼠用麻醉药实施镇静,收集左坐骨神经,用4%PFA固定7日并用20%蔗糖固定24小时后,进行冻结包埋。与实施例3-2(4)同样评价总轴索数、MBP阳性轴索数/总轴索数。
(4)统计处理
全部数值以mean±SEM标记。在实施例3-2(1)至(4)、实施例4中,统计处理使用JMP software version 11(SAS Institute公司)通过Tukey-Kramer HSD检验进行。
在试验例3-2(5)中,统计解析使用SAS System Version 9.1.3(SAS Institute公司),2组间比较通过F检验进行,在等方差的情况下通过Student的t检验进行,在不等方差的情况下通过Welch检验进行。
3.结果
A.使用大鼠坐骨神经压迫损伤模型的药效评价
(1)维生素B12等的血中浓度
将结果示于图9。MeCbl泵组(18.35±2.27ng/mL)中确认了血中浓度的显著上升,但在MeCbl片材组(1.73±0.05ng/mL)中未确认到血中浓度的上升。在药剂非给药组(假对照组:1.99±0.33ng/mL、CTR片材组:1.48±0.05ng/mL和未治疗组:1.50±0.07ng/mL)中均未确认到血中浓度上升。
作为药剂使用本发明提取物、NGF或BDNF的情况下也同样,未确认到血中浓度的上升。
(2)运动功能和感觉功能评价
将SFI的结果示于图10。与未治疗组(-20.6±4.2)相比,MeCbl片材组(-9.0±2.0)确认到显著的改善,MeCbl泵组(-10.5±2.0)中确认到了恢复倾向。
将冯弗雷纤维丝试验的结果示于图11。与未治疗组(117.8±11.7g)相比,MeCbl片材组(80±7.6g)与MeCbl泵组(77.8±7.0g)同样确认到显著的改善。
将作为药剂含有本发明提取物的片材的冯弗雷纤维丝试验的结果示于图12。与未治疗组(2.75±0.41)相比,NTP片材组(1.35±0.13)确认到显著的改善。
作为药剂含有NGF或BDNF的片材的移植中,也在运动功能和感觉功能上确认到了改善。
(3)电生理学评价
将结果示于图13。(A)为CMAP的结果,(B)为TL的结果,(C)为NCV的结果。在CMAP和TL中,与未治疗组(CMAP:19.5±2.3mV、TL:3.45±0.08ms)相比,MeCbl片材组(CMAP:18.5±1.5mV、TL:3.27±0.09ms)、MeCbl泵组(CMAP:19.5±1.5mV、TL:3.24±0.07ms)均未确认到显著的改善。另一方面,在NCV中,与未治疗组(28.2±2.5m/s)相比,MeCbl片材组(44.4±2.8m/s)与MeCbl泵组(43.2±2.5m/s)组同样确认到了显著的改善。
作为药剂含有本发明提取物、NGF或BDNF的片材的移植中也同样确认到了改善。
(4)组织学评价
将结果示于图14和图15。图7为利用抗MBP抗体将髓鞘进行免疫染色的显微镜图像,图中看起来带白色的部分为染色的髓鞘。图15(A)为总轴索数的结果、图15(B)为MBP阳性轴索数/总轴索数的结果。
关于每1平方毫米的再生轴索的条数,在未治疗组(2843±68本/mm
作为药剂含有本发明提取物、NGF或BDNF的片材的移植中也与同样确认到了改善。
B.使用大鼠坐骨神经缺损模型的药效评价
(1)感觉功能评价
将结果示于图16。在冯弗雷纤维丝试验中,与神经再生诱导管组(172.0±36.7g)相比,神经再生诱导管+MeCbl片材组(84.0±9.80g)确认到了显著的改善。
作为药剂含有本发明提取物、NGF或BDNF的片材中也同样确认到了改善。
(2)电生理学评价
将TL的结果示于图17,将NCV的结果示于图18。在TL中,与神经再生诱导管组(4.67±0.37m/s)相比,神经再生诱导管+MeCbl片材组(3.43±0.12m/s)确认到了改善。在NCV中,与神经再生诱导管组(16.3±3.13m/s)相比,神经再生诱导管+MeCbl片材组(29.5±4.50m/s)确认到改善倾向。
作为药剂含有本发明提取物、NGF或BDNF的片材中也同样确认到了改善。
(3)组织学评价
在每1平方毫米的再生轴索的条数和髓鞘化率(MBP阳性轴索数/总轴索数)中,与神经再生诱导管组相比,神经再生诱导管+MeCbl片材组确认到了改善。
作为药剂含有本发明提取物、NGF或BDNF的片材中也同样确认到了改善。
通过将含药剂的片材移植到神经损伤部局部,可以确认到不使血中药剂浓度上升地神经损伤后的恢复促进。即,确认到神经损伤后的运动功能、感觉功能、电生理学的功能恢复,在步行解析中也确认到了改善。另外,在组织学上也有确认到髓轴索数的增加。综上,本发明对于末梢神经损伤后的功能恢复非常有益。
此外,本发明不限于上述各实施方式和实施例,能够在权利要求所示的范围中进行各式各样的变更,适当组合分别公开于不同实施方式的技术方案而得到的实施方式也包括在本发明的技术范围中。另外,本说明书中记载的全部学术文献和专利文献在本说明书中作为参考引用。
- 神经损伤治疗用药剂缓释片材
- 一种周围神经损伤再生康复治疗电极及治疗仪
