TREM2的激动剂
文献发布时间:2024-04-18 20:01:30
相关申请的交叉引用
本申请要求于2021年5月14日提交的美国临时申请号63/188,800的优先权,该美国临时申请的公开内容通过援引以其全文并入本文。
序列表
本申请含有题为“01164-0014-00PCT_ST25”的计算机可读形式的序列表,该序列表创建于2022年5月9日,大小为115KB,其通过援引并入本文。
技术领域
本申请尤其公开了特异性地结合至TREM2的某些抗体。在一些实施方案中,该抗体充当TREM2激动剂。
背景技术
TREM2(表达在骨髓细胞上的触发受体2)是一种活化性免疫细胞受体,于脑内在小胶质细胞中表达((Hickman等人,Nat.Neurosci.16(12):1896-1905(2013);Zhang等人,Neuron 89:37-53(2016);Deczkowska等人,Cell 181:1207-1217(2020);Hansen等人,J.Cell Biology 217(2):459-472(2018);Yeh等人,Trends Mol.Med.23:512-533(2017))。某些TREM2突变已被鉴定为阿尔茨海默病(AD)的风险因素(Guerreiro等人,N.Engl.J.Med.368:117-27(2013);Jonsson等人,N.Engl.J.Med.368:107-116(2013)。还在小鼠模型中进行了研究,以了解TREM2如何影响AD病理,诸如β-淀粉样蛋白(Aβ)斑块和tau蛋白的磷酸化聚集体的发展。一个新出现的共识是,当TREM2功能受损时,Aβ斑块的压实形态较少,并且对周围神经突的损害更大(Meilandt等人,J Neurosci.40:1872-19(2020);Wang et al.,J.Exp.Medicine 213:667-675(2016);Yuan et al.,Neuron 90:724-739(2016))。
尽管其他研究表明某些磷脂是TREM2的相关配体,但已发现Aβ聚集体直接与重组TREM2胞外结构域结合。当APOE或APOJ被脂质化时,TREM2也会与它们结合,并促进含有APOE/APOJ的脂质颗粒的摄取。(Yeh等人,Neuron 91:328-340(2016))。此外,当Aβ寡聚体结合至APOE/APOJ脂质颗粒时,小胶质细胞对Aβ的摄取和降解会加速,这一过程部分地由TREM2介导。连接后,TREM2引发DAP12/Fyn/Syk信号传导级联,影响许多小胶质细胞过程,包括吞噬作用、胞吞作用、趋化作用、CSF-1介导的存活、聚集体降解和代谢变化。因此,TREM2似乎是响应于淀粉样蛋白和脂质的小胶质细胞活性的核心。
发明内容
本公开涉及特异性地结合至TREM2并充当TREM2激动剂的抗体,并且这些抗体可能具有一组特别独特的特征,可用于治疗神经退行性疾病诸如阿尔茨海默病(AD)和多发性硬化症(MS)。
TREM2蛋白是一种细胞跨膜蛋白,其在被称为茎区的细胞外区域中被切割,从而产生可溶性肽,称为“可溶性TREM2”或“sTREM2”。TREM2在体内的切割被认为发生在残基H157与S158之间,从而产生sTREM2。本公开描述了具有特异性地结合至不溶性完整TREM2中的茎区而不与切割产物sTREM2结合的独特特性的抗体。例如,本文的某些抗体不仅充当TREM2激动剂,而且还以范围从10nM至低至100-500pM、10-50pM或1-10pM的解离常数特异性地结合至TREM2的茎结构域,并且特异性地结合至跨越H157至S158切割位点的TREM2表位。这些抗体特异性地结合至TREM2茎区,而不与可溶性TREM2结合。
这些抗体对未经切割的TREM2的特异性可能在体内有几种潜在益处,包括在体内给药和/或阻断切割位点后避免抗体与外周和大脑中的可溶性TREM2的不希望的结合,并降低从细胞表面脱落的sTREM2的量。可溶性TREM2结合的缺乏在体内可能是有益的,例如,通过允许更多经给药的抗TREM2抗体到达细胞表面上未经切割的TREM2的所需靶标。作为示例而非限制,这种独特的结合谱可以防止抗体在体内不希望地结合至可溶性TREM2,并确保抗体更特异性地靶向中枢神经系统内细胞表面上的TREM2而不是外周中的sTREM2。
因此,本公开涵盖某些抗体,其(a)特异性地结合至TREM2茎结构域,并且更特异性结合至跨越H157至S158切割位点的TREM2表位,并且(b)不与可溶性TREM2结合,并因此可能不存在体内可溶性TREM2结合的风险。在一些实施方案中,本公开的抗体还(c)充当TREM2激动剂,例如,通过在经培养的细胞中诱导NFAT控制的基因表达和/或Syk激酶磷酸化,并且(d)对TREM2表现出非常高的亲和力,例如,以例如100-500pM、10-50pM或1-10pM的解离常数特异性地结合至TREM2。在一些实施方案中,本文的抗体还在小鼠模型中在体内以及在人小胶质细胞模型中抑制可溶性TREM2的脱落,降低血浆、CSF和/或脑中可溶性TREM2的水平,增强人小胶质细胞的存活,并且增加人小胶质细胞模型中的Aβ斑块形成和压实(例如,如通过人小胶质细胞中增加的Aβ斑块强度和/或增加的X04斑块强度所测量),并且因此可以提供若干神经保护活性。
本公开尤其涵盖一种分离的抗体,其特异性地结合至表达在骨髓细胞上的触发受体-2(TREM2),其中该抗体包含重链可变区(VH),该重链可变区包含:包含SEQ ID NO:1、9、11、19或62的氨基酸序列的CDR-H1;包含SEQ ID NO:2、10、12、20、55、63、65或73的氨基酸序列的CDR-H2:以及包含如下氨基酸序列的CDR-H3:X
本公开还涵盖,例如,一种分离的抗体,其特异性地结合至表达在骨髓细胞上的触发受体-2(TREM2),其中该抗体包含重链可变区(VH),该重链可变区包含:包含SEQ ID NO:1、9、11、19或62的氨基酸序列的CDR-H1;包含SEQ ID NO:2、10、12、20、55、63、65或73的氨基酸序列的CDR-H2:以及包含如下氨基酸序列的CDR-H3:X
在本文的一些实施方案中,抗体具有以下特性中的一种或多种、两种或更多种、三种或更多种、四种或更多种、五种或更多种、六种或更多种、或全部:
(a)与TREM2的茎结构域特异性结合;
(b)不与可溶性TREM2(sTREM2)结合;
(c)以较高的亲和力与由氨基酸146至161(SEQ ID NO:96)或151至165(SEQ IDNO:97)组成的TREM2多肽特异性结合,其是与由氨基酸139至158(SEQ ID NO:92)和/或159至175(SEQ ID NO:94)组成的TREM2多肽相比;
(d)与跨越H157至S158切割位点的TREM2表位特异性结合;
(e)与野生型TREM2茎结构域多肽相比,对包含D152A、H157A和I159A取代的TREM2茎结构域多肽显示出降低的结合亲和力(例如,如通过双层干涉法所测量);
(f)以通过表面等离子体共振(SPR)的在37℃小于1nM、小于0.7nM、小于0.6nM、小于0.5nM、小于0.4nM、小于0.3nM的KD与人和食蟹猴TREM2特异性结合;以及
(g)以通过表面等离子体共振(SPR)的在37℃小于100pM、小于50pM、小于10pM、小于7pM、小于5pM、小于4pM、小于3pM或小于2pM的K
此外,在一些实施方案中,该抗体具有源自大鼠IGHV6-8种系区段的VH序列和/或其中该抗体具有源自大鼠IGKV2S11种系区段的VL序列。在一些实施方案中,轻链可变区(VL)包含:包含SEQ ID NO:4、27或67的氨基酸序列的CDR-L1;包含SEQ ID NO:5的氨基酸序列的CDR-L2;以及包含SEQ ID NO:6、29或69的氨基酸序列的CDR-L3。在一些实施方案中,轻链可变区(VL)包含:包含SEQ ID NO:4的氨基酸序列的CDR-L1;包含SEQ ID NO:5的氨基酸序列的CDR-L2;以及包含SEQ ID NO:6的氨基酸序列的CDR-L3。在一些实施方案中,该重链可变区(VH)包含:包含SEQ ID NO:1或9的氨基酸序列的CDR-H1;包含SEQ ID NO:2或10的氨基酸序列的CDR-H2;以及包含SEQ ID NO:3的氨基酸序列的CDR-H3;并且其中该轻链可变区(VL)包含:包含SEQ ID NO:4的氨基酸序列的CDR-L1;包含SEQ ID NO:5的氨基酸序列的CDR-L2,以及包含SEQ ID NO:6的氨基酸序列的CDR-L3;或该重链可变区(VH)包含:包含SEQID NO:11或19的氨基酸序列的CDR-H1;包含SEQ ID NO:12或20的氨基酸序列的CDR-H2;以及包含SEQ ID NO:13的氨基酸序列的CDR-H3;并且其中该轻链可变区(VL)包含:包含SEQID NO:4的氨基酸序列的CDR-L1;包含SEQ ID NO:5的氨基酸序列的CDR-L2,以及包含SEQID NO:6的氨基酸序列的CDR-L3。在一些实施方案中,该抗体包含与SEQ ID NO:7、17、30、40、50、60、70、76、77、78、81、82、83、133、135、137、139、146、148、150或152的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VH。在一些实施方案中,该抗体包含与SEQID NO:7、17、133、135、137、139、146、148、150或152的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VH。在一些实施方案中,该抗体包含与SEQ ID NO:8、18、31、41、51、61、71、79、80、84、85、132、134、136、138、145、147、149或151的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VL。在一些实施方案中,该抗体包含与SEQ ID NO:8、18、132、134、136、138、145、147、149或151的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VL。在一些实施方案中,该抗体包含VH,该VH包含SEQ ID NO:7、17、133、135、137、139、146、148、150或152的氨基酸序列。在一些实施方案中,该抗体包含VL,该VL包含SEQ ID NO:8、18、132、134、136、138、145、147、149或151的氨基酸序列。
本公开尤其还涵盖一种分离的抗体,其特异性地结合至表达在骨髓细胞上的触发受体-2(TREM2),其中该抗体包含:
(a)重链可变区(VH),该重链可变区包含:包含SEQ ID NO:1的氨基酸序列的CDR-H1,包含SEQ ID NO:2的氨基酸序列的CDR-H2,以及包含SEQ ID NO:3的氨基酸序列的CDR-H3;以及轻链可变区(VL),该轻链可变区包含:包含SEQ ID NO:4的氨基酸序列的CDR-L1,包含SEQ ID NO:5的氨基酸序列的CDR-L2,以及包含SEQ ID NO:6的氨基酸序列的CDR-L3;
(b)重链可变区(VH),该重链可变区包含:包含SEQ ID NO:9的氨基酸序列的CDR-H1,包含SEQ ID NO:10的氨基酸序列的CDR-H2,以及包含SEQ ID NO:3的氨基酸序列的CDR-H3;以及轻链可变区(VL),该轻链可变区包含:包含SEQ ID NO:4的氨基酸序列的CDR-L1,包含SEQ ID NO:5的氨基酸序列的CDR-L2,以及包含SEQ ID NO:6的氨基酸序列的CDR-L3;
(c)重链可变区(VH),该重链可变区包含:包含SEQ ID NO:11的氨基酸序列的CDR-H1,包含SEQ ID NO:12的氨基酸序列的CDR-H2,以及包含SEQ ID NO:13的氨基酸序列的CDR-H3;以及轻链可变区(VL),该轻链可变区包含:包含SEQ ID NO:14的氨基酸序列的CDR-L1,包含SEQ ID NO:15的氨基酸序列的CDR-L2,以及包含SEQ ID NO:16的氨基酸序列的CDR-L3;
(d)重链可变区(VH),该重链可变区包含:包含SEQ ID NO:19的氨基酸序列的CDR-H1,包含SEQ ID NO:20的氨基酸序列的CDR-H2,以及包含SEQ ID NO:13的氨基酸序列的CDR-H3;以及轻链可变区(VL),该轻链可变区包含:包含SEQ ID NO:14的氨基酸序列的CDR-L1,包含SEQ ID NO:15的氨基酸序列的CDR-L2,以及包含SEQ ID NO:16的氨基酸序列的CDR-L3;
(e)重链可变区(VH),该重链可变区包含:包含SEQ ID NO:24的氨基酸序列的CDR-H1,包含SEQ ID NO:25的氨基酸序列的CDR-H2,以及包含SEQ ID NO:26的氨基酸序列的CDR-H3;以及轻链可变区(VL),该轻链可变区包含:包含SEQ ID NO:27的氨基酸序列的CDR-L1,包含SEQ ID NO:28的氨基酸序列的CDR-L2,以及包含SEQ ID NO:29的氨基酸序列的CDR-L3;
(f)重链可变区(VH),该重链可变区包含:包含SEQ ID NO:34的氨基酸序列的CDR-H1,包含SEQ ID NO:35的氨基酸序列的CDR-H2,以及包含SEQ ID NO:36的氨基酸序列的CDR-H3;以及轻链可变区(VL),该轻链可变区包含:包含SEQ ID NO:37的氨基酸序列的CDR-L1,包含SEQ ID NO:38的氨基酸序列的CDR-L2,以及包含SEQ ID NO:39的氨基酸序列的CDR-L3;
(g)重链可变区(VH),该重链可变区包含:包含SEQ ID NO:44的氨基酸序列的CDR-H1,包含SEQ ID NO:45的氨基酸序列的CDR-H2,以及包含SEQ ID NO:46的氨基酸序列的CDR-H3;以及轻链可变区(VL),该轻链可变区包含:包含SEQ ID NO:47的氨基酸序列的CDR-L1,包含SEQ ID NO:48的氨基酸序列的CDR-L2,以及包含SEQ ID NO:49的氨基酸序列的CDR-L3;
(h)重链可变区(VH),该重链可变区包含:包含SEQ ID NO:54的氨基酸序列的CDR-H1,包含SEQ ID NO:55的氨基酸序列的CDR-H2,以及包含SEQ ID NO:56的氨基酸序列的CDR-H3;以及轻链可变区(VL),该轻链可变区包含:包含SEQ ID NO:57的氨基酸序列的CDR-L1,包含SEQ ID NO:58的氨基酸序列的CDR-L2,以及包含SEQ ID NO:59的氨基酸序列的CDR-L3;或者
(i)重链可变区(VH),该重链可变区包含:包含SEQ ID NO:64的氨基酸序列的CDR-H1,包含SEQ ID NO:65的氨基酸序列的CDR-H2,以及包含SEQ ID NO:66的氨基酸序列的CDR-H3;以及轻链可变区(VL),该轻链可变区包含:包含SEQ ID NO:67的氨基酸序列的CDR-L1,包含SEQ ID NO:68的氨基酸序列的CDR-L2,以及包含SEQ ID NO:69的氨基酸序列的CDR-L3。
在一些实施方案中,该抗体:
包含以上部分(a)的CDR,并且进一步包含与SEQ ID NO:7的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VH;
包含以上部分(b)的CDR,并且进一步包含与SEQ ID NO:7的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VH;
包含以上部分(c)的CDR,并且进一步包含与SEQ ID NO:17的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VH;
包含以上部分(d)的CDR,并且进一步包含与SEQ ID NO:17的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VH;
包含以上部分(e)的CDR,并且进一步包含与SEQ ID NO:30的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VH;
包含以上部分(f)的CDR,并且进一步包含与SEQ ID NO:40的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VH;
包含以上部分(g)的CDR,并且进一步包含与SEQ ID NO:50的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VH;
包含以上部分(h)的CDR,并且进一步包含与SEQ ID NO:60的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VH;或包含以上部分(i)的CDR,并且进一步包含与SEQ ID NO:70的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VH。
在一些实施方案中,该抗体:
包含以上部分(a)的CDR,并且进一步包含与SEQ ID NO:8的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VL;
包含以上部分(b)的CDR,并且进一步包含与SEQ ID NO:8的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VL;
包含以上部分(c)的CDR,并且进一步包含与SEQ ID NO:18的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VL;
包含以上部分(d)的CDR,并且进一步包含与SEQ ID NO:18的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VL;
包含以上部分(e)的CDR,并且进一步包含与SEQ ID NO:31的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VL;
包含以上部分(f)的CDR,并且进一步包含与SEQ ID NO:41的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VL;
包含以上部分(g)的CDR,并且进一步包含与SEQ ID NO:51的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VL;
包含以上部分(h)的CDR,并且进一步包含与SEQ ID NO:61的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VL;或包含以上部分(i)的CDR,并且进一步包含与SEQ ID NO:71的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VL。
在一些情况下,该抗体:
包含以上部分(a)的CDR,并且进一步包含VH,该VH包含SEQ ID NO:7的氨基酸序列;
包含以上部分(b)的CDR,并且进一步包含VH,该VH包含SEQ ID NO:7的氨基酸序列;
包含以上部分(c)的CDR,并且进一步包含VH,该VH包含SEQ ID NO:17的氨基酸序列;
包含以上部分(d)的CDR,并且进一步包含VH,该VH包含SEQ ID NO:17的氨基酸序列;
包含以上部分(e)的CDR,并且进一步包含VH,该VH包含SEQ ID NO:30的氨基酸序列;
包含以上部分(f)的CDR,并且进一步包含VH,该VH包含SEQ ID NO:40的氨基酸序列;
包含以上部分(g)的CDR,并且进一步包含VH,该VH包含SEQ ID NO:50的氨基酸序列;
包含以上部分(h)的CDR,并且进一步包含VH,该VH包含SEQ ID NO:60的氨基酸序列;或包含以上部分(i)的CDR,并且进一步包含VH,该VH包含SEQ ID NO:70的氨基酸序列。
在一些情况下,该抗体:
包含以上部分(a)的CDR,并且进一步包含VL,该VL包含SEQ ID NO:8的氨基酸序列;
包含以上部分(b)的CDR,并且进一步包含VL,该VL包含SEQ ID NO:8的氨基酸序列;
包含以上部分(c)的CDR,并且进一步包含VL,该VL包含SEQ ID NO:18的氨基酸序列;
包含以上部分(d)的CDR,并且进一步包含VL,该L包含SEQ ID NO:18的氨基酸序列;
包含以上部分(e)的CDR,并且进一步包含VL,该VL包含SEQ ID NO:31的氨基酸序列;
包含以上部分(f)的CDR,并且进一步包含VL,该VL包含SEQ ID NO:41的氨基酸序列;
包含以上部分(g)的CDR,并且进一步包含VL,该VL包含SEQ ID NO:51的氨基酸序列;
包含以上部分(h)的CDR,并且进一步包含VL,该VL包含SEQ ID NO:61的氨基酸序列;或包含以上部分(i)的CDR,并且进一步包含VL,该VL包含SEQ ID NO:71的氨基酸序列。
在一些情况下,该抗体包含:VH,其包含SEQ ID NO:7的氨基酸序列;以及VL,其包含SEQ ID NO:8的氨基酸序列。在一些情况下,该抗体包含:VH,其包含SEQ ID NO:17的氨基酸序列;以及VL,其包含SEQ ID NO:18的氨基酸序列。在一些情况下,该抗体包含VL,与人IGKV2-28*01种系相比,该VL在框架区中包含1至5个氨基酸取代,任选地其中该氨基酸取代包含Q100P和/或V104L。在一些情况下,该抗体:包含以上部分(a)的CDR,并且进一步包含VL,该VL包含SEQ ID NO:145的氨基酸序列;
包含以上部分(b)的CDR,并且进一步包含VL,该VL包含SEQ ID NO:145的氨基酸序列;
包含以上部分(a)的CDR,并且进一步包含VL,该VL包含SEQ ID NO:147的氨基酸序列;
包含以上部分(b)的CDR,并且进一步包含VL,该VL包含SEQ ID NO:147的氨基酸序列;
包含以上部分(a)的CDR,并且进一步包含VL,该VL包含SEQ ID NO:149的氨基酸序列;
包含以上部分(b)的CDR,并且进一步包含VL,该VL包含SEQ ID NO:149的氨基酸序列;
包含以上部分(a)的CDR,并且进一步包含VL,该VL包含SEQ ID NO:151的氨基酸序列;
包含以上部分(b)的CDR,并且进一步包含VL,该VL包含SEQ ID NO:151的氨基酸序列;
包含以上部分(c)的CDR,并且进一步包含VL,该VL包含SEQ ID NO:132的氨基酸序列;
包含以上部分(d)的CDR,并且进一步包含VL,该VL包含SEQ ID NO:132的氨基酸序列;
包含以上部分(c)的CDR,并且进一步包含VL,该VL包含SEQ ID NO:134的氨基酸序列;
包含以上部分(d)的CDR,并且进一步包含VL,该L包含SEQ ID NO:134的氨基酸序列;
包含以上部分(c)的CDR,并且进一步包含VL,该VL包含SEQ ID NO:136的氨基酸序列;
包含以上部分(d)的CDR,并且进一步包含VL,该L包含SEQ ID NO:136的氨基酸序列;
包含以上部分(c)的CDR,并且进一步包含VL,该VL包含SEQ ID NO:138的氨基酸序列;或包含以上部分(d)的CDR,并且进一步包含VL,该VL包含SEQ ID NO:138的氨基酸序列。
在一些实施方案中,本文的抗体具有以下特性中的一种或多种、两种或更多种、三种或更多种、四种或更多种、五种或更多种、六种或更多种、或全部:
(a)与TREM2的茎结构域特异性结合;
(b)不与可溶性TREM2(sTREM2)结合;
(c)以较高的亲和力与由氨基酸146至161(SEQ ID NO:96)或151至165(SEQ IDNO:97)组成的TREM2多肽特异性结合,其是与由氨基酸139至158(SEQ ID NO:92)和/或159至175(SEQ ID NO:94)组成的TREM2多肽相比;
(d)与跨越H157至S158切割位点的TREM2表位特异性结合;
(e)与野生型TREM2茎结构域多肽相比,对包含D152A、H157A和I159A取代的TREM2茎结构域多肽显示出降低的结合亲和力(例如,如通过双层干涉法所测量);
(f)以通过表面等离子体共振(SPR)的在37℃小于1nM、小于0.7nM、小于0.6nM、小于0.5nM、小于0.4nM、或小于0.3nM、或100至500pM或100至200pM的K
(g)以通过表面等离子体共振(SPR)的在37℃小于100pM、小于50pM、小于10pM、小于7pM、小于5pM、小于4pM、小于3pM、或小于2pM、或10至50pM或10至25pM的K
本申请还涵盖,例如,一种分离的抗体,其特异性地结合表达在骨髓细胞上的触发受体-2(TREM2),其中该抗体包含:
VH,其包含SEQ ID NO:146的氨基酸序列;以及VL,其包含SEQ ID NO:145的氨基酸序列;
VH,其包含SEQ ID NO:148的氨基酸序列;以及VL,其包含SEQ ID NO:147的氨基酸序列;
VH,其包含SEQ ID NO:150的氨基酸序列;以及VL,其包含SEQ ID NO:149的氨基酸序列;或者
VH,其包含SEQ ID NO:152的氨基酸序列;以及VL,其包含SEQ ID NO:151的氨基酸序列。在一些实施方案中,该抗体具有以下特性中的一种或多种、两种或更多种、三种或更多种、四种或更多种、五种或更多种、或全部:
(a)与TREM2的茎结构域特异性结合;
(b)不与可溶性TREM2(sTREM2)结合;
(c)以较高的亲和力与由氨基酸146至161(SEQ ID NO:96)或151至165(SEQ IDNO:97)组成的TREM2多肽特异性结合,其是与由氨基酸139至158(SEQ ID NO:92)和/或159至175(SEQ ID NO:94)组成的TREM2多肽相比;
(d)与跨越H157至S158切割位点的TREM2表位特异性结合;
(e)与野生型TREM2茎结构域多肽相比,对包含D152A、H157A和I159A取代的TREM2茎结构域多肽显示出降低的结合亲和力(例如,如通过双层干涉法所测量);以及
(f)以通过表面等离子体共振(SPR)的在37℃小于1nM、小于0.7nM、小于0.6nM、小于0.5nM、小于0.4nM、或小于0.3nM、或100至500pM或100至200pM的K
本申请进一步涵盖,例如,一种分离的抗体,其特异性地结合表达在骨髓细胞上的触发受体-2(TREM2),其中该抗体包含:
VH,其包含SEQ ID NO:133的氨基酸序列;以及VL,其包含SEQ ID NO:132的氨基酸序列;
VH,其包含SEQ ID NO:135的氨基酸序列;以及VL,其包含SEQ ID NO:134的氨基酸序列;
VH,其包含SEQ ID NO:137的氨基酸序列;以及VL,其包含SEQ ID NO:136的氨基酸序列;或者
VH,其包含SEQ ID NO:139的氨基酸序列;以及VL,其包含SEQ ID NO:138的氨基酸序列。在一些实施方案中,该抗体具有以下特性中的一种或多种、两种或更多种、三种或更多种、四种或更多种、五种或更多种、或全部:
(a)与TREM2的茎结构域特异性结合;
(b)不与可溶性TREM2(sTREM2)结合;
(c)以较高的亲和力与由氨基酸146至161(SEQ ID NO:96)或151至165(SEQ IDNO:97)组成的TREM2多肽特异性结合,其是与由氨基酸139至158(SEQ ID NO:92)和/或159至175(SEQ ID NO:94)组成的TREM2多肽相比;
(d)与跨越H157至S158切割位点的TREM2表位特异性结合;
(e)与野生型TREM2茎结构域多肽相比,对包含D152A、H157A和I159A取代的TREM2茎结构域多肽显示出降低的结合亲和力(例如,如通过双层干涉法所测量);以及
(f)以通过表面等离子体共振(SPR)的在37℃小于100pM、小于50pM、小于10pM、小于7pM、小于5pM、小于4pM、小于3pM、或小于2pM、或10至50pM或10至25pM的K
在一些情况下,本文的抗体具有以下特征中的一者或多者、两者或更多者、三者或更多者、四者或更多者、五者或更多者、六者或更多者、七者或更多者、八者或更多者、或全部:
(a)在表达人TREM2的Jurkat-NFAT荧光素酶报告基因细胞中诱导荧光素酶报告基因活性;
(b)降低血浆中体内sTREM2的水平;
(c)在表达人TREM2的Jurkat-NFAT荧光素酶报告基因细胞中抑制sTREM2的脱落;
(d)在人MDM细胞中诱导酪氨酸磷酸化;
(e)在人MDM细胞中诱导SYK磷酸化;
(f)在缺乏IL-34和CSF-1的情况下,增强人iPSC来源的小胶质细胞的存活;
(g)在人iPSC来源的小胶质细胞中抑制sTREM2的脱落;
(h)在人iPSC来源的小胶质细胞中诱导SYK磷酸化;以及
(i)在人iPSC来源的小胶质细胞中存在Aβ寡聚体的情况下,增加总Aβ斑块强度和/或平均X04斑块强度(例如,如本文实例17的测定中所述)。在一些实施方案中,本文的抗体在脱靶结合测定中还具有低脱靶结合评分(例如,<1的评分)(例如,如本文实例10中所述)。
在一些实施方案中,该抗体为抗体片段,诸如Fv、单链Fv(scFv)、Fab、Fab'或(Fab')
本文的公开内容还涵盖,例如,一种分离的抗体,其特异性地结合至表达在骨髓细胞上的触发受体-2(TREM2),其中该抗体包含:包含SEQ ID NO:17的氨基酸序列或由该氨基酸序列组成的重链;和/或包含SEQ ID NO:18的氨基酸序列或由该氨基酸序列组成的轻链。本文的公开内容进一步涵盖一种分离的抗体,其特异性地结合至表达在骨髓细胞上的触发受体-2(TREM2),其中该抗体包含:包含SEQ ID NO:144的氨基酸序列或由该氨基酸序列组成的重链;和/或包含SEQ ID NO:176的氨基酸序列或由该氨基酸序列组成的轻链。本文的公开内容还涵盖一种分离的抗体,其特异性地结合至表达在骨髓细胞上的触发受体-2(TREM2),其中该抗体包含:重链,其包含SEQ ID NO:144的氨基酸序列或由该氨基酸序列组成但缺少SEQ ID NO:144的C末端赖氨酸或缺少SEQ ID NO:144的C末端甘氨酸和赖氨酸;和/或轻链,其包含SEQ ID NO:176的氨基酸序列或由该氨基酸序列组成。本公开还涵盖一种分离的抗体,其特异性地结合至表达在骨髓细胞上的触发受体-2(TREM2),其中该抗体包含:包含由SEQ ID NO:144的氨基酸序列组成的重链;和/或由SEQ ID NO:176的氨基酸序列组成的轻链。在一些实施方案中,该抗体特异性地结合至TREM2茎结构域并且不与可溶性TREM2(sTREM2)结合,并且其中该抗体特异性地结合至跨越H157至S158切割位点的TREM2表位,和/或以较高亲和力特异性地结合至由氨基酸146至161(SEQ ID NO:96)或151至165(SEQ ID NO:97)组成的TREM2多肽,其是与由氨基酸139至158(SEQ ID NO:92)和/或159至175(SEQ ID NO:94)组成的TREM2多肽相比。在一些实施方案中,该抗体特异性地结合至TREM2茎结构域并且不与可溶性TREM2(sTREM2)结合,并且其中该抗体为TREM2激动剂。在本文的一些实施方案中,抗体具有以下特性中的一种或多种、两种或更多种、三种或更多种、四种或更多种、五种或更多种、六种或更多种、或全部:
(a)与TREM2的茎结构域特异性结合;
(b)不与可溶性TREM2(sTREM2)结合;
(c)以较高的亲和力与由氨基酸146至161(SEQ ID NO:96)或151至165(SEQ IDNO:97)组成的TREM2多肽特异性结合,其是与由氨基酸139至158(SEQ ID NO:92)和/或159至175(SEQ ID NO:94)组成的TREM2多肽相比;
(d)与跨越H157至S158切割位点的TREM2表位特异性结合;
(e)与野生型TREM2茎结构域多肽相比,对包含D152A、H157A和I159A取代的TREM2茎结构域多肽显示出降低的结合亲和力(例如,如通过双层干涉法所测量);
(f)以通过表面等离子体共振(SPR)的在37℃小于1nM、小于0.7nM、小于0.6nM、小于0.5nM、小于0.4nM、小于0.3nM的KD与人和食蟹猴TREM2特异性结合;以及
(g)以通过表面等离子体共振(SPR)的在37℃小于100pM、小于50pM、小于10pM、小于7pM、小于5pM、小于4pM、小于3pM或小于2pM的K
(a)在表达人TREM2的Jurkat-NFAT荧光素酶报告基因细胞中诱导荧光素酶报告基因活性;
(b)降低血浆中体内sTREM2的水平;
(c)在表达人TREM2的Jurkat-NFAT荧光素酶报告基因细胞中抑制sTREM2的脱落;
(d)在人MDM细胞中诱导酪氨酸磷酸化;
(e)在人MDM细胞中诱导SYK磷酸化;
(f)在缺乏IL-34和CSF-1的情况下,增强人iPSC来源的小胶质细胞的存活;
(g)在人iPSC来源的小胶质细胞中抑制sTREM2的脱落;
(h)在人iPSC来源的小胶质细胞中诱导SYK磷酸化;以及
(i)在人iPSC来源的小胶质细胞中存在Aβ寡聚体的情况下,增加总Aβ斑块强度和/或平均X04斑块强度(例如,如本文实例17的测定中所述)。在一些实施方案中,该抗体在脱靶结合测定中还具有低脱靶结合评分(例如,<1的评分)(例如,如本文实例10中所述)。
本文的公开内容还涵盖一种分离的抗体,其特异性地结合至表达在骨髓细胞上的触发受体-2(TREM2),其中该抗体包含重链可变区(VH)和轻链可变区(VL),其中该VH包含:包含SEQ ID NO:11或19的氨基酸序列的CDR-H1;包含SEQ ID NO:12或20的氨基酸序列的CDR-H2;以及包含SEQ ID NO:13的氨基酸序列的CDR-H3,并且进一步地其中该抗体特异性地结合至TREM2茎结构域并且不与可溶性TREM2(sTREM2)结合,其中该抗体为TREM2激动剂,并且其中该抗体特异性地结合至跨越H157至S158切割位点的TREM2表位,和/或以较高亲和力特异性地结合至由氨基酸146至161(SEQ ID NO:96)或151至165(SEQ ID NO:97)组成的TREM2多肽,其是与由氨基酸139至158(SEQ ID NO:92)和/或159至175(SEQ ID NO:94)组成的TREM2多肽相比。在一些实施方案中,例如,与野生型TREM2茎结构域多肽相比,该抗体对包含D152A、H157A和I159A取代的TREM2茎结构域多肽显示出降低的结合亲和力(例如,如通过双层干涉法所测量的),和/或通过表面等离子体共振(SPR),在37℃下,以小于100pM、小于50pM、小于10pM、小于7pM、小于5pM、小于4pM、小于3pM、或小于2pM、或10-50pM或10-25pM的K
(a)在表达人TREM2的Jurkat-NFAT荧光素酶报告基因细胞中诱导荧光素酶报告基因活性;
(b)降低血浆中体内sTREM2的水平;
(c)在表达人TREM2的Jurkat-NFAT荧光素酶报告基因细胞中抑制sTREM2的脱落;
(d)在人MDM细胞中诱导酪氨酸磷酸化;
(e)在人MDM细胞中诱导SYK磷酸化;
(f)在缺乏IL-34和CSF-1的情况下,增强人iPSC来源的小胶质细胞的存活;
(g)在人iPSC来源的小胶质细胞中抑制sTREM2的脱落;
(h)在人iPSC来源的小胶质细胞中诱导SYK磷酸化;以及
(i)在人iPSC来源的小胶质细胞中存在Aβ寡聚体的情况下,增加总Aβ斑块强度和/或平均X04斑块强度(例如,如本文实例17的测定中所述)。在一些实施方案中,该抗体在脱靶结合测定中还具有低脱靶结合评分(例如,<1的评分)(例如,如本文实例10中所述)。进一步地,在一些实施方案中,该VH包含SEQ ID NO:17、133、135、137或139的氨基酸序列,或其中该抗体包含重链,该重链包含SEQ ID NO:144的氨基酸序列或由该氨基酸序列组成。在一些情况下,该抗体包含人IgG1 Fc区,该人IgG1 Fc区包含(a)N297G取代,(b)L234A、L235A和P329G取代(LALAPG取代),或(c)N297G、M428L和N434S取代。在一些情况下,该抗体具有降低的效应子功能,或为无效应子,或不与FcγR结合。
在一些实施方案中,抗体可为双特异性或多特异性抗体,或与至少一个其他分子共价地或非共价地缀合。在一些情况下,该抗体与至少一个其他分子共价地或非共价地缀合,其中该至少一个其他分子包含检测标记物和/或药物。
本公开还包括一种药物组合物,其包含如本文所述的抗体以及药用载体。本公开还涵盖一种分离的核酸或两种或更多种核酸的组,其编码本文所公开的抗体。本公开还包括一种分离的载体,其包含编码本文的抗体的重链和轻链的一种或多种核酸。本公开进一步涵盖一种分离的宿主细胞,其包含该核酸或载体。本公开还涵盖一种生产与TREM2特异性地结合的抗体的方法,该方法包括在适合表达该抗体的条件下培养该宿主细胞。在一些情况下,该方法包括从该宿主细胞回收该抗体。本公开还涵盖一种抗体,其通过该方法生产。
本公开进一步包括一种治疗有此需要的受试者中与TREM2功能丧失相关的病症的方法,该方法包括向该受试者施用本文的抗体或本文的药物组合物。在一些实施方案中,本公开包括一种降低有此需要的受试者中sTREM2的水平的方法,该方法包括向该受试者施用本文的抗体或本文的药物组合物。在一些情况下,该病症为神经炎症或神经退行性疾病,或其中该受试者患有神经炎症或神经退行性疾病。在一些情况下,该神经炎症或神经退行性疾病为阿尔茨海默病、帕金森病、额颞叶痴呆、痴呆、多发性硬化症(MS)、肌萎缩性脊髓侧索硬化症(ALS)、Nasu-Hakola病、格林巴利综合征(Guillain-BarréSyndrome,GBS)、溶酶体贮积病、鞘磷脂沉积病(Neimann-Pick C)、黏多糖贮积症II/IIIB、异染性脑白质营养不良、多灶性运动神经病、神经白塞病(neuro-Behcet’s disease)、视神经脊髓炎(NMO)、视神经炎、多发性肌炎、皮肌炎、卒中、横贯性脊髓炎、创伤性脑损伤或脊髓损伤。在一些情况下,该疾病为阿尔茨海默病。在一些情况下,该疾病为MS。
本公开还涵盖本文的抗体或药物组合物,其用于治疗有此需要的受试者中与TREM2功能丧失相关的病症。在一些实施方案中,本文的公开内容涵盖本文的抗体或药物组合物,其用于降低有此需要的受试者中sTREM2的水平。在一些情况下,该病症为神经炎症或神经退行性疾病,或其中该受试者患有神经炎症或神经退行性疾病。在一些情况下,该神经炎症或神经退行性疾病为阿尔茨海默病、帕金森病、额颞叶痴呆、痴呆、多发性硬化症(MS)、肌萎缩性脊髓侧索硬化症(ALS)、Nasu-Hakola病、格林巴利综合征(Guillain-BarréSyndrome,GBS)、溶酶体贮积病、鞘磷脂沉积病(Neimann-Pick C)、黏多糖贮积症II/IIIB、异染性脑白质营养不良、多灶性运动神经病、神经白塞病(neuro-Behcet’s disease)、视神经脊髓炎(NMO)、视神经炎、多发性肌炎、皮肌炎、卒中、横贯性脊髓炎、创伤性脑损伤或脊髓损伤。在一些情况下,该疾病为阿尔茨海默病。在一些情况下,该疾病为MS。
本公开进一步包括本文的抗体或本文的药物组合物在制备用于治疗有此需要的受试者中与TREM2功能丧失相关的病症的药物中的用途。本文的公开内容还包括本文的抗体或药物组合物在制备用于降低有此需要的受试者中sTREM2的水平的药物中的用途。在一些情况下,该病症为神经炎症或神经退行性疾病,或其中该受试者患有神经炎症或神经退行性疾病。在一些情况下,该神经炎症或神经退行性疾病为阿尔茨海默病、帕金森病、额颞叶痴呆、痴呆、多发性硬化症(MS)、肌萎缩性脊髓侧索硬化症(ALS)、Nasu-Hakola病、格林巴利综合征(Guillain-BarréSyndrome,GBS)、溶酶体贮积病、鞘磷脂沉积病(Neimann-PickC)、黏多糖贮积症II/IIIB、异染性脑白质营养不良、多灶性运动神经病、神经白塞病(neuro-Behcet’sdisease)、视神经脊髓炎(NMO)、视神经炎、多发性肌炎、皮肌炎、卒中、横贯性脊髓炎、创伤性脑损伤或脊髓损伤。在一些情况下,该疾病为阿尔茨海默病。在一些情况下,该疾病为MS。
另外的目的和优点将部分地在下文的描述中阐述,并且部分地将从该描述中理解,或者可以通过实践获知。这些目的和优点将通过所附权利要求中特别指出的要素和组合来实现和获得。应理解,前述一般描述和下述详细描述均为示例性的且仅为解释性的,并且不限制权利要求。例如,除了本文所描绘和要求保护的各种实施方案之外,所公开的主题还涉及具有本文所公开和要求保护的特征的其他组合的其他实施方案。这样,本文所呈现的特定特征,尤其是呈现为方面或实施方案,可以在所公开的主题的范围内以其他方式彼此组合,使得所公开的主题包括本文所公开的特征的任何合适的组合。出于说明和描述的目的,呈现了本文所公开主题的具体实施方案的描述。其并不旨在穷举或将所公开的主题限制为所公开的那些实施方案。
附图说明
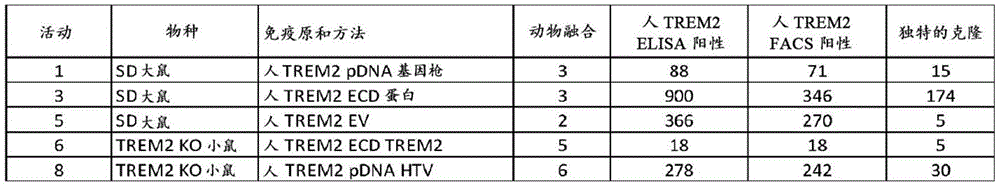
图1示出了通过使用不同免疫策略的杂交瘤获得的抗TREM2克隆的总结。
图2A至2B提供了各种TREM2茎肽序列以及三种不同抗体与每种肽的结合强度。图2A示出了TREM2茎区内的肽片段的序列。位于残基157与158之间的TREM2切割位点侧翼的TREM2残基以粗体显示。图2B示出了三种抗体与图2A的肽的结合数据(以nM计)。结合以灰色阴影显示(较深的阴影指示较强的结合)以及A
图3A至3B示出了抗TREM2抗体的轻链和重链可变区氨基酸序列。相对于3.10C2可变区序列的氨基酸差异以黑色指示。根据Chothia或Kabat的CDR区在序列上方指示,并且Kabat CDR定义也加下划线。图3A示出了5个克隆的轻链可变区序列。图3B示出了6个克隆的重链可变区序列。
图4示出了具有与不同轻链组合的来自大鼠库深度测序数据集的IGHV6-8克隆的抗体的ELISA筛选。表中的茎、149-158、159-175和抑制素分别指代TREM2的茎区、茎的片段149-158和159-175以及30-mer抑制素对照肽。ELISA信号以灰色阴影显示。IMGT定义中的克隆的CDR H3序列(长度5)显示在左侧的列中。克隆3.10C2仅与其自身的同源轻链配对。KV2S11是指在种系序列构型中具有IGK2S11种系区段的轻链,并且与3.10C2抗体组具有类似的VJ连接序列。
图5示出了影响抗TREM2抗体结合的丙氨酸/甘氨酸突变的总结。灰色框指示影响解离速率结合或不同抗体的总结合的突变。TREM2中的氨基酸残基和位置显示在表的顶行中。TREM2中位于蛋白质切割位点侧翼的两个残基在同一行中以灰色突出显示。抗体AL2p-31是小鼠抗体9F5的人源化高亲和力变体。抗体Para.09具有抗体3.2H7轻链。
图6A至6B示出了人源化3.10C2 CDR移植物变体序列。可变区序列与用于人源化的人框架序列进行比对。与框架序列(顶部序列)的差异以黑色突出显示。Kabat定义中的CDR区加下划线。每幅图中的“3.10C2”是指大鼠3.10C2可变区序列。图6A示出了3个变体的轻链可变区序列。图6B示出了4个变体的重链可变区序列。
图7A至7B示出了3.10C2 CDR移植物克隆的表达产量。图7A示出了通过具有不同重链和轻链人源化变体的人源化IgG变体的滴度(mg/L)测量的表达产量。克隆L9和L10分别与克隆L1和L5相同(见图6A),但在框架4中具有Q100P突变。图7B示出了人源化3.10C2-H1重链变体与人源化3.10C2-L1变体或大鼠3.10C2轻链组合的Fab片段的表达产量(mg)。
图8A至8B示出了人源化3.27H7轻链和Para.09重链CDR移植物变体序列。可变区序列与用于人源化的人框架序列进行比对。与框架序列(顶部序列)的差异以黑色突出显示。Kabat定义中的CDR区加下划线。“3.27H7”和“Para.09”是大鼠可变区序列。图8A示出了三个变体的轻链可变区序列。图8B示出了四个变体的重链可变区序列。
图9A至9B示出了抗体h3.10C2.v1的可变区和CDR的序列。Kabat CDR区加下划线。图9A示出了轻链可变区序列。图9B示出了重链可变区序列。
图10示出了抗体3.10C2的扫描诱变。图10示出了抗体3.10C2重链CDR单点突变体在37℃下的解离速率分布。在同一组实验中确定的抗体3.10C2的解离速率用虚线显示。指示了相对于野生型3.10C2具有较低解离速率的两个3.10C2点突变体,每个突变体的倍数改善显示在括号中。示出了440个突变体的数据。
图11示出了在CHO细胞中产生Para.09的大鼠和人源化变体的蛋白A层析后的表达产量(mg/L)。指示了每种抗体的同种型。
图12A至12B示出了抗体hPara.09.v2的可变区的氨基酸序列。Kabat CDR区加下划线。图12A示出了轻链可变区序列。图12B示出了重链可变区序列。
图13A和13B示出了hPara.09.v2和hPara.09.v2突变体的轻链(图13A)和重链(图13B)的序列和CDR区。突出显示了轻链中的Q100P、I58V和V104L突变以及相对于hPara.09.v2的其他突变。Kabat CDR区加下划线。
图14A至14B示出了抗体h3.10C2.v1和h3.10C2.v1突变体的轻链(图14A)和重链(图14B)可变区的序列和CDR区。突出显示了轻链中的Q100P、I58V和L104V突变。Kabat CDR区加下划线。
图15示出了四种抗TREM2抗体(亲本和人源化)的标准化杆状病毒(BV)ELISA反应性:具有大鼠可变区和人IgG1恒定区的嵌合克隆,以及人源化变体h3.10C2.v1和hPara.09.v2,其中人IgG1恒定区具有N297G突变以消除Fc受体结合。
图16示出了在体外结合至可溶性TREM2(sTREM2)和不与其结合的抗体。图16示出了以下测试抗体的sTREM2结合的标准化值:对照抗体1.16B8(CTL)、大鼠Para.09–LC3.27H7 mIgG2a LALAPG(Para09)、大鼠3.10C2 mIgG2a LALAPG(3.10C2)、大鼠3.18E5mIgG2a LALAPG(3.18E5)、大鼠3.50G1 mIgG2a LALAPG(3.50G1)、大鼠3.27H7mIgG2aLALAPG(3.27H7)、大鼠3.36F5 mIgG2a LALAPG(3.36F5)、A.9F5(本文中也称为9F5)、AL2p-12、AL2p-31、AL2p-58、BM.3D3、BM.42E8、BM.RS9、BM.14D3和BM.14D8。
图17示出了mIgG2a形式的重组抗体的Jurkat报告基因活性。Jurkat细胞经工程改造以在NFAT(经活化的T细胞的核因子)的控制下表达荧光素酶,并表达人TREM2。图17示出了在细胞中诱导中度至强荧光素酶表达的8种抗体:3.10C2、3.18E5、3.27H7、3.50G1、3.17G12、3.27H5、3.41B10和3.47B1。
图18A至18B示出了递增浓度的大鼠抗人和人源化抗TREM2抗体对于在表达人TREM2的Jurkat-NFAT荧光素酶报告基因细胞中的荧光素酶表达的影响。示出了在24小时后在存在不同浓度的mIgG2 LALAPG形式的大鼠抗人抗体(图18A)和人源化hPara.09.v2和h3.10C2.v1抗体(图18B)的情况下的荧光素酶信号。
图19A至19C示出了大鼠抗人3.10C2、3.18E5、3.27H7和3.50G1mIgG2a LALAPG抗体在表达hTREM2突变体R47H(图19A)、R62H(图19B)或H157Y(图19C)的Jurkat-NFAT荧光素酶报告基因细胞系中对荧光素酶表达的诱导。
图20A至20B和20D显示,24小时后,大鼠抗人和人源化抗体对于表达hTREM2的Jurkat-NFAT荧光素酶报告基因细胞系中的sTREM2脱落的影响,如通过ELISA所测量的。图20A示出了递增浓度的大鼠1.20A2mIgG2a LALAPG、大鼠Para.09mIgG2a LALAPG和大鼠3.10C2 mIgG2aLALAPG抗体对于sTREM2水平的影响。图20B示出了人IgG1 N297G形式的人源化h3.10C2.v1和hPara.09.v2抗体的作用。图20D示出了人源化抗体hPara.09v2、hPara.09.v2 Q100P/V104L和hPara.09.v2 Q100P的作用。图20C示出了由hPara.09v2、hPara.09.v2 Q100P/V104L和hPara.09.v2 Q100P抗体诱导的荧光素酶表达。
图21示出了抗体3.10C2、3.18E5、3.27H7、3.50G1和9F5与鼠IgG2LALAPG对于人诱导性多能干细胞(iPSC)衍生的小胶质细胞中的TREM2脱落的影响。
图22A至22C示出了在与人源化抗TREM2抗体温育规定的10至20分钟时间段(图22A至22B)或与规定的剂量范围的抗体温育(图22C)后,原代人单核细胞衍生的巨噬细胞(hMDM)细胞中的泛磷酸化酪氨酸(pY)水平(图22A)和磷酸化SYK(pSYK)水平(图22B至22C)。在图22B中,还与经修饰以降低TREM2表达的hMDM细胞(gTREM2)进行了磷酸化的比较。图22C示出了递增剂量的人源化抗体hPara.09.v2 N297G或hPara.09.v2 Q100P/V104L N297G或对照抗体对于SYK磷酸化的影响。测量pSYK水平并将其相对于总SYK量进行归一化。n=6,来自3个独立的生物样本。
图23A至23E显示,大鼠抗人和人源化抗TREM2抗体促进人诱导性多能干细胞(iPSC)小胶质细胞存活。图23A示出了通过用递增剂量的hPara.09v2、h3.10C2.v1治疗诱导的野生型(WT,细线)或TREM2 KO(KO,虚线)iPSC小胶质细胞的存活,测量为通过对照抗体(gD hIgG1N297G)治疗诱导的反应的倍数。误差条+/-SEM。图23B示出了iPSC-MG细胞响应于用递增剂量(0、1、10、100ng)的抗体治疗的存活。抗体根据TREM2结合进行分组(残基跨度显示在图的顶部)。误差条+/-SEM。图23C示出了人源化抗体(hPara09.v2 N297G、hPara09.v2.Q100P/V104LN297G)在iPSC-MG中在1、4和24小时的时间点的pSYK诱导。误差条+/-SEM。*P<0.05,**P<0.01,****<0.0001。图23D示出了在存在和不存在SYK抑制剂(SYKi)的情况下,递增浓度的人源化Para.09.v2抗体或抗gD对照抗体对于小胶质细胞存活的影响。误差条+/-SEM。图23E示出了所列抗TREM2抗体与对照抗gD抗体相比的小胶质细胞存活和EC
图24A至24C显示,人源化抗TREM2抗体增加iPSC-MG淀粉样蛋白β斑块形成和压实。图24A示出了用hPara.09.Q100P hIgG1 N297G或对照gD.hIgG1.N297G治疗的iPSC小胶质细胞周围的Aβ斑块样结构和Aβ聚集体形成的免疫荧光图像。从左到右,图片显示:Aβ、淀粉样蛋白斑块染色(甲氧基X04染色)、小胶质细胞染色(IBA1染色)以及来自全部三种染色的合并图像,该合并图像示出了IBA1阳性小胶质细胞、Aβ、和淀粉样蛋白斑块的染色共置。图24B示出了在存在递增浓度的几种人源化抗TREM2抗体或对照抗gD抗体的情况下的总Aβ斑块强度,这些抗体全部为人IgG1 N297G形式。每种抗体的EC
图25A至25C示出了用抗TREM2或对照抗体治疗的小鼠中的sTREM2水平。图25A至25B示出了来自用鼠IgG2 LALAPG形式的3.10C2和Para.09抗体治疗的小鼠的血浆(图25A)和脑匀浆(图25B)样品中sTREM2相对于对照抗体(gp120)的百分比。图25C示出了与同种型对照相比,来自用递增剂量的鼠IgG2a LALAPG形式的Para.09和AL2p58抗体治疗的小鼠的血浆中的sTREM2水平(pg/ml)。
图26A至26F示出了来自用h3.10C2.v1.hIgG1.N297G、hPara.09.v2.hIgG1.N297G或抗gD.hIgG1.N297G对照抗体给药的食蟹猴的CSF、血浆和脑裂解物样品中随时间推移的sTREM2水平。图26A至26C示出了历时2天在CSF(图26A)、血浆(图26B)和脑(图26C)中测量的sTREM2水平。图26D至26F示出了历时28天在CSF(图26D)、血浆(图26E)和脑(图26F)中测量的sTREM2水平。
图27示出了来自用3.10C2、Para.09或对照抗体治疗的小鼠的脑切片,对这些切片进行针对增殖标志物Ki67的染色。细胞增殖表示为每4',6-二脒基-2-苯基吲哚(DAPI)阳性细胞数的平均Ki67+细胞数。
具体实施方式
定义
如本文所用,术语“约”是指数值,包括例如整数、分数和百分比,无论是否明确指出。术语“约”通常是指本领域普通技术人员将认为等同于所述值(例如,具有相同的功能或结果)的数值范围(例如,所述范围+/-5%-10%)。当诸如“至少”和“约”等术语位于数值或范围列表之前时,这些术语修饰列表中提供的所有值或范围。在一些情况下,术语“约”可以包括四舍五入到最接近的有效数字的数值。
除非另有定义,否则与本发明相关的科学和技术术语应具有本领域普通技术人员通常理解的含义。此外,除非上下文另有要求,否则单数术语应包括复数,而复数术语应包括单数。
在本申请中,除非另有说明,否则使用“或”表示“和/或”。在多项从属权利要求的上下文中,“或”的使用仅以替代方式回指多于一个在前的独立或从属权利要求。此外,除非另外特别说明,例如“元件”或“组分”的术语涵盖包含一个单位的元件和组分,以及包含多于一个亚单位的元件和组分。
与重组DNA、寡核苷酸合成、组织培养和转化(例如,电穿孔、脂转染)、酶促反应和纯化技术结合使用的示例性技术描述于例如Sambrook等人Molecular Cloning:ALaboratory Manual(第2版,Cold Spring Harbor Laboratory Press,Cold SpringHarbor,N.Y.(1989))等。
如根据本公开所用,除非另外指明,否则以下术语应理解为具有以下含义:
如本文所用,“TREM2”或“表达在骨髓细胞上的触发受体-2”是指人TREM2蛋白(“hTREM2”),除非另有明确说明(即,鼠TREM2或食蟹猴TREM2等)。包括氨基酸1至18的信号序列的示例性hTREM2氨基酸序列显示在SEQ ID NO:21中,而没有该信号序列的示例性序列显示在SEQ ID NO:22中。包括信号序列的TREM2也可以被称为蛋白质的“前体”或“前蛋白”形式,而没有信号序列的TREM2可以被称为蛋白质的“成熟”形式。蛋白质的膜结合形式包括V型免疫球蛋白(Ig)结构域(在氨基酸19至128处),随后是TREM2“茎”结构域(在氨基酸129至174处;SEQ ID NO:90),它们共同形成蛋白质的“胞外结构域”,随后是跨膜结构域(残基175至197)和胞质结构域(残基198至230)。蛋白质的可溶性形式,本文中的“可溶性TREM2”或“sTREM2”,可以通过茎结构域中的切割或通过可变剪接在体内产生。例如,蛋白酶可以在H157与S158之间切割蛋白质,切割可溶性TREM2,包含蛋白质的N末端部分直至H157,例如残基19至157。示例性sTREM2氨基酸序列显示在SEQ ID NO:23中。蛋白质中可能被切割掉以形成sTREM2的部分也称为“胞外结构域”,并且包含残基19至157。一般而言,如本文所用,术语“TREM2”是指蛋白质的膜结合形式,除非上下文明确阐明提及蛋白质的两种形式。另外,hTREM2包含几种同种型或等位基因,其天然序列或剪接可能不同于SEQ ID No:21和22中所示以及如本文实例部分中所描述的同种型或等位基因。除非提及特定同种型或序列,否则术语TREM2包含所有这些天然形式的TREM2。
“亲和力”是指分子(例如,抗体)的单个结合位点与其结合配偶体(例如,抗原)之间的非共价相互作用的总和的强度。除非另有说明,否则如本文所用,“结合亲和力”是指内在结合亲和力,其反映了结合对的成员(例如,抗体和抗原)之间的1:1相互作用。分子X对其配偶体Y的亲和力一般可由解离常数(K
本文中的术语“抗体”是指包含重链的至少互补决定区(CDR)1、CDR2和CDR3以及轻链的至少CDR1、CDR2和CDR3的分子,其中该分子能够与抗原结合。该术语以最广泛的含义使用,并且涵盖各种抗体结构,包括但不限于单克隆抗体、多克隆抗体、多特异性抗体(例如,双特异性抗体、双抗体等)、全长抗体、单链抗体、抗体缀合物和抗体片段,只要它们表现出所需的TREM2特异性结合活性即可。
“分离的”抗体是已从其自然环境的组分中分离出来的抗体。在一些方面,通过例如电泳(例如,SDS-PAGE、等电聚焦(IEF)、毛细管电泳)或色谱(例如,离子交换或反相HPLC)方法确定,将抗体纯化至大于95%或99%的纯度。关于评估抗体纯度的方法的综述,参见例如Flatman等人,J.Chromatogr.B 848:79-87(2007)。
“抗原”是指抗体的靶标,即抗体与之特异性结合的分子。术语“表位”表示抗体结合的蛋白质或非蛋白质抗原上的位点。蛋白质上的表位既可以由连续的氨基酸伸长段(线性表位)形成,也可以通过包含非连续的氨基酸(构象表位)形成,例如由于抗原折叠,即由于蛋白质抗原的三级折叠而在空间上接近。在蛋白质抗原暴露于变性剂后,线性表位通常仍被抗体结合,而构象表位通常在用变性剂处理后被破坏。在一些情况下,本文中的TREM2“表位”可以“跨越”分子中的位点,诸如天然蛋白酶切割位点或断裂点,这意味着一个或多个抗体残基与该切割位点任一侧的抗原之间存在密切接触点,或者意味着抗体结合至跨越该位点的TREM2肽。在这种情况下,TREM2表位包括切割位点或断裂点每一侧的残基。
在本公开中,“特异性结合(specifically binds/specific binding)”及类似术语意指结合亲和力足够强以致结合对的成员之间的相互作用不能归因于随机的分子缔合(即“非特异性结合”)。特异性结合通常需要1μM或更小的解离常数(K
“抗TREM2抗体”或“TREM2抗体”或“特异性地结合TREM2的抗体”或“结合至TREM2的抗体”及类似短语是指特异性地结合至本文所定义的TREM2的抗体。
本文中的某些抗体“不与可溶性TREM2结合”。如本文所用,这意味着当在ELISA测定中进行测定时,抗体可能不会显示出任何超过10%的与sTREM2的结合,并且在一些情况下不会显示出任何超过5%的与sTREM2的结合,其中该结合百分比是针对阳性对照抗体1.16B8的结合百分比归一化的,该阳性对照抗体与sTREM2的结合设置为100%。对照抗体1.16B8轻链序列显示在SEQ ID NO:170中,并且其重链序列显示在SEQ ID NO:171中。在一些实施方案中,可以如下文实例11和图16中所示进行ELISA测定。在一些实施方案中,抗体3.17A9用作测定中的检测剂。检测抗体3.17A9轻链序列显示在SEQ ID NO:168中,并且其重链序列显示在SEQ ID No:169中。本文中的某些抗体“不与FcγR结合”,或具有“不与FcγR结合”的重链恒定区或Fc区,这意味着在合适的体外结合测定中未检测到高于痕量水平的结合。
术语“重链”是指包含至少一个重链可变区的多肽,其具有或不具有前导序列。在一些实施方案中,重链包含重链恒定区的至少一部分。术语“全长重链”是指包含重链可变区和重链恒定区的多肽,其具有或不具有前导序列。
术语“轻链”是指包含至少一个轻链可变区的多肽,其具有或不具有前导序列。在一些实施方案中,轻链包含轻链恒定区的至少一部分。术语“全长轻链”是指包含轻链可变区和轻链恒定区的多肽,其具有或不具有前导序列。
如本文所用的术语“高变区”或“HVR”是指抗体可变区中在序列上高变并且确定抗原结合特异性的各个区域,例如“互补决定区”(“CDR”)。通常,抗体包含六个CDR;三个在VH中(CDR-H1或重链CDR1、CDR-H2、CDR-H3),并且三个在VL中的(CDR-L1、CDR-L2、CDR-L3)。除非另有指示,否则CDR根据本文的序列表确定,并且重链和轻链的区和结构域的氨基酸位置根据Kabat等人,Sequences of Proteins of Immunological Interest,第5版,PublicHealth Service,National Institutes of Health,Bethesda,MD(1991)中描述的Kabat编号系统进行编号。在一些情况下,序列表中同时提供Kabat和Chothia重链CDR1和CDR2。在SEQ ID No:1至6和9至10以及11至16和19至20的情况下,Kabat和Chothia CDR在CDR-H1和CDR-H2中不同,但在其余四个CDR中相同。本领域的技术人员将理解,也可以根据McCallum或任何其他科学上可接受的命名系统来确定CDR名称。参见,例如,Chothia和Lesk,J.Mol.Biol.196:901-917(1987);Kabat等人,Sequences of Proteins of ImmunologicalInterest,第5版Public Health Service,National Institutes of Health,Bethesda,MD(1991);MacCallum等人J.Mol.Biol.262:732-745(1996))。存在于氨基酸残基27c至36(L1)、46至55(L2)、89至96(L3)、30至35b(H1)、47至58(H2)和93至101(H3)处的抗原接触点构建MacCallum CDR。
“框架”或“FR”是指并非互补决定区(CDR)的一部分的可变区残基中的残基。可变区的FR通常由以下四个FR组成:FR1、FR2、FR3和FR4。因此,CDR和FR序列通常在VH(或VL)中以如下序列出现:FR1-CDR-H1(CDR-L1)-FR2-CDR-H2(CDR-L2)-FR3-CDR-H3(CDR-L3)-FR4。
术语“可变区”或“可变结构域”是指抗体重链或轻链的参与抗体与抗原结合的结构域。天然抗体的重链和轻链的可变结构域(分别为VH和VL)通常具有相似的结构,其中每个结构域包含四个保守框架区(FR)和三个互补决定区(CDR)。参见,例如,Kindt等人KubyImmunology,第6版,W.H.Freeman and Co.,第91页(2007)。可变结构域可包含:重链(HC)CDR1-FR2-CDR2-FR3-CDR3,其具有或不具有FR1和/或FR4的全部或一部分;以及轻链(LC)CDR1-FR2-CDR2-FR3-CDR3,其具有或不具有FR1和/或FR4的全部或一部分。也就是说,可变结构域可缺乏FR1和/或FR4的一部分,只要它保留抗原结合活性即可。单个VH或VL结构域可足以赋予抗原结合特异性。此外,结合特定抗原的抗体可分别使用来自结合该抗原的抗体的VH或VL结构域来进行分离,以筛选互补VL或VH结构域的文库。参见例如,Portolano等人,J.Immunol.150:880-887(1993);Clarkson等人,Nature 352:624-628(1991)。
抗体的轻链和重链“恒定区”是指在FR和CDR以及可变区之外的额外的序列部分。某些抗体片段可能缺乏恒定区的全部或一部分。从N末端至C末端,每条重链均具有可变结构域(VH),亦称为可变重链结构域或重链可变区,随后为三个恒定重链结构域(CH1、CH2和CH3)。类似地,从N末端至C末端,每条轻链均具有可变结构域(VL),亦称为可变轻链结构域或轻链可变区,随后为恒定轻链(CL)结构域。
本文的术语“Fc区”用于定义免疫球蛋白重链的C末端区,该C末端区包含恒定区的至少一部分。该术语包括天然序列Fc区和变体Fc区。在一方面,人IgG重链Fc区从Cys226或从Pro230延伸至重链的羧基末端。然而,由宿主细胞产生的抗体可以经历对来自重链的C末端的一个或多个,特别是一个或两个氨基酸的翻译后切割。因此,由宿主细胞通过表达编码全长重链的特定核酸分子产生的抗体可以包括全长重链,或者该抗体可以包括全长重链的切割变体。这可能是重链的最后两个C末端氨基酸为甘氨酸(G446)和赖氨酸(K447,根据EU索引)的情况。因此,Fc区的C末端赖氨酸(Lys447)或C末端甘氨酸(Gly446)和赖氨酸(Lys447)可以存在或可以不存在。因此,例如,“全长IgG1”包括具有Gly446和Lys447或不具有Lys447或不具有Gly446和Lys447两者的IgG1。如果没有另外指明,则包含Fc区的重链的氨基酸序列在本文中被表示为没有C末端甘氨酸-赖氨酸二肽。在一个方面,包含在根据本发明的抗体中的包括如本文所指定的Fc区的重链可包含Gly446和Lys447(根据EU索引编号)。在一个方面,包含在根据本发明的抗体中的包括如本文所指定的Fc区的重链可包含Gly446(根据EU索引编号)。除非本文另有说明,否则Fc区或恒定区中氨基酸残基的编号是根据EU编号系统,也称为EU索引,如Kabat等人,Sequences of Proteins ofImmunological Interest,第5版美国卫生与公众服务部,国立卫生研究院,马里兰州贝塞斯达,1991)。
“效应子功能”是指可归因于抗体的Fc区、随着抗体同种型的变化而变化的那些生物学活性。抗体效应子功能的实例包括:C1q结合和补体依赖性细胞毒性(CDC);Fc受体结合;抗体依赖性细胞介导的细胞毒性(ADCC);吞噬作用;细胞表面受体(例如,B细胞受体)的下调;以及B细胞活化。例如,具有“完整效应子功能”的抗体包含具备其特定同种型的天然、完整效应子功能的重链恒定区或Fc区,诸如野生型重链恒定区或Fc区,或具备尚未显示会影响效应子功能的修饰的重链恒定区或Fc区。相比之下,抗体重链恒定区或Fc区可以以多种方式进行修饰,诸如通过氨基酸取代、插入或缺失,或通过糖基化修饰,以降低或增强效应子功能,这取决于抗体的用途。本文中,一些抗体可能具有“完整的效应子功能”,而其他抗体可能是“无效应子”,这意味着它们不显示可检测的CDC或ADCC活性,或者它们包含先前已显示不具有可检测的CDC或ADCC活性的重链恒定区或Fc区。在其他情况下,抗体可能具有突变型Fc区或重链恒定区,与对应的野生型Fc或重链恒定区相比,该突变型Fc区或重链恒定区具有“降低的效应子功能”(例如,先前已显示具有降低的效应子功能,或在此处的抗体背景下,具有降低的效应子功能)。与对应的野生型Fc区相比,此类具有降低的效应子功能的抗体可以例如显示出较低程度的CDC和/或ADCC活性和/或FcγR结合活性,和/或例如,可以保留一些效应子功能,诸如结合至特定Fc受体诸如FcRn,但伴有低或不可检测的CDC或ADCC或FcγR结合活性。
抗体的“类别”是指抗体的重链所具有的恒定结构域或恒定区的类型。存在五大类抗体:IgA、IgD、IgE、IgG和IgM,并且这些抗体中的一些可以进一步分为亚类(同种型),例如IgG
“抗体片段”是指除了完整抗体以外的分子,其包含完整抗体的一部分且结合完整抗体结合的抗原(即TREM2)。抗体片段的实例包括但不限于Fv、Fab、Fab'、Fab'-SH、F(ab')
术语“全长抗体”、“完整抗体”及“全抗体”在本文中可互换地用于指代具有基本上类似于天然抗体结构的结构或在IgG抗体的情况下具有含有如本文所定义的Fc区的重链的抗体。
术语“嵌合”抗体是指这样的抗体,在该抗体中重链和/或轻链的一部分来源于特定来源或物种,而重链和/或轻链的其余部分来源于不同的来源或物种。
“人源化”抗体是指这样的嵌合抗体,其包含来自非人CDR的氨基酸残基和来自人FR的氨基酸残基。在某些方面,人源化抗体将基本上包含所有的至少一个、通常两个可变结构域,其中所有或基本上所有CDR对应于非人抗体的CDR,并且所有或基本上所有的FR对应于人抗体的FR。人源化抗体任选地可以包含来源于人抗体的抗体恒定区的至少一部分。“人源化形式”的抗体,例如非人抗体,是指已经进行过人源化的抗体。
如本文所用的术语“单克隆抗体”是指从基本上同质的抗体群体获得的抗体,即,除了可能的变体抗体(例如,含有天然存在的突变或在单克隆抗体制剂的生产过程中产生,此类变体通常以少量形式存在)之外,包括该群体的个别抗体具有同一性和/或结合相同表位。与通常包括针对不同决定簇(表位)的不同抗体的多克隆抗体制剂相反,单克隆抗体制剂中的每种单克隆抗体针对抗原上的单一决定簇。因此,修饰语“单克隆”表示抗体的特征是从基本上同质的抗体群体获得的,并且不应解释为需要通过任何特定方法生产抗体。例如,根据本发明的单克隆抗体可以通过多种技术制备,包括但不限于杂交瘤方法、重组DNA方法、噬菌体展示方法,以及利用含有全部或部分人免疫球蛋白基因座的转基因动物的方法,在本文中描述了用于制备单克隆抗体的此类方法和其他示例性方法。
“多特异性”抗体是特异性地结合至超过一种靶抗原的抗体,而“双特异性”抗体是特异性地结合至两种抗原的抗体。“抗体缀合物”是与一种或多种异源分子(包括但不限于治疗剂或标记)缀合的抗体。
相对于参照多肽序列的“氨基酸序列同一性百分比(%)”被定义为在比对候选序列与参考多肽序列并引入空位(如果必要的话)以实现最大的序列同一性百分比之后,并且出于比对的目的在不考虑将任何保守取代作为序列同一性的组成部分的情况下,候选序列中的氨基酸残基与参考多肽序列中的氨基酸残基相同的百分比。用于确定氨基酸序列同一性百分比的比对可以通过本领域技术范围内的各种方式实现,例如使用公众可获得的计算机软件,诸如BLAST、BLAST-2、Clustal W、Megalign(DNASTAR)软件或FASTA程序包。本领域技术人员可确定用于比对序列的适当参数,包括在所比较的序列的全长上实现最大比对所需的任何算法。可替代地,可以使用序列比较计算机程序ALIGN-2来生成同一性百分比值。ALIGN-2序列比较计算机程序由基因泰克公司编写,并且源代码已经与用户文档一起提交到U.S.Copyright Office,Washington D.C.,20559,在那里以美国版权登记号TXU510087注册,并且在WO 2001/007611中有所描述。
除非另外指明,否则出于本文的目的,使用FASTA包第36.3.8c版或更高版本的ggsearch程序,利用BLOSUM50比较矩阵生成氨基酸序列同一性百分比的值。FASTA程序包由W.R.Pearson和D.J.Lipman(1988),“Improved Tools for Biological SequenceAnalysis”,PNAS 85:2444-2448;W.R.Pearson(1996)“Effective protein sequencecomparison”Meth.Enzymol.266:227-258;以及Pearson等人(1997)Genomics 46:24-36创作并且可从www.fasta.bioch.virginia.edu/fasta_www2/fasta_down.shtml或www.Ebi.ac.uk/Tools/sss/fasta公开获得。可替代地,可以使用可在fasta.bioch.virginia.edu/fasta_www2/index.cgi处访问的公共服务器来比较序列,使用ggsearch(全局蛋白质:蛋白质)程序和默认选项(BLOSUM50;开放:-10;ext:-2;Ktup=2)来确保执行全局而非局部比对。在输出比对标头中给出氨基酸同一性百分比。
术语“核酸分子”或“多核苷酸”包括包含核苷酸聚合物的任何化合物和/或物质。每个核苷酸由碱基组成,特别是嘌呤或嘧啶碱基(即胞嘧啶(C)、鸟嘌呤(G)、腺嘌呤(A)、胸腺嘧啶(T)或尿嘧啶(U))、糖(即脱氧核糖或核糖)和磷酸酯基团。通常,核酸分子通过碱基序列进行描述,其中所述碱基代表核酸分子的一级结构(线性结构)。碱基序列通常表示为从5'至3'。在本文中,术语核酸分子涵盖脱氧核糖核酸(DNA)(包括例如互补DNA(cDNA)和基因组DNA)、核糖核酸(RNA)(特别是信使RNA(mRNA))、DNA或RNA的合成形式,以及包含这些分子中的两种或更多种的混合聚合物。核酸分子可以是线性的或环状的。此外,术语核酸分子包括有义链和反义链,以及单链和双链形式。此外,本文所描述的核酸分子可含有天然存在的或非天然存在的核苷酸。非天然存在的核苷酸的示例包括具有衍生化的糖或磷酸主链键或经化学修饰的残基的经修饰的核苷酸碱基。核酸分子还涵盖适合作为用于本发明的抗体的体外和/或体内(例如,在宿主或患者体内)直接表达的载体的DNA和RNA分子。此类DNA(例如cDNA)或RNA(例如mRNA)载体可以是未修饰的或经修饰的。例如,可以对mRNA进行化学修饰以增强RNA载体的稳定性和/或编码分子的表达,使得可以将mRNA注射到受试者体内以产生体内抗体(参见例如Stadler等人,Nature Medicine 2017,在线发表于2017年6月12日,doi:10.1038/nm.4356或EP 2 101 823 B1)。
“分离的”核酸是指已从其自然环境的组分中分离的核酸分子。分离的核酸包括这样的核酸分子,其包含在通常含有核酸分子的细胞中,但该核酸分子存在于染色体外或与其天然染色体位置不同的染色体位置处。
“编码抗TREM2抗体的分离的核酸”是指编码抗TREM2抗体重链和轻链(或其片段)的一个或多个核酸分子,包括在单一载体或单独的载体中的此类核酸分子,以及存在于宿主细胞中一个或多个位置的此类核酸分子。
如本文所用的术语“载体”是指能够载运与其相连的另一核酸的核酸分子。该术语包括作为自我复制核酸结构的载体,以及并入其已被引入的宿主细胞的基因组中的载体。某些载体能够指导与其可操作地连接的核酸的表达。此类载体在本文中称为“表达载体”。
术语“宿主细胞”、“宿主细胞系”和“宿主细胞培养物”可互换使用,并且是指已经将外源核酸引入其中的细胞,包括此类细胞的子代。
术语“信号序列”或“前导序列”是指位于多肽N末端的氨基酸残基序列,其促进多肽从哺乳动物细胞中分泌。前导序列可以在多肽从哺乳动物细胞输出时被切割,形成成熟蛋白质。前导序列可以为天然的或合成的,并且它们可能与它们所连接的蛋白质异源或同源。非限制性示例性前导序列还包括来自异源蛋白质的前导序列。在一些实施方案中,抗体缺少前导序列。在一些实施方案中,抗体包含至少一个前导序列,该前导序列可选自天然抗体前导序列和异源前导序列。
如本文所用,术语“脱落”是指通过蛋白茎区的蛋白水解切割从膜结合的TREM2产生可溶性TREM2的过程。在体内,“脱落”可能发生在细胞表面,例如,由于金属蛋白酶或其他酶对细胞膜上的TREM2的切割。在一些情况下,在蛋白质的H157与S158之间发生切割,从胞外结构域残基19至157形成sTREM2。
如本文所用,术语“激动剂”是指引起其所结合的分子的至少一种活性或功能增加、或以其他方式活化或帮助活化该分子的物质,诸如抗体。如本文所用,术语“拮抗剂”是指引起其所结合的分子的至少一种活性或功能降低、或以其他方式阻断或抑制该分子的至少一种活性或功能的物质,诸如抗体。
例如,本文的“激动剂抗TREM2抗体”或类似短语是指在表达人TREM2的Jurkat-NFAT报告基因细胞中诱导荧光素酶报告基因活性和/或在表达人TREM2的Jurkat-NFAT报告基因细胞中、在人单核细胞衍生的巨噬细胞(MDM)细胞中和/或在人诱导性多能干细胞(iPSC)衍生的小胶质细胞中诱导SYK磷酸化(p-SYK)的抗体。如本文所述,例如,激动剂抗TREM2抗体还可以具有进一步的活性,诸如在不存在IL-34和CSF-1的情况下增强人iPSC来源的小胶质细胞的存活,以及活化人巨噬细胞和小胶质细胞中的TREM2信号传导,以及其他活性。
术语“受试者”和“患者”在本文中可互换使用以指代人类。在一些实施方案中,还提供了治疗其他哺乳动物的方法,这些哺乳动物包括但不限于啮齿类动物、猿猴、猫、犬、马、牛、猪、绵羊、山羊、哺乳类实验动物、哺乳类农场动物、哺乳类运动动物和哺乳类宠物。
如本文所用,“治疗”涵盖对用于人类或其他哺乳动物的疾病的治疗剂的任何施用或应用,并且包括抑制疾病或疾病的进展,抑制或减缓疾病或其进展,遏制或减缓其发展,抑制、降低或减缓疾病的至少一种症状的发展,减缓到疾病发作的时间,预防至少一种疾病症状的发作,减缓到至少一种疾病症状的发作时间,部分地或完全地缓解疾病,或治愈疾病,例如,通过引起退化,或者恢复或修复丧失、缺失或缺陷功能;或者刺激低效过程。术语“抑制(inhibition或inhibit)”是指任何症状或表型特征的减少或停止,或者指该症状或特征的发生率、程度或可能性的降低或停止。
“药用载体”是指本领域常规用于与治疗剂一起使用的无毒固体、半固体或液体填充剂、稀释剂、包封材料、调配助剂或载体,它们一起构成用于向受试者施用的“药物组合物”。药用载体在所采用的剂量和浓度下对接受者是无毒的,并且与调配物的其他成分相容。药用载体适用于所采用的调配物。例如,如果治疗剂待口服施用,则载体可以是凝胶胶囊。如果治疗剂待皮下施用,则载体理想地对皮肤没有刺激性并且不会引起注射部位反应。
本文中的术语“有效量”是指足以产生所需结果的量,该所需结果为诸如如上所述的治疗、抑制或降低。
独特的抗TREM2抗体的开发
本文的公开内容涵盖抗TREM2抗体。在本文的一些实施方案中,抗体具有一组独特的特性。例如,本文中的某些抗体(a)在跨越残基157与158之间的切割位点的表位处特异性地结合至TREM2茎结构域,并且还特异性地结合至由TREM2的残基151至165组成的多肽,(b)不与可溶性TREM2结合,并且因此可能不存在体内可溶性TREM2结合的显著风险,(c)充当TREM2激动剂,并且(d)以例如100-500pM、10-50pM或1-10pM的解离常数特异性地结合至TREM2。
如下文实例部分所述,本文的特定示例性抗体部分地在大鼠抗人TREM2抗体的初始筛选之后获得。据发现,不同于筛选中发现的其他抗体且不同于其他先前描述的抗TREM2抗体,特异性地结合至TREM2的氨基酸151至165区中的结合表位的一组特定的大鼠抗人TREM2抗体具有相对高的亲和力和与可溶性TREM2的结合的缺少两者。该组抗体包括大鼠抗人抗体3.10C2、3.50G1、3.18E5、3.27H7(也称为“3.10C2组抗体”)和3.36F5。(参见图3A至3B,并且还参见图2A至2B和16)。
对重链可变区执行进一步的经TREM2免疫的大鼠免疫库深度测序实验,以获得对TREM2具有更高亲和力的抗体。该实验导致对Para.09重链可变区的鉴定,其与3.10C2组抗体克隆性地无关,并且与先前鉴定的3.10C2组抗体相比,其重链CDR3不同。(参见图4和8B)。Para.09重链可变区与来自先前鉴定的3.10C2组抗体的轻链可变区组合。所得Fab片段对人和食蟹猴TREM2的亲和力约为1-5pM(即1-5E x 10
然后将大鼠抗人抗体人源化。抗体h3.10C2.v1和hPara.09.v2是本文的人源化抗体的实例。(参见图9A至9B和12A至12B)。然后对人源化抗体的轻链框架区进行进一步修饰,例如,以改善特性,诸如表达产量。例如,在轻链框架区的位置58、100和/或104处的特定修饰(例如,I58V、Q100P和/或V104L(如本文所用,命名惯例是“氨基酸-位置-新氨基酸”,即,I58V表示位置58处的氨基酸I更改为氨基酸V))导致人源化抗体不仅保留了起始大鼠抗人抗体的特征,诸如对TREM2茎结构域的高亲和力,而且也以相对较高的产量表达。此类示例性抗体显示在图13A至13B和14A至14B中。如下文实例11和13至17中进一步描述的,例如,本文的抗体是TREM2激动剂并且还在体外和体内展示出许多其他有益的生物学特性。
示例性抗TREM2抗体序列
在一些实施方案中,本公开涵盖一种分离的抗体,其特异性地结合至TREM2,其中该抗体包含重链可变区(VH)和轻链可变区(VL),其中该VH包含:包含SEQ ID NO:1、9、11、19或62CDR-H1;和包含SEQ ID NO:2、10、12、20、55、63、65或73的氨基酸序列的CDR-H2。在一些实施方案中,该VL包含:包含SEQ ID NO:4、27、37、47、57或67的氨基酸序列的CDR-L1;包含SEQ ID NO:5的氨基酸序列的CDR-L2;以及包含SEQ ID NO:6、29、39、49、59或69的氨基酸序列的CDR-L3。在一些实施方案中,VH包含CDR-H3,其包含如下氨基酸序列:X
在一些实施方案中,本公开涵盖一种分离的抗体,其特异性地结合至TREM2,其中该抗体包含:重链可变区(VH),该重链可变区包含:包含SEQ ID NO:1、9、11、19或62的氨基酸序列的CDR-H1;包含SEQ ID NO:2、10、12、20、55、63、65或73的氨基酸序列的CDR-H2:以及包含如下氨基酸序列的CDR-H3:X
在一些情况下,该轻链可变区(VL)包含3.10C2或3.27H7的轻链CDR。例如,抗体轻链可变区可以包含:包含SEQ ID NO:4、27或67的氨基酸序列的CDR-L1;包含SEQ ID NO:5的氨基酸序列的CDR-L2;以及包含SEQ ID NO:6、29或69的氨基酸序列的CDR-L3。在一些情况下,抗体包含3.27H7的轻链CDR,即,包含SEQ ID NO:4的氨基酸序列的CDR-L1;包含SEQ IDNO:5的氨基酸序列的CDR-L2,以及包含SEQ ID NO:6的氨基酸序列的CDR-L3。
在一些情况下,该重链可变区(VH)包含:包含SEQ ID NO:1或9的氨基酸序列的CDR-H1;包含SEQ ID NO:2或10的氨基酸序列的CDR-H2;以及包含SEQ ID NO:3的氨基酸序列的CDR-H3;并且其中该轻链可变区(VL)包含:包含SEQ ID NO:4的氨基酸序列的CDR-L1;包含SEQ ID NO:5的氨基酸序列的CDR-L2,以及包含SEQ ID NO:6的氨基酸序列的CDR-L3。在其他情况下,该重链可变区(VH)包含:包含SEQ ID NO:11或19的氨基酸序列的CDR-H1;包含SEQ ID NO:12或20的氨基酸序列的CDR-H2;以及包含SEQ ID NO:13的氨基酸序列的CDR-H3;并且其中该轻链可变区(VL)包含:包含SEQ ID NO:4的氨基酸序列的CDR-L1;包含SEQID NO:5的氨基酸序列的CDR-L2,以及包含SEQ ID NO:6的氨基酸序列的CDR-L3。
在一些实施方案中,本文的抗体可以包含与图3B中所示的序列的重链可变区氨基酸序列至少90%、95%、97%或99%相同的重链可变区氨基酸序列。在一些实施方案中,本文的抗体可以包含与图6B中所示的序列的重链可变区氨基酸序列至少90%、95%、97%或99%相同的重链可变区氨基酸序列。在一些实施方案中,本文的抗体可以包含与图8B中所示的序列的重链可变区氨基酸序列至少90%、95%、97%或99%相同的重链可变区氨基酸序列。在一些实施方案中,本文的抗体可以包含与图9B中所示的序列的重链可变区氨基酸序列至少90%、95%、97%或99%相同的重链可变区氨基酸序列。在一些实施方案中,本文的抗体可以包含与图12B中所示的序列的重链可变区氨基酸序列至少90%、95%、97%或99%相同的重链可变区氨基酸序列。在一些实施方案中,本文的抗体可以包含与图13B中所示的序列的重链可变区氨基酸序列至少90%、95%、97%或99%相同的重链可变区氨基酸序列。在一些实施方案中,本文的抗体可以包含与图14B中所示的序列的重链可变区氨基酸序列至少90%、95%、97%或99%相同的重链可变区氨基酸序列。在一些实施方案中,抗体框架区可以是嵌合的或人源化的。
在一些情况下,该抗体包含与SEQ ID NO:7或17的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VH。在一些实施方案中,该抗体包含与SEQ ID NO:7、17、30、40、50、60、70、76、77、78、81、82、83、133、135、137、139、146、148、150或152的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VH。在一些实施方案中,该抗体包含与SEQID NO:7、17、133、135、137、139、146、148、150或152的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VH。在其他情况下,该抗体包含VH,该VH包含SEQ ID NO:7、17、30、40、50、60、70、76、77、78、81、82、83、133、135、137、139、146、148、150或152的氨基酸序列。在一些实施方案中,该抗体包含VH,该VH包含SEQ ID NO:7、17、133、135、137、139、146、148、150或152的氨基酸序列。
在一些实施方案中,抗体轻链可变区包含与图3A中所示的序列的氨基酸序列至少90%、95%、97%或99%相同的氨基酸序列。在一些实施方案中,抗体轻链可变区包含与图6A中所示的序列的氨基酸序列至少90%、95%、97%或99%相同的氨基酸序列。在一些实施方案中,抗体轻链可变区包含与图8A中所示的序列的氨基酸序列至少90%、95%、97%或99%相同的氨基酸序列。在一些实施方案中,抗体轻链可变区包含与图9A中所示的序列的氨基酸序列至少90%、95%、97%或99%相同的氨基酸序列。在一些实施方案中,抗体轻链可变区包含与图12A中所示的序列的氨基酸序列至少90%、95%、97%或99%相同的氨基酸序列。在一些实施方案中,抗体轻链可变区包含与图13A中所示的序列的氨基酸序列至少90%、95%、97%或99%相同的氨基酸序列。在一些实施方案中,抗体轻链可变区包含与图14A中所示的序列的氨基酸序列至少90%、95%、97%或99%相同的氨基酸序列。在一些实施方案中,轻链可变区框架是人源化的或嵌合的。
在一些实施方案中,该抗体包含与SEQ ID NO:8或18的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VL。在一些实施方案中,该抗体包含与SEQ ID NO:8、18、31、41、51、61、71、79、80、84、85、132、134、136、138、145、147、149或151的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VL。在一些实施方案中,该抗体包含与SEQ IDNO:8、18、132、134、136、138、145、147、149或151的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VL。在一些实施方案中,该抗体包含VL,该VL包含SEQ ID NO:8或18的氨基酸序列。在一些实施方案中,该抗体包含VL,该VL包含SEQ ID NO:8、18、31、41、51、61、71、79、80、84、85、132、134、136、138、145、147、149或151的氨基酸序列。在一些实施方案中,该抗体包含VL,该VH包含SEQ ID NO:8、18、132、134、136、138、145、147、149或151的氨基酸序列。
在一些实施方案中,该抗体包含抗体3.10C2、3.50G1、3.18E5、3.36F5、3.27H7或Para.09的重链CDR和抗体3.27H7的轻链CDR。在一些实施方案中,该抗体包含抗体3.10C2或Para.09的重链CDR和抗体3.27H7的轻链CDR。(参见图3A至3B)。在一些实施方案中,抗体是人源化的或嵌合的。
在一些实施方案中,抗体包含以下CDR组中的一者:
(a)重链可变区(VH),该重链可变区包含:包含SEQ ID NO:1的氨基酸序列的CDR-H1,包含SEQ ID NO:2的氨基酸序列的CDR-H2,以及包含SEQ ID NO:3的氨基酸序列的CDR-H3;以及轻链可变区(VL),该轻链可变区包含:包含SEQ ID NO:4的氨基酸序列的CDR-L1,包含SEQ ID NO:5的氨基酸序列的CDR-L2,以及包含SEQ ID NO:6的氨基酸序列的CDR-L3;
(b)重链可变区(VH),该重链可变区包含:包含SEQ ID NO:9的氨基酸序列的CDR-H1,包含SEQ ID NO:10的氨基酸序列的CDR-H2,以及包含SEQ ID NO:3的氨基酸序列的CDR-H3;以及轻链可变区(VL),该轻链可变区包含:包含SEQ ID NO:4的氨基酸序列的CDR-L1,包含SEQ ID NO:5的氨基酸序列的CDR-L2,以及包含SEQ ID NO:6的氨基酸序列的CDR-L3;
(c)重链可变区(VH),该重链可变区包含:包含SEQ ID NO:11的氨基酸序列的CDR-H1,包含SEQ ID NO:12的氨基酸序列的CDR-H2,以及包含SEQ ID NO:13的氨基酸序列的CDR-H3;以及轻链可变区(VL),该轻链可变区包含:包含SEQ ID NO:14的氨基酸序列的CDR-L1,包含SEQ ID NO:15的氨基酸序列的CDR-L2,以及包含SEQ ID NO:16的氨基酸序列的CDR-L3;
(d)重链可变区(VH),该重链可变区包含:包含SEQ ID NO:19的氨基酸序列的CDR-H1,包含SEQ ID NO:20的氨基酸序列的CDR-H2,以及包含SEQ ID NO:13的氨基酸序列的CDR-H3;以及轻链可变区(VL),该轻链可变区包含:包含SEQ ID NO:14的氨基酸序列的CDR-L1,包含SEQ ID NO:15的氨基酸序列的CDR-L2,以及包含SEQ ID NO:16的氨基酸序列的CDR-L3;
(e)重链可变区(VH),该重链可变区包含:包含SEQ ID NO:24的氨基酸序列的CDR-H1,包含SEQ ID NO:25的氨基酸序列的CDR-H2,以及包含SEQ ID NO:26的氨基酸序列的CDR-H3;以及轻链可变区(VL),该轻链可变区包含:包含SEQ ID NO:27的氨基酸序列的CDR-L1,包含SEQ ID NO:28的氨基酸序列的CDR-L2,以及包含SEQ ID NO:29的氨基酸序列的CDR-L3;
(f)重链可变区(VH),该重链可变区包含:包含SEQ ID NO:34的氨基酸序列的CDR-H1,包含SEQ ID NO:35的氨基酸序列的CDR-H2,以及包含SEQ ID NO:36的氨基酸序列的CDR-H3;以及轻链可变区(VL),该轻链可变区包含:包含SEQ ID NO:37的氨基酸序列的CDR-L1,包含SEQ ID NO:38的氨基酸序列的CDR-L2,以及包含SEQ ID NO:39的氨基酸序列的CDR-L3;
(g)重链可变区(VH),该重链可变区包含:包含SEQ ID NO:44的氨基酸序列的CDR-H1,包含SEQ ID NO:45的氨基酸序列的CDR-H2,以及包含SEQ ID NO:46的氨基酸序列的CDR-H3;以及轻链可变区(VL),该轻链可变区包含:包含SEQ ID NO:47的氨基酸序列的CDR-L1,包含SEQ ID NO:48的氨基酸序列的CDR-L2,以及包含SEQ ID NO:49的氨基酸序列的CDR-L3;
(h)重链可变区(VH),该重链可变区包含:包含SEQ ID NO:54的氨基酸序列的CDR-H1,包含SEQ ID NO:55的氨基酸序列的CDR-H2,以及包含SEQ ID NO:56的氨基酸序列的CDR-H3;以及轻链可变区(VL),该轻链可变区包含:包含SEQ ID NO:57的氨基酸序列的CDR-L1,包含SEQ ID NO:58的氨基酸序列的CDR-L2,以及包含SEQ ID NO:59的氨基酸序列的CDR-L3;或者
(i)重链可变区(VH),该重链可变区包含:包含SEQ ID NO:64的氨基酸序列的CDR-H1,包含SEQ ID NO:65的氨基酸序列的CDR-H2,以及包含SEQ ID NO:66的氨基酸序列的CDR-H3;以及轻链可变区(VL),该轻链可变区包含:包含SEQ ID NO:67的氨基酸序列的CDR-L1,包含SEQ ID NO:68的氨基酸序列的CDR-L2,以及包含SEQ ID NO:69的氨基酸序列的CDR-L3。CDR(a)至(i)在随后的四个段落中也有提及。
在一些实施方案中,抗体:
(a)包含来自上一段落的(a)或(b)的CDR,并且进一步包含与SEQ ID NO:7的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VH;
(c)包含来自上一段落的(c)或(d)的CDR,并且进一步包含与SEQ ID NO:17的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VH;
(e)包含来自上一段落的(e)的CDR,并且进一步包含与SEQ ID NO:30的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VH;
(f)包含来自上一段落的(f)的CDR,并且进一步包含与SEQ ID NO:40的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VH;
(g)包含来自上一段落的(g)的CDR,并且进一步包含与SEQ ID NO:50的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VH;
(h)包含来自上一段落的(h)的CDR,并且进一步包含与SEQ ID NO:60的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VH;或
(i)包含来自上一段落的(i)的CDR,并且进一步包含与SEQ ID NO:70的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VH在一些实施方案中,抗体:
(a)包含以上(a)或(b)的CDR,并且进一步包含与SEQ ID NO:8的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VL;
(c)包含以上(c)或(d)的CDR,并且进一步包含与SEQ ID NO:18的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VL;
(e)包含以上(e)的CDR,并且进一步包含与SEQ ID NO:31的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VL;
(f)包含以上(f)的CDR,并且进一步包含与SEQ ID NO:41的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VL;
(g)包含以上(g)的CDR,并且进一步包含与SEQ ID NO:51的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VL;
(h)包含以上(h)的CDR,并且进一步包含与SEQ ID NO:61的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VL;或
(i)包含以上(i)的CDR,并且进一步包含与SEQ ID NO:71的氨基酸序列至少90%、至少95%、至少97%或至少99%相同的VL。
在一些情况下,该抗体:
(a)包含(a)的CDR,并且进一步包含VH,该VH包含SEQ ID NO:7的氨基酸序列;
(b)包含(b)的CDR,并且进一步包含VH,该VH包含SEQ ID NO:7的氨基酸序列;
(c)包含(c)的CDR,并且进一步包含VH,该VH包含SEQ ID NO:17的氨基酸序列;
(d)包含(d)的CDR,并且进一步包含VH,该VH包含SEQ ID NO:17的氨基酸序列;
(e)包含(e)的CDR,并且进一步包含VH,该VH包含SEQ ID NO:30的氨基酸序列的;
(f)包含(f)的CDR,并且进一步包含VH,该VH包含SEQ ID NO:40的氨基酸序列;
(g)包含(g)的CDR,并且进一步包含VH,该VH包含SEQ ID NO:50的氨基酸序列;
(h)包含(h)的CDR,并且进一步包含VH,该VH包含SEQ ID NO:60的氨基酸序列;或
(i)包含(i)的CDR,并且进一步包含VH,该VH包含SEQ ID NO:70的氨基酸序列
在一些情况下,该抗体:
(a)包含(a)的CDR,并且进一步包含VL,该VL包含SEQ ID NO:8的氨基酸序列;
(b)包含(b)的CDR,并且进一步包含VL,该VL包含SEQ ID NO:8的氨基酸序列;
(c)包含(c)的CDR,并且进一步包含VL,该VL包含SEQ ID NO:18的氨基酸序列;
(d)包含(d)的CDR,并且进一步包含VL,该VL包含SEQ ID NO:18的氨基酸序列;
(e)包含(e)的CDR,并且进一步包含VL,该VL包含SEQ ID NO:31的氨基酸序列;
(f)包含(f)的CDR,并且进一步包含VL,该VL包含SEQ ID NO:41的氨基酸序列;
(g)包含(g)的CDR,并且进一步包含VL,该VL包含SEQ ID NO:51的氨基酸序列;
(h)包含(h)的CDR,并且进一步包含VL,该VL包含SEQ ID NO:61的氨基酸序列;或
(i)包含(i)的CDR,并且进一步包含VL,该VL包含SEQ ID NO:71的氨基酸序列。
如上所述,在一些实施方案中,VH和/或VL是人源化的。在一些实施方案中,抗体包含如图6A至6B所示的轻链和重链,例如,将3.10C2L1与3.10C2H1、H3或H5组合,或将3.10C2L5与3.10C2H1、H3或H5组合。在一些实施方案中,抗体包含如图8A至8B所示的轻链和重链,例如,将3.27H7L1与Para.09H1、H5或H7组合,或将3.27H7L6与Para.09H1、H5或H7组合。在一些实施方案中,该抗体包含VH,该VH包含:包含SEQ ID NO:1或11的氨基酸序列的CDR-H1;包含SEQ ID NO:2或12的氨基酸序列的CDR-H2;以及包含如下氨基酸序列的CDR-H3:X
在一些实施方案中,如上所述,该抗体包含:VH,其包含SEQ ID NO:7的氨基酸序列;以及VL,其包含SEQ ID NO:8的氨基酸序列。(参见图9A至9B;即h3.10C2.v1)。在一些实施方案中,如上所述,该抗体包含:VH,其包含SEQ ID NO:17的氨基酸序列;以及VL,其包含SEQ ID NO:18的氨基酸序列。(参见图10A至10B;即hPara.09.v2)。在上述任何实施方案中,抗体可以是人源化的或嵌合的(即,具有人源化的或嵌合的框架区)。
在一些实施方案中,抗体的框架区在人源化后经进一步修饰,例如以改善特性,诸如表达产量。在一些实施方案中,抗体包含根据SEQ ID NO:18的轻链,但在框架区中具有1至5个残基处的取代。在一些实施方案中,抗体包含根据SEQ ID NO:18的轻链,但在框架区中的I58、Q100和V104中的一者或多者处具有取代,诸如I58V、Q100P和/或V104L。在一些实施方案中,抗体包含根据SEQ ID NO:18的轻链,但具有Q100P取代、I58V和Q100P取代两者、或Q100P和V104L取代两者。(参见,例如,图13A和14A)。在一些此类实施方案中,抗体包含以下VH和VL组中的一者:(a)SEQ ID No:133和132(抗体hPara.09.v2 Q100P);(b)SEQ ID No:135和134(抗体hPara.09.v2 I58V/Q100P);(c)SEQ ID No:137和136(抗体hPara.09.v2Q100P/V104L);(d)SEQ ID No:146和145(抗体h3.10C2.v1 Q100P);(e)SEQ ID No:148和147(抗体h3.10C2.v1I58V/Q100P);或(f)SEQ ID No:150和149(抗体h3.10C2.v1Q100P/V104L)。在其他实施方案中,抗体包含SEQ ID No:139和138的VH和VL(h3.10C2.H1-3.10C2.L10)。在又其他实施方案中,抗体包含SEQ ID NO:152和151的VH和VL(hPara.09.H5-3.10C2.L10)。
在一些实施方案中,该抗体包含VL,与人IGKV2-28*01种系相比,该VL在框架区中包含1至10个氨基酸取代(参见图8A,其示出了IGKV2-28*01的Kabat/Chothia框架区和CDR区)。在一些情况下,该抗体包含VL,与人IGKV2-28*01相比,该VL在框架区中包含1至5个氨基酸取代。在一些实施方案中,这些氨基酸取代包含Q100P或V104L或Q100P和V104L两者。在一些此类情况下,VL在位置58处包含Val,而在其他情况下,VL在位置58处包含Ile(例如,与IGKV2-28*01相比,Q100P和58V或Q100P和V58I)。
在本文的任何实施方案中,该抗体可以为抗体片段,诸如Fv、单链Fv(scFv)、Fab、Fab'或(Fab')
在一些实施方案中,该抗体包含重链,该重链包含SEQ ID NO:144的氨基酸序列或由该氨基酸序列组成。在一些实施方案中,该抗体包含轻链,该轻链包含SEQ ID NO:176的氨基酸序列或由该氨基酸序列组成。在一些实施方案中,该抗体包含:重链,其包含SEQ IDNO:144的氨基酸序列或由该氨基酸序列组成;以及轻链,其包含SEQ ID NO:176的氨基酸序列或由该氨基酸序列组成。在一些实施方案中,该抗体包含:重链,其包含SEQ ID NO:144的氨基酸序列或由该氨基酸序列组成但缺少SEQ ID NO:144的C末端赖氨酸或缺少SEQ IDNO:144的C末端甘氨酸和赖氨酸;以及轻链,其包含SEQ ID NO:176的氨基酸序列或由该氨基酸序列组成。在一些实施方案中,该抗体包含重链,该重链包含与SEQ ID NO:144的氨基酸序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的氨基酸序列。在一些实施方案中,该抗体包含轻链,该轻链包含与SEQ ID NO:176的氨基酸序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的氨基酸序列。在一些实施方案中,该抗体包含:重链,其包含与SEQ ID NO:144的氨基酸序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的氨基酸序列;以及轻链,其包含与SEQ ID NO:176的氨基酸序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的氨基酸序列。在一些实施方案中,该抗体包含:重链,其包含SEQ ID NO:144的氨基酸序列或由该氨基酸序列组成,任选地没有C末端赖氨酸或甘氨酸-赖氨酸;以及轻链,其包含与SEQ IDNO:176的氨基酸序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的氨基酸序列。在一些实施方案中,该抗体包含:重链,其包含与SEQ ID NO:144的氨基酸序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的氨基酸序列;以及轻链,其包含SEQ ID NO:176的氨基酸序列或由该氨基酸序列组成。在一些实施方案中,该抗体包含重链,该重链包含与SEQ ID NO:144的氨基酸序列相比具有1、2、3、4或5个氨基酸取代、插入或缺失的氨基酸序列。在一些实施方案中,该抗体包含轻链,该轻链包含与SEQ IDNO:176的氨基酸序列相比具有1、2、3、4或5个氨基酸取代、插入或缺失的氨基酸序列。在一些实施方案中,该抗体包含:重链,其包含与SEQ ID NO:144的氨基酸序列相比具有1、2、3、4或5个氨基酸取代、插入或缺失的氨基酸序列;以及轻链,其包含与SEQ ID NO:176的氨基酸序列相比具有1、2、3、4或5个氨基酸取代、插入或缺失的氨基酸序列。在一些实施方案中,该抗体包含:重链,其包含SEQ ID NO:144的氨基酸序列或由该氨基酸序列组成,任选地没有C末端赖氨酸或甘氨酸-赖氨酸;以及轻链,其包含与SEQ ID NO:176的氨基酸序列相比具有1、2、3、4或5个氨基酸取代、插入或缺失的氨基酸序列。在一些实施方案中,该抗体包含:重链,其包含与SEQ ID NO:144的氨基酸序列相比具有1、2、3、4或5个氨基酸取代、插入或缺失的氨基酸序列;以及轻链,其包含SEQ ID NO:176的氨基酸序列或由该氨基酸序列组成。在任何上述允许SEQ ID NO:144和/或SEQ ID NO:176中的序列变异的情况下,在一些实施方案中,此类序列变异限于抗体框架和/或恒定区,使得抗体还包含SEQ ID NO:11、12和13或替代性地19、20和13的重链CDR,和/或SEQ ID NO:14、15和16的轻链CDR。在其他实施方案中,SEQ ID NO:144和/或SEQ ID NO:176中的此类序列变异限于抗体恒定区,使得抗体还包含SEQ ID NO:17和/或18。
在一些情况下,抗体可以是双特异性的或多特异性的。在一些情况下,抗体可以直接或通过接头缀合至另一个分子,诸如标记或药物。
在一些情况下,抗体具有完整的效应子功能。在一些情况下,抗体具有Fc区,该Fc区具有降低的效应子功能。在其他情况下,抗体具有Fc区,该Fc区为无效应子的。例如,抗体治疗剂的Fc区可以结合至补体成分C1q和Fc-γ受体(FcγR),以引发细胞效应子反应,诸如吞噬作用、细胞因子释放和活性氧物质的产生。(参见,例如,X.Wang等人,Protein&Cell 9:63-73(2018);S.B.Mkaddem等人,Frontiers in Immunology,可在https://doi.org/10.3389/fimmu.2019.00811(2019)获得)。这些途径的过度活化可能对CNS有害,特别是在病理情况下。(D.J.DiSabato等人,J.Neurochemistry 139(S2):136-153(2016))。临床上,针对淀粉样蛋白β的抗体治疗剂具有完整的效应子功能并与结合至淀粉样蛋白β聚集体,大大增加了潜在有害副作用ARIA(淀粉样蛋白相关成像异常)的发生率,而尚未观察到仅结合至单体形式的淀粉样蛋白β的抗体或具有降低的效应子功能的抗体所致的ARIA。(M.Filippi等人,JAMA Neurol.79(3):291-304(2022))。在一些实施方案中,例如如本文实例和附图中所述,本文的具有降低的效应子功能的抗体(诸如包含具有LALAPG或N297G突变的人IgG1重链恒定区,如上所述)足以通过TREM2刺激在CNS中引发小胶质细胞反应。
示例性抗体变体、片段和恒定区
在进一步的方面,本文的特异性地结合至TREM2的抗体可单独或组合地合并入任何特征,如以下部分中所述。
抗体片段
在某些实施方案中,本文提供的抗体是抗体片段。抗体片段包括但不限于Fab、Fab’、Fab’-SH、F(ab’)
双体抗体是具有两个抗原结合位点的抗体片段,其可以是二价或双特异性的。参见,例如,EP 404,097;WO 1993/01161;Hudson等人,Nat.Med.9:129-134(2003);和Hollinger等人,Proc.Natl.Acad.Sci.USA 90:6444-6448(1993)。关于三体抗体和四体抗体的描述也可参见Hudson等人,Nat.Med.9:129-134(2003)。
单结构域抗体为包含抗体的全部或部分重链可变结构域或者全部或部分轻链可变结构域的抗体片段。在某些实施方案中,单结构域抗体是人单结构域抗体(Domantis,Inc.,Waltham,MA;参见,例如,美国专利号6,248,516)。
抗体片段可以通过各种技术制备,包括但不限于完整抗体的蛋白水解消化以及由重组宿主细胞(例如,大肠杆菌或噬菌体)产生,如本文所述。
嵌合和人源化抗体
在某些实施方案中,本文提供的抗体是嵌合抗体。某些嵌合抗体如以下文献所述:例如美国专利号第4,816,567号和Morrison等人,Proc.Natl.Acad.Sci.USA,81:6851-6855(1984)。在一个实例中,嵌合抗体包括非人可变区(例如,来源于小鼠、大鼠、仓鼠、兔或非人灵长类动物(诸如猴)的可变区)和人恒定区。在另一个实例中,嵌合抗体为其中类别或亚类已经与亲本抗体的类别或亚类改变的“类别转换”抗体。嵌合抗体包括其抗原结合片段。
在某些实施方案中,嵌合抗体是人源化抗体。通常,将非人抗体人源化以减少对人的免疫原性,同时保留亲本非人抗体的特异性和亲和力。通常,人源化抗体包括一个或多个可变结构域,其中HVR(例如(CDR(或其部分))来源于非人抗体,而FR(或其部分)来源于人抗体序列。人源化抗体任选地还将包含人恒定区的至少一部分。在一些实施方案中,人源化抗体中的一些FR残基被来自非人抗体(例如,HVR残基所来源于的抗体)的相应残基取代,例如,以恢复或改善抗体特异性或亲和力。
综述了人源化抗体及其制备方法,如以下文献中所述:例如,Almagro和Fransson,Front.Biosci.13:1619-1633(2008),又如以下文献中所述:例如,Riechmann等人,Nature332:323-329(1988);Queen等人,Proc.Nat’lAcad.Sci.USA 86:10029-10033(1989);美国专利号5,821,337、7,527,791、6,982,321和7,087,409;Kashmiri等人,Methods 36:25-34(2005)(具体描述了决定区(SDR)接枝);Padlan,Mol.Immunol.28:489-498(1991)(描述“表面再塑”);Dall’Acqua等人,Methods 36:43-60(2005)(描述“FR改组”);和Osbourn等人,Methods 36:61-68(2005)和Klimka等人,Br.J.Cancer,83:252-260(2000)(描述FR改组的“导向选择”方法)。
可用于人源化的人框架区包括但不限于:使用“最佳匹配”方法选择的框架区(参见,例如,Sims等人J.Immunol.151:2296(1993));源自轻链或重链可变区特定亚组的人抗体的共有序列的框架区(参见,例如,Carter等人Pro c.Natl.Acad.Sci.USA,89:4285(1992);和Presta等人J.Immunol.,151:2623(1993));人成熟(体细胞突变)框架区或人种系框架区(参见,例如,Almagro和Fransson,Front.Biosci.13:1619-1633(2008));和来自筛选FR文库的框架区(参见,例如,Baca等人,J.Biol.Chem.272:10678-10684(1997)和Rosok等人,J.Biol.Chem.271:22611-22618(1996))。
在一些实施方案中,人源化抗体可包含人IgG1、IgG2、IgG3或IgG4重链恒定区。
双特异性或多特异性抗体
在某些实施方案中,本文提供的抗体为多特异性抗体,例如,双特异性抗体。多特异性抗体是对至少两个不同位点具有结合特异性的单克隆抗体。在某些实施方案中,结合特异性中的一者为TREM2,并且另一者针对任何其他抗原。在某些实施方案中,双特异性抗体可与TREM2的两个不同的表位结合。双特异性抗体还可用于定位药物(诸如细胞毒性剂)或将检测标记定位到表达TREM2的细胞。在一些实施方案中,多特异性抗体(例如,双特异性抗体)包含第一可变结构域,该第一可变结构域包含如本文所述的CDR或可变区。可以将双特异性抗体制成全长抗体或抗体片段。
用于制备多特异性抗体的技术包括但不限于,具有不同特异性的两个免疫球蛋白重链-轻链对的重组共表达(参见Milstein和Cuello,Nature 305:537(1983))、WO 93/08829和Traunecker等人,EMBO J.10:3655(1991))和“杵臼(knob-in-hole)”工程化(参见,例如,美国专利号5,731,168)。多特异性抗体也可以通过以下方法制备:工程静电控制效应来制造抗体Fc-异二聚体分子(WO 2009/089004A1);交联两个或多个抗体或片段(参见,例如,美国专利号4,676,980和Brennan等人,Science,229:81(1985));使用亮氨酸拉链产生双特异性抗体(参见,例如,Kostelny等人,J.Imm“nol.,1”8(5):1547-1553(1992));使用“双抗体”技术制备双特异性抗体片段(参见,例如,Hollinger等人,Proc.Natl.Acad.Sci.USA,90:6444-6448(1993));以及使用单链Fv(sFv)二聚体(参见,例如Gruber等人,J.Immunol.,152:5368(1994));以及按照例如Tutt等人J.Immunol.147:60(1991)所述的方法制备三特异性抗体。
本文还包括具有三个或更多个功能性抗原结合位点的工程化抗体,包括“章鱼抗体”(参见,例如US2006/0025576)。
进一步的抗体变体
在某些实施方案中,考虑了本文提供的抗体的氨基酸序列变体。例如,可能期望改善抗体的结合亲和力和/或其他生物特性。抗体的氨基酸序列变体可以通过向编码抗体的核苷酸序列中引入适当的修饰或通过肽合成来制备。此类修饰包括例如抗体氨基酸序列内残基的缺失、和/或插入和/或取代。可以进行缺失、插入和取代的任何组合以实现最终构建体,前提条件是最终构建体具有期望特征,例如,抗原结合。所生成的人源化变体的具体实例描述于例如本文的图6A至6B、8A至8B、9A至9B和12A至12B中。
取代、插入和删除性变体
在某些实施方案中,提供了具有一或多个氨基酸取代的抗体变体。用于取代诱变的目的位点包括HVR和FR。保守取代显示在表A的“优选取代”标题下。更多实质性改变提供于表A中的“示例性取代”标题下,并且在下文参考氨基酸侧链类别进行了进一步描述。可以将氨基酸取代引入所关注抗体中,并对产物进行所需活性(例如,保留/改善的抗原结合、降低的免疫原性、或增加或降低的ADCC或CDC活性)筛选。
表A
可根据共同的侧链特性将氨基酸分组:
(1)疏水性:正亮氨酸、Met、Ala、Val、Leu、Ile;
(2)中性亲水性:Cys、Ser、Thr、Asn、Gln;
(3)酸性:Asp、Glu;
(4)碱性:His、Lys、Arg;
(5)影响链取向的残基:Gly、Pro;
(6)芳香族:Trp、Tyr、Phe。
非保守性取代将需要用这些类别中的一个的成员交换另一类别。
一种类型的取代变体涉及取代亲本抗体(例如,人源化抗体或人抗体)的一个或多个高可变区残基。通常,为进一步研究而选择的一种或多种所得变体相对于亲本抗体将在某些生物特性(例如,提高的亲和力、降低的免疫原性)上具有修饰(例如,改善)和/或将基本上保留亲本抗体的某些生物特性。示例性取代变体是亲和力成熟抗体,其可例如使用诸如本文所述的那些基于噬菌体展示的亲和力成熟技术方便地生成。简而言之,将一个或多个HVR残基突变并且将变体抗体展示在噬菌体上并针对特定生物活性(例如结合亲和力)进行筛选。
可以在HVR中进行改变(例如,取代),例如,以改善抗体亲和力。这些改变可以在HVR“热点”中进行,即,在体细胞成熟期间经历高频突变的由密码子编码的残基(参见,例如,Chowdhury,Methods Mol.Biol.207:179-196(2008)),和/或与抗原接触的残基,并测试所得变体VH或VL的结合亲和力。通过构建并自二级文库重新选择而实现的亲和力成熟已被例如Hoogenboom等人在Methods in Molecular Biology 178:1-37(O'Brien等人编,HumanPress,Totowa,NJ,(2001))中进行描述。在亲和力成熟的一些实施方案中,通过多种方法(例如,易错PCR、链改组或寡核苷酸定向突变)中的任一者将多样性引入出于成熟目的而挑选的可变基因中。然后创建一个二级文库。随后对该文库进行筛选以鉴别具有所需亲和力的任何抗体变体。引入多样性的另一种方法涉及HVR定向方法,其中将若干HVR残基(例如,每次4至6个残基)随机化。参与抗原结合的HVR残基可例如使用丙氨酸扫描突变或建模来特异性地鉴别。具体而言,常常靶向CDR-H3和CDR-L3。
在某些实施方案中,取代、插入或缺失可发生在一个或多个HVR内,只要此类改变基本上不降低抗体的抗原结合能力即可。例如,可在HVR中进行基本上不降低结合亲和力的保守性改变(例如,如本文提供的保守性取代)。此类改变可以在HVR的抗原接触残基之外。在上文提供的变体VH和VL序列的某些实施方案中,每个HVR保持不变,或包含不超过一个、两个或三个氨基酸取代。
可用于鉴别可被靶向诱变的抗体残基或区域的方法称作“丙氨酸扫描诱变”,如Cunningham和Wells(1989)Science,244:1081-1085所描述。在此方法中,鉴别残基或一组靶残基(例如,带电残基,诸如Arg、Asp、His、Lys和Glu)并用中性或带负电的氨基酸(例如,丙氨酸或多丙氨酸)置换以确定抗体与抗原的相互作用是否受到影响。可在对初始取代展示功能敏感性的氨基酸位置引入其他取代。可替代地或另外地,利用抗原-抗体复合物的晶体结构鉴定抗体与抗原之间的接触点。可靶向或消除作为取代的候选的此类接触残基和相邻残基。可筛选变体以确定它们是否具备期望的特性。
氨基酸序列插入包括长度范围为一个残基至含有一百个或更多个残基的多肽的氨基和/或羧基末端融合,以及一个或多个氨基酸残基的序列内插入。末端插入的实例包括具有N末端甲硫氨酰残基的抗体。抗体分子的其他插入变体包括与增加抗体的血清半衰期的酶(例如对于ADEPT)或多肽的抗体的N末端或C末端的融合。
糖基化变体
Fc区糖基化的改变,以及某些Fc区突变,可以通过增强或降低效应子功能来影响抗体的效应子功能,或者在一些情况下可能使抗体无效应子。
在某些实施方案中,改变本文提供的抗体以增加或降低抗体糖基化的程度。糖基化位点向抗体的添加或缺失可通过改变氨基酸序列以产生或去除一个或多个糖基化位点而方便地实现。
当抗体包含Fc区时,附接于其上的碳水化合物可以被改变。由哺乳动物细胞产生的天然抗体通常包含支链的双触角寡糖,该双触角寡糖通常通过N-键合附接至Fc区的CH2结构域的Asn297。参见,例如,Wright等人TIBTECH 15:26-32(1997)。寡糖可包括各种碳水化合物,例如,甘露糖、N-乙酰基葡糖胺(GlcNAc)、半乳糖和唾液酸,以及附接至双触角寡糖结构的“主干”中的GlcNAc的岩藻糖。在一些实施方案中,可以对本发明的抗体中的寡糖进行修饰,以便产生具有某些改善的特性的抗体变体。
在一方面,可以修饰抗体以降低或消除Asn297处的糖基化,诸如通过将该残基突变为甘氨酸或另一种氨基酸(N297G)。在其他情况下,可以修饰Fc区中的其他残基以降低ADCC活性和/或CDC活性或降低或修饰Fc-γ受体结合。
在另一个实施方案中,提供了抗体变体,其具有缺少附接(直接或间接)至Fc区的岩藻糖的碳水化合物结构。例如,此类抗体中岩藻糖的含量可以为1%至80%、1%至65%、5%至65%或20%至40%。岩藻糖的量为通过计算相对于通过MALDI-TOF质谱测得的与Asn297附接的所有糖结构(例如,复合、杂合和高甘露糖结构)的总和,糖链中在Asn297处的岩藻糖的平均量,确定,如WO 2008/077546中所述。Asn297是指位于Fc区中约位置297处的天冬酰胺残基(Fc区残基的Eu编号);然而,由于抗体中的微小序列变化,Asn297也可以位于位置297上游或下游大约±3个氨基酸处,即,在位置294与300(EU编号)之间。此类岩藻糖基化变体可具有改善的ADCC功能。参见,例如,美国专利公开号US 2003/0157108(Presta,L.);US2004/0093621(Kyowa Hakko Kogyo Co.,Ltd)。有关“去岩藻糖化”或“岩藻糖缺陷型”抗体变体的出版物的实例包括:US2003/0157108;WO 2000/61739;WO 2001/29246;US 2003/0115614;US2002/0164328;US2004/0093621;US2004/0132140;US2004/0110704;US2004/0110282;US2004/0109865;WO 2003/085119;WO 2003/084570;WO 2005/035586;WO 2005/035778;WO2005/053742;WO2002/031140;Okazaki等人J.Mol.Biol.336:1239-1249(2004);Yamane-Ohnuki等人Biotech.Bioeng.87:614(2004)。能够产生去岩藻糖基化抗体的细胞系的实例包括缺乏蛋白质岩藻糖基化的Lec13 CHO细胞(Ripka等人Arch.Biochem.Biophys.249:533-545(1986);美国专利申请号US2003/0157108,Presta,L;以及WO 2004/056312 A1,Adams等人,尤其在实例11),以及敲除细胞系,诸如α-1,6-岩藻糖基转移酶基因、FUT8、敲除CHO细胞(参见,例如,Yamane-Ohnuki等人Biotech.Bioeng.87:614(2004);Kanda,Y.等人,Biotechnol.Bioeng.,94(4):680-688(2006);以及WO2003/085107)。在一些实施方案中,抗体可具有人IgG1、IgG2、IgG3或IgG4重链恒定区,例如,包含在Asn297(EU编号)处的突变以降低岩藻糖基化或替代性地消除糖基化。在一些实施方案中,抗体可具有Asn297Ala或Asn297Gly突变。
抗体变体进一步被提供有二等分的寡糖,例如,其中附接至抗体的Fc区的双触角型寡糖被GlcNAc二等分。此类抗体变体可具有减少的岩藻糖基化和/或改善的ADCC功能。此类抗体变体的实例描述于,例如,WO 2003/011878(Jean-Mairet等人);美国专利号6,602,684(Umana等人);和US2005/0123546(Umana等人)中。还提供了在附接至Fc区的寡糖中具有至少一个半乳糖残基的抗体变体。这样的抗体变体可以具有改善的CDC功能。此类抗体变体描述于例如WO 1997/30087(Patel等人);WO 1998/58964(Raju,S.);以及WO 1999/22764(Raju,S.)中。
Fc区变体
在某些实施方案中,一个或多个氨基酸修饰可引入本文提供的抗体的Fc区中,从而生成Fc区变体。Fc区变体可包含人Fc区序列(例如,人IgG1、IgG2、IgG3或IgG4 Fc区),其在一个或多个氨基酸位置处包含氨基酸修饰(例如,取代)。
在某些实施方案中,本发明考虑了具有一些但不是全部效应子功能(即以产生具有降低的效应子功能的抗体或者以产生无效应子抗体)的抗体变体,这可使其成为应用的理想候选物,在这些应用中,抗体的体内半衰期很重要而某些效应子功能(诸如补体和ADCC)为不必要的或有害的。可以进行体外和/或体内细胞毒性测定,以确认CDC和/或ADCC活性的降低/耗尽。例如,可以进行Fc受体(FcR)结合测定以确保抗体缺乏FcγR结合(因此可能缺乏ADCC活性),但是保留FcRn结合能力。用于介导ADCC的主要细胞NK细胞仅表达FcγRIII,而单核细胞表达Fc(RI、FcγRII和FcγRIII。造血细胞上的FcR表达汇总于Ravetch和Kinet,Annu.Rev.Immunol.9:457-492(1991)的第464页的表3中。评估所关注分子的ADCC活性的体外测定的非限制性实例描述于美国专利号5,500,362中(参见,例如,Hellstrom,I.等人Proc.Nat’l Acad.Sci.USA 83:7059-7063(1986))和Hellstrom,I等人,Proc.Nat’lAcad.Sci.USA 82:1499-1502(1985);5,821,337(参见Bruggemann,M.等人,J.Exp.Med.166:1351-1361(1987))。替代性地,可采用非放射性测定方法(参见,例如,用于流式细胞术的ACTI
具有降低的效应子功能的抗体包括具有Fc区残基238、265、269、270、297、327和329中一者或多者的取代的那些抗体(美国专利号6,737,056;残基的EU编号)。此类Fc突变体包括具有在氨基酸位置265、269、270、297和327中的两者或更多者处的取代的Fc突变体,包括其中残基265和297由丙氨酸取代的所谓的“DANA”Fc突变体(美国专利号7,332,581;EU编号)。在一些实施方案中,抗体包含根据EU编号惯例在氨基酸位置265处的工程化丙氨酸。在一些实施方案中,抗体包含根据EU编号惯例在氨基酸位置297处的工程化丙氨酸。
描述了具有改善的或降低的与FcR的结合的某些抗体变体。(参见,例如,美国专利号6,737,056;WO 2004/056312;以及Shields等人,J.Biol.Chem.9(2):6591-6604(2001)。)
在某些实施方案中,抗体变体包括具有改善的ADCC的一个或多个氨基酸取代的Fc区,例如,在Fc区的298、333和/或334位的取代(残基的EU编号)。
在一些实施方案中,在Fc区中作出改变,导致改变(即,改善或减少)的C1q结合和/或补体依赖性细胞毒性(CDC),例如,如美国专利号6,194,551、WO 99/51642和Idusogie等人J.Immunol.164:4178-4184(2000)中所述。
具有更长半衰期并改善了与新生儿Fc受体(FcRn)(其负责将母体IgG转移给胎儿,参见Guyer等人,J.Immunol.117:587(1976)和Kim等人,J.Immunol.24:249(1994))的结合的抗体描述于US2005/0014934(Hinton等人)中。那些抗体包含Fc区,该Fc区中具有改善Fc区与FcRn的结合的一个或多个取代。此类Fc变体包括具有以下Fc区残基中的一者或多者处的取代的Fc变体:238、256、265、272、286、303、305、307、311、312、317、340、356、360、362、376、378、380、382、413、424或434(EU编号),例如,Fc区残基434的取代(美国专利号7,371,826)。有关Fc区变体的其他实例,另外参见:Duncan&Winter,Nature 322:738-40(1988);美国专利号5,648,260;美国专利号5,624,821;以及WO 94/29351。
在一些实施方案中,该抗体可具有野生型人IgG1 Fc区或野生型人IgG4 Fc区、人IgG4 S228P Fc区、人IgG4 S228P/M252Y/S254T/T256E Fc区、人IgG1 N297G Fc区、人IgG1LALAPG(L234A/L235A/P329G)Fc区或人IgG1 N297G/M428L/N434S Fc区。(所有位置均采用EU编号。)
经半胱氨酸工程改造的抗体变体
在某些实施方案,可期望产生经半胱氨酸工程化改造的抗体,例如,“thioMAbs”,其中抗体的一个或多个残基被半胱氨酸残基取代。在特定实施方案中,取代的残基存在于抗体的可接近位点处。如本文进一步描述的,通过用半胱氨酸取代那些残基,从而将反应性硫醇基团定位于抗体的可接近部位处,并且可以用于将抗体与其他部分(诸如药物部分或接头-药物部分)缀合,以产生免疫缀合物。在某些实施方案中,以下任何一个或多个残基可被半胱氨酸取代:轻链的V205(Kabat编号);重链的A118(EU编号);以及重链Fc区的S400(EU编号)。可如例如美国专利号7,521,541中所述形成半胱氨酸改造的抗体。
抗体衍生物和缀合物
在某些实施方案中,本文提供的抗体可以被进一步修饰以包含本领域已知的并且容易获得的另外的非蛋白质部分。适合于抗体衍生化的部分包括但不限于水溶性聚合物。水溶性聚合物的非限制性实例包括但不限于聚乙二醇(PEG)、乙二醇/丙二醇的共聚物、羧甲基纤维素、葡聚糖、聚乙烯醇、聚乙烯吡咯烷酮、聚-1,3-二氧戊环、聚-1,3,6-三氧杂环己烷、乙烯/马来酸酐共聚物、聚氨基酸(均聚物或随机共聚物)和葡聚糖或聚(N-乙烯吡咯烷酮)聚乙二醇、丙二醇均聚物、聚环氧丙烷/环氧乙烷共聚物、聚氧乙烯化多元醇(例如甘油)、聚乙烯醇以及它们的混合物。由于其在水中的稳定性,聚乙二醇丙醛在制造中可具有优势。聚合物可具有任何分子量,并且可以具有支链或不具有支链。附接于抗体的聚合物的数目可变化,并且如果附接了多于一个聚合物,那么它们可以为相同或不同的分子。通常,可基于以下考虑因素测定用于衍生化的聚合物的数目和/或类型,包括但不限于抗体待改善的特定特性或功能、抗体衍生物是否将用于限定条件下的疗法等。
在另一个实施方案中,提供了抗体和可通过暴露于辐射而选择性地加热的非蛋白质部分的缀合物。在一个实施方案中,非蛋白质部分是碳纳米管(Kam等人,Proc.Natl.Acad.Sci.USA 102:11600-11605(2005))。辐射可具有任何波长,并且包括但不限于对普通细胞没有伤害、但是将非蛋白质性部分加热至抗体-非蛋白质性部分近端的细胞被杀死的温度的波长。
在一些实施方案中,抗TREM2抗体缀合至检测标记物和/或药物。如本文所用,检测标记物是促进抗体的检测和/或促进抗体所结合的分子的检测的部分。非限制性示例性检测标记包括但不限于放射性同位素、荧光基团、酶基团、化学发光基团、生物素、表位标签、金属结合标签等。
特定抗TREM2抗体的示例性特性
如本文实例中所述,从本文筛选鉴定了一组大鼠抗人抗TREM2抗体,随后进行深度测序分析,这些抗体具有一组独特的特性,包括,例如,(a)在跨越残基157与158之间的切割位点的表位处与TREM2茎结构域特异性结合,并且还与由残基151至165组成的多肽特异性结合,并且在hTREM2的残基151至161内更特异性地结合,(b)不与可溶性TREM2结合,(c)充当TREM2激动剂,以及(d)以高亲和力与TREM2特异性结合。这些大鼠抗人抗体3.10C2、3.27H7、3.50G1、3.18E5(“3.10C2组”)、3.36F5和Para.09及其人源化变体可能具有这些和额外的特性,这些特性在下文更详细地描述。
结合亲和力
在一些实施方案中,本文的抗体以高亲和力与人和食蟹猴TREM2特异性结合。例如,在一些实施方案中,本文的抗TREM2抗体可以例如以通过表面等离子体共振(SPR)的在37℃小于1nM、小于0.5nM、小于100pM、小于50pM、小于25pM、小于10pM、小于7pM、小于5pM、小于4pM、小于3pM或小于2pM的K
在一些实施方案中,本文的抗TREM2抗体以小于500pM(即,小于0.5nM)的K
例如,原始大鼠抗人3.10C2抗体的Fab和IgG版本两者均以约200pM的K
本文的K
在以下实例中,通过SPR以两种形式之一测量亲和力。在一种形式中,将TREM2-Fc固定在蛋白A芯片上,并使用可溶性抗TREM2 Fab片段作为配体。在第二种形式中,将抗TREM2 IgG固定在抗CH1 Biacore
表位和可溶性TREM2结合的缺少,以及TREM2脱落的抑制
如实例部分所示,本公开提供了抗体,这些抗体在跨越hTREM2的残基129至174(参见SEQ ID NO:90)的TREM2的茎结构域内特异性结合但不与可溶性TREM2(sTREM2;hTREM2的残基19至157)结合,与文献中先前作为茎结合物描述的其他抗TREM2抗体相反。sTREM2通过残基H157与S158之间的TREM2切割形成,并且通常包含TREM2的残基19至157。在一些实施方案中,与TREM2的茎结构域的结合可通过对包含TREM2的残基129至174(SEQ ID NO:90)或残基129至175(SEQ ID NO:177;图2A)的多肽执行结合测定来显示,该多肽包含茎结构域和第一跨膜结构域残基。本文提供的结果显示,本公开内容的3.10C2、Para.09、3.50G1、3.18E5、3.36F5或3.27H7抗体,以及本文所述的那些抗体的人源化版本诸如Para.09.v2、3.10C2.v1,可能与跨越H157至S158切割位点的表位结合,该表位在H157至S158切割位点处的TREM2切割时被破坏,并且不存在于sTREM2中。(参见,例如,图2A至2B和图5。)相比之下,文献中描述的若干抗TREM2抗体显示与可溶性TREM2结合,并可能识别未因完整TREM2的切割而被破坏的不同表位,尽管在一些情况下,它们可能会接触切割位点周围的残基(参见例如,图5)。因此,本公开提供了抗体,这些抗体具有其他抗TREM2抗体中未发现的特性——与完整TREM2结合但不与sTREM2结合的能力,尽管似乎与结合sTREM2的先前抗体的类似蛋白质区域相互作用。
如前所述,本文的某些抗体不与可溶性TREM2结合。如本文所用,这意味着当在ELISA测定中进行测定时,抗体可能不会显示出任何超过10%的与sTREM2的结合,并且在一些情况下不会显示出任何超过5%的与sTREM2的结合,其中该结合百分比是针对阳性对照抗体1.16B8的结合百分比归一化的,该阳性对照抗体与sTREM2的结合设置为100%。对照抗体1.16B8轻链序列显示在SEQ ID NO:170中,并且其重链序列显示在SEQ ID NO:171中。在一些实施方案中,抗体3.17A9用作ELISA测定中的检测剂。检测抗体3.17A9轻链序列显示在SEQ ID NO:168中,并且重链序列显示在SEQ ID NO:169中。在一些实施方案中,包含hTREM2的残基19至157的多肽可用于测定结合(例如,SEQ ID NO:21的残基19至157)。在一些实施方案中,抗体在ELISA测定中不与可溶性TREM2结合,其中结合针对对照抗体1.16B8的结合进行归一化,其中检测抗体3.17A9用作检测试剂,并且其中sTREM2是包含SEQ ID NO:21的残基19至157的多肽。在一些实施方案中,可以如下文实例11和图16中所示进行ELISA测定。
例如,如本文实例11中所示,人TREM2 ELISA测定通过将待测试的抗体作为捕获试剂涂覆到板孔上并使用生物素化的IgV反应性单克隆抗体3.17A9作为检测试剂来测量抗体与sTREM2的结合。将对照抗体1.16B8用作阳性对照抗体以建立sTREM2结合的标准。例如,在此测定中,大鼠Para.09–LC 3.27H7 mIgG2a LALAPG(Para09)、大鼠3.10C2 mIgG2aLALAPG(3.10C2)、大鼠3.18E5 mIgG2a LALAPG(3.18E5)、大鼠3.50G1mIgG2a LALAPG(3.50G1)、大鼠3.27H7 mIgG2a LALAPG(3.27H7)、大鼠3.36F5 mIgG2a LALAPG(3.36F5)均未显示出与sTREM2的任何结合(参见图16,其显示,与1.116B8对照相反,这些抗体的归一化sTREM2结合接近于零)。还测试了具有hIgG1 N297G恒定区的人源化抗体Para.09.v2抗体的sTREM2结合,并且与具有mIgG2 LALAPG的大鼠Para.09一样,没有显示出与sTREM2的任何结合。因此,在一些实施方案中,本文的抗体,诸如图16中所示的那些抗体和此类抗体的人源化变体,诸如Para.09.v2、3.10C2.v1,不与可溶性TREM2结合。在一些实施方案中,那些抗体与TREM2茎结构域结合但不与可溶性TREM2结合。
缺少与sTREM2的结合在体内可能是有利的,因为它可以显著降低或消除体内抗体与sTREM2之间不希望的结合的可能性。例如,不受机制限制,sTREM2反而可以充当抗TREM2抗体的“诱饵”,使得体内的抗体分子不太容易与细胞表面上的TREM2结合。
如本文的实例和附图中所示,本文的抗体还可以在跨越H157至S158切割位点的区处与TREM2的茎区内的残基结合,具体而言在TREM2的149至168、146至169、146至161和151至165范围内的残基内。这种独特的跨越切割位点的表位可以解释为什么本文的抗体既可以与TREM2茎结合但又不与可溶性TREM2结合。(参见例如,图5。)在一些实施方案中,本文的抗体以较高的亲和力与由氨基酸146至161(SEQ ID NO:96)和/或151至165(SEQ ID NO:97)组成的TREM2多肽特异性结合,其是与由氨基酸139至158(SEQ ID NO:92)和/或159至175(SEQ ID NO:94)组成的TREM2多肽相比。在一些情况下,本文的抗体以较高的亲和力与由氨基酸149至168(SEQ ID NO:93)、146至169(SEQ ID NO:95)、146至161(SEQ ID NO:96)和/或151至165(SEQ ID NO:97)组成的TREM2多肽特异性结合,其是与由氨基酸139至158(SEQ IDNO:92)和/或159至175(SEQ ID NO:94)组成的TREM2多肽相比。在一些实施方案中,本文的抗体以较高的亲和力与由氨基酸146至161(SEQ ID NO:96)和/或151至165(SEQ ID NO:97)组成的TREM2多肽特异性结合,其是与由氨基酸139至158(SEQ ID NO:92)组成以及由159至175(SEQ ID NO:94)组成的TREM2多肽相比。在一些情况下,本文的抗体以较高的亲和力与由氨基酸149至168(SEQ ID NO:93)、146至169(SEQ ID NO:95)、146至161(SEQ ID NO:96)和/或151至165(SEQ ID NO:97)组成的TREM2多肽特异性结合,其是与由氨基酸139至158(SEQ ID NO:92)组成以及由159至175(SEQ ID NO:94)组成的TREM2多肽相比。
如本文提供的实例中所示,数据表明本公开的抗体与TREM2的残基151至161内的表位特异性结合。(参见图2A和2B。)在一些实施方案中,本文的抗体与包括Asp-152、His-154、Val-155、Glu-156、His-157、Ser-158、Ile-159和Ser-160中的一者或多者、跨越H157至S158处的TREM2切割位点的表位结合。(参见图5。)在一些实施方案中,本文的抗体与包含残基152、154、157、158和159的表位结合。在一些实施方案中,本文的抗体与包括Asp-152、His-157和Ile-159的表位特异性结合。在某些实施方案中,本文的抗体与包括残基Asp-152、His-154、Val-155、Glu-156、His-157和Ile-159中的一者或多者的表位结合。在一些实施方案中,本文的抗体与包括Glu-156和Ser-160的表位结合。丙氨酸扫描分析表明,抗体Para.09(其包含与抗体3.27H7的轻链可变区配对的Para.09重链可变区)的TREM2结合受到在例如Asp-152、His-157和Ile-159处的丙氨酸突变的影响。(图5。)Para.09和3.10C2在丙氨酸扫描测定中具有类似的模式,除了3.10C2的结合另外还受到H154和S158处的丙氨酸突变的影响。(图5。)
在一些实施方案中,与不与TREM2特异性结合的对照抗体(例如,同种型对照)相比,本文的抗体,诸如Para.09或3.10C2(包括此类抗体的人源化变体诸如Para.09.v2和3.10C2.v1)也降低体内sTREM2的水平,诸如在鼠血浆、CSF或脑组织中,如通过ELISA测定所测量。例如,在一些实施方案中,可以通过确定在存在抗TREM2抗体的情况下温育的血浆、CSF或脑组织样品中的可溶性TREM2的水平相较于同种型对照抗体的变化来进行ELISA测定。在存在抗TREM2抗体的情况下降低的sTREM2的水平指示sTREM2脱落受到抑制。
如下文实例18A至18B中所示,与sTREM2结合的缺少也与这种体内sTREM2耗竭(在鼠血浆、CSF和脑组织中)相关。与比较物抗体相反,用示例性抗体Para.09治疗导致低于基线对照水平的显著降低的血浆sTREM2水平,而用比较物抗TREM2抗体治疗使血浆中sTREM2的水平增加至数倍。(实例18B和图25C。)例如,在mIgG2 LALAPG背景下的Para.09抗体在施用后在小鼠中导致血浆中可溶性TREM2水平降低70%-85%,持续至少7天,而比较物抗体经历同一时间段使sTREM2水平增加至超过2倍。(图25C。)因此,在一些实施方案中,本文的抗体诸如Para.09和3.10C2及其人源化变体诸如Para.09.v2和3.10C2.v1在向小鼠施用后导致鼠血浆中可溶性TREM2水平降低,持续至少7天。因此,具有增加的对完整TREM2的特异性并且缺少体内与sTREM2的结合的本公开的抗体在升高的sTREM2水平是不期望的情况下可能具有特别的效用。
因此,本文的抗体诸如Para.09和3.10C2及其人源化变体可具备以下特性中的任何一者或多者:(a)与TREM2的茎结构域特异性结合;(b)不与可溶性TREM2(sTREM2)结合;(c)以较高的亲和力与由氨基酸146至161(SEQ ID NO:96)或151至165(SEQ ID NO:97)组成的TREM2多肽特异性结合,其是与由氨基酸139至158(SEQ ID NO:92)和/或159至175(SEQID NO:94)组成的TREM2多肽相比;(d)与跨越H157至S158切割位点的TREM2表位特异性结合;(e)与野生型TREM2茎结构域多肽相比,对包含D152A、H157A和I159A取代的TREM2茎结构域多肽显示出降低的结合亲和力(例如,如通过双层干涉法所测量);以及(f)以通过表面等离子体共振(SPR)的在37℃小于100pM、小于50pM、小于10pM、小于7pM、小于5pM、小于4pM、小于3pM或小于2pM、或10至50pM或10至25pM的K
在某些示例性实施方案中,抗体包含重链可变区(VH)和轻链可变区(VL),其中该VH包含:包含SEQ ID NO:11或19的氨基酸序列的CDR-H1;包含SEQ ID NO:12或20的氨基酸序列的CDR-H2;以及包含SEQ ID NO:13的氨基酸序列的CDR-H3,并且进一步地其中该抗体不与可溶性TREM2(sTREM2)结合,其中该抗体为如以下部分中进一步描述的TREM2激动剂。在一些实施方案中,该VH包含SEQ ID NO:17、133、135、137或139的氨基酸序列或与SEQ IDNO:17、133、135、137或139的氨基酸序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的氨基酸序列;或者该抗体包含:重链,其包含具有或不具有C末端赖氨酸或C末端甘氨酸-赖氨酸的SEQ ID NO:144的氨基酸序列或由该氨基酸序列组成,或者包含与SEQ ID NO:144的氨基酸序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的氨基酸序列。在一些情况下,抗体还与跨越H157至S158切割位点的TREM2表位特异性结合,且/或以较高的亲和力与由氨基酸146至161(SEQ ID NO:96)或151至165(SEQ IDNO:97)组成的TREM2多肽特异性结合,其是与由氨基酸139至158(SEQ ID NO:92)和/或159至175(SEQ ID NO:94)组成的TREM2多肽相比。在一些情况下,抗体不与可溶性TREM2结合,并且与野生型TREM2茎结构域多肽相比,对包含D152A、H157A和I159A取代的TREM2茎结构域多肽具有降低的结合亲和力(例如,如通过双层干涉法所测量)。在一些情况下,抗体还以通过表面等离子体共振(SPR)的在37℃小于100pM、小于50pM、小于10pM、小于7pM、小于5pM、小于4pM、小于3pM、或小于2pM、或10至50pM或10至25pM的K
本文所述的抗体还可具有下一部分中所述的额外生物活性中的一种或多种以及本部分中所述的上述特性的任何组合。
额外的生物活性
在一些实施方案中,本文的抗体,诸如Para.09和3.10C2及其人源化变体,可具有以下进一步的特征中的一者或多者、两者或更多者、三者或更多者、四者或更多者、五者或更多者、或六者或更多者、七者或更多者、八者或更多者、或全部:(a)在表达人TREM2的Jurkat-NFAT荧光素酶报告基因细胞中诱导荧光素酶报告基因活性;(b)降低血浆中体内sTREM2的水平;(c)在表达人TREM2的Jurkat-NFAT荧光素酶报告基因细胞中抑制sTREM2的脱落;(d)在人MDM细胞中诱导酪氨酸磷酸化;(e)在人MDM细胞中诱导SYK磷酸化;(f)在缺乏IL-34和CSF-1的情况下,增强人iPSC来源的小胶质细胞的存活;(g)在人iPSC来源的小胶质细胞中抑制sTREM2的脱落;(h)在人iPSC来源的小胶质细胞中诱导SYK磷酸化;以及(i)在人iPSC来源的小胶质细胞中,在存在Aβ寡聚体的情况下增加总Aβ斑块强度和/或平均X04斑块强度(例如,如本文实例17的测定中所述)。
因此,在一些实施方案中,本文的抗体,诸如Para.09和3.10C2及其人源化变体,还在经培养的细胞中(包括在已经工程化以表达人TREM2的Jurkat细胞中,或替代性地,在人单核细胞来源的巨噬细胞(MDM)中或在人诱导性多能干细胞(iPSC)来源的小胶质细胞中)降低sTREM2水平(即,抑制sTREM2脱落)。在一些情况下,细胞培养测定中的sTREM2水平可以通过ELISA测定来测量。
在一些实施方案中,本文的抗体为TREM2激动剂。例如,在一些实施方案中,本文的抗体在表达人TREM2的Jurkat-NFAT报告基因细胞中诱导报告基因表达。例如,TREM2活性可能会导致细胞信号传导事件,从而导致在NFAT(经活化的T细胞的核因子)控制下的基因表达增强。例如,可以使用Jurkat细胞来评估NFAT活性,该细胞经工程化以响应于NFAT转录因子对基因表达的活化而表达报告基因,诸如萤火虫荧光素酶。为了测试抗TREM2抗体对NFAT控制的基因表达的效应,可以构建表达人TREM2的Jurkat-NFAT报告基因细胞。在一些实施方案中,本文的抗体在表达人TREM2的Jurkat-NFAT报告基因细胞中增强报告基因表达。(参见图18A至18B。)在一些实施方案中,本文的抗体还在表达人TREM2突变体诸如hTREM2R47H、hTREM2 R62H和/或H157Y的Jurkat-NFAT报告基因细胞中增强报告基因表达。(参见图19A至19C。)
TREM2活性,以及因此,抗TREM2抗体的激动作用,也可以通常通过酪氨酸残基的磷酸化水平或通过Syk激酶的磷酸化水平来评估,Syk激酶是一种在TREM2相关细胞信号传导活化时被磷酸化的激酶。因此,在一些实施方案中,本文的抗体增加TREM2活性,如通过在表达人TREM2的Jurkat-NFAT报告基因细胞、人iPSC来源的小胶质细胞或人MDM细胞中的一者或多者中泛磷酸化酪氨酸(pY)水平和磷酸化Syk激酶(p-SYK)水平中的一者或两者的增加所测量。在一些实施方案中,本文的抗体在人iPSC来源的小胶质细胞和人MDM细胞中增加SYK磷酸化。
在一些实施方案中,当在缺乏IL-34和CSF-1(它们通常为促进细胞存活和生长所需)的情况下培养人iPSC来源的小胶质细胞时,本文的抗体也增强这些细胞的存活。例如,人源化抗体hPara.09.v2、h3.10C2.v1、hPara.09Q100P V104L和hPara.09Q100P各自增强iPSC来源的小胶质细胞存活,并且EC
在一些实施方案中,本文的抗体在人iPSC来源的小胶质细胞中,在存在Aβ寡聚体的情况下增加Aβ斑块强度和/或增加X04斑块强度。(参见实例17和图24A至24C。)例如,当用特定标志物染料对iPSC来源的小胶质细胞进行染色时,可以将斑块形成和压实测量为增加的强度,这些特定标志物染料为诸如识别Aβ(即,测量“Aβ强度”或“Aβ斑块强度”)或Aβ斑块(X04标志物,其测量“X04强度”或“X04斑块强度”)的那些染料。在一些情况下,可以确定“总”Aβ斑块强度。并且在一些情况下,可以测量“平均”X04斑块强度。用于测量斑块形成和压实、总Aβ斑块强度和平均X04斑块强度的测定的实例示于实例17和图24A至24C中。
在一些实施方案中,本文的抗体在iPSC来源的小胶质细胞中增加Aβ斑形成和压实,如通过与同种型对照抗体相比,总Aβ斑块强度和平均X04强度中的一者或两者的增加所示。例如,在一些实施方案中,与同种型对照抗体相比,抗体的存在使总Aβ斑块强度增加4-6倍。在一些实施方案中,本文的抗体具有介于100与800nM之间的用于增加总Aβ斑块强度的EC
例如,来自表达人TREM2的Jurkat-NFAT报告基因细胞以及来自MDM和iPSC来源的小胶质细胞模型的数据指示,本文的抗体可能具有神经保护活性。例如,本文的抗体可以具有以下生物活性的组合:增强人iPSC来源的小胶质细胞的存活、增加p-SYK磷酸化和/或NFAT控制的基因表达,以及在人iPSC来源的小胶质细胞中在存在Aβ寡聚体的情况下促进Aβ斑块形成和压实。在一些实施方案中,本文的抗体在BV ELISA测定中也显示出很少或没有显著的脱靶结合。(
某些示例性人源化抗体的序列和特性
抗体h3.10C2.v1
在一些方面,本公开涉及一种抗体,该抗体包含重链可变区和轻链可变区,其中该重链可变区包含氨基酸序列,该氨基酸序列包含3.10C2抗体的重链CDR,这些重链CDR包含SEQ ID NO:1、2和3(Kabat)或包含SEQ ID NO:9、10和3(Chothia)。(参见图9B。)在一些实施方案中,抗体包含重链可变区和轻链可变区,其中该轻链可变区包含氨基酸序列,该氨基酸序列包含3.10C2.v1抗体的轻链CDR,这些轻链CDR基于3.27H7的轻链CDR Fab,包含SEQ IDNO:4、5和6。(参见图9A。)在一些实施方案中,抗体包含3.10C2.v1的重链和轻链CDR,这些CDR包含SEQ ID NO:1至6。在一些实施方案中,抗体包含3.10C2.v1的重链和轻链CDR,包含SEQ ID NO:9、SEQ ID NO:10、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5和SEQ ID NO:6。
在一些实施方案中,抗体包含SEQ ID NO:1、2和3或替代性地9、10和3的重链CDR,和/或SEQ ID NO:4、5和6的轻链CDR,并且进一步包含重链可变区,该重链可变区包含与SEQID NO:7的氨基酸序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的氨基酸序列。在一些实施方案中,抗体包含SEQID NO:1、2和3或替代性地9、10和3的重链CDR,和/或SEQ ID NO:4、5和6的轻链CDR,并且进一步包含轻链可变区,该轻链可变区包含与SEQ ID NO:8的氨基酸序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的氨基酸序列。在一些实施方案中,抗体包含SEQ ID NO:1、2和3或替代性地9、10和3的重链CDR,和/或SEQ ID NO:4、5和6的轻链CDR,并且进一步包含:重链可变区,该重链可变区包含与SEQ ID NO:7的氨基酸序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的氨基酸序列;以及轻链可变区,该轻链可变区包含与SEQ ID NO:8的氨基酸序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的氨基酸序列。在一些实施方案中,抗体包含SEQ ID NO:1、2和3或替代性地9、10和3的重链CDR,和/或SEQ ID NO:4、5和6的轻链CDR,并且进一步包含重链可变区,该重链可变区包含SEQ ID NO:7的氨基酸序列。在一些实施方案中,抗体包含SEQ ID NO:1、2和3或替代性地9、10和3的重链CDR,和/或SEQ ID NO:4、5和6的轻链CDR,并且进一步包含轻链可变区,该轻链可变区包含SEQ ID NO:8的氨基酸序列。在一些实施方案中,抗体包含SEQ ID NO:1、2和3或替代性地9、10和3的重链CDR,和/或SEQ ID NO:4、5和6的轻链CDR,并且进一步包含重链可变区,该重链可变区包含SEQ ID NO:7的氨基酸序列,但在SEQ ID NO:7的重链框架区中具有至多5个,诸如1、2、3、4或5个氨基酸取代、插入或缺失。在一些实施方案中,抗体包含SEQ ID NO:1、2和3或替代性地9、10和3的重链CDR,和/或SEQ ID NO:4、5和6的轻链CDR,并且进一步包含轻链可变区,该轻链可变区包含SEQ ID NO:8的氨基酸序列,但在SEQ ID NO:8的轻链框架区中具有至多5个,诸如1、2、3、4或5个氨基酸取代、插入或缺失。在一些实施方案中,抗体包含重链可变区和轻链可变区,该重链可变区包含SEQ ID NO:7的氨基酸序列,并且该轻链可变区包含SEQID NO:8的氨基酸序列,但是在SEQ ID NO:7和/或SEQ ID NO:8的框架区中具有至多5个氨基酸取代、插入或缺失,诸如1个、2个、3个、4个或5个氨基酸取代、插入或缺失。
在一些实施方案中,抗体包含:重链可变区,该重链可变区包含SEQ ID NO:7的氨基酸序列;以及轻链可变区,该轻链可变区包含SEQ ID NO:8的氨基酸序列。在一些实施方案中,该抗体进一步包含重链和/或轻链恒定区。
在本文的任何实施方案中,该抗体可以为抗体片段,诸如Fv、单链Fv(scFv)、Fab、Fab'或(Fab')
在一些实施方案中,该抗体可以具有下文更详细描述的某些特性。例如,在一些方面,该抗体具有以下特征中的一者或多者、两者或更多者、三者或更多者、四者或更多者、五者或更多者、或全部:(a)与TREM2的茎结构域特异性结合并且与由hTREM2的残基151至165(SEQ ID NO:97)组成的多肽特异性结合;(b)不与可溶性TREM2(sTREM2)结合;以及(c)以通过表面等离子体共振(SPR)的在37℃小于1nM、小于0.7nM、小于0.6nM、小于0.5nM、小于0.4nM、或小于0.3nM、或100至500pM或100至200pM的K
在一些方面,该抗体为TREM2激动剂,其与跨越TREM2的H157至S158切割位点的表位特异性结合并且不与可溶性TREM2结合。在一些方面,该抗体为TREM2激动剂,其与跨越TREM2的H157至S158切割位点的表位特异性结合;不与可溶性TREM2结合;并且以通过表面等离子体共振(SPR)的在37℃通过表面等离子体共振(SPR)的在37℃小于1nM、小于0.7nM、小于0.6nM、小于0.5nM、小于0.4nM、或小于0.3nM、或100至500pM或100至200pM的K
在一些情况下,该抗体在脱靶结合测定诸如BV ELISA测定中还具有低脱靶结合评分(例如,<1的评分)(一个实例是如本文实例10中所述进行的测定)。在一些情况下,此类抗体可以充当TREM2激动剂,并且还可以具有下文列出的特性(a)至(i)中的一者或多者。
具体地,在一些方面,该抗体还可以具有以下特征的一者或多者、两者或更多者、三者或更多者、四者或更多者、五者或更多者、或六者或更多者、七者或更多者、八者或更多者、或全部:(a)在表达人TREM2的Jurkat-NFAT报告基因细胞中诱导荧光素酶报告基因活性;(b)降低血浆中体内sTREM2的水平;(c)在Jurkat-NFAT荧光素酶报告基因细胞中抑制sTREM2的脱落及/或诱导人TREM2的内化;(d)在表达人TREM2的人MDM细胞中诱导酪氨酸磷酸化;(e)在表达人TREM2的人MDM细胞中诱导SYK磷酸化(p-SYK);(f)增强人iPSC来源的小胶质细胞的存活;(g)在人iPSC来源的小胶质细胞中抑制sTREM2的脱落;(h)在人iPSC来源的小胶质细胞中活化TREM2信号传导;以及(i)在人iPSC来源的小胶质细胞中,在存在Aβ寡聚体的情况下增加总Aβ斑块强度和/或平均X04斑块强度。
h3.10C2.v1变体抗体
在一些实施方案中,本文的抗体可包含h3.10C2.v1的重链和轻链CDR以及h3.10C2.v1抗体的重链框架区,如上文所述和图9A至9B中所示,但在抗体轻链中具有额外的修饰,例如,如图14A中所示。例如,在一些实施方案中,可以在框架区中作出某些轻链修饰以提高表达产量等,如下文实例中所述。
在一些实施方案中,抗体包含以下VH和VL组中的一者:(a)SEQ ID NO:146和145(抗体h3.10C2.v1 Q100P);(b)SEQ ID NO:148和147(抗体h3.10C2.v1 I58V/Q100P);或(c)SEQ ID NO:150和149(抗体h3.10C2.v1 Q100P/V104L)。在一些实施方案中,该抗体进一步包含重链和/或轻链恒定区。
在本文的任何实施方案中,该抗体可以为抗体片段,诸如Fv、单链Fv(scFv)、Fab、Fab'或(Fab')
在一些实施方案中,该抗体可以具有下文更详细描述的某些特性。例如,在一些方面,该抗体具有以下特征中的一者或多者、两者或更多者、三者或更多者、四者或更多者、五者或更多者、或全部:(a)与TREM2的茎结构域特异性结合;(b)不与可溶性TREM2(sTREM2)结合;以及(c)以通过表面等离子体共振(SPR)的在37℃小于1nM、小于0.7nM、小于0.6nM、小于0.5nM、小于0.4nM、或小于0.3nM、或100至500pM或100至200pM的K
在一些方面,该抗体为TREM2激动剂,其与跨越TREM2的H157至S158切割位点的表位特异性结合并且不与可溶性TREM2结合。在一些方面,该抗体为TREM2激动剂,其与跨越TREM2的H157至S158切割位点的表位特异性结合;不与可溶性TREM2结合;并且以通过表面等离子体共振(SPR)的在37℃小于1nM、小于0.7nM、小于0.6nM、小于0.5nM、小于0.4nM、或小于0.3nM、或100至500pM或100至200pM的K
在一些情况下,该抗体在脱靶结合测定中还具有低脱靶结合评分(例如,<1的评分)(如本文实例10中所述进行)。在一些情况下,此类抗体可以充当TREM2激动剂,并且还可以具有下文列出的特性(a)至(i)中的一者或多者。
具体地,在一些方面,该抗体还可以具有以下进一步的特征的一者或多者、两者或更多者、三者或更多者、四者或更多者、五者或更多者、或六者或更多者、七者或更多者、八者或更多者、或全部:(a)在表达人TREM2的Jurkat-NFAT报告基因细胞中诱导荧光素酶报告基因活性;(b)降低血浆中体内sTREM2的水平;(c)在Jurkat-NFAT荧光素酶报告基因细胞中抑制sTREM2的脱落;(d)在人MDM细胞中诱导酪氨酸磷酸化;(e)在人MDM细胞中诱导SYK磷酸化;(f)在缺乏IL34和CSF1的情况下,增强人iPSC来源的小胶质细胞的存活;(g)在人iPSC来源的小胶质细胞中抑制sTREM2的脱落;(h)在人iPSC来源的小胶质细胞中诱导SYK磷酸化;以及(i)在人iPSC来源的小胶质细胞中,在存在Aβ寡聚体的情况下增加总Aβ斑块强度和/或平均X04斑块强度。
在一些实施方案中,这些抗体包含以下VH和VL组中的一者:(a)SEQ ID NO:146和145(抗体h3.10C2.v1 Q100P);(b)SEQ ID NO:148和147(抗体h3.10C2.v1 I58V/Q100P);和(c)SEQ ID NO:150和149(抗体h3.10C2.v1 Q100P/V104L)。
抗体hPara.09.v2
在一些实施方案中,该抗体包含抗体Para.09.v2的重链和轻链CDR,其中重链CDR基于Para.09重链并且轻链CDR基于3.27H7 Fab。在一些实施方案中,本文的抗体包含SEQID NO:11、12和13(Kabat)或替代性地19、20和13(Chothia)的重链CDR,和/或SEQ ID NO:14、15和16的轻链CDR。在一些实施方案中,抗体包含SEQ ID NO:11、12和13(Kabat)或替代性地19、20和13(Chothia)的重链CDR,和/或SEQ ID NO:14、15和16的轻链CDR,并且进一步包含重链可变区,该重链可变区包含与SEQ ID NO:17的氨基酸序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的氨基酸序列。在一些实施方案中,抗体包含SEQ ID NO:11、12和13或替代性地19、20和13的重链CDR,和/或SEQ ID NO:14、15和16的轻链CDR,并且进一步包含轻链可变区,该轻链可变区包含与SEQ ID NO:18的氨基酸序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的氨基酸序列。在一些实施方案中,抗体包含SEQ ID NO:11、12和13或替代性地19、20和13的重链CDR,和/或SEQ ID NO:14、15和16的轻链CDR,并且进一步包含:重链可变区,该重链可变区包含与SEQ ID NO:17的氨基酸序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的氨基酸序列;以及轻链可变区,该轻链可变区包含与SEQID NO:18的氨基酸序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的氨基酸序列。在一些实施方案中,抗体包含SEQ ID NO:11、12和13或替代性地19、20和13的重链CDR,和/或SEQ ID NO:14、15和16的轻链CDR,并且进一步包含重链可变区,该重链可变区包含SEQ ID NO:17的氨基酸序列。在一些实施方案中,抗体包含SEQ ID NO:11、12和13或替代性地19、20和13的重链CDR,和/或SEQID NO:14、15和16的轻链CDR,并且进一步包含轻链可变区,该轻链可变区包含SEQ ID NO:18的氨基酸序列。在一些实施方案中,抗体包含SEQ ID NO:11、12和13或替代性地19、20和13的重链CDR,和/或SEQ ID NO:14、15和16的轻链CDR,并且进一步包含重链可变区,该重链可变区包含SEQ ID NO:17的氨基酸序列,但在SEQ ID NO:17的重链框架区中具有至多5个,诸如1、2、3、4或5个氨基酸取代、插入或缺失。在一些实施方案中,抗体包含SEQ ID NO:11、12和13或替代性地19、20和13的重链CDR,和/或SEQ ID NO:14、15和16的轻链CDR,并且进一步包含轻链可变区,该轻链可变区包含SEQ ID NO:18的氨基酸序列,但在SEQ ID NO:18的重链框架区中具有至多5个,诸如1、2、3、4或5个氨基酸取代、插入或缺失。在一些实施方案中,抗体包含重链可变区和轻链可变区,该重链可变区包含SEQ ID NO:17的氨基酸序列,并且该轻链可变区包含SEQ ID NO:18的氨基酸序列,但是在SEQ ID NO:17和/或SEQ ID NO:18的框架区中具有至多5个氨基酸取代、插入或缺失,诸如1个、2个、3个、4个或5个氨基酸取代、插入或缺失。
在一些实施方案中,抗体包含:重链可变区,该重链可变区包含SEQ ID NO:17的氨基酸序列;以及轻链可变区,该轻链可变区包含SEQ ID NO:18的氨基酸序列。在一些实施方案中,该抗体进一步包含重链和/或轻链恒定区。
在本文的任何实施方案中,该抗体可以为抗体片段,诸如Fv、单链Fv(scFv)、Fab、Fab'或(Fab')
在一些实施方案中,该抗体包含重链,该重链包含SEQ ID NO:144的氨基酸序列或由该氨基酸序列组成。在一些实施方案中,该抗体包含轻链,该轻链包含SEQ ID NO:176的氨基酸序列或由该氨基酸序列组成。在一些实施方案中,该抗体包含:重链,其包含SEQ IDNO:144的氨基酸序列或由该氨基酸序列组成;以及轻链,其包含SEQ ID NO:176的氨基酸序列或由该氨基酸序列组成。在一些实施方案中,该抗体包含:重链,其包含SEQ ID NO:144的氨基酸序列或由该氨基酸序列组成但缺少SEQ ID NO:144的C末端赖氨酸或缺少SEQ IDNO:144的C末端甘氨酸和赖氨酸;以及轻链,其包含SEQ ID NO:176的氨基酸序列或由该氨基酸序列组成。在一些实施方案中,该抗体包含重链,该重链包含与SEQ ID NO:144的氨基酸序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的氨基酸序列。在一些实施方案中,该抗体包含轻链,该轻链包含与SEQ ID NO:176的氨基酸序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的氨基酸序列。在一些实施方案中,该抗体包含:重链,其包含与SEQ ID NO:144的氨基酸序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的氨基酸序列;以及轻链,其包含与SEQ ID NO:176的氨基酸序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的氨基酸序列。在一些实施方案中,该抗体包含:重链,其包含SEQ ID NO:144的氨基酸序列或由该氨基酸序列组成,任选地没有C末端赖氨酸或甘氨酸-赖氨酸;以及轻链,其包含与SEQ IDNO:176的氨基酸序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的氨基酸序列。在一些实施方案中,该抗体包含:重链,其包含与SEQ ID NO:144的氨基酸序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的氨基酸序列;以及轻链,其包含SEQ ID NO:176的氨基酸序列或由该氨基酸序列组成。在一些实施方案中,该抗体包含重链,该重链包含与SEQ ID NO:144的氨基酸序列相比具有1、2、3、4或5个氨基酸取代、插入或缺失的氨基酸序列。在一些实施方案中,该抗体包含轻链,该轻链包含与SEQ IDNO:176的氨基酸序列相比具有1、2、3、4或5个氨基酸取代、插入或缺失的氨基酸序列。在一些实施方案中,该抗体包含:重链,其包含与SEQ ID NO:144的氨基酸序列相比具有1、2、3、4或5个氨基酸取代、插入或缺失的氨基酸序列;以及轻链,其包含与SEQ ID NO:176的氨基酸序列相比具有1、2、3、4或5个氨基酸取代、插入或缺失的氨基酸序列。在一些实施方案中,该抗体包含:重链,其包含SEQ ID NO:144的氨基酸序列或由该氨基酸序列组成,任选地没有C末端赖氨酸或甘氨酸-赖氨酸;以及轻链,其包含与SEQ ID NO:176的氨基酸序列相比具有1、2、3、4或5个氨基酸取代、插入或缺失的氨基酸序列。在一些实施方案中,该抗体包含:重链,其包含与SEQ ID NO:144的氨基酸序列相比具有1、2、3、4或5个氨基酸取代、插入或缺失的氨基酸序列;以及轻链,其包含SEQ ID NO:176的氨基酸序列或由该氨基酸序列组成。在任何上述允许SEQ ID NO:144和/或SEQ ID NO:176中的序列变异的情况下,在一些实施方案中,此类序列变异限于抗体框架和/或恒定区,使得抗体还包含SEQ ID NO:11、12和13或替代性地19、20和13的重链CDR,和/或SEQ ID NO:14、15和16的轻链CDR。在其他实施方案中,SEQ ID NO:144和/或SEQ ID NO:176中的此类序列变异限于抗体恒定区,使得抗体还包含SEQ ID NO:17和/或18。
在一些实施方案中,该抗体可以具有下文更详细描述的某些特性。
例如,在一些方面,该抗体具有以下特征中的一者或多者、两者或更多者、三者或更多者、四者或更多者、五者或更多者、或全部:(a)与TREM2的茎结构域特异性结合;(b)不与可溶性TREM2(sTREM2)结合;以及(c)以通过表面等离子体共振(SPR)的在37℃小于100pM、小于50pM、小于10pM、小于7pM、小于5pM、小于4pM、小于3pM或小于2pM,诸如10至50pM或10至25pM的K
在一些情况下,该抗体在脱靶结合测定中还具有低脱靶结合评分(例如,<1的评分)(如本文实例10中所述进行)。在一些情况下,与包含3.10C2的重链和轻链CDR的抗体相比,该抗体可能具有较低的对人TREM2的K
在一些方面,该抗体为TREM2激动剂,其与跨越TREM2的H157至S158切割位点的表位特异性结合,并且不与可溶性TREM2结合。在一些方面,该抗体为TREM2激动剂,其与跨越TREM2的H157至S158切割位点的表位特异性结合;不与可溶性TREM2结合。在一些方面,该抗体为TREM2激动剂,其与跨越TREM2的H157至S158切割位点的表位特异性结合;并且不与可溶性TREM2结合;并且还以通过表面等离子体共振(SPR)的在37℃小于100pM、小于50pM、小于10pM、小于7pM、小于5pM、小于4pM、小于3pM或小于2pM,诸如10至50pM或10至25pM的K
在这些情况中的任一种中,该抗体可以进一步具有下文列出的进一步的特性(a)至(i)中的一者或多者。
具体地,在一些方面,该抗体还可以具有以下特征的一者或多者、两者或更多者、三者或更多者、四者或更多者、五者或更多者、或六者或更多者、七者或更多者、八者或更多者、或全部:(a)在表达人TREM2的Jurkat-NFAT报告基因细胞中诱导荧光素酶报告基因活性;(b)降低血浆中体内sTREM2的水平;(c)在表达人TREM2的Jurkat-NFAT荧光素酶报告基因细胞中抑制sTREM2的脱落;(d)在人MDM细胞中诱导酪氨酸磷酸化;(e)在人MDM细胞中诱导SYK磷酸化;(f)在缺乏IL-34和CSF-1的情况下,增强人iPSC来源的小胶质细胞的存活;(g)在人iPSC来源的小胶质细胞中抑制sTREM2的脱落;(h)在人iPSC来源的小胶质细胞中诱导SYK磷酸化;以及(i)在人iPSC来源的小胶质细胞中,在存在Aβ寡聚体的情况下增加总Aβ斑块强度和/或平均X04斑块强度。在一些实施方案中,与包含3.10C2的重链和轻链CDR的抗体相比,该抗体可具有较高的荧光素酶报告基因活性(例如,如本文实例中所述的在Jurkat-NFAT报告基因测定中的较低EC50)。在一些实施方案中,与包含3.10C2的重链和轻链CDR的抗体相比,该抗体可在Jurkat-NFAT报告基因细胞中显示对sTREM2脱落的更大抑制作用(例如,在如实例中所述的测定中)。
hPara.09.v2变体抗体
在一些实施方案中,本文的抗体可包含hPara.09.v2的重链和轻链CDR以及hPara.09.v2抗体的重链框架区,如上文所述和图12A至12B中所示,但在抗体轻链中具有额外的修饰,例如,如图13A中所示。例如,在一些实施方案中,可以在框架区中作出某些轻链修饰以提高表达产量,如下文实例中所述。
在一些此类实施方案中,抗体包含以下VH和VL组中的一者:(a)SEQ ID NO:133和132(抗体hPara.09.v2 Q100P);(b)SEQ ID NO:135和134(抗体hPara.09.v2 I58V/Q100P);(c)SEQ ID NO:137和136(抗体hPara.09.v2 Q100P/V104L)。在一些实施方案中,该抗体进一步包含重链和/或轻链恒定区。在一些实施方案中,抗体轻链包含SEQ ID NO:176的氨基酸序列或由该氨基酸序列组成。
在本文的任何实施方案中,该抗体可以为抗体片段,诸如Fv、单链Fv(scFv)、Fab、Fab'或(Fab')
在一些实施方案中,该抗体可以具有下文更详细描述的某些特性。例如,在一些方面,该抗体具有以下特征中的一者或多者、两者或更多者、三者或更多者、四者或更多者、五者或更多者、或全部:(a)与TREM2的茎结构域特异性结合;(b)不与可溶性TREM2(sTREM2)结合;以及(c)以通过表面等离子体共振(SPR)的在37℃小于100pM、小于50pM、小于10pM、小于7pM、小于5pM、小于4pM、小于3pM、或小于2pM、或10至50pM或10至25pM的K
在一些情况下,该抗体在脱靶结合测定中还具有低脱靶结合评分(例如,<1的评分)(如本文实例10中所述进行)。在一些情况下,与包含3.10C2的重链和轻链CDR的抗体相比,该抗体可能具有较低的对人TREM2的K
在这些情况中的任一种中,该抗体可以进一步具有下文列出的进一步的特性(a)至(i)中的一者或多者。
在一些方面,该抗体还可以具有以下特征的一者或多者、两者或更多者、三者或更多者、四者或更多者、五者或更多者、或六者或更多者、七者或更多者、八者或更多者、或全部:(a)在表达人TREM2的Jurkat-NFAT报告基因细胞中诱导荧光素酶报告基因活性;(b)降低血浆中体内sTREM2的水平;(c)在表达人TREM2的Jurkat-NFAT荧光素酶报告基因细胞中抑制sTREM2人TREM2的脱落;(d)在人MDM细胞中诱导酪氨酸磷酸化;(e)在人MDM细胞中诱导SYK磷酸化;(f)在缺乏IL-34和CSF-1的情况下,增强人iPSC来源的小胶质细胞的存活;(g)在人iPSC来源的小胶质细胞中抑制sTREM2的脱落;(h)在人iPSC来源的小胶质细胞中诱导SYK磷酸化;以及(i)在人iPSC来源的小胶质细胞中,在存在Aβ寡聚体的情况下增加总Aβ斑块强度和/或平均X04斑块强度。在一些实施方案中,与包含3.10C2的重链和轻链CDR的抗体相比,该抗体可具有较高的荧光素酶报告基因活性(例如,如本文实例中所述的在Jurkat-NFAT报告基因测定中的较低EC50)。在一些实施方案中,与包含3.10C2的重链和轻链CDR的抗体相比,该抗体可在Jurkat-NFAT报告基因细胞中显示对sTREM2脱落的更大抑制作用(例如,在如实例中所述的测定中)。
在一些实施方案中,这些抗体包含以下VH和VL组中的一者:(a)SEQ ID NO:133和132(抗体hPara.09.v2 Q100P);(b)SEQ ID NO:135和134(抗体hPara.09.v2 I58V/Q100P);(c)SEQ ID NO:137和136(抗体hPara.09.v2 Q100P/V104L)。
编码抗体的核酸
还提供了包含编码抗TREM2抗体的一条或多条链的多核苷酸的核酸分子。在一些实施方案中,核酸分子包含编码抗TREM2抗体的重链或轻链的多核苷酸。在一些实施方案中,核酸分子包含编码重链的多核苷酸和编码抗TREM2抗体的轻链的多核苷酸两者。在一些实施方案中,第一核酸分子包含编码重链的第一多核苷酸,并且第二核酸分子包含编码轻链的第二多核苷酸。
在一些此类实施方案中,重链和轻链从一个核酸分子表达或从两个独立的核酸分子表达为两个独立的多肽。在一些实施方案中,诸如当抗体为scFv时,单个多核苷酸编码包含连接在一起的重链和轻链两者的单个多肽。
在一些实施方案中,编码抗TREM2抗体的重链或轻链的多核苷酸包含编码前导序列的核苷酸序列,该前导序列在翻译时位于重链或轻链的N末端。如上所述,前导序列可以是天然的重链或轻链前导序列,或者可以是另一种异源前导序列。
可以使用本领域常规的重组DNA技术构建核酸分子。在一些实施方案中,核酸分子是适合在选定的宿主细胞中表达的表达载体。
载体和宿主细胞以及生产方法
提供了包含编码抗TREM2重链和/或抗TREM2轻链的多核苷酸的载体。还提供了包含编码抗TREM2重链和/或抗TREM2轻链的多核苷酸的载体。此类载体包括但不限于DNA载体、噬菌体载体、病毒载体、逆转录病毒载体等。在一些实施方案中,载体包含编码重链的第一多核苷酸序列和编码轻链的第二多核苷酸序列。在一些实施方案中,重链和轻链从载体表达为两个独立的多肽。在一些实施方案中,重链和轻链表达为单个多肽的一部分,诸如例如,当该抗体为scFv时。
在一些实施方案中,第一载体包含编码重链的多核苷酸并且第二载体包含编码轻链的多核苷酸。在一些实施方案中,第一载体和第二载体以类似的量(诸如类似的摩尔量或类似的质量量)转染到宿主细胞中。在一些实施方案中,将5:1至1:5的摩尔比或质量比的第一载体和第二载体转染到宿主细胞中。在一些实施方案中,使用介于1:1与1:5之间的编码重链的载体与编码轻链的载体的质量比。在一些实施方案中,使用1:2的编码重链的载体与编码轻链的载体的质量比。
在一些实施方案中,选择经优化用于在CHO或CHO来源的细胞、或在NSO细胞中表达多肽的载体。示例性的此类载体描述于例如Running Deer等人,Biotechnol.Prog.20:880-889(2004)。
在一些实施方案中,选择用于抗TREM2重链和/或抗TREM2轻链在动物(包括人)中的体内表达的载体。在一些此类实施方案中,多肽的表达处于以组织特异性方式起作用的启动子的控制下。例如,肝脏特异性启动子描述于例如PCT公开号WO 2006/076288中
为重组生产抗TREM2抗体,将例如如上所述的编码抗体的核酸分离并且插入至一个或多个载体中以用于在宿主细胞中进一步克隆和/或表达。可以使用常规程序来容易地对此类核酸进行分离和测序(例如,通过使用能够与编码抗体的重链和轻链的基因特异性结合的寡核苷酸探针)。
用于克隆或表达编码抗体的载体的合适宿主细胞包括本文所述的原核或真核细胞。例如,可以在细菌中产生抗体,特别是当不需要糖基化和Fc效应子功能时。关于抗体片段和多肽在细菌中的表达,参见,例如,美国专利号5,648,237、5,789,199和5,840,523。(另见Charlton,Methods in Molecular Biology,第248卷(B.K.C.Lo,B.K.C.主编,HumanaPress,Totowa,NJ,2003),第245-254页,描述抗体片段在大肠杆菌中的表达。)抗体可在表达后在可溶性级分中从细菌细胞糊中分离,并且可以进一步纯化。
除了原核生物外,诸如丝状真菌或酵母等真核微生物也是用于编码抗体的载体的合适克隆或表达宿主,该真核微生物包括这样的真菌和酵母菌株:其糖基化途径已经“人源化”,从而使得产生具有部分或完全人糖基化模式的抗体。参见Gerngross,Nat.Biotech.22:1409-1414(2004);和Li等人,Nat.Biotech.24:210-215(2006)。
用于表达糖基化抗体的合适宿主细胞也来源于多细胞生物(无脊椎动物和脊椎动物)。无脊椎动物细胞的实例包括植物细胞和昆虫细胞。已经鉴定出了许多可以与昆虫细胞一起使用的杆状病毒株,特别是用于转染草地夜蛾(Spodoptera frugiperda)细胞。
植物细胞培养物也可用作宿主。参见,例如,美国专利号5,959,177、6,040,498、6,420,548、7,125,978和6,417,429(描述了用于在转基因植物中产生抗体的PLANTIBODIES
脊椎动物细胞也可用作宿主。例如,适于在悬浮液中生长的哺乳动物细胞系可能是有用的。有用的哺乳动物宿主细胞系的其他实例包括:由SV40(COS-7)转化的猴肾CV1系;人胚胎肾系(例如Graham等人,J.Gen Virol.36:59(1977)中所述的293或293细胞);幼仓鼠肾细胞(BHK);小鼠支持细胞(例如,Mather,Biol.Reprod.23:243-251(1980)中所述的TM4细胞);猴肾细胞(CV1);非洲绿猴肾细胞(VERO-76);人宫颈癌细胞(HELA);犬肾细胞(MDCK;buffalo大鼠肝细胞(BRL 3A);人肺细胞(W138);人肝细胞(Hep G2);小鼠乳腺肿瘤(MMT060562);TRI细胞(例如,Mather等人,Annals N.Y.Acad.Sci.383:44-68(1982)中所述);MRC 5细胞;以及FS4细胞。其他有用的哺乳动物宿主细胞系包括中国仓鼠卵巢(CHO)细胞,包括DHFR
可以通过任何合适的方法纯化抗TREM2抗体。此类方法包括但不限于,使用亲和基质或疏水相互作用层析术。合适的亲和配体包括TREM2ECD和结合抗体恒定区的配体。例如,可以使用蛋白A、蛋白G、蛋白A/G或抗体亲和柱来结合恒定区并纯化抗TREM2抗体。疏水相互作用层析术,例如,丁基或苯基柱,也可能适合于纯化一些多肽。许多纯化多肽的方法是本领域已知的。在一些实施方案中,抗TREM2抗体在无细胞系统中生产。非限制性示例性无细胞系统在例如Sitaraman等人,Methods Mol.Biol.498:229-44(2009);Spirin,TrendsBiotechnol.22:538-45(2004);Endo等人,Biotechnol.Adv.21:695-713(2003)中描述。
药物使用方法
本公开还涵盖在例如药物治疗中使用本文的抗TREM2抗体的方法。例如,本公开涵盖治疗受试者中与TREM2功能丧失相关的病症的方法。本公开还涵盖降低受试者中sTREM2的水平的方法。
在一些情况下,该病症为神经炎症或神经退行性疾病。实例包括,例如,阿尔茨海默病、帕金森病、额颞叶痴呆、痴呆、多发性硬化症(MS)、肌萎缩性脊髓侧索硬化症(ALS)、Nasu-Hakola病、格林巴利综合征(GBS)、溶酶体贮积病、鞘磷脂沉积病(Neimann-Pick C)、黏多糖贮积症II/IIIB、异染性脑白质营养不良、多灶性运动神经病、神经白塞病、视神经脊髓炎(NMO)、视神经炎、多发性肌炎、皮肌炎、卒中、横贯性脊髓炎、创伤性脑损伤或脊髓损伤。在一些情况下,该病症为阿尔茨海默病。在一些情况下,该病症为MS。
例如,阿尔茨海默病(AD)的病理特点包括形成淀粉样蛋白斑块的β-淀粉样肽的细胞外沉积物以及被称为神经原纤维缠结的聚集的过度磷酸化tau的细胞内沉积物。这些病理之后为大脑炎症增加,包括经活化的星形胶质细胞和小胶质细胞,以及神经退化。AD的家族性形式可能由早老素1/2和淀粉样蛋白前体蛋白基因中的突变引起的。表达这些人类突变以及Tau蛋白中的突变的转基因小鼠在Aβ病理学、过度磷酸化Tau和神经退化中显示出类似的年龄依赖性增加。引起TREM2功能丧失的突变导致不规则的小胶质细胞斑块压实、斑块周围的神经炎性营养不良升高、aβ诱导的tau病理学和神经退化升高。不希望受理论束缚,增强TREM2活性可增强小胶质细胞活性,并通过吞噬或压实成毒性较小的淀粉样蛋白斑块来促进毒性淀粉样蛋白-β肽的去除,从而治疗AD。
多发性硬化症(MS)是一种以CNS中自体免疫相关脱髓鞘为特征的疾病。在患者中,该疾病呈现为症状(诸如共济失调、肢体无力以及视神经炎和其他神经系统效应)的发作。目前的治疗涉及免疫抑制剂,并且有效性可能有限,而没有任何疗法可以有效地预防或逆转该疾病。已提出髓鞘再生疗法作为治疗以及可能逆转MS的方法。促进少突胶质细胞从祖细胞(OPC)分化为成熟的髓鞘化少突胶质细胞的化合物和疗法已被认为是一种可能的髓鞘再生疗法以及修饰神经胶质细胞的治疗。具体地,小胶质细胞被认为在清除髓鞘碎片、促进新髓鞘形成方面发挥作用。TREM2功能丧失导致低髓鞘性脑白质营养不良,并且TREM2敲除小鼠在MS动物模型中对髓鞘再生和恢复有严重损害。不希望受理论束缚,TREM2途径的活化可加速髓鞘再生,从而治疗MS。
在各种实施方案中,抗TREM2抗体可以通过各种途径在体内施用,包括但不限于口服、静脉内、皮下、肠胃外、鼻内、肌肉内、皮内、局部、透皮和鞘内,或以其他方式通过植入或吸入施用。主题组合物可以配制成固体、半固体、液体或气体形式的制剂;包括但不限于片剂、胶囊剂、粉剂、颗粒剂、软膏剂、溶液剂、栓剂、灌肠剂、注射剂、吸入剂和气雾剂。编码抗TREM2抗体的核酸分子可以直接施用或在载体诸如病毒载体中施用。可以根据预期应用选择适当的调配物和施用途径。
在各种实施方案中,包含抗TREM2抗体的组合物以具有多种药用载体的调配物形式提供(参见例如,Gennaro,Remington:The Science and Practice of Pharmac
在各种实施方案中,包含抗TREM2抗体的组合物可通过将它们溶解、悬浮或乳化在水性或非水性溶剂(诸如植物油或其他油、合成脂肪酸甘油酯、高级脂肪酸酯或丙二醇)中而配制以用于注射或输注;并且如果需要,可以使用常规添加剂,诸如增溶剂、等渗剂、悬浮剂、乳化剂、稳定剂和防腐剂。在各种实施方案中,组合物可以例如使用加压的可接受的推进剂(诸如二氯二氟甲烷、丙烷、氮气等)配制以用于吸入。在各种实施方案中,组合物还可以诸如用可生物降解或不可生物降解的聚合物配制成缓释微胶囊。非限制性示例性可生物可降解调配物包括聚乳酸-乙醇酸聚合物。非限制性示例性不可生物降解调配物包括聚甘油脂肪酸酯。制备此类调配物的某些方法例如在EP 1 125 584 A1中描述。
还提供了包含一个或多个容器的药物包装和试剂盒,每个容器含有一个或多个剂量的抗TREM2抗体。在一些实施方案中,提供单位剂量,其中该单位剂量含有预定量的包含抗TREM2抗体的组合物,具有或不具有一种或多种额外的药剂。在一些实施方案中,这种单位剂量提供在一次性使用的预填充注射器中以用于注射。在各种实施方案中,单位剂量中含有的组合物可以包括盐水、蔗糖等;缓冲剂,诸如磷酸盐等;和/或在稳定且有效的pH范围内配制。替代性地,在一些实施方案中,组合物可以以冻干粉末的形式提供,该冻干粉末可以在添加适当的液体(例如,无菌水)后重构。在一些实施方案中,组合物包含一种或多种抑制蛋白质聚集的物质,包括但不限于蔗糖和精氨酸。在一些实施方案中,本发明的组合物包含肝素和/或蛋白聚糖。
实例
实例1:大鼠抗TREM2抗体的制备
A.材料和方法
为了生成抗人TREM2抗体,对Sprague Dawley大鼠(Charles River,Hollister,CA)或TREM2敲除小鼠(Genentech,South San Francisco)用通过基因枪或流体动力尾静脉(HTV)注射递送的各种抗原形式进行免疫:用完全弗氏佐剂(Complete Freund'sAdjuvant)或Ribi乳化的人TREM2细胞外结构域(ECD)蛋白;表达人全长TREM2的细胞外囊泡(EV);或编码全长人TREM2的pDNA(图1)。
从经免疫的动物收获淋巴结和脾脏,并如下分离B细胞。对于大鼠,使用BDBiosciences的生物素化抗体(CD4、CD8a、CD11b/c、CD161、HIS48、IgM)混合液富集经类别转换的B细胞,然后使用链霉亲和素珠进行磁力分离(Miltenyi Biotec,San Diego,CA)。对于小鼠,使用泛B细胞分离试剂盒(Miltenyi Biotec,San Diego,CA)富集B细胞,然后对IgM阳性B细胞(生物素化抗IgMII/41,BD Biosciences)进行磁力耗竭。通过电融合(HarvardApparatus,Holliston,MA),将IgM耗竭的B细胞与Sp2ab骨髓瘤细胞(Abeome,Athens,GA)融合。在Clonacell-HY培养基C(StemCell Technologies,Canada)中隔夜恢复后,在HAT(次黄嘌呤-氨基蝶呤-胸苷)(Sigma-Aldrich)中选择细胞。然后收获融合的杂交瘤,并用抗大鼠IgG-Alexa 488(Jackson ImmunoResearch)对大鼠杂交瘤进行染色,或用抗小鼠IgG FITC(Bethy Labs)对小鼠杂交瘤进行染色,并用荧光缀合的人TREM2-Alexa Fluor 643(NovusBiological)进行染色。使用FACSAriaIII分选器(BD,Franklin Lakes,NJ)将单个IgG+/人TREM2+杂交瘤细胞分选到96孔板中并培养7天。通过针对人TREM2抗原的ELISA筛选上清液,并对ELISA阳性克隆进行放大。使用表达DOX诱导型人TREM2的293细胞和功能活性,通过FACS筛选来自杂交瘤上清液的经纯化的IgG(Gamma Bind Plus,GE Healthcare,Pittsburgh,PA)的细胞表面结合。
B.结果
共有1,650个杂交瘤克隆以ELISA形式特异性结合经固定的人TREM2(图1)。其中,947个在FACS中与表达人TREM2的293细胞结合(图1)。然后对FACS阳性杂交瘤克隆的免疫球蛋白基因的可变区进行测序。
总共鉴定出229个独特的克隆,其中大部分来自用人TREM2 ECD免疫的SD大鼠(图1)。独特的FACS阳性抗TREM2克隆的可变区序列用于通过基因合成(GeneWiz)而克隆为小鼠IgG2a、具有LALAPG的无效应子小鼠IgG2a(L234A/L235A/P329G,Eu编号系统)、嵌合人IgG1、嵌合无效应子人IgG1 LALAPG(L234A/L235A/P329G)和嵌合无效应子人IgG1N297G。将重组IgG在CHO细胞中瞬时表达,并通过蛋白A和尺寸排阻层析术进行纯化。还将选定的克隆在CHO细胞中克隆为嵌合人Fab片段,并通过抗CH1亲和层析术和尺寸排阻层析术进行纯化。
实例2:抗TREM2克隆的表位特异性
A.材料和方法
筛选抗体与人TREM2茎的肽(TREM2残基129至174)的结合。使用具有重叠序列(范围从TREM2残基129至175)的肽来覆盖整个茎(图2A)。使用酶联免疫吸附测定(ELISA)将抗体表位定位到人TREM2的茎区。在涂有链霉亲和素的ELISA板中捕获重叠的生物素化肽。使用与辣根过氧化物酶缀合的抗小鼠IgG检测抗体对肽的结合。
B.结果
发现了几个与人TREM2的茎肽片段结合的抗体组,其中三种大鼠抗人抗体通常与TREM2的残基151至161结合:图2B中的抗体3.10C2、3.18E5和3.50G1(结合亲和力以nM计)。特别地,相较于与由残基129至175组成的肽结合,这三种抗体与hTREM2茎的残基146至169、146至161、149至168或151至165的肽的结合至少一样好(如果不是更好的话)。这四种肽各自涵盖从hTREM2茎的残基151至残基161的区,并且包括在hTREM2茎上的His157至Ser158切割位置,这也在图2A中描述。与129至175肽的亲和力相比,这些抗体对所有其他经测试的肽的亲和力显著降低。
实例3:大鼠抗TREM2抗体的亲和力
A.材料和方法
测试了四十六种大鼠抗人抗体对hTREM2和食蟹猴TREM2茎的结合亲和力。使用Biacore
B.结果
测量了四十六种测试抗体针对hTREM2茎的结合亲和力——所测量的K
实例4:大鼠抗体克隆的深度测序和克隆Para.09的鉴定
进行进一步的研究,目的是从经免疫的大鼠抗体库深度测序数据集中鉴定克隆,这些克隆将会具有与3.10C2、3.50G1、3.18E5和3.27H7抗体组(统称为“3.10C2组”)以及3.36F5抗体克隆类似的结合和活性特性,但具有甚至更高的对TREM2的亲和力。
A.基本原理和介绍
先前已表明,在啮齿动物抗体库中,尽管CDR H3具有多样性,但对共享相同V
此外,克隆3.36F5具有与3.10C2组克隆非常类似的V
最近描述了深度测序数据集中克隆谱系外的克隆的挖掘策略(Richardson等人,mAbs doi:10.1080/19420862.2020.1869409(2021))。然而,与此处描述的方法不同,该方法依赖于包括CDR H3在内的氨基酸同一性,并且仅限于具有相同CDR H3长度的序列(Richardson等人,2021)。这里使用的搜索策略完全忽略CDR H3序列,甚至允许不同的CDRH3长度,这与目前持有的CDR H3为主要特异性决定因素的观点相矛盾,这一观点隐含在Richardson等人的搜索策略中,该搜索策略在用于克隆选择的同一性计算中包括CDR H3序列。此外,与Richardson等人不同,我们在此描述的方法不明确要求克隆之间具有给定水平的在任何一组残基上的氨基酸同一性,仅使用V
B.材料和方法
使用大鼠特异性引物进行cDNA合成和PCR扩增,通过双末端Illumina测序对3只经免疫大鼠的V
选择来自具有IGHV6-8种系区段和不同CDR H3序列的独立克隆型的29个克隆,并将其与3.10C2克隆组的不同轻链配对以表达IgG片段。将编码所选变体的全长重链和轻链的DNA克隆以1-ml规模转染到Expi293细胞中,并如前所述通过蛋白A层析术纯化IgG(Bos等人,Biotechnol.Bioeng.112:1832-4,doi:10.1002/bit.25601(2015);Luan等人,Mabs 10:624-35,doi:10.1080/19420862.2018.1445450(2018))。
以ELISA形式测试克隆与TREM2茎肽的结合。每个克隆的重链CDR3显示在图4(左列)中。
C.结果
在29个选定的克隆中,一个被称为Para.09的克隆当在ELISA中与3.10C2组的轻链配对时强劲地结合至人TREM2茎肽(TREM2残基129至175)并且结合至从残基149至158的TREM2肽片段,类似于3.10C2对照(图4)。克隆Para.09的CDR H3序列比3.10C2组的CDR H3长1个残基,并且具有不同的IGHJ种系区段(IGHJ3而不是IGHJ2),这表明Para.09不是3.10C2组的克隆变体,而是大鼠库中独立生成的克隆谱系。此外,当忽略插入时,Para.09相对于3.10C2组在CDR H3中具有2个氨基酸差异(对于3.10C2和Para.09分别为TG-LDY与TDILEY,插入下划线,并且差异以粗体和斜体突出显示)(图3B)。也就是说,Para.09的CDR H3残基中只有一半(在IMGT系统中为6个中的3个,在Kabat系统中为4个中的2个)在克隆3.10C2中的类似位置处是相同的。突出显示Para.09相对于3.10C2类克隆的独立克隆起源,Para.09在重链框架4区中具有大鼠IGHJ3种系区段,而3.10C2组克隆具有大鼠IGHJ2种系区段。
此外,单独的CDR H3序列不预测TREM2结合物。这以克隆Para.10为例,其在与3.10C2组或种系轻链中的任一者配对时不与TREM2茎或肽片段149至158(即由3.10C2组中的抗体结合的表位)结合(图3A至3B)。该克隆的CDR H3比3.10C2组中的CDR H3长1个残基(并且与Para.09CDR H3的长度相同),而在其他位置处没有区别(对于3.10C2和Para.10分别为TGL-DY与TGLGDY,插入下划线)。也就是说,在Para.09CDR H3区中没有明显的序列特性,这使得该克隆成为明显的抗TREM2候选物。最后,深度测序数据集中3.10C2组和Para.09谱系序列的频率解释了不太可能通过杂交瘤发现Para.09克隆的原因:而在深度测序数据集中,有8,283个读段计数是关于147个独特的3.10C2组V
A.材料和方法
通过SPR在Biacore
B.结果
与包含抗体3.10C2的重链和轻链可变区的Fab相比,所有Para.09克隆变体均显示出显著更高的亲和力,无论使用何种轻链,并且尽管Para.09中的CDR H1和H2相对于3.10C2具有高度类似性(表1)。这指示CDR H3对于更高的结合亲和力至关重要。在结合动力学中,较高的亲和力通过较高的缔合速率(k
实例6:TREM2茎中与抗体相互作用的残基的定位(mapping)
A.材料和方法
虽然预计Para.09的表位与3.10C2组中的抗体驻留在同一区中,但根据抗体的生成方式,执行了更详细的研究以评估单个残基对结合的重要性。克隆Para.09、抗体3.10C2和3.10C2组的其他抗体(诸如3.50G1)的表位定位是通过测试与具有残基149至161的单个丙氨酸点突变或在位置153处的丙氨酸至甘氨酸突变的合成TREM2肽的结合来进行的(图5)。在Octet Red仪器中通过生物层干涉仪(BLI)测试对合成肽的结合,将合成肽固定在链霉亲和素涂覆的传感器尖端中,并将肽与游离的可溶性Fab片段结合,以避免遮掩对结合的效应的亲合力效应。这是必要的,因为单突变对于抗体结合的效应由于它们的高亲和力而不明显,尤其是Para.09,即使对突变体的亲和力降低,它也能强劲地结合至突变型肽。因此,使用Fab片段的结合降低或更快解离作为这些突变对于抗体结合的影响的读出。
B.结果
重叠肽定位为3.10C2、3.18E5和3.50G1的表位提供近似跨度,该表位来自从残基Glu-151至介于残基Ile-159到Arg-161(含)之间的间隔的范围(图2A至2B)。如本实例中所述,通过突变扫描对3.10C2、3.50G1和Para.09的进一步定位表明,具有对结合重要的侧链的残基位于从Asp-152至Ile-159(含)的范围内,与结合至重叠肽相一致。如图5所示,抗体3.10C2和3.50G1(两者均在3.10C2组中)具有类似的结合谱,其中合成肽在位置152、154、157、158和159处包含丙氨酸突变,这些丙氨酸突变跨越TREM2切割位点,各自影响Fab片段与肽的结合。具体地,对于3.10C2、3.50G1和Para.09抗体中的每一者,用于结合的重要TREM2残基侧链至少包括Asp-152、His-157和Ile-159。对于具有TREM2的残基148至165的肽复合的huPara.09.v2 Q100P和hu3.10C2.v1 Q100P的晶体结构的检查
还使用突变扫描评估了几种先前描述的抗TREM2抗体与TREM2的茎区的结合。对于抗体14D3和14D8(例如,在WO2018015573中描述),A153G突变影响结合,而D152A和S158A突变不影响结合(图5),这指示3.10C2组与Para.09之间相对于14D3/14D8抗体的表位特异性差异。相较于3.10C2、3.50G1和Para.09-L27H7抗体,先前描述的9F5和AL2p-31抗体(在WO2017062672和/或WO201928292中描述),后者为9F5的人源化和亲和力成熟的版本,具有对于突变的不同敏感度模式,这些突变从残基150延伸至残基156或恰好在切割位点之前的157(图5)。与3.10C2、3.50G1和Para.09-L27H7相比,从残基158至161的丙氨酸突变不影响9F5和AL2p-31Fab的结合。因此,这些先前描述的抗体表现出的不同之处在于,它们不与切割位点任一测的残基相互作用,而仅与在切割后见于sTREM2中的残基相互作用。
实例7:抗体3.10C2的人源化
A.材料和方法
通过CDR移植将抗体3.10C2在VK2和VH3框架中人源化。简言之,将大鼠抗体的CDR区移植到轻链IGKV2-28*01和重链IGKV3-73*01框架中,这些框架是这些抗体的最接近的人种系(图6A至6B)。对于轻链,CDR区包括Kabat位置24至34(CDR L1)、50至56(CDR L2)和89至97(CDR L3),并且对于重链,包括Kabat位置26至35(CDR H1)、50至65(CDR H2)和93至102(CDR H3)。将被称为“游标(Vernier)”位置并且在大鼠抗体与人种系之间不同的结构域界面中的大鼠框架残基添加到CDR移植物中以挽救与抗原的结合,如其在CDR移植物人源化中正常地进行(参见例如美国专利号8,426,147)。在这种情况下,这些残基包括轻链残基2、4和68以及重链框架残基24、48、49、76和78(图6A至6B)。将具有不同组的人和小鼠框架残基的变体在Expi293细胞中表达为人IgG1,并通过蛋白A层析术纯化。
通过将重链变体与3.10C2-L1轻链组合来测试人源化重链变体的亲和力。将这些变体表达为Fab片段,通过蛋白A层析术纯化,并使用Biacore
B.结果
具有带有所有大鼠框架游标残基的3.10C2-L1轻链变体的人源化变体的纯化产量始终很低(图7A)。具有大鼠框架残基Thr-2以及人残基Met-4和Gly-68的另一种轻链变体3.10C2-L5在Expi293细胞中也始终具有低产量(图7A)。
两种人源化变体3.10C2-H3/3.10C2-L1和3.10C2-H5/3.10C2-L1 Fab片段具有与大鼠3.10C2 Fab片段相当的解离速率,但具有显著降低的缔合速率(表2)。其他变体具有显著较低的解离速率(表2)。
人源化变体的低表达,加上测试的Fab变体在溶液中的意外低缔合速率,表明表达和产物品质上存在缺陷。在几种人源化重链变体(图7A)仍保留对应于重链(HH)二聚物的洗脱峰的情境中,在轻链中用Gln-100(人残基)替换Pro-100(大鼠残基),该位置为人源化中通常不包括的框架4位置,在轻链L9和L10(分别对应于具有Pro-100的轻链1和5)中恢复了IgG的表达。
使用轻链Pro-100突变体的结果表明,表达不佳是由于轻链中的缺陷所致。我们通过表达由3.10C2-H1重链(具有框架位置24、48、49、76和78作为3.10C2大鼠残基的人源化变体)与人源化3.10C2-L1或大鼠3.10C2轻链组合构成的杂合Fab片段来证实这一点。3.10C2-H1/3.10C2-L1人源化变体表达较差,而具有3.10C2-H1重链和大鼠3.10C2轻链的杂合Fab片段表达强劲(图7B),这证实人源化3.10C2的轻链在表达上有缺陷。我们研究了3.10C2抗体组的其他轻链是否更适合人源化和表达。
我们测试了抗TREM2抗体3.27H7的人源化轻链变体(3.10C2的克隆变体)与人源化3.10C2重链配对是否会导致人源化变体更好的表达和产物品质。将3.27H7轻链在与3.10C2轻链相同的框架中人源化,在移植物中包括轻链框架残基2、4、58和68(图8A至8B)。将人源化3.10C2重链变体与人源化3.27H7轻链变体组合,以产生具有N297G突变的人IgG1。
表达并纯化了四种人源化3.10C2/3.27H7杂合变体。通过蛋白A层析术纯化后,3.10C2-H1/3.27H7-L1克隆以246mg/L在瞬时转染的CHO细胞中表达良好,并显示出具有99.5%物质的单分散峰。
变体3.10C2-H3/3.27H7-L1 IgG和3.10C2-H3/3.27H7-L6 IgG以364和408mg/L在CHO细胞中也表达良好。然而,通过质谱法在经纯化的样品中检测到一些重链-重链(HH)二聚物。
变体3.10C2-H1/3.27H7-L6 IgG以356mg/L在CHO细胞中表达良好,通过尺寸排阻层析术显示单分散峰,并且在非还原条件下通过质谱法未检测到HH二聚物。该变体被重新命名为h3.10C2.v1,并且其序列如图9A至9B中所示。
h3.10C2.v1(图9A至9B)对人和食蟹猴TREM2的亲和力通过SPR在Biacore
实例8:通过饱和诱变使抗体3.10C2重链的亲和力成熟
A.材料和方法
通过重叠重组PCR构建基于3.10C2抗体重链的突变体文库,目的是进一步提高抗体亲和力。将编码重链和轻链的DNA片段混合,每种突变体混合一次,并用于以1ml规模转染Expi293细胞,并如前所述通过蛋白A层析术进行纯化(Bos等人,Biotechnol.Bioeng.(2015);Luan等人,Mabs(2018))。
所得文库由单个IgG克隆组成,每个克隆在重链可变区中每分子具有一个突变。在Biacore
B.结果
相对于亲本3.10C2克隆,所生成的数百个包含突变T93E和T93H的突变型克隆中只有2个克隆的解离速率显著降低但降低幅度相对小(1.4至2倍)(图10)。有趣的是,突变G94D和D101E,即Para.09相对于抗体3.10C2中相同位置的相应CDR H3残基,减少3.10C2对TREM2的亲和力(G94D)或消除结合(D101E)(图10),这指示Para.09的CDR H3在结构上不等同于3.10C2的CDR H3。另外,扫描诱变(图10)指示,克隆3.10C2的亲和力几乎达到最大值,并且不能通过重链CDR诱变轻易地提高。因此,使用克隆Para.09实现的针对与3.10C2组相同的表位的实质性较高亲和力要求CDR H3的实质性改变,包括插入,这些改变是通过探索相同结构性CDR H3序列的变化的传统亲和力优化方法所不容易获得的,但并非CDR H3中结构上不同的解决方案。
实例9:抗体Para.09的人源化
A.材料和方法
使用与用于抗体3.10C2的框架相同的框架,通过CDR移植在VK2和VH3框架中对包含Para.09重链可变区和3.27H7轻链可变区的抗体Para.09(也称为Para.09-27H7)进行人源化。简言之,将大鼠Para.09VH序列的CDR区移植到重链IGKV3-73*01框架中,该框架是该抗体的最接近的人种系(图9B)。用于Para.09人源化的轻链使用与上述抗体3.27H7相同的人源化轻链变体(图9A)。将被称为“游标(Vernier)”位置并且在大鼠抗体与人种系之间不同的结构域界面中的大鼠框架残基添加到CDR移植物中以挽救与抗原的结合,如实例7中关于3.10C2抗体人源化所述。一种具有所有框架游标位置的被称为Para.09-H1/3.27H7-L1的变体在CHO细胞中表达为具有N297G突变的人IgG1。
B.结果
与具有小鼠IgG2a或人IgG1恒定区的嵌合抗体相比,人源化Para.09-H1/3.27H7-L1的纯化产量较低(图11)。然而,与3.27H7-L6(与h3.10C2.v1中的轻链相同的轻链)配对的人源化Para.09-H1重链在CHO细胞中的表达产生了高水平的IgG(314mg/L培养物),没有HH二聚物且IgG组装的其他副产物相对较少。对具有较少大鼠框架残基的重链变体的进一步分析导致将Para.09-H5鉴定为具有最少大鼠残基的变体,其在与轻链3.27H7-L6组合时在CHO细胞中产生高水平的IgG表达(544mg/L培养物),没有可检测的HH二聚物。该变体被称为hPara.09.v2,并且其序列如图12A至12B中所示。该变体重命名为hPara.09.v2(图12A至12B),其对TREM2的单价亲和力,如上文针对h3.10C2.v1 IgG和Fab片段所述确定,对hTREM2的单价亲和力范围为11至21pM,并且对食蟹猴TREM2的单价亲和力范围为18至22pM(表3)。
表3:hPara.09.v2和h3.10C2.v1对人TREM2和食蟹猴TREM2的结合亲和力
总之,确定了一系列大鼠抗TREM2抗体的TREM2结合表位并测量了结合亲和力。(参见实例1至6)。将候选抗体经工程化以提高TREM2亲和力和表达产量,并进行人源化。(参见实例7至9)。所鉴定的抗体包括:(1)大鼠Para.09(其包含3.27H7轻链和Para.09重链;即,Para.09-L27H7;序列如图3A至3B中所示),(2)人源化Para.09.v2(即,hPara.09.v2;序列如图12A至12B中所示),(3)大鼠3.10C2(序列如图6A至6B中所示),(4)人源化3.10C2.v1(即,h.310.C2.v1;序列如图9A至9B中所示)。
实例10:脱靶结合的测定
A.材料和方法
使用杆状病毒颗粒作为抗原,用ELISA测定测试了大鼠和人源化抗体与“脱靶”(即,除预期TREM2之外的靶标)结合的潜力(BV ELISA;
B.结果
具有人IgG1恒定区的嵌合大鼠抗体在测定中具有非常低的反应性,评分低于1(图15)。类似地,人源化抗TREM2抗体h3.10C2.v1和hPara.09.v2(两者均作为人IgG1 N297G)的归一化BV ELISA评分低于1(图15),这指示没有可检测的脱靶结合倾向。因此,人源化h3.10C2.v1和hPara.09.v2抗体具有对TREM2的高亲和力,在中至低皮摩尔范围内,同时保留有利的、低的或不可检测的脱靶结合潜力。
实例11:与可溶性TREM2的结合的确定
A.材料和方法
使用人TREM2 ELISA测定来测量超过四十种抗体与可溶性TREM2(sTREM2)的结合,如下所示:将测试抗hTREM2抗体涂覆到板孔上作为捕获试剂,并使用生物素化的IgV反应性单克隆抗体3.17A9作为检测试剂。将抗体1.16B8用作对照抗体以建立sTREM2结合的标准。将涂有测试抗体或对照抗体的板与来自表达hTREM2的转基因小鼠的骨髓源性巨噬细胞(BMDM)培养物的稀释培养物上清液一起温育。sTREM2由表达hTREM2的BMDM培养物组成性地产生,并脱落到培养物上清液中。对于检测,在450nm处记录测量值;并且对于背景,在570nm处记录测量值。利用在R&D Systems试剂盒中提供的试剂来选择3.17A9/1.16B8抗体,因为商业试剂与一些所测试抗体的sTREM2检测不兼容。对照抗体1.16B8轻链序列显示在SEQ IDNO:170中,并且其重链序列显示在SEQ ID NO:171中。检测抗体3.17A9轻链序列显示在SEQID NO:168中,并且重链序列显示在SEQ ID NO:169中。
B.结果
图16示出了抗体的sTREM2结合的值。将结合相对于对照(CTL)抗体1.16B8(其设置为1)归一化。归一化的sTREM2结合显示为:大鼠Para.09–LC 3.27H7 mIgG2a LALAPG(Para09)、大鼠3.10C2 mIgG2aLALAPG(3.10C2)、大鼠3.18E5 mIgG2a LALAPG(3.18E5)、大鼠3.50G1mIgG2a LALAPG(3.50G1)、大鼠3.27H7 mIgG2a LALAPG(3.27H7)、大鼠3.36F5mIgG2a LALAPG(3.36F5)、A.9F5、AL2p-12、AL2p-31、AL2p-58、BM.3D3、BM.42E8、BM.RS9、BM.14D3和BM.14D8。经测试的抗体大鼠Para.09–LC 3.27H7 mIgG2a LALAPG(Para09)、大鼠3.10C2 mIgG2aLALAPG(3.10C2)、大鼠3.18E5 mIgG2a LALAPG(3.18E5)、大鼠3.50G1mIgG2aLALAPG(3.50G1)、大鼠3.27H7 mIgG2a LALAPG(3.27H7)、大鼠3.36F5 mIgG2a LALAPG(3.36F5)包含mIgG2a LALAPG重链恒定区。在经测试的抗体中,仅3.10C2、Para.09和克隆相关抗体3.18E5、3.50G1、3.27H7和3.36F5未显示与sTREM2的任何结合(参见图16,其显示与1.116B8对照相反,那些归一化的sTREM2结合接近于零的抗体)。还测试了具有hIgG1 N297G恒定区的人源化抗体Para.09.v2抗体的sTREM2结合,并且与具有mIgG2 LALAPG的大鼠Para.09一样,没有显示出与sTREM2的任何结合。
另外,在本实验中测试了先前在文献中描述为与茎hTREM2结合的九种抗体,包括A.9F5(也称为9F5)、AL2p-12、AL2p-31、AL2p-58、BM.3D3、BM.42E8、BM.RS9、BM.14D3和BM.14D8,在例如WO2018015573、WO201955841、WO2017062672和/或WO201928292中描述。与3.10C2、Para.09、3.18E5、3.50G1、3.27H7和3.36F5抗体不同,此处测试的九种先前描述的抗体在该测定中与sTREM2结合(参见图16,其显示对于那些抗体,归一化的sTREM2结合为0.5至1.5)。当与经测试的抗体的结合谱一起考虑时,这个结果是令人惊讶的,因为经测试的抗体在TREM2茎区具有表位,并且该结果可能反映了3.10C2、Para.09、3.18E5、3.50G1、3.27H7和3.36F5抗体与先前描述的抗体相比的独特表位。(参见例如,图5。)
早前实例中描述的肽图谱和突变扫描结果可以为在3.10C2/Para.09/3.50G1与抗体9F5及其衍生物之间观察到的与可溶性TREM2的结合的差异提供基础。Para.09、3.10C2和3.50G1的表位跨越His-157与Ser-158之间的ADAM10切割位点,并且切割位点两侧都有重要的接触位点,如通过突变扫描和结构分析所确定的。(参见图5。)相反,如上文实例6中所指出的,A.9F5(图5中的9F9)及其衍生物AL2p-31的表位完全位于TREM2切割位点的N末端侧。(参见图5。)TREM2接触点的这种差异可能解释了观察到的与sTREM2结合的差异,从而导致这些先前描述的抗体与可溶性TREM2结合。
然而,令人惊讶的是,抗体14D3和14D8具有与丙氨酸突变型肽结合的模式,该模式看起来与抗体3.10C2、3.50G1和Para.09类似(图5),但仍显示出以单价和生理相关方式强劲地与sTREM2结合(图16)。这是非常令人惊讶的,因为具有非常高的亲和力的3.10C2和Para.09可以预期保留对可溶性TREM2中部分表位的结合,而亲和力较低(3至5nM)的14D3和14D8抗体可能更容易失去与这些部分表位的结合。这表明,早前实例中描述的结合谱可能无法解释抗TREM2抗体与TREM2之间的所有相互作用,这些相互作用是抗TREM2抗体区分全长、膜结合TREM2与可溶性TREM2形式所必需的,进一步确立了本公开的抗体的独特性。
因此,如这些结果所示,具有3.10C2、Para.09、3.18E5和3.50G1抗体结合谱的抗体是独特的。这些抗体与TREM2茎区有效地结合,而不与可溶性TREM2结合。这些抗体的特异性可具有几个潜在的益处,包括在体内给药后允许外周和脑中的可溶性TREM2保持不含所给药的抗体。这些抗体对其跨越完整TREM2的切割位点的表位的高亲和力以及它们与经切割的可溶性TREM2的结合的缺少可能以几种方式在体内有益——从允许更多所给药的抗TREM2抗体到达细胞表面上TREM2的预期靶标,到降低从细胞表面脱落的sTREM2的量。
实例12:抗TREM2抗体诱导TREM2依赖性和NFAT驱动的荧光素酶活性
A.材料和方法
使用基于Jurkat的荧光素酶报告基因细胞系来测试全长抗hTREM2抗体诱导人TREM2相关信号传导的能力。TREM2活化及其在细胞膜处与DAP12(12千道尔顿的DNAX活化蛋白)的相互作用可诱导Syk激酶(脾酪氨酸激酶,其磷酸化形式称为pSYK或磷酸化-SYK)的磷酸化以及细胞质中的其他细胞信号传导事件,最终导致经活化的T细胞核因子(NFAT)控制的基因表达的活化。因此,Syk激酶的磷酸化和NFAT控制的基因表达两者均可用于确定抗体对TREM2活性的效应以及抗体是否激动TREM2。在此测定中,Jurkat细胞经工程化以在NFAT反应元件的控制下表达荧光素酶报告基因,并且还共表达人TREM2和DAP12,以测试添加抗体是否会由于NFAT的活化而诱导报告基因的表达。
亲本Jurkat荧光素酶报告基因细胞系(人T淋巴细胞;Signosis)经工程化以在NFAT反应元件的控制下稳定地表达萤火虫荧光素酶报告基因。然后使用基于MSCV的逆转录病毒载体转导亲本Jurkat荧光素酶报告基因细胞系,以共表达TREM2(野生型或突变体)和DAP12,以生成Jurkat-NFAT荧光素酶TREM2报告基因细胞系。
Jurkat报告基因测定用于测试抗人TREM2抗体与同种型对照抗体相比的激动作用。将每种抗体和同种型对照以10ug/mL可溶性形式添加到Jurkat-NFAT荧光素酶报告基因细胞中,并在37℃温育24小时。通过添加Bright-Glo
为了确定抗人TREM2抗体的时间依赖性报告基因活性,在添加用于测量荧光素酶活性的Bright-Glo
B.结果
在Jurkat报告基因测定中筛选了在实例1的筛选中鉴定的五十六种大鼠抗人TREM2抗体(以重组mIgG2a的形式)。在这56种抗体中,与同种型对照相比,只有8种抗体(包括四种“3.10C2组”抗体:3.10C2、3.18E5、3.27H7和3.50G1)以Luc RLU(荧光素酶相对光单位)诱导荧光素酶报告基因活性,表明这些抗TREM2抗体可以模拟Jurkat-NFAT荧光素酶报告基因细胞中的天然配体活性(图17)。在这8种抗体中,四种“3.10C2组”抗体:3.10C2、3.18E5、3.27H7和3.50G1表现出相当强的激动作用,而其他四种经测试的抗体仅表现出适度的激动活性(图17)。其余48种经测试的抗体的Luc RLU值小于同种型对照。这些数据表明,与结合茎区的外部的抗体相比,与TREM2茎的位置151至165处的特定表位特异性结合的3.10C2组抗体具有相对强的激动剂活性。
还使用Jurkat-NFAT报告基因细胞在时间进程测定中测试了相同的56种抗体。在经测试的抗体中,与同种型相比,“3.10C2组”抗体3.10C2、3.18E5、3.27H7和3.50G1也表现出强烈的时间依赖性激动剂活性(Luc RLU变化倍数)。
实例13:mIgG2a LALAPG或hIgG1 N297G形式的抗TREM2抗体在Jurkat报告基因细胞中诱导荧光素酶活性
A.材料和方法
将大鼠抗人抗体Para.09和3.10C2经工程化以包含鼠IgG2a LALAPG Fc区(以降低Fc的效应子功能),并进一步在Jurkat-NFAT荧光素酶报告基因细胞中测试激动剂活性。将人源化抗体Para.09.v2和3.10C2类似地经工程化为人IgG1 N297G形式以降低效应子功能,并且也进行了测试。如上文实例12中所述进行基于Jurkat的荧光素酶报告基因测定。为了测试抗人TREM2抗体的剂量依赖性活性,将存在连续稀释的抗人TREM2抗体的情况下将Jurkat-NFAT荧光素酶报告基因细胞培养24小时。
还评估了针对常见hTREM2突变的抗hTREM2抗体活性:构建了Jurkat-NFAT荧光素酶报告基因细胞系,其分别表达三种hTREM2突变体:R47H、R62H和H157Y。这些突变体的存在可能与阿尔茨海默病风险增加相关。
收集上清液样品进行TREM2脱落分析,然后添加Bright-Glo
B.结果
在24小时的时间点,大鼠和人源化抗体两者均表现出激动剂活性,如通过荧光素酶报告基因活性的诱导所示。参见图18A(大鼠抗体)和图18B(人源化抗体)。这些数据进一步证明,大鼠和人源化Para.09和3.10C2抗体两者均具有激动剂活性,并且此类活性与抗体效应子功能无关。
四种“3.10C2组”抗体(以mIgG2a LALAPG形式)3.10C2、3.18E5、3.27H7和3.50G1还在经工程化以分别表达三种hTREM2突变体R47H(图19A)、R62H(图19B)和H157Y(图19C)的Jurkat-NFAT报告基因细胞中诱导荧光素酶活性。这些结果表明,抗hTREM2抗体具有针对野生型hTREM2和针对这些hTREM2突变两者的激动剂活性,并且因此,它们可能对具有这些突变型TREM2蛋白的患者有用。
实例14:mIgG2a LALAPG或hIgG1 N297G形式的抗TREM2抗体在Jurkat报告基因细胞中阻断TREM2脱落
A.材料和方法
阿尔茨海默病患者可能在疾病发作前数十年就发生TREM2脱落,从而释放出可溶性TREM2。可溶性TREM2与淀粉样蛋白斑块的结合可能反过来会中断小胶质细胞对神经元保护性斑块的压实。因此,在实例12和13中描述的Jurkat-NFAT荧光素酶报告基因细胞中测试了本文的大鼠和人源化Para.09和3.10C2抗体两者,以确定它们是否也可以抑制TREM2脱落。为了确定可溶性抗人TREM2抗体在Jurkat-NFAT荧光素酶报告基因细胞中的TREM2脱落抑制活性,在24小时的时间点从报告基因测定板收获上清液,并使用ELISA测定法测量sTREM2,如上文实例11中所述。
接下来,将Jurkat-NFAT报告基因和TREM2脱落抑制测定中人源化Para.09变体hPara.09v2、hPara.09v2.Q100P/V104L和hPara.09.v2 Q100P的活性与人源化3.10C2.v1抗体的活性进行比较。在存在连续稀释的人源化抗体的情况下,将Jurkat-NFAT荧光素酶报告基因细胞培养24小时,并如上所述进行测试。
B.结果
在ELISA测定中,与相同形式的其他经测试的抗体相比,mIgG2aLALAPG形式的Para.09表现出最强的TREM2脱落抑制活性。与hIgG1N297G形式的人源化抗体h3.10C2 v1相比,hIgG1 N297G形式的人源化抗体hPara.09.v2表现出较强的TREM2脱落抑制作用(参见图20B)。显示大鼠抗体对sTREM2脱落的抑制与另一种抗体(1.20A2 mIgG2a LALAPG)相反,后者在该测定中显示出微不足道的脱落抑制。(参见图20A)。
变体hPara.09v2.Q100P/V104L和hPara.09.v2 Q100P与hPara.09v2相同,Q100P/V104L和Q100P突变分别除外(图13A至13B)。如图20C至20D所示,hIgG1 N297G形式的hPara.09v2、hPara.09v2.Q100P/V104L和hPara.09.v2 Q100P表现出相当的活性。另外,与实例13中所示的结果一致,这三种Para.09人源化抗体的活性高于人源化3.10C2.v1抗体的活性。
在Jurkat NFAT荧光素酶报告基因细胞中测量的TREM2抗体的效力(EC
表4:TREM2抗体的效力(EC
(NA=不可用)
实例15:可溶性抗TREM2抗体在人iPSC来源的小胶质细胞中阻断TREM2脱落
A.材料和方法
由于TREM2在体内在小胶质细胞中表达,因此接下来在人iPSC来源的小胶质细胞中测试了对TREM2脱落的抑制作用。为了确定人iPSC来源的小胶质细胞(CellularDynamics)中抗人TREM2抗体对TREM2脱落的抑制作用,在存在10ug/mL可溶性抗TREM2mIgG2a LALAPG抗体的情况下,用维持培养基(Cellular Dynamics)培养iPSC小胶质细胞。将ADAM10蛋白酶抑制剂GI254023X(Sigma-Aldrich)用作阻断sTREM2切割和脱落的阳性对照。在第3天收获培养物上清液样品,使用R&D测定试剂盒进行ELISA测定。
B.结果
大鼠抗人TREM2抗体3.10C2、3.18E5、3.27H7和3.50G1以与GI254023X(α-分泌酶ADAM10的有效选择性金属蛋白酶抑制剂)相当的水平降低sTREM2,而先前描述的抗体9F5抑制TREM2脱落的程度较小(图21)。这些数据表明,TREM2脱落被3.10C2、3.18E5、3.27H7和3.50G1激动性抗TREM2抗体阻断,并且细胞膜结合的TREM2也可能被这些相同的抗体稳定化。这些数据还证实了在体内表达TREM2的细胞类型中Jurkat-NFAT细胞的数据。
实例16:原代人单核细胞来源的巨噬细胞(MDM)中在TREM2活化后的磷酸化酪氨酸和pSYK活化
如上所述,TREM2在细胞膜处与DAP12的结合导致TREM2相关细胞信号传导的活化,部分直至Syk激酶(SYK)的磷酸化,以形成pSYK。因此,在人巨噬细胞模型系统中确定了抗TREM2抗体对SYK磷酸化以及对泛酪氨酸磷酸化的效应,以进一步评估这些抗体的激动剂活性。为了确保磷酸化的变化是由TREM2活性引起的,还在TREM2缺失的背景下进行了测试。以人IgG1 N297G形式测试抗体,以降低抗体效应子活性。
A.材料和方法
1.人单核细胞来源的巨噬细胞的分离和培养
使用
为了形成靶向TREM2的导引RNA双链体,将基于序列TTGTAGATTCCGCAGCGTAA或AATGGTGAGAGTGCCACCCA或TACCAGTGCCAGAGCCTCCA(分别为SEQ ID NO:173、174和175)的Alt-R CRISPR-Cas9 crRNA(Integrated DNA Technologies)在双链体缓冲液(IntegratedDNA Technologies)中溶解至100uM,并以1比1的摩尔比与以100uM溶解在Duplex缓冲液中的Alt-R tracrRNA混合。将crRNA和tracrRNA混合物通过在95℃温育5分钟进行杂交,随后在室温下温育15分钟并在-20℃储存。通过将crRNA/tracrRNA双链体与5μg Alt-RS.p.HiFiCas9核酸酶V3(Integrated DNA Technologies)以3比1的摩尔比混合并在室温下温育至少15分钟,形成核糖核蛋白复合物。将两个独立的导引RNA序列的两个核糖核蛋白复合物以1比1的比率组合,并将两个导引RNA转染到hMDM中。
为了生成TREM2缺陷细胞池,在解冻后16至24小时收集hMDM,以500x g离心5分钟,然后重悬于P3原代核转染溶液(Lonza)中,浓度为每20μL反应2-4x10
2.泛酪氨酸和SYK磷酸化的测量
对于所有实验,在添加抗TREM2抗体之前,将hMDM切换到低葡萄糖培养基中并剥夺M-CSF和血清24小时。将hMDM与抗体在37℃温育10或20分钟。抗体刺激后,去除培养基,并在含有完整微型蛋白酶抑制剂(Roche)和phosSTOP(Roche)磷酸酶抑制剂的RIPA缓冲液中裂解细胞。收集蛋白质裂解物后,使用样品测量泛磷酸化酪氨酸(pY)和磷酸化SYK活性两者。对于pY表达,对样品进行蛋白质印迹分析,并将膜与P-Y-1000(1:1000,Cell SignalingTechnology)和抗β肌动蛋白(1:1000,Sigma Aldrich)在4℃温育过夜。第二天,在室温下在黑暗中添加二级荧光抗体1小时,并使用Odyssey红外成像平台(1:10,000,LI-COR)进行成像。在ImageStudio Lite(LI-COR)中计算条带强度,并且在相对于同种型对照归一化之前将所有样品相对于加载对照归一化。
按照试剂盒说明,使用相应的
B.结果
在图22A中,基于蛋白质印迹法评估泛磷酸化酪氨酸活性。相对于同种型对照,hPara.09.v2 N297G治疗显示,在刺激后20分钟时,pY显著增加。在图22B中,用
实例17:抗TREM2抗体Para.09促进人iPSC小胶质细胞存活
由于TREM2在脑中在小胶质细胞中表达,因此在人iPSC来源的小胶质细胞模型系统中进行了进一步的实验,以确定抗体对于小胶质细胞存活、sTREM2脱落、SYK磷酸化以及Aβ斑块形成和压实的效应。
A.材料和方法
1.iPSC小胶质细胞存活测定(EC
i.抗体涂覆
为了涂覆384孔板(Cell Carrier Ultra,Perkin Elmer),在冷DMEM/F12(Gibco)中制备1mg/mL的N297G和LALAPG变体h3.10C2.v1和hPara.09.v2.N297G的储备溶液。将储备溶液混合并用于在96孔试剂主体(Greiner Bio-One)中进行连续稀释。使用配备有自动多通道移液器(Voyager125μL,Integra)的移液机器人(Assist Plus,Integra),通过25μL/孔的重复分配(n=4至6),将涂渍溶液转移到384孔板中。为了最大限度地减少蒸发和边缘效应,以DPBS(Sigma-Aldrich)填充外孔。短暂离心后,将板在37℃、5% CO
ii.iPSC小胶质细胞培养基制备
所使用的基础培养基是含有以下各项的基础培养基(BrainPhys Basal,StemCellTechnologies):B27补充剂(Gibco)、N2补充剂(Gibco)、1mM肌酸(Sigma)、200nM L-抗坏血酸2-磷酸倍半镁(Sigma)、20ng/mL重组BDNF(Peprotech)、20ng/mL重组人GDNF(Peprotech)、1μg/mL小鼠层粘连蛋白(Gibco)、0.5mM Glutamax
iii.iPSC小胶质细胞解冻、接种和培养
将人野生型或TREM2KO iPSC来源的小胶质细胞(iCell Microglia,FujifilmCellular Dynamics,Inc.)在完全的小胶质细胞培养基中解冻。计数后,将细胞离心并重悬于最低营养素小胶质细胞培养基中。对于细胞存活测定,吸出先前涂覆的384孔板(CellCarrier Ultra,Perkin Elmer)的涂渍溶液,并将细胞以8,000个细胞/孔接种到50μL的相应培养基中。将板短暂离心,并将细胞在37℃、5% CO
iv.上清液的收集及细胞的固定
培养3天后,通过配备有自动多通道移液器(Voyager 125μL,Integra)的移液机器人(Assist Plus,Integra)收集细胞的上清液。吸液速度设置为2μL/秒,并且移液高度保持在板底部上方1至1.2mm,以避免干扰细胞层。将30μL/孔转移至384深孔微孔板(GreinerBio-One)。收集上清液后,立即将细胞在DPBS(Sigma-Aldrich)中的4% PFA(ElectronMicroscopy Science)、4%蔗糖(Sigma-Aldrich)中在室温下固定1小时。固定后,将细胞用DPBS(Sigma-Aldrich)洗涤两次。
2.免疫染色
在免疫染色之前,将细胞与在DPBS(Sigma-Aldrich)中含有2%正常驴血清(JacksounImmuno Research)、1% BSA(JacksonImmuno Research)和0.1% Triton X-100(Sigma-Aldrich)的封闭缓冲液一起在室温下温育1小时。将初级兔抗Iba1多克隆抗体(1:500,Wako)稀释在封闭溶液中,在室温下温育1小时,并将细胞用封闭缓冲液洗涤三次。在封闭缓冲液中制备二级Cy3驴抗兔(1:600,JacksonImmuno Research)、Alexa Fluor
3.成像
在配备有20倍水浸物镜的自动高内涵成像仪(Opera
4.iPSC小胶质细胞Aβ斑块形成测定
为了测试板结合的抗TREM2抗体在Aβ斑块形成和压实中的效应,执行了体外人iPSC-MG斑块形成测定,该测定使用合成Aβ寡聚体模拟在AD脑中发现的增加的Aβ寡聚体水平。如本实例的部分1中所述,在存在对照抗体(gD hIgG1 N297G)或递增浓度的TREM2抗体的情况下,在存在Aβ寡聚体而没有IL-34和CSF-1的情况下,培养iPSC小胶质细胞。Aβ寡聚体是通过将重构至100μM的Aβ单体(1-42)(Anaspec)在BrainPhys
5.
将不同形式的48或96孔培养微孔板用DMEM/F12(Gibco)中的200μg/mL抗体涂覆。将96孔板(Greiner Bio-One)以50μL/孔涂覆,并将48孔板(Greiner Bio-One)以150μL/孔涂覆,并在37℃、5% CO
6.裂解物制备
培养3天后,通过用裂解缓冲液(超裂解缓冲液,Perkin Elmer)裂解细胞,获得用于测量Tyr525/526上的磷酸化和内源SYK的总水平的样品。去除使用过的培养基,并将新鲜制备的1x裂解缓冲液添加到微孔板中(对于48孔为100μL,对于96孔为60μL)。将板在板振荡器(350rpm)上于室温下搅拌10分钟。通过将裂解物连续转移到相同培养条件(N=3至4,n=2至3)的非裂解重复孔中来生成浓缩样品。将板在室温下再次搅拌10分钟,并将浓缩的裂解物转移至96孔深孔板(Greiner Bio-One)并在-80℃冷冻。
7.Luminex测定
使用Luminex多分析物分析技术(Inflammation 20-Plex Human ProcartaPlex
8.SYK磷酸化测定
为了确定抗TREM2抗体是否诱导SYK磷酸化,将野生型iPSC-MG在没有IL-34和CSF-1的培养基中并且在存在板结合的抗体的情况下在48孔板中培养,该板结合的抗体为:对照(gD hIgG1 N297G)、抗TREM2hPara.09.V2 hIgG1 N297G或变体hPara.Q100P.V104L hIgG1N297G抗体。将细胞铺板,持续指定的时间点(1小时、4小时、24小时),然后裂解并用
B.结果
1.抗TREM2抗体促进人iPSC-MG存活
通过在没有IL-34和CSF-1(二者通常为小胶质细胞存活所需)的情况下培养人iPSC来源的小胶质细胞(iPSC-MG),我们测试了与对照抗gD抗体相比,抗TREM2抗体3.10C2v1和hPara09.v2(在IgG1 N297G背景下)是否促进iPSC-MG存活。(图23A)。使用对照抗体,大多数小胶质细胞在没有IL-34和CSF-1的情况下培养3天后死亡。相比之下,3.10C2v1和hPara09.v2以剂量依赖性方式促进iPSC-MG存活。为了验证存活效应是通过TREM2信号传导介导的,还在TREM2敲除(KO)iPSC小胶质细胞中测试了抗体。抗体3.10C2v1和hPara09.v2不促进TREM2-KO iPSC小胶质细胞存活。因此,抗TREM2激动剂抗体3.10C2v1和hPara09.v2以TREM2依赖性方式促进iPSC-MG存活。
使用来自6个表位箱中的每一个的具有最高亲和力的2至4个抗体克隆,使用人iPSC-MG存活测定筛选来自实例1的筛选的抗TREM2抗体,其显示与hTREM2的不同区域的结合(图23B)。与3.10C2组相对应的表位箱中的抗体即使在1ng和10ng时也显示出最高的存活活性。因此,3.10C2组抗体在促进iPSC-MG小胶质细胞存活方面显示出最高的激动剂活性。
2.抗TREM2抗体在iPSC-MG中诱导pSYK依赖性存活
TREM2通过其与DAP12的缔合发出信号,该DAP12通过其基于胞质免疫受体酪氨酸的活化基序(ITAM)募集SYK。因此,SYK是TREM2信号传导的下游效应子。如图23C所示,与对照抗gD抗体相比,hPara.09.V2 hIgG1 N297G和变体hPara.Q100P.V104L hIgG1 N297G抗体在温育1小时的时间点显示出磷酸化SYK的2倍升高,并且在4小时的时间点显示出超过10倍诱导(误差条+/-SEM。*P<0.05,**P<0.01,****<0.0001,使用2因子ANOVA)。磷酸化SYK水平在24小时的时间点恢复至对照水平。与上述对于人MDM细胞的结果一致,两种抗体均通过SYK激酶在iPSC来源的小胶质细胞中引发TREM2信号传导增加。
为了测试TREM2活化介导的存活是否需要SYK激酶活性,将人iPSC-MG与抗TREM2抗体hPara.09.V2 hIgG1 N297G在存在250nM的SYK抑制剂PRT-060318(PRT318)的情况下温育(图23D)。在存在SYK抑制剂的情况下,hPara.09.V2 hIgG1 N297G不促进iPSC-MG存活,这指示TREM2介导的存活功能需要SYK活性。
iPSC-MG测定进一步用于确定抗TREM2抗体克隆的EC
这些数据进一步证实,在巨噬细胞和小胶质细胞模型中,抗体通过SYK磷酸化有效地活化TREM2信号传导。
3.抗TREM2抗体和TREM2针对阿尔茨海默病的神经保护功能
先前的几项研究指示,TREM2活性可调节小胶质细胞将Aβ堆积成致密斑块,并且这可能在阿尔茨海默病(AD)中赋予重要的神经保护活性。(Ulrich等人,ACS Chem Neuroscidoi:10.1021/acschemneuro.5b00313(2016);Yeh FL等人,Trends Mol Med doi:10.1016/j.molmed.2017.03.008(2017);Bohlen CJ等人,Ann Rev Genet doi:10.1146/annurev-genet-112618-043515(2019);Wang Y等人,J Exp Med doi:10.1084/jem.20151948(2016);Meilandt WJ等人,J Neurosci doi:10.1523/JNEUROSCI.1871-19.2019(2020)。)
图24A单独地及组合地(合并的)示出了用对照抗gD抗体或hPara09.Q100P处理的细胞的染色,这些细胞具有Aβ(Aβ)、淀粉样蛋白斑块(X04)和IBA1的标志物。将Aβ寡聚体添加到人iPSC来源的小胶质细胞培养物中2天,导致稳健的Aβ斑块状结构形成和Aβ聚集体的形成(图24A左侧的Aβ图)。淀粉样蛋白特异性结合染料甲氧基-X04结合至在淀粉样蛋白斑块中发现的Aβ肽的特异性确认(Klunk WE等人,Neutopathol Exp Neurol doi:10.1093/jnen/61.9.797(2002))。使用X04染色确认观察到的聚集体是由小胶质细胞形成的淀粉样蛋白斑块。(图24A,中心的X04图。)IBA1标志物标记小胶质细胞。在图24A中,右侧的IBA1图显示在存在hPara09.Q100P hIgG1 N279G抗体的情况下强度更高的IBA1染色。
Aβ和X04染色强度的增加各自反映了淀粉样蛋白斑块的形成和压实。与对照抗体相比,hPara09.Q100P hIgG1 N279G增强人iPSC小胶质细胞中Aβ聚集体的形成(图24A)。用对照抗体处理的细胞中的Aβ聚集体更分散,而在存在抗TREM2 hPara09.Q100P hIgG1N279G抗体的情况下形成的Aβ聚集体更亮且密实得多,并且是圆的(图24A,Aβ图)。增加的Aβ染色指示,响应于抗TREM2 hPara09.Q100P hIgG1 N279G抗体,有更多的Aβ肽被压实到Aβ聚集体的相同区域中。与Aβ染色一致,在存在抗TREM2的情况下,Aβ聚集体中也存在强度更高的X04染色,这指示更多的染料与特定的淀粉样蛋白斑块状结构结合(图24A,X04图)。与对照相比,在存在抗TREM2的情况下,在淀粉样蛋白斑块周围检测到更多的小胶质细胞(图24A,合并图)。
除了hPara09.Q100P hIgG1 N279G之外,本测定还测试了几种人源化抗TREM2抗体。为了将总淀粉样蛋白斑块形成定量,测量总X04强度并将其相对于无抗体对照进行归一化。每个条件N=4个孔。误差条+/-SEM。在存在抗TREM2抗体的情况下,淀粉样蛋白斑块状结构增加了至多5倍。(图24B)。为了测量淀粉样蛋白斑块压实,测量了每个Aβ聚集体区域内斑块染料X04染色的平均强度。图24C示出了在增加的抗体浓度下的平均X04 iPSC-MG斑块强度。每种抗体的EC
因此,用本公开的抗TREM2抗体进行治疗证明磷酸化SYK比率增加了至多10倍,这指示TREM2信号活化,并且导致在缺乏所需小胶质细胞生长因子IL-34和CSF-1的情况下小胶质细胞存活增加了5至8倍。在存在模拟AD病理性脑环境的Aβ寡聚体的情况下,抗TREM2抗体还将Aβ斑块的形成和压实增加了3至5倍,如通过总Aβ斑块强度和平均X04斑块强度的增加所测量。这种小胶质细胞存活的增加可能允许更多的小胶质细胞作用于Aβ寡聚体并将其堆积成淀粉样蛋白斑块。因此,这些抗体可以通过在人小胶质细胞中活化TREM2信号传导、功能性地增加小胶质细胞存活并促进Aβ压实成淀粉样蛋白斑块来提供体内神经保护。
实例18A:3.10C2和Para.09的全身施用在小鼠中降低体内可溶性TREM2水平
A.材料和方法
通过腹膜内(i.p.)施用,在PS2APP小鼠TREM2敲除(KO)背景下用3.10C2、Para.09(大鼠Para.09-LC 3.27H7)或对照gp120 IgG抗体向表达人TREM2的转基因小鼠给药。每种抗体包含mIgG2a LALAPG主链。在第0天施用的剂量为20mg/kg和80mg/kg,并且在第3天收集血浆和脑样品。
小鼠为7至8月龄。用阿弗丁麻醉小鼠并通过心脏穿刺收集血液。将小鼠脑用冷磷酸盐缓冲盐水(PBS)灌注,取出并沿中线分开。将一个半球在4% PFA中滴注固定48小时,然后转移到PBS中,然后转移到30%蔗糖中进行冷冻保存。在滑动切片机上制作冠状切片(35μm)。从另一个半脑中分离出海马体和皮层并迅速冷冻。将皮质组织在10体积的含有蛋白酶抑制剂混合液(Roche目录号4693159001)和PhosSTOP
使用通过R&D Systems(目录号DY1828-05)进行的人TREM2ELISA测定来检测血浆和脑裂解物中的sTREM2。将测定试剂盒中提供的人sTREM2捕获抗体(AF1828)稀释在PBS中并固定在96孔板中。将板封闭并洗涤后,添加经稀释的样品和标准品,并在室温下温育2小时。洗涤后,将人sTREM2检测抗体稀释并再温育2小时。将板再洗涤一次并与链霉亲和素-HRP一起温育20分钟,然后在室温下用底物溶液温育20分钟。停止反应后,使用两个滤光片读取板,对于检测,在450nm读取,并且对于背景,在570nm读取。根据通过将光密度与浓度作图获得的标准曲线来确定浓度。
B.结果
相对于在施用对照抗体(gp120)后测量的可溶性TREM2水平,3.10C2.mIgG2aLALAPG和Para.09.mIgG2a LALAPG抗体的施用在血浆(图25A)和脑匀浆(图25B)样品两者中均引起可溶性TREM2水平的剂量依赖性降低。sTREM2的降低可能指示抗体阻断了脱落,或者替代性地它们可能在活化时诱导受体的内化。sTREM2的降低表明治疗抗体可以与体内外周和脑中的靶标结合。
实例18B:Para09施用导致体内血浆可溶性TREM2水平降低,与用比较物抗TREM2抗体所观察到的效应相反
A.材料和方法
通过i.p.施用,在PS2APP小鼠TREM2敲除(KO)背景下用Para.09(大鼠Para.09-LC3.27H7)、比较物抗体AL2p58或对照gp120 IgG抗体向表达人TREM2的转基因小鼠(5至6月龄)给药。每种抗体包含mIgG2aLALAPG主链。所施用的剂量为:Para09–100mg/kg、200mg/kg;Al2p58–20mg/kg、100mg/kg、200mg/kg;gp120同种型对照–200mg/kg。在第3天或第7天收集终末血浆。
如实例18A中所述进行动物处置、组织收集和处理以及通过R&DSystems进行的人TREM2 ELISA测定。用阿弗丁麻醉小鼠并通过心脏穿刺收集血液。使用通过R&D Systems(目录号DY1828-05)进行的人TREM2ELISA测定来检测血浆裂解物中的sTREM2。将测定试剂盒中提供的人sTREM2捕获抗体稀释在PBS中并固定在96孔板中。将板封闭并洗涤后,添加经稀释的样品和标准品,并在室温下温育2小时。洗涤后,将人sTREM2检测抗体稀释并再温育2小时。将板再洗涤一次并与链霉亲和素-HRP一起温育20分钟,然后在室温下用底物溶液温育20分钟。停止反应后,使用两个滤光片读取板,对于检测,在450nm读取,并且对于背景,在570nm读取。根据通过将光密度与浓度作图获得的标准曲线来确定浓度。
B.结果
Para.09mIgG2a LALAPG抗体的施用导致血浆样品中可溶性TREM2水平实质性地且剂量依赖性地降低70%-85%(图25C)。相反,相对于使用对照抗体时观察到的sTREM2水平,比较物抗TREM2抗体(其已被描述为与TREM2的茎区结合,AL2p58(参见WO2019028292),并且在早前实例中显示与sTREM2结合)显示血浆sTREM2水平显著增加超过2倍。如图25C中所示,在用AL2p58治疗的动物中,血浆sTREM2水平的这种增加在治疗后持续至少7天。因此,Para09的施用降低了血浆中的sTREM2水平,而比较物抗体的施用具有相反的效应,即引起体内血浆sTREM2水平的长期且显著的增加,这可能是与sTREM2结合的不期望的副作用。
实验18C:h3.10C2.v1和hPara.09.v2抗体的单剂量静脉内注射在食蟹猴中降低体内可溶性TREM2水平
A.材料和方法
在第1天,用50或200mg/kg的h3.10C2.v1.huIgG1.N297G、hPara.09.v2.hIgG.N297G或对照抗体(抗gD.hIgG1.N297G)对约2至3岁的本地雌性食蟹猴进行静脉内给药。通过手术在食蟹猴的腰椎中植入鞘内导管,以进行CSF样品收集。通过外周静脉从有意识的动物收集血液样品。对动物实施安乐死并进行大体尸检以收集脑样品。从小脑、大脑皮层和海马体收集30至50mg的脑穿刺物。对于在给药后持续时间为2天的队列,在第-7天、第0天、第1天和第2天收集CSF和血浆样品,对于在给药后持续时间为28天的队列,在第-7天、第0天、第1天、第2天、第4天、第7天、第10天、第14天、第21天和第28天收集样品。将在第-7天和第0天在治疗前收集的样品进行平均以确定基线可溶性TREM2(sTREM2)浓度。从在研究第3天和第29天实施安乐死的动物收集脑样品。
使用商用人TREM2 ELISA试剂盒(Origene EA102484)确定食蟹猴脑CSF、血浆和脑裂解物中的可溶性TREM2水平。96孔板预涂有抗TREM2捕获抗体。将100μL标准品、对照或样品添加到每个孔中,并在37℃温育90分钟。通过抽吸除去孔中的内容物,并将100μL经稀释的生物素化检测抗体添加到每个孔中。在37℃温育1小时后,将板用洗涤缓冲液洗涤3次。将100μL/孔的抗生物素蛋白-过氧化物酶二级检测试剂添加到板中,并将板在37℃进一步温育30分钟。将板洗涤5次后,添加90μL/孔的显色试剂,并将板温育15至25分钟。添加100μL/孔的终止液以终止显色。以650nm为参考波长,在450nm处测量吸光度。从标准曲线的4参数拟合外推样品的浓度。可报告的检测范围为0.0313至2.0ng/mL,CSF的定量下限为156pg/mL,血浆为313pg/mL,并且脑裂解物的定量下限为94pg/mL。
B.结果
与对照组相比,在h3.10C2.v1.huIgG1.N297G和hPara.09.v2.hIgG.N297G组中的大多数样品中观察到sTREM2降低的总体趋势(图26A-26C)。在血浆中观察到最大幅度的降低(相对于对照组,治疗组(>/=50%),然后是CSF,然后是脑。用h3.10C2.v1.huIgG1.N297G或hPara.09.v2.hIgG.N297G治疗似乎在CSF和脑中显示出剂量依赖性反应。与h3.10C2.v1.huIgG1.N297G相比,hPara.09.v2.hIgG.N297G在脑和CSF中显示出最大幅度的sTREM2降低。对于运行28天的50mg/kg组,在脑、CSF和血浆中观察到sTREM2的降低,尤其是在十天时(图26D-26F)。
sTREM2的降低表明,治疗性抗体可以与脑和CSF中的体内完整TREM2靶标结合,并且还在外周中导致sTREM2的长期降低。
实例19:TREM2活化抗体增加体内细胞增殖
A.材料和方法
将自由浮动的冠状切片(35μm,每只动物两个)在PBS中洗涤两次,每次5分钟,然后用PBS-Triton X100(0.1%)洗涤两次,每次10分钟。然后将切片在Dako Target RetrievalSolution(Roche目录号S236784-2)中于105C温育10分钟,在PBS中洗涤,然后在PBS中的5%牛血清白蛋白(BSA)0.3% Triton X100中于室温下封闭2至3小时。将初级抗体(小鼠单克隆Ki67;BD Pharmigen目录号556003)按1:100稀释并在4℃温育过夜,将驴抗小鼠Alexa555二级抗体在RT下温育2小时。将切片封固在Superfrost
对用3.10C2、Para09或对照gp120 IgG抗体(每种抗体包含mIgG2aLALAPG主链)治疗的小鼠的脑切片进行对增殖标志物Ki67染色,并计算Ki67+/DAPI+细胞的数量。对每只动物的两个切片中的Ki67和DAPI阳性细胞进行计数和取平均值。
B.结果
如图27所示,与同种型对照治疗的小鼠相比,Para.09(80mg/kg)在单次注射后三天时显著增加Ki67+细胞的数量。Ki67+细胞的单因子ANOVA发现显著的治疗效果(F(4,15)=3.477P=0.0336),通过Tukey事后多重比较,Para.09(80mg/kg)与对照同种型(gp120,80mg/kg)之间存在显著差异(p<0.05)。该数据证实,Para.09诱导TREM2途径活化并增加体内细胞增殖。
实例20:抗TREM2抗体对于人阿尔茨海默病鼠模型中淀粉样蛋白和Tau病理学的效应
阿尔茨海默病(AD)的病理特点包括形成淀粉样蛋白斑块的β-淀粉样肽的细胞外沉积物以及被称为神经原纤维缠结的聚集的过度磷酸化tau的细胞内沉积物。这些病理之后为大脑炎症增加,包括经活化的星形胶质细胞和小胶质细胞,以及神经退化。表达人早老素2和淀粉样前体蛋白突变(这些突变引起家族形式的AD)的转基因小鼠(PS2APP小鼠)显示出与AD患者类似的Aβ病理学的年龄依赖性增加。与Tau突变P301L小鼠(TauPS2APP小鼠)杂交的PS2APP小鼠显示出AD病理学的额外特征,包括过度磷酸化的Tau和神经退化。在小鼠Trem2敲除背景下,将表达人TREM2(hTREM2 BAC)的小鼠与TauPS2APP小鼠交配,以测试使用抗TREM2抗体活化人Trem2是否通过吞噬或压实成毒性较小的淀粉样蛋白斑块来增强小胶质细胞活性并促进有毒淀粉样蛋白-β肽的去除。在这项研究中,每组14至16只TauPS2APP-hTrem2小鼠从34周龄开始每周或每月(每4周)接受低剂量或高剂量的抗TREM2抗体或对照IgG抗体的全身注射,持续16周。通过在治疗开始和结束时对小鼠进行成像,通过体积MRI监测脑萎缩的变化。
给药完成后,收集血浆和脑样品以通过ELISA测量抗体暴露,将一个半脑固定在多聚甲醛中进行免疫组织化学染色,并收集皮质和海马组织进行生化分析。使用淀粉样蛋白染色剂(诸如甲氧基-X04)进行斑块形成的组织学染色。通过用小胶质细胞标志物(诸如Iba1和甲氧基-X04)染色来评估斑块周围的小胶质细胞聚集和形态变化。为了确定治疗是否会改变斑块相关的神经退化(神经炎性营养不良)的发展,用甲氧基-X04和溶酶体蛋白标志物(例如,LAMP1)对切片进行斑块共染色,该标志物在斑块周围的神经炎性营养不良中积累。
通过对各种形式的磷酸化和聚集的tau进行染色(例如,使用AT8、PHF1、MC1和p212/214抗体)来测量抗TREM2抗体治疗对海马体中pTau和神经退化的组织学测量的效应。通过用氨基铜银染色剂对切片进行染色来评估神经退化,该染色检测正在退化的轴突和突起。神经丝轻链(NfL)是正在退化的轴突的可溶性标志物,其也可以通过ELISA从血浆和CSF中进行测量。
实例21:抗TREM2抗体在多发性硬化症模型中的效应
多发性硬化症(MS)是一种以CNS中自体免疫相关脱髓鞘为特征的疾病。在患者中,该疾病呈现为症状(诸如共济失调、肢体无力以及视神经炎和其他神经系统效应)的发作。在铜立荣(cuprizone)诱导的MS脱髓鞘模型中测试抗TREM2抗体对TREM2途径的活化是否加速髓鞘再生。铜立荣是一种有毒的铜螯合剂,当引入啮齿类动物食物(0.2%至0.25%)时,其可靠地靶向少突胶质细胞,从而在脑内引起沿着白质束的脱髓鞘病变,这类似于在人MS患者中观察到的脱髓鞘。通常将小鼠治疗4周,此时胼胝体的病变可通过MRI检测到。从铜立荣食物中去除后,正常的野生型小鼠在铜立荣治疗后3天显示出降解的髓磷脂的积累(通过dMBP染色测量)、完整髓磷脂的减少(通过Solochrome花青染色测量)以及星形胶质细胞(GFAP)和小胶质细胞(Iba1)浸润到病变位点。野生型小鼠中增加的前体和成熟的少突胶质细胞(Olig2)通常在第3天升高,从而支持髓鞘再生,髓鞘再生通常在铜立荣治疗后14天时完成。电子显微镜也可用于量化白质束中髓鞘再生的水平。
使用hTREM2-BAC转基因小鼠测试抗TREM2抗体治疗对髓鞘再生事件的影响:将该转基因小鼠暴露于铜立荣食物四周以诱导病变,然后用抗TREM2抗体或同种型对照抗体(诸如gp120)治疗,同时去除铜立荣食物。通常,每组包含5至10只小鼠。各组包括食用对照食物或铜立荣食物持续4周的小鼠,其中将食用铜立荣食物持续4周的小鼠组放置为食用对照食物3、7或14天。在食用4周的铜立荣食物后,小鼠接受单次高剂量的抗TREM2或对照抗体,并在注射抗体后3、7或14天收集脑和血浆样品。使用高分辨率成像和自动分析软件(MATLAB)对胼胝体病变的染色切片(例如,每个受试者6至18个切片)进行量化。通过电子显微镜测量来自抗体注射后14天的样品的髓鞘再生。
尽管为了清楚理解的目的先前已通过举例说明和实例相当详细地描述了本发明,但是这些描述和实例不应解释为限制本发明的范围。本文引用的所有专利和科学文献的公开内容均全文以引用方式明确地并入。
序列表
下表提供了在本文的文本和附图中描述或引用的某些序列。在SEQ ID NO:90、92至93和95至101中,TREM2残基H157和S158(蛋白质中切割位点的位置)加下划线。
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
序列表
<110> 基因泰克公司
<120> TREM2 的激动剂
<130> 01164-0014-00PCT
<150> US 63/188,800
<151> 2021-05-14
<160> 177
<170> PatentIn 版本 3.5
<210> 1
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.10C2.v1 重链 CDR1
<400> 1
Asn Val Trp Met His
1 5
<210> 2
<211> 19
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.10C2.v1 重链 CDR2
<400> 2
His Ile Lys Ala Lys Ser Asp Asn Tyr Ala Thr Tyr Tyr Ala Glu Ser
1 5 1015
Val Lys Gly
<210> 3
<211> 3
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.10C2.v1 重链 CDR3
<400> 3
Leu Asp Tyr
1
<210> 4
<211> 16
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.10C2.v1 轻链 CDR1
<400> 4
Arg Ser Ser Arg Ser Leu Leu Thr Ser Lys Gly Ile Thr Ser Leu Tyr
1 5 1015
<210> 5
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.10C2.v1 轻链 CDR2
<400> 5
Arg Met Ser Asn Leu Ala Ser
1 5
<210> 6
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.10C2.v1 轻链 CDR3
<400> 6
Ala Gln Phe Leu Val Tyr Pro Tyr Thr
1 5
<210> 7
<211> 114
<212> PRT
<213> 人工序列
<220>
<223> 合成:h3.10C2.V1 重链可变区
<400> 7
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 1015
Ser Leu Lys Leu Ser Cys Ala Thr Ser Gly Phe Pro Phe Ser Asn Val
202530
Trp Met His Trp Val Arg Gln Ala Ser Gly Lys Gly Leu Glu Trp Ile
354045
Ala His Ile Lys Ala Lys Ser Asp Asn Tyr Ala Thr Tyr Tyr Ala Glu
505560
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Thr Thr
65707580
Ile Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
859095
Tyr Cys Thr Gly Leu Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val
100 105 110
Ser Ser
<210> 8
<211> 112
<212> PRT
<213> 人工序列
<220>
<223> 合成:h3.10C2.V1 轻链可变区
<400> 8
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 1015
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Arg Ser Leu Leu Thr Ser
202530
Lys Gly Ile Thr Ser Leu Tyr Trp Tyr Leu Gln Lys Pro Gly Gln Ser
354045
Pro Gln Leu Leu Ile Tyr Arg Met Ser Asn Leu Ala Ser Gly Val Pro
505560
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65707580
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Phe
859095
Leu Val Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 9
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.10C2.v1 重链 CDR1 (Chothia)
<400> 9
Gly Phe Pro Phe Ser Asn Val
1 5
<210> 10
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.10C2.v1 重链 CDR2 (Chothia)
<400> 10
Lys Ala Lys Ser Asp Asn Tyr Ala
1 5
<210> 11
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 合成:PARA.09 重链 CDR1
<400> 11
Asn Val Trp Leu His
1 5
<210> 12
<211> 19
<212> PRT
<213> 人工序列
<220>
<223> 合成:PARA.09 重链 CDR2
<400> 12
His Ile Lys Ala Lys Ser Asp Asn Tyr Ala Thr Tyr Tyr Ala Glu Ser
1 5 1015
Val Lys Gly
<210> 13
<211> 4
<212> PRT
<213> 人工序列
<220>
<223> 合成:PARA.09 重链 CDR1
<400> 13
Ile Leu Glu Tyr
1
<210> 14
<211> 16
<212> PRT
<213> 人工序列
<220>
<223> 合成:PARA.09 轻链 CDR1
<400> 14
Arg Ser Ser Arg Ser Leu Leu Thr Ser Lys Gly Ile Thr Ser Leu Tyr
1 5 1015
<210> 15
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成:PARA.09 轻链 CDR1
<400> 15
Arg Met Ser Asn Leu Ala Ser
1 5
<210> 16
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成:PARA.09 轻链 CDR1
<400> 16
Ala Gln Phe Leu Val Tyr Pro Tyr Thr
1 5
<210> 17
<211> 115
<212> PRT
<213> 人工序列
<220>
<223> 合成:hPARA.09.V2 重链可变区
<400> 17
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 1015
Ser Leu Lys Leu Ser Cys Ala Thr Ser Gly Phe Pro Phe Ser Asn Val
202530
Trp Leu His Trp Val Arg Gln Ala Ser Gly Lys Gly Pro Glu Trp Val
354045
Ala His Ile Lys Ala Lys Ser Asp Asn Tyr Ala Thr Tyr Tyr Ala Glu
505560
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65707580
Val Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
859095
Tyr Cys Thr Asp Ile Leu Glu Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 18
<211> 112
<212> PRT
<213> 人工序列
<220>
<223> 合成:hPARA.09.V2 轻链可变区
<400> 18
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 1015
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Arg Ser Leu Leu Thr Ser
202530
Lys Gly Ile Thr Ser Leu Tyr Trp Tyr Leu Gln Lys Pro Gly Gln Ser
354045
Pro Gln Leu Leu Ile Tyr Arg Met Ser Asn Leu Ala Ser Gly Ile Pro
505560
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65707580
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Phe
859095
Leu Val Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 19
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成:PARA.09 重链 CDR1 (Chothia)
<400> 19
Gly Phe Pro Phe Ser Asn Val
1 5
<210> 20
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 合成:PARA.09 重链 CDR2 (Chothia)
<400> 20
Lys Ala Lys Ser Asp Asn Tyr Ala
1 5
<210> 21
<211> 230
<212> PRT
<213> 智人
<220>
<221> 位点
<222> (1)..(230)
<223> 人 TREM2 NP_061838.1(包括信号序列)
<400> 21
Met Glu Pro Leu Arg Leu Leu Ile Leu Leu Phe Val Thr Glu Leu Ser
1 5 1015
Gly Ala His Asn Thr Thr Val Phe Gln Gly Val Ala Gly Gln Ser Leu
202530
Gln Val Ser Cys Pro Tyr Asp Ser Met Lys His Trp Gly Arg Arg Lys
354045
Ala Trp Cys Arg Gln Leu Gly Glu Lys Gly Pro Cys Gln Arg Val Val
505560
Ser Thr His Asn Leu Trp Leu Leu Ser Phe Leu Arg Arg Trp Asn Gly
65707580
Ser Thr Ala Ile Thr Asp Asp Thr Leu Gly Gly Thr Leu Thr Ile Thr
859095
Leu Arg Asn Leu Gln Pro His Asp Ala Gly Leu Tyr Gln Cys Gln Ser
100 105 110
Leu His Gly Ser Glu Ala Asp Thr Leu Arg Lys Val Leu Val Glu Val
115 120 125
Leu Ala Asp Pro Leu Asp His Arg Asp Ala Gly Asp Leu Trp Phe Pro
130 135 140
Gly Glu Ser Glu Ser Phe Glu Asp Ala His Val Glu His Ser Ile Ser
145 150 155 160
Arg Ser Leu Leu Glu Gly Glu Ile Pro Phe Pro Pro Thr Ser Ile Leu
165 170 175
Leu Leu Leu Ala Cys Ile Phe Leu Ile Lys Ile Leu Ala Ala Ser Ala
180 185 190
Leu Trp Ala Ala Ala Trp His Gly Gln Lys Pro Gly Thr His Pro Pro
195 200 205
Ser Glu Leu Asp Cys Gly His Asp Pro Gly Tyr Gln Leu Gln Thr Leu
210 215 220
Pro Gly Leu Arg Asp Thr
225 230
<210> 22
<211> 212
<212> PRT
<213> 智人
<220>
<221> 位点
<222> (1)..(212)
<223> 人 TREM2 (没有信号序列)
<400> 22
His Asn Thr Thr Val Phe Gln Gly Val Ala Gly Gln Ser Leu Gln Val
1 5 1015
Ser Cys Pro Tyr Asp Ser Met Lys His Trp Gly Arg Arg Lys Ala Trp
202530
Cys Arg Gln Leu Gly Glu Lys Gly Pro Cys Gln Arg Val Val Ser Thr
354045
His Asn Leu Trp Leu Leu Ser Phe Leu Arg Arg Trp Asn Gly Ser Thr
505560
Ala Ile Thr Asp Asp Thr Leu Gly Gly Thr Leu Thr Ile Thr Leu Arg
65707580
Asn Leu Gln Pro His Asp Ala Gly Leu Tyr Gln Cys Gln Ser Leu His
859095
Gly Ser Glu Ala Asp Thr Leu Arg Lys Val Leu Val Glu Val Leu Ala
100 105 110
Asp Pro Leu Asp His Arg Asp Ala Gly Asp Leu Trp Phe Pro Gly Glu
115 120 125
Ser Glu Ser Phe Glu Asp Ala His Val Glu His Ser Ile Ser Arg Ser
130 135 140
Leu Leu Glu Gly Glu Ile Pro Phe Pro Pro Thr Ser Ile Leu Leu Leu
145 150 155 160
Leu Ala Cys Ile Phe Leu Ile Lys Ile Leu Ala Ala Ser Ala Leu Trp
165 170 175
Ala Ala Ala Trp His Gly Gln Lys Pro Gly Thr His Pro Pro Ser Glu
180 185 190
Leu Asp Cys Gly His Asp Pro Gly Tyr Gln Leu Gln Thr Leu Pro Gly
195 200 205
Leu Arg Asp Thr
210
<210> 23
<211> 139
<212> PRT
<213> 智人
<220>
<221> 位点
<222> (1)..(139)
<223> 可溶性人 TREM2(TREM2 胞外结构域)
<400> 23
His Asn Thr Thr Val Phe Gln Gly Val Ala Gly Gln Ser Leu Gln Val
1 5 1015
Ser Cys Pro Tyr Asp Ser Met Lys His Trp Gly Arg Arg Lys Ala Trp
202530
Cys Arg Gln Leu Gly Glu Lys Gly Pro Cys Gln Arg Val Val Ser Thr
354045
His Asn Leu Trp Leu Leu Ser Phe Leu Arg Arg Trp Asn Gly Ser Thr
505560
Ala Ile Thr Asp Asp Thr Leu Gly Gly Thr Leu Thr Ile Thr Leu Arg
65707580
Asn Leu Gln Pro His Asp Ala Gly Leu Tyr Gln Cys Gln Ser Leu His
859095
Gly Ser Glu Ala Asp Thr Leu Arg Lys Val Leu Val Glu Val Leu Ala
100 105 110
Asp Pro Leu Asp His Arg Asp Ala Gly Asp Leu Trp Phe Pro Gly Glu
115 120 125
Ser Glu Ser Phe Glu Asp Ala His Val Glu His
130 135
<210> 24
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.10C2 重链 CDR1
<400> 24
Asn Val Trp Met His
1 5
<210> 25
<211> 19
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.10C2 重链 CDR2
<400> 25
His Ile Lys Ala Lys Ser Asp Asn Tyr Ala Thr Tyr Tyr Ala Glu Ser
1 5 1015
Val Lys Gly
<210> 26
<211> 3
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.10C2 重链 CDR3
<400> 26
Leu Asp Tyr
1
<210> 27
<211> 16
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.10C2 轻链 CDR1
<400> 27
Arg Ser Ser Lys Ser Leu Leu Gly Val Arg Asp Ile Thr Ser Leu Tyr
1 5 1015
<210> 28
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.10C2 轻链 CDR2
<400> 28
Arg Met Ser Asn Leu Ala Ser
1 5
<210> 29
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.10C2 轻链 CDR3
<400> 29
Ala Gln Phe Leu Arg Tyr Pro Tyr Thr
1 5
<210> 30
<211> 114
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.10C2 重链可变区
<400> 30
Glu Val Gln Leu Val Glu Thr Gly Gly Ser Leu Val Gln Pro Gly Lys
1 5 1015
Ser Leu Lys Leu Thr Cys Ala Thr Ser Gly Phe Pro Phe Ser Asn Val
202530
Trp Met His Trp Val Arg Gln Ser Pro Glu Lys Gln Leu Glu Trp Ile
354045
Ala His Ile Lys Ala Lys Ser Asp Asn Tyr Ala Thr Tyr Tyr Ala Glu
505560
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Thr Ser
65707580
Ile Tyr Leu Gln Met Asn Ser Leu Lys Glu Asp Asp Thr Ala Ile Tyr
859095
Tyr Cys Thr Gly Leu Asp Tyr Trp Gly Gln Gly Val Met Val Thr Val
100 105 110
Ser Ser
<210> 31
<211> 112
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.10C2 轻链可变区
<400> 31
Asp Thr Val Leu Thr Gln Ala Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 1015
Glu Ser Ala Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu Gly Val
202530
Arg Asp Ile Thr Ser Leu Tyr Trp Tyr Leu Gln Lys Pro Gly Lys Ser
354045
Pro Gln Leu Leu Ile Tyr Arg Met Ser Asn Leu Ala Ser Gly Val Pro
505560
Asp Arg Phe Ser Gly Ser Gly Ser Glu Thr Asp Phe Thr Leu Lys Ile
65707580
Ser Glu Val Glu Thr Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Phe
859095
Leu Arg Tyr Pro Tyr Thr Phe Gly Pro Gly Thr Lys Leu Glu Leu Lys
100 105 110
<210> 32
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.10C2 重链 CDR1 (Chothia)
<400> 32
Gly Phe Pro Phe Ser Asn Val
1 5
<210> 33
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.10C2 重链 CDR2 (Chothia)
<400> 33
Lys Ala Lys Ser Asp Asn Tyr Ala
1 5
<210> 34
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.50G1 重链 CDR1
<400> 34
Asn Val Trp Met His
1 5
<210> 35
<211> 19
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.50G1 重链 CDR2
<400> 35
His Ile Lys Ala Lys Ser Asp Asn Tyr Ala Thr Tyr Tyr Ala Glu Ser
1 5 1015
Val Lys Gly
<210> 36
<211> 3
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.50G1 重链 CDR3
<400> 36
Leu Asp Tyr
1
<210> 37
<211> 16
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.50G1 轻链 CDR1
<400> 37
Arg Ser Asn Lys Ser Leu Leu Gly Ile Arg Asp Ile Thr Ser Leu Tyr
1 5 1015
<210> 38
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.50G1 轻链 CDR2
<400> 38
Arg Met Ser Asn Leu Ala Ser
1 5
<210> 39
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.50G1 轻链 CDR3
<400> 39
Ala Gln Phe Leu Arg Tyr Pro Tyr Thr
1 5
<210> 40
<211> 114
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.50G1 重链可变区
<400> 40
Glu Val Gln Leu Val Glu Thr Gly Gly Ser Leu Val Gln Pro Gly Lys
1 5 1015
Ser Leu Lys Leu Thr Cys Ala Thr Ser Gly Phe Pro Phe Ser Asn Val
202530
Trp Met His Trp Val Arg Gln Ser Pro Glu Lys Gln Leu Glu Trp Ile
354045
Ala His Ile Lys Ala Lys Ser Asp Asn Tyr Ala Thr Tyr Tyr Ala Glu
505560
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Thr Ser
65707580
Ile Tyr Leu Gln Met Asn Ser Leu Lys Asp Asp Asp Thr Ala Ile Tyr
859095
Tyr Cys Thr Gly Leu Asp Tyr Trp Gly Gln Gly Val Met Val Thr Val
100 105 110
Ser Ser
<210> 41
<211> 112
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.50G1 轻链可变区
<400> 41
Asp Thr Val Leu Thr Gln Ala Pro Leu Ser Val Ser Val Thr Pro Gly
1 5 1015
Glu Ser Ala Ser Ile Ser Cys Arg Ser Asn Lys Ser Leu Leu Gly Ile
202530
Arg Asp Ile Thr Ser Leu Tyr Trp Phe Leu Gln Lys Pro Gly Lys Ser
354045
Pro Gln Leu Leu Ile Tyr Arg Met Ser Asn Leu Ala Ser Gly Val Pro
505560
Asp Arg Phe Ser Gly Ser Gly Ser Glu Thr Asp Phe Thr Leu Lys Ile
65707580
Ser Glu Val Glu Thr Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Phe
859095
Leu Arg Tyr Pro Tyr Thr Phe Gly Pro Gly Thr Lys Leu Glu Leu Gln
100 105 110
<210> 42
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.50G1 重链 CDR1 (Chothia)
<400> 42
Gly Phe Pro Phe Ser Asn Val
1 5
<210> 43
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.50G1 重链 CDR2 (Chothia)
<400> 43
Lys Ala Lys Ser Asp Asn Tyr Ala
1 5
<210> 44
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.18E5 重链 CDR1
<400> 44
Asn Val Trp Met His
1 5
<210> 45
<211> 19
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.18E5 重链 CDR2
<400> 45
His Ile Lys Ala Lys Ser Asp Asn Tyr Ala Thr Tyr Tyr Ala Glu Ser
1 5 1015
Val Lys Gly
<210> 46
<211> 3
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.18E5 重链 CDR3
<400> 46
Leu Asp Tyr
1
<210> 47
<211> 16
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.18E5 轻链 CDR1
<400> 47
Arg Ser Asn Lys Ser Leu Leu Gly Ile Arg Asp Ile Thr Ser Leu Tyr
1 5 1015
<210> 48
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.18E5 轻链 CDR2
<400> 48
Arg Met Ser Asn Leu Ala Ser
1 5
<210> 49
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.18E5 轻链 CDR3
<400> 49
Ala Gln Phe Leu Arg Tyr Pro Tyr Thr
1 5
<210> 50
<211> 114
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.18E5 重链可变区
<400> 50
Glu Val Gln Leu Val Glu Thr Gly Gly Ser Leu Val Gln Pro Gly Lys
1 5 1015
Ser Leu Lys Leu Thr Cys Ala Thr Ser Gly Phe Pro Phe Ser Asn Val
202530
Trp Met His Trp Val Arg Gln Ser Pro Glu Lys Gln Leu Glu Trp Ile
354045
Ala His Ile Lys Ala Lys Ser Asp Asn Tyr Ala Thr Tyr Tyr Ala Glu
505560
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Thr Thr
65707580
Ile Tyr Leu Gln Met Asn Ser Leu Lys Glu Ala Asp Thr Ala Ile Tyr
859095
Tyr Cys Thr Gly Leu Asp Tyr Trp Gly Gln Gly Val Met Val Thr Val
100 105 110
Ser Ser
<210> 51
<211> 112
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.18E5 轻链可变区
<400> 51
Asp Thr Val Leu Thr Gln Ala Pro Leu Ser Val Ser Val Thr Pro Gly
1 5 1015
Glu Ser Ala Ser Ile Ser Cys Arg Ser Asn Lys Ser Leu Leu Gly Ile
202530
Arg Asp Ile Thr Ser Leu Tyr Trp Tyr Leu Gln Lys Pro Gly Lys Ser
354045
Pro Gln Leu Leu Ile Tyr Arg Met Ser Asn Leu Ala Ser Gly Val Pro
505560
Asp Arg Phe Ser Gly Ser Gly Ser Glu Thr Asp Phe Thr Leu Lys Ile
65707580
Ser Glu Val Glu Thr Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Phe
859095
Leu Arg Tyr Pro Tyr Thr Phe Gly Pro Gly Thr Lys Leu Glu Leu Lys
100 105 110
<210> 52
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.18E5 重链 CDR1 (Chothia)
<400> 52
Gly Phe Pro Phe Ser Asn Val
1 5
<210> 53
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.18E5 重链 CDR2 (Chothia)
<400> 53
Lys Ala Lys Ser Asp Asn Tyr Ala
1 5
<210> 54
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.36F5 重链 CDR1
<400> 54
Asn Val Trp Met His
1 5
<210> 55
<211> 19
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.36F5 重链 CDR2
<400> 55
Gln Ile Lys Gly Lys Ser Asp Asn Tyr Ala Thr Tyr Tyr Ala Glu Ser
1 5 1015
Leu Gln Gly
<210> 56
<211> 3
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.36F5 重链 CDR3
<400> 56
Leu Asp Tyr
1
<210> 57
<211> 16
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.36F5 轻链 CDR1
<400> 57
Arg Ser Asn Lys Ser Leu Leu Ser Ser Lys Gly Ile Thr Ser Leu Tyr
1 5 1015
<210> 58
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.36F5 轻链 CDR2
<400> 58
Arg Met Ser Asn Leu Ala Ser
1 5
<210> 59
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.36F5 轻链 CDR3
<400> 59
Ala Gln Phe Leu Gln Tyr Pro Tyr Thr
1 5
<210> 60
<211> 114
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.36F5 重链可变区
<400> 60
Glu Val Gln Leu Val Glu Thr Gly Gly Ser Leu Val Gln Pro Gly Arg
1 5 1015
Ser Leu Lys Leu Thr Cys Ala Thr Ser Gly Phe Thr Phe Thr Asn Val
202530
Trp Leu His Trp Ile Arg Arg Ser Pro Glu Asn Gln Leu Glu Trp Val
354045
Gly Gln Ile Lys Gly Lys Ser Asp Asn Tyr Ala Thr Tyr Tyr Ala Glu
505560
Ser Leu Gln Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Glu Arg Ser
65707580
Ile Tyr Leu Gln Met Asn Asn Leu Lys Glu Glu Asp Thr Ala Ile Tyr
859095
Tyr Cys Thr Gly Leu Asp Tyr Trp Gly Gln Gly Val Met Val Thr Val
100 105 110
Ser Ser
<210> 61
<211> 112
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.36F5 轻链可变区
<400> 61
Asp Thr Val Leu Thr Gln Gly Pro Leu Ser Val Ser Val Thr Pro Gly
1 5 1015
Glu Ser Ala Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu Ser Ser
202530
Lys Gly Ile Thr Ser Leu Tyr Trp Tyr Leu Gln Lys Pro Gly Lys Ser
354045
Pro Gln Leu Leu Ile Tyr Arg Met Ser Asn Leu Ala Ser Gly Val Pro
505560
Asp Arg Phe Ser Gly Gly Gly Ser Glu Thr Asp Phe Thr Leu Lys Ile
65707580
Ser Lys Val Glu Thr Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Phe
859095
Leu Gln Tyr Pro Tyr Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105 110
<210> 62
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.36F5 重链 CDR1 (Chothia)
<400> 62
Gly Phe Thr Phe Thr Asn Val
1 5
<210> 63
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.36F5 重链 CDR2 (Chothia)
<400> 63
Lys Gly Lys Ser Asp Asn Tyr Ala
1 5
<210> 64
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.27H7 重链 CDR1
<400> 64
Asn Val Trp Leu His
1 5
<210> 65
<211> 19
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.27H7 重链 CDR2
<400> 65
Gln Ile Lys Ala Arg Ser Asp Asn Tyr Ala Thr Tyr Tyr Ala Glu Ser
1 5 1015
Val Lys Gly
<210> 66
<211> 3
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.27H7 重链 CDR3
<400> 66
Leu Asp Tyr
1
<210> 67
<211> 16
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.27H7 轻链 CDR1
<400> 67
Arg Ser Ser Arg Ser Leu Leu Thr Ser Lys Gly Ile Thr Ser Leu Tyr
1 5 1015
<210> 68
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.27H7 轻链 CDR2
<400> 68
Arg Met Ser Asn Leu Ala Ser
1 5
<210> 69
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.27H7 轻链 CDR3
<400> 69
Ala Gln Phe Leu Val Tyr Pro Tyr Thr
1 5
<210> 70
<211> 114
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.27H7 重链可变区
<400> 70
Glu Val Gln Leu Val Glu Thr Gly Gly Ser Leu Val Gln Pro Gly Gly
1 5 1015
Ser Leu Lys Leu Thr Cys Ala Thr Ser Gly Phe Pro Phe Ser Asn Val
202530
Trp Leu His Trp Ile Arg Arg Ser Pro Glu Lys Gln Leu Glu Trp Val
354045
Ala Gln Ile Lys Ala Arg Ser Asp Asn Tyr Ala Thr Tyr Tyr Ala Glu
505560
Ser Val Lys Gly Arg Phe Ile Val Ser Arg Asp Asp Ser Lys Thr Thr
65707580
Ile Tyr Leu Gln Met Asn Asn Leu Lys Glu Glu Asp Thr Ala Ile Tyr
859095
Tyr Cys Thr Gly Leu Asp Tyr Trp Gly Gln Gly Val Met Val Thr Val
100 105 110
Ser Ser
<210> 71
<211> 112
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.27H7 轻链可变区
<400> 71
Asp Val Val Leu Thr Gln Ala Pro Leu Ser Val Ser Val Thr Pro Gly
1 5 1015
Glu Ser Ala Ser Ile Ser Cys Arg Ser Ser Arg Ser Leu Leu Thr Ser
202530
Lys Gly Ile Thr Ser Leu Tyr Trp Tyr Leu Gln Lys Pro Gly Met Ser
354045
Pro His Leu Leu Ile Tyr Arg Met Ser Asn Leu Ala Ser Gly Ile Pro
505560
Asp Arg Phe Ser Gly Ser Gly Ser Glu Thr Asp Phe Thr Leu Lys Ile
65707580
Ser Glu Val Glu Pro Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Phe
859095
Leu Val Tyr Pro Tyr Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105 110
<210> 72
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.27H7 重链 CDR1 (Chothia)
<400> 72
Gly Phe Pro Phe Ser Asn Val
1 5
<210> 73
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.27H7 重链 CDR2 (Chothia)
<400> 73
Lys Ala Arg Ser Asp Asn Tyr Ala
1 5
<210> 74
<211> 114
<212> PRT
<213> 人工序列
<220>
<223> 合成:IGHV3-73*01 种系重链
<400> 74
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 1015
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Gly Ser
202530
Ala Met His Trp Val Arg Gln Ala Ser Gly Lys Gly Leu Glu Trp Val
354045
Gly Arg Ile Arg Ser Lys Ala Asn Ser Tyr Ala Thr Ala Tyr Ala Ala
505560
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65707580
Ala Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
859095
Tyr Cys Thr Arg Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val
100 105 110
Ser Ser
<210> 75
<211> 112
<212> PRT
<213> 人工序列
<220>
<223> 合成:IGKV2-28*01 种系轻链
<400> 75
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 1015
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
202530
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
354045
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
505560
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65707580
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
859095
Leu Gln Thr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 76
<211> 114
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.10C2-H1 重链可变区
<400> 76
Glu Val Gln Leu Val Glu Thr Gly Gly Ser Leu Val Gln Pro Gly Lys
1 5 1015
Ser Leu Lys Leu Thr Cys Ala Thr Ser Gly Phe Pro Phe Ser Asn Val
202530
Trp Met His Trp Val Arg Gln Ser Pro Glu Lys Gln Leu Glu Trp Ile
354045
Ala His Ile Lys Ala Lys Ser Asp Asn Tyr Ala Thr Tyr Tyr Ala Glu
505560
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Thr Ser
65707580
Ile Tyr Leu Gln Met Asn Ser Leu Lys Glu Asp Asp Thr Ala Ile Tyr
859095
Tyr Cys Thr Gly Leu Asp Tyr Trp Gly Gln Gly Val Met Val Thr Val
100 105 110
Ser Ser
<210> 77
<211> 114
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.10C2-H3 重链可变区
<400> 77
Glu Val Gln Leu Val Glu Thr Gly Gly Ser Leu Val Gln Pro Gly Lys
1 5 1015
Ser Leu Lys Leu Thr Cys Ala Thr Ser Gly Phe Pro Phe Ser Asn Val
202530
Trp Met His Trp Val Arg Gln Ser Pro Glu Lys Gln Leu Glu Trp Ile
354045
Ala His Ile Lys Ala Lys Ser Asp Asn Tyr Ala Thr Tyr Tyr Ala Glu
505560
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Thr Ser
65707580
Ile Tyr Leu Gln Met Asn Ser Leu Lys Glu Asp Asp Thr Ala Ile Tyr
859095
Tyr Cys Thr Gly Leu Asp Tyr Trp Gly Gln Gly Val Met Val Thr Val
100 105 110
Ser Ser
<210> 78
<211> 114
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.10C2-H5 重链可变区
<400> 78
Glu Val Gln Leu Val Glu Thr Gly Gly Ser Leu Val Gln Pro Gly Lys
1 5 1015
Ser Leu Lys Leu Thr Cys Ala Thr Ser Gly Phe Pro Phe Ser Asn Val
202530
Trp Met His Trp Val Arg Gln Ser Pro Glu Lys Gln Leu Glu Trp Ile
354045
Ala His Ile Lys Ala Lys Ser Asp Asn Tyr Ala Thr Tyr Tyr Ala Glu
505560
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Thr Ser
65707580
Ile Tyr Leu Gln Met Asn Ser Leu Lys Glu Asp Asp Thr Ala Ile Tyr
859095
Tyr Cys Thr Gly Leu Asp Tyr Trp Gly Gln Gly Val Met Val Thr Val
100 105 110
Ser Ser
<210> 79
<211> 112
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.10C2-L1 轻链可变区
<400> 79
Asp Thr Val Leu Thr Gln Ala Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 1015
Glu Ser Ala Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu Gly Val
202530
Arg Asp Ile Thr Ser Leu Tyr Trp Tyr Leu Gln Lys Pro Gly Lys Ser
354045
Pro Gln Leu Leu Ile Tyr Arg Met Ser Asn Leu Ala Ser Gly Val Pro
505560
Asp Arg Phe Ser Gly Ser Gly Ser Glu Thr Asp Phe Thr Leu Lys Ile
65707580
Ser Glu Val Glu Thr Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Phe
859095
Leu Arg Tyr Pro Tyr Thr Phe Gly Pro Gly Thr Lys Leu Glu Leu Lys
100 105 110
<210> 80
<211> 112
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.10C2-L5 轻链可变区
<400> 80
Asp Thr Val Leu Thr Gln Ala Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 1015
Glu Ser Ala Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu Gly Val
202530
Arg Asp Ile Thr Ser Leu Tyr Trp Tyr Leu Gln Lys Pro Gly Lys Ser
354045
Pro Gln Leu Leu Ile Tyr Arg Met Ser Asn Leu Ala Ser Gly Val Pro
505560
Asp Arg Phe Ser Gly Ser Gly Ser Glu Thr Asp Phe Thr Leu Lys Ile
65707580
Ser Glu Val Glu Thr Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Phe
859095
Leu Arg Tyr Pro Tyr Thr Phe Gly Pro Gly Thr Lys Leu Glu Leu Lys
100 105 110
<210> 81
<211> 115
<212> PRT
<213> 人工序列
<220>
<223> 合成:Para.09-H1 重链可变区
<400> 81
Glu Val Gln Leu Val Glu Thr Gly Gly Ser Leu Val Gln Pro Gly Lys
1 5 1015
Ser Leu Arg Leu Thr Cys Ala Thr Ser Gly Phe Pro Phe Ser Asn Val
202530
Trp Leu His Trp Val Arg Gln Ser Pro Glu Lys His Pro Glu Trp Val
354045
Ala His Ile Lys Ala Lys Ser Asp Asn Tyr Ala Thr Tyr Tyr Ala Glu
505560
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ser
65707580
Val Phe Leu Gln Met Asn Ser Leu Lys Glu Glu Asp Thr Ala Ile Tyr
859095
Tyr Cys Thr Asp Ile Leu Glu Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 82
<211> 115
<212> PRT
<213> 人工序列
<220>
<223> 合成:Para.09-H5 重链可变区
<400> 82
Glu Val Gln Leu Val Glu Thr Gly Gly Ser Leu Val Gln Pro Gly Lys
1 5 1015
Ser Leu Arg Leu Thr Cys Ala Thr Ser Gly Phe Pro Phe Ser Asn Val
202530
Trp Leu His Trp Val Arg Gln Ser Pro Glu Lys His Pro Glu Trp Val
354045
Ala His Ile Lys Ala Lys Ser Asp Asn Tyr Ala Thr Tyr Tyr Ala Glu
505560
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ser
65707580
Val Phe Leu Gln Met Asn Ser Leu Lys Glu Glu Asp Thr Ala Ile Tyr
859095
Tyr Cys Thr Asp Ile Leu Glu Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 83
<211> 115
<212> PRT
<213> 人工序列
<220>
<223> 合成:Para.09-H7 重链可变区
<400> 83
Glu Val Gln Leu Val Glu Thr Gly Gly Ser Leu Val Gln Pro Gly Lys
1 5 1015
Ser Leu Arg Leu Thr Cys Ala Thr Ser Gly Phe Pro Phe Ser Asn Val
202530
Trp Leu His Trp Val Arg Gln Ser Pro Glu Lys His Pro Glu Trp Val
354045
Ala His Ile Lys Ala Lys Ser Asp Asn Tyr Ala Thr Tyr Tyr Ala Glu
505560
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ser
65707580
Val Phe Leu Gln Met Asn Ser Leu Lys Glu Glu Asp Thr Ala Ile Tyr
859095
Tyr Cys Thr Asp Ile Leu Glu Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 84
<211> 112
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.27H7-L1 轻链可变区
<400> 84
Asp Val Val Leu Thr Gln Ala Pro Leu Ser Val Ser Val Thr Pro Gly
1 5 1015
Glu Ser Ala Ser Ile Ser Cys Arg Ser Ser Arg Ser Leu Leu Thr Ser
202530
Lys Gly Ile Thr Ser Leu Tyr Trp Tyr Leu Gln Lys Pro Gly Met Ser
354045
Pro His Leu Leu Ile Tyr Arg Met Ser Asn Leu Ala Ser Gly Ile Pro
505560
Asp Arg Phe Ser Gly Ser Gly Ser Glu Thr Asp Phe Thr Leu Lys Ile
65707580
Ser Glu Val Glu Pro Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Phe
859095
Leu Val Tyr Pro Tyr Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105 110
<210> 85
<211> 112
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.27H7-L6 轻链可变区
<400> 85
Asp Val Val Leu Thr Gln Ala Pro Leu Ser Val Ser Val Thr Pro Gly
1 5 1015
Glu Ser Ala Ser Ile Ser Cys Arg Ser Ser Arg Ser Leu Leu Thr Ser
202530
Lys Gly Ile Thr Ser Leu Tyr Trp Tyr Leu Gln Lys Pro Gly Met Ser
354045
Pro His Leu Leu Ile Tyr Arg Met Ser Asn Leu Ala Ser Gly Ile Pro
505560
Asp Arg Phe Ser Gly Ser Gly Ser Glu Thr Asp Phe Thr Leu Lys Ile
65707580
Ser Glu Val Glu Pro Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Phe
859095
Leu Val Tyr Pro Tyr Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105 110
<210> 86
<211> 232
<212> PRT
<213> 智人
<220>
<221> 位点
<222> (1)..(232)
<223> 人 IgG1 Fc 区
<400> 86
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
1 5 1015
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
202530
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
354045
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
505560
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
65707580
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
859095
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
100 105 110
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
115 120 125
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr
130 135 140
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
145 150 155 160
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
165 170 175
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
180 185 190
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
195 200 205
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
210 215 220
Ser Leu Ser Leu Ser Pro Gly Lys
225 230
<210> 87
<211> 232
<212> PRT
<213> 智人
<220>
<221> 位点
<222> (1)..(232)
<223> 人 IgG1 N297G Fc 区
<400> 87
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
1 5 1015
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
202530
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
354045
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
505560
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
65707580
Tyr Gly Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
859095
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
100 105 110
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
115 120 125
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr
130 135 140
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
145 150 155 160
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
165 170 175
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
180 185 190
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
195 200 205
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
210 215 220
Ser Leu Ser Leu Ser Pro Gly Lys
225 230
<210> 88
<211> 330
<212> PRT
<213> 小家鼠
<220>
<221> 位点
<222> (1)..(330)
<223> 鼠 IgG2 Fc 区
<400> 88
Ala Lys Thr Thr Ala Pro Ser Val Tyr Pro Leu Ala Pro Val Cys Gly
1 5 1015
Asp Thr Thr Gly Ser Ser Val Thr Leu Gly Cys Leu Val Lys Gly Tyr
202530
Phe Pro Glu Pro Val Thr Leu Thr Trp Asn Ser Gly Ser Leu Ser Ser
354045
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu
505560
Ser Ser Ser Val Thr Val Thr Ser Ser Thr Trp Pro Ser Gln Ser Ile
65707580
Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys
859095
Ile Glu Pro Arg Gly Pro Thr Ile Lys Pro Cys Pro Pro Cys Lys Cys
100 105 110
Pro Ala Pro Asn Leu Leu Gly Gly Pro Ser Val Phe Ile Phe Pro Pro
115 120 125
Lys Ile Lys Asp Val Leu Met Ile Ser Leu Ser Pro Ile Val Thr Cys
130 135 140
Val Val Val Asp Val Ser Glu Asp Asp Pro Asp Val Gln Ile Ser Trp
145 150 155 160
Phe Val Asn Asn Val Glu Val His Thr Ala Gln Thr Gln Thr His Arg
165 170 175
Glu Asp Tyr Asn Ser Thr Leu Arg Val Val Ser Ala Leu Pro Ile Gln
180 185 190
His Gln Asp Trp Met Ser Gly Lys Glu Phe Lys Cys Lys Val Asn Asn
195 200 205
Lys Asp Leu Pro Ala Pro Ile Glu Arg Thr Ile Ser Lys Pro Lys Gly
210 215 220
Ser Val Arg Ala Pro Gln Val Tyr Val Leu Pro Pro Pro Glu Glu Glu
225 230 235 240
Met Thr Lys Lys Gln Val Thr Leu Thr Cys Met Val Thr Asp Phe Met
245 250 255
Pro Glu Asp Ile Tyr Val Glu Trp Thr Asn Asn Gly Lys Thr Glu Leu
260 265 270
Asn Tyr Lys Asn Thr Glu Pro Val Leu Asp Ser Asp Gly Ser Tyr Phe
275 280 285
Met Tyr Ser Lys Leu Arg Val Glu Lys Lys Asn Trp Val Glu Arg Asn
290 295 300
Ser Tyr Ser Cys Ser Val Val His Glu Gly Leu His Asn His His Thr
305 310 315 320
Thr Lys Ser Phe Ser Arg Thr Pro Gly Lys
325 330
<210> 89
<211> 330
<212> PRT
<213> 小家鼠
<220>
<221> 位点
<222> (1)..(330)
<223> 鼠 IgG2 LALAPG Fc 区
<400> 89
Ala Lys Thr Thr Ala Pro Ser Val Tyr Pro Leu Ala Pro Val Cys Gly
1 5 1015
Asp Thr Thr Gly Ser Ser Val Thr Leu Gly Cys Leu Val Lys Gly Tyr
202530
Phe Pro Glu Pro Val Thr Leu Thr Trp Asn Ser Gly Ser Leu Ser Ser
354045
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu
505560
Ser Ser Ser Val Thr Val Thr Ser Ser Thr Trp Pro Ser Gln Ser Ile
65707580
Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys
859095
Ile Glu Pro Arg Gly Pro Thr Ile Lys Pro Cys Pro Pro Cys Lys Cys
100 105 110
Pro Ala Pro Asn Ala Ala Gly Gly Pro Ser Val Phe Ile Phe Pro Pro
115 120 125
Lys Ile Lys Asp Val Leu Met Ile Ser Leu Ser Pro Ile Val Thr Cys
130 135 140
Val Val Val Asp Val Ser Glu Asp Asp Pro Asp Val Gln Ile Ser Trp
145 150 155 160
Phe Val Asn Asn Val Glu Val His Thr Ala Gln Thr Gln Thr His Arg
165 170 175
Glu Asp Tyr Asn Ser Thr Leu Arg Val Val Ser Ala Leu Pro Ile Gln
180 185 190
His Gln Asp Trp Met Ser Gly Lys Glu Phe Lys Cys Lys Val Asn Asn
195 200 205
Lys Asp Leu Gly Ala Pro Ile Glu Arg Thr Ile Ser Lys Pro Lys Gly
210 215 220
Ser Val Arg Ala Pro Gln Val Tyr Val Leu Pro Pro Pro Glu Glu Glu
225 230 235 240
Met Thr Lys Lys Gln Val Thr Leu Thr Cys Met Val Thr Asp Phe Met
245 250 255
Pro Glu Asp Ile Tyr Val Glu Trp Thr Asn Asn Gly Lys Thr Glu Leu
260 265 270
Asn Tyr Lys Asn Thr Glu Pro Val Leu Asp Ser Asp Gly Ser Tyr Phe
275 280 285
Met Tyr Ser Lys Leu Arg Val Glu Lys Lys Asn Trp Val Glu Arg Asn
290 295 300
Ser Tyr Ser Cys Ser Val Val His Glu Gly Leu His Asn His His Thr
305 310 315 320
Thr Lys Ser Phe Ser Arg Thr Pro Gly Lys
325 330
<210> 90
<211> 46
<212> PRT
<213> 人工序列
<220>
<223> 合成:hTREM2 茎 129-174
<400> 90
Leu Ala Asp Pro Leu Asp His Arg Asp Ala Gly Asp Leu Trp Phe Pro
1 5 1015
Gly Glu Ser Glu Ser Phe Glu Asp Ala His Val Glu His Ser Ile Ser
202530
Arg Ser Leu Leu Glu Gly Glu Ile Pro Phe Pro Pro Thr Ser
354045
<210> 91
<211> 20
<212> PRT
<213> 人工序列
<220>
<223> 合成:hTREM2 茎 129-148
<400> 91
Leu Ala Asp Pro Leu Asp His Arg Asp Ala Gly Asp Leu Trp Phe Pro
1 5 1015
Gly Glu Ser Glu
20
<210> 92
<211> 20
<212> PRT
<213> 人工序列
<220>
<223> 合成:hTREM2 茎 139-158
<400> 92
Gly Asp Leu Trp Phe Pro Gly Glu Ser Glu Ser Phe Glu Asp Ala His
1 5 1015
Val Glu His Ser
20
<210> 93
<211> 20
<212> PRT
<213> 人工序列
<220>
<223> 合成:hTREM2 茎 149-168
<400> 93
Ser Phe Glu Asp Ala His Val Glu His Ser Ile Ser Arg Ser Leu Leu
1 5 1015
Glu Gly Glu Ile
20
<210> 94
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 合成:hTREM2 茎 159-175
<400> 94
Ile Ser Arg Ser Leu Leu Glu Gly Glu Ile Pro Phe Pro Pro Thr Ser
1 5 1015
Ile
<210> 95
<211> 24
<212> PRT
<213> 人工序列
<220>
<223> 合成:hTREM2 茎 146-169
<400> 95
Glu Ser Glu Ser Phe Glu Asp Ala His Val Glu His Ser Ile Ser Arg
1 5 1015
Ser Leu Leu Glu Gly Glu Ile Pro
20
<210> 96
<211> 16
<212> PRT
<213> 人工序列
<220>
<223> 合成:hTREM2 茎 146-161
<400> 96
Glu Ser Glu Ser Phe Glu Asp Ala His Val Glu His Ser Ile Ser Arg
1 5 1015
<210> 97
<211> 15
<212> PRT
<213> 人工序列
<220>
<223> 合成:hTREM2 茎 151-165
<400> 97
Glu Asp Ala His Val Glu His Ser Ile Ser Arg Ser Leu Leu Glu
1 5 1015
<210> 98
<211> 15
<212> PRT
<213> 人工序列
<220>
<223> 合成:hTREM2 茎 155-169
<400> 98
Val Glu His Ser Ile Ser Arg Ser Leu Leu Glu Gly Glu Ile Pro
1 5 1015
<210> 99
<211> 10
<212> PRT
<213> 人工序列
<220>
<223> 合成:hTREM2 茎 152-161
<400> 99
Asp Ala His Val Glu His Ser Ile Ser Arg
1 5 10
<210> 100
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 合成:hTREM2 茎 154-164
<400> 100
His Val Glu His Ser Ile Ser Arg Ser Leu Leu
1 5 10
<210> 101
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 合成:hTREM2 茎 151-161
<400> 101
Glu Asp Ala His Val Glu His Ser Ile Ser Arg
1 5 10
<210> 102
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.10C2 HC CDR3 (IMGT)
<400> 102
Thr Gly Leu Asp Tyr
1 5
<210> 103
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 合成:Para.01 HC CDR3 (IMGT)
<400> 103
Ile Leu Ala Tyr Ser
1 5
<210> 104
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 合成:Para.02 HC CDR3 (IMGT)
<400> 104
Thr Leu Gly Ala Tyr
1 5
<210> 105
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 合成:Para.03 HC CDR3 (IMGT)
<400> 105
Thr Pro Gly Val Tyr
1 5
<210> 106
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 合成:Para.04 HC CDR3 (IMGT)
<400> 106
Thr Arg Phe Asp Tyr
1 5
<210> 107
<211> 6
<212> PRT
<213> 人工序列
<220>
<223> 合成:Para.05 HC CDR3 (IMGT)
<400> 107
Arg Glu Gly Phe Asp Tyr
1 5
<210> 108
<211> 6
<212> PRT
<213> 人工序列
<220>
<223> 合成:Para.06 HC CDR3 (IMGT)
<400> 108
Arg Gly Arg Leu Val Asp
1 5
<210> 109
<211> 6
<212> PRT
<213> 人工序列
<220>
<223> 合成:Para.07 HC CDR3 (IMGT)
<400> 109
Arg Asn Tyr Phe Asp Tyr
1 5
<210> 110
<211> 6
<212> PRT
<213> 人工序列
<220>
<223> 合成:Para.08 HC CDR3 (IMGT)
<400> 110
Arg Ser Gly Pro Ser Tyr
1 5
<210> 111
<211> 6
<212> PRT
<213> 人工序列
<220>
<223> 合成:Para.09 HC CDR3 (IMGT)
<400> 111
Thr Asp Ile Leu Glu Tyr
1 5
<210> 112
<211> 6
<212> PRT
<213> 人工序列
<220>
<223> 合成:Para.10 HC CDR3 (IMGT)
<400> 112
Thr Gly Leu Gly Asp Tyr
1 5
<210> 113
<211> 6
<212> PRT
<213> 人工序列
<220>
<223> 合成:Para.11 HC CDR3 (IMGT)
<400> 113
Thr Pro Ala Phe Asp Tyr
1 5
<210> 114
<211> 6
<212> PRT
<213> 人工序列
<220>
<223> 合成:Para.12 HC CDR3 (IMGT)
<400> 114
Thr Arg Leu Gly Asp Tyr
1 5
<210> 115
<211> 6
<212> PRT
<213> 人工序列
<220>
<223> 合成:Para.13 HC CDR3 (IMGT)
<400> 115
Thr Arg Gln Leu Gly Gly
1 5
<210> 116
<211> 6
<212> PRT
<213> 人工序列
<220>
<223> 合成:Para.14 HC CDR3 (IMGT)
<400> 116
Thr Ser Gly Ser Leu Tyr
1 5
<210> 117
<211> 6
<212> PRT
<213> 人工序列
<220>
<223> 合成:Para.15 HC CDR3 (IMGT)
<400> 117
Thr Ser Pro Pro Asp Tyr
1 5
<210> 118
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成:Para.16 HC CDR3 (IMGT)
<400> 118
Leu Pro Lys Gly Phe Ala Tyr
1 5
<210> 119
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成:Para.17 HC CDR3 (IMGT)
<400> 119
Pro Arg Asp Leu Gly Asp Tyr
1 5
<210> 120
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成:Para.18 HC CDR3 (IMGT)
<400> 120
Ser Leu Phe Phe Asn Tyr His
1 5
<210> 121
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成:Para.19 HC CDR3 (IMGT)
<400> 121
Ser Pro Arg Gly Phe Ala Tyr
1 5
<210> 122
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成:Para.20 HC CDR3 (IMGT)
<400> 122
Ser Thr Ala Pro Phe Ala Tyr
1 5
<210> 123
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成:Para.21 HC CDR3 (IMGT)
<400> 123
Thr Phe Asn Asn Phe Asp Ser
1 5
<210> 124
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成:Para.22 HC CDR3 (IMGT)
<400> 124
Thr Gly Ser Tyr Phe Asp Tyr
1 5
<210> 125
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成:Para.23 HC CDR3 (IMGT)
<400> 125
Thr Leu Phe Phe Asn Tyr His
1 5
<210> 126
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成:Para.24 HC CDR3 (IMGT)
<400> 126
Thr Leu Gly Gly Tyr Asn Tyr
1 5
<210> 127
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成:Para.25 HC CDR3 (IMGT)
<400> 127
Thr Pro Gly Asn Phe Asn Tyr
1 5
<210> 128
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成:Para.26 HC CDR3 (IMGT)
<400> 128
Thr Ser Gly Gly Phe Asp Tyr
1 5
<210> 129
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成:Para.27 HC CDR3 (IMGT)
<400> 129
Thr Ser Gly Tyr Phe Asp Tyr
1 5
<210> 130
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成:Para.28 HC CDR3 (IMGT)
<400> 130
Thr Val Thr Leu Gly Ala Tyr
1 5
<210> 131
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成:Para.29 HC CDR3 (IMGT)
<400> 131
Thr Tyr Arg Gly Phe Asp Phe
1 5
<210> 132
<211> 112
<212> PRT
<213> 人工序列
<220>
<223> 合成:hPara.09.v2 Q100P 轻链可变区
<400> 132
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 1015
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Arg Ser Leu Leu Thr Ser
202530
Lys Gly Ile Thr Ser Leu Tyr Trp Tyr Leu Gln Lys Pro Gly Gln Ser
354045
Pro Gln Leu Leu Ile Tyr Arg Met Ser Asn Leu Ala Ser Gly Ile Pro
505560
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65707580
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Phe
859095
Leu Val Tyr Pro Tyr Thr Phe Gly Pro Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 133
<211> 115
<212> PRT
<213> 人工序列
<220>
<223> 合成:hPara.09.v2 Q100P 重链可变区
<400> 133
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 1015
Ser Leu Lys Leu Ser Cys Ala Thr Ser Gly Phe Pro Phe Ser Asn Val
202530
Trp Leu His Trp Val Arg Gln Ala Ser Gly Lys Gly Pro Glu Trp Val
354045
Ala His Ile Lys Ala Lys Ser Asp Asn Tyr Ala Thr Tyr Tyr Ala Glu
505560
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65707580
Val Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
859095
Tyr Cys Thr Asp Ile Leu Glu Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 134
<211> 112
<212> PRT
<213> 人工序列
<220>
<223> 合成:hPara.09.v2 I58V/Q100P 轻链可变区
<400> 134
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 1015
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Arg Ser Leu Leu Thr Ser
202530
Lys Gly Ile Thr Ser Leu Tyr Trp Tyr Leu Gln Lys Pro Gly Gln Ser
354045
Pro Gln Leu Leu Ile Tyr Arg Met Ser Asn Leu Ala Ser Gly Val Pro
505560
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65707580
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Phe
859095
Leu Val Tyr Pro Tyr Thr Phe Gly Pro Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 135
<211> 115
<212> PRT
<213> 人工序列
<220>
<223> 合成:hPara.09.v2 I58V/Q100P 重链可变区
<400> 135
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 1015
Ser Leu Lys Leu Ser Cys Ala Thr Ser Gly Phe Pro Phe Ser Asn Val
202530
Trp Leu His Trp Val Arg Gln Ala Ser Gly Lys Gly Pro Glu Trp Val
354045
Ala His Ile Lys Ala Lys Ser Asp Asn Tyr Ala Thr Tyr Tyr Ala Glu
505560
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65707580
Val Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
859095
Tyr Cys Thr Asp Ile Leu Glu Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 136
<211> 112
<212> PRT
<213> 人工序列
<220>
<223> 合成:hPara.09.v2 Q100P/V104L 轻链可变区
<400> 136
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 1015
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Arg Ser Leu Leu Thr Ser
202530
Lys Gly Ile Thr Ser Leu Tyr Trp Tyr Leu Gln Lys Pro Gly Gln Ser
354045
Pro Gln Leu Leu Ile Tyr Arg Met Ser Asn Leu Ala Ser Gly Ile Pro
505560
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65707580
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Phe
859095
Leu Val Tyr Pro Tyr Thr Phe Gly Pro Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 137
<211> 115
<212> PRT
<213> 人工序列
<220>
<223> 合成:hPara.09.v2 Q100P/V104L 重链可变区
<400> 137
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 1015
Ser Leu Lys Leu Ser Cys Ala Thr Ser Gly Phe Pro Phe Ser Asn Val
202530
Trp Leu His Trp Val Arg Gln Ala Ser Gly Lys Gly Pro Glu Trp Val
354045
Ala His Ile Lys Ala Lys Ser Asp Asn Tyr Ala Thr Tyr Tyr Ala Glu
505560
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65707580
Val Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
859095
Tyr Cys Thr Asp Ile Leu Glu Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 138
<211> 112
<212> PRT
<213> 人工序列
<220>
<223> 合成:hPara.09.H5-3.10C2.L10 轻链可变区
<400> 138
Asp Thr Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 1015
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu Gly Val
202530
Arg Asp Ile Thr Ser Leu Tyr Trp Tyr Leu Gln Lys Pro Gly Gln Ser
354045
Pro Gln Leu Leu Ile Tyr Arg Met Ser Asn Leu Ala Ser Gly Val Pro
505560
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65707580
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Phe
859095
Leu Arg Tyr Pro Tyr Thr Phe Gly Pro Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 139
<211> 115
<212> PRT
<213> 人工序列
<220>
<223> 合成:hPara.09.H5-3.10C2.L10 重链可变区
<400> 139
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 1015
Ser Leu Lys Leu Ser Cys Ala Thr Ser Gly Phe Pro Phe Ser Asn Val
202530
Trp Leu His Trp Val Arg Gln Ala Ser Gly Lys Gly Pro Glu Trp Val
354045
Ala His Ile Lys Ala Lys Ser Asp Asn Tyr Ala Thr Tyr Tyr Ala Glu
505560
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65707580
Val Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
859095
Tyr Cys Thr Asp Ile Leu Glu Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 140
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 合成:Alt-R CRISPR-Cas9 crRNA 1
<400> 140
ttgtagattc cgcagcgtaa 20
<210> 141
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 合成:Alt-R CRISPR-Cas9 crRNA 2
<400> 141
aatggtgaga gtgccaccca 20
<210> 142
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 合成:Alt-R CRISPR-Cas9 crRNA 3
<400> 142
taccagtgcc agagcctcca 20
<210> 143
<211> 444
<212> PRT
<213> 人工序列
<220>
<223> 合成:H3.10C2.H1.hIgG1.N297G
<400> 143
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 1015
Ser Leu Lys Leu Ser Cys Ala Thr Ser Gly Phe Pro Phe Ser Asn Val
202530
Trp Met His Trp Val Arg Gln Ala Ser Gly Lys Gly Leu Glu Trp Ile
354045
Ala His Ile Lys Ala Lys Ser Asp Asn Tyr Ala Thr Tyr Tyr Ala Glu
505560
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Thr Thr
65707580
Ile Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
859095
Tyr Cys Thr Gly Leu Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val
100 105 110
Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser
115 120 125
Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys
130 135 140
Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu
145 150 155 160
Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu
165 170 175
Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr
180 185 190
Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val
195 200 205
Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Tyr Gly Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 144
<211> 445
<212> PRT
<213> 人工序列
<220>
<223> 合成:hPara.09.H5.hIgG1.N297G
<400> 144
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 1015
Ser Leu Lys Leu Ser Cys Ala Thr Ser Gly Phe Pro Phe Ser Asn Val
202530
Trp Leu His Trp Val Arg Gln Ala Ser Gly Lys Gly Pro Glu Trp Val
354045
Ala His Ile Lys Ala Lys Ser Asp Asn Tyr Ala Thr Tyr Tyr Ala Glu
505560
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65707580
Val Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
859095
Tyr Cys Thr Asp Ile Leu Glu Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
115 120 125
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
130 135 140
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
145 150 155 160
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
165 170 175
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
180 185 190
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
195 200 205
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
210 215 220
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
225 230 235 240
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
245 250 255
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
260 265 270
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
275 280 285
Pro Arg Glu Glu Gln Tyr Gly Ser Thr Tyr Arg Val Val Ser Val Leu
290 295 300
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
305 310 315 320
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
325 330 335
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
340 345 350
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
355 360 365
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
370 375 380
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
385 390 395 400
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
405 410 415
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
420 425 430
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 145
<211> 112
<212> PRT
<213> 人工序列
<220>
<223> 合成:h3.10C2.v1 Q100P 轻链可变区
<400> 145
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 1015
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Arg Ser Leu Leu Thr Ser
202530
Lys Gly Ile Thr Ser Leu Tyr Trp Tyr Leu Gln Lys Pro Gly Gln Ser
354045
Pro Gln Leu Leu Ile Tyr Arg Met Ser Asn Leu Ala Ser Gly Ile Pro
505560
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65707580
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Phe
859095
Leu Val Tyr Pro Tyr Thr Phe Gly Pro Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 146
<211> 114
<212> PRT
<213> 人工序列
<220>
<223> 合成:h3.10C2.v1 Q100P 重链可变区
<400> 146
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 1015
Ser Leu Lys Leu Ser Cys Ala Thr Ser Gly Phe Pro Phe Ser Asn Val
202530
Trp Met His Trp Val Arg Gln Ala Ser Gly Lys Gly Leu Glu Trp Ile
354045
Ala His Ile Lys Ala Lys Ser Asp Asn Tyr Ala Thr Tyr Tyr Ala Glu
505560
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Thr Thr
65707580
Ile Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
859095
Tyr Cys Thr Gly Leu Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val
100 105 110
Ser Ser
<210> 147
<211> 112
<212> PRT
<213> 人工序列
<220>
<223> 合成:h3.10C2.v1 I58V/Q100P 轻链可变区
<400> 147
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 1015
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Arg Ser Leu Leu Thr Ser
202530
Lys Gly Ile Thr Ser Leu Tyr Trp Tyr Leu Gln Lys Pro Gly Gln Ser
354045
Pro Gln Leu Leu Ile Tyr Arg Met Ser Asn Leu Ala Ser Gly Val Pro
505560
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65707580
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Phe
859095
Leu Val Tyr Pro Tyr Thr Phe Gly Pro Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 148
<211> 114
<212> PRT
<213> 人工序列
<220>
<223> 合成:h3.10C2.v1 I58V/Q100P 重链可变区
<400> 148
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 1015
Ser Leu Lys Leu Ser Cys Ala Thr Ser Gly Phe Pro Phe Ser Asn Val
202530
Trp Met His Trp Val Arg Gln Ala Ser Gly Lys Gly Leu Glu Trp Ile
354045
Ala His Ile Lys Ala Lys Ser Asp Asn Tyr Ala Thr Tyr Tyr Ala Glu
505560
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Thr Thr
65707580
Ile Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
859095
Tyr Cys Thr Gly Leu Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val
100 105 110
Ser Ser
<210> 149
<211> 112
<212> PRT
<213> 人工序列
<220>
<223> 合成:h3.10C2.v1 Q100P/V104L 轻链可变区
<400> 149
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 1015
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Arg Ser Leu Leu Thr Ser
202530
Lys Gly Ile Thr Ser Leu Tyr Trp Tyr Leu Gln Lys Pro Gly Gln Ser
354045
Pro Gln Leu Leu Ile Tyr Arg Met Ser Asn Leu Ala Ser Gly Ile Pro
505560
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65707580
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Phe
859095
Leu Val Tyr Pro Tyr Thr Phe Gly Pro Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 150
<211> 114
<212> PRT
<213> 人工序列
<220>
<223> 合成:h3.10C2.v1 Q100P/V104L 重链可变区
<400> 150
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 1015
Ser Leu Lys Leu Ser Cys Ala Thr Ser Gly Phe Pro Phe Ser Asn Val
202530
Trp Met His Trp Val Arg Gln Ala Ser Gly Lys Gly Leu Glu Trp Ile
354045
Ala His Ile Lys Ala Lys Ser Asp Asn Tyr Ala Thr Tyr Tyr Ala Glu
505560
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Thr Thr
65707580
Ile Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
859095
Tyr Cys Thr Gly Leu Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val
100 105 110
Ser Ser
<210> 151
<211> 112
<212> PRT
<213> 人工序列
<220>
<223> 合成:h3.10C2.H1-3.10C2.L10 轻链可变区
<400> 151
Asp Thr Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 1015
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu Gly Val
202530
Arg Asp Ile Thr Ser Leu Tyr Trp Tyr Leu Gln Lys Pro Gly Gln Ser
354045
Pro Gln Leu Leu Ile Tyr Arg Met Ser Asn Leu Ala Ser Gly Val Pro
505560
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65707580
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Phe
859095
Leu Arg Tyr Pro Tyr Thr Phe Gly Pro Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 152
<211> 114
<212> PRT
<213> 人工序列
<220>
<223> 合成:h3.10C2.H1-3.10C2.L10 重链可变区
<400> 152
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 1015
Ser Leu Lys Leu Ser Cys Ala Thr Ser Gly Phe Pro Phe Ser Asn Val
202530
Trp Met His Trp Val Arg Gln Ala Ser Gly Lys Gly Leu Glu Trp Ile
354045
Ala His Ile Lys Ala Lys Ser Asp Asn Tyr Ala Thr Tyr Tyr Ala Glu
505560
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Thr Thr
65707580
Ile Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
859095
Tyr Cys Thr Gly Leu Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val
100 105 110
Ser Ser
<210> 153
<211> 16
<212> PRT
<213> 人工序列
<220>
<223> 合成:hPara.09.H5-3.10C2.L10 CDR L1
<400> 153
Arg Ser Ser Lys Ser Leu Leu Gly Val Arg Asp Ile Thr Ser Leu Tyr
1 5 1015
<210> 154
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成:hPara.09. H5-3.10C2.L10 CDR L2
<400> 154
Arg Met Ser Asn Leu Ala Ser
1 5
<210> 155
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成:hPara.09. H5-3.10C2.L10 CDR L3
<400> 155
Ala Gln Phe Leu Arg Tyr Pro Tyr Thr
1 5
<210> 156
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 合成:hPara.09. H5-3.10C2.L10 CDR H1
<400> 156
Asn Val Trp Leu His
1 5
<210> 157
<211> 19
<212> PRT
<213> 人工序列
<220>
<223> 合成:hPara.09. H5-3.10C2.L10 CDR H2
<400> 157
His Ile Lys Ala Lys Ser Asp Asn Tyr Ala Thr Tyr Tyr Ala Glu Ser
1 5 1015
Val Lys Gly
<210> 158
<211> 4
<212> PRT
<213> 人工序列
<220>
<223> 合成:hPara.09. H5-3.10C2.L10 CDR H3
<400> 158
Ile Leu Glu Tyr
1
<210> 159
<211> 16
<212> PRT
<213> 人工序列
<220>
<223> 合成:h3.10C2.H1-3.10C2.L10 轻链 CDR1
<400> 159
Arg Ser Ser Lys Ser Leu Leu Gly Val Arg Asp Ile Thr Ser Leu Tyr
1 5 1015
<210> 160
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成:h3.10C2.H1-3.10C2.L10 轻链 CDR2
<400> 160
Arg Met Ser Asn Leu Ala Ser
1 5
<210> 161
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成:h3.10C2.H1-3.10C2.L10 轻链 CDR 3
<400> 161
Ala Gln Phe Leu Arg Tyr Pro Tyr Thr
1 5
<210> 162
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 合成:h3.10C2.H1-3.10C2.L10 重链 CDR1
<400> 162
Asn Val Trp Met His
1 5
<210> 163
<211> 19
<212> PRT
<213> 人工序列
<220>
<223> 合成:h3.10C2.H1-3.10C2.L10 重链 CDR2
<400> 163
His Ile Lys Ala Lys Ser Asp Asn Tyr Ala Thr Tyr Tyr Ala Glu Ser
1 5 1015
Val Lys Gly
<210> 164
<211> 3
<212> PRT
<213> 人工序列
<220>
<223> 合成:h3.10C2.H1-3.10C2.L10 重链 CDR3
<400> 164
Leu Asp Tyr
1
<210> 165
<211> 232
<212> PRT
<213> 智人
<220>
<221> 位点
<222> (1)..(232)
<223> 人 IgG1 Fc LALAPG
<400> 165
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
1 5 1015
Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
202530
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
354045
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
505560
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
65707580
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
859095
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
100 105 110
Leu Gly Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
115 120 125
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr
130 135 140
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
145 150 155 160
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
165 170 175
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
180 185 190
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
195 200 205
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
210 215 220
Ser Leu Ser Leu Ser Pro Gly Lys
225 230
<210> 166
<211> 229
<212> PRT
<213> 智人
<220>
<221> 位点
<222> (1)..(229)
<223> 人 IgG4 Fc
<400> 166
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
1 5 1015
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
202530
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
354045
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
505560
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65707580
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
859095
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys
225
<210> 167
<211> 229
<212> PRT
<213> 智人
<220>
<221> 位点
<222> (1)..(229)
<223> 人 IgG4 Fc S228P
<400> 167
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
1 5 1015
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
202530
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
354045
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
505560
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65707580
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
859095
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys
225
<210> 168
<211> 214
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.17A9 轻链
<400> 168
Asp Ile Gln Met Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 1015
Asp Arg Val Thr Ile Asn Cys Lys Val Ser Gln Asn Val Asp Arg Asn
202530
Leu Asn Trp Tyr Gln Gln Asn Leu Gly Glu Pro Pro Lys Pro Leu Ile
354045
Asn Phe Ala Asn Ser Leu Gln Thr Gly Val Pro Ser Arg Phe Ser Gly
505560
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65707580
Glu Asp Val Ala Thr Tyr Phe Cys Leu Gln His Asn Ser Trp Pro Leu
859095
Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys Arg Ala Asp Ala Ala
100 105 110
Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu Gln Leu Thr Ser Gly
115 120 125
Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe Tyr Pro Lys Asp Ile
130 135 140
Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg Gln Asn Gly Val Leu
145 150 155 160
Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser Thr Tyr Ser Met Ser
165 170 175
Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu Arg His Asn Ser Tyr
180 185 190
Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser Pro Ile Val Lys Ser
195 200 205
Phe Asn Arg Asn Glu Cys
210
<210> 169
<211> 448
<212> PRT
<213> 人工序列
<220>
<223> 合成:3.17A9 重链
<400> 169
Glu Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Gly Lys Pro Gly Thr
1 5 1015
Ser Ile Lys Leu Ser Cys Lys Val Ser Gly Phe Asn Ile Arg Ser Thr
202530
Phe Met His Trp Val Asn Gln Arg Pro Gly Lys Gly Leu Glu Trp Ile
354045
Gly Arg Ile Asp Pro Ala Asn Gly Asn Thr Val Tyr Gly Glu Lys Phe
505560
Lys Asn Lys Ala Thr Leu Thr Ala Asp Thr Ser Ser Asn Thr Ala Tyr
65707580
Met Gln Leu Ser Gln Leu Lys Ser Asp Asp Thr Ala Ile Tyr Phe Cys
859095
Ala Leu Glu Phe Gly Val Ser Trp Phe Glu Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Lys Thr Thr Ala Pro Ser Val Tyr Pro
115 120 125
Leu Ala Pro Val Cys Gly Asp Thr Thr Gly Ser Ser Val Thr Leu Gly
130 135 140
Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Leu Thr Trp Asn
145 150 155 160
Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Thr Ser Ser Thr
180 185 190
Trp Pro Ser Gln Ser Ile Thr Cys Asn Val Ala His Pro Ala Ser Ser
195 200 205
Thr Lys Val Asp Lys Lys Ile Glu Pro Arg Gly Pro Thr Ile Lys Pro
210 215 220
Cys Pro Pro Cys Lys Cys Pro Ala Pro Asn Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Ile Phe Pro Pro Lys Ile Lys Asp Val Leu Met Ile Ser Leu
245 250 255
Ser Pro Ile Val Thr Cys Val Val Val Asp Val Ser Glu Asp Asp Pro
260 265 270
Asp Val Gln Ile Ser Trp Phe Val Asn Asn Val Glu Val His Thr Ala
275 280 285
Gln Thr Gln Thr His Arg Glu Asp Tyr Asn Ser Thr Leu Arg Val Val
290 295 300
Ser Ala Leu Pro Ile Gln His Gln Asp Trp Met Ser Gly Lys Glu Phe
305 310 315 320
Lys Cys Lys Val Asn Asn Lys Asp Leu Pro Ala Pro Ile Glu Arg Thr
325 330 335
Ile Ser Lys Pro Lys Gly Ser Val Arg Ala Pro Gln Val Tyr Val Leu
340 345 350
Pro Pro Pro Glu Glu Glu Met Thr Lys Lys Gln Val Thr Leu Thr Cys
355 360 365
Met Val Thr Asp Phe Met Pro Glu Asp Ile Tyr Val Glu Trp Thr Asn
370 375 380
Asn Gly Lys Thr Glu Leu Asn Tyr Lys Asn Thr Glu Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Tyr Phe Met Tyr Ser Lys Leu Arg Val Glu Lys Lys
405 410 415
Asn Trp Val Glu Arg Asn Ser Tyr Ser Cys Ser Val Val His Glu Gly
420 425 430
Leu His Asn His His Thr Thr Lys Ser Phe Ser Arg Thr Pro Gly Lys
435 440 445
<210> 170
<211> 214
<212> PRT
<213> 人工序列
<220>
<223> 合成:1.16B8 轻链
<400> 170
Asp Ile Gln Met Thr Gln Thr Pro Ser Ser Met Pro Ala Ser Leu Gly
1 5 1015
Glu Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Gly Ile Ser Asn Tyr
202530
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Ile Lys Pro Leu Ile
354045
Tyr Tyr Thr Ser Asn Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
505560
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Ser Leu Glu Pro
65707580
Glu Asp Phe Ala Met Tyr Tyr Cys Gln Gln Tyr Asp Ser Ser Pro Trp
859095
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Ala Asp Ala Ala
100 105 110
Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu Gln Leu Thr Ser Gly
115 120 125
Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe Tyr Pro Lys Asp Ile
130 135 140
Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg Gln Asn Gly Val Leu
145 150 155 160
Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser Thr Tyr Ser Met Ser
165 170 175
Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu Arg His Asn Ser Tyr
180 185 190
Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser Pro Ile Val Lys Ser
195 200 205
Phe Asn Arg Asn Glu Cys
210
<210> 171
<211> 447
<212> PRT
<213> 人工序列
<220>
<223> 合成:1.16B8 重链
<400> 171
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 1015
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Ser
202530
Ala Met Ala Trp Val Arg Gln Ala Pro Lys Lys Gly Leu Glu Trp Val
354045
Ala Thr Ile Ile Tyr Asp Thr Ser Ser Thr Tyr Tyr Arg Asp Ser Val
505560
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Ser Thr Leu Tyr
65707580
Leu Gln Met Asp Ser Leu Arg Ser Glu Asp Thr Ala Thr Tyr Tyr Cys
859095
Ala Leu Phe Gly Val Asp Val Met Asp Ala Trp Gly Gln Gly Ala Ser
100 105 110
Val Thr Val Ser Ser Ala Lys Thr Thr Ala Pro Ser Val Tyr Pro Leu
115 120 125
Ala Pro Val Cys Gly Asp Thr Thr Gly Ser Ser Val Thr Leu Gly Cys
130 135 140
Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Leu Thr Trp Asn Ser
145 150 155 160
Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Thr Ser Ser Thr Trp
180 185 190
Pro Ser Gln Ser Ile Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr
195 200 205
Lys Val Asp Lys Lys Ile Glu Pro Arg Gly Pro Thr Ile Lys Pro Cys
210 215 220
Pro Pro Cys Lys Cys Pro Ala Pro Asn Ala Ala Gly Gly Pro Ser Val
225 230 235 240
Phe Ile Phe Pro Pro Lys Ile Lys Asp Val Leu Met Ile Ser Leu Ser
245 250 255
Pro Ile Val Thr Cys Val Val Val Asp Val Ser Glu Asp Asp Pro Asp
260 265 270
Val Gln Ile Ser Trp Phe Val Asn Asn Val Glu Val His Thr Ala Gln
275 280 285
Thr Gln Thr His Arg Glu Asp Tyr Asn Ser Thr Leu Arg Val Val Ser
290 295 300
Ala Leu Pro Ile Gln His Gln Asp Trp Met Ser Gly Lys Glu Phe Lys
305 310 315 320
Cys Lys Val Asn Asn Lys Asp Leu Gly Ala Pro Ile Glu Arg Thr Ile
325 330 335
Ser Lys Pro Lys Gly Ser Val Arg Ala Pro Gln Val Tyr Val Leu Pro
340 345 350
Pro Pro Glu Glu Glu Met Thr Lys Lys Gln Val Thr Leu Thr Cys Met
355 360 365
Val Thr Asp Phe Met Pro Glu Asp Ile Tyr Val Glu Trp Thr Asn Asn
370 375 380
Gly Lys Thr Glu Leu Asn Tyr Lys Asn Thr Glu Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Tyr Phe Met Tyr Ser Lys Leu Arg Val Glu Lys Lys Asn
405 410 415
Trp Val Glu Arg Asn Ser Tyr Ser Cys Ser Val Val His Glu Gly Leu
420 425 430
His Asn His His Thr Thr Lys Ser Phe Ser Arg Thr Pro Gly Lys
435 440 445
<210> 172
<211> 107
<212> PRT
<213> 小家鼠
<220>
<221> 位点
<222> (1)..(107)
<223> 鼠 κ(轻链)可变区
<400> 172
Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu
1 5 1015
Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe
202530
Tyr Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg
354045
Gln Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser
505560
Thr Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu
65707580
Arg His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser
859095
Pro Ile Val Lys Ser Phe Asn Arg Asn Glu Cys
100 105
<210> 173
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 合成:Alt-R CRISPR-Cas9 crRNA 的序列
<400> 173
ttgtagattc cgcagcgtaa 20
<210> 174
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 合成:Alt-R CRISPR-Cas9 crRNA 的序列
<400> 174
aatggtgaga gtgccaccca 20
<210> 175
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 合成:Alt-R CRISPR-Cas9 crRNA 的序列
<400> 175
taccagtgcc agagcctcca 20
<210> 176
<211> 219
<212> PRT
<213> 人工序列
<220>
<223> 合成:hPara.09v2 轻链
<400> 176
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 1015
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Arg Ser Leu Leu Thr Ser
202530
Lys Gly Ile Thr Ser Leu Tyr Trp Tyr Leu Gln Lys Pro Gly Gln Ser
354045
Pro Gln Leu Leu Ile Tyr Arg Met Ser Asn Leu Ala Ser Gly Ile Pro
505560
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65707580
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Phe
859095
Leu Val Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 177
<211> 46
<212> PRT
<213> 人工序列
<220>
<223> 合成:包含肽残基 129-175 的 hTREM2 茎结构域(图 2A)
<400> 177
Leu Ala Asp Pro Leu Asp His Arg Asp Ala Gly Asp Leu Trp Phe Pro
1 5 1015
Gly Glu Ser Glu Ser Phe Glu Asp Ala His Val Glu His Ser Ile Ser
202530
Arg Ser Leu Leu Glu Gly Glu Ile Pro Phe Pro Pro Thr Ser
354045
