一种表达LGALS9的通用型细胞及其制备方法
文献发布时间:2024-04-18 20:01:30
相关申请的交叉引用
本申请要求2022年7月11日提交的申请号为202210815169.7的中国发明专利申请的优先权和权益,其整体内容通过引用的方式纳入本文。
技术领域
本发明属于基因工程与干细胞技术交叉领域,具体涉及一种表达LGALS9的通用型细胞及其制备方法。
背景技术
通过细胞的体外培养或干细胞的诱导分化,能够在体外大量的再生健康的功能细胞,能够通过异体功能细胞移植治疗疾病,但是,免疫不相容和移植细胞遭受的免疫排斥仍然是其临床应用的关键障碍。干细胞是一类具备自我更新能力及向特定功能体细胞分化能力的“种子”细胞,依据干细胞特性的程度差异,主要将干细胞分为:全能干细胞(Totipotent stem cells)、多能干细胞(Pluripotent stem cells,PSCs)和成体干细胞(Adult stem cell)。人类胚胎干细胞(hESC)和诱导多能干细胞(iPSC)具有无限增殖、自我更新和分化到各种类型细胞的潜力,在治疗癌症、神经相关、心血管等疾病具有重要应用前景。
移植自体细胞治疗可以回避免疫排斥问题,但是从病人身上制造自体细胞成本高昂且制备流程周期长(Khera et al.,2013),并且个体来源的细胞产品的质量和有效性不确定。有数据表明病人体内的细胞与正常人的存在差异,治疗效果可能受影响。
可通过免疫抑制药物、HLA匹配和基因编辑来降低免疫原性,或降低宿主免疫系统对异体移植细胞的排斥反应。免疫抑制药物副作用大,会导致骨髓抑制、肝毒性、脱发和胃肠道不良反应。现在美国、日本、中国都在建立HLA匹配的iPSC库,但建库和维护都需要高额的成本,因为HLA抗原的基因是在人类基因组中观察到的最具多态性的基因。目前各地的iPSC库无法为各自国家的大多数人提供匹配,覆盖的只能是特定人群(Solomon et al.,2015;Turner et al.,2013)。针对大患者群体的异体细胞治疗可能在经济上和建设及运行成本上相对配型库具有非常明显的优势,但异体细胞治疗会受到强烈的免疫排斥。于是,构建同种异体免疫兼容的通用型PSCs迫在眉睫。
人类的主要组织相容性复合体(MHC),即人白细胞抗原(HLA),是导致免疫不相容的主要原因。HLA复合体由一系列基因组成,可分为I类、II类和III类。MHC-I基因在几乎所有的组织细胞类型中表达,表达“非己”MHC-I类分子的移植细胞将刺激CD8+T细胞的活化而被消除。CD4+辅助T细胞识别“非己”细胞的MHC-II基因,从而进行免疫排斥,而III类分子不参与免疫活动。使用基因编辑的方法改变免疫原性元件,以产生低免疫原性细胞,使得具备免疫豁免性的“off-the-shelf”细胞治疗产品的大规模制造成为可能。
近年已有先驱报道通过敲除B2M、CIITA等基因,实现MHC-I和MHC-II细胞表面或本身基因的缺失表达,进而使细胞具备免疫耐受或逃逸T/B细胞特异性免疫应答,产生免疫兼容的通用型PSCs,为更广泛的通用型PSCs源细胞、组织、器官应用奠定了重要的基础。然而,HLA分子是自然杀伤细胞(NK细胞)的主要抑制性配体,MHC-I类阴性细胞易受天然杀伤(NK)细胞裂解。体内外数据均显示宿主NK细胞可消除植入的B2M
人体免疫系统能识别并攻击非自身抗原,从而抵抗感染。因此在异体器官移植过程中,免疫系统会攻击移植的器官,导致免疫排斥和移植失败。虽然胚胎和胎盘是半同种异体移植物,类似于移植的器官,但它们可以诱导母体耐受,并且不会产生强烈的免疫反应。胎盘高表达的HLA-G通过与蜕膜自然杀伤细胞相互作用调节母胎耐受,同时在胎盘中也检测到CD47高表达(Liu et al.,2021;Than et al.,2019)。另一方面,肿瘤细胞可逃逸免疫监视已经众所周知,其通过减少HLA的表达,减少抗原呈递,从而阻止它们被免疫细胞识别;并增加表达免疫抑制成分如HLA-G、PD-L1和CTLA-4等(Barnet etal.,2018;Bogomiakovaet al.,2019;de Charette and Houot,2018)。
已有一些研究探索母胎免疫耐受,肿瘤免疫逃逸与器官移植之间的关系(Sun etal.,2021)。已报道模拟母胎耐受和肿瘤逃逸机制在破坏MHC-I和MHC-II类基因表达的基础上使细胞表达HLAG等非经典HLA-I类分子,或表达PD-L1、CTLA4-Ig、CD47、CD24等免疫抑制检查点蛋白,对NK细胞表现出一定的免疫耐受保护(Zhao,W.etal.,2020;Ye,Q.et al.,2020)。
然而,这些方案存在仅基于领域已知常识明星分子的直接应用,而免疫逃逸和耐受大多依赖于免疫抑制受体-配体结合,而且在肿瘤状态或母胎界面具有特定的微环境。低免因子的跨领域直接应用于异体移植存在不确定性,配对受体或配体是否存在于移植细胞和免疫细胞上,移植环境是否满足逃逸条件?怀孕的母胎中是什么状态,可能和器官移植时的状态时不同的,因此,现有技术存在免疫兼容性不彻底、不明确或缺乏持久性、有效剂量窗口窄等技术问题。且到目前为止,母胎免疫耐受和肿瘤逃逸的潜在分子机制仍在不断摸索,持续发现的新基因可以进一步开发低免疫原性细胞(Barnet et al.,2018)。由此表明需要筛选出更多新的分子来实现更优化的改造干细胞,以获得更优的免疫豁免性方案。
参考文献:
De Charette,M.,and Houot,R.(2018).Hide or defend,the two strategiesof lymphoma immune evasion:potential implications forimmunotherapy.Haematologica 103,1256-1268.
Liu,Y.,Gao,S.,Zhao,Y.,Wang,H.,Pan,Q.,and Shao,Q.(2021).DecidualNatural Killer Cells:A Good Nanny at the Maternal-Fetal Interface DuringEarly Pregnancy.Front Immunol 12,663660.
Than,N.G.,Hahn,S.,Rossi,S.W.,and Szekeres-Bartho,J.(2019).Editorial:Fetal-Maternal Immune Interactions in Pregnancy.Front Immunol 10,2729.
Zhao,W.,Lei,A.,Tian,L.,Wang,X.,Correia,C.,Weiskittel,T.,Li,H.,Trounson,A.,Fu,Q.,Yao,K.,et al.(2020).Strategies for Genetically EngineeringHypoimmunogenic Universal Pluripotent Stem Cells.iScience 23,101162.
发明内容
针对现有技术所存在的不足,本发明提供了改造细胞获得低免疫原性的新方法,首次采取将涉及到母胎耐受和肿瘤逃逸的各机制分子进行大批量筛选的策略,通过多轮功能检测,最终鉴定出了代表性的新基因LGALS9。该基因能够显著减少或逃逸免疫系统的识别和攻击,尤其是自然杀伤细胞、巨噬细胞等的攻击。本发明提出了通过不可预料的领域转化开发新基因实现细胞的免疫豁免性的可行策略。
本发明通过敲除人多能干细胞内质网中β-2-微球蛋白(B2M)和敲除MHC-II基因转录的正调节因子CIITA,成功构建B2M/CIITA双等位基因敲除阳性克隆DKO细胞;然后使用慢病毒载体在DKO细胞中过表达本发明鉴定出的新基因LGALS9,由此获得的人多能干细胞可在逃逸T细胞攻击的基础上,进一步逃逸NK细胞的杀伤。同时这些低免疫原性的多能干细胞保留了其干性和分化能力等多能干细胞的关键生物学功能。
为了实现上述目的,本发明采用如下技术方案:
第一方面,本发明提供一种通用型细胞,其相对于野生型细胞,包含:
1)MHC-I和/或MHC-II人类白细胞抗原的表达降低或不表达;
2)LGALS9的表达序列;
所述细胞能逃逸T细胞攻击及NK细胞的杀伤。
在某些方面,所述细胞包括MHC-I和MHC-II人类白细胞抗原的表达降低或不表达。
在某些方面,所述细胞还包括修饰以增加一种或多种多肽的表达,增加的多肽选自:DUX4,CD27,CD35,CD200,HLA-C,PD-L1,CD47,CD24,CD26,CCL21,Mfge8和SerpinB9。
在某些方面,所述细胞中使用基因编辑工具(诸如TALEN和/或CRISPR系统)靶向编码MHC-I的一种或多种转录调节因子的一个或多个基因,以及编码MHC-II的一种或多种转录调节因子的一个或多个基因,来实现MHC-I和MHC-II基因的表达降低或不表达。
在某些实施方式中,为实现MHC-I和MHC-II基因的表达降低或不表达,所述MHC-I的转录调节因子可优选自:B2M、TAP1、TAP2、TAP相关糖蛋白(Tapasin)或NLRC5中的一个或多个;所述MHC-II的转录调节因子可优选自:CIITA、RFXANK、RFX5、RFXAP中的一个或多个;
所述转录调节因子优选B2M和CIITA。
在某些实施方式中,所述细胞还包括通过选择性灭活CIITA基因的稀有切割核酸内切酶靶向CIITA基因的遗传修饰。
在某些实施方式中,所述细胞还包括通过选择性灭活B2M基因的稀有切割核酸内切酶靶向B2M基因的遗传修饰。
在某些实施方式中,所述稀有切割核酸内切酶选自CAS蛋白,TALE-核酸酶,锌指核酸酶,大核酸酶和归巢核酸酶。
在某些实施方式中,其中通过稀有切割内切核酸酶靶向CIITA基因或B2M基因的遗传修饰包括CAS蛋白或编码CAS蛋白的多核苷酸,和至少一个用于特异性靶向CIITA基因或B2M基因的导向核糖核酸序列。
在具体的实施方式中,使用CRISPR/CAS9系统分别对B2M和CIITA外显子区段进行两端直接敲除,其中,针对B2M基因的gRNA的靶序列为SEQ ID NO:2和SEQ ID NO:3,针对CIITA基因的gRNA的靶序列为SEQ ID NO:4和SEQ ID NO:5。
在某些方面,所述细胞中通过引入针对编码MHC-I的一种或多种转录调节因子的一个或多个基因,或编码MHC-II的一种或多种转录调节因子的一个或多个基因的基因表达修饰分子,来实现MHC-I和/或MHC-II基因的表达降低或不表达,其中所述基因表达修饰分子包括选自siRNA,shRNA,microRNA,反义RNA和另一种RNA介导的抑制分子中的一种。
在某些方面,所述LGALS9的氨基酸序列与如SEQ ID NO:1所示的序列具有70%以上的同源性,例如80%以上的同源性,再例如90%以上、95%以上、98%以上的同源性;
进一步优选地,所述LGALS9的氨基酸序列如SEQ ID NO:1所示。
在某些方面,所述细胞是胚胎干细胞。
在某些方面,所述细胞是多能干细胞。
在某些实施方案中,所述细胞是低免疫原性干细胞。
在某些实施方案中,所述细胞是人类干细胞或人类体细胞。
第二方面,本发明提供一种第一方面通用型细胞的制备方法,包含如下步骤:
1)敲除细胞的MHC-I的一种或多种转录调节因子的一个或多个基因;和/或,
2)敲除细胞的MHC-II的一种或多种转录调节因子的一个或多个基因;
3)在细胞中引入编码LGALS9蛋白的核酸序列。
在某些方面,所述MHC-I的转录调节因子可优选自:B2M、TAP1、TAP2、TAP相关糖蛋白(Tapasin)或NLRC5中的一个或多个;所述MHC-II的转录调节因子可优选自:CIITA、RFXANK、RFX5、RFXAP中的一个或多个。
在某些实施例方式中,所述转录调节因子选自B2M和CIITA。
在某些方面,步骤1)和2)所述的敲除为通过选择性灭活CIITA基因或B2M基因的稀有切割核酸内切酶靶向CIITA基因或B2M基因的遗传修饰。
优选地,所述稀有切割核酸内切酶选自CAS蛋白,TALE-核酸酶,锌指核酸酶,大核酸酶和归巢核酸酶。
进一步优选地,其中通过稀有切割内切核酸酶靶向CIITA基因或B2M基因的遗传修饰包括CAS蛋白或编码CAS蛋白的多核苷酸,和至少一个用于特异性靶向CIITA基因或B2M基因的导向核糖核酸序列。
在某些实施例方式中,步骤1)和2)使用CRISPR系统分别对B2M和CIITA外显子区段进行两端直接敲除,其中,针对B2M基因的gRNA的靶序列为SEQ ID NO:2、3,针对CIITA基因的gRNA的靶序列为SEQ ID NO:4、5。
在某些方面,步骤1)或2)所述的敲除为通过引入针对编码MHC-I的一种或多种转录调节因子的一个或多个基因,或编码MHC-II的一种或多种转录调节因子的一个或多个基因的基因表达修饰分子,来实现MHC-I和/或MHC-II基因的表达降低或不表达,其中所述基因表达修饰分子包括选自siRNA,shRNA,microRNA,反义RNA和另一种RNA介导的抑制分子中的一种。
在某些方面,步骤3)采用表达载体将编码LGALS9蛋白的核酸序列引入细胞中。
优选地,所述步骤3)采用的表达载体为病毒载体。
在某些实施例方式中,步骤3)采用的病毒载体为慢病毒。
在某些方面,步骤3)将编码LGALS9蛋白的核酸序列导入所述细胞的选定位点;优选地,所述细胞的选定位点是安全港基因位点。
在某些方面,所述LGALS9的氨基酸序列与如SEQ ID NO:1所示的序列具有70%以上的同源性,例如80%以上的同源性,再例如90%以上、95%以上、98%以上的同源性;
进一步优选地,所述LGALS9的氨基酸序列如SEQ ID NO:1所示。
在某些方面,所述通用型细胞还包括第二表达载体,其包含编码选自DUX4,CD27,CD35,CD200,HLA-C,PD-L1,CD47,CD24,CD26,CCL21,Mfge8和SerpinB9中的一种的多核苷酸序列。
在某些实施方案中,所述第二表达载体是诱导型表达载体;优选地,所述第二表达载体是病毒载体。
第三方面,本发明提供一种制备分化的通用型细胞的方法,包括在分化条件下培养根据第二方面的方法制备的通用型细胞,从而制备分化的低免疫原性细胞。
在某些方面,其中所述分化条件适于将细胞分化为选自心肌细胞,神经细胞,胶质细胞,内皮细胞,T细胞,NK细胞,NKT细胞,巨噬细胞,造血祖细胞,间充质细胞,胰岛细胞,软骨细胞,视网膜色素上皮细胞,肾细胞,肝细胞,甲状腺细胞,皮肤细胞,血细胞和上皮细胞的细胞类型。
第四方面,本发明提供一种治疗需要细胞治疗的患者的方法,包括给予根据第三方面的方法制备的分化的低免疫原性细胞群。
第五方面,本发明提供一种组合物,所述组合物包含第一方面所述的通用型细胞。
在某些方面,所述组合物包含第一方面所述的通用型细胞和一种或多种治疗剂,所述治疗剂包含肽、细胞因子、小分子化合物、大分子、ADC、抗体、纳米粒子、生物类似物、mRNA、中药、蛋白、疫苗、检查点抑制剂、丝裂原、生长因子、小RNA、双链RNA(doublestranded RNA;dsRNA)、单核血细胞、饲养细胞、饲养细胞组分或其置换因子、包含一种或多种所关注多核酸的载体、抗体等。
第六方面,本发明提供一种表达LGALS9蛋白,并具有表达降低或不表达的MHC I类和/或MHC II类人白细胞抗原的细胞。
第七方面,本发明提供一种不表达CIITA,表达LGALS9蛋白,并且具有表达降低或不表达的MHC I类和/或MHC II类人白细胞抗原的细胞。
第八方面,本发明提供一种不表达B2M,表达LGALS9蛋白,并具有表达降低或不表达的MHC I类和/或MHC II类人白细胞抗原的细胞。
第九方面,本发明提供一种不表达CIITA和B2M,表达LGALS9蛋白,并具有表达降低或不表达的MHC I类和/或MHC II类人白细胞抗原的细胞。
第十方面,本发明提供一种表达LGALS9蛋白和至少一种选自:DUX4,CD27,CD35,CD200,HLA-C,PD-L1,CD47,CD24,CD26,CCL21,Mfge8和SerpinB9的多肽,并具有表达降低或不表达的MHC I类和/或MHC II类人白细胞抗原的的细胞。
第十一方面,本发明提供一种不表达CIITA,表达LGALS9蛋白和至少一种选自:DUX4,CD27,CD35,CD200,HLA-C,PD-L1,CD47,CD24,CD26,CCL21,Mfge8和SerpinB9,并且具有表达降低或不表达的MHC I类和/或MHC II类人白细胞抗原的细胞。
第十二方面,本发明提供一种不表达B2M,表达LGALS9蛋白和至少一种选自:DUX4,CD27,CD35,CD200,HLA-C,PD-L1,CD47,CD24,CD26,CCL21,Mfge8和SerpinB9的多肽,并且具有表达降低或不表达的MHC I类和/或MHC II类人白细胞抗原的细胞。
第十三方面,本发明提供一种不表达CIITA和B2M,表达LGALS9蛋白和至少一种选自:DUX4,CD27,CD35,CD200,HLA-C,PD-L1,CD47,CD24,CD26,CCL21,Mfge8和SerpinB9的多肽,并且具有表达降低或不表达的MHC I类和/或MHC II类人白细胞抗原的细胞。
第十四方面,本发明提供一种上述第六方面~第十三方面所述的细胞,其中所述细胞选自干细胞,分化细胞,多能干细胞,诱导的多能干细胞,成体干细胞,祖细胞,体细胞,原代T细胞和嵌合抗原受体T细胞。
第十五方面,本发明提供第一方面所述的通用型细胞、第五方面所述的组合物在制备用于细胞治疗的产品中的应用。
第十六方面,本发明提供第一方面所述的通用型细胞、第五方面所述的组合物在制备用于器官移植的产品中的应用。
第十七方面,本发明提供第一方面所述的通用型细胞、第五方面所述的组合物在构建通用型PSCs细胞库中的应用。
第十八方面,本发明提供第一方面所述的通用型细胞、第五方面所述的组合物作为基因药物载体的应用。
本发明的有益效果:
本发明在干细胞中失活主要组织相容性复合体MHC-I和II类基因后,过表达LGALS9,获得的人多能干细胞可在逃逸T细胞攻击的基础上,进一步逃逸NK细胞的杀伤,多次杀伤率均小于DKO,与阳性对照H1 WT和现有技术DKO+CD47平均杀伤率类似。同时这些低免疫原性的多能干细胞保留了其干性和分化能力。
附图说明
图1.人胚胎干细胞系H1中B2M基因敲除策略及结果图;
图2.人胚胎干细胞系H1中CIITA基因敲除策略及结果图;
图3.实施例1中使用RT-qPCR检测DKO细胞中B2M和CIITA在RNA水平的表达图;
图4.实施例1中使用Western-blot检测B2M蛋白水平的结果图;
图5.实施例1中用INF-gamma刺激野生型H1(WT)及DKO,通过流式细胞计数仪检测各种细胞中HLA-I/II的表达图;
其中,T细胞为检测HLA-I/II类分子的阳性对照;
图6.实施例1中获得的B2M/CIITA双等位基因敲除阳性克隆(DKO)核型图;
图7.实施例2中利用免疫荧光和RT-qPCR检测WT和DKO细胞在RNA和蛋白水平干性基因POU5F1/NANOG/SOX2的表达图;
其中MSC为阴性对照;
图8.实施例2中利用免疫荧光检测WT和DKO细胞表面干性基因SSEA-4和Tra1-81的表达图。
图9.使用免疫组化显示DKO细胞可形成具有内、中、外三个胚层的畸胎瘤;
图10.实施例2中采用RTCA检测对DKO细胞免疫功能进行验证的结果图;
图11.pGC-EF1a质粒结构示意图;
图12.流式细胞计数仪检测实施例3中构建的DKO+CD47细胞系CD47的表达图;
图13.实施例3中RTCA检测NK细胞对过表达CD47的DKO+CD47细胞株、WT、DKO细胞的杀伤结果图;
图14.实施例4中RTCA检测NK细胞对过表达候选蛋白的细胞株、H1WT(阳性对照)、H1 DKO细胞(阴性对照)的杀伤结果图。
图15.实施例5中对构建的DKO+LGALS9细胞株使用qPCR检测其mRNA相较于DKO过表达水平。
图16实施例5中对构建的DKO+LGALS9细胞株利用免疫荧光(A)和流式(B)检测干性基因表达。
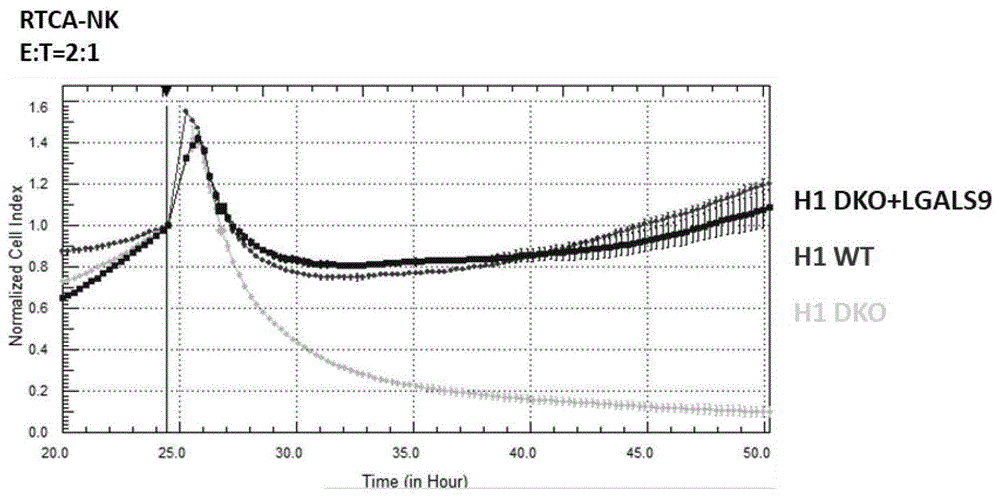
图17.实施例5中RTCA检测NK细胞对过表达LGALS9蛋白的DKO+LGALS9细胞株、WT、DKO细胞的杀伤结果图。
具体实施方式
下文将结合具体实施例对本发明的技术方案做更进一步的详细说明。应当理解,下列实施例仅为示例性地说明和解释本发明,而不应被解释为对本发明保护范围的限制。凡基于本发明上述内容所实现的技术均涵盖在本发明旨在保护的范围内。
除非另有说明,以下实施例中使用的原料和试剂均为市售商品,或者可以通过已知方法制备。下列实施例中未注明具体条件的实验方法,通常按照常规条件如Sambrook等人,分子克隆:实验室手册(New York:Cold Spring Harbor Laboratory Press,1989)中所述的条件,或按照制造厂商所建议的条件。
除非另外定义或由背景清楚指示,否则在本公开中的全部技术与科学术语具有如本公开所属领域的普通技术人员通常理解的相同含义。
实施例1.构建B2M及CIITA双敲除细胞系(DKO)
1、细胞培养试剂:
表1
2、方法及结果:
本发明选用了人多能干细胞系H1(Wicell,WA01)或H9(Wicell,WA09),使用CRISPR/CAS9敲除内质网中β-2-微球蛋白(B2M),使细胞表面MHC-I不能形成功能性分子,从而逃逸同种异体CD8
其中,B2M的CRISPR/CAS9基因敲除策略如图1所示,使用B2M-gRNA1和B2M-gRNA2对B2M外显子区段进行两端直接敲除,然后分别使用B2M-F1/R1和B2M-F2/R2两对PCR引物进行基因组序列敲除验证。
gRNA序列:
B2M-gRNA1:CGTGAGTAAACCTGAATCTT
B2M-gRNA2:AGTCACATGGTTCACACGGC
鉴定引物
B2M-F1:TGGGGCCAAATCATGTAGACTC
B2M-R1:TCAGTGGGGGTGAATTCAGTGT
B2M-F2+B2M-R2=608bp
敲除后:无条带
B2M-F2:CAGAAGTCCTTGAGAGCCTCC
B2M-R2:TGTGCATCAGTATCTCAGCAGG
B2M-F2+B2M-R2=812bp
敲除后:569bp。
另外,CIITA的CRISPR/CAS9基因敲除策略如图2所示,使用CIITA-gRNA1和CIITA-gRNA2对CIITA外显子区段进行两端直接敲除,然后分别使用CIITA-F1/R1和CIITA-F2/R2两对PCR引物进行基因组序列敲除验证。
gRNA序列:
CIITA-gRNA1:GATATTGGCATAAGCCTCCC
CIITA-gRNA2:CATCGCTGTTAAGAAGCTCC
鉴定引物:
CIITA-F1:CTGTGCCTCTACCACTTCTATG
CIITA-R1:CCTTCCATGTCACACAACAGCC
CIITA-F1+CIITA-R1=368bp
敲除后:无条带
CIITA-F2:TGGAATCCACACTTTCCAGTTC
CIITA-R2:TGGAGTCTCCGTTCCTCCAG
CIITA-F2+CIITA-R2=889bp
敲除后:459bp
具体操作如下:
1)在Matrigel包被的6孔板上正常使用mTeSR1培养人类多能干细胞至80%密度。使用TRYPLE消化后加入DMEM/F12中和,计数。吸取2×10
2)根据Neon转染系统100μL电转体系,加入15μg TrueCut
3)100μL RNP电转体系重悬细胞,Neon转染系统进行电转,电转参数为1200V,30ms,1pause。电转后细胞迅速加入提前预热的培养基,均匀接种于1孔包被了Matrigel的6孔板中。
4)每天更换新鲜mTeSR1培养基。待单细胞生长起来,挑取单个克隆于48孔板内,待克隆扩增后,收取基因组样品进行PCR检测基因编辑情况,PCR结果如图1和2所示。PCR阳性克隆送公司做Sanger测序进一步验证。
5)鉴定阳性的B2M/CIITA双等位基因敲除克隆DKO扩增培养及冻存。
使用qPCR检测B2M/CIITA双等位基因敲除克隆DKO的B2M和CIITA在RNA水平的表达情况,如图3所示,确定敲除。
B2M-F:AAGATGAGTATGCCTGCCGT
B2M-R:ATGCGGCATCTTCAAACCTC
CIITA-F:CCTGGAGCTTCTTAACAGCGA
CIITA-R:TGTGTCGGGTTCTGAGTAGAG
使用Western-Blot检测B2M/CIITA双等位基因敲除克隆DKO的B2M蛋白水平的表达情况,如图4所示,确定敲除。
使用INF-gamma刺激WT及DKO:细胞铺板,第二天换液时将含有INF-gamma的培养基加入到细胞中,作用48h后将细胞消化后使用流式检测HLA-I/II的表达情况。结果如图5显示B2M/CIITA双等位基因敲除的干细胞阳性克隆(DKO)不能响应INF-gamma的刺激而表达HLA-I/II类分子。T细胞为检测HLA-I/II类分子的阳性对照。
对获得的B2M/CIITA双等位基因敲除阳性克隆(DKO)进行核型检测:用胰蛋白酶处理固定于载玻片上的染色体标本,再用Giemsa染液染色。将分裂中期染色体进行染色体数目、形态结构分析,确定其核型是否与正常核型一致。结果如图6所示,DKO核型正常。
实施例2.验证实施例1中DKO细胞系的干性和免疫功能
1、WT和DKO细胞中干性基因的表达
免疫荧光检测显示WT和DKO细胞在蛋白水平表达干性基因POU5F1和NANOG:将细胞铺板在12孔板中,待细胞长到60-80%的密度后吸去培养基,加入4%多聚甲醛进行固定。细胞破膜后使用POU5F1和NANOG的一抗在4℃过夜孵育,洗去一抗后室温孵育带有荧光标记的二抗,随后使用荧光显微镜进行拍照。结果如图7A所示。RT-qPCR检测显示WT和DKO细胞在RNA水平表达干性基因POU5F1、NANOG和SOX2:结果如图7B所示。(MSC为干性基因表达的阴性对照)
流式结果检测显示WT和DKO细胞表面均高表达干性基因SSEA-4和Tra1-81占比分别为100%,99.98%和96.75%,99.13%。结果如图8所示。
2、获得的B2M/CIITA双等位基因敲除阳性克隆(DKO)的分化能力
在免疫缺陷小鼠(SCID Beige)皮下注射100μL含5E+5DKO细胞的悬液,待畸胎瘤体积大于1.5cm
获得的B2M/CIITA双等位基因敲除阳性克隆(DKO)可以在体内形成畸胎瘤并分化出内中外三胚层的细胞。如图9所示。
3、DKO细胞免疫功能验证
T细胞及NK细胞的杀伤性实验使用xCELLigence RTCA Instrument。将相同数量WT和DKO细胞系使用含有IL-2的Essential 8培养基重悬,并接种于用基质胶包被的96-wellE-plates,加入活化的T细胞或NK细胞进行杀伤检测。RTCA检测数据使用xCELLigence软件进行分析,计算杀伤率和逃逸功能。
表2
如图10的RTCA数据显示,WT细胞因为有HLA-I的表达而逃逸NK细胞的杀伤,但会被T细胞杀伤。DKO细胞能逃逸T细胞杀伤,同时对NK细胞的杀伤更为敏感。
实施例3.DKO+CD47细胞系的构建及免疫功能验证
在实施例1获得的DKO细胞中使用慢病毒载体过表达CD47(NM_198793),所述CD47的氨基酸序列如SEQ ID NO.18,将过表达序列的cDNA(SEQ ID NO.19)构建在由EF1a启动,且带puromycin筛选标记的慢病毒质粒中(pGC-EF1a),pGC-EF1a质粒的结构如图11所示。质粒用BamHI/NheI酶切,连接成功后采用Sanger测序验证插入序列正确性并进行病毒包装。对实施例2构建的DKO人类多能干细胞进行转染,24h换液,48h后换成带puromycin的培养基进行筛选。构建的稳转株细胞DKO+CD47的结果如图12所示,确认表达无误后进行细胞扩增和后续功能性检测。
参照实施例2,使用RTCA检测过表达的DKO+CD47细胞株是否可以在逃逸T细胞杀伤的同时成功逃逸NK细胞的杀伤,如图13所示,NK细胞可有效杀伤DKO细胞,WT和DKO+CD47过表达细胞可逃逸NK杀伤。
实施例4.表达包含母胎耐受和肿瘤免疫逃逸分子蛋白的通用型细胞的筛选
本发明各分子蛋白的构建策略及筛选:
本次共筛选了22个候选靶点,其氨基酸和cDNA序列如表3所示。候选靶点涉及到母胎耐受或肿瘤免疫逃逸,其中:
涉及母胎耐受的分子:HLA-E、HLA-G、CTLA4-Ig。
涉及肿瘤表达的抑制性免疫受体(免疫检查点):MICA、MICB、ULBP1、ULBP2、ULBP3、CTLA4-Ig、C1-Inhibitor、LGALS9、CD46、CD55、CD59、CD20、HER2。
涉及肿瘤微环境中的调节因子:TDO、IDO1、IDO2、IL-10、IL37、IL-12A、IL-35B。
表3
/>
利用天然免疫抑制机制改造成多能干细胞以赋予低免疫原性,但这些类型的方法依赖于免疫抑制受体-配体对或特定的微环境,以及它们是否存在于移植细胞和免疫细胞上,因此仅引入这些基因可能不一定会带来完全的低免疫原性,需要通过实际检测进行功能确认(Zhao et al.,2020)。
在实施例1获得的DKO细胞中使用慢病毒载体分别过表达本次筛选的22个候选靶点,所述22个候选靶点的氨基酸序列如表3所示,将过表达序列的cDNA(NM_009587.3)分别构建在由EF1a启动,且带puromycin筛选标记的慢病毒质粒中(pGC-EF1a),pGC-EF1a质粒的结构如图11所示。质粒用BamHI/NheI酶切,连接成功后采用Sanger测序验证插入序列正确性并进行病毒包装。对实施例2构建的DKO人类多能干细胞进行转染,24h换液,48h后换成带puromycin的培养基进行筛选。对22个候选靶点的稳转株进行多次NK体外杀伤性实验(n≥5),拟筛选出对NK细胞的逃逸程度最优的候选新靶标。相对杀伤比例归一至阴性对照H1DKO细胞,并分高(high:E:T=2:1)和低(low:E:T=1:1or 0.5:1)两个NK比例(E:T)进行汇总。杀伤比例小于1,说明相对于DKO有逃逸能力,比例越低说明逃逸能力越强。阳性对照为H1 WT和实施例3构建的H1 DKO+CD47。结果如图14所示,有且只有DKO+LGALS9多个比例下、多次杀伤率均小于DKO,与阳性对照H1 WT和现有技术DKO+CD47平均杀伤率类似,为逃逸NK杀伤的最优细胞。效果甚至优于常识明星分子HLA-G、CTLA4-Ig等,达到了不可预期的效果。
实施例5.DKO+LGALS9细胞系的构建及免疫功能验证
1、DKO+LGALS9细胞构建及过表达检测
直接合成编码LGALS9(LGALS9的氨基酸序列如NP_033665.1所示)的核酸序列并构建在由EF1a启动,且带puromycin筛选标记的慢病毒质粒中(pGC-EF1a),pGC-EF1a质粒的结构如图11所示。质粒用BamHI/NheI酶切,连接成功后采用Sanger测序验证插入序列正确性并进行病毒包装。对实施例2获得的DKO人类多能干细胞进行转染后换成带puromycin的培养基进行筛选。构建的DKO+LGALS9细胞使用qPCR检测mRNA的过表达水平,DKO细胞为阴性对照,结果如图15所示。
LGALS9 F1:TCTGGGACTATTCAAGGAGGTC
LGALS9 R1:CCATCTTCAAACCGAGGGTTG
2、DKO+LGALS9细胞中干性基因的表达
参考实施例2,免疫荧光检测显示DKO+LGALS9细胞在蛋白水平表达干性基因OCT4、NANOG、SOX2、TRA-1-60、TRA-1-81,结果如图16A所示。流式结果检测显示DKO+LGALS9细胞表面高表达干性基因SSEA-4、OCT4、TRA-1-60和Tra1-81占比分别为99.20%、98.52%、99.69%和97.93%。结果如图16B所示。
3.DKO+LGALS9细胞免疫功能检测
DKO+LGALS9细胞确认构建及干性表达无误后进行细胞扩增和后续功能性检测。参照实施例2,在RTCA检测的NK细胞杀伤性实验中,实施例2构建的DKO细胞被NK细胞完全杀伤,H1WT和DKO+LGALS9成功逃逸。如图17所示。
以上,对本发明的实施方式进行了说明。但是,本发明不限定于上述实施方式。凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
