一种靶向GPC3的嵌合抗原受体单核/巨噬细胞及构建方法和应用
文献发布时间:2023-06-19 18:53:06
技术领域
本发明涉及肿瘤治疗领域,特别是涉及一种靶向GPC3的嵌合抗原受体单核/巨噬细胞及构建方法和应用。
背景技术
嵌合抗原受体(chimericantigen receptor,CAR)技术是指将一个特异抗原的受体人工嵌合在细胞表面的技术,是过继性免疫细胞疗法(ACT)的基础,用于嵌合的抗原受体分为胞内和胞外两个部分,胞外部分可以识别特异的肿瘤抗原,胞内部分可以活化被嵌合的免疫细胞,诱导细胞的肿瘤杀伤作用。该项技术最先在T细胞上应用并在血液肿瘤中表现优异,已上市的几款CAR-T疗法均针对血液瘤疾病。但由于CAR-T细胞疗法存在较高的细胞因子释放综合征(CRS)风险,且由于实体瘤中的靶点抗原选择限制、肿瘤浸润率低、肿瘤微环境抑制等因素导致其对实体瘤的治疗效果不佳。
目前,肝癌有效治疗药物十分匮乏,索拉非尼的上市填补了肝癌一线靶向用药的空白,但是它也只能延长近3个月的总生存期,ORR只有2%-3%。随后上市的靶向药物如仑伐替尼、瑞戈非尼等,也并没有带来显著的生存期改善获益。目前认为,肿瘤药物难开发的最主要原因在于其异质性。而肝癌恰恰是异质性最强的恶性肿瘤之一。由于肝癌的高度异质性,迄今为止未找到肝癌相关的“癌基因依赖”,因此肝癌的分子靶向疗法经过十多年的开发也疗效甚微,且理论依据不足。
此外,临床试验的初步报告表明,免疫治疗在肝癌中的应答率低,疗效有限。在分析可能影响肝癌免疫治疗临床结果的分子和细胞因素时,肝免疫耐受机制不能被忽视。肝脏的免疫抑制环境是由幼稚T细胞(Naive T Cell)、树突状细胞、库普弗细胞和肝细胞等在调控促炎和抗炎细胞因子,在肝脏环境中的动态协调活动来维持的。虽然这一机制过程并不完全清楚,目前已知肝脏的最重要的免疫学特性之一是诱导T细胞耐受状态;与此同时,当前研究对实体肿瘤形成的肿瘤免疫抑制微环境造成的T细胞衰竭机制已有共识;肝脏的先天免疫耐受环境,加之肿瘤微环境形成的免疫抑制微环境,使得当前包括CAR-T在内的诸多免疫治疗策略在肝癌的治疗中尚未取得实质性进展。
Glypican-3(GPC3)是一种由580个氨基酸组成的65kD蛋白质,是一种硫酸乙酰肝素蛋白聚糖,通过糖基磷脂酰肌醇与细胞膜结合。GPC3可以通过典型的Wnt信号通路刺激肝癌细胞的生长。GPC3的一个卷曲状的富含半胱氨酸的结构域,可以调节Wnt结合并介导小鼠肝癌肿瘤的生长。此外,GPC3还可以负性调控骨形态发生蛋白7(BMP-7)以调节细胞增殖。GPC3在正常和良性组织中不存在,而在人类胚胎和多种肿瘤细胞中表达,如肝癌、黑色素瘤和鳞状非小细胞肺癌。GPC3在细胞膜上的过表达可以诱导M2极化的肿瘤相关巨噬细胞进入人肝癌组织,从而可能刺激肝癌的进展和转移。GPC3的表达与肝细胞癌的大小有关,GPC3被确定为癌症免疫治疗的有希望的靶点,因此GPC3是一种很好的肿瘤治疗靶点。
当前已开展的临床研究表明,单纯依赖GPC3单一靶点,甚至佐以CAR-T、CAR-NK细胞免疫治疗技术,仍无法获得肝癌治疗的理想收益。因此在设计有效的肝癌免疫疗法时,必须解决两个关键问题:肝脏肿瘤细胞的免疫原性强度,尤其是针对促进肝癌进展的免疫逃逸的特定机制如何开展原创性的颠覆设计。
巨噬细胞作为一种经典的固有免疫细胞,通过吞噬和抗原提呈作用构成了人体复杂免疫系统的基石。巨噬细胞先天对于肝脏具有归巢效应,肝脏是机体巨噬细胞富集的主要组织脏器。外周血单核细胞归巢至肝脏后,分化为肝巨噬细胞,又称库普弗细胞(Kupffercells,KC),肝巨噬细胞具有变形运动和活跃的吞噬功能,还具有处理和传递抗原、调节机体免疫应答等作用,是最适合肝脏微环境的免疫细胞。基于巨噬细胞过继免疫治疗体系开展肝癌细胞免疫治疗设计,具有独到的理论基础和先天优势。基于肝癌产生的免疫抑制机制,有针对性地开展CAR-M技术设计,通过CAR技术改造赋予其靶向识别并摧毁肿瘤细胞的作用。CAR-M除了具有吞噬肿瘤细胞的作用外,还具有促进抗原提呈能力和增强T细胞杀伤的作用。与CAR-T相比,CAR-M的循环时间有限,非肿瘤靶向毒性小,同时CAR-M具有更好的实体肿瘤浸润性,而不会产生免疫耐受或者免疫衰竭,预期将在细胞治疗中有所突破。
发明内容
本发明的目的是提供一种靶向GPC3的嵌合抗原受体单核/巨噬细胞及构建方法和应用,以解决上述现有技术存在的问题,首次提出了靶向GPC3的CAR-M细胞免疫疗法,并通过实验验证了CAR-M细胞免疫疗法治疗实体瘤,这为实体瘤的治疗奠定了理论基础。
为实现上述目的,本发明提供了如下方案:
本发明提供一种嵌合抗原受体,包括胞外域、跨膜域和胞内域,所述胞外域包含抗原结合域,所述抗原结合域用于与靶细胞上的抗原结合,所述抗原结合域为抗GPC3scFv分子,其氨基酸序列如SEQ ID NO:1所示。
优选的是,所述胞内域包括FcγRⅠ共刺激域和可分泌型细胞因子GM-CSF,所述FcγRⅠ共刺激域的氨基酸序列如SEQ ID NO:2所示;所述可分泌型细胞因子GM-CSF的氨基酸序列如SEQ ID NO:3所示。
优选的是,所述胞内域还包括T细胞或者NK细胞调节因子,所述T细胞或者NK细胞调节因子包括IL15和IL2。
本发明还提供一种重载载体,包括所述的嵌合抗原受体。
本发明还提供一种重组细胞,其表达所述的嵌合抗原受体。
优选的是,所述细胞包括T细胞、B细胞、NK细胞、单核细胞和巨噬细胞中的任意一种。
本发明还提供一种药物组合物,包括所述的重组细胞。
本发明还提供一种构建所述的重组细胞的方法,其包括将所述的嵌合抗原受体的编码核酸,或所述的重组载体转入细胞的步骤;其中,所述细胞来自于受试者分离的样品。更优选的是,所述受试者分离的样品为T细胞、B细胞、NK细胞、单核细胞和巨噬细胞中的任意一种;更优选的是,所述受试者分离的样品为巨噬细胞。
本发明还提供所述的嵌合抗原受体,或所述的重组载体,或所述的重组细胞在制备治疗实体瘤药物中的应用。
优选的是,所述实体瘤包括GPC3高表达的肿瘤。更有选的是,GPC3高表达的肿瘤为肝癌,但不限于此。
本发明公开了以下技术效果:
本发明公开了针对肝癌、靶向GPC3嵌合抗原受体巨噬细胞(CAR-M),该CAR-M细胞特定靶向GPC3靶点,对GPC3靶蛋白具有良好的杀伤能力,使得CAR-M先天归巢效应佐以特异活细胞靶向,显著提高药物富集;抑制GPC3通路抑制癌细胞生长的同时,发挥对肿瘤细胞的特异吞噬作用清除肿瘤细胞。本发明提出的抗GPC3型CAR-M可分泌GM-CSF,在保持自身M1特性的同时,可将M2型巨噬细胞逆转成M1型巨噬细胞,有望促进肿瘤微环境中肿瘤相关巨噬细胞TAM的极性逆转,改善离体扩增CAR-M细胞的抗肿瘤功能,从而改善患者的预后;同时还可分泌IL15,可在肿瘤微环境中实现刺激T细胞和NK细胞的增殖和活化,诱导B细胞免疫球蛋白合成和支持细胞毒性效应细胞分化,重塑肿瘤微环境,从而获得高效、持久的抗肿瘤效应,具有良好的临床应用前景。基于此,本发明首个提出靶向GPC3的CAR-M细胞免疫疗法,并用CAR-M细胞免疫疗法治疗肝癌的技术方案,为细胞免疫疗法治疗肝癌奠定科学基础。
附图说明
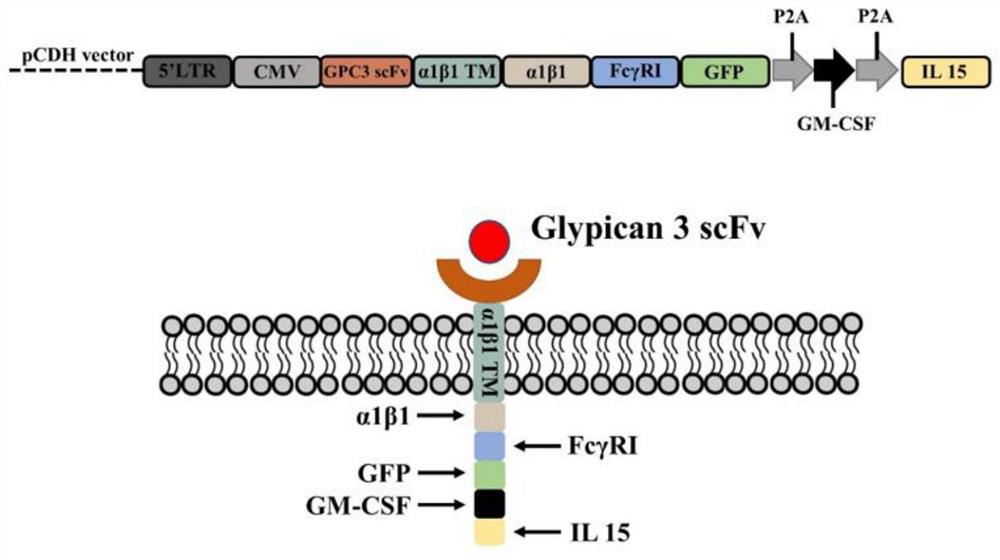
图1为GPC3 CAR-M构建模式图;
图2为GPC3 CAR-M的共聚焦显微成像;蓝色为DAPI染色,代表细胞核;红色为DiI,代表细胞膜;绿色为GPC3-GFP,代表着跨膜表达的GPC3-GFP蛋白;Merge为DAPI、DiI、GPC3-GFP的叠加图片,体现了GPC3-GFP与DiI的共定位;
图3为GPC3 CAR-M吞噬Huh-7肿瘤能力检测结果;
图4为GPC3 CAR-M体外自身M1表型极化检测结果;A:qPCR检测CD80的表达情况;B:qPCR检测CD206的表达情况;*表示不同组之间的显著性差异,***为P<0.001,**为P<0.01,*为P<0.05;
图5为GPC3 CAR-M体外抗M2复极化检测;A:qPCR检测CD80的表达情况;B:qPCR检测CD206的表达情况;*表示不同组之间的显著性差异,***为P<0.001,**为P<0.01,*为P<0.05;
图6为GPC3 CAR-M体外调控M0型巨噬细胞极化为M1型;A:qPCR检测CD80的表达情况;B:qPCR检测CD206的表达情况;*表示不同组之间的显著性差异,***为P<0.001,**为P<0.01,*为P<0.05;
图7为GPC3 CAR-M体外调控M2型巨噬细胞逆转情况分析;A:qPCR检测CD80的表达情况;B:qPCR检测CD206的表达情况;*表示不同组之间的显著性差异,***为P<0.001,**为P<0.01,*为P<0.05;
图8为GPC3 CAR-M激活T细胞迁移能力检测结果;A:GPC3 CAR-M激活T细胞迁移的模式图;B:GPC3 CAR-M在下室分泌IL-15因子,激活T细胞,T细胞向下室迁移的数量;C:GPC3CAR-M在下室分泌IL-15因子,激活T细胞,T细胞向下室迁移后,上室剩余的数量;
图9为GPC3 CAR-M对小鼠肿瘤靶向性验证IVIS成像;
图10为GPC3 CAR-M细胞在不同时间段小鼠肿瘤处荧光分布定量结果;
图11为GPC3 CAR-M细胞在小鼠主要组织脏器及肿瘤的荧光分布IVIS拍摄结果;
图12为GPC3 CAR-M细胞在小鼠组织脏器(A)以及肿瘤的荧光定量结果统计(B);
图13为小鼠治疗过程中的肿瘤体积变化情况(A)和体重的变化情况(B),以及小鼠肿瘤解剖后的大小生长情况(C)和离体的肿瘤重量结果图(D);
图14为不同实验组荷瘤小鼠的生存曲线。
具体实施方式
现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
实施例1构建靶向GPC3 CAR-M细胞及验证其功能
1、设计与构建CAR-M细胞
靶向GPC3 CAR-M的分子结构由胞外域、跨膜域和胞内域三部分构成(如图1所示)。胞外域中的抗原结合域是抗GPC3 scFv分子。α1β1跨膜域的主要功能在于将CAR分子锚定在细胞膜上,其对CAR分子表达的稳定性及激活胞内信号域具有重要作用。胞内域主要由α1β1整合素胞内结构域、FcγRⅠ共刺激胞内结构域、标记蛋白GFP、可分泌型细胞因子GM-CSF和IL15组成。
具体构建过程如下:通过NCBI寻找各个元件的氨基酸序列,将序列进行优化,随后对序列进行串联,串联顺序为:GPC3 scFv、linker、α1β1整合素跨膜区、α1β1整合素胞内结构域、FcγRⅠ共刺激胞内结构域、linker、标记蛋白GFP、P2A、GM-CSF、P2A、IL-15,将串联后的序列进行基因合成,获得GPC3 CAR质粒;将其转染巨噬细胞,构建巨噬细胞特异性CAR(GPC3 CAR-M)。
上述涉及的各元件的序列:所述GPC3 scFv的氨基酸序列(SEQ ID NO:1):DVVMTQSPLSLPVTPGEPASISCRSSQSLVHSNANTYLHWYLQKPGQSPQLLIYKVSNRFSGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCSQNTHVPPTFGQGTKLEIKRGGGGSGGGGSGGGGSQVQLVQSGAEVKKPGASVKVSCKASGYTFTDYEMHWVRQAPGQGLEWMGALDPKTGDTAYSQKFKGRVTLTADESTSTAYMELSSLRSEDTAVYYCTRFYSYTYWGQGTLVTVSS。
所述GPC3 scFv的核苷酸序列,如SEQ ID NO:5所示。
α1β1整合素跨膜区为α1β1整合素的跨膜区域,其氨基酸序列如SEQ ID NO:6所示:LWVILLSAFAGLLLLMLLILALW。
α1β1整合素跨膜区为α1β1整合素的跨膜区域,其核苷酸序列如SEQ ID NO:7所示。
α1β1整合素胞内结构域的氨基酸序列如SEQ ID NO:8所示:KIGFFKRPLKKK MEK。
α1β1整合素胞内结构域的核苷酸序列如SEQ ID NO:9所示。
FcγRⅠ共刺激胞内结构域的氨基酸序列(SEQ ID NO:2):KIGFFKRPLKKKMEK KIHRLQREKKYNLEVPLVSEQGKKANSFQQVRSDGVYEEVTATASQTTPKEAPDGPRSSVGDCGPEQPEPLPPSDSTGAQTSQS。
FcγRⅠ共刺激胞内结构域的核苷酸序列如SEQ ID NO:10所示。
linker的氨基酸序列如SEQ ID NO:11所示:GGGSGGGSGGGTGGGSGGG。
linker的核苷酸序列如SEQ ID NO:12所示。
标记蛋白GFP的氨基酸序列如SEQ ID NO:13所示:VSKGEELFTGVVPILVEL DGDVNGHKFSVSGEGEGDATYGKLTLKFICTTGKLPVPWPTLVTTLTYGVQCFSRYPDHMKQHDFFKSAMPEGYVQERTIFFKDDGNYKTRAEVKFEGDTLVNRIELKGIDFKEDGNILGHKLEYNYNSHNVYIMADKQKNGIKVNFKIRHNIEDGSVQLADHYQQNTPIGDGPVLLPDNHYLSTQSALSKDPNEKRDHMVLLEFVTAAGITLGMDELYK。
标记蛋白GFP的核苷酸序列如SEQ ID NO:14所示。
P2A氨基酸序列如SEQ ID NO:15所示:GSGATNFSLLKQAGDVEENPGP。
P2A核苷酸序列如SEQ ID NO:16所示。
GM-CSF氨基酸序列(SEQ ID NO:3):MWLQNLLFLGIVVYSLSAPTRSPITVT RPWKHVEAIKEALNLLDDMPVTLNEEVEVVSNEFSFKKLTCVQTRLKIFEQGLRGNF TKLKGALNMTASYYQTYCPPTPETDCETQVTTYADFIDSLKTFLTDIPFECKKPGQK。
GM-CSF核苷酸序列如SEQ ID NO:17所示。
IL-15氨基酸序列(SEQ ID NO:4):MKILKPYMRNTSISCYLCFLLNSHFLTEA GIHVFILGCVSVGLPKTEANWIDVRYDLEKIESLIQSIHIDTTLYTDSDFHPSCKVTAM NCFLLELQVILHEYSNMTLNETVRNVLYLANSTLSSNKNVAESGCKECEELEEKTFTE FLQSFIRIVQMFINTS。
IL-15核苷酸序列如SEQ ID NO:18所示。
2、慢病毒的包装及滴度测定
(1)HEK293T细胞的接种
将4×10
(2)穿梭质粒及辅助质粒的转染
按3:1:1:1比例分别取质粒pCDH-Affibody-GFP 2.0μg、Rev 0.67μg、Gag 0.67μg和VSV 0.67μg加入到装有400μL Opti-MEM的1.5mL离心管中混匀室温孵育5min,再加入6.0μL TurboFect Transfection Reagent转染试剂,枪头轻柔吹打混匀,室温孵育15-20min;
(3)慢病毒的合成
将上述孵育好的混合液缓慢滴加到接种了293T细胞的6孔细胞培养板中,边滴加边轻轻摇动培养板,置于37℃、5% CO
(4)慢病毒的收集
将上述步骤中获得的细胞培养基于离心管中3000rpm离心5min,吸取上清液至新的无菌离心管中进行下一步的浓缩纯化;
(5)慢病毒的纯化浓缩
为去除细胞碎片,将含有慢病毒的培养基于4℃、4000g下离心10min。用0.45μm的过滤器过滤上清液并收集,离心机4℃、15000g离心2h。弃上清,利用病毒保存液重悬病毒颗粒,再10000g离心5min后取上清于-80℃中保存备用;
(6)慢病毒的滴度检测
向9个无菌的1.5mL离心管中加入90μL含有6.0μg/mL聚凝胺的DMEM完全培养基,再将10μL已获得的重组慢病毒颗粒Affibody-GFP-LV加入第一个离心管中吹打均匀,吸出10μL混合液加入到第二个离心管中,如此连续直至最后一管,每组设置三个重复。将5×10
3、制备Anti-GPC3-GM-CSF-IL-15-CAR-M细胞系
(1)J774A.1细胞的接种:将4×10
(2)J774A.1细胞的感染:以每9:1的比例向巨噬细胞的培养基中加入Anti-GPC3-GM-CSF-IL-15-CAR慢病毒病毒颗粒,并加入聚凝胺使其终浓度为6.0μg/mL,放于37℃、5%CO
(3)感染慢病毒的J774A.1细胞的换液培养:24h后更换新鲜DMEM完全培养基;48h后第二次换液,放于37℃、5% CO
(4)获得慢病毒感染的J774A.1细胞:观察细胞生长情况及形态变化;
(5)稳转靶向GPC3 CAR-M细胞系的筛选:利用嘌呤霉素进行筛选,每隔1天更换一次含有嘌呤霉素的新鲜DMEM培养基,使培养基中嘌呤霉素的浓度保持不变,观察细胞生长情况及形态变化。约持续3-4次后药筛完成,胰酶消化药筛后的细胞并按0.5个/100μL的细胞浓度将细胞接种于96孔板中,用含有嘌呤霉素的DMEM完全培养基继续培养,选择仅含有单个细胞的孔进行细胞扩大培养,传代至新的培养瓶或培养皿中进行扩增或者冻存。
3、靶向GPC3 CAR-M细胞体外和体内功能验证
3.1验证GPC3-CAR-M细胞的表达情况
(1)J774A.1细胞的接种:将4×10
(2)J774A.1细胞的感染:以每9:1的比例向巨噬细胞的培养基中加入GPC3-GM-CSF-IL-15-CAR慢病毒病毒颗粒,并加入聚凝胺使其终浓度为6.0μg/mL,放于37℃、5% CO
(3)感染慢病毒的J774A.1细胞的换液培养:24h后更换新鲜DMEM完全培养基;48h后第二次换液,放于37℃、5% CO
(4)用10μg/mL Dio进行巨噬细胞膜染色,0.5μg/mL DAPI进行核染色。染色30min后,进行共聚焦拍摄GPC3 CAR的表达。
如图2所示,结果显示:GPC3 CAR-M成功在巨噬细胞膜上表达,生成了完整的GPC3CAR-M。
3.2GPC3 CAR-M的体外吞噬活性检测
将上述构建的GPC3 CAR-M,分别基于1:1的效靶比,以GPC3+-Huh-7肿瘤细胞为模型,使用GPC3 CAR-M吞噬肿瘤细胞,具体操作为:
于6孔板中分别接种4×10
结果如图3所示,相对于UTD-M、Empty组,GPC3 CAR-M组的吞噬肿瘤细胞能力得到了显著提升,这意味着GPC3 CAR-M吞噬能力得到了增强。
3.3GPC3 CAR-M的体外M1表型极化检测
将上述构建的GPC3 CAR-M,分别基于2×10
于6孔板中分别接种4×10
(1)利用SuperReal PreMix Plus(SYBR Green)试剂盒,并按照试剂盒说明书进行实验;
(2)正常溶解2×SuperReal Premix Plus、50×ROX Reference Dye、模板、引物和RNase-free ddH
(3)在冰上将反转得到的cDNA模板以一定体系与正向引物、反向引物、Mix、ROX、ddH2O混合,利用移液枪将混合液添加入八连管中,20μL体系包括:10μL2×SuperRealPremix Plus、0.6μL正向引物(10μM)、0.6μL反向引物(10μM)、0.1-2μL cDNA模板、0.4μL 50×ROX Reference Dye,使用RNase-free ddH2O补充至总体积20μL;
(4)盖上管盖,吹打混匀,用微量离心机离心5-10s,确保所有组分均在管底;
(5)将反应体系放置于RT-qPCR仪ABI 7300中,设置仪器参数,95℃预变性15min、95℃变性10s、60±1℃退火20s,72℃延伸31s,40个循环,运行程序,待程序结束后导出Ct值,并利用2
结果如图4所示,与UTD组和Empty组相比,GPC3 CAR-M组M1型标志物CD80表达水平均显著上升,但其M2型标志物CD206表达水平均显著下降,说明GPC3CAR-M组相对于UTD组和Empty组,均呈现显著性的M1型抗肿瘤巨噬细胞特性,这意味着GM-CSFGPC3 CAR-M的极化方面发挥了作用,提示GPC3 CAR-M可能抗M2复极化。
3.4GPC3 CAR-M体外抗M2复极化验证
采用肿瘤细胞培养上清液体外模拟肿瘤抑制性微环境体系,分别作用GPC3CAR-M及对照组普通巨噬细胞,将构建成功的GPC3 CAR-M细胞与普通巨噬细胞组进行对照分析,肿瘤培养上清对GPC3 CAR-M诱导5d,提取其提取细胞总RNA,qPCR检测进一步验证GPC3CAR-M抗极化能力。具体步骤包括:
(1)于6孔板中每孔加入2×10
(2)待UTD-M、Empty和GPC3 CAR-M组细胞贴壁后,吸去孔板中的培养基,用PBS清洗细胞2-3次,分别向6孔板中每组加入肿瘤细胞培养上清,每组实验设置3个平行孔;
(3)细胞诱导5d后,吸去6孔板中的培养基,用PBS清洗细胞2-3次,再向6孔板中每孔加入1mL的Trizol,提取RNA,利用SuperReal PreMix Plus(SYBR Green)试剂盒,并按照试剂盒说明书进行实验;
(4)正常溶解2×SuperReal Premix Plus、50×ROX Reference Dye、模板、引物和RNase-free ddH
(5)在冰上将反转得到的cDNA模板以一定体系与正向引物、反向引物、Mix、ROX、ddH
(6)盖上管盖,吹打混匀,用微量离心机离心5-10s,确保所有组分均在管底;
(7)将反应体系放置于RT-qPCR仪ABI 7300中,设置仪器参数,95℃预变性15min、95℃变性10s、60±1℃退火20s,72℃延伸31s,40个循环,运行程序,待程序结束后导出Ct值,并利用2
结果如图5所示,在肿瘤上清液的作用下,与UTD-M、Empty组相比,GPC3 CAR-M组M2型标志物CD206表达水平均显著下降,提示UTD-M、Empty组在肿瘤微环境中出现了M2型极化,而GPC3 CAR-M组仍然保持显著性的M1型巨噬细胞特征。
3.5GPC3 CAR-M体外调控M0型巨噬细胞极化为M1型
采用GPC3 CAR-M培养上清液体外诱导普通巨噬细胞,提取其提取细胞总RNA,qPCR检测进一步验证TMER CAR-M抗极化能力。具体步骤包括:
(1)于6孔板中每孔加入2×10
(2)细胞诱导5d后,吸去6孔板中的培养基,用PBS清洗细胞2-3次,再向6孔板中每孔加入1mL的Trizol,提取RNA,检测方法同上述的qPCR的检测方法。
结果如图6所示,与普通巨噬细胞组相比,在GPC3 CAR-M组上清液的作用下,GPC3CAR-M组M2型标志物CD206表达水平均显著下降,提示UTD-M、Empty组不能诱导M0型巨噬细胞编程为M1表型,而GPC3 CAR-M组上清诱导的巨噬细胞显示出显著性的M1型巨噬细胞特征,说明GPC3 CAR-M上清能够调控M0型巨噬细胞极化为M1型,初步评价其体外调控能力。
3.6GPC3 CAR-M体外调控M2型巨噬细胞逆转为M1型
采用肿瘤细胞培养上清液体外模拟肿瘤抑制性微环境体系,分别作用GPC3CAR-M、Empty及UTD,将构建成功的GPC3 CAR-M细胞与Empty和UTD组进行对照分析,肿瘤培养上清对普通巨噬细胞诱导,随后使用GPC3 CAR-M上清进行诱导,提取其提取细胞总RNA,qPCR检测进一步验证GPC3 CAR-M抗极化能力。具体步骤包括:
(1)于6孔板中每孔加入2×10
(2)细胞诱导5d后,吸去6孔板中的培养基,用PBS清洗细胞2-3次,使用UTD-M、Empty、GPC3 CAR-M细胞培养液上清进行诱导;
(3)细胞诱导5d后,吸去6孔板中的培养基,用PBS清洗细胞2-3次,再向6孔板中每孔加入1mL的Trizol,提取RNA,检测方法同上述的qPCR的检测方法。
结果如图7所示,与UTD-M、Empty组相比,在GPC3 CAR-M组上清液的作用下,GPC3CAR-M组M2型标志物CD206表达水平均显著下降,提示UTD-M、Empty组在肿瘤微环境中不能诱导M2型巨噬细胞重编程为M1表型,而GPC3 CAR-M组上清诱导的巨噬细胞显示出显著性的M1型巨噬细胞特征,说明GPC3 CAR-M上清能够调控M2型巨噬细胞逆转为M1型,初步评价其体外肿瘤微环境调控能力。
3.7GPC3 CAR-M的体外促进免疫T细胞迁移能力评估
将上述构建的GPC3 CAR-M,分别基于不同的效靶比,以T细胞为模型,使用GPC3CAR-M招募T细胞,具体操作为:
(1)将UTD和GPC3 CAR-M细胞分别用DMEM完全培养基(含10% FBS和1%双抗)重悬后接种到Transwell小室(5μm)的下室;
(2)将小鼠原代T细胞(用抗CD3抗体激活48h)用无血清的培养基重悬后接种在上室,在5% CO
(3)检测上室未迁移的T细胞和下室迁移的T细胞,流式进行计数。
从图8结果发现,与UTD组相比,GPC3 CAR-M组能够显著使T细胞迁移至下室,其最大效靶比的招募效果是UTD组的2倍以上,说明GPC3 CAR-M具备招募T细胞的能力。
3.8GPC3 CAR-M对GPC3高表达的癌细胞系具有很好的靶向富集效果
为验证构建的GPC3 CAR-M细胞对GPC3高表达的癌细胞系Huh7具有较好的靶向肿瘤的效果,进行了以下靶向验证实验。具体操作如下:
(1)将5-6周龄的裸鼠,随机分为2个实验组(UTD组、Anti-GPC3-CAR-M组),每组各3只小鼠,每只小鼠皮下接种1×10
(2)裸鼠皮下种瘤约14d成瘤,通过尾静脉注射经过IR780孵育过的治疗细胞1×106个(普通巨噬细胞和Anti-GPC3 CAR);
(3)在注射后0h,2h,4h,8h,12h,24h,48h进行IVIS拍摄,观察荧光分布强弱情况;
(4)48h后处死小鼠,取心,肝,脾,肺,肾和肿瘤进行离体拍摄。
结果如图9和图10所示,结果显示,显示随着时间增加,GPC3 CAR-M组的肿瘤处荧光比UTD组更强,在24h处肿瘤荧光富集量达到最大,是RAW264.7组的3倍左右,表明GPC3CAR-M细胞相比于UTD而言具有更强的靶向效果。
与小鼠在体IVIS荧光分布结果相同,小鼠离体组织荧光分布同样表明GPC3CAR-M细胞相比于UTD细胞而言具有更强的靶向效果且在除肿瘤外的其他组织上分布比RAW264.7组少。图11为UTD组和GPC3 CAR-M组小鼠的心、肝、脾、肺、肾及肿瘤的IVIS拍摄结果,GPC3CAR-M组在肿瘤处荧光富集最强,其他正常的离体器官组织荧光较弱,与在体小鼠组织的荧光数据对比看出具有一致性。图12为UTD组和GPC3 CAR-M组离体器官组织及肿瘤部位的定量结果,可以看出,与在体小鼠组织的荧光数据对比看出具有一致性,GPC3 CAR-M组的肿瘤荧光强度显著高于UTD组的肿瘤荧光强度,除肿瘤外的其他离体组织的荧光定量显示UTD组的数值更高,显示出GPC3 CAR-M细胞良好的肿瘤靶向作用。
3.9GPC3 CAR-M小鼠试验模型对肝癌肿瘤模型的显著性抑制
成功构建GPC3 CAR-M细胞后,在小鼠水平对其抑制肿瘤的功能进行了验证。为了证明所构建的GPC3 CAR-M细胞具有在体外抑制小鼠肿瘤的效果,发明人使用人肝癌细胞Huh7对裸鼠进行皮下瘤注射,构建了裸鼠Huh7肿瘤模型,随后进行抗肿瘤实验研究。具体操作如下:
(1)将5-6周龄的裸鼠,随机分为4个实验组(PBS组、UTD组、Empty组、Anti-GPC3-CAR-M组,分别尾静脉注射PBS、J774A.1、J774A.1+Empty、GPC3 CAR-M细胞),每组各6只小鼠,每只小鼠皮下接种1×10
(2)小鼠第一次治疗:每组分别通过尾静脉注射3×10
(3)小鼠第二次治疗:第一次治疗5d后,进行第二次治疗。每组分别通过尾静脉注射3×10
(4)第37天时,将小鼠断颈处死,解剖取得小鼠肿瘤,重获得离体肿瘤大小照片和离体肿瘤重量;
如图13所示,所构建的GPC3 CAR-M细胞实验组相比于其它对照组,肿瘤的生长明显受到了抑制,具有良好的抗肿瘤效果;同时,治疗过程中,小鼠本身的体重没有明显下降,说明实验较安全;在离体情况下,GPC3 CAR-M实验组比其它对照组解剖后的肿瘤更小,瘤重更轻,对小鼠的负荷更小。因此,通过跨膜表达平台所构建的GPC3 CAR-M细胞相对于其它对照组而言,具有显著的肿瘤抑制效果。
3.10肿瘤移植模型检测靶向GPC3 CAR-M细胞治疗荷瘤小鼠后小鼠的生存情况
发现GPC3 CAR-M细胞具有显著的抗肿瘤效果后,发明人在小鼠水平对其治疗后的生存情况进行了验证。使用人肝癌细胞Huh7对裸鼠进行皮下瘤注射,构建了裸鼠Huh7肿瘤模型,随后进行抗肿瘤实验研究。具体操作步骤如下:
(1)将5-6周龄的裸鼠,随机分为4个实验组(PBS组、UTD组、Empty组、GPC3CAR-M组),每组各6只小鼠,每只小鼠皮下接种1×10
(2)小鼠第一次治疗:每组分别通过尾静脉注射3×10
(3)小鼠第二次治疗:第一次治疗5d后,进行第二次治疗。每组分别通过尾静脉注射3×10
(4)统计小鼠的存活数量,绘制小鼠的生存曲线。
小鼠经过不同的细胞治疗后的生存情况,结果如图14所示。从结果可以看出,所构建的GPC3 CAR-M细胞实验组相比于其它对照组,小鼠的生存期普遍延长。因此,通过跨膜表达平台所构建的GPC3 CAR-M细胞相对于其它对照组而言,可以显著延长荷瘤小鼠的生存期。
从上述实施例及实验结果看,本发明构建的GPC3 CAR-M细胞具有如下特点(对其特点产生进行机理分析):
1)GPC3 CAR-M细胞实体瘤浸润能力强:由于肿瘤细胞周围基质形成的物理屏障,T细胞不易进入肿瘤环境,而巨噬细胞可以明显地浸入肿瘤环境中。TAM在肿瘤侵袭、转移、免疫抑制和血管生成中起着重要作用。CAR-M能降低TAM的比例,影响TAM的细胞表型,对肿瘤的治疗有积极作用。
2)GPC3 CAR-M细胞除了具有吞噬肿瘤细胞的作用外,还具有促进抗原提呈能力和增强T细胞杀伤的作用。
3)GPC3 CAR-M细胞的循环时间有限,非肿瘤靶向毒性较小。
4)GPC3 CAR-M细胞可在肿瘤部位分泌GM-CSF因子:GM-CSF将肿瘤微环境中的M2型巨噬细胞逆转成M1型的巨噬细胞,改善抑制性的肿瘤微环境。粒细胞巨噬细胞集落刺激因子(GM-CSF)最早作为一种造血生长因子被发现,能刺激骨髓前体细胞形成粒细胞和巨噬细胞;GM-CSF增强了通过活化的血管内皮细胞的髓样细胞的运输,并促进血管中单核细胞和巨噬细胞的积累;GM-CSF通过促进浸润性单核细胞分化为M1巨噬细胞,并可能促进单核细胞衍生的树突状细胞(MoDC)的表达。
5)GPC3 CAR-M细胞可在肿瘤部位分泌细胞因子IL15,改善抑制性的肿瘤微环境:白细胞介素-15(interleukin-15,IL-15)是一种可溶性细胞因子,于1994年被两个独立的实验室发现,具有激活T细胞、B细胞和NK细胞,并介导这些细胞的增殖和存活,由于IL-15在抗肿瘤、促炎症、抗感染中的重要作用。IL-15主要由单核细胞和巨噬细胞产生。人体多种组织表达IL-15mRNA,如心、肺、肾、尤其是胎盘和肌肉。IL-15Rα在人和小鼠中广泛表达,IL-15信号通路的主要机制是IL-15与细胞上的IL-15Rα亚基结合后,IL-15停留在细胞表面,与附近的效应NK细胞或T细胞上的IL-2R/IL-15Rβ-γc形成免疫突触,激活JAK1/JAK3和STAT3/STAT5途径、Syk激酶和磷脂酶C(PLC)γ、Lck激酶和Shc,导致PI3K/Akt和Ras/Raf/MAPK信号级联的激活。这些途径导致Bcl2、Myc和Fos/Jun和NFkB激活的后续表达。IL-15能诱导T细胞、B细胞和自然杀伤细胞(NK cell)的分化以及促进T细胞、B细胞和NK细胞的增殖。IL-15的在免疫细胞治疗中不会引起活化的T细胞凋亡;IL-15能维持记忆性T细胞,从而对长期抗肿瘤活性中起到重要作用。因此,IL-15作为一种多效细胞因子,在免疫,肿瘤发生,过敏性反应及自身免疫疾病中均发挥着重要作用。
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
- 一种靶向CD19的嵌合抗原受体T细胞的制备方法及应用
- 一种靶向全人源化mesothelin的嵌合抗原受体的方法和用途
- 一种靶向人源化mesothelin的嵌合抗原受体的方法和用途
- 一种新型可调控的双嵌合抗原受体T细胞及其构建方法和应用
- 同时靶向GPC3和CD276的嵌合抗原受体、嵌合抗原受体T细胞及其制备方法和应用
- 一种嵌合抗原受体-单核/巨噬细胞(CAR-M)的构建及其应用
