一种诱导胚胎干细胞定向分化为外胚层软骨祖细胞的培养基、方法及用途
文献发布时间:2023-06-19 18:53:06
技术领域
本申请涉及干细胞技术领域,特别涉及一种诱导胚胎干细胞定向分化为外胚层软骨祖细胞的培养基、方法及用途。
背景技术
软骨为无血管的组织,一旦发生损伤或破坏,其修复极为困难。目前,随着基础研究向临床医学的转化,干细胞治疗已成为国内、外研究的一大热点。间充质干细胞(Mesenchymal stem cells,MSCs)由于其来源丰富,取材方便,目前已成为最常用的种子细胞,但是由于其增殖能力有限、多项分化及分化后的细胞缺乏承重能力等不可控因素,限制了BMSCs在临床修复关节软骨方面的应用。胚胎干细胞(embryonic stem cell,ESCs)作为一种具有多向分化潜能的细胞,诱导其向软骨细胞定向分化也受到较多课题组的关注。利用ESCs实现向软骨的定向诱导分化,有望成为修复受损软骨组织有效解决办法。
目前关于ESCs向软骨的定向分化实验研究已积累了相当程度的数据,大部分基础及临床的研究均集中在将ESCs经中胚层途径分化成软骨细胞。这些技术方法虽然在其他关节软骨修复方面具有良好的应用前景,然而在颞下颌关节(temporomandibular joint,TMJ)领域却并不适用。其原因在于,在胚胎发育过程中,TMJ与全身其他大关节有着显著不同。在胚层来源上,几乎所有的关节软骨均来自于中胚层,而TMJ髁突软骨则来源于神经外胚层。这就导致无论是在生物学组成、组织结构、机体代谢还是生长模式等方面,TMJ髁突软骨与其他关节软骨均有着显著差异。因此,主流的ESCs向软骨诱导方法并不适合TMJ软骨的损伤修复。
随着基础研究的深入发展,通过小分子的时空把控来调节干细胞命运的证据逐渐增多。采用分步诱导方法,模拟TMJ髁突软骨的发育途径,实现ESCs经神经外胚层途径分化成为一种软骨干细胞,有望为TMJ髁突软骨的损伤修复提供新的思路与细胞来源。
发明内容
鉴于以上所述现有技术的缺点,本申请的目的在于提供一种诱导胚胎干细胞定向分化为外胚层软骨祖细胞的方法及用途,用于解决现有技术中的问题。
为实现上述目的及其他相关目的,本申请第一方面提供一种体外诱导胚胎干细胞定向分化为外胚层软骨祖细胞的培养基,所述培养基包括神经嵴诱导培养基和/或CSSEDF培养基,所述神经嵴诱导培养基的组分包括基础培养基、BMP4和TGF-β受体抑制剂;所述CSSEDF培养基的组分包括基础培养基、GSK-3抑制剂、TGF-β受体抑制剂、smoothened激动剂、EGF、FGF2和BMP受体抑制剂。
本申请第二方面提供所述的培养基用于体外诱导培养胚胎干细胞定向分化为外胚层软骨祖细胞的用途。
本申请第三方面提供一种体外诱导胚胎干细胞定向分化为外胚层软骨祖细胞的方法,包括以下步骤:
1)将胚胎干细胞复苏并扩增,得到传代培养的细胞;
2)将步骤1)所述的传代培养的细胞接种至所述培养基培养,得到外胚层软骨祖细胞。
本申请第四方面提供一种外胚层软骨祖细胞,所述外胚层软骨祖细胞通过所述的方法制备得到。
本申请第五方面提供所述的外胚层软骨祖细胞在制备修复软骨缺损产品中的用途。
与现有技术相比,本申请的有益效果为:
1、能够高效的定向分化得到外胚层软骨祖细胞,并且所得到的外胚层软骨祖细胞具备良好的稳定性、增殖能力及自发分化为软骨细胞的潜能。
2、与传统的中胚层来源的软骨细胞相比,本发明所分化得到的外胚层软骨祖细胞与颞下颌关节髁突软骨细胞在整个表达谱上更为接近,对起源于外胚层的软骨具有极高的研究价值。
附图说明
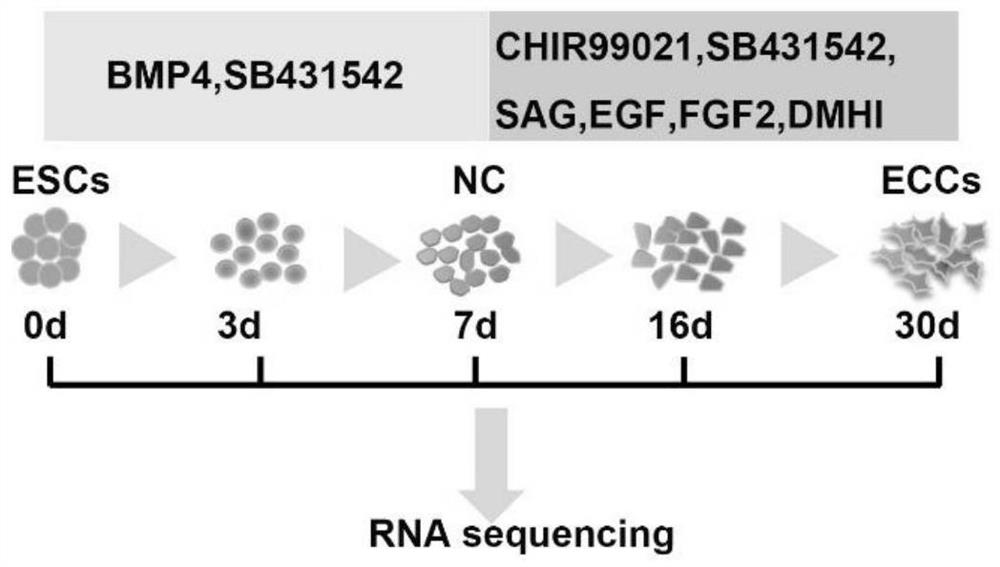
图1a为本发明中分步诱导胚胎干细胞定向分化为外胚层软骨祖细胞的示意图。
图1b为各时间点不同细胞系的转录组数据的PCA图。
图2为本发明中外胚层软骨祖细胞分化途径验证图。其中,图2a为bulk RNA-seq聚类分析外胚层标志物在诱导过程中表达。图2b为bulk RNA-seq聚类分析神经嵴标志物在诱导过程中表达。图2c为GO富集分析在细胞诱导过程中差异基金在骨-软骨体系的腹肌情况。图2d为bulk RNA-seq聚类分析软骨标志物在诱导过程中表达。
图3为本发明中外胚层软骨祖细胞自我更新能力检测图。其中,图3a为外胚层软骨祖细胞的单细胞克隆形成图。图3b为外胚层软骨祖细胞的外胚层标志物SIX1的细胞免疫荧光染色图。图3c为外胚层软骨祖细胞的外胚层标志物NESTIN的细胞免疫荧光染色图。图3d为外胚层软骨祖细胞的外胚层标志物ETS1的细胞免疫荧光染色图。图3e为外胚层软骨祖细胞的软骨标志物SOX9的细胞免疫荧光染色图。图3f为外胚层软骨祖细胞的软骨标志物RUNX2的细胞免疫荧光染色图。图3g为外胚层软骨祖细胞的软骨标志物SOX5的细胞免疫荧光染色图。图3h为外胚层软骨祖细胞的软骨标志物TWIST1的细胞免疫荧光染色图。图3i为外胚层软骨祖细胞的软骨标志物CD29的细胞免疫荧光染色图。图3j为外胚层软骨祖细胞的颌面部发育标志物FOXC1的细胞免疫荧光染色图。图3k为外胚层软骨祖细胞的颌面部发育标志物FOXC2的细胞免疫荧光染色图。图3l为外胚层软骨祖细胞的颌面部发育标志物MSX1的细胞免疫荧光染色图。图3m为不同代次外胚层软骨祖细胞Ki67与软骨相关标志基因SOX5,SOX9,TWIST1,CD29的流式细胞分析检测图。图3n为不同代次外胚层软骨祖细胞软骨相关标志物SOX9,COL1A1,SOX5,COL2A1,OCN,RUNX2,ACAN的表达。
图4为本发明中外胚层软骨祖细胞自发分化潜能效果图。其中,图4a为外胚层软骨祖细胞自发分化培养后大体图。图4b为外胚层软骨祖细胞自发分化培养后HE染色图。图4c为外胚层软骨祖细胞自发分化培养后台盼蓝染色图。图4d为外胚层软骨祖细胞自发分化培养后阿利新蓝染色图。图4e为外胚层软骨祖细胞自发分化培养后番红O固绿染色图。图4f为外胚层软骨祖细胞自发分化培养后Collagen II免疫组化染色图。图4g为外胚层软骨祖细胞自发分化培养后Collagen X免疫组化染色图。图4h为外胚层软骨祖细胞自发分化培养后Aggrecan免疫组化染色图。图4i为外胚层软骨祖细胞自发分化培养后RUNX2免疫组化染色图。图4j为外胚层软骨祖细胞自发分化培养后Collagen I免疫组化染色图。图4k为外胚层软骨祖细胞自发分化培养后Lubricin免疫组化染色图。
图5为本发明中外胚层软骨祖细胞、经典中胚层软骨祖细胞和人外胚层髁突软骨细胞的单细胞转录组表达图。其中,图5a为人外胚层髁突软骨细胞的单细胞转录组表达图。图5b为外胚层软骨祖细胞的单细胞转录组表达图。图5c为外胚层软骨祖细胞、经典中胚层软骨祖细胞和人外胚层髁突软骨细胞的单细胞转录组功能聚类分析图。
图6为本发明中外胚层软骨祖细胞修复体内软骨缺损的效果图。其中,图6a为膝关节软骨缺损及修复模型。图6b为体视镜直接观察外胚层软骨祖细胞修复体内软骨缺损GFP绿色荧光情况。图6c为体视镜直接观察对照组(单sponge支架)修复体内软骨缺损GFP绿色荧光情况。图6d为荧光显微镜观察外胚层软骨祖细胞修复体内软骨缺损后软骨组织切片GFP绿色荧光情况图。图6e为荧光显微镜观察对照组(单sponge支架)修复体内软骨缺损后软骨组织切片GFP绿色荧光情况图。图6f为外胚层软骨祖细胞修复体内软骨缺损后软骨组织切片HE染色图。图6g为外胚层软骨祖细胞修复体内软骨缺损后软骨组织切片Collagen I免疫组化染色图。图6h为外胚层软骨祖细胞修复体内软骨缺损后软骨组织切片CollagenII免疫组化染色图。图6i为外胚层软骨祖细胞修复体内软骨缺损后软骨组织切片番红O固绿染色图。图6j为外胚层软骨祖细胞修复体内软骨缺损后软骨组织切片Collagen X免疫组化染色图。图6k为外胚层软骨祖细胞修复体内软骨缺损后软骨组织切片Lubricin免疫组化染色图。
具体实施方式
为了使本申请的发明目的、技术方案和有益效果更加清晰,下面结合实施例对本申请作进一步说明。应理解,所述实施例只用于解释本申请,并非用于限定申请的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法,熟悉此技术的人士可由本说明所揭露的内容容易地了解本申请的其他优点及功效。
本申请的发明人经过大量探索研究,发现了一种诱导胚胎干细胞定向分化为外胚层软骨祖细胞的方法及用途,通过在不同培养基中分步诱导的方法,能够高效的定向分化得到外胚层软骨祖细胞,并且所得到的外胚层软骨祖细胞具备良好的稳定性、增殖能力及自发分化为软骨细胞的潜能,最重要的是,与传统的中胚层来源的软骨细胞相比,本发明所分化得到的外胚层软骨祖细胞与颞下颌关节髁突软骨细胞在整个表达谱上更为接近,在此基础上完成了本申请。
本申请提供一种体外诱导胚胎干细胞定向分化为外胚层软骨祖细胞的培养基,其特征在于,所述培养基包括神经嵴诱导培养基和/或CSSEDF培养基,所述神经嵴诱导培养基的组分包括基础培养基、BMP4和TGF-β受体抑制剂;所述CSSEDF培养基的组分包括基础培养基、GSK-3抑制剂、TGF-β受体抑制剂、smoothened激动剂、EGF、FGF2和BMP受体抑制剂。
本申请提供的体外诱导胚胎干细胞定向分化为外胚层软骨祖细胞的培养基中,当所述培养基包括神经嵴诱导培养基和CSSEDF培养基时,是指培养过程中分别使用两种培养基。所述神经嵴诱导培养基用于诱导神经嵴细胞,所述CSSEDF培养基用于促进软骨干细胞的自我更新。
本申请提供的体外诱导胚胎干细胞定向分化为外胚层软骨祖细胞的培养基中,所述神经嵴诱导培养基中,以所述基础培养基的总体积为基准,所述BMP4的浓度为0.1~100ng/ml,具体的,所述BMP4的浓度可以为0.1~10ng/ml、10~20ng/ml、或20~100ng/ml等。在一优选实施例中,所述BMP4的浓度为20ng/ml。所述BMP4是指添加骨形成蛋白4。
本申请提供的体外诱导胚胎干细胞定向分化为外胚层软骨祖细胞的培养基中,所述神经嵴诱导培养基中,以所述基础培养基的总体积为基准,所述TGF-β受体抑制剂的添加量为0.01~100μM。具体的,所述TGF-β受体抑制剂的添加量可以为0.01~2μM、2~20μM、或20~100μM等。在一优选实施例中,所述TGF-β受体抑制剂的浓度为2μM。所述TGF-β是一种转化生长因子。所述TGF-β受体抑制剂选自616452,LY2109761,Pirfenidone,Repsox(E-616452),SB431542,A77-01,Tranilast,Galunisertib(LY2157299),A8301,GW788388,ITD-1,SD208,SB525334,LY364947,ASP3029,D4476和SB505124中的一种或多种的组合。在一优选实施例中,所述TGF-β受体抑制剂选自SB431542。
本申请提供的体外诱导胚胎干细胞定向分化为外胚层软骨祖细胞的培养基中,所述CSSEDF培养基中,以所述基础培养基的总体积为基准,所述GSK-3抑制剂的添加量为0.1~50μM。具体的,所述GSK-3抑制剂的添加量可以为0.1~1μM、1~10μM、或10~50μM等。在一优选实施例中,所述GSK-3抑制剂的浓度为1μM。所述GSK3是指一种丝氨酸蛋白激酶。所述GSK-3抑制剂选自CHIR99021、BIO及LY2090314中的一种或多种的组合。在一优选实施例中,所述GSK-3抑制剂选自CHIR99021。
本申请提供的体外诱导胚胎干细胞定向分化为外胚层软骨祖细胞的培养基中,所述CSSEDF培养基中,以所述基础培养基的总体积为基准,所述TGF-β受体抑制剂的添加量为0.01~100μM。具体的,所述TGF-β受体抑制剂的添加量可以为0.01~2μM、2~10μM、或10~100μM等。在一优选实施例中,所述TGF-β受体抑制剂的浓度为2μM。所述TGF-β受体抑制剂选自616452,LY2109761,Pirfenidone,Repsox(E-616452),SB431542,A77-01,Tranilast,Galunisertib(LY2157299),A8301,GW788388,ITD-1,SD208,SB525334,LY364947,ASP3029,D4476和SB505124中的一种或多种的组合。在一优选实施例中,所述TGF-β受体抑制剂选自SB431542。
本申请提供的体外诱导胚胎干细胞定向分化为外胚层软骨祖细胞的培养基中,所述CSSEDF培养基中,以所述基础培养基的总体积为基准,所述smoothened激动剂的添加量为0.01~20μM。具体的,所述smoothened激动剂的添加量可以为0.01~0.2μM、0.2~5μM、5~10μM、或10~20μM等。在一优选实施例中,所述smoothened激动剂的浓度为0.2μM。所述smoothened激动剂选自purmorphamine、SAG及GSA 10中的一种或多种的组合。在一优选实施例中,所述smoothened激动剂选自SAG。
本申请提供的体外诱导胚胎干细胞定向分化为外胚层软骨祖细胞的培养基中,所述CSSEDF培养基中,以所述基础培养基的总体积为基准,所述EGF的浓度为0.1~500ng/ml。具体的,所述EGF的浓度可以为0.1~10ng/ml、10~20ng/ml、或20~500ng/ml等。在一优选实施例中,所述EGF的浓度为20ng/ml。所述EGF是指表皮生长因子。
本申请提供的体外诱导胚胎干细胞定向分化为外胚层软骨祖细胞的培养基中,所述CSSEDF培养基中,以所述基础培养基的总体积为基准,所述FGF2的浓度为0.1~500ng/mlng/ml。具体的,所述FGF2的浓度可以为0.1~15ng/ml、15~20ng/ml、或20~500ng/ml等。在一优选实施例中,所述FGF2的浓度为20ng/ml。所述FGF2是指碱性成纤维细胞生长因子。
本申请提供的体外诱导胚胎干细胞定向分化为外胚层软骨祖细胞的培养基中,所述CSSEDF培养基中,以所述基础培养基的总体积为基准,所述BMP受体抑制剂的添加量为0.01~50μM。具体的,所述BMP受体抑制剂的添加量可以为0.01~1μM、1~10μM、或10~50μM等。在一优选实施例中,所述BMP受体抑制剂的浓度为1μM。所述BMP是指骨形态发生蛋白。所述BMP受体抑制剂选自DMH1、K02288、LDN-193189、Noggin中的一种或多种的组合。在一优选实施例中,所述BMP受体抑制剂选自DMH1。
本申请提供的体外诱导胚胎干细胞定向分化为外胚层软骨祖细胞的培养基中,所述基础培养基选自MEM、DEM、DEM/F12、RPMI1640或F12中的一种或几种。优选的,所述基础培养基为含有N2、B27的DEM/F12。优选的,以所述基础培养基的体积为基准计,N2的浓度为0.1~10%(v/v),具体的,所述N2的浓度为0.1~0.5%、0.5~1%、或1~10%等。优选的,以所述基础培养基的体积为基准计,B27的浓度为0.1~10%(v/v)。具体的,所述B27的浓度为0.1~0.5%、0.5~1%、或1~10%等。在一优选实施例中,所述N2的浓度为0.5%(v/v),所述B27的浓度为0.5%(v/v)。所述N2和所述B27都是指一种无血清细胞培养添加剂。
本申请还提供所述的培养基用于体外诱导培养胚胎干细胞定向分化为外胚层软骨祖细胞的用途。本领域技术人员可根据实际需要,选择所述培养基用于胚胎干细胞的诱导分化。
本申请还提供一种体外诱导胚胎干细胞定向分化为外胚层软骨祖细胞的方法,包括以下步骤:
1)将胚胎干细胞复苏并扩增,得到传代培养的细胞;
2)将步骤1)所述的传代培养的细胞接种至所述的培养基培养,得到外胚层软骨祖细胞。
本申请提供的体外诱导胚胎干细胞定向分化为外胚层软骨祖细胞的方法中,步骤1)中,所述胚胎干细胞选自Hues9,Hues 7,H9、重编程细胞(ihPSCs)中的一种。所述复苏是指在基质胶包被的培养基中进行。所述传代是指当细胞在培养瓶中长到一定密度都会因为接触抑制而停止生长,之后就需要将其稀释分种,细胞才能继续生长。
本申请提供的体外诱导胚胎干细胞定向分化为外胚层软骨祖细胞的方法中,步骤2)中,先在所述的培养基中的神经嵴诱导培养基中进行培养2~10天,具体的,可以为2~5天、5~7天、7~9天、或9~10天;再在所述的培养基中的CSSEDF培养基中培养直至获得目标细胞。所述CSSEDF培养基可以在细胞传代过程中长期使用。在一优选实施例中,先在所述的培养基中的神经嵴诱导培养基中进行培养7天,再在所述的培养基中的CSSEDF培养基中培养23天。采用分步诱导方法,可以模拟颞下颌关节髁突软骨细胞的发育途径,实现胚胎干细胞经神经外胚层途径分化成为一种软骨干细胞。
本申请还提供一种外胚层软骨祖细胞,所述外胚层软骨祖细胞通过所述的方法制备得到。与传统的中胚层来源的软骨细胞相比,本发明所分化得到的外胚层软骨祖细胞与颞下颌关节髁突软骨细胞在整个表达谱上更为接近。
本申请还提供外胚层软骨祖细胞在制备修复软骨缺损产品中的用途,有利于为颞下颌关节髁突软骨的损伤修复提供新的思路与细胞来源。
下面通过实施例对本申请予以进一步说明,但并不因此而限制本申请的范围。
实施例中所用试剂的型号如表1:
表1试剂信息
实施例1
分步诱导胚胎干细胞向外胚层软骨祖细胞定向分化
(A)在Essential 8
(B)将Hues9,Hues 7,H9,H1和ihPSCs按照1*10
(C)随后,将培养基更换成CSSEDF培养基,具体成分如下:在含有N2、B27的DMEM/F12基础培养基中加入1μM CHIR99021,2μM SB431542,0.2μM SAG,20ng/ml EGF,20ng/mlFGF2和1μM DMH1,各种细胞系在该培养基中继续培养23天,得到Hues9、Hues7、H9、H1和ihPSCs分化得到的细胞。
(D)在0天、3天、7天、16天和30天分别收集细胞,提取细胞内RNA进行转录组测序,提取RNA步骤如下:
(1)将细胞中的培养液弃去,加入RNA抽提试剂Trizol;
(2)将Trizol裂解的细胞,4℃离心,12000rpm,10min,将上清移至DEPC-TreatedEP管中;
(3)加入1/5Trizol体积的氯仿,震荡混匀,4℃离心,8000rpm,15min;
(4)小心移出上清约400μl至新DEPC-Treated EP管中,加入等体积异丙醇,混匀-20℃放置半小时;
(5)将EP管取出,4℃离心,8000rpm,15min;
(6)弃上清,小心不要倒出沉淀,用75%酒精(DEPC水配制)清洗沉淀,4℃离心,7500rpm,10min,重复一次;
(7)超净台风干,彻底去除所有酒精,用约20μl DEPC水溶解RNA;
(8)将所得RNA,取2μl测定浓度,注意纯度,其余放置-80℃保存。
流程示意图如图1a所示。图1b为各时间点不同细胞系的转录组数据的PCA图。由图1可见,该诱导方法在不同的细胞系之间具有很好的一致性和可重复性。
实施例2
胚胎干细胞定向诱导分化为外胚层软骨祖细胞的分化途径验证
对实施例1获得的Hues9、Hues7、H9、H1和ihPSCs步骤(D)中各时间点转录组测序的数据进行分析,参考例如Chia-Lung Wu等人,Single cell transcriptomic analysis ofhuman pluripotent stem cell chondrogenesis,Nature Communications,Vol.13,No.12(1),2021年,分析内容如下:
(A)聚类分析外胚层关键标志物在诱导过程各细胞系的表达。
(B)聚类分析神经嵴关键标志物在诱导过程各细胞系的表达。
(C)GO富集分析比较差异基因在骨-软骨体系的富集情况。
(D)聚类分析软骨发育关键标志物在诱导过程各细胞系的表达。
检测结果如图2所示。由图2a可见,外胚层相关标志物FOXC1、FOXD1、TWIST1、SIX1、SIX2、ETS1、ZIC1、VIM和ZBTB17在诱导后的细胞中高表达;由图2b可见,神经嵴相关标志基因在诱导过程及诱导后的细胞中高表达;由图2c可见,骨-软骨发育途径,尤其是颅颌面骨发育在诱导后的细胞中得到富集;由图2d可见,软骨发育的关键基因在诱导过程及诱导后的细胞中高表达。
实施例3
鉴定诱导后细胞的自我更新能力
(A)克隆形成实验:取实施例1中的Hues9在CSSEDF诱导后对数生长的软骨祖细胞(ECC)胰酶消化成单细胞,细胞计数。根据计数结果加入培养基进行倍比稀释至1×10
(B)细胞免疫荧光染色:
(1)从4℃冰箱中取出细胞爬片,放在托板上回温,将标签(实验名称、抗体名称、二抗荧光素名称和日期)贴上,晾干。
(2)用光镜抗体稀释液稀释第一抗体,稀释度为1:200~2000,充分混匀后加在爬片上,每张爬片50~100μl,4℃孵育16~24小时。
(3)复温后吸弃一抗工作液(见表1),加100μl 0.01M PBS,5min后换一次PBS,共3次。注意换液时勿对着爬片冲洗。(以下步骤全程避光)
(4)用0.01M PBS稀释荧光二抗(见表1)。二抗为FITC或AlexFluo594标记的荧光抗体,抗体稀释度均为1:100。
(5)吸干指甲油及外周的水,加入荧光二抗,37℃孵育45min。
(6)吸弃一抗工作液,加100μl 0.01M PBS,5min换一次PBS,共3次。
(7)封片:刮去指甲油,用荧光封片剂封片,盖玻片四周刷指甲油固定。切片可当时观察,或放在-20℃保存。从-20℃冰箱中拿出切片后需置于暗处回温。
(C)流式细胞技术检测诱导后细胞不同代次间软骨关键标志物的表达情况:
(1)培养的细胞胰酶消化成单细胞,过滤BD的40um滤网。
(2)将单细胞悬液加入2mL圆底离心管中,离心,1500rpm,5min,弃上清液;用PBS1mL洗涤1次,离心;反复3次。
(3)加入用PBA稀释的荧光素标记的抗体200μl,用微量移液器轻轻吹打混匀,4℃或置冰上孵育30min~1h。离心弃上清液。加入冷PBS 1mL,离心洗涤2次,以除去未结合的多余抗体成分。
(4)向细胞中加入冷PBS 500μl,吹打混匀,置流式管中,4℃避光保存,待测。
(D)PCR检测诱导后不同代次细胞中软骨标志物的表达情况:提取Total RNA,将Total RNA反转录为cDNA,置PCR仪检测。
检测结果入图3所示。由图3a可见,诱导后的单细胞能形成克隆样生长;由图3b~3d可见诱导后的细胞表达外胚层标志物SIX1、NESTIN和ETS1;由图3e~3l可见,诱导后的细胞表达成软骨标志物SOX9、RUNX2、SOX5、TWIST1、CD29和颌面部发育关键标志物FOXC1、FOXC2和MSX1;由图3m可见,诱导后的早期代次和晚期代次细胞中,软骨关键标志物SOX5、SOX9、TWIST1、CD29和细胞增殖的关键标志物Ki67的阳性细胞率较为一致。图3n同样表面,在不同代次间软骨关键标志物的表达无显著差异。
实施例4
评价诱导后细胞的自分化能力
(A)将胶原包被的凝胶海绵用灭好菌的手术刀片切成1×1×0.5cm大小放于低粘附的6孔板,每孔可放2~3块;消化实施例1中Hues9在CSSEDF诱导后的软骨祖细胞(ECC)细胞成单细胞,计数,用CSSEDF培养基重悬成5×10
(B)培养8周后对支架材料上培养的支架材料进行固定、脱水、包埋、切片,进行HE染色、甲苯胺蓝、阿利新蓝、翻红O染色,免疫组织化学染色检测Col2、AGG、RUNX2、Col1和lubricin的表达情况。
免疫组织化学染色具体步骤如下:
(1)取切片(石蜡切片),脱蜡至水:二甲苯I(15min)→二甲苯II(15min)→100%酒精(5min)→100%酒精(3min)→90%酒精(3min)→80%酒精(3min)→70%酒精(3min)→蒸馏水(3min)。注:冬天将二甲苯放入温箱中,提高温度再使用。
(2)PBS浸洗3次,每次3min。
(3)微波修复:枸橼酸钠修复液微波炉中高火7~8min,冷却2min,在修复1~2min,自然冷却30min至室温。
(4)PBS浸洗3次,每次3min。
(5)3% H
(6)PBS浸洗2次,每次3min。
(7)10%山羊血清(A液)37℃封闭30min;
(8)甩去血清,加一抗(见表1)4℃孵育过夜或37℃孵育2h。
(9)若4℃孵育过夜则次日,37℃复温30min。
(10)PBS浸洗3次,每次3min。
(11)加生物素化二抗(B液)(见表1)37℃孵育30min。
(12)PBS浸洗3次,每次3min。
(13)加辣根酶标记的链霉卵白素工作液(C液)37℃孵育30min。
(14)PBS浸洗5次,每次5min。
(15)DAB液显色,镜下控制。
(16)蒸馏水充分浸洗终止反应。
(17)苏木素复染5min,流水冲洗15min。
(18)酒精脱水,二甲苯透明约40min。
(19)中性树胶封片,烘干,镜下观察。
检测结果如图4所示。由图a可见,诱导8周后的支架材料透亮、有光泽,并有一定的弹性;图4b的HE染色可见,支架材料内可见一个个集落样生长的软骨团;该软骨团甲苯胺蓝、阿利新蓝和翻红O染色呈强阳性(图4c~4e);免疫组织化学染色可见自发分化后的软骨团分泌Col2、AGG、RUNX2、Col1和lubricin(图4f~4k)。
实施例5
比较诱导后的软骨祖细胞、经典中胚层软骨祖细胞和人外胚层髁突软骨细胞的单细胞转录组表达异同
参考例如Chia-Lung Wu等人,Single cell transcriptomic analysis of humanpluripotent stemcell chondrogenesis,Nature Communications,Vol.13,No.12(1),2021年,具体步骤为:
(A)收集实施例1中Hues9在CSSEDF诱导后的软骨祖细胞(ECC)、人TMJ髁突软骨细胞(TMJ-CC)进行单细胞转录测序。
(B)将诱导后的软骨祖细胞(ECC)、人TMJ髁突软骨细胞(TMJ-CC)和文献中的经典中胚层软骨祖细胞(CP)进行比较。
结果如图5所示。由图5a可见,ECC和TMJ-CC均表达外胚层关键标志物,如col1a,BARX1,SIX1,MSX1,TWIST和FOXC1。由图5b可见,与CP比,ECC与TMJ-CC在转录组水平更为接近。由功能聚类分析可见(图5c),ECC和与TMJ-CC均可富集外胚层标志物。而CP则富集中胚层标志物。
实施例6
体内实验评价外胚层软骨祖细胞修复软骨缺损的效果。
(A)对外胚层软骨祖细胞标记GFP绿色荧光蛋白,并将带有GPF标签的蛋白植入sponge支架材料内。具体步骤为:
(1)Day 1,准备细胞:在24孔培养板接种若干孔处于实施例1中Hues9在CSSEDF诱导后对数生长期的软骨祖细胞(ECC)和平行对照293T细胞,铺板时细胞融合率为50%左右,每孔加入100μL培养基,培养箱中培养至细胞贴壁,进行病毒感染时细胞的最佳融合度为70%左右。
(2)Day 2,准备病毒:4℃保存的病毒,取出后轻轻用移液器混匀,-80℃冻存的病毒在冰上融化后使用。
接着感染目的细胞:吸去培养器皿中的旧培养基,用PBS清洗两次,更换新鲜培养基。使用移液器吸取准确体积的病毒液加入目的细胞和对照细胞中。将病毒液和培养基混匀,放于二氧化碳培养箱(37℃、5%CO
(3)Day 3(加入病毒液24小时后),弃去含病毒的培养液,换上新鲜完全培养液,继续在培箱中进行培养。
(4)Day 4(加入病毒48~72小时后),对于带GFP报告基因的病毒,可通过荧光显微镜观测GFP荧光强度,对于携带嘌呤霉素(Puromycin)抗性基因的病毒,换上含适当浓度Puromycin完全培养液(Puromycin标准终浓度范围为1~10μg/mL),筛选出稳定表达的细胞株。
(B)构建大鼠膝关节缺损模型,将载有外胚层软骨祖细胞的sponge支架材料置于膝关节软骨缺损内。8周后取出膝关节标本,进行组织学评价。
(C)体视镜直接观察GFP绿色荧光情况,组织学染色评价修复后的软骨组织,具体步骤为:
(1)切片取出37℃,晾干,PBS浸洗3次,每次3min;
(2)10%山羊血清封闭37℃,30min;
(3)弃去封闭液,滴加适当稀释度的两种浓缩一抗(见表1),放入4℃冰箱过夜或37℃,2h;
(4)若4℃冰箱过夜则第2天取出,37℃复温30min;
(5)PBS浸洗3次,每次3min;
(6)滴加适当稀释度的两种不同来源的荧光标记二抗(见表1),避光,室温下孵育2h;
(7)PBS洗3次,每次5min,避光;
(8)滴加适当稀释度的4',6-二脒基-2-苯基吲哚(DAPI)衬染,室温10min后弃去;
(9)PBS浸洗3次,每次5min;
(10)80%甘油封片,荧光显微镜下观察,拍照。
检测结果如图6所示。图6a示膝关节软骨缺损及修复模型;图6b~6c示体视镜下实验组修复的软骨组织可见绿色荧光,对照组未见绿色荧光;组织学可见(图6d~6e),实验组中修复的软骨组织可见绿色荧光,而对照组未见绿色荧光。由图6f~6k可见,实验组形成的软骨组织翻红O,Col2,Col1,Col10,RUNX2,lubricin和AGG染色呈阳性。
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本申请。任何熟悉此技术的人士皆可在不违背本申请的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本申请的权利要求所涵盖。
- 诱导人胚胎干细胞定向分化为肝样组织的培养基及诱导方法和应用
- 诱导人胚胎干细胞定向分化为肝样组织的培养基及诱导方法和应用
