羟脯氨酸修饰的重组III型人源化胶原蛋白及其制备方法和应用
文献发布时间:2023-06-19 19:23:34
技术领域
本发明属于基因工程技术领域,具体地涉及一种羟脯氨酸修饰的重组Ⅲ型人源化胶原蛋白及其制备方法和应用。
背景技术
胶原蛋白(Collagen)是人体的一种非常重要的蛋白质,主要存在于结缔组织中。是哺乳动物体内含量最多、分布最广的功能性蛋白,占蛋白质总量的25-30%。它具有很强的伸张能力,是韧带和肌键的主要成份,胶原蛋白还是细胞外基质的主要组成成分。胶原蛋白具有很好的生物相容性、生物降解性以及生物活性,被广泛的应用于医学材料及药物方面、美容化妆品、保健品以及各种实用工业中。Ⅲ型胶原蛋白较细小,由三条肽链向右卷曲扭成三股螺旋状,存在于表皮层和真皮层之间,称为婴儿胶原蛋白。微胶原层(CushionNetwork)主要由Ⅲ型胶原蛋白构成,是指位于表皮层与真皮层之间的组织结构,是撑起表皮的关键,也是肌肤塌陷的第一步。
胶原蛋白主要来源依旧为动物源胶原,如鱼等海产品以及牛、猪等牲畜加工副产物,通过酸、碱、酶等提取工艺来获取。使用这种传统方法制备的动物源胶原有一定的病毒隐患,且应用于人体时易引起异体异种的排异反应,限制了胶原蛋白的应用;此外动物胶原蛋白的功效具有不确定性。随着生物科技的发展,利用微生物作为底盘细胞实现胶原蛋白的表达生产,可很好地解决动物源胶原蛋白固有的不足。人源化重组技术可提高胶原蛋白的生物组织相容性,解决免疫原性问题;重组蛋白结构设计目的性更强,成分更明确,有效保证胶原蛋白的生物活性。因此,近年来关于重组胶原蛋白的研究和应用呈上升趋势。
胶原蛋白的结构相对复杂。在生物体中,胶原蛋白的合成和修饰从原胶原开始,原胶原是胶原蛋白的基本结构单位。原胶原肽链的一级结构具有(Gly-X-Y)n重复单位。原胶原经历了羟基化、糖基化、相互交联等诸多化学变化,受到了多种生物酶的复杂调控,最终形成胶原蛋白的三股螺旋结构。在重组胶原蛋白结构设计上存在几个问题:首先是对脯氨酸与赖氨酸的羟基化功能的缺失;其次,序列设计时并不是100%与人III型胶原蛋白序列一致,或者生产的序列破坏了胶原蛋白特征性的Gly-X-Y重复序列,三螺旋结构不稳定(缺少足够羟脯氨酸会导致三螺旋结构不稳定,易降解),这些都制约了重组胶原蛋白的进一步应用。
发明内容
(一)要解决的技术问题
鉴于现有技术的上述缺点、不足,本发明提供一种羟脯氨酸修饰的重组Ⅲ型人源化胶原蛋白,与人III型胶原蛋白具有100%相同序列的蛋白片段,同源性高,应用于人体无排异;该蛋白片段严格遵守Gly-X-Y重复序列,不存在突变导致的疾病风险,具有人体胶原蛋白的典型生物学功能和稳定的三螺旋结构。此外,该蛋白片段具有多个人III型胶原蛋白的重要功能位点,生物活性高。本发明还涉及重组Ⅲ型人源化胶原蛋白片段的制备方法和应用。
(二)技术方案
第一方面,本发明提供一种羟脯氨酸修饰的重组Ⅲ型人源化胶原蛋白片段,其为如下蛋白片段中的任一种:
蛋白片段a:其包含n个串联的如SEQ ID NO.1所示氨基酸序列的重复单体,n为整数且n≥1;其中,至少1个重复单体中的至少1个脯氨酸被羟脯氨酸替代;
蛋白片段b:与所述蛋白片段a具有83-97%同一性且保留所述蛋白片段a的细胞黏附性能的蛋白片段;
蛋白片段c:对所述蛋白片段a的氨基酸序列进行修饰后得到的保留所述蛋白片段a的细胞黏附性能的蛋白片段;所述修饰包括对蛋白片段的氨基酸序列添加、取代、缺失或插入1个或多个氨基酸残基;添加、插入和缺失不发生在重复单体中或重复单体之间;取代是指所述蛋白片段a的氨基酸序列上的部分氨基酸发生保守性替换。
其中,83-97%同一性的氨基酸序列包括与蛋白片段a的氨基酸序列具有83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%或97%序列同一性的氨基酸序列。
根据本发明的较佳实施例,所述蛋白片段a中,n=1~15,当n≥2时,各重复单体之间直接串联。
根据本发明的较佳实施例,所述蛋白片段a还包含至少一段如SEQ ID NO.2所示氨基酸序列;其与SEQ ID NO.1所示氨基酸序列的C端直接相连。
根据本发明的较佳实施例,所述蛋白片段a具有一段如SEQ ID NO.3所示的氨基酸序列。
第二方面,本发明还提供一种核酸分子,所述核酸分子包含编码所述重组Ⅲ型人源化胶原蛋白片段的核苷酸序列或其互补序列。
根据本发明的较佳实施例,所述核酸分子具有如SEQ ID NO.5所示的核苷酸序列。
第三方面,本发明还提供一种携带编码所述的重组Ⅲ型人源化胶原蛋白片段的多核苷酸或其互补序列的重组质粒、重组载体或重组细菌。优选地,所述重组细菌为大肠杆菌BL21。
第四方面,本发明还提供一种制备重组Ⅲ型人源化胶原蛋白片段的方法,包括:
(1)将编码重组Ⅲ型人源化胶原蛋白片段的基因与编码脯氨酸-4-羟化酶的基因共转入宿主细胞,将宿主细胞在培养基中培养使其产生蛋白;
其中,编码Ⅲ型人源化胶原蛋白片段的基因是通过对SEQ ID NO.3所示的氨基酸序列反向设计并根据宿主细胞的最适密码子进行优化得到;编码脯氨酸-4-羟化酶的基因是通过对SEQ ID NO.6所示的氨基酸序列反向设计并根据宿主细胞的最适密码子进行优化得到;
(2)收取并纯化所述蛋白(优选采用Ni柱纯化);
(3)酶切所述蛋白;
(4)纯化酶切后的蛋白(优选采用Ni柱纯化),获得目的蛋白片段。
步骤(1)中,所述宿主细胞为原核细胞、酵母或真核细胞,优选地,所述宿主细胞为大肠杆菌BL21(DE3)。
优选地,步骤(1)的方法为:
将SEQ ID NO.5所示的核苷酸序列通过KpnI和BamHI的酶切位点插入pET-32a表达载体,得到重组Ⅲ型人源化胶原蛋白片段的表达载体;
将SEQ ID No .7所示的核苷酸序列通过NcoI和XhoI的酶切位点插入pET-28a表达载体,得到脯氨酸-4-羟化酶L593的表达载体;
将构建成功的两种表达载体pET-32a和pET-28a共转入大肠杆菌感受态细胞BL21(DE3)。
上述pET-32a和pET-28a表达载体可用其他载体,如穿梭载体、噬菌体或病毒载体等替代。
优选地,在步骤(1)中,先通过在SEQ ID NO.6所示的氨基酸序列的N端增加SEQ IDNo .4所示肽链,然后反向设计并根据宿主细胞的最适密码子进行优化,将优化密码子转入宿主细胞;且在步骤(3)中使用Tev蛋白酶酶切宿主细胞产生的蛋白,纯化酶切后的蛋白获得目的蛋白片段。
所述宿主细胞采用发酵培养模式进行培养,培养至预定密度后,诱导宿主细胞表达蛋白,诱导方式为:降温至10-16℃并添加IPTG(异丙基-β-D-硫代半乳糖苷);优选的,所述IPTG的浓度为0.5mM-1M。
第五方面,本发明还涉及如上所述的重组Ⅲ型人源化胶原蛋白片段在制备具有促进细胞黏附作用的产品中的用途。
本发明提供如上所述的重组Ⅲ型人源化胶原蛋白片段在制备护肤品、皮肤修复敷料、植入剂、人工皮肤、医疗器械或保健食品中的应用。
(三)有益效果
(1)本发明提供一种羟脯氨酸修饰化的重组III型人源化胶原蛋白片段,具有与人III型胶原蛋白100%同一性序列的肽段,该肽段严格遵守Gly-X-Y重复序列模式,不存在突变导致的疾病风险,同源性高,制成植入剂无排异,生物相容性和安全性好。本发明提供的重组III型人源化胶原蛋白片段,其氨基酸序列进行了羟脯氨酸修饰,提高片段中羟脯氨酸的含量,更接近天然胶原蛋白,可保持稳定的三股螺旋结构,具有极强的锁水能力,细胞黏附活性高,黏附活性是商品化的人胎盘来源的Ⅲ型胶原蛋白的10倍左右。此外,所述重组人源化III型胶原蛋白片段具有多个人III型胶原蛋白的重要功能位点(与整合素α2β1的结合位点GRPGER、GLPGEN),生物活性高。当蛋白片段是由多个重复单体串联时则可以获得更多结合位点,蛋白片段将具有更高生物活性。
(2)本发明还提供了一种高表达羟脯氨酸修饰重组人源化III型胶原蛋白片段的宿主细胞系;通过反向设计编码脯氨酸-4-羟化酶的核苷酸序列,对该序列进行密码子优化得到SEQ ID No .7所示核苷酸序列,将其转入宿主细胞中,借以有效提高脯氨酸-4-羟化酶对人III型胶原蛋白片段的羟基化率;实验证明,本发明制备的重组人源化III型胶原蛋白片段的相对羟基化率达到40%左右。
在构建重组Ⅲ型人源化胶原蛋白片段的表达载体时,还在人III型胶原蛋白片段的C端增加SEQ ID No .2所示的端序列肽段,帮助胶原蛋白折叠成三股螺旋,以增加蛋白片段的稳定性提高表达量;在人III型胶原蛋白片段的N端增加SEQ ID No .4所示肽链,以便对蛋白产物进行纯化操作,提高目的蛋白产品的纯度。
(3)本发明制备人III型胶原蛋白片段的方法,通过在人III型胶原蛋白片段的N端增加SEQ ID No.4所示肽链,在C端增加SEQ ID No.2所示端序列肽段以得到长肽链,反向设计编码该长肽链的核酸序列并根据宿主物种的最适密码子和稀有密码子搭配的方法进行密码子优化,将优化密码子转入宿主细胞,以高效表达羟脯氨酸修饰的重组人源化III型胶原蛋白片段,制备的蛋白片段水溶性好,质量稳定,可广泛应用于护肤品、皮肤修复敷料、医学美容、保健食品等领域。
附图说明
图1为本发明实施例1制备的羟脯氨酸修饰化的重组III型人源化胶原蛋白片段的电泳图。
图2为阳性对照(1.0 μg/mL的HYP)、人胎盘Ⅲ型胶原蛋白(sigma,C4407)和实施例1的羟脯氨酸修饰化的重组III型人源化胶原蛋白片段的OD560nm(用于表征羟脯氨酸含量)。
图3为实施例1的羟脯氨酸修饰化的重组III型人源化胶原蛋白片段相对人胎盘Ⅲ型胶原蛋白的相对羟化率。
图4为实施例1的羟脯氨酸修饰化的重组III型人源化胶原蛋白片段与人胎盘I型胶原蛋白(sigma,C7774)的样本吸光度值(用于表征贴壁细胞数,即胶原蛋白活性);样本吸光度值=测试孔
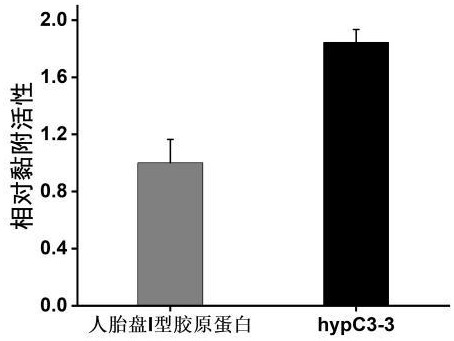
图5为实施例1的羟脯氨酸修饰化的重组III型人源化胶原蛋白片段相对人胎盘I型胶原蛋白的黏附活性。
具体实施方式
为了更好的解释本发明,以便于理解,下面结合附图,通过具体实施方式,对本发明作详细描述。
本发明提供一种羟脯氨酸修饰的重组Ⅲ型人源化胶原蛋白片段,其为如下蛋白片段中的任一种:
蛋白片段a:其包含n个串联的如SEQ ID NO.1所示氨基酸序列的重复单体,n为整数且n≥1;其中,至少1个重复单体中的至少1个脯氨酸被羟脯氨酸替代;
蛋白片段b:与所述蛋白片段a具有83-97%同一性且保留所述蛋白片段a的细胞黏附性能的蛋白片段;
蛋白片段c:对所述蛋白片段a的氨基酸序列进行修饰后得到的保留所述蛋白片段a的细胞黏附性能的蛋白片段;所述修饰包括对蛋白片段的氨基酸序列添加、取代、缺失或插入1个或多个氨基酸残基;添加、插入和缺失不发生在重复单体中或重复单体之间;取代是指所述蛋白片段a的氨基酸序列上的部分氨基酸发生保守性替换。
SEQ ID NO.1的氨基酸序列为:
GLAGYPGPAGPPGPPGPPGTSGHPGSPGSPGYQGPPGEPGQAGPSGPPGPPGAIGPSGPAGKDGESGRPGRPGERGLPGPPGIKGPAGIPGFPGMKGHRGFDGRNGEKGETGAPGLKGENGLPGENGAPGPMGPRGAPGERGRPGLPGAAGARGNDGARGSDGQPGPPGPPGTAGFPGSPGAKGEVGPAGSPGSNGAPGQRGEP。前述氨基酸序列为胶原蛋白片段的一个重复单体。
优选地,蛋白片段a中,n=1~15,当n≥2时,且各重复单体之间为直接串联。蛋白片段a中,除了n个如SEQ ID NO.1所示的氨基酸序列串联肽链外,在串联肽链的两端还可以连接其他氨基酸或肽链。
上文中,83-97%同一性的氨基酸序列是指与蛋白片段a的氨基酸序列具有83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%或97%的同一性。其中,蛋白片段b必须是在保留蛋白片段a相同/相当的细胞黏附性能的前提下具有与蛋白片段a的83-97%序列同一性。
序列同一性是指:相对于参考多肽序列的“氨基酸序列同一性百分数”定义为在将候选序列与参考多肽序列进行比对,并在必要时引入空位以获取最大百分比序列同一性,且不将任何保守置换视为序列同一性的一部分之后,候选序列中与参考多肽序列中的氨基酸残基相同的氨基酸残基的百分数。用于确定氨基酸序列同一性百分数的比对可以用本领域技术人员熟知的各种方式实现,例如,使用公众可获得的计算机软件,如BLAST、BLAST-2、ALIGN或Megalign(DNASTAR)软件。本领域技术人员可以确定用于比对序列的合适参数,包括在所比较的序列的全长上实现最大比对所需的任何算法。
上文中,添加是指在蛋白片段a的全长序列的C端或N端再连接1个或多个氨基酸。插入是指在蛋白片段a的氨基酸序列中的适当位置插入1个或多个氨基酸残基,插入的氨基酸残基可以全部或部分彼此相邻或不彼此相邻。缺失是指从蛋白片段a的氨基酸序列中删除1个或多个氨基酸。取代是指蛋白片段a的氨基酸序列中的部分氨基酸(1个或多个)被保守性替换。其中,添加、插入和缺失不发生在SEQ ID NO.1所示的重复单体中或重复单体之间。其中“多个”可以是2~11个。
蛋白片段c必须是在保留蛋白片段a相同/相当的细胞黏附性能的前提下发生的修饰。
蛋白片段b或c可以是在蛋白片段a的氨基酸序列中按下表进行氨基酸的保守性替换所得到的氨基酸序列。
上文中,多肽序列中的所有氨基酸可为L型氨基酸,其中的一个或多个(如2-5个、2-4个或2-3个)氨基酸也可以用构象为D型的氨基酸、人工修饰的氨基酸、自然界存在的稀有氨基酸等进行替换,以提高多肽的生物利用度、稳定性和/或抗病毒活性。其中D型氨基酸是指与组成蛋白质的L型氨基酸相对应的氨基酸;人工修饰的氨基酸指经过甲基化、磷酸化等修饰的组成蛋白质的常见L型氨基酸;自然界存在的稀有氨基酸包括组成蛋白质的不常见氨基酸和不组成蛋白质的氨基酸,例如羟脯氨酸、5-羟基赖氨酸、甲基组氨酸、γ氨基丁酸、高丝氨酸等。
在本发明中,重组Ⅲ型人源化胶原蛋白片段可以通过如下方法制备:(1)构建大肠杆菌基因工程菌;(2)大肠杆菌基因工程菌的发酵培养;(3)蛋白的诱导和表达;(4)蛋白的纯化和酶切。在步骤(1)中,大肠杆菌基因工程菌的构建通过如下步骤进行:将包含重组Ⅲ型人源化胶原蛋白片段的多核苷酸的表达载体以及包含脯氨酸-4-羟化酶的多核苷酸的表达载体共转入大肠杆菌感受态细胞BL21(DE3)中,筛选得到阳性大肠杆菌基因工程菌。
为了使产生的蛋白片段更加稳定,在蛋白片段的末端(C端)还连接一段如SEQ IDNO.2所示的端序列肽段(GAPGPCCGG);其与SEQ ID NO.1所示氨基酸序列的C端直接相连。该端序列肽段可帮助胶原蛋白折叠成三股螺旋结构,使产生的蛋白片段更加稳定。将1个SEQID NO.1所示氨基酸序列的C端与如SEQ ID NO.2所示氨基酸序列(GAPGPCCGG)相连接,即得到如SEQ ID NO.3所示的氨基酸序列:
GLAGYPGPAGPPGPPGPPGTSGHPGSPGSPGYQGPPGEPGQAGPSGPPGPPGAIGPSGPAGKDGESGRPGRPGERGLPGPPGIKGPAGIPGFPGMKGHRGFDGRNGEKGETGAPGLKGENGLPGENGAPGPMGPRGAPGERGRPGLPGAAGARGNDGARGSDGQPGPPGPPGTAGFPGSPGAKGEVGPAGSPGSNGAPGQRGEPGAPGPCCGG。
为了便于对产生的蛋白片段进行纯化操作,在设计编码重组Ⅲ型人源化胶原蛋白片段的多核苷酸时,在SEQ ID NO.3所示的氨基酸序列的N端连接如SEQ ID No.4所示的氨基酸序列以形成TEV酶切位点(SEQ ID No.4:ENLYFQ),最终连成全长为219aa的氨基酸序列,记作为SEQ ID NO.8,具体为:ENLYFQGLAGYPGPAGPPGPPGPPGTSGHPGSPGSPGYQGPPGEPGQAGPSGPPGPPGAIGPSGPAGKDGESGRPGRPGERGLPGPPGIKGPAGIPGFPGMKGHRGFDGRNGEKGETGAPGLKGENGLPGENGAPGPMGPRGAPGERGRPGLPGAAGARGNDGARGSDGQPGPPGPPGTAGFPGSPGAKGEVGPAGSPGSNGAPGQRGEPGAPGPCCGG。
然后根据SEQ ID NO.8进行反向设计并根据宿主细胞的最适密码子进行优化,得到SEQ ID No.5所示的全长为663bp的核苷酸序列,最后将SEQ ID No.5所示的核苷酸序列作为编码重组Ⅲ型人源化胶原蛋白片段的多核苷酸进行质粒构建,以便转入大肠杆菌。SEQID No.5所示的核苷酸序列为:GAAAATTTATATTTTCAAGGACTAGCTGGTTACCCGGGTCCGGCAGGCCCCCCGGGTCCGCCAGGACCGCCGGGCACCAGCGGCCACCCGGGCTCCCCGGGTTCGCCGGGTTATCAGGGTCCGCCGGGCGAACCGGGCCAGGCAGGTCCTAGCGGTCCGCCGGGCCCACCGGGCGCGATTGGTCCGAGCGGTCCGGCTGGTAAAGATGGGGAGAGCGGTCGCCCAGGCAGACCTGGCGAGCGTGGCTTGCCTGGACCGCCGGGCATCAAGGGCCCGGCGGGTATCCCGGGTTTTCCGGGCATGAAGGGTCATCGTGGCTTCGACGGCCGCAATGGTGAAAAAGGCGAAACCGGTGCGCCAGGTCTGAAGGGTGAAAACGGCCTGCCGGGCGAGAACGGTGCTCCGGGCCCGATGGGTCCGCGTGGTGCTCCGGGTGAGCGCGGTCGTCCGGGCCTGCCGGGCGCGGCAGGCGCGCGTGGAAACGACGGCGCCCGTGGTTCTGATGGTCAACCGGGTCCGCCGGGTCCGCCGGGTACGGCCGGTTTCCCGGGCTCCCCGGGCGCGAAAGGTGAAGTTGGTCCGGCGGGTAGCCCGGGTTCAAATGGTGCGCCAGGCCAACGTGGTGAGCCGGGCGCCCCGGGCCCTTGTTGCGGTGGTTAA。其末端包括一个终止密码子TAA,该终止密码子也可替换成TAG或TGA。
本发明的实施例中,使用的脯氨酸-4-羟化酶的氨基酸序列是如SEQ ID No.6所示的氨基酸序列,为了提高蛋白产品中羟脯氨酸的含量,在设计编码脯氨酸-4-羟化酶的多核苷酸时,通过对SEQ ID No.6所示的氨基酸序列进行反向编译,并结合大肠杆菌的最适密码子和稀有密码子相搭配的方式进行密码子优化,得到如SEQ ID No.7所示的核苷酸序列,以该核苷酸序列为编码脯氨酸-4-羟化酶的基因,构建质粒,以便转入大肠杆菌中得到大肠杆菌基因工程菌。
SEQ ID No.6的氨基酸序列为:MKTVTIITIIVVIIVVILIIMVLSKSCVSHFRNVGSLNSRDVNLKDDFSYANIDDPYNKPFVLNNLINPTKCQEIMQFANGKLFDSQVLSGTDKNIRNSQQMWISKNNPMVKPIFENICRQFNVPFDNAEDLQVVRYLPNQYYNEHHDSCCDSSKQCSEFIERGGQRILTVLIYLNNEFSDGHTYFPNLNQKFKPKTGDALVFYPLANNSNKCHPYSLHAGMPVTSGEKWIANLWFRERKFS。
SEQ ID No.7的核苷酸序列为(共729bp):
ATGAAAACTGTAACAATAATCACGATAATTGTCGTCATTATCGTGGTGATCCTGATCATCATGGTTTTGTCCAAGAGCTGCGTTAGCCATTTTCGCAATGTGGGCAGCCTGAATAGCCGTGATGTTAATCTCAAGGACGACTTCTCCTATGCTAACATTGATGACCCGTATAACAAGCCATTTGTTTTGAACAACCTGATTAATCCAACCAAATGCCAAGAGATCATGCAGTTCGCCAACGGCAAACTGTTTGACTCCCAAGTGCTTTCCGGTACTGACAAAAACATCCGTAACTCGCAACAAATGTGGATCAGCAAGAACAACCCGATGGTCAAACCGATTTTTGAAAATATCTGCCGTCAGTTCAACGTGCCGTTCGACAACGCGGAAGATCTGCAGGTTGTGCGTTATCTGCCGAATCAATACTACAATGAGCACCACGATTCTTGTTGTGATTCGAGCAAGCAGTGCAGCGAATTTATTGAACGTGGCGGTCAGCGTATTTTGACCGTTCTAATCTATCTGAACAACGAGTTCTCAGATGGTCACACGTACTTCCCGAACTTGAATCAGAAATTTAAACCGAAAACCGGTGACGCGCTGGTGTTTTACCCGTTAGCAAATAACTCTAACAAGTGCCATCCGTACAGCCTGCATGCGGGCATGCCGGTTACCAGCGGTGAGAAATGGATTGCGAACCTGTGGTTCCGCGAGCGCAAGTTCTCTTAA。其末端包括一个终止密码子TAA,该终止密码子也可替换成TAG或TGA。
在上述步骤(2)与(3)中,大肠杆菌基因工程菌的发酵培养和蛋白的诱导和表达可以通过如下步骤进行:a.挑取优选后的大肠杆菌基因工程菌单菌落,置于含有氨苄抗生素和卡那抗生素的LB液体培养基中,在适宜条件下过夜培养后再转移至含有氨苄抗生素和卡那抗生素的LB液体培养基中培养,至OD值升高至对数生长期时,降温至10-16℃;b.加入终浓度为0.5mM-1M IPTG进行诱导,培养16-20h后离心收集菌体。
在上述步骤(4)中,蛋白的纯化和酶切可以通过如下步骤进行:a.用缓冲液重悬细菌,然后进行菌体破碎,破碎后在1-4℃条件下高速离心,收集上清液;b.利用Ni亲和柱结合蛋白,而后先用缓冲液清洗Ni柱,再用含有低浓度咪唑的洗涤缓冲溶液漂洗杂蛋白,再用含有高浓度咪唑的洗脱缓冲液洗脱目的蛋白;c.在洗脱的蛋白样品中加入Tev蛋白酶,1-4℃过夜透析酶切;d.将过夜酶切的溶液脱盐后结合Ni亲和柱,收集流穿溶液,浓缩后得到目的蛋白。
在本发明中,宿主细胞可以是原核细胞,真核细胞,例如真菌和酵母,应当理解,本领域技术人员可以通过用其它表达菌株替换上述大肠杆菌菌株作为宿主细胞。
在本发明中,合适的载体是载体构建领域已知的,包括启动子的选择和其他调控元件,例如增强子元件。本发明所述的载体包括适合引入细胞的序列。例如,载体可以是表达载体,在该载体中,所述蛋白的编码序列受到它自身顺式作用调控元件的控制,载体的设计便于宿主细胞的基因整合或基因替换等。本领域普通技术人员应理解,在本发明中,“载体”包括DNA分子,例如,质粒、噬菌体、病毒或其他载体,它含有一个或多个异源的或重组的核苷酸序列。合适的噬菌体和病毒载体包括,但不限于:λ-噬菌体、EMBL噬菌体、猿猴病毒、牛疣病毒、Epstein-Barr病毒、腺病毒、疱疹病毒、小鼠肉瘤病毒、鼠类乳癌病毒、慢病毒等。
以下为本发明的较佳实施例。
实施例1
本实施例为羟脯氨酸修饰化的重组III型人源化胶原蛋白片段的制备方法,包括如下步骤:
(1)构建包含重组III型人源化胶原蛋白片段的多核苷酸的表达载体:根据SEQ IDNo .5的核苷酸序列,委托南京金斯瑞生物科技有限公司进行基因片段的合成,并将合成后的基因片段通过KpnI和BamHI的酶切位点插入pET-32a表达载体,得到重组表达质粒。
(2)构建包含脯氨酸-4-羟化酶L593的多核苷酸的表达载体:根据SEQ ID No .7的核苷酸序列,委托南京金斯瑞生物科技有限公司进行基因片段的合成,并将合成后的基因片段通过NcoI和XhoI的酶切位点插入pET-28a表达载体,得到重组表达质粒。
(3)构建大肠杆菌基因工程菌:将构建成功的两种表达质粒pET-32a、pET-28a共转入大肠杆菌感受态细胞BL21(DE3)。
具体过程为:(1)在-80℃冰箱中取出大肠杆菌感受态细胞BL21(DE3)置于冰上,待半融时于超净台各取1μL两种表达质粒加入大肠杆菌感受态细胞BL21(DE3)中 ;(2)将混合物置于冰上冰浴5min,然后于42℃水浴热激60s,取出后置于冰上冰浴5min;(3)于超净台中加入500μL液体LB培养基(10g/L蛋白胨,5g/L酵母提取物,10g/L氯化钠,100μg/ml氨苄抗生素,50μg/ml卡那抗生素),放于37℃、220rpm条件下复苏60min;(4)取200μL的复苏菌液均匀涂布在含有氨苄抗生素和卡那抗生素的LB平板上;(5)将平板放在37℃的培养箱过夜培养,待其长出大小均匀的菌落。
(4)诱导大肠杆菌基因工程菌表达羟脯氨酸修饰化的重组III型人源化胶原蛋白片段:具体过程为:挑取板上的菌落至10ml LB液体培养基(100μg/ml氨苄抗生素,50μg/ml卡那抗生素),放于37℃摇床中,220rpm培养12h左右接至1L培养基中,37℃,220rpm培养至OD
(5)蛋白的纯化,具体过程为:将菌液分装于离心瓶中,于4000rpm、4℃离心20min,收集菌体。将收集的菌体用结合缓冲液(Binding buffer)(150mM NaCl,20ml HEPES NaOHpH7.4)重悬,然后进行超声破碎,将细胞破碎后的菌液分装至离心瓶中,于16000rpm、4℃离心30min,收集上清液。
将上清加入到1mL Ni亲和树脂重力柱中,流穿结束后加入8倍柱体积的结合缓冲液清洗Ni柱;而后加入8倍柱体积的洗涤缓冲液(washing buffer)(150mM NaCl,20mlHEPES NaOH pH7.4,20mM咪唑)洗涤Ni柱;最后用8倍柱体积的洗脱缓冲液(elutionbuffer) (150mM NaCl,20ml HEPES NaOH pH7.4,300mM咪唑)洗脱目的蛋白。
向洗脱的目的蛋白中加入200ul Tev酶,4℃过夜透析酶切。将酶切后的上清溶液加入到1ml Ni 亲和树脂重力柱中,流穿三遍后,即得到目的蛋白片段(记作蛋白hypC3-3),该目的蛋白片段为如SEQ ID No.3所示的氨基酸序列并且其中部分脯氨酸被羟化成羟脯氨酸。
实施例2
对实施例1制备的重组III型人源化胶原蛋白片段进行生物学评价,包括如下几个方面的评价:
(1)检测羟脯氨酸修饰化的重组III型人源化胶原蛋白hypC3-3:
利用SDS-PAGE对蛋白片段hypC3-3进行检测和确认。具体过程为:取纯化后的蛋白液20μL,加入5μl 5×的蛋白上样缓冲液(250mM的Tris-HCl pH 6.8,10%SDS,0.5%溴酚蓝,50%甘油,5%β-巯基乙醇),置于100℃沸水中煮5min,然后每孔10μl加入SDS-PAGE蛋白胶中,电压250V电泳0.5h后,用考马斯亮蓝染色液(0 .1%考马斯亮蓝R-250,25%乙醇,10%冰醋酸)进行蛋白染色3min,再利用蛋白脱色液(10%醋酸,5%乙醇)进行脱色。结果如图1所示。检测结果说明,本发明构建的宿主细胞系确实可获得重组III型人源化胶原蛋白片段。
(2)检测重组III型人源化胶原蛋白hypC3-3的脯氨酸羟化率
用HYP检测试剂盒(Solarbio,BC0250)检测OD560nm的吸光度,包括阳性对照(1.0μg/ml的HYP)、人胎盘Ⅲ型胶原蛋白(sigma,C4407)以及样本hypC3-3。按照HYP检测试剂盒说明处理样本,根据空白对照和阳性对照结果确认实验的可行性。以人胎盘Ⅲ型胶原蛋白羟脯氨酸含量为100%,计算出蛋白hypC3-3脯氨酸的相对羟化率。
如图2、图3的羟脯氨酸含量的检测结果显示,蛋白hypC3-3中羟脯氨酸含量为人胎盘Ⅲ型胶原蛋白中羟脯氨酸含量的58%左右,即蛋白hypC3-3中脯氨酸的相对羟化率达到约58%。
(3)对重组III型人源化胶原蛋白hypC3-3的生物活性测定
测定蛋白溶液的浓度。将蛋白hypC3-3样品稀释50倍,利用NanoDrop分别测定样品在215nm和225nm下的紫外光吸收。利用经验公式C(μg/m L)=144×(A215-A225) ×50计算蛋白质浓度,注意需在A215<1.5的情况下检测。检测完蛋白浓度后,用缓冲液(150mM NaCl,20mM HEPES NaOH pH7.4)将所有待测蛋白浓度调整到0.5mg/mL。
设置空白孔、PBS孔、对照孔即人胎盘I型胶原蛋白(sigma,C7774)、胶原蛋白样本孔。向96孔板中加入100 μL PBS、人胎盘I型胶原蛋白、hypC3-3胶原蛋白溶液,室温静置60min。向每孔中加入100 μL浓度为1×10
根据空白对照的数值,计算出每孔相对应的吸光度,计算出的吸光度值与贴壁的细胞数成正比。计算公式如下:样本吸光度值=测试孔
最终,蛋白hypC3-3的样本吸光度结果如图4所示;换算成相对黏附活性如图5所示,本发明制备的胶原蛋白hypC3-3的黏附活性是商品化的人胎盘来源的I型胶原蛋白的1.84倍,表现出的生物活性也更高。
因此,本发明提供的重组Ⅲ型人源化胶原蛋白片段可用于制备促进细胞黏附作用的产品中,如细胞贴壁黏附剂(可替代多聚赖氨酸),也可用于制备护肤品、皮肤修复敷料、植入剂、人工皮肤、医疗器械或保健食品等。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
