一种能够特异性抑制Mre11 K673乳酸化的多肽及其用途
文献发布时间:2024-04-18 19:58:53
技术领域
本发明属于生物医药领域,涉及一种多肽及其用途,具体来说是一种能够特异性抑制Mre11 K673乳酸化的多肽及其用途。
背景技术
温伯格效应(The Warburg effect),也称为有氧糖酵解,是大多数癌症的代谢特征,是指即使在癌细胞中存在氧气的情况下,也会产生大量乳酸的过程。这个中间代谢产物——乳酸,是由癌细胞中乳酸脱氢酶(LDH)催化的丙酮酸产生的,已被报道在在多种细胞过程中发挥关键作用,包括促进肿瘤细胞作为能量来源的增殖、肿瘤细胞转移扩散和免疫抑制。然而,它在癌细胞中的非代谢功能在很大程度上仍然未知。最近,芝加哥大学赵英明教授团队发现,乳酸是组蛋白乳酸化的主要来源,除了其代谢功能外,乳酸还诱导一种迄今未知的翻译后修饰(PTM),称为乳酸化。他们发现乳酸诱导组蛋白赖氨酸残基的乳酸化进而调控基因转录表达。研究表明,乳酸能促进化疗耐药性。然而,这种表型的确切机制仍有待探索。
维持基因组完整性对于确保遗传物质忠实复制和可靠传播至关重要。内源性和外源性因素引起的DNA损伤和DNA复制错误是基因组不稳定性的主要诱因。其中,DNA双链断裂(DSBs)是危害最大的DNA损伤形式,对基因组的不稳定性构成极大威胁。DSB修复缺陷涉及多种疾病,包括衰老、癌症、神经紊乱、生长迟缓和免疫缺陷。
在目前的模型中,有两条主要途径负责修复DSBs,包括非同源末端连接(NHEJ)和同源重组(HR)。与HR相比,NHEJ速度快得多,但容易出错,它将断裂的末端直接结合在一起,这种修复方式可能引入大量突变。与NHEJ(发生在整个细胞周期中)不同,HR严格发生在S和G2期,因为修复需要同源模板。因此,HR是修复DSB的无错误机制。HR的重要步骤之一是末端切除受损的DNA,以产生合适的单链DNA。在哺乳动物中,末端切除由Mre11/RAD50/NBS1(MRN)复合物启动,然后由磷酸化形式的CtIP(CTBP-interacting protein,C端结合蛋白相互作用蛋白,是一种由DSB激活的DNA核酸内切酶)促进。MRN复合物是一种DSBs传感器和多功能复合物,在DNA双链断裂的传感、处理和修复中起着关键作用。
HR是最重要的DNA损伤修复类型之一,无错误,在保持基因组稳定性和抑制肿瘤发生方面发挥着关键作用。另一方面,癌症中HR的高激活与化疗耐药性有关。MRN复合物的核心成分Mre11负责DNA结合和切割DNA。DSBs发生后,Mre11被招募到损伤部位开始DNA末端切除。接下来,核酸外切酶EXO1/DNA 2被进一步募集到DNA损伤部位,然后介导广泛切除,这是HR修复的关键过程。因此,Mre11向DNA的募集是Mre11介导的DNA切除和HR修复启动的关键步骤。
Mre11的失调会导致免疫缺陷、辐射敏感性、细胞周期检查点缺陷和癌症发展的易感性增加。因此,Mre11的精确调控对于保护基因组稳定性和细胞活力至关重要。Mre11的翻译后修饰在调节其功能中起着重要作用。UBQLN4介导的Mre11泛素化导致其降解,进而影响DSBs修复途径的选择。UFL1对K282上Mre11的UFMylation对于最佳ATM激活、同源重组介导的DSB修复和基因组完整性至关重要。PLK1介导的Mre11磷酸化降低其与DNA结合的能力,从而抑制HR修复。PRMT1在其GAR结构域对Mre11的精氨酸甲基化调节其外切酶活性。此外,C1QBP促进Mre11的稳定性,但通过与Mre11相互作用阻止其DNA结合来抑制其外切酶活性。DYLL1和Nej1(XLF的酵母同源物)也被报道与Mre11直接结合,然后抑制Mre11切除。目前的模型表明Mre11以RAD50依赖和独立的方式与DNA结合。然而,Mre11在DNA损伤时向DNA募集的调控和机制在很大程度上仍然未知。
Mre11是MRN复合物的核心成分,具有核酸内切酶和3'-5'核酸外切酶活性。Mre11含有两个DNA结合域(DBD),使其能够结合单链DNA(ssDNA)或双链DNA(dsDNA)。当发生DNA双链损伤断裂后,Mre11立即被招募到DSBs位点,并通过与CtIP合作启动DNA末端切除来切割损伤的DNA。随后,通过外切酶EXO1和DNA2完成了长距离的DNA切除。同时,产生的ssDNA被复制蛋白A(RPA)快速包裹和保护,然后被RAD51重组酶取代,这对寻找同源模版和后续的HR过程至关重要。越来越多的发明表明,HR的过度激活是癌症化疗耐药性的主要原因。代谢异常是癌细胞最显著的特征之一。癌症细胞中最著名的代谢改变是温伯格效应,其定义是即使在氧气充足的情况下,糖酵解也显著增加。然而,尚不清楚HR是否受到温伯格效应的影响。
发明内容
本发明的目的在于提供一种能够特异性抑制Mre11 K673乳酸化的细胞穿透肽及其用途,所述的这种能够特异性抑制Mre11 K673乳酸化的多肽及其用途要解决现有技术中的药物对于代谢异常导致的癌症的治疗效果不佳的技术问题。
本发明提供了一种分离的多肽,任一选自如下的多肽:
(1)含有如SEQ ID NO:3所示的氨基酸序列的多肽;
(2)含有SEQ ID NO:3所示的氨基酸序列中至少含有SSTSSSKIMSQSQ的片段。
优选的,上述分离的多肽,其氨基酸序列如SEQ ID NO.3所示(HLYVSPWGGSSTSSSKIMSQSQ)。
本发明还提供了一种分离的多核苷酸其序列选自:
(1)上述分离的多肽的编码序列;或者
(2)(1)所述编码序列的互补序列。
本发明还提供了一种表达载体,其含有上述多核苷酸。
术语“表达载体”指本领域熟知的细菌质粒、噬菌体、酵母质粒、植物细胞病毒、哺乳动物细胞病毒或其他载体。总之,只要能在宿主体内复制和稳定,任何质粒和载体都可以用。表达载体的一个重要特征是通常含有复制起点、启动子、标记基因和翻译控制元件。其可以用于转化适当的宿主细胞,以使其能够表达多肽。
本发明还提供了一种药物组合物,其包含上述多肽和药学上或生理学上可接受的载体。
本发明还提供了上述分离的多肽、分离的多核苷酸、表达载体在制备用于特异性抑制Mre11 K673乳酸化的药物中的用途。本发明还提供了上述分离的多肽、分离的多核苷酸、表达载体在如下任一种中的应用:
1)制备提高癌细胞对化疗药物敏感性的药物;
2)制备增强化疗药物治疗效果的药物。
进一步的,所述的化疗药物为能够诱导DNA发生双链断裂损伤的化疗药物。
进一步的,所述的化疗药物为铂类或者PARP抑制剂类化疗药物。
进一步的,所述的癌细胞为结直肠癌细胞、乳腺癌细胞或者卵巢癌细胞。
本发明还提供了乳酸化修饰的Mre11 K673在筛选用于治疗癌症的药物中的用途,所述的筛选步骤如图5A-5B。
本发明还提供了第一种成分与第二种成分一同在制备用于治疗癌症疾病的药物中的应用,其中所述的第一种成分由上述药物组合物组成,且其中所述的第二种成分由化疗药物组成。
进一步的,所述的化疗药物为能够诱导DNA发生双链断裂损伤的化疗药物。
进一步的,所述的化疗药物为铂类或者PARP抑制剂类化疗药物。进一步的,所述的癌症疾病为结直肠癌、乳腺癌或者卵巢癌。
在本发明中,Mre11能被CBP(CREB-binding protein,是一种乙酰转移酶)催化而发生乳酸化修饰。DNA损伤后,Mre11和CBP之间的相互作用增加,Mre11乳酸化增加。此外,Mre11在其第二个DNA结合域K673处被乳酸化。有趣的是,我们的发现表明Mre11的乳酸化增强了其DNA结合能力,然后促进了末端切除和HR修复。Mre11的高乳酸化化导致HR修复和化学抗性的高效力。因此,将抑制Mre11乳酸化的CBP抑制剂(CBPi)或LDH抑制剂(LDHi)与化疗联合使用可显著减弱HR修复并增加癌症杀伤效果。此外,我们在体内使用高乳酸化结肠癌PDX模型进行了癌症杀伤试验,结果表明抑制Mre11 K673乳酸化显著增强了PARPi介导的结肠癌杀伤作用。
乳酸化是一种能被乳酸或乳酸钠诱导新型翻译后修饰。Mre11蛋白对同源重组修复(HR)以及维持基因组稳定性具有十分关键的作用。我们的发明发现,Mre11在DNA损伤后,第673位赖氨酸能发生乳酸化修饰且这个过程是由CBP乙酰转移酶催化的。Mre11的乳酸化修饰促进其与DNA的结合,从而促进DNA末端切除和同源重组修复(HR)。抑制CBP或LDH能够下调Mre11乳酸化导致抑制HR,并增强结直肠癌患者来源的异种移植物(PDX)模型对化疗的敏感性。
本发明证明了乳酸化调节HR。从机理上讲,Mre11在DNA损伤后被乳酸化。CBP在位于其第二个DNA结合域(DBD)的K673处催化Mre11发生乳酸化修饰。Mre11的乳酸化在调节Mre11与DNA结合和DNA末端切除中发挥关键作用。Mre11的高乳酸化促进癌细胞的HR和化疗耐药性。
本发明揭示乳酸化Mre11是一个新的HR修复调控蛋白,他们将癌症代谢与DSBs修复联系起来。考虑到温伯格效应在大多数肿瘤中产生大量乳酸,蛋白质乳酸化可能会增强癌症的HR修复,并导致化疗耐药性。同时,DNA损伤也通过激活CBP增强Mre11乳酸化。内部因素(温伯格效应产生的乳酸)和外部因素(化疗诱导的高乳酸化-Mre11)可能会在肿瘤发展和治疗过程中过度激活HR,从而导致化疗耐受。
本发明和已有技术相比,其技术进步是显著的。我们的发现表明Mre11的乳酸化促进HR,靶向Mre11乳酸化可能是克服癌症化疗耐药性的有效策略。本发明通过设计和筛选获得一种能够特异性抑制Mre11乳酸化的细胞穿透肽(CPP),该肽可抑制DNA末端切除并和DNA损伤修复。该肽对Mre11 K673乳酸化具有明显的抑制作用,并抑制HR,进而提高了癌细胞对化疗的敏感性。本发明的多肽能够显著抑制HR,进而促进癌细胞对顺铂和PARP抑制剂(PARPi)的敏感性。该多肽和化疗药物(顺铂或奥拉帕利)的组合在体外和体内显著促进了化疗介导的癌细胞杀伤效果。靶向Mre11乳酸化具有潜在治疗策略。本发明还发现HR通路中关键蛋白能够发生乳酸化修饰,并将癌症代谢与DSB修复联系起来。
附图说明
图1显示了CBP介导Mre11 K673发生乳酸化修饰。
图2显示了Mre11乳酸化修饰促进其与DNA的结合和招募到DNA损伤位点上。
图3显示了Mre11乳酸化修饰促进DNA末端切割和同源重组修复。
图4显示了高Mre11乳酸化修饰促进化疗耐受。
图5显示了通过短肽特异性靶向Mre11乳酸化修饰联合化疗药物显著提高对肿瘤的杀伤效果。
具体实施方式
本发明的实验材料和实验过程如下描述:
细胞培养、质粒、试剂和抗体
HEK293T、U2OS、卵巢癌细胞系OV-car8、乳腺癌细胞系MBA-MD-231和结肠癌细胞系HCT116和RKO购自ATCC。除非另有说明,细胞在添加10%胎牛血清(FBS)的DMEM中培养,温度为37℃,浓度为5%(v/v)CO
l-乳酸钠(71718)、LDHi(O2751)、嘌呤霉素、顺铂(P4394)、5-溴-2′-脱氧尿苷(BRDU)、ATM抑制剂KU55933和依托泊苷(E1383)购自Sigma-Aldrich。CBP抑制剂(SGC-CBP30)购自Selleckchem。Olaparib和MCT1/4抑制剂(Syrosingopine,Su-3118)购自Selleckchem。
本发明中使用了以下抗体:抗GAPDH(Proteintech,60004-1-lg),抗β-actin(Proteintech,66009-1-Ig),抗γH2AX(EMD Millipore:2884537,1:1000),抗Flag(Sigma:F1804,1:2000),抗HA(Cell Signaling Technology:no.3724,1:2000),抗RPA32(Santacruz:sc-56770,1:1000),抗RAD51(GENETEX:GTX100469,1:1000),抗BRDU(BD:347580,1:100),抗Mre11(GENETEX:GTX70212,1:1000),抗RAD50(GENETEX:GTX70228 1:1000),抗NBS1(Novus:NB100-143,1:1000),抗pan-Kla(PTM Biolab:PTM-1401RM,1:1000),抗LDHA(CellSignaling Technology:no.2012S,1:1000),抗LDHB(Millipore Sigma:ABC927,1:1000),抗H3(Proteintech,no.17168-1-AP,1:2000)和抗Mre11-K673la(1:1000)通过PTM Biolab公司生产。
DNA转染、病毒包装与慢病毒感染
用聚醚酰亚胺(PEI)或Lipofectamine 2000(Thermo Fisher Scientific)转染细胞。在慢病毒载体和包装质粒(pMD2G和pSPAX2)共转染后,收集病毒上清液两次(24小时和48小时)。将收获的慢病毒添加到细胞中,用8μg ml/l聚胺进行进一步实验,以提高感染效率。用含有2μg/mL嘌呤霉素的培养基选择稳定的细胞。免疫印迹法检测稳定细胞。
HR报告分析
采用DR-GFP和EJ5-GFP报告系统检查DSB修复效率。简言之,将稳定表达所述shRNA的HEK293T细胞或正常HEK293T细胞接种到六个孔板中,一式三份。24小时后,用含有3l聚醚酰亚胺(PEI)、500ng DR-GFP(或500ng EJ5-GFP)、100ng mCherry和500ng I-SceI质粒的复合物转染每个孔中的细胞。转染后24小时,用指定的试剂处理细胞。转染后48小时,收集细胞并通过流式细胞仪分析(FACS)进行分析,通过RFP阳性细胞或RFP/GFP两种阳性细胞进行分选。修复效率的比率按照前面所述进行计算。
免疫荧光
在处理前24小时,将细胞接种到带有盖玻片的六孔板中。对于RRA32病灶染色,将细胞在-20℃下用甲醇:丙酮(1:1)固定20分钟。使用PBS洗涤细胞两次,并在室温下用4%PFA再次固定15分钟。对于RAD51染色,细胞在冰上用预提取缓冲液(20mM HEPES,pH 7.4,20mM NaCl,5mM MgCl2,0.5%NP-40,1mM DTT和蛋白酶抑制剂混合物)预提取10分钟,然后用4%PFA固定10分钟。染色前,在室温下用2%山羊血清阻断细胞1h。然后,在4℃下用一级抗体孵育细胞过夜。用PBS洗涤3次后,将细胞与二级抗体在室温下孵育1h。用PBS洗涤3次后,将细胞与DAPI在室温下孵育约2分钟。洗涤后,用抗褪色溶液固定细胞,并使用Nikoneclipse80i荧光显微镜观察。
BRDU染色的末端切除检测
将接种在盖玻片上的U2OS细胞与20μg/ml BRDU预孵育24小时,然后用顺铂处理12小时。用PBS洗涤细胞,然后用缓冲液1(10mM PIPE,pH 7.0,100mM NaCl,300mM蔗糖,3mMMgCl2,0.5%Triton X-100)在冰上释放10分钟。接下来,使用PBS洗涤细胞,并在冰上用缓冲液2(10mM Tris-HCl,pH 7.5;10mM NaCl;3mM MgCl2,1%吐温-40,0.5%脱氧胆酸钠)再释放10分钟。洗涤后,在室温下用4%PFA固定细胞30分钟。将载玻片阻断5%BSA,然后在4℃下与抗BRDU(1:100)一抗孵育过夜。二级抗体和DAPI如上所述染色。
质谱分析
为了鉴定Mre11乳酸化位点,在收获前用50mM NALA处理稳定表达HA标记的Mre11的293T细胞24小时,然后裂解。使用抗HA琼脂糖珠纯化裂解物。然后在SDS–PAGE上解析颗粒,并用考马斯蓝染色。切除对应于HA-Mre11的带,并将其发送用于质谱分析。
免疫共沉淀和蛋白质印迹
对于瞬时转染和共免疫沉淀测定,将编码HA标记的Mre11或HA标记的CBP构建体的构建体瞬时共转染HEK293T细胞。用含有1×蛋白酶抑制剂的NETN缓冲液(20mM Tris–HCl,pH8.0,100mM NaCl,1mM EDTA和0.5%Nonidet P-40)在冰上裂解转染细胞25分钟。通过12000rpm离心10分钟去除细胞碎片后,收集可溶性部分,并在4℃下与HA珠温育2h。HA珠用NETN缓冲液洗涤三次,在1×SDS加载缓冲液中煮沸5分钟,并在SDS–PAGE上解析。使用TBST缓冲液中的5%牛奶封闭膜,然后按指示用抗体探测。
HRD评分分析
TCGA乳腺癌队列HRD评分较早发布,可从基因组数据共享(GDC)下载。从UCSCxenabrowser下载日志转换TPM的表达式数据。根据先前定义的PAM50特征,对基础亚型(n=140)进行HRD评分分析。根据BRCA1和LDHA的中值表达水平对样品进行分组。通过Mann-whitney Wilcoxon检验检验统计显著性。
全细胞提取物和染色质组分提取
首先,用含有1×蛋白酶抑制剂的NETN缓冲液(20mM Tris–HCl,pH 8.0,100mMNaCl,1mM EDTA和0.5%Nonidet P-40)在冰上裂解细胞10分钟。离心(12000rpm,4℃下10分钟)后,收集上清液作为全细胞提取物。剩余的用PBS缓冲液洗涤至少3次,并用冷的EBC2缓冲液(50mMTris HCl[pH 7.5]、300mMNaCl、5mMCaCl2和10U微量核酸酶)进一步裂解。超声处理和离心(12000rpm,4℃下10分钟)后,收集上清液作为染色质组分。
菌落形成测定
将指示的细胞(500-2000)接种在六孔板的每个孔中,一式三份。对于化疗敏感性试验,1天后,将细胞暴露于指定剂量的指定药物,并在培养箱中放置10-14天以允许菌落形成。结肠用GIEMSA染色并定量。结果与电镀效率标准化。
电泳迁移率转移测定
将指定浓度的Mre11蛋白与dsDNA或悬突DNA底物在37℃下在含有100mM KCl的反应缓冲液(25mM Tris-HCl,pH 7.5,5mM MgCl2,1mM DTT,100mg/ml BSA,2mM ATP)中孵育15分钟。孵育后,将反应物与负载缓冲液(20mMTris HCl,pH 7.5,40%甘油,2mMEDTA,0.2%橙色G)混合,然后在SB缓冲液(10mM NaOH,40mM硼酸,pH 8.0)中使用0.5%琼脂糖凝胶进行电泳。
多肽合成
所有多肽均由国平制药有限公司(中国合辉)合成。通过高压液相色谱对体外和体内的合成肽进行纯化,使其纯度>98%。体内使用的肽的氨基酸序列为D亚型。对于体外实验,将肽溶解在PBS中以产生10mM储备溶液。对于体内使用,将K673-pe和K673R-pe溶解在PBS中并保持在冰上直至注射。注射前,将溶液置于室温。
结直肠癌患者衍生类器官模型
四个结肠癌类器官首次通过蛋白质印迹法测定泛乳酸盐水平。此外,根据它们的泛乳酸化水平,这些类器官被分为两组,高乳酸化和低乳酸化。将状态良好的类器官传代并接种在标准96孔细胞培养板(Corning)中。分别用顺铂单独或与LDHi或CBPi联合治疗类器官的高乳酸化水平。分别用顺铂单独或与乳酸或乳酸钠联合治疗低乳酸盐水平的类器官。72h后,通过CCK8检查类器官的生长。
动物
所有动物实验和程序均严格按照美国国立卫生发明院制定的《实验动物护理和使用指南》(国家科学院出版社,2011年)进行,并遵循同济大学医学院批准的伦理指南协议进行。
结直肠癌患者衍生异种移植(PDX)模型
将结肠癌患者来源的异种移植物(PDX)皮下移植到6周龄的雌性nu/nu小鼠中。将携带150-200mm
对于K673-pe或K673R-pe与奥拉帕尼的组合以杀死结肠癌PDX测定,如上所述携带150-200mm3肿瘤的小鼠也被随机分为六组:溶媒对照组(盐水)、K673R-pe(5mg.kg-1)组、K673-pe(5mg.kg-1)组、奥拉帕尼组(50mg/kg-1)、,奥拉帕利(50mg·kg-1)+K673R pe(5mg·kg-1,5mg·kg-1)组和奥拉帕利50mg·kg-1,+K673 pe(5mg·kg-2)组。K673-pe或K673R-pe每天腹腔注射一次,奥拉帕尼每周腹腔注射三次。
量化和统计分析
对于细胞存活、PDO、PDX异种移植和RPA2、Mre11、RDA51、BRDU和Mre11-k673la病灶测定,数据表示为三个独立实验的平均值±S.E.M。对于动物发明,数据表示为5只小鼠的平均值±S.E.M。在GraphPad Prism中使用Student t检验或χ2检验进行统计分析。
实施例1Mre11能够发生乳酸化修饰
鉴于乳酸化是一种新的翻译后修饰,其在细胞中的作用在很大程度上仍然未知。因为LDHA是催化乳酸产生的主要激酶,因此LDHA可能调控蛋白的乳酸化修饰。有趣的是,我们发现低LDHA表达的患者表现出更高的HRD评分,这表明HR缺乏。此外,通过乳酸钠(NALA)处理细胞显著提高细胞的泛乳酸化水平和同源重组修复(HR)的效率,这些结果初步表明高水平的蛋白质乳酸化修饰可能在HR修复中发挥关键作用(图1A-1C)。
通过筛选了几个关键的HR蛋白,我们发现Mre11在细胞中能发生很强的乳酸化修饰(图1D)。乳酸钠处理增强了Mre11的乳酸化,而LDHi处理的结果正好相反(图1E)。敲低LDHA/B显著降低了Mre11的乳酸化(图2C)。通过在筛选多种乙酰转移酶后,我们发现CBP是主要介导Mre11发生乳酸化的乙酰转移酶(图2F)。抑制或者敲低CBP显著降低Mre11乳酸化(图1G)。
Mre11是一个进化保守的蛋白质,主要由一个核酸酶结构域、两个DBD结构域和一个GAR结构域组成(图1H)。为了鉴定出Mre11发生乳酸化的位点,我们将纯化的HA标记的Mre11蛋白用于质谱(MS)分析。如图2J,K673被鉴定为潜在的Mre11乳酸化位点。进一步通过位点突变实验,我们发现位于第二个DBD结构域的内K673是Mre11响应DNA损伤发生乳酸化修饰的主要位点(图1K)。
实施例2Mre11乳酸化修饰促进其与DNA的结合和招募到DNA损伤位点上
由于Mre11具有能与DNA结合的结构域,据报道Mre11与DNA的结合以RAD50依赖或不依赖的方式发生。然而,Mre11与DNA结合的机制仍还未完全清楚。为了检测乳酸化是否影响Mre11与DNA的结合,我们首先利用纯化的Mre11 WT进行体外乳酸化,然后再进行体外DNA结合实验。如图2A所示,电泳迁移率转移测定(EMSA)结果表明,乳酸化促进Mre11与dsDNA和悬突DNA的结合。此外,与Mre11 KR突变体相比,WT Mre11与DNA结合表现出更高的亲和力(图2B)。此外,乳酸钠(NALA)处理增强了Mre11或Mre11-K673la焦点的形成和Mre11招募到染色质(图2C-2D)。同时,通过抑制CBP或LDH,显著减少Mre11染色质募集减少(图2E-2F)。此外,与Mre11 WT相比,Mre11 KR招募到染色质的量显著减少(图2E-2F)。同样,Mre11 KR在DNA损伤后显示出较少的焦点的形成(图2G)。总之,我们的发现表明Mre11的乳酸化对其与DNA结合和DNA损伤诱导焦点形成很重要。
实施例3Mre11乳酸化修饰促进DNA末端切割和同源重组修复
为了进一步确定乳酸化是否影响DNA末端切除,我们首先使用乳酸钠或LDHi处理的细胞,然后检测p-RPA2的水平和BRDU焦点的形成情况。抑制LDHA/B显著降低顺铂诱导的p-RPA2水平(图3A)。乳酸钠处理显著增加了DNA损伤诱导的BRDU焦点的形成(图3B)。此外,乳酸钠能够挽救因抑制LDHA/B导致p-RPA2的减弱(图3A)。
为了进一步探讨Mre11 K673的乳酸化在DNA末端切除中的作用,我们构建了稳定表达Mre11 WT和Mre11 KR的肿瘤细胞(其内源性Mre11已经被敲低)。我们发现Mre11 KR细胞抑制了DNA损伤诱导的p-RPA2水平(图3C)。此外,在Mre11 WT细胞中,乳酸钠处理显著增强了DNA损伤p-RPA2水平,而在Mre11 KR细胞中则没有这种现象(图3C)。此外,Mre11 KR突变损害了DNA损伤诱导RPA2和RAD51焦点的形成(图3D-3E)。由于Mre11的乳酸化增强了DNA切除,这是HR修复的关键起始步骤,我们接下来测试Mre11乳酸化是否调节HR修复和基因组稳定性。如图3F所示,Mre11 KR突变降低了HR修复。此外,通过检测DNA损伤后的γH2AX水平,我们发现Mre11 KR突变损害了DNA损伤修复(图3G)。
实施例4高Mre11乳酸化修饰促导致化疗耐受
由于Mre11的乳酸化增强了DNA切除并促进HR修复,通过高度激活的HR修复导致肿瘤细胞对PARP抑制剂或者铂类化疗药物抵抗。接下来我们检测Mre11乳酸化修饰是否会影响化疗药物对肿瘤细胞的杀伤效果。如图4A-4B所示,乳酸钠处理导致癌细胞对奥拉帕尼更加耐受,而联合CBPi处理逆转了这种效应。此外,与Mre11 WT细胞相比,Mre11 KR细胞对奥拉帕利处理表现出更加敏感的效果(图4C-4D)。同时,通过CBPi或NALA操纵乳酸化影响Mre11WT细胞对的化疗反应,而对Mre11 KR突变细胞没有影响(图4C-4D)。这些结果初步表明,在基于细胞的模型中Mre11乳酸化调节肿瘤细胞对化疗的反应。
为了进一步证实Mre11乳酸化在化疗中的作用,我们使用高Mre11乳酸化的PDX在体内进行肿瘤杀伤实验。如图4E-4G所示,CBPi和LDHi处理均显著增强了奥拉帕利对高K673乳酸化结肠PDX的杀伤作用,这些结果表明CBPi或LDHi联合化疗可能是Mre11 K673高乳酸化癌症治疗的潜在有效策略。
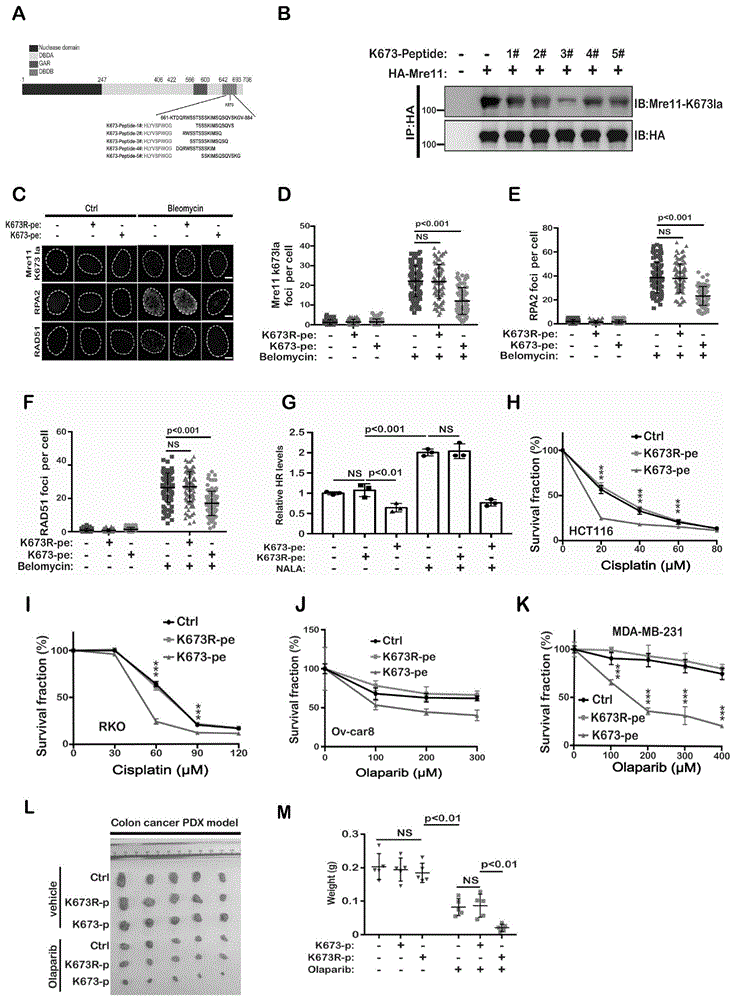
实施例5通过短肽特异性靶向Mre11乳酸化修饰联合化疗药物显著提高对肿瘤的杀伤效果
鉴于靶向CBP或LDH可能对多种信号通路产生影响,因此需要一种专门靶向Mre11K673乳酸化的策略。基于蛋白质翻译后修饰(PTMs)的基序,特异性生成多肽已经被证明是抑制蛋白质翻译后修饰的一种有前途和有效的策略。
在分析Mre11 K673位点附近的序列后,本发明结合之前的文献报道并基于Mre11发生乳酸化修饰的序列,设计和包含Mre11 K673位点在内的大约长度为13个氨基酸再加上细胞穿膜肽。五种与细胞穿透肽(CPPs)(其已成为细胞内递送生物分子的最常用和最有效的工具之一)融合的短肽(图5A)。
具体的,多肽的序列,具体如下:
K673-Peptide-1#:HLYVSPWGGTSSSKIMSQSQVS(SEQ ID NO.1);
K673-Peptide-2#:HLYVSPWGGRWSSTSSSKIMSQ(SEQ ID NO.2);
K673-Peptide-3#:HLYVSPWGGSSTSSSKIMSQSQ(SEQ ID NO.3);
K673-Peptide-4#:HLYVSPWGGDQRWSSTSSSKIM(SEQ ID NO.4);
K673-Peptide-5#:HLYVSPWGGSSKIMSQSQVSKG(SEQ ID NO.5)。
K673-肽-3#(称为K673-pe)对Mre11的乳酸化具有最强的抑制作用(图5B)。基于K673-pe肽,我们合成了一个对照的多肽(称为K673R-pe),其中K673残基被R残基取代。如图5C-5E所示,K673-pe显著抑制DNA损伤诱导的Mre11-k673la和RPA2焦点的形成,这表明K673-pe抑制Mre11 K673乳酸化,导致DNA末端切除显著减少。此外,K673-pe处理还减少了DNA损伤诱导的RAD51焦点的形成,这与K673-pe处理后HR水平的显著降低一致(图5C,5F-5G)。这些结果表明,K673-pe肽可以通过抑制Mre11乳酸化来下调HR。
接下来,我们发明K673-pe是否促进癌细胞对化疗药物的敏感。如图5H-5K所示,K673-pe而不是K673R-pe显著增强了结直肠癌细胞HCT11-6(图5H),结直肠癌细胞RKO(图5I)卵巢癌细胞((图5J),乳腺癌细胞(图5K)对顺铂或者PARP抑制剂敏感性。
为了进一步证实K673-pe联合化疗在体内的协同杀伤作用,我们利用高乳酸化的Mre11K673结肠癌PDX模型进行肿瘤杀伤实验。如图5L-5M所示,K673-pe而不是K673R-pe显著增强结肠PDX对奥拉帕尼敏感性。这些结果表明,K673-pe靶向Mre11 K673乳酸化修饰是增强高Mre11 K673乳酸化修饰肿瘤化疗效果的潜在策略。
