α-1,2-岩藻糖基转移酶及其应用
文献发布时间:2023-06-19 12:11:54
技术领域
本发明属于生物工程技术领域,具体涉及一种α-1,2-岩藻糖基转移酶及应用。
背景技术
2’-岩藻糖基乳糖是一种新型稀有母乳寡糖,具有选择性刺激肠道益生菌的生长,阻止病原菌对小肠上皮细胞的粘附从而保护婴幼儿肠道健康,提高免疫系统等生理功能。目前2’- 岩藻糖基乳糖已经被欧盟,FDA等批准为婴幼儿奶粉添加剂,具有广阔的应用前景。
α-1,2-岩藻糖基转移酶(α1,2-fucosyltransferase,FucT)是催化合成2’-岩藻糖基乳糖的关键酶,负责将供体GDP-L-岩藻糖转移到受体分子乳糖。虽然已经有报道多条α-1,2-岩藻糖基转移酶。但是大多数α-1,2-岩藻糖基转移酶在大肠杆菌中可溶性表达量很低,限制了大规模合成2’-岩藻糖基乳糖。寻找可溶性表达及酶活较高α-1,2-岩藻糖基转移酶,也是提高2’-岩藻糖基乳糖产量的重要手段。
发明内容
有鉴于此,本发明的目的之一在于提供一种α-1,2-岩藻糖基转移酶,本发明的目的之二在于提供一种编码α-1,2-岩藻糖基转移酶的基因,本发明的目的之三在于提供一种重组表达载体,本发明的目的之四在于提供一种重组表达载体的构建方法,本发明目的之五在于提供一种基因工程菌,本发明的目的之六在于提供一种α-1,2-岩藻糖基转移酶在催化GDP-L-岩藻糖形成2’-岩藻糖基乳糖中的应用。
为达到上述目的,本发明提供如下技术方案:
1、一种α-1,2-岩藻糖基转移酶,所述α-1,2-岩藻糖基转移酶氨基酸序列如SEQ IDNO.1 所示。
2、一种编码α-1,2-岩藻糖基转移酶的基因,所述基因的核苷酸序列如SEQ IDNO.2所示。
3、一种重组表达载体,所述载体包含所述的α-1,2-岩藻糖基转移酶的核苷酸序列。
4、一种重组表达载体的构建方法,所述方法为,以菌株Kosakonia sp.ZX03 CCTCCM2018092为模板,用上、下游引物扩增编码α-1,2-岩藻糖基转移酶的基因,再与表达载体连接,得到重组表达载体,所述上游引物核苷酸序列为SEQ ID NO.5,所述下游引物核苷酸序列为SEQ ID NO.6。
作为优选的技术方案之一,所述载体的结构骨架为pET21C。
5、一种基因工程菌,所述基因工程菌由所述重组表达载体转化至宿主细胞中获得。
6、利用α-1,2-岩藻糖基转移酶在催化GDP-L-岩藻糖形成2’-岩藻糖基乳糖中的应用。
有益效果:
本发明发现了一种新的α-1,2-岩藻糖基转移酶,具有催化GDP-fucose产生岩藻糖基乳糖的能力,为岩藻糖基转移酶的酶库提供新的选择,并为岩藻糖基转移酶定向进化提供新的起点。
生物材料保藏
菌株Kosakonia sp.ZX03于2018年3月2日保藏于中国典型培养物保藏中心(简称CCTCC,地址:湖北省武汉市武昌区八一路299号),保藏编号为CCTCC M2018092。
附图说明
图1为不同α-1,2-岩藻糖基转移酶蛋白同源性比对;
图2为pET-FKP质粒构建图;
图3为质粒构建电泳图,A为pET-FutCks质粒构建图,B为pET-FutCks-FKP质粒构建图;
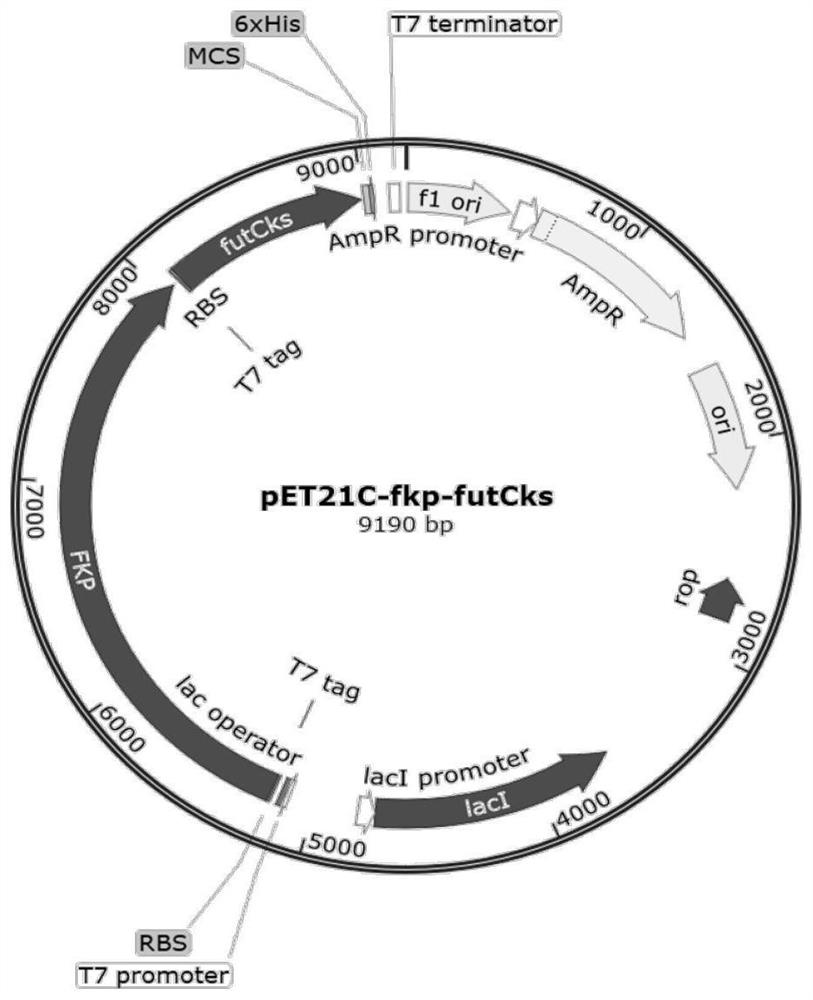
图4为pET-FutCks-FKP质粒构建图谱;
图5为FutCks蛋白电泳图,T为菌液全蛋白,S为上清,I为沉淀;
图6为重组菌株生产2’-岩藻糖基乳糖的液相检测结果图。
具体实施方式
下面将结合附图,对本发明的优选实施例进行详细的描述。实施例中未注明具体条件的实验方法,通常按照常规条件,例如分子克隆实验指南(第三版,J.萨姆布鲁克等著)中所述的条件,或按照制造厂商所建议的条件。
实施例1
α-1,2-岩藻糖基转移酶的发现
(1)α-1,2-岩藻糖基转移酶蛋白同源性比对
将幽门螺旋杆菌的α-1,2-岩藻糖基转移酶FutC的蛋白序列与菌株Kosakoniasp.ZX03 C CTCC M2018092的蛋白序列进行blastP比对分析。结果如表1所示,菌株Kosakonia sp.Z X03 CCTCC M2018092基因组存在与FutC蛋白序列相似度为29.642%的蛋白序列,将其命名为FutCks,氨基酸序列如SEQ ID NO.1所示,核苷酸序列如SEQ ID NO.2所示,这条蛋白序列与进行比对的序列同源性并不高,但是它的E值以及得分非常高,表明这条蛋白可能是α-1,2-岩藻糖基转移酶。
表1α-1,2-岩藻糖基转移酶蛋白比对结果
(2)α-1,2-岩藻糖基转移酶蛋白核心基序比对
不同来源的α-1,2-岩藻糖基转移酶的同源性都存在较低的同源性,而这些α-1,2-岩藻糖基转移酶只要有共同的催化基序就可以行使α-1,2-岩藻糖基转移酶的功能,进一步对FutCks蛋白序列与已经报道的α-1,2-岩藻糖基转移酶利用Geneious比对分析,结果如图1所示,FutCk s蛋白序列与文献报道的α-1,2-岩藻糖基转移酶有着共同的基序,这也表明FutCks蛋白序列可能具有α-1,2-岩藻糖基转移酶的活性。
实施例2
α-1,2-岩藻糖基转移酶质粒构建
(1)构建pET-FKP、pET-FutCks与pET-FutCks-FKP质粒
利用岩藻糖经补救途径合成GDP-岩藻糖是一种产生岩藻糖供体的有效方式,这一步骤需要L-岩藻糖激酶/GDP-L-岩藻糖焦磷酸化酶双功能酶基因(FKP)的参与,因此,构建FKP与F utCks两个基因同时表达的质粒。
由江苏金唯智生物经过密码子优化后合成,用引物FKP-F(SEQ ID NO.3)和FKP-R(S EQ ID NO.4)扩增FKP基因,
PCR体系:
PCR程序:
获得PCR产物经过天根琼脂糖凝胶DNA回收试剂盒(增强型)纯化后,与经过NdeI和s acI双酶切的pET21C连接,构建pET-FKP质粒,构建结果如图2所示。
用引物FutCks-F(SEQ ID NO.5)和FutCks-R(SEQ ID NO.6)扩增FutCks基因,
PCR体系:
PCR程序:
获得PCR产物经过天根琼脂糖凝胶DNA回收试剂盒(增强型)纯化后,与经过NdeI和sacI双酶切的pET21C连接,构建pET-FutCks质粒,结果如图3中A、B所示,菌落PCR结果显示,成功构建pET-FutCks质粒(图3中A),双酶切结果也显示pET-FutCks质粒条带大小正确(图3中B)。将构建成功的质粒pET-FutCks与pET-FKP通过同尾酶连接BioBricK的方法连接起来,构建pET-FutCks-FKP,构建图谱如图4所示。
pET-FutCks酶切体系:
pET-FKP酶切体系:
获得酶切产物经过天根琼脂糖凝胶DNA回收试剂盒(增强型)纯化后,用T4连接酶(New England Biolabs,M0202V)连接,反应条件:1×T4 DNA连接酶反应缓冲液中,加入1μlDNA Ligase,双酶切的pET-FutCk的质粒加入1.5μl,双酶切的FKP片段加入3.5μl,用水补足20μl,16℃过夜连接,转化进入DH10B感受态细胞中,在Carb抗性平板上进行转化子筛选。
FKP-F:TAAGAAGGAGATATACATATGCAGAAACTGCTCAGTCTG(SEQ ID NO.3);
FKP-R:GCAAGCTTGTCGACGGAGCTCACTAGTTTAACTACGGCTAACTTGGAAAC (SEQ IDNO.4);
FutCks-F:TAAGAAGGAGATATACATATGATCGTTAGATTATCAGGTGG(SEQ ID NO.5);
FutCks-R:GCAAGCTTGTCGACGGAGCTCACTAGTTTACAGCTTAATCCAGCCATC (SEQ IDNO.6);
T7 Promoter-F:TAATACGACTCACTATAGGGG(SEQ ID NO.7);
T7 Terminator-R:GCTAGTTATTGCTCAGCGG(SEQ ID NO.8);
(2)重组质粒在大肠杆菌JM109(DE3)中的表达
将构建成功的质粒pET-FutCks,pET-FutCks-FKP,分别转入大肠杆菌中JM109(DE3)宿主中,挑选单菌落于37℃,220rpm过夜培养。第二天以1%的接种量转接到30mL TB培养基中,37℃,220rpm培养至菌液OD
实施例3
pET-FutCks-FKP重组表达蛋白在2’-岩藻糖基乳糖合成中的应用
通过对补救途径质粒pET-FutCks-FKP进行摇瓶发酵实验,验证pET-FutCks-FKP重组质粒所表达的α-1,2-岩藻糖基转移酶FutCks是否具有催化GDP-L-岩藻糖形成2’-岩藻糖基乳糖的功能。具体方法如下:
构建成功的pET-FutCks-FKP质粒转入大肠杆菌JM109(DE3)宿主菌中,挑选单菌落接种到TB液体培养基37℃,220rpm过夜培养。以1%接种量接种到10ml含有1%甘油TB发酵培养基,37℃,220rpm培养培养至OD=0.6左右,冰上静止10-15min,加入终浓度为0.1 mM的IPTG诱导目的基因的表达,同时加入0.5%L-岩藻糖,0.6%乳糖。25℃,220rpm发酵48h,HPLC检测2’-岩藻糖基乳糖产量。取1mL发酵液,设置超声功率350W,超声时间超3s,停7s,时间10min。12000rpm离心20min。采用示差检测器(Benson carbohydrate column BP-800)检测2’-岩藻糖基乳糖,检测条件:Pb++色谱柱,流动相为纯水,流速0.8mL/min,柱温80℃。
结果如图6所示,摇瓶发酵结果显示产生580mg/L的2’-岩藻糖基乳糖,说明补救途径质粒pET-FutCks-FKP能够产生2’-岩藻糖基乳糖,表明pET-FutCks-FKP重组质粒所表达的α-1,2-岩藻糖基转移酶FutCks具有催化功能,这是一种新的α-1,2-岩藻糖基转移酶。
最后说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本技术方案的宗旨和范围,其均应涵盖在本发明的权利要求范围当中。
序列表
<110> 西南大学
<120> α-1,2-岩藻糖基转移酶及其应用
<160> 8
<170> SIPOSequenceListing 1.0
<210> 1
<211> 298
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 1
Met Ile Val Arg Leu Ser Gly Gly Leu Gly Asn Gln Leu Phe Gln Phe
1 5 10 15
Ala Ala Ala Lys Ala Leu Glu Ile Lys Phe Gly Gly Asn Val Ile Ile
20 25 30
Asp Asp Ser Tyr Tyr Asp Asn Gln Pro Gly Lys Asp Thr Phe Arg Lys
35 40 45
Leu Glu Ile Phe Gln Phe Asn Val Gln Tyr Ala Arg Lys Ser Asn Ser
50 55 60
Lys Glu Lys Lys Asn Thr Arg Asn Lys Val Leu Ala Leu Lys Leu Phe
65 70 75 80
Ala Arg Ile Pro Gly Val Asn Ser Pro Ser Val Leu Arg Lys Ile Lys
85 90 95
Arg Leu Ile His Val Tyr Asn Glu Asp Ser Phe Ile Tyr His Glu Lys
100 105 110
Ala Arg Glu Asn Asp Tyr Val Ile Gly Tyr Phe Gln Asn Tyr Ser Phe
115 120 125
Leu Lys Glu Ser Ile Asp Ser Ile Gln Gln Gln Phe Thr Leu Ala Pro
130 135 140
Glu Val Asp Ala Glu Met Arg Ser Leu Ser Ser Tyr Gln Val Ile Asn
145 150 155 160
Gln His Val Asn Thr Ile Ala Val His Ile Arg Arg Gly Asp Tyr Val
165 170 175
Thr Asn Ala Asn Ala Ser Ala Phe His Gly Leu Cys Asp Val Glu Tyr
180 185 190
Tyr Lys Lys Ser Ile Glu Leu Ile Thr Ala Arg Thr Thr Asp Pro Lys
195 200 205
Phe Val Phe Phe Ser Asp Asp Ile Ser Trp Val Lys Glu Thr Phe Ser
210 215 220
Trp Val Pro Asp Ala Ser Phe Val Glu Asn Ala Gly Ser Thr Ser Ser
225 230 235 240
Ala Val Asp Met Tyr Leu Met Ser Leu Cys Lys His Asn Ile Ile Ala
245 250 255
Asn Ser Thr Tyr Ser Trp Trp Gly Ala Val Leu Asn Thr Asn Pro Glu
260 265 270
Lys Ile Val Ile Cys Pro Glu Arg Trp Thr Leu Asn Asp Ser Ile Gly
275 280 285
Gln Leu Tyr Val Asp Gly Trp Ile Lys Leu
290 295
<210> 2
<211> 897
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 2
atgatcgtta gattatcagg tggtttagga aatcaactct tccagttcgc tgcagcgaaa 60
gcgcttgaaa ttaaatttgg tgggaatgtc atcattgatg acagctatta tgataatcag 120
cctggtaaag ataccttcag gaagctggag atctttcagt ttaacgttca gtacgccagg 180
aagagcaaca gtaaagagaa aaagaatacg cgtaacaaag tgttggcgct caagcttttc 240
gctcgcatcc cgggagttaa tagcccatcc gttcttcgta aaatcaaacg tttaatccat 300
gtctataatg aagactcctt catttaccat gagaaggcac gcgagaacga ttacgtcatt 360
ggctatttcc aaaattatag ttttctgaaa gagagtattg attccattca gcagcaattt 420
acgcttgccc cggaagtgga tgctgaaatg cgaagtctca gctcttatca ggtcataaac 480
cagcatgtga ataccatcgc cgtacatatt cgccgtggcg attatgtgac aaatgcaaat 540
gccagcgcat ttcatgggtt atgtgatgtt gagtactata aaaaatcaat tgaattgata 600
actgccagaa ccacggatcc gaaatttgtc tttttttccg atgatattag ctgggttaaa 660
gagacctttt catgggttcc agatgcttct ttcgttgaga acgctggctc tacatcctct 720
gcggttgata tgtatctgat gtcgctctgt aagcataata tcattgcgaa cagcacttac 780
agttggtggg gagcagtgct caataccaat cctgaaaaga tcgtcatatg tcctgaacga 840
tggactttga acgatagtat tggccagctg tacgttgatg gctggattaa gctgtaa 897
<210> 3
<211> 39
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 3
taagaaggag atatacatat gcagaaactg ctcagtctg 39
<210> 4
<211> 50
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 4
gcaagcttgt cgacggagct cactagttta actacggcta acttggaaac 50
<210> 5
<211> 41
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 5
taagaaggag atatacatat gatcgttaga ttatcaggtg g 41
<210> 6
<211> 48
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 6
gcaagcttgt cgacggagct cactagttta cagcttaatc cagccatc 48
<210> 7
<211> 21
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 7
taatacgact cactataggg g 21
<210> 8
<211> 19
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 8
gctagttatt gctcagcgg 19
