用于施加局部免疫增敏剂的皮肤贴片和玻璃拭子
文献发布时间:2023-06-19 19:28:50
背景技术
局部免疫增敏剂是当以相当少量局部施加于皮肤时在大部分人中诱导迟发型超敏反应(DTH)的化合物。局部免疫增敏剂的示例包括方形酸二丁酯(SADBE)、方形酸乙酯、方形酸酯(通常包括单酯和二酯)、二苯基环丙烯酮(DPCP)、1-氯-2,4-二硝基苯(DNCB)和1-氯-2,6-二硝基苯。(Buckley等人,Lee等人)
毒常春藤及其活性成分漆酚也是局部免疫增敏剂。
SADBE以及其他局部免疫增敏剂二苯基环丙烯酮和DNCB已经成功地用于治疗寻常疣和斑秃。在这些情况下,使用重量/体积为0.05%至2.0%的溶液。载体几乎总是丙酮。免疫增敏剂在这些应用中都显示出有效性。对于寻常疣,通常大约以周为间隔将免疫增敏剂反复施加到疣上,直到疣消退。对于斑秃,通常每周一次将免疫增敏剂反复施加到头皮患处,直到消退。(Buckley等人,Lee等人)
现已证实,SADBE能有效地预防唇疱疹(感冒疮或口腔疱疹)频繁发作的人发病。(Palli等人,Chang等人)已发现将单剂量施加到手臂,而非嘴唇或病变处,在约四个月内显著地减少了感冒疮的发病次数。(Palli等人,Chang等人)该机制看起来是这样的:在施加一剂后8周,这一剂以全身性方式改变了免疫基因表达,包括在暴露于单纯疱疹病毒和体外的其他刺激的外周血单核细胞(PBMC)中增加干扰素γ(IFNG)表达并且减少白介素-5(IL5)表达(McTavish等人)。
发明内容
需要用于局部递送局部免疫增敏剂的新单位剂型和装置。除其他优点外,本文所提供的单位剂型、装置和试剂盒递送体积更一致且受控的药物溶液、防止给药不足和给药过量、防止或阻止重复给药,并且提供更一致的施加药物溶液的皮肤面积。这些单位剂型和装置及试剂盒还提供了用于药物溶液的容器,这有助于药物溶液在储存中保持稳定和不变,因为容器与空气完全隔绝,从而允许排除能够与某些局部免疫增敏剂反应并使其分解的水蒸气和氧气,并且使药物溶液仅与玻璃接触,玻璃是一种不与溶液反应也不被溶液提取的惰性物质。
本发明的实施方案提供了局部免疫增敏剂和其他局部施加药物的单位剂型,其储存稳定,可以由最终用户患者方便、安全且准确地使用,避免局部药物与患者的非预期皮肤接触,并且有助于在一致的皮肤面积上施加体积或量一致的药物。
本发明的一个实施方案提供了一种皮肤贴片,包括:(a)背衬层,该背衬层包括织物,以及覆盖在织物的至少一部分面积上方的粘合剂;(b)吸收纱布层,该吸收纱布层覆盖在背衬层的一部分面积上方;该吸收纱布层包含液体或半液体溶液,该溶液包含载体和溶解在该载体中的局部免疫增敏剂。
本文的术语“半液体”是指粘性但不完全是固体的组合物,包括霜膏、乳液或凝胶。
另一个实施方案提供了一种玻璃拭子,包括:(a)密封的玻璃安瓿,其包含局部免疫增敏剂溶解在液体载体中的液体溶液;以及(b)附接到密封的玻璃安瓿的泡沫涂敷器顶端;其中密封的玻璃安瓿可以通过普通力量的人用手挤压而破裂,并且其中该玻璃拭子被适配成使得当玻璃安瓿破裂并倒置时,液体溶液在5分钟内充满泡沫顶端,因此该泡沫顶端在接触表面时用液体溶液将该表面润湿。
在一个具体的优选实施方案中,该玻璃拭子还包括(c)聚合物阻隔层,其包围玻璃安瓿并密封到泡沫涂敷器顶端,其中该聚合物阻隔层被适配成防止破裂的玻璃碎片和液体溶液穿透该聚合物阻隔层与通过挤压使玻璃拭子破裂的人手指的皮肤接触。
另一个实施方案提供了一种制作玻璃拭子的方法,该玻璃拭子包括:(a)密封的玻璃安瓿,其包含局部免疫增敏剂溶解在液体载体中的液体溶液,其中局部免疫增敏剂为方形酸酯,液体载体为二甲基亚砜(DMSO)、甲醇、乙醇、丙醇、丁醇、异丙醇、异丁醇、丙酮,或它们的组合;以及(b)附接到密封的玻璃安瓿的泡沫涂敷器顶端;其中密封的玻璃安瓿可以通过普通力量的人用手挤压而破裂,并且其中该玻璃拭子被适配成使得当玻璃安瓿破裂并倒置时,液体溶液在5分钟内充满泡沫顶端,因此该泡沫顶端在接触表面时用液体溶液将该表面润湿。该方法包括(a)(1)用分子筛处理载体(优选地在干燥气氛下),以从载体去除水,从而产生干燥的载体;将方形酸酯溶解到干燥的载体中(优选地在干燥气氛下),以产生无水溶液;或者(a)(2)将方形酸酯溶解到载体中以形成溶液,然后用分子筛处理溶液(优选地在干燥气氛下),以从载体去除水,从而产生无水溶液。该方法还包括(b)在干燥气氛下将该无水溶液填充到玻璃安瓿中,然后密封玻璃安瓿以形成气密密封;其中该安瓿中的无水溶液仅与玻璃接触,直到气密密封被破坏。
另一个实施方案提供了一种试剂盒,包括:(a)皮肤贴片,该皮肤贴片包括:(a)(1)背衬层,该背衬层包括织物,以及覆盖在织物的至少一部分面积上方的粘合剂;(a)(2)吸收纱布层,该吸收纱布层覆盖在粘合剂背衬层的一部分面积上方;以及(b)容纳液体或半液体溶液的密封容器,该溶液包含溶解在载体中的局部免疫增敏剂。
在该试剂盒的一个优选实施方案中,密封容器(b)为玻璃拭子,包括:(b)(1)密封的玻璃安瓿,其包含局部免疫增敏剂溶解在液体载体中的液体溶液;以及(b)(2)附接到密封的玻璃安瓿的泡沫涂敷器顶端;其中密封的玻璃安瓿可以通过普通力量的人用手挤压而破裂,并且其中该玻璃拭子被适配成使得当玻璃安瓿破裂并倒置时,液体溶液在5分钟内充满泡沫顶端,因此该泡沫顶端在接触表面时用液体溶液将该表面润湿。在一个更优选的实施方案中,该玻璃拭子还包括(b)(3)聚合物阻隔层,其包围玻璃安瓿并密封到泡沫涂敷器顶端,其中该聚合物阻隔层被适配成防止破裂的玻璃碎片和液体溶液穿透该聚合物阻隔层与通过挤压使玻璃拭子破裂的人手指的皮肤接触。
另一个实施方案提供了一种局部施加受控剂量的局部免疫增敏剂的方法,包括:将粘合剂皮肤贴片施加并粘附到人的皮肤上,该粘合剂皮肤贴片包括:背衬层,该背衬层包括织物,以及覆盖在织物的至少一部分面积上方的粘合剂;吸收纱布层,该吸收纱布层覆盖在背衬层的一部分面积上方;该吸收纱布层包含液体或半液体溶液,该溶液包含载体和溶解在该载体中的局部免疫增敏剂。
附图说明
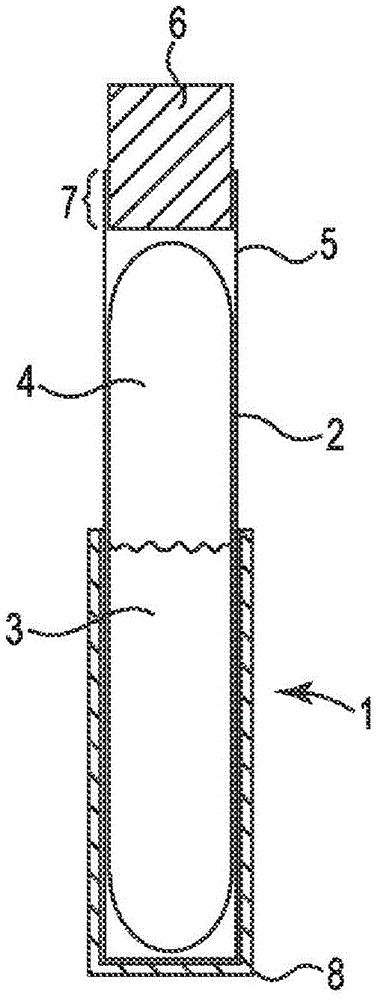
图1是本发明的皮肤贴片的示意图。
图2是本发明的玻璃拭子的示意图。
图3.
图4.
施加SADBE皮肤贴片后的主要刺激评分平均值±SEM。在诱导时,经由皮肤贴片向动物施用2%、6%和18%的SADBE(第0天),并在随后的30天内进行给药部位评价。再次攻击豚鼠的皮肤,将相同浓度的第二个SADBE贴片(第34天)施加到不同的位置,并在随后的28天内进行给药部位评价(每剂量水平n=10)。
图5.
施加SADBE皮肤贴片后的主要刺激评分平均值。在诱导时,经由皮肤贴片向动物施用2%、6%和18%的SADBE(第0天),并在随后的25天内进行给药部位评价。再次攻击小型猪的皮肤,将相同浓度的第二个SADBE贴片(第32天)施加到不同的位置,并在随后的30天内进行给药部位评价。
具体实施方式
本发明的一个实施方案提供了一种皮肤贴片,包括:(a)背衬层,该背衬层包括织物,以及覆盖在织物的至少一部分面积上方的粘合剂;(b)吸收纱布层,该吸收纱布层覆盖在背衬层的一部分面积上方;该吸收纱布层包含液体或半液体溶液,该溶液包含载体和溶解在该载体中的局部免疫增敏剂。图1中示出了该皮肤贴片的一个示例。
皮肤贴片1包括背衬层2,以及在该背衬层的至少一部分上方的粘合剂3。粘合剂用于将贴片粘附到患者的皮肤上。图1还示出了阻隔层4,其覆盖在背衬层1和粘合剂2的上面,并且铺垫在吸收纱布层5的下面。吸收纱布5任选地包含液体或半液体溶液6,该溶液包含载体和溶解在载体中的局部免疫增敏剂。
背衬层2和粘合剂3以及纱布5可以是用于皮肤贴片(诸如BAND AID绷带)中的常规材料。例如,在一个实施方案中,背衬层连同粘合剂为3M医用胶带9916(3M公司,SaintPaul,MN,USA)。在这种情况下,背衬层为2.2oz/yd
在一个实施方案中,纱布层5中的液体或半液体溶液6是局部免疫增敏剂方形酸二丁酯(SADBE)溶解在载体二甲基亚砜(DMSO)中的溶液。
图2示出了本发明的玻璃拭子1。玻璃拭子1包括密封的玻璃安瓿2,该玻璃安瓿容纳局部免疫增敏剂溶解在载体、优选液体载体中的液体或半液体溶液3。该密封的玻璃安瓿还包含顶部空间4,该顶部空间通常容纳大约为大气压的气体。该气体可以是空气或惰性气体,诸如氮气或氩气。在具体实施方案中,该气体是干燥的,意味着只有很少的水蒸气,或完全没有水蒸气。如果免疫增敏剂是水不稳定的,就像SADBE那样,则需要干燥气体。可以将空气干燥,但更典型地,干燥气体可以是惰性气体,诸如氮气或氩气。图2还示出了包围玻璃安瓿2的阻隔层5。在具体实施方案中,阻隔层5是溶解局部免疫增敏剂的载体不可渗透的,也是该免疫增敏剂不可渗透的。在具体实施方案中,阻隔层5为聚合物,优选地为半透明聚合物,更优选地为透明聚合物。在一个实施方案中,阻隔层为乙酸丁酸纤维素。玻璃拭子还包括泡沫顶端6。在一个实施方案中,泡沫顶端由聚烯烃构成。聚烯烃不可溶于DMSO和其他溶剂,并且耐受DMSO和其他溶剂,因此DMSO-SADBE溶液不会提取任何物质,也不会由于接触泡沫顶端而改性。泡沫顶端6应当与阻隔层5一起密封,并且在图2中,它们沿着卡圈区域7密封。该密封可以通过粘合剂或更优选地通过直接密封来实现,诸如通过热焊接或声波焊接或者通过使用挥发性溶剂来实现,该挥发性溶剂部分地溶解阻隔层5,以使其粘附到泡沫顶端6以形成密封。
阻隔层可以包含多于一种材料。例如,它可以包括在阻隔层的一部分上方的聚合物共混物或硬纸板层,该聚合物共混物或硬纸板层与阻隔层的另一部分上方的聚合物连接。如图2所示,还可以存在覆盖玻璃拭子的一端或两端的硬纸板帽8。在图2中,示出一个硬纸板帽8覆盖玻璃拭子的底端。它可以是可翻转且可移除的硬纸板帽,在运输中覆盖泡沫顶端6,并且在使用者挤压越过硬纸板和阻隔层两者以破坏玻璃安瓿之前由使用者移除并重新定位在玻璃拭子的另一端上方。
当玻璃安瓿破裂时,溶液3从玻璃安瓿中漏出,但是由于受到阻隔层的限制,因此没有玻璃碎片也没有溶液与使用者手指的皮肤接触。然后,使用者应当在玻璃拭子破裂之后将其倒置,以允许溶液3充满泡沫顶端6。使用者还可以在玻璃拭子破裂之后挤压玻璃拭子,以使溶液充满泡沫顶端的过程加速。当泡沫顶端充满溶液时,使用者可以将泡沫顶端轻搽或擦拭到其皮肤上,以将溶液施加到皮肤上,或者可以将泡沫顶端轻搽或擦拭到皮肤贴片的纱布部分上,以将溶液送入吸收纱布层中,然后可以将皮肤贴片施加到使用者的皮肤上,以将溶液给药到使用者的皮肤上。
不管有无皮肤贴片,玻璃拭子都有助于施用其量相当确定的免疫增敏剂溶液。它还有助于避免递送过多的溶液,并且避免溶液从其施加的地方滴落而接触非目标区域(诸如手指)。玻璃拭子还提供了单次使用的容器,一经使用,该容器就可见地破裂和损坏,因此患者不太可能随时间推移尝试重复使用该容器多次给药(这将导致过量给药)。玻璃拭子实现了这些益处,原因在于,药物溶液充满泡沫顶端大约需要30秒至60秒,因此该顶端可以用于润湿另一个表面,并且泡沫顶端最初以及在几分钟内并没有饱和,因而很难且最初不可能将溶液滴到使用者的皮肤或贴片上,这种溶液滴落是要避免的,因为这会导致剂量超过预期以及溶液滴到非目标区域上。单次使用后,玻璃拭子由于玻璃破碎而可见地破裂。这使得在家里的患者不太可能尝试使用同一个玻璃拭子再次按后续剂量自我给药,用该SADBE-DMSO溶液再次自我给药来预防唇疱疹发病不在设计之中,因为已经证明,对手臂的单次给药可以在3个月或更长的时间内预防发病(Palli等人,Chang等人),并且对手臂的单次给药在该单次给药后引起显著的全身性免疫变化长达8周(McTavish等人)。此外,即使DMSO溶液中只存在少量的水,SADBE也是相当不稳定的,并且DMSO在暴露于空气后会从空气中吸收水分,因此在将包装破坏之后,不希望使用者重复使用容器,原因是SADBE的浓度将由于水分吸收到溶液中和水解而随时间推移明显下降。利用玻璃拭子中的乙酸丁酸纤维素阻隔层,提供了阻止重复使用的附加可见信号。在玻璃拭子破裂并且DMSO-SADBE溶液与乙酸丁酸纤维素接触后,乙酸丁酸纤维素层在约60分钟内从透明变为白色。阻隔层中的其他聚合物可能会具有相同的改变外观的属性,从而在与DMSO或免疫增敏剂的其他载体接触后表现为可见地损坏。
单独使用或与玻璃拭子组合使用的皮肤贴片也具有与玻璃拭子相同的优点:在施加的免疫增敏剂溶液的体积方面以及在施加该药物的皮肤面积方面,它促进了一致的给药。它还有助于避免递送过多的溶液,并且避免溶液从其施加的地方滴落而接触非目标区域(诸如手指)。该皮肤贴片还提供了一种基本上不能用于第二次给药的单次使用的施用装置,因此使得患者不太可能尝试用同一个贴片或者包含单个皮肤贴片和容纳液体或半液体局部免疫增敏剂溶液的容器(无论该容器是否为玻璃拭子)的同一个试剂盒多次给药。
实施方案
在该皮肤贴片的一个实施方案中,吸收纱布包含聚酯。
在皮肤贴片、玻璃拭子、试剂盒和方法的具体实施方案中,局部免疫增敏剂包括方形酸酯、二苯基环丙烯酮、1-氯-2,4-二硝基苯(DNCB)、1-氯-2,6-二硝基苯或漆酚。
在具体实施方案中,免疫增敏剂为SADBE。
在某些实施方案中,载体包括霜膏、乳液、丙酮、矿物油、石油凝胶、二甲基亚砜(DMSO)、丙酮、丙醇、异丙醇、正丁醇、异丁醇、乙醇或甲醇。在具体实施方案中,载体包括DMSO、丙酮、乙醇或异丙醇。在具体实施方案中,载体包含DMSO。在其他具体实施方案中,载体包括DMSO、甲醇、丙酮、乙醇、丙醇、异丙醇、丁醇、异丁醇、水,或它们的组合。
在具体实施方案中,载体为DMSO,并且局部免疫增敏剂为以0.1%至5%(重量/体积)溶解在DMSO中的SADBE。
在皮肤贴片的具体实施方案中,吸收纱布层永久性地附接到粘合剂背衬层(直接附接,或通过阻隔层间接附接)。
在其他具体实施方案中,吸收纱布层没有附接到粘合剂背衬层。
在玻璃拭子的具体实施方案中,该玻璃拭子包括一个或多个阻隔层,该阻隔层部分或完全包围玻璃安瓿,并且被适配成防止破裂的玻璃碎片和液体溶液穿透一个或多个阻隔层与握住玻璃拭子的人的皮肤接触,但不防止液体溶液流过泡沫顶端。
在特定实施方案中,阻隔层包括聚合物阻隔层,例如乙酸纤维素、乙酸丁酸纤维素、聚酯或聚乙烯。
在特定实施方案中,玻璃拭子包括部分或完全包围玻璃安瓿并密封到泡沫涂敷器顶端的聚合物阻隔层,其中该聚合物阻隔层被适配成防止破裂的玻璃碎片和液体溶液穿透该聚合物阻隔层与通过挤压使玻璃拭子破裂的人手指的皮肤接触。
在本发明的皮肤贴片、玻璃拭子、方法和试剂盒的具体实施方案中,载体选自DMSO、甲醇、丙酮、乙醇、丙醇、异丙醇、丁醇、异丁醇、水,以及它们的组合。
在本发明的皮肤贴片、玻璃拭子、方法和试剂盒的具体实施方案中,局部免疫增敏剂为方形酸酯(例如SADBE),并且载体为DMSO、甲醇、乙醇、丙醇、丁醇、异丙醇、异丁醇、丙酮,或它们的组合。
在本发明的皮肤贴片、玻璃拭子、方法和试剂盒的一个具体实施方案中,载体为DMSO,并且局部免疫增敏剂为SADBE。玻璃拭子对于这种组合是特别有利的,因为密封的玻璃安瓿提供了排除空气和水蒸气的永久性气密密封,并且玻璃安瓿可以填充氮气或另一种惰性气体或干燥空气来限制水蒸气,这种做法是有利的,因为DMSO会从空气中迅速获得水分—这必须避免,因为SADBE容易在水的作用下水解,而且在具有高含水量的DMSO溶液中不稳定。另外,DMSO是提取或溶解许多物质(包括许多聚合物)的优良溶剂,但玻璃完全耐受DMSO。
在玻璃拭子的具体实施方案中,一个或多个阻隔层包括纤维素聚合物层(例如,乙酸纤维素或乙酸丁酸纤维素)和/或硬纸板层。
在玻璃拭子的具体实施方案中,特别是在免疫增敏剂为SADBE或方形酸酯的情况下,该溶液具有小于100ppm的水,或更优选地小于50ppm、小于20ppm或小于10ppm的水。
在玻璃拭子的具体实施方案中,玻璃安瓿中的溶液仅与玻璃接触,直到玻璃安瓿破裂。
本发明的一个实施方案是一种制作本发明的玻璃拭子的方法,包括:(a)在干燥气氛下用分子筛处理载体(例如,DMSO或丙酮),以从载体去除水,从而产生干燥的载体;(b)在干燥气氛下将局部免疫增敏剂(例如,SADBE)溶解到干燥的载体中,以产生无水溶液;以及(c)将该无水溶液填充到玻璃安瓿中,然后密封玻璃安瓿以形成气密密封;其中该溶液仅与玻璃接触,直到气密密封被破坏。优选地,步骤(c)是在干燥气氛(例如,氮气、氩气或干燥空气)下将无水溶液填充到玻璃安瓿中,然后密封玻璃安瓿以形成气密密封。
本发明的一个实施方案提供了一种制作权利要求15所述的玻璃拭子的方法,包括:(a)(1)用分子筛(优选地在干燥气氛下)处理载体(例如,DMSO或丙酮),以从载体去除水,从而产生干燥的载体;将方形酸酯溶解到干燥的载体中(优选地在干燥气氛下),以产生无水溶液;或者(a)(2)将方形酸酯溶解到载体(例如,DMSO或丙酮)中以形成溶液,然后用分子筛处理溶液(优选地在干燥气氛下),以从载体去除水,从而产生无水溶液。该方法还包括(b)在干燥气氛(例如,氮气、氩气或干燥空气)下将该无水溶液填充到玻璃安瓿中,然后密封玻璃安瓿以形成气密密封;其中该安瓿中的无水溶液仅与玻璃接触,直到气密密封被破坏。
另一个实施方案提供了一种试剂盒,包括:(a)皮肤贴片,该皮肤贴片包括:粘合剂背衬层,该粘合剂背衬层包括织物,以及覆盖在织物的至少一部分面积上方的粘合剂;吸收纱布层,该吸收纱布层覆盖在粘合剂背衬层的一部分面积上方;以及(b)容纳液体或半液体溶液的密封容器,该溶液包含溶解在载体中的局部免疫增敏剂。
在试剂盒的具体实施方案中,该皮肤贴片还包括介于纱布层与粘合剂背衬层之间的阻隔层,其中该阻隔层是载体和局部免疫增敏剂不可渗透的。
在具体实施方案中,密封容器是本发明的玻璃拭子。密封容器还可以是另一种类型的容器,诸如带螺帽的塑料小瓶、带螺帽的玻璃小瓶,或者具有可以用手折断的颈部的密封塑料小瓶。
在试剂盒的具体实施方案中,密封容器被适配成由人不用工具而用手打开。
本发明的另一个实施方案提供了一种局部施加受控剂量的局部免疫增敏剂的方法,包括:将粘合剂皮肤贴片施加并粘附到人的皮肤上,该粘合剂皮肤贴片包括:背衬层,该背衬层包括织物,以及覆盖在织物的至少一部分面积上方的粘合剂;吸收纱布层,该吸收纱布层覆盖在背衬层的一部分面积上方;该吸收纱布层包含液体或半液体溶液,该溶液包含载体和溶解在该载体中的局部免疫增敏剂。
局部施加通常用于用局部免疫增敏剂对人进行医学治疗,诸如预防疱疹发作,或者治疗寻常疣。
在局部施加受控剂量的局部免疫增敏剂的具体实施方案中,该方法还包括在施加步骤之前,打开容纳含有载体和溶解在载体中的局部免疫增敏剂的液体或半液体溶液的单位剂量容器,然后将溶液施加到皮肤贴片的吸收纱布层,以形成包含含有载体和溶解在载体中的局部免疫增敏剂的液体或半液体溶液的吸收纱布层。在这种情况下,在将溶液施加到皮肤贴片的吸收纱布层的步骤之前,该吸收纱布层不含局部免疫增敏剂溶液。
实施例
实施例1
安慰剂对照的1期临床试验表明,在唇疱疹频繁发病的受试者中,SADBE延长了到
方法
结果。
一个计划的主要终点是最后一次治疗剂量后到唇疱疹下一次发病的天数。然而,28名接受了2.0%SADBE增敏的患者中,有16名没有经历另一次发病,因而在增敏后没有接受后续的治疗剂量。因此,我们分析了增敏剂量后到下一次发病的时间。在最后一次可用的随访日期,对增敏后未曾经历首次发病的患者的数据进行审查,并对Kaplan-Meier时间-事件曲线进行估计并作图(图3)。安慰剂组的中位事件发生时间为40天,与之相比,2.0%SADBE组的中位事件发生时间超过122天,差异具有高度显著性(P=0.009)。
除了1名患者在暴露于SADBE增敏剂量24小时后发生自体敏感性皮炎外,唯一记录的其他不良事件是增敏部位瘙痒和发红,这见于13名接受了2.0%SADBE的患者和2名接受了安慰剂的患者。
讨论。
实施例2
与HSV-1免疫控制相关的免疫特性以及方形酸二丁酯对唇疱疹频繁发作的受试者
简介:研究了免疫特性的差异,包括外周血单核细胞(PBMC)的免疫基因表达,唇疱疹与对1型单纯疱疹病毒(HSV-1)的免疫控制良好或较差的相关性(即,唇疱疹发作的频率),以及这些特性在用方形酸二丁酯(SADBE)给药后如何变化。
方法:从抗HSV-1IgG阳性并且在过去的12个月中唇疱疹频繁发病(自我报告在过去的12个月中发作6次或更多次)、很少发病(在过去的12个月中发作1次或2次)或没有发病的人收集PBMC。测试了PBMC针对HSV-1和真菌抗原(念珠菌属(Candida))的增殖,以及在HSV-1和念珠菌属存在下的免疫基因表达。在采血后第1天,在频繁发病的受试者的手臂上局部给药一次2%SADBE的DMSO溶液,在2周和8周后收集他们的PBMC并测试。
将棉签浸入1ml液体研究药物小瓶中,然后在上臂内侧被石油凝胶环绕的直径约10mm至15mm的区域上涂抹一个点,由此来施加剂量。施加后,用TEGADERM
结果:对其HSV-1感染的免疫控制良好(发病次数较少)的患者在以下方面不同于对HSV-1感染的免疫控制较差的患者:(1)PBMC在体外对一起考虑的HSV-1、受HSV-1感染的细胞提取物和念珠菌属的增殖更多(P<0.01)。
(2)在用加热灭活的HSV-1病毒刺激的体外PBMC中,干扰素γ(IFNG)和另外五种免疫相关基因的表达较高(P均<0.05),并且白介素-5(IL5)和另外两种免疫相关基因的表达较低(P均<0.05)。
频繁发病的受试者用SADBE治疗一次,56天后,这些受试者的PBMC与治疗前第1天从相同受试者采集的PBMC存在差异,差异之处与上文列出的对HSV-1的免疫控制良好和免疫控制较差的受试者之间的差异完全相同,且具有相同的显著性水平。然而,在施加这一剂量后2周,PBMC与第1天收集的PBMC在这些基因表达和增殖测量结果中的几乎任何方面均没有差异。因此,局部施加到手臂的单剂量2%SADBE的DMSO溶液诱导免疫系统变化需要超过2周但不到8周的时间。
结论:PBMC在存在HSV-1的情况下较高地表达干扰素γ(IFNG)并且较低地表达白介素-5(IL5)与唇疱疹发病次数较少相关,因而向唇疱疹频繁发病的受试者的手臂局部施加单剂量2%SADBE的DMSO溶液改善了在存在HSV-1病毒的情况下对HSV-1的免疫应答,方式为:除其他变化之外,增加了PBMC中的IFNG表达并且减少了PBMC中的IL5表达。(McTavish等人)
实施例3
单剂量方形酸二丁酯(SADBE)降低复发性唇疱疹受试者发病频率的2期、多中心、
在机构审查委员会批准和获取书面知情同意书后,本研究在五个中心对在过去12个月中出现四次或更多次唇疱疹发作的受试者进行了研究。受试者随机进行以下处理:(1)在第1天接受一剂2%SADBE的DMSO溶液,(2)在第1天接受2%SADBE,然后在第22天接受第二剂较低剂量(0.5%)的“加强剂”,或(3)仅在第1天和第22天接受二甲基亚砜(DMSO)载体。对所有受试者随访1年。
将棉签浸入盲法标记的1ml液体研究药物小瓶中,然后在上臂内侧被石油凝胶环绕的直径约10mm至15mm的区域上涂抹一个点,由此来施加剂量。施加后,用TEGADERM
入选的合格受试者(n=140)在过去12个月中的中位发病次数为6(平均值=7.8)。1剂量组在以下方面优于安慰剂组:到下一次发病的时间,从第43天至第121天(p=0.024)(图1);在第43天至第121天内的平均发病次数,1剂量组(0.231±0.125标准误差)对比安慰剂组(0.610±0.068)(p=0.011);以及在第43天至第121天内发病的受试者的比例,1剂量组(9/39=23%)对比安慰剂组(19/41=46%)(p=0.036)。中度发病或重度发病的平均次数在接受1剂SADBE的受试者中相比接受安慰剂的受试者也有所下降:在第43天至第121天内,1剂量组(0.128±0.339)对比安慰剂组(0.390±0.703)(p=0.04),以及在第1天至第365天内,1剂量组(0.641±0.931)对比安慰剂组(1.341±1.76)(p=0.04)。
值得注意的是,在这些相同的指标上,2剂量组优于安慰剂组,但优势并不显著。1剂量可能优于2剂量方案的原因仍有待研究,但我们假设,较低浓度的第二剂量可能“耐受”或下调由第一剂量中的2%SADBE所带来的免疫变化。
在SADBE治疗组中观察到的最大改善发生在本研究的第43天至第121天内。一个可能的原因也许是SADBE历时约6周对免疫系统发挥最大作用,但该作用在第一剂量后约3至4个月开始逐渐减弱。
最常见的不良事件类型是给药部位反应,这些反应都是轻度或中度的,并且都在3个月内消退,这表明对唇疱疹高频发病的受试者局部施加2%SADBE具有良好的风险-效益概况。
实施例4
一项非GLP研究,旨在评价猪模型施加SADBE皮肤贴片后的皮肤刺激可能性和残留
American Preclinical Services研究ID STUDY ID:JLM001-PH50
简介
将浓度为2%(w/v)的方形酸二丁酯(SADBE)的二甲基亚砜(DMSO)溶液添加到皮肤贴片中,用于经皮给药SADBE,以测试迟发型超敏反应或其他皮肤刺激,并且测试在不同体积和暴露时间下有多少SADBE从贴片中消失,因而推测其进入了皮肤。
本研究的一个目的是确定药物从皮肤贴片洗脱到皮肤中的时间过程。为此目的,将贴片施加到猪的皮肤,并在1、3、6或24小时后取下,然后提取以确定贴片中剩余的残留SADBE药物的量。从最初装载到贴片上的量中丢失的SADBE被推测已经转移到猪皮肤中。
另一个目的是评估即时的和延迟的皮肤刺激,包括给药后4周内猪皮肤上的红斑和水肿。
材料和方法
皮肤贴片由类似于带粘合剂的3M 9916聚酯非织造背衬层的聚合物背衬层、3M9733聚酯膜层压体阻隔层和Precision Fabrics Group 0700-00010聚酯纱布层组成。纱布热密封到阻隔层上。纱布贴片面积为约3cm
在指定的时间从猪身体上取下贴片,立即剪下贴片的储库部分,放入装有10mlDMSO的50ml试管中。
在取下贴片后,立即使用Kimwipe擦拭贴片之前在猪身体上所粘贴的点,以试图回收在皮肤表面上并且没有被皮肤吸收的任何SADBE。在用Kimwipe擦拭后,将Kimwipe置于装有10ml DMSO的单独的50ml试管中。
将装有DMSO与贴片或Kimwipe的试管送到我们的实验室,以200rpm摇动10分钟,然后将来自每根试管的DMSO放入进样小瓶中,通过HPLC在C18柱上分析SADBE含量,采用的程序为SADBE3-50ul。SADBE在该程序中在约24.0分钟洗脱,并在255nm处吸收,因此使用255nm处24.0分钟时的峰面积来定量SADBE。
HPLC程序的详细信息如下:
该程序在HPLC领域称为SADBE3-50ul,进样量为50ul。
色谱柱:USP L1(ODS),250mm×4.6mm,5um(C18)Agilent部件编号880995-902
流动相:A:25mM KH
B:甲醇
流速:1.0mL/min
波长:255nm,215nm
温度:室温
进样体积:50ul
梯度洗脱(表1)
结果
在2018年8月6日,将第一组贴片置于3只猪的身体上。用弹性绷带绕过贴片包裹在每只猪的躯干周围,来将贴片全部在猪身体上固定就位。结果在表2中示出。丢失的以及推测在皮肤中的SADBE的净HPLC面积计算为从20ul和50ul对照预测的面积减去从施加到皮肤的测试贴片提取的SADBE的观察到的HPLC面积。
表2.第1天的贴片的SADBE含量
/>
对照表明,从贴片回收SADBE是通过将贴片储库提取到10ml DMSO中的该程序完成的。
第2周
在2018年8月13日,对4号和5号猪进行了SADBE贴片测试。在这种情况下,两只猪的贴片上均覆盖有TEGADERM
表3. 2018年8月13日,贴片HPLC的SADBE面积
药物从贴片中洗脱的总结和结论
对于每个贴片,计算从贴片丢失因此假定转移到皮肤中的SADBE的百分比,对给定体积(装载到贴片上的2%SADBE溶液的体积)和时间点(贴片在猪身体上保留的时间)的结果进行平均,根据弹性绷带是否将贴片在猪身体上固定就位进行分解,再对结果进行平均。结果在下面的表4中示出。
表4.根据暴露时间、贴片上装载的体积以及是否使用弹性绷带将贴片固定到皮肤上,将SADBE转移到皮肤中的量进行平均。(需注意:转移到皮肤中的百分比等于100%减去取下贴片后仍在贴片中检测到的百分比。假设不再处于贴片中的所有药物都转移到皮肤中。)
SADBE从贴片转移到皮肤中的结论
弹性绷带增加了皮肤对药物的吸收。
在1至6小时的时间点,较大的体积得到略少或略低的药物转移百分比。但是转移到皮肤中的装载药物的百分比相比于转移到皮肤中的药物绝对体积更为一致。也就是说,体积从20ul增加到4倍即80ul并没有导致转移药物的百分比降至1/4。
截至6小时,超过80%的装载药物转移到皮肤中,测试了使用弹性绷带的所有装载体积。截至24小时,超过95%的装载药物转移到皮肤中。
皮肤刺激
皮肤刺激评分如表5所示。
每周在每个贴片施加部位进行3次评分,持续四周。
在施加和取下贴片后的任何时间,没有猪在任何药物施加部位出现水肿。因此,以下评分仅针对红斑。
每次单独施加贴片的红斑评分在表6中示出。所显示的评分是取下贴片时的红斑评分,后面是每个贴片部位每周3次评分中的最高值。
表6.
从表6中可以大致看出,红斑评分在第2周达到峰值,在第4周降至零。这在表7中示出,该表给出了对所有贴片和剂量以及取下贴片时的暴露时间,在第1周、第2周和第3周内的平均评分(对于这三周中的每个周,每个个体的最高评分的平均值)。这种迟发性红斑是迟发型超敏反应的特征,SADBE在人体中引起迟发型超敏反应是已知的。
表7.
如表8中所示,剂量体积越大并且贴片佩戴时间越长,红斑评分就越高。从20ul到50ul,红斑评分增加很大,但80ul剂量与50ul相比,红斑评分没有进一步增加。暴露3小时的红斑评分与暴露1小时的红斑评分相比显著增加,但暴露6小时和24小时的红斑评分与暴露3小时的红斑评分相比没有显著增加。
表8.
皮肤刺激数据的总结
猪表现出具有迟发型超敏反应特征的皮肤刺激,其中红斑随时间推移增加并在第2周达到峰值,然后截至第4周消退。没有猪在贴片施加部位出现水肿。红斑取决于剂量和暴露时间。
实施例5
豚鼠模型中的非GLP SADBE皮肤贴片剂量范围、皮肤刺激和毒性评价
目的/目标
测试制品
·方形酸二丁酯(SADBE)(2%、6%、18%,皮肤贴片)
·皮肤贴片(4.5cm×4.5cm的正方形),其由以下部件组成:
о背衬层,为3M医用胶带9916(3M公司,Saint Paul,MN,USA)(2.2oz/yd
о阻隔层,为3M 9733聚酯膜。
о纱布贴片,为Precision Fabrics PFG 0700-00010聚酯,面积约3cm
о40lb纸硅胶衬垫(分裂衬垫)
方法
取三十(30)只豚鼠(15只雌性和15只雄性)用于这项非GLP研究。在给药前和给药后(皮肤贴片装载20微升的2%、6%或18%SADBE药物溶液),记录体重、群体食物消耗量,以及给药部位的红斑、焦痂形成和水肿的Draize评分。将装载有SADBE的皮肤贴片施加到动物,使其保留在原处约12小时加/减1小时。在约12小时给药期后,通过Draize评分对贴片部位进行评估。在此期间,经由每周体重和每日群体食物消耗量观察动物在给药后以及在整个研究持续过程中每日的毒性迹象。在28天的评估期后,再次进行攻击,施加第二贴片(在诱导期期间未处理)并通过Draiz评分进行评估。
存活期结束时,收集血液进行标准的血液学和血清化学分析,然后对动物实施人道安乐死。在尸检时收集第二给药部位和颈部淋巴结用于进一步的组织病理学评价。移出给药部位,固定并包埋。对给药部位进行组织学检查,评价细胞类型的存在和发生的组织反应。
结果
经由皮肤贴片以任何测试剂量向豚鼠皮肤经皮施加SADBE对体重和食物消耗量均没有显著影响。
第一次用皮肤SADBE贴片施加2%SADBE有轻微刺激性。用2%SADBE再次攻击有中度刺激性。第一次用皮肤SADBE贴片施加6%SADBE有中度刺激性。用6%SADBE再次攻击有中度刺激性。第一次用皮肤SADBE贴片施加18%SADBE有严重刺激性。用18%SADBE再次攻击有中度刺激性。
在所有剂量下,观察到存在主要由淋巴细胞、浆细胞和巨噬细胞组成的多灶性罕见至轻度炎性细胞浸润,并且这种浸润在给药部位内聚积。此外,在所有经SADBE治疗的部位均观察到轻度至中度的角化不全、轻微多灶性坏死和脂肪浸润。与2%至6%不同,在18%SADBE时,在治疗部位观察到轻微多灶性坏死、中等厚度的纤维结缔组织带和多灶性轻度新血管形成,这可能是毒性效应。在所有SADBE治疗组中,两只动物的颈部淋巴结切片和腹股沟淋巴结切片均在正常限度内。
对装载有SADBE的贴片的生物分析结果表明,SADBE在不暴露于动物皮肤时在贴片中稳定超过12小时,没有明显的SADBE丢失,也没有SADBE转化成降解产物SAMBE。对动物皮肤上暴露12小时后的贴片进行分析,结果显示,大部分SADBE从贴片丢失,因此推测已进入豚鼠皮肤。
皮肤刺激和迟发型超敏反应
在本研究的每一天观察测试部位的皮肤刺激,并且通过红斑与焦痂和水肿两者的Draize量表进行评分。表9和表10列出了每一项的等级,均为0至4级。累积红斑与焦痂和水肿评分是主要刺激指数评分,因此该评分为0至8级。
表9:红斑与焦痂形成的Draize量表
贴片测试反应分级量表
表10:水肿形成的Draize量表
贴片测试反应分级量表
为了评估测试制品SADBE(在DMSO中为2%、6%和18%)对豚鼠皮肤刺激可能性和敏感性的影响,将Draize评分系统用于对红斑和焦痂反应以及对水肿进行给药部位评价。将测试制品(20ul)装载到皮肤贴片上,然后施加于剃毛的豚鼠皮肤,维持12小时(诱导期)。第一给药部位评价在施加后30天进行。施加第二剂,也进行了给药部位评价,持续约5周(攻击阶段)。
计算了每个测试制品剂量的主要刺激指数(pII),以评估刺激可能性。主要刺激指数(pII)是主要刺激评分的平均值。主要刺激评分是红斑/焦痂评分和水肿评分的总和,其导致最大刺激可能性为8。计算了研究过程中每个测试制品剂量的每日主要刺激指数(pII)(图4)。pII用于将测试制品治疗的刺激可能性分类为可忽略不计至无刺激(0至0.9)、轻微(0.9至1.9)、中度(2至4.9)或严重(5至8)。根据该量表,2%SADBE在第一剂后有轻微刺激性,在第二剂后有中度刺激性;6%SADBE在两剂后都有中度刺激性;18%SADBE在第一剂后有严重刺激性,在第二剂后有中度刺激性。(图4)
在诱导时,在28天观察期期间,测试的SADBE最低剂量即2%SADBE显示对剃毛豚鼠皮肤的轻微皮肤刺激持续超过约17天。当在未用过的部位用2%SADBE再次攻击相同的豚鼠时,皮肤刺激达到轻微至中度水平,持续约5天,并在施加于皮肤后约9天恢复至无刺激水平。
在诱导时,在28天观察期期间,6%SADBE显示持续约18天的中度皮肤刺激,截至约23天恢复至轻微刺激和无刺激水平。当在未用过的部位用6%SADBE再次攻击相同的豚鼠时,皮肤刺激达到中度水平,在约5天时达到峰值,并在施加于皮肤后约14天恢复至无刺激水平。
在诱导时,在28天观察期期间,测试的SADBE最高浓度即18%SADBE显示持续约21天的对剃毛豚鼠皮肤的中度至严重皮肤刺激,截至给药后约27天恢复至轻微刺激和无刺激水平。当在未用过的部位用18%SADBE再次攻击相同的豚鼠时,皮肤刺激达到中度水平,在约8天时达到峰值,并在施加于皮肤后约19天恢复至无刺激水平。
动物健康结果
概括地说,评估了体重、食物消耗量、临床监测结果和临床病理学结果。在研究期间,在经皮以任何测试剂量施加测试制品后的任何时间,豚鼠体重均未受到影响。在研究期间,在经皮施加测试制品后的任何时间,食物消耗量也均未受到影响。临床监测观察结果未揭示任何显著的异常。
组织病理学结果
所有组织样品组织学载玻片均由研究病理学家使用光学显微镜检查。
雌性经治疗的皮肤部位(第1组;2%SADBE贴片):
所有动物的腋窝淋巴结切片和腹股沟淋巴结切片均在正常限度内。
在第118037号动物中,肠系膜淋巴结的皮髓质区存在轻度多灶性出血,这与肉眼尸检发现的斑驳暗红色变色相关联。
雄性经治疗的皮肤部位(第1组;2%SADBE贴片)
对5个治疗皮肤部位进行评分。在真皮中存在主要由巨噬细胞组成的多灶性罕见炎性细胞浸润。未观察到坏死、新血管形成、纤维化和脂肪浸润。
第116050号动物的右侧腋窝淋巴结皮质中存在轻度多灶性出血,这与肉眼尸检发现的深红色变色相关联。剩余动物的腋窝淋巴结切片和腹股沟淋巴结切片均在正常限度内。
雌性经治疗的皮肤部位(第2组;6%SADBE贴片):
对5个治疗皮肤部位进行评分。在真皮中存在主要由淋巴细胞、浆细胞和巨噬细胞组成的多灶性罕见至轻度炎性细胞浸润。在第117356、117353和117367号动物中观察到纤维结缔组织窄带。未观察到坏死、新血管形成和脂肪浸润。
第117356号动物的右侧腋窝淋巴结髓质中存在轻度多灶性出血,这与肉眼尸检发现的深红色变色相关联。剩余动物的腋窝淋巴结切片和腹股沟淋巴结切片均在正常限度内。在第118849号动物中,肠系膜淋巴结的皮髓质区存在轻度多灶性出血,这与肉眼尸检发现的斑驳暗红色变色相关联。
雄性经治疗的皮肤部位(第2组;6%SADBE贴片)
对5个治疗皮肤部位进行评分。在真皮中存在主要由浆细胞和巨噬细胞组成的多灶性罕见至轻度炎性细胞浸润。未观察到坏死、新血管形成、纤维化和脂肪浸润。
第116105号动物的右侧腹股沟淋巴结皮质中存在轻度多灶性出血,这与肉眼尸检发现的深红色变色相关联。剩余动物的腋窝淋巴结切片和腹股沟淋巴结切片均在正常限度内。
雌性经治疗的皮肤部位(第3组;18%SADBE贴片)
对5个治疗皮肤部位进行评分。在真皮中存在主要由淋巴细胞、浆细胞和巨噬细胞组成的多灶性罕见至轻度炎性细胞浸润。在第119069号动物中观察到中等厚度的纤维结缔组织带。观察到轻微多灶性坏死和新血管形成。未观察到脂肪浸润。
所有动物的腋窝淋巴结切片和腹股沟淋巴结切片均在正常限度内。
雄性经治疗的皮肤部位(第3组;18%SADBE贴片)
对5个治疗皮肤部位进行评分。在真皮中存在主要由淋巴细胞、浆细胞和巨噬细胞组成的多灶性罕见至重度炎性细胞浸润。在第116102、116048和117906号动物中观察到纤维结缔组织的窄带至中等厚度带。观察到轻微多灶性坏死和轻度多灶性新血管形成。未观察到脂肪浸润。
第116048号动物的右侧和左侧腋窝淋巴结皮质中存在轻度多灶性出血,这与肉眼尸检发现的深红色变色相关联。剩余动物的腋窝淋巴结切片和腹股沟淋巴结切片均在正常限度内。
生物分析结果
American Preclinical Services研究ID STUDY ID:JLM002-PH00
简介
将浓度为2%(w/v)的方形酸二丁酯(SADBE)的二甲基亚砜(DMSO)溶液添加到皮肤贴片中,用于经皮给药SADBE,以测试迟发型超敏反应或其他皮肤刺激。在Squarex实验室进行了HPLC分析,目的是分析由APS制备的给药制剂中的SADBE含量,确定在施加时间期间皮肤贴片中的测试制品的稳定性,以及在向动物施加12小时后测试皮肤贴片中的残留SADBE。
材料和方法
皮肤贴片由类似于带粘合剂的3M 9916聚酯非织造背衬层的聚合物背衬层、3M9733聚酯膜层压体阻隔层和Precision Fabrics Group 0700-00010聚酯纱布层组成。纱布热密封到阻隔层上。纱布贴片面积为1.53cm
在指定的时间从猪身体上取下贴片,立即剪下贴片的储库部分,放入装有10mlDMSO的50ml试管中。
将装有DMSO与贴片的试管送到Squarex实验室,以200rpm摇动1小时或更长时间,然后将来自每根试管的DMSO放入进样小瓶中,通过HPLC在C18柱上分析SADBE含量,采用的程序为SADBE3-50ul。SADBE在该程序中在约24.0分钟洗脱,并在255nm处吸收,因此使用255nm处24.0分钟时的峰面积来定量SADBE。SADBE降解产物方形酸单丁酯(SAMBE)也通过在12.7分钟的洗脱时间处的255nm曲线下面积来定量。
HPLC程序的详细信息如下:
该程序在HPLC领域称为SADBE3-50ul,进样量为50ul。
色谱柱:USP L1(ODS),250mm×4.6mm,5um(C18)Agilent部件编号880995-902
流动相:A:25mM KH
B:甲醇
流速:1.0mL/min
波长:255nm,215nm
温度:室温
进样体积:50ul
梯度洗脱(表11)
结果
表12示出了由APS制备的小瓶的测试制品分析结果。装有2%、6%和18%SADBE的DMSO溶液的测试制品小瓶符合规范,并且在制备后24小时具有预测的SADBE浓度。
表2.
表13示出了装载有20ul 2%、6%或18%SADBE的贴片在将左侧纱布朝上置于空气中12小时24小时之后的分析结果。结果表明,SADBE在不暴露于动物皮肤时在贴片中稳定超过12小时。没有明显的SADBE丢失,也没有SADBE转化成SAMBE。
表13.
表14示出了在豚鼠身体上放置12小时之后收集的贴片中剩余的SADBE和SAMBE降解产物的量,其为对于所施加的每个SADBE百分比,10只动物上的10个贴片的平均值。
表14
结果显示,对于2%贴片,少于2%的起始SADBE保留在贴片中,并且丢失SADBE中仅有12%被检测为仍在贴片上的SAMBE降解产物。因此,几乎所有SADBE均明显转移到豚鼠皮肤中。
对于6%贴片,平均有11%的SADBE留在贴片上,而对于18%贴片,平均有34%的SADBE留在贴片上。因此,随着SADBE浓度增加,转移到皮肤中的效率降低,但是大部分SADBE仍然从贴片丢失,推测转移到皮肤中,即便对于18%SADBE贴片也是如此。
结论
在所有剂量下,在给药后以及在整个研究持续过程中每日均没有观察到全身毒性的迹象,但观察到了一定程度的皮肤毒性。所测试的SADBE最低浓度(2%)在第一剂后(延迟几天)有轻微刺激性,并且在再次攻击时有中度刺激性,如通过皮肤刺激的主要刺激指数(pII)给出的评分所指示。所测试的最高浓度(18%)在第一剂后有严重刺激性,在再次攻击后有中度刺激性。SADBE在2%至18%的浓度下在豚鼠中表现出皮肤刺激可能性,因而是皮肤刺激剂和皮肤增敏剂。
实施例6
哥廷根小型猪模型中的非GLP SADBE皮肤贴片剂量范围、皮肤刺激和毒性评价
目的/目标
本非GLP研究的目的是评价经由皮肤贴片递送的各种浓度的SADBE对给药部位刺激和毒性终点的影响,其中毒性终点诸如体重、群体食物消耗量、临床观察结果、处死前临床病理学、总体和组织病理学。
测试制品
·方形酸二丁酯(SADBE)(在DMSO中为2%、6%、18%溶液,皮肤贴片)
·皮肤贴片(4.5cm×4.5cm的正方形),其由以下部件组成:
о背衬层,为3M医用胶带9916(3M公司,Saint Paul,MN,USA)(2.2oz/yd
о阻隔层,为3M 9733聚酯膜。
о纱布贴片,为Precision Fabrics PFG 0700-00010聚酯,面积约3cm
о40磅纸硅胶衬垫(分裂衬垫)
方法
本非GLP研究共使用6只哥廷根小型猪(3只雌性,3只雄性)。在给药前,记录基线体重、群体食物消耗量,以及在未来给药部位的红斑和焦痂形成以及水肿的Draize评分(参见表1和表2)。将装载有20微升的2%、6%或18%SADBE药物溶液的皮肤贴片(1个贴片/动物)施加到动物,使其保留在原处约12小时。在约12小时给药期后,如实施例5中那样通过Draize评分对贴片部位进行评估,5x/周,持续21天。在此期间,经由每周体重和每周群体食物消耗量观察动物在给药后以及在整个研究持续过程中每日的毒性迹象。在25天评估期后,再次攻击动物,之后是持续30天的第二个给药和评估期。存活期结束时,对动物实施人道安乐死,然后进行了完全尸检。在施加贴片后收集了用于制备贴片的测试制品小瓶和暴露于小型猪的贴片,以便在Squarex实验室中使用HPLC测定SADBE和SADBE降解产物方形酸单丁酯(SAMBE)的含量。
移出给药部位,固定并包埋。对给药部位进行组织学检查,评价细胞类型的存在和发生的组织反应。
结果
经由皮肤贴片以任何剂量向小型猪皮肤施加SADBE对体重和食物消耗量均没有显著影响,表明测试制品没有诱导任何显著的全身毒性。动物在给药后以及在整个研究持续过程中每日均没有显示出任何显著的毒性迹象。
第一次经由皮肤贴片向小型猪皮肤施加2%SADBE有中度刺激性。用2%SADBE再次攻击有中度至严重刺激性。
第一次经由皮肤贴片向小型猪皮肤施加6%SADBE有中度刺激性。用6%SADBE再次攻击有中度至严重刺激性。
第一次经由皮肤贴片向小型猪皮肤施加18%SADBE有中度至严重刺激性。用18%SADBE再次攻击有严重刺激性。
在全部测试剂量(2%至18%)下,SADBE在初始剂量下均有中度刺激性,并且在小型猪的皮肤上显示出皮肤刺激。所测试的SADBE最高浓度(18%)在用第二剂再次攻击时有严重刺激性。因此,SADBE是一种皮肤刺激剂和增敏剂。
在所有剂量下,在给药部位的真皮中观察到主要由淋巴细胞、浆细胞和巨噬细胞组成的多灶性罕见至轻度炎性细胞浸润。此外,在所有经SADBE治疗的部位均观察到轻度至中度的角化不全、轻微多灶性坏死和脂肪浸润。在检查的任何组织切片中均未观察到新血管形成和纤维化。
在所有SADBE治疗组中,两只动物的颈部淋巴结切片和腹股沟淋巴结切片均在正常限度内。
对装载有SADBE的贴片的生物分析结果表明,SADBE在不暴露于动物皮肤时在贴片中稳定超过12小时,没有明显的SADBE丢失,也没有SADBE转化成降解产物SAMBE。SADBE从施加于小型猪的贴片丢失,因此推测已进入小型猪的皮肤。
皮肤刺激和迟发型超敏反应
在本研究的每一天观察测试部位的皮肤刺激,并且通过红斑与焦痂和水肿两者的Draize量表进行评分。实施例5中的表9和表10列出了每一项的等级,均为0至4级。累积红斑与焦痂和水肿评分是主要刺激指数评分,因此该评分为0至8级。
计算了研究过程中每个测试制品剂量的每日主要刺激指数(pII)(图5)。pII用于将测试制品治疗的刺激可能性分类为可忽略不计至无刺激(0至0.9)、轻微(0.9至1.9)、中度(2至4.9)或严重(5至8)。根据该量表,2%SADBE在第一剂后达到中度刺激水平(pII约3.5),并且在第二剂后有中度至严重刺激性(pII出现瞬时峰值5);6%SADBE在第一剂后达到中度刺激水平(pII约3.0至4.0),并且在第二剂后有中度至严重刺激性(pII出现瞬时峰值5.5)。18%SADBE在第一剂后有中度至严重刺激性(pII约5.0),并且在第二剂后有严重刺激性(pII约6)。
在诱导时,在25天观察期期间,测试的SADBE最低剂量即2%SADBE显示对剃毛小型猪皮肤的中度皮肤刺激持续超过约15天。当在未用过的部位用2%SADBE再次攻击相同的小型猪时,观察到严重的皮肤刺激,该严重刺激持续约1至2天,然后达到中等水平,持续约17天,并在施加于皮肤后约22天恢复至无刺激水平。
在诱导时,在28天观察期期间,6%SADBE也显示对剃毛小型猪皮肤的中度皮肤刺激持续约21天。当在未用过的部位用6%SADBE再次攻击相同的小型猪时,观察到严重的皮肤刺激,该严重刺激持续1天,然后达到中等水平,持续约19天,并在施加于皮肤后约22天恢复至无刺激水平。
在诱导时,在28天观察期期间,测试的18%SADBE(即最高浓度)显示对剃毛小型猪皮肤的中度至严重皮肤刺激持续约22天。当在未用过的部位用18%SADBE再次攻击相同的小型猪时,观察到严重的皮肤刺激,该严重刺激持续约5天,然后达到中等水平,持续约24天,并在施加于皮肤后约26天恢复至无刺激水平。
动物健康结果
概括地说,评估了体重、食物消耗量、临床监测结果和临床病理学结果。所有评估均表明,动物并未由于施加SADBE而经历任何显著的毒性。
肉眼尸检结果
尸检时未观察到任何异常。
组织病理学结果
所有动物的颈部淋巴结切片和腹股沟淋巴结切片均在正常限度内。
在不存在对照(未经治疗的)部位时,没有计算测试制品相对评分。
组织样品组织学载玻片(H&E)由研究病理学家使用光学显微镜检查。用2%和6%SADBE给药的动物的经治疗皮肤部位揭示了在真皮中存在主要由淋巴细胞、浆细胞和巨噬细胞组成的多灶性罕见至轻度炎性细胞浸润。然而,在使用18%SADBE时,经治疗皮肤部位揭示了在真皮中存在主要由淋巴细胞、浆细胞和巨噬细胞组成的多灶性罕见至重度炎性细胞浸润。在检查的所有切片中均存在轻度至中度的角化不全。所有动物的颈部淋巴结切片和腹股沟淋巴结切片在所有剂量下均在正常限度内。
分析结果
American Preclinical Services研究ID STUDY ID:JLM003-PH00
简介
将浓度为2%(w/v)的方形酸二丁酯(SADBE)的二甲基亚砜(DMSO)溶液添加到皮肤贴片中,用于经皮给药SADBE,以测试迟发型超敏反应或其他皮肤刺激。在Squarex实验室进行了HPLC分析,目的是分析由APS制备的给药制剂中的SADBE含量,确定在施加时间期间皮肤贴片中的测试制品的稳定性,以及在向动物施加12小时后测试皮肤贴片中的残留SADBE。
材料和方法
皮肤贴片由类似于带粘合剂的3M 9916聚酯非织造背衬层的聚合物背衬层、3M9733聚酯膜层压体阻隔层和Precision Fabrics Group 0700-00010聚酯纱布层组成。纱布热密封到阻隔层上。纱布贴片面积为1.53cm
在指定的时间从猪身体上取下贴片,立即剪下贴片的储库部分,放入装有10mlDMSO的50ml试管中。
将装有DMSO与贴片的试管送到Squarex实验室,以200rpm摇动30分钟至过夜,然后将来自每根试管的DMSO放入进样小瓶中,通过HPLC在C18柱上分析SADBE含量,采用的程序为SADBE3-50ul。SADBE在该程序中在约24.0分钟洗脱,并在255nm处吸收,因此使用255nm处24.0分钟时的峰面积来定量SADBE。SADBE降解产物方形酸单丁酯(SAMBE)也通过在12.7分钟的洗脱时间处的255nm曲线下面积来定量。
HPLC程序的详细信息如下:
该程序在HPLC领域称为SADBE3-50ul,进样量为50ul。
色谱柱:USP L1(ODS),250mm×4.6mm,5um(C18)Agilent部件编号880995-902
流动相:A:25mM KH
B:甲醇
流速:1.0mL/min
波长:255nm,215nm
温度:室温
进样体积:50ul
梯度洗脱(表15)
结果
表16示出了由APS制备的小瓶的测试制品分析结果。装有2%、6%和18%SADBE的DMSO溶液的测试制品小瓶符合规范,并且在制备后24小时具有预测的SADBE浓度。
表16.
表17示出了装载有20ul 2%或6%SADBE的贴片在将左侧纱布朝上置于空气中12小时24小时之后的分析结果。结果表明,SADBE在不暴露于动物皮肤时在贴片中稳定超过12小时。没有明显的SADBE丢失,也没有SADBE转化成SAMBE。
表17.
表18示出了在小型猪身体上放置12小时之后收集的贴片中剩余的SADBE和SAMBE降解产物的量。
结果显示,对于2%贴片,约11%的起始SADBE保留在贴片中,并且起始SADBE中少于1%被检测为仍在贴片上的SAMBE降解产物。因此,约89%的SADBE明显转移到小型猪皮肤中。
对于6%贴片和18%贴片,起始SADBE量中保留在贴片上的SADBE百分比增加。对于6%贴片,35%的起始SADBE保留在贴片上;而对于18%贴片,65%的起始SADBE保留在贴片上。因此,在6%贴片中,大多数SADBE离开了贴片,而在18%贴片中,约1/3SADBE离开了贴片,但从贴片丢失的SADBE的绝对量仍在增加,因此推测随着贴片上装载的SADBE的浓度增加,从贴片丢失的SADBE已进入皮肤,尽管丢失和推测转移到皮肤中的量以比贴片上装载的浓度减少的比例稍小的比例增加。
结论
在所有剂量下,在给药后以及在整个研究持续过程中每日均没有观察到全身毒性的迹象,但观察到了皮肤毒性。
所测试的所有SADBE浓度(2%至18%)在第一剂后(延迟几天)有中度刺激性,并且在再次攻击时有中度至严重刺激性,如通过皮肤刺激的主要刺激指数(pII)给出的评分所指示。所测试的最高浓度(18%)在第一剂后有中度刺激性,在再次攻击后有严重刺激性。SADBE在2%至18%的浓度下在小型猪中表现出皮肤刺激可能性,因而是皮肤刺激剂和皮肤增敏剂。
实施例7
装有皮肤贴片和填充DMSO的玻璃拭子的试剂盒
我们从James Alexander Corp.(Blairstown,NJ,USA)购买了填充0.6ml DMSO的0.6ml玻璃拭子。玻璃拭子如图2所示,其具有密封的玻璃安瓿(长45mm,内径5mm)和聚烯烃平顶拭子(高10mm),包裹在乙酸丁酸纤维素阻隔层中,并且具有可移除的硬纸板套管。
我们从Innovize Corp.(Vadnais Heights,MN,USA)购买了两种设计的定制皮肤贴片。这些皮肤贴片如图1所示,其组成元件如下:
·皮肤贴片(4.5cm×4.5cm的正方形),其由以下部件组成:
о背衬层,为3M医用胶带9916(3M公司,Saint Paul,MN,USA)(2.2oz/yd
о阻隔层,为3M 9733聚酯膜。
о纱布贴片,为Precision Fabrics PFG 0700-00000聚酯,面积约3cm
о40磅纸硅胶衬垫(分裂衬垫)
皮肤贴片的第2种设计是相同的,只不过纱布由Precision Fabrics Group PFG0700-00010组成。
发明人用手压碎小瓶,然后将其翻转并轻轻挤压一次,让重力发挥作用。在不到1分钟内,泡沫顶端变湿,该顶端在被轻搽或擦拭到皮肤贴片的纱布上时可以开始将贴片润湿。发明人将泡沫顶端轻搽到纱布上,直到纱布在其面积的约90%上可见地湿润。在即将添加DMSO之前以及添加DMSO后立即对贴片称重,以获得所施加的DMSO的净重。
纱布0700-00010
用单独的0700-00010贴片第二次操作。41.6mg,达到完全润湿。48.7mg,在轻搽下尽可能地润湿。加一滴液体,此时的重量为85mg。这一滴液体被吸收;没有滴落。
具有0700-00000织物的贴片
用单独的0.700-00000贴片第二次操作,在31mg时通过轻搽达到100%可见地润湿。
新的00000材料具有比00010材料更锐利的润湿边界,因此更容易看到湿润的区域。00010材料芯吸更多,这可能是边界看起来既不锐利也不清晰的原因。00010纱布可以完全吸收液滴,但00000纱布在贴片以竖直取向放置时却无法不滴落液滴。
参考文献
Palli MA,McTavish H,Kimball A,Horn TD.Immunotherapy of RecurrentHerpes Labialis With Squaric Acid.JAMA Dermatol.2017;153:828-829.
McTavish H,Zerebiec KW,Zeller JC,Shekels LL,Matson MA,Kren BT.Immunecharacteristics correlating with HSV-1immune control and effect of squaricacid dibutyl ester on immune characteristics of subjects with frequent herpeslabialis episodes.Immun.Inflamm.Dis.2019;7(1):22-40.
Chang ALS,Honari G,Guan L,Zhao L,Palli MA,Horn TD,Dudek AZ,McTavishH.A phase 2,multi-center,placebo-controlled study of single dose squaric aciddibutyl ester(SADBE)to reduce frequency of outbreaks in subjects withrecurrent herpes labialis.J Am Acad Dermatol.2020Apr 11:S0190-9622(20)30561-2.doi:10.1016/j.jaad.2020.04.021.
Buckley DA,Du Vivier AWP.The therapeutic use of topical contactsensitizers in benign dermatoses.British Journal of Dermatology 2001;145:385-405.
Lee AN,Mallory SB.Contact immunotherapy with squaric aciddibutylester for the treatment of recalcitrant warts.J Am Acad Dermatol 1999;41:595-599.
所有引用的参考文献据此以引用方式并入。
