一种基于APS为活性磺酸供体的合成和再生系统的构建方法
文献发布时间:2024-01-17 01:20:32
技术领域
本发明涉及一种基于APS为活性磺酸供体的合成和再生系统的构建方法,属于生物技术领域。
背景技术
APS(腺苷-5′-磷酰硫酸,adenosine-5′-phosphosulfate)是PAPS的前体,由ATP硫酸化酶(ATPS,EC 2.7.7.4)催化ATP和硫酸根合成,并生成副产物PPi。通常认为PAPS是唯一通用的活性磺酸供体,本课题组在前期工作中猜想并验证了APS也是通用的活性磺酸供体。利用APS作为一个新的活性磺酸供体,比PAPS更有优势,其反应步骤更少,且副产物是AMP可直接通过聚磷酸激酶生成ATP,再生路径更短。
以APS为磺酸供体,构建磺酸修饰体系,应用至多糖类(肝素、硫酸软骨素)、肽类(水蛭素)、黄酮类(柚皮素)、植物次级代谢产物(葡萄糖甙)和激素(雌激素)等多种磺基产物的合成,具有十分重大的意义。
发明内容
本发明提供了腺苷5′-磷酰硫酸再生的方法,以AMP,ADP或ATP中的任一物质为底物,在磺基转移酶、聚磷酸激酶和ATP硫酸化酶的参与下合成APS。
在一种实施方式中,所述方法以ATP和硫酸盐为底物,催化合成APS。
在一种实施方式中,所述ATP硫酸化酶的氨基酸序列如SEQ ID NO.1~4任一所示。
在一种实施方式中,所述聚磷酸激酶的氨基酸序列如SEQ ID NO.9~13任一所示。
在一种实施方式中,所述方法还有焦磷酸酶参与,所述焦磷酸酶的氨基酸序列如SEQ ID NO.5~8任一所示。
在一种实施方式中,所述方法以聚磷酸polyP
在一种实施方式中,催化合成APS的催化体系中缓冲液为10~50mM Tris-HCl,pH为6.0~8.0,添加2~20mM ATP、1~5mM硫酸镁、10-200mM硫酸钠,0.5~1.0mg/mL ATP硫酸化酶、磺酸化酶和聚磷酸激酶。
在一种实施方式中,所述磺基转移酶包括硫酸软骨素A磺酸转移酶(氨基酸序列如SEQ ID NO.14所示)、肝素N磺酸化转移酶(氨基酸序列如SEQ ID NO.15所示)、海藻糖磺酸转移酶(氨基酸序列如SEQ ID NO:13所示)或雌激素磺酸转移酶(氨基酸序列如SEQ ID NO:16所示)。
在一种实施方式中,所述磺基转移酶还在出发序列的基础上进行了突变,所述突变包括但不限于:
(1)将第143位精氨酸突变为半胱氨酸;
(2)将第152位丝氨酸氨酸突变为脯氨酸;
(3)将第154位色氨酸氨酸突变为天冬酰胺。
本发明还提供了APS循环再生系统,所述APS循环再生系统具有将APS催化合成AMP,将AMP催化合成ATP,将ATP催化合成APS从而构成闭环的循环催化反应过程;所述催化反应过程在酶的催化作用下完成。
在一种实施方式中,所述酶包括磺基转移酶、聚磷酸激酶和ATP硫酸化酶。
在一种实施方式中,所述酶为磺基转移酶、聚磷酸激酶、焦磷酸酶和ATP硫酸化酶。
在一种实施方式中,所述磺基转移酶还具有如下至少一种突变:
(1)将第143位精氨酸突变为半胱氨酸;
(2)将第152位丝氨酸氨酸突变为脯氨酸;
(3)将第154位色氨酸氨酸突变为天冬酰胺。
在一种实施方式中,所述ATP硫酸化酶的氨基酸序列如SEQ ID NO.1~4任一所示;所述聚磷酸激酶的氨基酸序列如SEQ ID NO.9~13任一所示;所述焦磷酸酶的氨基酸序列如SEQ ID NO.5~8任一所示。
在一种实施方式中,所述APS循环再生系统以细胞为载体。
在一种实施方式中,所述细胞包括但不限于可表达磺基转移酶、聚磷酸激酶和ATP硫酸化酶中至少一种酶的微生物细胞。
在一种实施方式中,所述APS循环再生系统是含有磺基转移酶、聚磷酸激酶和ATP硫酸化酶的组合物。
在一种实施方式中,所述APS循环再生系统还含有聚磷酸polyP
在一种实施方式中,所述硫酸盐包括但不限于硫酸镁或硫酸钠。
在一种实施方式中,所述硫酸盐的含量为2~200mM。
本发明还提供所述APS循环再生系统在磺酸化产品合成中的应用。
在一种实施方式中,所述磺酸化产品包括不限于肝素、硫酸软骨素、水蛭素或黄酮。
在一种实施方式中,所述催化反应温度为20~40℃,催化时间为24~72h。
本发明提供了腺苷-5′-磷酰硫酸(APS)在作为新的通用活性磺酸供体中的应用。
在一种实施方式中,所述应用是将APS向AMP的转化反应用于磺酸化合物的催化生产过程。
本发明还提供所述方法在提高腺苷5′-磷酰硫酸再生循环次数或在合成磺酸产品中的应用。
有益效果:
1、本发明通过验证APS为新的活性磺酸基供体,实现了更短步骤的磺酸供体合成和更短步骤的再生,大大降低了磺酸化修饰反应的成本,并成功完成了成功在肝素、硫酸软骨素和磺酸海藻糖等磺酸化修饰合成。
2、本发明通过在APS合成体系中加入副产物焦磷酸的水解酶,大大提高了APS的合成效率。
3、本发明通过修饰磺酸转移酶中的3'PB motif(3'-磷酸结合位点),提高磺基转移酶对APS的亲和力,提高APS的利用率,进而提高APS再生循环的磺酸化修饰效率。
附图说明
图1是APS和PAPS的结构区别。
图2是APS作为磺酸供体修饰合成磺酸化产品。
图3是不同来源ATP硫酸化酶的比酶活。
图4是不同来源焦磷酸酶的比酶活。
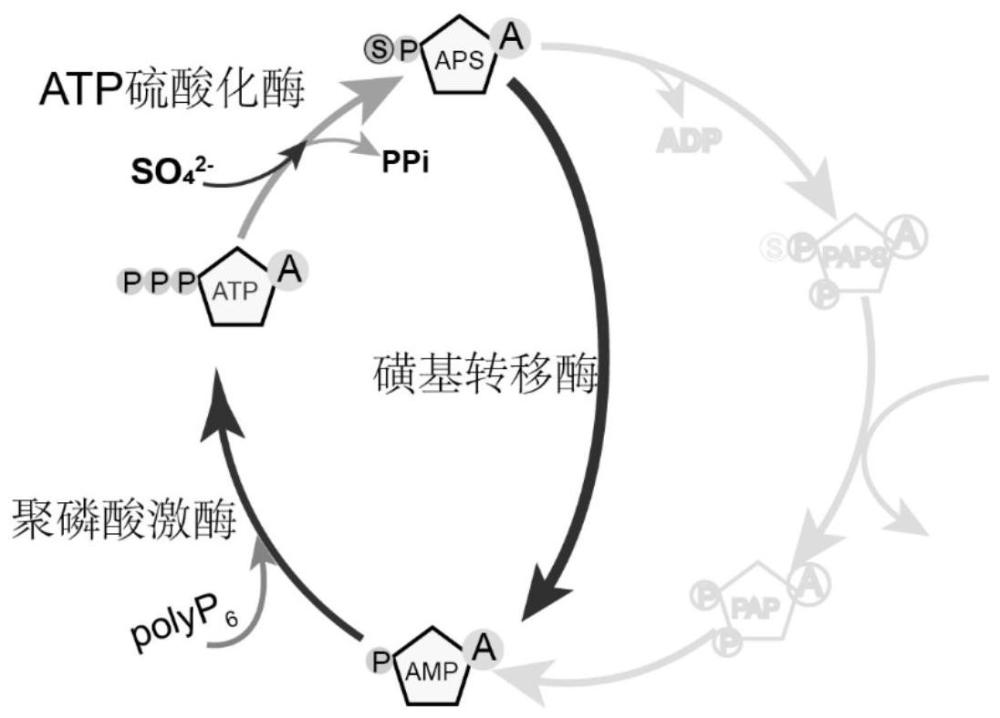
图5是APS循环再生系统示意图。
图6是不同来源聚磷酸激酶的比活力。
图7是APS循环再生系统用于磺酸产品修饰的循环次数。
图8是不同磺基转移酶的3'PB位置定位。
图9是海藻糖磺酸转移酶的3'PB位置突变体的相对酶活。
具体实施方式
1.Escherichia coli BL21(DE3)、pET28a(+)为实验室保藏。
2.质粒构建试剂及测序验证均在上海生物生工公司购买和完成。
3.各种分析纯试剂购自国药集团,APS分析品在sigma购买。
4.培养基:
LB培养基:10g/L NaCl,10g/L胰蛋白胨,5g/L酵母粉。
TB培养基,2.31g/L KH
蛋白表达:将含有编码目的蛋白基因的重组质粒转入E.coli BL21(DE3),验证后在含有相应抗生素的平板上划线培养,挑取单菌落接种于LB种子培养基中,培养至种子液后,将种子液按1mL/50mL体积分数转接到50mL TB发酵培养基中,继续培养1~2h后加入0.5mM的IPTG并在30℃进行诱导培养10h。结束后收集菌体,超声破碎后用于纯化和分析。
蛋白纯化:将收集的菌体超声破碎后高速离心去除细胞碎片,上清利用0.22μm水系膜过滤,利用Ni-NTA亲和层析对目的蛋白进行纯化。A液平衡柱子后上样粗酶液,再利用A液平衡层析柱,之后利用不同浓度的B液冲洗层析柱并收集冲洗液,利用SDS-PAGE验证纯化的组分,并将最纯的组分用PD-10脱盐柱进行脱盐,脱盐时使用低盐缓冲液(10mM Tris-HCl,0.1M NaCl;pH 6.0),收集得到纯化脱盐的蛋白。A液:20mM Tris-HCl buffer pH 7.5,500mM NaCl;B液:20mM Tris-HCl buffer pH 7.5,500mM NaCl,500mM咪唑。
AMP、ADP、ATP、APS检测方法:采用Agilent 1600HPLC系统,Polyamine II柱(4.6×250mm,12nm),流动相:50mM KH
ATP硫酸化酶活定义为:35℃条件下,每小时降解1μM APS所需要的酶量。
磺基转移酶酶活:35℃条件下,每小时转移1mM磺酸基团至目的产物上所需要的对应磺基转移酶的酶量。
循环次数:具体实施方式中提及的循环次数是指加入的底物APS在整个APS循环系统中的利用次数,其计算方法为初始加入APS的催化中产物的量除循环体系中产物的量。
实施例1:APS作为活性磺酸供体的应用
APS是PAPS的合成前体,仅在3'位置上相差一个磷酸基团,为了验证APS可作为通用的磺酸供体,筛选多种、不同类别的磺酸转移酶是否能利用APS。分别选择硫酸软骨素A磺酸转移酶(C4ST,氨基酸序列如SEQ ID NO.14所示)、肝素N磺酸化转移酶(NST,氨基酸序列如SEQ ID NO.15所示)、海藻糖磺酸转移酶(Gene ID:66738808,Stf0,氨基酸序列如SEQ IDNO:13所示)和雌激素磺酸转移酶(Gene ID:360268,EST,氨基酸序列如SEQ ID NO:16所示)。将上述磺酸转移酶在Tris-HCl反应体系下反应,反应体系含有:50mM Tris-HCl pH=7.5,10mM APS,10mM待磺酸化底物,0.5g/L对应磺酸转移酶;反应温度为35℃,反应12h。催化结果利用液质联用进行检测。结果如图2所示,底物脱乙酰肝素、雌激素、硫酸软骨素和海藻糖都分别以APS作为磺酸供体在对应位置生成了磺酸基团,生成了N-磺酸化肝素、磺酸雌激素、硫酸软骨素A和海藻糖-2-硫酸,证明了APS是一个通用活性磺酸供体。
实施例2:APS合成催化体系的构建
APS由底物ATP和硫酸根经过ATP硫酸化酶催化合成,并产生副产物焦磷酸。比较筛选不同来源的ATP硫酸化酶,包括酿酒酵母(Gene ID:853466,ScATPS,氨基酸序列如SEQ IDNO.1所示)、克鲁维酵母(Gene ID:2894185,KlATPS,氨基酸序列如SEQ ID NO.3所示)、毕赤酵母(Gene ID:8196926,KpATP,氨基酸序列如SEQ ID NO.2所示)和产黄青霉菌(ProteinID:CAP86100.1,PcATPS,氨基酸序列如SEQ ID NO.4所示)。将所筛选的ATP硫酸化酶表达、纯化后,测定比酶活,如图3所示,其中产黄青霉菌来源的ATP硫酸化酶PcATPS活性最高为860U/mg,而ScATPS的酶活为620U/mg,KlATPS的酶活为598U/mg以及KpATPS的酶活为580U/mg。
为了进一步提高APS的转化效率,通过向APS合成体系中引入焦磷酸酶,水解焦磷焦磷酸,拉动反应正向进行,提高ATP硫酸化酶的催化效率。比较筛选不同来源的ATP硫酸化酶,包括大肠杆菌(Gene ID:948748,EcPPA,氨基酸序列如SEQ ID NO.5所示)、铜绿假单胞菌(Gene ID:879025,PaPPA,氨基酸序列如SEQ ID NO.6所示)、和酿酒酵母(Gene ID:855309,ScPPA,氨基酸序列如SEQ ID NO.7所示)。所述蛋白经表达纯化后加入到APS的合成体系中,分别测定对ATP硫酸化酶的促进作用,结果如图4所示。焦磷酸酶的引入均能提高ATP硫酸化酶的活性,其中铜绿假单胞菌对ATP硫酸化酶的促进作用最明显。
实施例3:AMP转化ATP的酶的筛选
为了实现APS的再生,需要将AMP再次转化为ATP,因此筛选了不同来源的聚磷酸激酶。分别选择铜绿假单胞菌(PA2428,Gene ID:882843,氨基酸序列如SEQ ID NO.8所示;PA0414,Gene ID:879494,氨基酸序列如SEQ ID NO.9所示)、谷氨酸棒杆菌(PPK2A,ProteinID:WP_011013972.1,氨基酸序列如SEQ ID NO.10所示)、表皮葡萄球菌(SePPK2,CDD:274736,氨基酸序列如SEQ ID NO.11所示)和耐辐射奇球菌(DrPPK2,CDD:274737,氨基酸序列如SEQ ID NO.12所示)来源的聚磷酸激酶。合成编码聚磷酸激酶的基因片段,将基因片段连接至质粒pET28a(+)的Nde I和Hind III限制性酶切位点之间,得到重组质粒。将重组质粒转化至Escherichia coli BL21(DE3)细胞中,在30℃条件下培养2h后,添加0.5mMIPTG继续诱导10h,收集胞内酶,测定酶活。结果显示,聚磷酸激酶同时具有AMP磷酸化酶和ADP磷酸化酶活性,可从AMP一步直接合成ATP,磷酸供体为polyP
实施例4:APS循环再生系统的构建
如图5所示,建立APS循环再生系统。所述APS循环再生系统具有能够在酶的催化作用下,将APS催化合成AMP,将AMP催化合成ATP,将ATP催化合成APS从而构成闭环的循环催化反应过程。
其中,APS在磺基转移酶的催化下合成AMP;所述磺基转移酶包括但不限于硫酸软骨素A磺酸转移酶(C4ST,氨基酸序列如SEQ ID NO.14所示)、肝素N磺酸化转移酶(NST,氨基酸序列如SEQ ID NO.15所示)、海藻糖磺酸转移酶(氨基酸序列如SEQ ID NO:13所示)和雌激素磺酸转移酶(氨基酸序列如SEQ ID NO:14所示)。AMP在聚磷酸参与和聚磷酸激酶的催化作用下生成ATP;所述聚磷酸激酶可选择氨基酸序列如SEQ ID NO.8~SEQ ID NO.12所示的聚磷酸激酶。ATP在硫酸盐的参与及ATP硫酸化酶的催化作用下生成APS;所述ATP硫酸化酶可以为氨基酸序列如SEQ ID NO.1~SEQ ID NO.4任一所示的ATP硫酸化酶。
APS循环再生系统可以以含有酶制剂的催化体系参与反应;催化体系含有:在Tris-HCl反应体系下反应,反应体系含有:50mM Tris-HCl pH=7.5,10mM ATP,20mMMgSO
实施例5:APS再生系统的在硫酸软骨素生产中的应用
APS再生系统含有:0.5g/L聚磷酸激酶SePPK2、0.5g/L ATP硫酸化酶ScATPS、20mMpolyP
实施例:6:APS再生系统的在肝素生产中的应用
APS再生系统含有:0.5g/L聚磷酸激酶SePPK2、0.5g/L ATP硫酸化酶ScATPS、20mMpolyP
实施例7:APS再生系统的在海藻糖-2-磺酸盐生产中的应用
APS再生系统含有:0.5g/L聚磷酸激酶SePPK2、0.5g/L ATP硫酸化酶ScATPS、20mMpolyP
实施例8:APS结合区域3'PB重新编辑提高APS再生系统的循环能力
通过比对不同磺酸转移酶结合APS的结合区域3'PB motif(图8),3'PB区域对APS和PAPS的结合十分重要,其中3'PB motif是结合APS结构中3'OH的区域,重新改造3'PBmotif区域对提高磺酸转移酶对APS的亲和力十分重要。
以海藻糖磺酸转移酶(SEQ ID NO:13)为例,通过分子对接确定与APS直接作用的氨基酸的位置为143、152和154位,分别对其进行饱和突变,确定将第143位精氨酸突变为半胱氨酸,第152位丝氨酸突变为脯氨酸,将第154位色氨酸突变为天冬酰胺,构建单突变体。在单突变的基础上进行叠加突变。表达突变酶时,挑取单菌落在LB中过夜培养,1%(v/v)的接种量转接到发酵培养基TB中37℃培养2h后加入0.5mM IPTG转移到30℃继续培养12h,对野生酶和突变酶的比酶活进行测定,结果显示,野生酶的比酶活为3.2U/mg蛋白,突变体相对野生酶大大提高了对APS的利用率(图9)。突变体应用到构建的APS再生系统中,其磺酸化效率较野生型也提高了2倍。为其他磺基转移酶的突变也提供了参考。
对比例1:
具体实施方式同实施例1,区别在于,将实施例1的焦磷酸酶替换为等量的PcATPS(Protein ID:CAP86100.1)。结果显示,其生成APS的速度没有提高。
对比例2:
具体实施方式同实施例7,区别在于,还构建了将第142位突变为半胱氨酸的突变体,结果显示,对该位点的突变对于APS的亲和力没有提高作用。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
