一种生产高活性液态乳的紫外线杀菌方法及杀菌机
文献发布时间:2023-06-19 09:27:35
技术领域
本发明涉及一种生产高活性液态乳的紫外线杀菌方法及杀菌机,属于食品加工技术领域。
背景技术
紫外线杀菌是一种新型的非热杀菌方式。用于灭菌的紫外线(UV-C)波段通常为200-280nm,以253.7nm为最佳。紫外线通过破坏细菌、病毒、真菌和其他微生物的DNA阻止其繁殖,进而杀死微生物。紫外线杀菌主要应用于三个领域:空气杀菌,液体杀菌和表面杀菌。在食品工业中,对于液体杀菌,已应用有水、蛋液、果汁、酒类等澄清液体。由于紫外线对浑浊液体的穿透力较弱,因此目前可用于紫外线杀菌的物料主要局限于澄清液体。
牛乳营养成分丰富,对人类成长和健康起着重要作用。牛乳含有丰富的蛋白质、维生素、矿物质等,除此之外,牛乳中含有丰富的生物活性蛋白,包括免疫蛋白和抗菌酶等。这些活性蛋白对人类肠道健康与免疫系统起到保护作用。而这些生物活性蛋白大部分为热敏蛋白,在牛乳热杀菌过程中极易失活。因此紫外杀菌作为一种较为成熟的非热杀菌技术,在牛乳杀菌方面有着良好的应用前景。尽管紫外杀菌温度低、效率高,但由于牛奶的浊度高,导致紫外线穿透率降低,杀菌效果大大减弱。
目前已有研究者发明了几种针对不同液体食品的紫外线杀菌方法和装置。孙一军(201811149112.8)公开了一种引用水紫外线杀菌方法,采用水管内部照射杀菌,并使用梯子形杀菌通道,增加了水流的紫外处理时间,提高了紫外杀菌效率;但由于牛乳为浑浊液体,虽然梯子形通道可起到一定的分流效果,但紫外灯分别在装置两端,牛乳接触紫外线不均匀无法保证杀菌效果。林大雄(201680016968.0)公开了一种UV-C水净化设备,改进了UV-C LED模块,减少了紫外光在传播中的损失,提高了光提取效率;但是物料容器为水槽,UV-C模块安装在水槽中,物料深度大,且呈静止状态,杀菌过程不连续。孙福宽(201220341807.8)公开了一种紫外线饮料杀菌装置,装置主要由盛放饮料的容器和内部的紫外灯管组成,物料由容器顶部进入,从底部流出;采用微波发生器产生微波激发紫外线,提高了紫外强度和杀菌效果,且延长了紫外灯的使用寿命;但是由于容器内紫外灯管外围空间较大,物料在容器内流动时液层较厚,紫外线难以全部透过浑浊液体;且物料垂直于紫外灯管流入和流出,方向与紫外灯管方向垂直,流动时难以控制液体的流动方式;因此,此装置无法保证浑浊物料受紫外线照射均匀。尹全权(201720671599.0)公开了一种饮料生产用紫外线杀菌器,长形筒体内部装有多根紫外灯管,且与腔体方向垂直,物料入口和出口均在腔体顶部;由于筒体内部空间较大,且没有引流装置,物料流动状态难以控制;筒体内有多根紫外灯管,物料所接收的实际紫外剂量难以计算。马学武(201710865815.X)公开了一种驴奶加工用紫外线灭菌装置,包括灭菌箱和储存箱。灭菌箱采用热杀菌,紫外灯管安装在储存箱中。在热杀菌时,若灭菌箱温度超过设定值,即灭菌箱出现故障时,灭菌箱中的驴奶会自动排入储存箱中,由紫外线对驴奶进行持续杀菌;此装置中紫外仅起到备用和辅助杀菌的作用,且物料在储存箱中与紫外灯接触不均匀,杀菌效率很低。
由上述可知,现有的液体食品的紫外杀菌方式和设备均不适用于牛乳杀菌。因此,亟需一种能对牛乳这一浑浊液体杀菌并可保留活性成分的紫外线杀菌方法,且杀菌效果优良,可连续处理,紫外剂量、产量、处理温度均可调节的紫外线杀菌装置。
发明内容
为了解决上述至少一个问题,本发明提供了一种用于生产高活性液态乳的紫外杀菌方法及杀菌机。
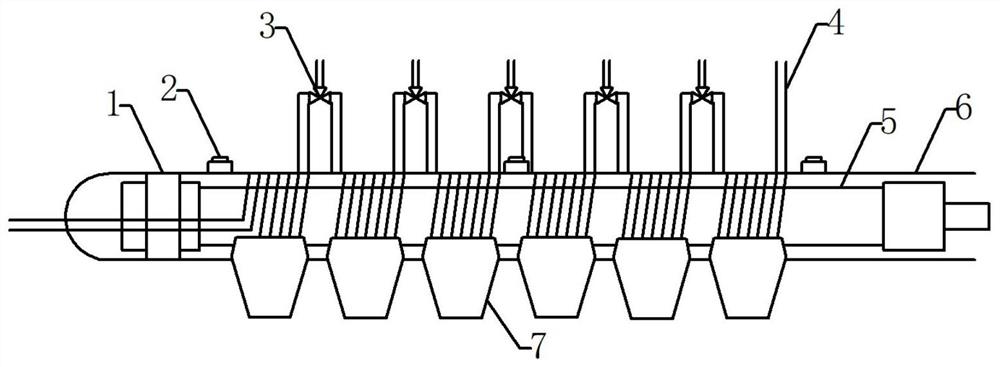
本发明的第一个目的是提供一种用于生产高活性液态乳的紫外杀菌机,所述紫外杀菌机包括紫外杀菌构件15,紫外杀菌构件15包括垫片1、紫外强度监测器2、三通阀3、PFA管4、紫外灯管5、石英套管6、PFA管固定夹7,其中紫外灯管5表面罩有石英套管6,PFA管4紧密缠绕在石英套管6周围,PFA管由PFA管固定夹7固定,PFA管4与石英套管6之间没有空隙,PFA管4每缠绕1m(10-30圈)作为一个杀菌区域,相邻杀菌区域的PFA管4用三通阀3连接;在紫外灯管5和石英套管6之间有垫片1;紫外强度检测器2紧贴在石英套管6的外侧未缠绕PFA管的地方。
在本发明的一种实施方式中,所述紫外杀菌机中相邻杀菌区域之间包括一个或多个紫外强度检测器2。
在本发明的一种实施方式中,所述紫外杀菌机一侧配有进料泵8,PFA管4一端从进料泵8中穿过,液态乳经进料泵8送进管路。
在本发明的一种实施方式中,所述的紫外杀菌机中一侧配有进料泵8,另一侧配有控制台9。
在本发明的一种实施方式中,所述的紫外杀菌机中还包括灯管固定器10和紫外灯支架11,灯管固定器10和紫外灯支架11用来固定紫外灯管5。
在本发明的一种实施方式中,所述的紫外杀菌机中还包括外壳支架12、不锈钢外壳13;不锈钢外壳13由外壳支架12支撑;不锈钢外壳13内包含多个紫外灯管5。
在本发明的一种实施方式中,所述的紫外杀菌机中还包括隔板14,隔板14是将每根紫外灯管5隔开,保证了不同灯管发出的紫外光不相互干扰。
在本发明的一种实施方式中,所述的紫外杀菌机中还包括分流器16,分流器16在进料泵8和不锈钢外壳13之间;分流器16是将原料按照流量平均分配到每个PFA管4中。
在本发明的一种实施方式中,所述的紫外杀菌机中还包括加热管17,加热管17在进料泵8和不锈钢外壳13之间的PFA管4周围,用来加热物料至某一温度再进行后续紫外杀菌。
在本发明的一种实施方式中,所述紫外杀菌装置中紫外杀菌构件15数量可为1-100个,相应的,加热管17和分流器16数量可为1-10个;当紫外杀菌构件数为多个时,并联放置,紫外杀菌机的处理量可为3-1200L/h。
在本发明的一种实施方式中,所述的紫外杀菌机还包括控制台9,所述控制台9可控制紫外灯管5、紫外强度监测器2、进料泵8、加热管17和不锈钢外壳13内的温度,并显示每个紫外强度监测器监测到的紫外强度。
在本发明的一种实施方式中,所述的紫外杀菌机包括紫外杀菌构件15、进料泵8、控制台9、灯管固定器10、紫外灯支架11、外壳支架12、不锈钢外壳13、隔板14、分流器16、加热管17,紫外杀菌构件15包括垫片1、紫外强度监测器2、三通阀3、PFA管4、紫外灯管5、石英套管6、PFA管固定夹7;其中,不锈钢外壳13由外壳支架12支撑;不锈钢外壳13内包含多个紫外灯管5,多个紫外灯管5之间由隔板14分隔开,紫外灯管5由灯管固定器10和紫外灯支架11固定;紫外灯管5表面罩有石英套管6,紫外灯管5和石英套管6之间有一层垫片1,PFA管4紧密缠绕在石英套管6周围,PFA管4与石英套管6之间没有空隙,PFA管4缠绕10-30圈作为一个杀菌区域,整个杀菌区域由PFA管固定夹7固定,相邻杀菌区域的PFA管4用三通阀3连接;紫外强度检测器2紧贴在石英套管6的外侧未缠绕PFA管的地方;紫外杀菌机中一侧配有进料泵8,另一侧配有控制台9;进料泵8和不锈钢外壳13之间的PFA管4周围有加热管17;分流器16在在进料泵8和不锈钢外壳13之间。
在本发明的一种实施方式中,所述石英套管6的外径为2-3cm,可以进一步优选为2.3cm,由两个不锈钢支架支撑固定,保证紫外灯管与石英套管同轴。
在本发明的一种实施方式中,在运行过程中,液态乳经进料泵8进入PFA管4的一端,液态乳在管内绕流数周,接受紫外光照射后从PFA管4的另一端流出,通过控制三通阀3的开闭,可改变液态乳在PFA管4内的流向,使液态乳进入下一个区域中继续进行紫外杀菌,或结束杀菌,直接流出。
在本发明的一种实施方式中,所述不锈钢外壳13严格密封,内部配温控系统,可通过水浴控制紫外杀菌模块的温度在0-80℃之间。
在本发明的一种实施方式中,所述不锈钢外壳13内部有多个金属卡槽,可固定缠绕在石英套管外的PFA管4。
在本发明的一种实施方式中,PFA管4规格为:内径为1-2mm,外径为2-3mm;进一步优选为:1mm*2mm、1.5mm*2mm或2mm*3mm(内径×外径)。
在本发明的一种实施方式中,所述紫外杀菌装置中PFA管4环绕内径Dc与PFA管4内径D比值介于0.03-0.1之间,保证了液态乳在不同流速下均能在管内均匀混合,进而使液态乳在不同处理量下均有良好的紫外杀菌效果。
本发明的第二个目的是提供一种采用本发明所述的杀菌机生产高活性液态乳的方法。
在本发明的一种实施方式中,杀菌机中PFA管4规格为:内径为1-2mm,外径为2-3mm;进一步优选为:1mm*2mm、1.5mm*2mm或2mm*3mm(内径×外径)。
在本发明的一种实施方式中,所述的液态乳为牛乳或羊乳。
在本发明的一种实施方式中,所述紫外杀菌装置中PFA管4环绕内径Dc与PFA管4内径D比值介于0.03-0.1之间,保证了液态乳在不同流速下均能在管内均匀混合,进而使液态乳在不同处理量下均有良好的紫外杀菌效果;根据如下式(1)和式(2)计算雷诺数(R
其中ρ为液态乳密度,为1021.46kg/m
Re<2100表示液体流动状态为层流,Re>4000表示液体流动状态为湍流,Re介于两者之间,表示混合流动状态。De是流体在盘管中流动方式的表征,当0.03<D/Dc<0.1时,盘管中流体产生二次流窝,可增强流体混合程度。
在本发明的一种实施方式中,通过改变液态乳流量或实际使用的PFA管4的长度,改变液态乳的紫外剂量,使液态乳中微生物达到巴氏杀菌的要求,并且确保液态乳中生物活性蛋白没有显著下降;通过改变并联的紫外灯管根数,可以改变处理量。
在本发明的一种实施方式中,所述高活性液态乳指经过某种杀菌方式,液态乳中微生物限量符合巴氏杀菌乳国家标准(GB 19645—2010、GB 19301—2010),可作为巴氏杀菌乳储藏售卖,且免疫活性蛋白和抗菌酶这类生物活性蛋白含量更高的液态乳。
在本发明的一种实施方式中,所述紫外杀菌强度可通过改变液态乳流量来控制;选择的液态乳的流量为50-200mL/min;具体为取新鲜液态乳,保持液态乳温度在25℃,经过5个杀菌区域,分别控制液态乳在管内的流量为50-200mL/min,对应紫外剂量为65-16mJ/cm
在本发明的一种实施方式中,所述杀菌强度可通过改变PFA管4的长度来控制;选择2-6个杀菌区域,每个区域的缠绕圈数是12圈(每圈PFA4的长度为1m);具体为取新鲜液态乳,保持液态乳温度在25℃,通过控制三通阀3的开闭,使液态乳经过2-6个杀菌区域,对应紫外剂量为16-47mJ/cm
在本发明的一种实施方式中,所述高活性液态乳的处理量可通过改变并联的紫外杀菌构件15数来调整;因每根紫外灯管的适宜处理量为50-200mL/min,紫外杀菌构件15数量可为1-100个,相应的,加热管17和分流器16数量可为1-10个;当紫外杀菌构件15数为多个时,并联放置,紫外杀菌机的处理量可为3-1200L/h。
在本发明的一种实施方式中,液态乳在紫外杀菌机PFA管4中的流量为50-200mL/min。
在本发明的一种实施方式中,液态乳经过的杀菌区域为2-6个,每个杀菌区域中PFA管的缠绕圈数为12圈,每圈PFA管的长度为1m。
在本发明的一种实施方式中,液态乳在接受紫外照射前,可通过加热管加热至某一温度;在紫外杀菌时,可通过温控系统将液态乳保持在某一温度,可调节的温度范围为0-80℃。
本发明的第三个目的是本发明所述的方法生产得到的高活性液态乳。
在本发明的一种实施方式中,所述的高活性液态乳为脱脂牛乳、全脂牛乳、脱脂羊乳、全脂羊乳中的一种。
本发明的有益效果:
(1)本发明提供了一种用于生产高活性液态乳的紫外杀菌机,实现了紫外线对液态乳这种浑浊液体的杀菌。本发明通过采用PFA管4螺旋环绕的形式,以及控制D/Dc范围为0.03-0.1,使液态乳在管中运行时得到充分混合,提高了液态乳的杀菌效率;本发明通过改变液态乳流量或液态乳在PFA管4中运行的长度两种方式改变牛乳接受的紫外剂量,进而控制液态乳的杀菌强度;本发明通过改变并联的紫外灯管数量改变液态乳的处理量,操作方便,耗时少,能满足多种处理要求,应用广泛。
(2)本发明提供了一种生产高活性液态乳的紫外杀菌方法,改变紫外剂量的方法多种多样,方便快速。本发明中的紫外杀菌方法可使液态乳微生物数量达到国家标准的要求,同时对液态乳中活性蛋白的损害显著低于热处理强度最弱的巴氏杀菌(72℃ 15s),几乎不会导致明显的活性蛋白损失。
(3)本发明提供了一种高活性的液态乳。与巴氏杀菌(72℃ 15s)相比,用本方法生产的高活性液态乳具有相同的安全性,却有更多的免疫活性蛋白和抗菌蛋白,是一种高活性巴氏杀菌的液态乳。
(4)牛乳中IgG、IgM、IgA和乳铁蛋白统称为免疫活性蛋白,具有抗菌、防御、抗炎症、抗氧化、抗癌和免疫调节功能。除此之外,LPO和XO这两种酶也具有抗菌活性,是牛乳中的有益酶。这些生物活性蛋白的保留对人体肠道健康和免疫功能有重要的促进作用。通过改变液态乳流量或PFA管4实际使用长度来改变紫外剂量,得到高活性液态乳。该液态乳经紫外杀菌后,菌落总数为0-40000CFU/mL,大肠菌群数为0CFU/mL,均在国家标准(GB19645—2010、GB 19301—2010)范围内。杀菌后牛乳中的生物活性蛋白与抗菌酶的含量或活性,包括IgG、IgM、IgA、乳铁蛋白、过氧化物酶、黄嘌呤氧化酶,与杀菌前相比均没有明显下降(而巴氏杀菌使其下降20-60%),是高活性的液态乳。可根据原料乳的卫生质量调整紫外杀菌强度。
附图说明
图1为紫外杀菌机内部紫外杀菌构件15的结构;
图2为紫外杀菌机主视图(透视);
图3为紫外杀菌机左视图(透视);
图4为紫外杀菌机俯视图(透视);
图1-图4中,垫片1、紫外强度监测器2、三通阀3、PFA管4、紫外灯管5、石英套管6、PFA管固定夹7、括进料泵8、控制台9、灯管固定器10、紫外灯支架11、外壳支架12、不锈钢外壳13、隔板14、紫外杀菌构件15、分流器16、加热管17。
图5为实施例6中两种紫外剂量对牛乳免疫活性蛋白含量的影响;其中A是对IgG含量的影响;B是对乳铁蛋白含量的影响;C是对IgM含量的影响;D是对IgA含量的影响。
图6为实施例6中两种紫外剂量对牛乳过氧化物酶(LPO)和黄嘌呤氧化酶(XO)含量的影响。
具体实施方式
以下对本发明的优选实施例进行说明,应当理解实施例是为了更好地解释本发明,不用于限制本发明。
菌落总数测定:采用3M公司菌落总数测试片(6406),取1mL稀释后的样品,滴加在测试片中央后压紧上层薄膜,静置1分钟待培养基凝固后,置于32℃培养箱中培养24小时,取菌落数为25-250的测试片计数。
大肠菌群测定:采用3M公司菌落总数测试片(6416),取1mL稀释后的样品,滴加在测试片中央后压紧上层薄膜,静置1分钟待培养基凝固后,置于32℃培养箱中培养12小时,取菌落数为15-150的测试片计数。
芽孢总数测定:取一定量处理后的牛乳于无菌离心管中,置于80℃水浴锅内保温10min。保温结束后立即置于碎冰中冷却,取适量牛乳,稀释一定倍数后,按照菌落总数测定方法进行后续测定。
免疫活性蛋白(IgG、IgM、IgA、乳铁蛋白)含量测定:采用Elisa试剂盒(Cat.No.E10-118,E10-131,E10-101 and E10-126;Bethyl Laboratories,USA)测定牛乳中IgG、IgM、IgA和乳铁蛋白含量。将牛乳稀释500-1000倍进行测定,用4参数方程对标曲进行拟合定量。
乳过氧化物酶(LPO)活性测定:通过测定乳过氧化物酶催化Amplex Red染料(AR)氧化反应生成的红色荧光氧化产物(9-羟基-3-异吩恶唑酮)速率来确定活性大小。将23.1μL AR、4.6μL硫氰酸钾溶液和972.3μL 100mM磷酸盐缓冲液(PH 7.4)混合制备反应试剂,取30μL稀释后的牛乳与195μL反应试剂混合,再取50μL混合液加入96孔板中,37℃培养20min后,用酶标仪自动加样50μL 110μM过氧化氢溶液(空白用50μL去离子水代替过氧化氢溶液),每隔10s在激发/发射波长为544/590nm处测定荧光强度。用不同浓度梯度的过氧化氢溶液制备标准曲线。乳过氧化物酶活性通过下式(3)计算:
注:F1、F2为T时间内两个端点的荧光强度的差异,K为标准曲线的斜率。
黄嘌呤氧化酶(XO)活性测定:黄嘌呤氧化酶可催化次黄嘌呤产生过氧化氢,过氧化氢可被辣根过氧化物酶(HRP)催化生成荧光产物。将10μL 10mM AR、4μL 200U/mL HRP、40μL 10mM次黄嘌呤、946μL磷酸盐缓冲液(PH 7.4)混合制备反应试剂。取50μL稀释后的牛乳加入96孔板中,再加入50μL黄嘌呤氧化酶反应试剂混合,每隔30s用酶标仪测定激发/发射波长为544/590nm处测定荧光强度。用不同浓度梯度的过氧化氢溶液制备标准曲线。黄嘌呤氧化酶活性通过下式(4)计算:
注:F1、F2为T时间内两个端点的荧光强度的差异,K为标准曲线的斜率。
实施例1紫外杀菌机(一个紫外杀菌构件15)
所述的紫外杀菌机包括紫外杀菌构件15、进料泵8、控制台9、灯管固定器10、紫外灯支架11、外壳支架12、不锈钢外壳13,紫外杀菌构件15包括垫片1、紫外强度监测器2、三通阀3、PFA管4、紫外灯管5、石英套管6、PFA管固定夹7;其中,不锈钢外壳13由外壳支架12支撑;不锈钢外壳13内包含1个紫外灯管5,紫外灯管5由灯管固定器10和紫外灯支架11固定;紫外灯管5表面罩有石英套管6,紫外灯管5和石英套管6之间有一层垫片1,PFA管4紧密缠绕在石英套管6周围,PFA管4与石英套管6之间没有空隙,PFA管4缠绕10-30圈作为一个杀菌区域,整个杀菌区域由PFA管固定夹7固定,相邻杀菌区域的PFA管4用三通阀3连接;紫外强度检测器2紧贴在石英套管6的外侧未缠绕PFA管的地方;紫外杀菌机中一侧配有进料泵8,另一侧配有控制台9。
在运行过程中,液态乳经进料泵8进入PFA管4的一端,液态乳在管内绕流数周,接受紫外光照射后从PFA管4的另一端流出,通过控制三通阀3的开闭,可改变液态乳在PFA管4内的流向,使液态乳进入下一个区域中继续进行紫外杀菌,或结束杀菌,直接流出。紫外强度检测器2紧贴在石英套管外侧,可准确监测石英套管外测的紫外强度。不锈钢外壳13严格密封,内部配有温控系统,可通过水浴控制紫外杀菌模块的温度(0-80℃)。控制台9可控制紫外灯、紫外强度监测器和不锈钢外壳13内的温度。通过控制进料泵8,可选择并联的紫外灯管数,进而改变紫外杀菌的处理量。
实施例2紫外杀菌机(多个并联紫外杀菌构件15)
紫外杀菌机的正视图、俯视图、侧视图以及内部紫外杀菌模块示意图分别如图1、图2、图3、图4所示。所述的紫外杀菌机紫外杀菌构件15、进料泵8、控制台9、灯管固定器10、紫外灯支架11、外壳支架12、不锈钢外壳13、隔板14、分流器16、加热管17,紫外杀菌构件15包括垫片1、紫外强度监测器2、三通阀3、PFA管4、紫外灯管5、石英套管6、PFA管固定夹7;其中,不锈钢外壳13由外壳支架12支撑;不锈钢外壳13内包含多个紫外灯管5,多个紫外灯管5之间由隔板14分隔开,紫外灯管5由灯管固定器10和紫外灯支架11固定;紫外灯管5表面罩有石英套管6,紫外灯管5和石英套管6之间有一层垫片1,PFA管4紧密缠绕在石英套管6周围,PFA管4与石英套管6之间没有空隙,PFA管4缠绕10-30圈作为一个杀菌区域,整个杀菌区域由PFA管固定夹7固定,相邻杀菌区域的PFA管4用三通阀3连接;紫外强度检测器2紧贴在石英套管6的外侧未缠绕PFA管的地方;紫外杀菌机中一侧配有进料泵8,另一侧配有控制台9;进料泵8和不锈钢外壳13之间的PFA管4周围有加热管17;分流器16在在进料泵8和不锈钢外壳13之间。
在运行过程中,液态乳经进料泵8后,经过加热管17和分流器16,进入PFA管4的一端,液态乳在管内绕流数周,接受紫外光照射后从PFA管4的另一端流出,通过控制三通阀3的开闭,可改变液态乳在PFA管4内的流向,使液态乳进入下一个区域中继续进行紫外杀菌,或结束杀菌,直接流出。紫外强度检测器2紧贴在石英套管外侧,可准确监测石英套管外测的紫外强度。不锈钢外壳13严格密封,内部配有温控系统,可通过水浴控制紫外杀菌模块的温度(0-80℃)。控制台9可控制控制紫外灯管5、紫外强度监测器2、进料泵8、加热管17和不锈钢外壳13内的温度。分流器16最多可同时并联十条PFA管4,通过控制分流器16,可选择并联的紫外灯管数,进而改变紫外杀菌的处理量。
实施例3实施例1的杀菌机用于牛乳杀菌
为保证牛乳在PFA管4中运动时充分混合,根据式(1)和式(2)计算雷诺数(Re)和迪恩数(De):
其中ρ为牛乳密度,为1021.46kg/m
Re<2100表示液体流动状态为层流,Re>4000表示液体流动状态为湍流,Re介于两者之间,表示混合流动状态。De是流体在盘管中流动方式的表征,当0.03<D/Dc<0.1时,盘管中流体产生二次流窝,可增强流体混合程度。
按照表1中不同规格PFA管和不同外径石英套管组合设置紫外杀菌机,使得牛乳经过两个区域杀菌结束,计算Re和D/Dc,并通过以下公式(5)和(6)计算牛乳接受的紫外剂量:
UV-C剂量(mJ/cm
从表1可以看出:因紫外灯管一段外径为19mm,因此石英套管可能的内径最小为20mm。可以看出决定比值的主要因素为PFA管规格。因此,当石英套管外径为20-30mm时,应选用1*2mm、1.5*2.5mm、1.5*3mm、2*3mm、2*4mm的PFA管;当石英套管外径为20-30mm时,应选用1*2mm、1.5*2.5mm、1.5*3mm、2*3mm、2*4mm的PFA管。
表1不同规格PFA管和不同外径石英套管组合下的D/Dc值
对杀菌之后的牛乳进行性能测试,测试结果如表2。由表2可以看出,虽然2*4mmPFA管的D/Dc值符合要求,但细菌总数没有达到巴氏杀菌的标准。可能是由于管壁过厚,导致紫外透过率较低,进而影响了杀菌效果。因此可以选用的PFA管规格为1mm*2mm、1.5mm*2.5mm、2mm*3mm。
表2不同PFA管的规格下的杀菌效果
注:“-”表示平板上菌落少于1个,视为无法检出。
对照例1不同紫外杀菌设备的杀菌效果
采用市面上的直流型和静止型紫外杀菌设备对牛乳进行杀菌,直流型设备(Ster
控制直流型设备中牛乳的流速以及静止型设备中紫外灯的照射时间,控制三种紫外杀菌方式的牛乳与紫外光接触的表面紫外剂量为31mJ/cm
实施例3和对照例1得到的杀菌牛乳的测试结果如表3所示。从表3可以看出,在相同的紫外剂量下,用螺旋管型设备杀菌(实施例1)后的牛乳细菌总数最少,杀菌强度最高。因此,本发明的螺旋管型紫外杀菌机杀菌强度大,效率高。
表3实施例3和对照例1得到的杀菌牛乳的测试结果
实施例4改变牛乳流量(Q)来改变紫外剂量
选用内径为1.5mm、外径为2.5mm的PFA管。
取新鲜牛乳,保持牛乳温度在25℃,经过5个杀菌区域,分别控制牛乳在管内的流量为50、100、200mL/min,分别对应紫外剂量为65mJ/cm
同时用同一批次的鲜牛乳(菌落总数为5.48±0.03log(CFU/mL),大肠菌群数为2.77±0.01log(CFU/mL)),进行巴氏杀菌(72℃ 15s)作为对照,经过巴氏杀菌(72℃ 15s)的牛乳菌落总数为2.45±0.05log(CFU/mL),不含大肠菌群。
测定杀菌前后牛乳的菌落总数和大肠菌群,测试结果见表4:
我国对原料乳的微生物限量标准为2×10
表4实施例4的测试结果
注:“-”表示平板上菌落少于1个,视为无法检出。
实施例5通过改变PFA管4长度来改变紫外剂量
选用内径为1.5mm、外径为2.5mm的PFA管4,控制牛乳在管内的流量为150mL/min,通过三通阀3的开闭,使牛乳分别经过2、3、4、5、6个杀菌区域(每个杀菌区域的长度为1m,缠绕12圈),5种处理方式的紫外剂量分别为16、23、31、39、47mJ/cm
同时用同一批次的鲜牛乳(菌落总数为5.02±0.02log(CFU/mL),大肠菌群数为2.02±0.02log(CFU/mL)),进行巴氏杀菌(72℃ 15s)作为对照,经过巴氏杀菌(72℃ 15s)的牛乳菌落总数为1.18±0.00log(CFU/mL),不含大肠菌群。
测定杀菌前后牛乳的菌落总数和大肠菌群,测试结果见表5:
由表5数据结合国家标准(GB 19645—2010、GB 19301—2010)可知,5个参数的紫外杀菌牛乳菌落总数和大肠菌群数均达到了国家标准要求。PFA管4缠绕3m以上,牛乳的紫外杀菌效果便等同于巴氏杀菌(72℃ 15s)。
表5实施例5的测试结果
注:“-”表示平板上菌落少于1个,视为无法检出。
实施例6紫外杀菌对牛乳活性蛋白的影响
分别以牛乳流量为100mL/min、经过4个杀菌区域(紫外剂量为26mJ/cm
测试结果如表6、表7和图5、图6所示:由表6可知,用两种紫外剂量杀菌后的牛乳均达到了国标对巴氏杀菌乳的要求。紫外杀菌后,通过芽孢数可以看出,巴氏杀菌只能杀死牛乳中的细菌营养体,不能杀死其中的芽孢,而紫外杀菌除可杀死细菌营养体外,也可杀死一部分芽孢。通过表7、图5和图6可以看出,巴氏杀菌导致牛乳中4种免疫活性蛋白、LPO和XO显著降低,而两种紫外杀菌对这6种生物活性物质无明显影响,因此用本发明的紫外杀菌方法可生产高活性牛乳。
表6实施例6的杀菌测试结果
注:“-”表示平板上菌落少于1个,视为无法检出。
表7实施例6的活性测试结果
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的技术和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
