一种同时检测单增李斯特菌CC87和88型菌株的引物、试剂盒以及方法
文献发布时间:2023-06-19 11:26:00
技术领域
本发明属于微生物检测技术领域,具体涉及一种检测单核细胞增生李斯特菌CC87和88菌株的引物、试剂盒以及方法。
背景技术
单核细胞增生李斯特菌(Listeria monocytogenes,简称单增李斯特菌)是一种重要的兼性厌氧革兰氏食源性致病菌,可引起败血症、脑膜炎、脑膜脑炎、胸肌炎和等严重李斯特菌病,孕妇甚至导致流产等严重后果,敏感人群主要为老年人、新生儿、孕妇和免疫力低下者,致死率为20%-30%。近年来,我国部分城市有报道偶发李斯特菌病病例,主要人群为孕妇、新生儿等,对我国居民身体健康造成一定的威胁。
单核细胞增生李斯特菌遗传多样性丰富,具有14种血清型,分别为1/2a, 1/2b,1/2c,3a,3b,3c,4a,4b,4c,4ab,4d,4e,4h和7。脉冲场凝胶电泳 (pulse field gelelectrophoresis,PFGE)是单增李斯特菌分子分型的“金标准”,但随着DNA测序技术的发展,目前多位点序列分型(multilocus sequence typing, MLST)是单增李斯特菌遗传多样性分析的流行方法,其分辨力、稳定性均可与 PFGE媲美,比血清分型具有更高的分辨力和可靠性。据法国巴斯德研究所 BIGSdb-Lm数据库统计,目前单增李斯特菌已发现2331序列型(sequence types, STs)(截至2020年12月15日)。单增李斯特菌具有耐受低温、低水活度、宽范围pH和高盐等能力,因此广泛存在于食品加工、水体和土壤等环境中。目前,我国许多学者报道在食品样品和临床源样本中,克隆复合群(clonal complex, CC)87型菌株均为优势型别,可能与其能够耐受一定剂量的消毒剂、携带李斯特菌毒力岛-4(LIPI-4)等特征相关;同时有研究表明CC87型菌株是长期持续性污染食品生产加工的主要基因型,对食品安全带来严重的潜在威胁。
目前,采用MLST技术可以准确鉴定单增李斯特菌的CC型别,但目前DNA 序列测定成本较高、耗时相对较长、且测序的准确性也直接影响MLST分型结果的准确性。随着微生物全基因组测序技术的发展,基于比较基因组学分析获得CC型特异性DNA检测靶标,可以开发快速高通量、廉价、灵敏度高的PCR 鉴定技术。
多重PCR是在同一个反应体系中利用多对特异性引物同时扩增多段特异性 DNA序列靶标的PCR技术。目前已广泛应用于微生物血清分型、分子分型、病原体检测、转基因鉴定、遗传疾病诊断等生物、医学领域。多重PCR具有以下优势:(1)高通量,在一次操作中可对多达384个样品进行鉴定;(2)廉价高效,同一PCR扩增体系可同时检测多个特异性靶标,且无需进行DNA序列测定,根据靶标序列DNA条带扩增结果即可判断;(3)易于操作、耗时短,在同一PCR反应中实现多个靶标一步法同时扩增,150min内即可获得准确结果;(4) 准确性高,实现多个靶标的同步特异性扩增,大大降低了假阳性的可能性。随着引物对数量的增加,引物间的抑制作用降低了多重PCR的检测通量,在多重 PCR技术的实际应用过程中,由于在同一反应管内添加多对引物,引物的非特异性扩增、引物间二聚体形成、PCR反应体系优化以达到每个靶标DNA序列都能有效扩增等问题限制了多重PCR技术的应用。因此,开发高通量、高灵敏度和准确可靠的单增李斯特菌CC87和CC88型菌株多重PCR检测技术及其相应的试剂盒,对食品生产企业、检验检疫部门检测/监测单增李斯特菌污染具有重要的价值。
发明内容
本发明基于比较基因组学分析技术开发的多重PCR技术对单增李斯特菌 CC87和CC88型菌株的多个特异性检测靶标同时进行检测,可直接鉴定单增李斯特菌CC87和CC88型菌株。
本发明的目的之一:提供一种同时检测单增李斯特菌CC87和CC88型菌株的引物组,所述引物组包括核苷酸序列如SEQ ID NO:1~6所示。本发明的设计引物能够分别扩增出不同位置的目的条带,可以明显地区分单增李斯特菌、CC87 单增李斯特菌和CC88型单增李斯特菌。
优选地,其中所述如SEQ ID NO:1~2所示的引物扩增的目标基因为
A6K41_13255;所述如SEQ ID NO:3~4所示的引物扩增的目标基因为
JKV74_12770;所述如SEQ ID NO:5~6所示的引物扩增的目标基因为 CRH04_04965。
本发明分别针对单增李斯特菌CC87和CC88型菌株的特异性靶标序列设计了特异性扩增引物。本发明之所以选择上述基因作为各型菌株的靶标,是因为基因“JKV74_12770”为CC88型单增李斯特菌株的特异性分子靶标,仅存在于 CC88型单增李斯特菌株;基因“A6K41_13255”为CC87和CC88型菌株的特分子靶标,仅存在于CC87和CC88型单增李斯特菌株,不存在于其他克隆复合群;基因“CRH04_04965”为单增李斯特菌株的特异性分子靶标。因此,当使用如SEQ ID NO:1~6所示的引物进行多重PCR时,PCR产物会出现三种结果:若同时出现目标基因JKV74_12770(568bp)、A6K41_13255(1014bp)、 CRH04_04965(228bp)三条扩增条带,则该菌株鉴定为CC88型菌株;若同时出现目标基因A6K41_13255(1014bp)、CRH04_04965(228bp)两条扩增条带,则该菌株鉴定为CC87型菌株;若只出现目标基因CRH04_04965(228bp)一条扩增条带,则该菌株鉴定为单增李斯特菌。
本发明的目的之二:提供一种鉴定单增李斯特菌CC87和CC88型菌株的特异性靶标序列,所述序列包括如SEQ ID NO:7~9所示的核苷酸序列。
本发明的目的之三:提供一种检测单增李斯特菌CC87和CC88型菌株的试剂盒,所述试剂盒包括如SEQ ID NO:1~6所示的引物组。
优选地,所述试剂盒还包括:Taq DNA聚合酶、MgCl2、PCR扩增缓冲液、 dNTP、去离子水。
本发明的目的之四:提供一种鉴定单增李斯特菌CC87和CC88型菌株的方法,包括以下步骤:
S1提取待测菌株的基因组DNA;
S2进行多重PCR:以待测单核细胞增生李斯特菌的基因组为模板,利用如 SEQ IDNO:1~6所示的引物组扩增目的靶序列;
S3将步骤S2的扩增产物进行判定。
优选地,所述判定结果为:若同时出现目标基因JKV74_12770(568bp)、 A6K41_13255(1014bp)、CRH04_04965(228bp)三条扩增条带,则该菌株鉴定为CC88型菌株;若同时出现目标基因A6K41_13255(1014bp)、CRH04_04965 (228bp)两条扩增条带,则该菌株鉴定为CC87型菌株;若只出现目标基因 CRH04_04965(228bp)一条扩增条带,则该菌株鉴定为单增李斯特菌。
优选地,所述多重PCR的反应体系包括:浓度为10μM的SEQ ID NO:1~6 所示的引物0.5μL,2.5U/μL的Taq DNA polymerase 0.5μL,25mmol/LMgCl
优选地,所述多重PCR的反应程序为:95℃预变性5min;95℃变性30s, 60℃退火50s,72℃延伸60s,扩增35个循环;最后72℃延伸10min。
本发明的目的之五:提供了本发明的引物组或所述的特异性靶标序列在鉴定单增李斯特菌CC87和CC88型菌株中的应用。
与现有技术相比,本发明的有益效果为:
(1)本发明利用比较基因组学分析获得多个单核细胞增生李斯特菌CC87 和CC88型特异性靶标DNA序列,采用多重PCR技术扩增同步实现CC87和 CC88型菌株的快速鉴定,结果准确可靠;
(2)本发明公开的同时检测单核细胞增生李斯特菌CC87和CC88型菌株的多重PCR试剂盒,可同时检测CC87和CC88型菌株的多个特异性靶标,不仅可以节约试剂使用量和降低检测成本,而且具有高通量特点,提高了检测效率,具有灵敏度高、经济快速、操作简单和准确性高等优点;
(3)本发明公开的试剂盒进行检测时,只需要进行多重PCR扩增结合琼脂糖凝胶电泳即可准确鉴定单核细胞增生李斯特菌CC87和CC88型菌株,步骤简单快捷,无需进行DNA序列测定和比对分析,缩短了鉴定时间的同时降低了因 DNA序列测定结果准确性影响结果可信度的因素;
(4)本发明的多重PCR检测体系特异性强,多重PCR试剂盒检测CC87 和CC88型菌株的灵敏度分别达到7.16pg/25μL和6.08pg/25μL,单管进行,操作简便快捷,具有灵敏度高、经济快速、高通量等优点,可用于开发相关的检测试剂盒,可应用于食品检验、检验检疫等部门。
附图说明
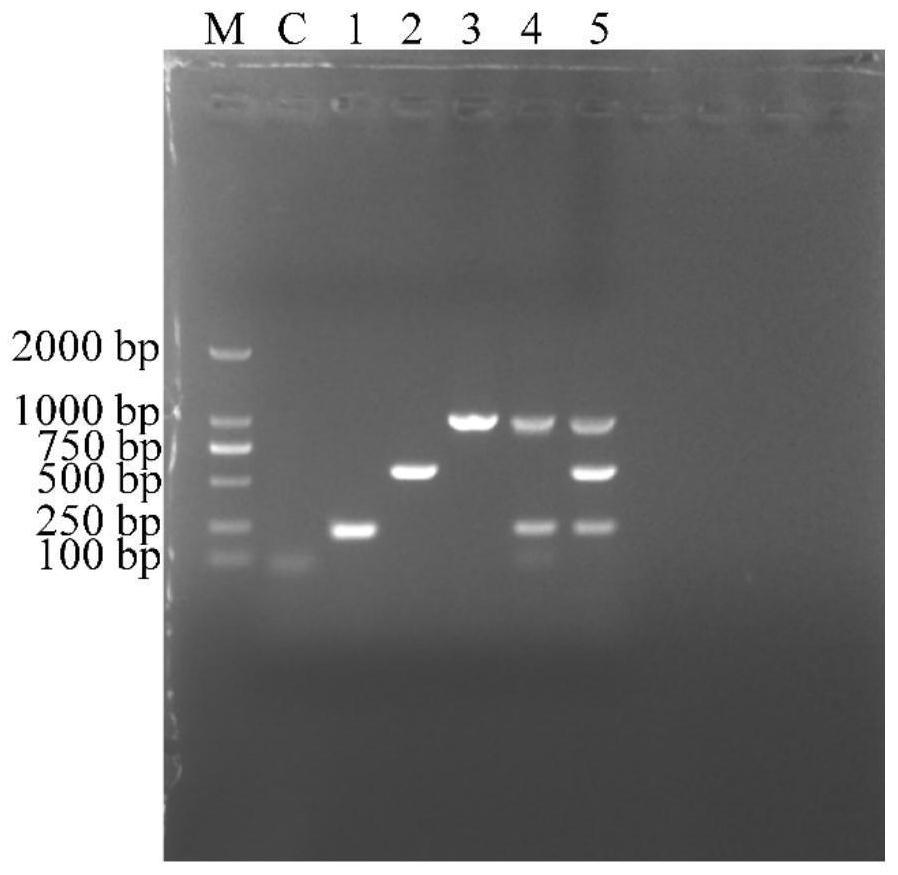
图1为单增李斯特菌CC87型和CC88型菌株鉴定PCR引物特异性分析结果示意图(M为DL2000 DNA标准marker,C为阴性对照,泳道1、2、3分别为基因CRH04_04965、JKV74_12770和A6K41_13255的特异性靶标序列扩增条带,泳道4为CC87菌株PCR产物的琼脂糖凝胶电泳结果,泳道5为CC88菌株PCR产物的琼脂糖凝胶电泳结果)。
图2为单增李斯特菌ST121菌株多重PCR特异性分析结果示意图(M为 DL2000 DNA标准marker,C为阴性对照,1~80泳道是PCR产物的琼脂糖凝胶电泳结果,其中1~12为单核细胞增生李斯特菌CC87型菌株,13为CC88型菌株,14~80为其他CC型单增李斯特菌)。
图3为单增李斯特菌CC87和CC88型菌株多重PCR灵敏度测定结果示意图(M为DL2000 DNA标准marker,C为阴性对照;图A为多重PCR检测CC87 型菌株,1~9泳道对应的DNA模板浓度分别为71.6ng、7.16ng、0.716ng、71.6pg、 7.16pg、0.716pg、71.6fg、7.16fg、0.716fg;图B为多重PCR检测CC88型菌株, 1~9泳道对应的模板浓度分别为60.8ng、6.08ng、0.608ng、60.8pg、6.08pg、 0.608pg、60.8fg、6.08fg、0.608fg)
具体实施方式
为了更加简洁明了的展示本发明的技术方案、目的和优点,下面结合具体实施例详细说明本发明的技术方案。如无特殊说明,本发明实施例中所涉及的试剂均为市售产品,均可以通过商业渠道购买获得。
实施例1单重PCR体系特异性检测
本实施例提供一种同时检测单核细胞增生李斯特菌CC87和CC88型菌株的 PCR试剂盒,包括常规PCR组件,还包括针对单核细胞增生李斯特菌CC87和 CC88型菌株的特异性引物,特异性引物序列见表1,常规PCR组件包括Taq DNA 聚合酶、MgCl2、PCR扩增缓冲液、dNTP、去离子水。
表1针对单核细胞增生李斯特菌CC87和CC88型菌株的特异性引物
单重PCR体系的特异性检测(为了与多重PCR进行区别本实施例将其命名为单重PCR):采用单引物对+基因组DNA模板的PCR扩增方法,扩增CC87 和CC88型菌株的各个靶标DNA序列,基因A6K41_13255、JKV74_12770和 CRH04_04965的模板均来自于各菌的基因组DNA,模板DNA浓度为20ng/μL。
单重PCR采用25μL反应体系,包括:10μmol/L的引物0.25~1.0μL,2.5U/ μL的TaqDNA polymerase 0.5μL,25mmol/L MgCl
PCR结果如图1所示,M为DL2000 DNA标准marker,依次为C为阴性对照,泳道1、2、3分别为基因4965、770和255的特异性靶标序列扩增条带,泳道4为CC87菌株PCR产物的琼脂糖凝胶电泳结果,泳道5为CC88菌株PCR 产物的琼脂糖凝胶电泳结果。可见,使用本发明的引物以及单重PCR体系检测靶标DNA,可以从相应基因组DNA模板中扩增出与其大小的单一产物,且条带清晰,结果表明本发明的单重PCR引物特异性强。
实施例2多重PCR体系检测
1.多重PCR体系的特异性检测:
采用多引物对+基因组DNA模板的PCR扩增方法,扩增CC87和CC88型菌株的各个靶标DNA序列,基因A6K41_13255、JKV74_12770和CRH04_04965 的模板均采用基因组DNA,模板DNA浓度为20ng/μL。多重PCR采用25μL 反应体系,包括:浓度为10μM的每条靶标DNA特异性引物0.5μL,2.5U/ μL的Taq DNA polymerase 0.5μL,25mmol/LMgCl
结果如图2所示,图中M为DL2000 DNA标准marker,C为阴性对照,1~80 泳道是PCR产物的琼脂糖凝胶电泳结果,其中1~12为单核细胞增生李斯特菌 CC87型菌株,13为CC88型菌株,14~80为其他CC型单增李斯特菌。可见,运用本发明的多重PCR体系检测靶标DNA,可以从相应基因组DNA模板中扩增出与其大小的单一产物,且条带清晰,结果表明本发明的多重PCR引物特异性强。
2.多重PCR体系的灵敏度检测:
采用10倍稀释法对含靶标基因的基因组DNA模板进行模板梯度PCR检测,将基因组模板用ddH
结果图3所示,图3-A为多重PCR检测CC87型菌株中,M为DL2000 DNA 标准marker,C为阴性对照,1~9泳道对应的DNA模板浓度分别为71.6ng/25 μL(即2.86ng/μL)、7.16ng/25μL、0.716ng/25μL、71.6pg/25μL、7.16pg /25μL、0.716pg/25μL、71.6fg/25μL、7.16fg/25μL、0.716fg/25μL;图3-B 为多重PCR检测CC88型菌株,1~9泳道对应的模板浓度分别为60.8ng/25μL、 6.08ng/25μL、0.608ng/25μL、60.8pg/25μL、6.08pg/25μL、0.608pg/25 μL、60.8fg/25μL、6.08fg/25μL、0.608fg/25μL。结果表明,使用本发明的多重PCR体系检测靶标DNA,CC87型和CC88型菌株检测灵敏度最高分别可达7.16pg/25μL(即0.286pg/μL)和6.08pg/25μL(即0.243pg/μL),具有较高的灵敏度,可用于单核细胞增生李斯特菌CC87和CC88型菌株的检测。
可见,本发明筛选获得的靶序列(SEQ ID NO:7~9)以及针对所述靶序列设计的扩增引物(SEQ ID NO:1~6)具有较高的特异性,能从单核细胞增生李斯特菌检测出单核细胞增生李斯特菌CC87和CC88型菌株,且具有高度的灵敏性, CC87型菌株的DNA模板浓度低至7.16pg(即0.286pg/μL)时以及CC88型菌株的DNA模板浓度低至6.08pg(即0.243pg/μL)时,仍能扩增出目的条带进行检测。
虽然,可通过引物软件以及引物的设计原则获得一系列可扩增靶序列(SEQ IDNO:7~9)的引物,但是要获得最佳灵敏度,使得DNA模板浓度低至7.16pg (即0.286pg/μL)和6.08pg(即0.243pg/μL)时,仍然能扩增出目的条带的引物,并不是仅能通过引物软件以及引物的设计原则就能获得,需要通过大量的实验筛选获得本发明灵敏度最佳的PCR扩增引物。
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
SEQUENCE LISTING
<110> 广东省科学院微生物研究所(广东省微生物分析检测中心)
<120> 一种同时检测单增李斯特菌CC87和88型菌株的引物、试剂盒以及方法
<130> 2.12
<160> 9
<170> PatentIn version 3.3
<210> 1
<211> 23
<212> DNA
<213> 合成
<400> 1
gttggtcaat gagaggggtg gtg 23
<210> 2
<211> 25
<212> DNA
<213> 合成
<400> 2
gggaagaact ccttacgatg cacat 25
<210> 3
<211> 23
<212> DNA
<213> 合成
<400> 3
gcacgggact agattggaag cag 23
<210> 4
<211> 26
<212> DNA
<213> 合成
<400> 4
tgctccgttt acactacttt cattcc 26
<210> 5
<211> 24
<212> DNA
<213> 合成
<400> 5
gagattcctg atcccgatcg tgta 24
<210> 6
<211> 26
<212> DNA
<213> 合成
<400> 6
cgcaacaaca atgaataata acgcag 26
<210> 7
<211> 2073
<212> DNA
<213> Listeria monocy togenes
<400> 7
atggaattaa aagattttca tcaatctctt atacaacagg tgaatgaaga ccgacaattg 60
actggttcta cattcgaaga ggcttttttt gatgcttatg ctgattattt agtagaaaat 120
gatgaaatca ttggtgaacc aaactttctt cattttgaaa tgccattatc tcgtaatcag 180
aaagcatgta tctctggttt tgcatacaat gagctagatg gaatcctata tttaatgctt 240
gtggatgata ttgatttcac tgacgaaatt ccaacgttat tacttactga tgctgagaga 300
ctttataaga gagctagaaa ctttttttca cattctgaag aaattgcaaa gtatggtgag 360
gagtcaaatg aagctgtaaa tctggctaga tcaatttaca caaggaaaga aaatgatcga 420
aatcagtatt atgaattagc atcagttaag gtcttcattt tcaccgacaa acctttgaca 480
cgtactttga agaggatgga ggatgaacaa attcaaggag tgaaaatttc aactcagctt 540
gtcgggatag aacgtatttt aagtttgtca gaaagtagaa aaggtaaggt tgatttagag 600
ataaatttga atgattttca attaatacct gcactaaaag ctaatgaagc tgatgattac 660
gaatcgtatc tatgtaatat aaatgggtac acattggcaa aactatataa tgaatatggt 720
agtagattga tagagagtaa cgttcgttct tttttacaaa cgcgcggtaa tgtcaacaaa 780
ggtattaagc gtactatatt aaaagagcct gaaagatttt ttgcttataa taatggttta 840
acctgtacag ctaaaagtat agttattaag gataatatta tcactgaaat tatcggacta 900
caaatcgtaa atggtggtca aactacagct agtcttgcaa atgtgttggt caatgagagg 960
ggtggtgctg aaaaccttca agaagtgtca gttccgatga aattgaatgt tataaaaaat 1020
attgaaattg aggacgagtt gattcctgaa atttcccggt atgctaattc gcagaataaa 1080
gtttcagatg ttgatttagc aagtaatcat ccttttcaca aaaaaattga agagctatca 1140
agaaaaattt cagctccagc agctgatgga ttttctcatg gaacatattg gtattatgag 1200
agagcggcag gacaatacgc acaagaaaca tataaaatgc cttctggaca aaaaaataat 1260
ttcataaata aaaatccaaa gagtcaaatg tttagaaaat cggattttgc taaatatttt 1320
aacatatatc aaaaaagacc tgacattgca tctaaaggag gtcaaacagc cttcaaagcc 1380
ttttcatcat ggataattag aacatgggaa aatgattcaa atattattaa tcaagagttt 1440
tataaagaaa tggtttctaa tattatcatg tttaaagaat tagataaact aacaaagaaa 1500
ggcgcagggt ctaacggtta taaagcaaat attaatgcat atacactatc ttatctgtat 1560
tggtatcttg aagagaaaat gaatatgaaa tttaattatt tgaaaatctg gcaacaacag 1620
tcagttccac aatcggtttt aaaatttatg gatgagattt catatgaaat ccgtgatatt 1680
ttaaaaagag tagacggaaa tgtcactgaa tatgctaaaa gaataattgc ttgggacgat 1740
gttaaattga tggtaaagat aaataaaaac tacgacttgt ccattattgc tatatcgaag 1800
gatgacatgg tacaatcgaa aaaaatagct agaaataacg aaaaatttga aaatgattac 1860
ctcggaactg tctcggtgta taaaagactc gaagagaatc cgaattatta taaagatatg 1920
ttgcttttta ttgatgtgca tcgtaaggag ttcttcccaa aagaacgaga cgtaattgct 1980
ttgttagtag ccaacaaatt tttatctgat aaacaaagcg agattgctct tcaagcgatt 2040
gaaaaagctg agcttgaagg ttttggattg taa 2073
<210> 8
<211> 1386
<212> DNA
<213> Listeria monocy togenes
<400> 8
atgagtgaac taataaaaag agaagaagtt tatcagaaaa tattcaaagc ctttaactat 60
ggaaatttag gaatgtttat aggagcggga ttttccaaag ctgtaattgg agatgggaaa 120
aatccagctt taggttggtt agatattatt cggaaagtga gtaaggtttt tagtattgag 180
tttccgcaag aaaaagattt attaggaatt tcattacctg acttagcgac ggatatatgt 240
aaaaaaatag ccgagaaaga agcatgtgaa tactctgaag cgaaaacttc atttaaaaaa 300
gaaatatgta atatatctaa ttggctccct gataaagaaa gtgaagagaa gtatagagag 360
aaactggagt atttaaatcc tgcatggatt gttactacta attatgatca agtgattgaa 420
atgattttga ctggaaaatg tattagctta aacccaatga gttatctttc agctcctagt 480
aatgttattc ctgtttatca tttgcacggg actagattgg aagcagaatc tattgttata 540
actcaagaag attatattcc aatgtttagg ccaaatgaat atagacaagt taaattagct 600
atgacgataa gagagtctac aacattgatt ttaggttatg gactaggtga tgttaatgtt 660
ctatcagctg ttgattggtc taaaaatatt tatactgaag aaacaacgta tccacatgga 720
attattcaag ccttatggaa atctaatcct aagaaagatg cttatataga cgaaaatggt 780
aatattattt tagaaattga agatttagaa acttttttag atgagttaat agaatttatt 840
aaattggagg aaattaaata caaagaaaag ctaaaagagt taaatcgact tattgatgat 900
ttaaaggtga ctaacgatga ttttattgac tcttttgtta atgataaaga tgctaggttg 960
gaaatactaa aagttgtatc agaatttgag tatcaaacag tgttaccata tatcgagttt 1020
ctaaataatt gtctggataa attatggaat gaaagtagtg taaacggagc atttgaaaaa 1080
tacaatgaat acttaacaat aatattagat attttgatta attatgaata taagaaaatg 1140
ccgcaaaaac tttttaaatt aagcatggag ggtttggatt gggttcttgg atatattgat 1200
ttgaatccag ctaaaaaaac acttgggaac agtcatttgg cgagtagtca atggcataat 1260
agaaaaaaca gtattccaga tgacaccaag gagcaaatat accagtatgc tgaaaaaaat 1320
aagttacatc aattaacaat agcaactgaa gaattttcag agaatcttta tttagttgaa 1380
aagtaa 1386
<210> 9
<211> 459
<212> DNA
<213> Listeria monocy togenes
<400> 9
atgattaaac gaactggtga gatagtactc gctattattg gtcttgtttt aagtatactc 60
gcacaagcat ttattgctat tattggtcta ttgatgataa gtggttcaaa aggaaaagaa 120
ggtttaacaa ctttctacaa caactactac aaaacaatga atgaatggga gatcccgaaa 180
aaagagattc ctgatcccga tcgtgtacta gattttgtgc aaacattatc ttggactgca 240
ttaacaggag gcttaattac gctcgcactt ggtatctttg ggatttacta catattcaaa 300
aataaaaaac cagtttttgc aggatattta tttttagcag caggcgttgt atcgttgctt 360
tctacagcac taattagttt cattcctgcg ttattattca ttgttgttgc gatactttgt 420
tttgtccgca aaccgaagag cactttttct ggattataa 459
- 一种同时检测单增李斯特菌CC87和88型菌株的引物、试剂盒以及方法
- 一种同时检测猪链球菌通用型和猪链球菌2型双重荧光定量PCR引物、试剂盒及方法
