结合到ILT4的抗体
文献发布时间:2023-06-19 11:39:06
技术领域
本申请涉及特异性结合到ILT4且抑制ILT4的抗体,以及其在癌症治疗中的用途。
背景技术
ILT4(免疫球蛋白样转录物4;也称为LILRB2、LIR2、MIR10和CD85d)表达在骨髓细胞上,诸如单核细胞、巨噬细胞和树突状细胞。ILT4为结构上相关的受体的家族的一部分,所述家族还包括蛋白LILRA1、LILRA2、LILRA3、LILRA4、LILRA5、LILRA6、ILT2、ILT3、ILT5和LIR8。
这个家族中的蛋白质的胞外结构域含有若干免疫球蛋白样重复序列,而其细胞质尾区含有若干基于酪氨酸的抑制基序(ITIM),其补充酪氨酸磷酸酶。
发明内容
本发明的某些实施方案概述于本发明结尾处的权利要求书中。例如,本发明包括以下实施方案以及在本文的正文的其他部分以及图式和序列中所描述的其他实施方案。
实施方案1:一种特异性结合到人类ILT4(hILT4或ILT4)的分离的抗体,所述抗体包含重链和轻链,并且还包含以下特征中的一种或多种:
-例如以10
-不特异性结合到hILT2、hILT3和/或hILT5;
-不特异性结合到LILRA和/或LILRB家族的一个或多个成员;
-例如在混合淋巴细胞反应(MLR)测定中刺激T细胞活化,如通过增加的T细胞增殖或IFN-γ分泌所测量,例如如实施例中所描述的测定中所示;
-刺激单核细胞分化或活化成巨噬细胞,例如刺激单核细胞分化成促炎性巨噬细胞,例如如所述实施例中所描述的测定中所示;
-促进CD83和CD86在人类单核细胞源性未成熟树突状细胞(Mo-iDC)上的表达,例如如所述实施例中所描述的测定中所示;
-在巨细胞病毒(CMV)溶胞物测定中增强在抗原刺激后的IFN-γ分泌,例如如所述实施例中所描述的测定中所示;
-在同种异体混合淋巴细胞反应(MLR)测定中增强在CD3刺激后通过CD4+和CD8+T细胞的IFN-γ和TNF-α分泌,例如如所述实施例中所描述的测定中所示;
-抑制HLA-A和/或HLA-B与ILT4的结合;
-结合到
-与本文所描述的抗体竞争结合到hILT4;
-特异性结合到包含SEQ ID NO:118的食蟹猴ILT4,例如如所述实施例中所描述的结合测定中所示;
-抑制人类ILT4(hILT4)与ILT4结合伴侣,诸如MHC I类分子,诸如HLA-A和HLA-B的结合(例如,抑制hILT4与HLA-A和HLA-B两者的结合);
-具有图28中所示的HLA-A和HLA-B结合概况;
-促进巨噬细胞朝向M1巨噬细胞的促炎性极化;
-具有如图27中所示的结合概况;
-不诱导(或触发)嗜碱性粒细胞活化;
-结合到hILT4的以下区域:(i)
-与成熟hILT4的一个或多个(或全部)氨基酸残基Lys43、Ile49、Thr50和Arg51相互作用,或与成熟hILT4的一个或多个(或全部)氨基酸残基Gly117、Val119、Try120、Leu134、Lys136、Gln149、Pro150、Ile159、Ser161、Val162、Gly163、Pro164、Pro167、His173、Try178、Pro183和Tyr184相互作用,或与成熟hILT4的一个或多个(或全部)氨基酸残基Glu42、Lys43、Gly76、Cys77、Leu88、Pro91、Pro183和Tyr184相互作用,如通过例如所述实施例中所描述的卡宾足迹法测定。
实施方案2:如实施方案1所述的分离的抗体,其包含重链和轻链,其中所述重链包含以下抗ILT4抗体的VH CDR1、CDR2和CDR3:9G4(SEQ ID NO:125-127)、9C8(SEQ ID NO:131-133)、2H2(SEQ ID NO:137-139)、2E5(SEQ ID NO:143-145)、24E5(SEQ ID NO:149-151)、21D9(SEQ ID NO:155-157)、21A5(SEQ ID NO:161-163)或10F10(SEQ ID NO:167-169)。
实施方案3:如实施方案1或2所述的分离的抗体,其包含重链和轻链,其中所述轻链包含以下抗ILT4抗体的VL CDR1、CDR2和CDR3:9G4(SEQ ID NO:128-130)、9C8(SEQ IDNO:134-136)、2H2(SEQ ID NO:140-142)、2E5(SEQ ID NO:146-148)、24E5(SEQ ID NO:152-154)、21D9(SEQ ID NO:158-160)、21A5(SEQ ID NO:164-166)或10F10(SEQ ID NO:170-172)。
实施方案4:如实施方案2所述的分离的抗体,其中所述重链包含以下抗ILT4抗体的VH CDR1、CDR2和CDR3以及VL CDR1、CDR2和CDR3:9G4(SEQ ID NO:143-148)、24E5(SEQ IDNO:149-154)、21D9(SEQ ID NO:155-160)、21A5(SEQ ID NO:161-166)或10F10(SEQ ID NO:167-172)。
实施方案5:如实施方案1-4中任一项所述的分离的抗体,其包含:
-包含9G4的VH CDR1、CDR2和CDR3的氨基酸序列(SEQ ID NO:125-127)的VH,和包含9G4的VL CDR1、CDR2和CDR3的氨基酸序列(SEQ ID NO:128-130)的VL;
-包含9C8的VH CDR1、CDR2和CDR3的氨基酸序列(SEQ ID NO:131-133)的VH,和包含9C8的VL CDR1、CDR2和CDR3的氨基酸序列(SEQ ID NO:134-136)的VL;
-包含2H2的VH CDR1、CDR2和CDR3的氨基酸序列(SEQ ID NO:137-139)的VH,和包含2H2的VL CDR1、CDR2和CDR3(SEQ ID NO:140-142)的VL;
-包含2E5的VH CDR1、CDR2和CDR3的氨基酸序列(SEQ ID NO:143-145)的VH,和包含2E5的VL CDR1、CDR2和CDR3的氨基酸序列(SEQ ID NO:146-148)的VL;
-包含24E5的VH CDR1、CDR2和CDR3的氨基酸序列(SEQ ID NO:149-151)的VH,和包含24E5的VL CDR1、CDR2和CDR3的氨基酸序列(SEQ ID NO:152-154)的VL;
-包含21D9的VH CDR1、CDR2和CDR3的氨基酸序列(SEQ ID NO:155-157)的VH,和包含21D9的VL CDR1、CDR2和CDR3的氨基酸序列(SEQ ID NO:158-160)的VL;
-包含21D9.b的VH CDR1、CDR2和CDR3的氨基酸序列(SEQ ID NO:155-157)的VH,和包含21D9.b的VL CDR1、CDR2和CDR3的氨基酸序列(SEQ ID NO:158-160)的VL;
-包含21D9.c的VH CDR1、CDR2和CDR3的氨基酸序列(SEQ ID NO:155-157)的VH,和包含21D9.c的VL CDR1、CDR2和CDR3的氨基酸序列(SEQ ID NO:158-160)的VL;
-包含21D9.d的VH CDR1、CDR2和CDR3的氨基酸序列(SEQ ID NO:155-157)的VH,和包含21D9.d的VL CDR1、CDR2和CDR3的氨基酸序列(SEQ ID NO:158-160)的VL;
-包含21D9.e的VH CDR1、CDR2和CDR3的氨基酸序列(SEQ ID NO:155-157)的VH,和包含21D9.e的VL CDR1、CDR2和CDR3的氨基酸序列(SEQ ID NO:158-160)的VL;
-包含21A5的VH CDR1、CDR2和CDR3的氨基酸序列(SEQ ID NO:161-163)的VH,和包含21A5的VL CDR1、CDR2和CDR3的氨基酸序列(SEQ ID NO:164-166)的VL;
-包含21A5.a的VH CDR1、CDR2和CDR3的氨基酸序列(SEQ ID NO:161-163)的VH,和包含21A5.a的VL CDR1、CDR2和CDR3的氨基酸序列(SEQ ID NO:164-166)的VL;
-包含10F10的VH CDR1、CDR2和CDR3的氨基酸序列(SEQ ID NO:167-169)的VH,和包含10F10的VL CDR1、CDR2和CDR3的氨基酸序列(SEQ ID NO:170-172)的VL;
-包含10F10.1的VH CDR1、CDR2和CDR3的氨基酸序列(SEQ ID NO:167-169)的VH,和包含10F10.1的VL CDR1、CDR2和CDR3的氨基酸序列(SEQ ID NO:170-172)的VL;
-包含10F10.3的VH CDR1、CDR2和CDR3的氨基酸序列(SEQ ID NO:167-169)的VH,和包含10F10.3的VL CDR1、CDR2和CDR3的氨基酸序列(SEQ ID NO:170-172)的VL;或
-包含10F10.4的VH CDR1、CDR2和CDR3的氨基酸序列(SEQ ID NO:167-169)的VH,和包含10F10.4的VL CDR1、CDR2和CDR3的氨基酸序列(SEQ ID NO:170-172)的VL。
实施方案6:如实施方案1-5中任一项所述的分离的抗体,其中所述抗体重链包含氨基酸序列与以下各者的VH的氨基酸序列具有至少95%、至少96%、至少97%、至少98%或至少99%同一性的VH:9G4(SEQ ID NO:51,氨基酸20-135)、9C8(SEQ ID NO:55)、2H2(SEQID NO:58)、2E5(SEQ ID NO:63)、24E5(SEQ ID NO:67)、21D9(SEQ ID NO:71)、21D9.b(SEQID NO:74)、21D9.c(SEQ ID NO:75)、21D9.d(SEQ ID NO:78)、21D9.e(SEQ ID NO:80)、21A5(SEQ ID NO:83)、21A5.a(SEQ ID NO:87)、10F10(SEQ ID NO:91)、10F10.1(SEQ ID NO:91)、10F10.3(SEQ ID NO:91)或10F10.4(SEQ ID NO:91)。
实施方案7:如实施方案1-6中任一项所述的分离的抗体,其中所述抗体轻链包含氨基酸序列与以下各者的VL的氨基酸序列具有至少95%、至少96%、至少97%、至少98%或至少99%同一性的VL:9G4(SEQ ID NO:50,氨基酸19-125)、9C8(SEQ ID NO:54)、2H2(SEQID NO:59)、2E5(SEQ ID NO:62)、24E5(SEQ ID NO:66)、21D9(SEQ ID NO:70)、21D9.b(SEQID NO:70)、21D9.c(SEQ ID NO:70)、21D9.d(SEQ ID NO:70)、21D9.e(SEQ ID NO:70)、21A5(SEQ ID NO:82)、21A5.a(SEQ ID NO:86)、10F10(SEQ ID NO:90)、10F10.1(SEQ ID NO:94)、10F10.3(SEQ ID NO:96)或10F10.4(SEQ ID NO:114)。
实施方案8:如实施方案1-7中任一项所述的分离的抗体,其中所述抗体重链包含氨基酸序列与以下各者的VH的氨基酸序列相比包含1、2、3、4或5个氨基酸取代、保守性取代或回复取代的VH:9G4(SEQ ID NO:51,氨基酸20-135)、9C8(SEQ ID NO:55)、2H2(SEQ IDNO:58)、2E5(SEQ ID NO:63)、24E5(SEQ ID NO:67)、21D9(SEQ ID NO:71)、21D9.b(SEQ IDNO:74)、21D9.c(SEQ ID NO:75)、21D9.d(SEQ ID NO:78)、21D9.e(SEQ ID NO:80)、21A5(SEQ ID NO:83)、21A5.a(SEQ ID NO:87)、10F10(SEQ ID NO:91)、10F10.1(SEQ ID NO:91)、10F10.3(SEQ ID NO:91)或10F10.4(SEQ ID NO:91)。
实施方案9:如实施方案1-8中任一项所述的分离的抗体,其中所述抗体轻链包含氨基酸序列与以下各者的VL的氨基酸序列相比包含1、2、3、4或5个氨基酸取代、保守性取代或回复取代的VL:9G4(SEQ ID NO:50,氨基酸19-125)、9C8(SEQ ID NO:54)、2H2(SEQ IDNO:59)、2E5(SEQ ID NO:62)、24E5(SEQ ID NO:66)、21D9(SEQ ID NO:70)、21D9.b(SEQ IDNO:70)、21D9.c(SEQ ID NO:70)、21D9.d(SEQ ID NO:70)、21D9.e(SEQ ID NO:70)、21A5(SEQ ID NO:82)、21A5.a(SEQ ID NO:86)、10F10(SEQ ID NO:90)、10F10.1(SEQ ID NO:94)、10F10.3(SEQ ID NO:96)或10F10.4(SEQ ID NO:114)。
实施方案10:如实施方案1-9中任一项所述的分离的抗体,其中所述重链包含以下抗ILT4抗体的VH:9G4(SEQ ID NO:51,氨基酸20-135)、9C8(SEQ ID NO:55)、2H2(SEQ IDNO:58)、2E5(SEQ ID NO:63)、24E5(SEQ ID NO:67)、21D9(SEQ ID NO:71)、21D9.b(SEQ IDNO:74)、21D9.c(SEQ ID NO:75)、21D9.d(SEQ ID NO:78)、21D9.e(SEQ ID NO:80)、21A5(SEQ ID NO:83)、21A5.a(SEQ ID NO:87)、10F10(SEQ ID NO:91)、10F10.1(SEQ ID NO:91)、10F10.3(SEQ ID NO:91)或10F10.4(SEQ ID NO:91)。
实施方案11:如实施方案1-10中任一项所述的分离的抗体,其中所述轻链包含以下抗ILT4抗体的VL:9G4(SEQ ID NO:50,氨基酸19-125)、9C8(SEQ ID NO:54)、2H2(SEQ IDNO:59)、2E5(SEQ ID NO:62)、24E5(SEQ ID NO:66)、21D9(SEQ ID NO:70)、21D9.b(SEQ IDNO:70)、21D9.c(SEQ ID NO:70)、21D9.d(SEQ ID NO:70)、21D9.e(SEQ ID NO:70)、21A5(SEQ ID NO:82)、21A5.a(SEQ ID NO:86)、10F10(SEQ ID NO:90)、10F10.1(SEQ ID NO:94)、10F10.3(SEQ ID NO:96)或10F10.4(SEQ ID NO:114)。
实施方案12:如实施方案1-11中任一项所述的分离的抗体,其包含以下抗ILT4抗体的VH和VL:9G4(SEQ ID NO:51,氨基酸20-135和SEQ ID NO:50,氨基酸19-125)、9C8(SEQID NO:55和SEQ ID NO:54)、2H2(SEQ ID NO:58和SEQ ID NO:59)、2E5(SEQ ID NO:63和SEQID NO:62)、24E5(SEQ ID NO:67和SEQ ID NO:66)、21D9(SEQ ID NO:71和SEQ ID NO:70)、21D9.b(SEQ ID NO:74和SEQ ID NO:70)、21D9.c(SEQ ID NO:75和SEQ ID NO:70)、21D9.d(SEQ ID NO:78和SEQ ID NO:70)、21D9.e(SEQ ID NO:80和SEQ ID NO:70)、21A5(SEQ IDNO:83和SEQ ID NO:82)、21A5.a(SEQ ID NO:87和SEQ ID NO:86)、10F10(SEQ ID NO:91和SEQ ID NO:90)、10F10.1(SEQ ID NO:91和SEQ ID NO:94)、10F10.3(SEQ ID NO:91和SEQID NO:96)或10F10.4(SEQ ID NO:91和SEQ ID NO:114)。
实施方案13:如实施方案1-11中任一项所述的分离的抗体,其包含:
-包含9G4的VH的VH CDR(SEQ ID NO:125-127)的VH,和包含9G4的VL CDR(SEQ IDNO:128-130)的VL,以及与9G4的VH和VL(SEQ ID NO:51,氨基酸20-135和SEQ ID NO:50,氨基酸19-125)具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的VH和VL氨基酸序列;
-包含9C8的VH的VH CDR(SEQ ID NO:131-133)的VH,和包含9C8的VL CDR(SEQ IDNO:134-136)的VL,以及与9C8的VH和VL(SEQ ID NO:55和SEQ ID NO:54)具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的VH和VL氨基酸序列;
-包含2H2的VH的VH CDR(SEQ ID NO:137-139)的VH,和包含2H2的VL CDR(SEQ IDNO:140-142)的VL,以及与2H2的VH和VL(SEQ ID NO:58和SEQ ID NO:59)具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的VH和VL氨基酸序列;
-包含2E5的VH的VH CDR(SEQ ID NO:143-145)的VH,和包含2E5的VL CDR(SEQ IDNO:146-148)的VL,以及与2E5的VH和VL(SEQ ID NO:63和SEQ ID NO:62)具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的VH和VL氨基酸序列;
-包含24E5的VH的VH CDR(SEQ ID NO:149-151)的VH,和包含24E5的VL CDR(SEQID NO:152-154)的VL,以及与24E5的VH和VL(SEQ ID NO:67和SEQ ID NO:66)具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的VH和VL氨基酸序列;
-包含21D9的VH的VH CDR(SEQ ID NO:155-157)的VH,和包含21D9的VL CDR(SEQID NO:158-160)的VL,以及与21D9的VH和VL(SEQ ID NO:71和SEQ ID NO:70)具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的VH和VL氨基酸序列;
-包含21D9.b的VH的VH CDR(SEQ ID NO:155-157)的VH,和包含21D9.b的VL CDR(SEQ ID NO:158-160)的VL,以及与21D9.b的VH和VL(SEQ ID NO:74和SEQ ID NO:70)具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的VH和VL氨基酸序列;
-包含21D9.c的VH的VH CDR(SEQ ID NO:155-157)的VH,和包含21D9.c的VL CDR(SEQ ID NO:158-160)的VL,以及与21D9.c的VH和VL(SEQ ID NO:75和SEQ ID NO:70)具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的VH和VL氨基酸序列;
-包含21D9.d的VH的VH CDR(SEQ ID NO:155-157)的VH,和包含21D9.d的VL CDR(SEQ ID NO:158-160)的VL,以及与21D9.d的VH和VL(SEQ ID NO:78和SEQ ID NO:70)具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的VH和VL氨基酸序列;
-包含21D9.e的VH的VH CDR(SEQ ID NO:155-157)的VH,和包含21D9.e的VL CDR(SEQ ID NO:158-160)的VL,以及与21D9.e的VH和VL(SEQ ID NO:80和SEQ ID NO:70)具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的VH和VL氨基酸序列;
-包含21A5的VH的VH CDR(SEQ ID NO:161-163)的VH,和包含21A5的VL CDR(SEQID NO:164-166)的VL,以及与21A5的VH和VL(SEQ ID NO:83和SEQ ID NO:82)具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的VH和VL氨基酸序列;
-包含21A5.a的VH的VH CDR(SEQ ID NO:161-163)的VH,和包含21A5.a的VL CDR(SEQ ID NO:164-166)的VL,以及与21A5.a的VH和VL(SEQ ID NO:87和SEQ ID NO:86)具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的VH和VL氨基酸序列;
-包含10F10的VH的VH CDR(SEQ ID NO:167-169)的VH,和包含10F10的VL CDR(SEQID NO:170-172)的VL,以及与10F10的VH和VL(SEQ ID NO:91和SEQ ID NO:90)具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的VH和VL氨基酸序列;
-包含10F10.1的VH的VH CDR(SEQ ID NO:167-169)的VH,和包含10F10.1的VL CDR(SEQ ID NO:170-172)的VL,以及与10F10.1的VH和VL(SEQ ID NO:91和SEQ ID NO:94)具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的VH和VL氨基酸序列;
-包含10F10.3的VH的VH CDR(SEQ ID NO:167-169)的VH,和包含10F10.3的VL CDR(SEQ ID NO:170-172)的VL,以及与10F10.3的VH和VL(SEQ ID NO:91和SEQ ID NO:96)具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的VH和VL氨基酸序列;或
-包含10F10.4的VH的VH CDR(SEQ ID NO:167-169)的VH,和包含10F10.4的VL CDR(SEQ ID NO:170-172)的VL,以及与10F10.4的VH和VL(SEQ ID NO:91和SEQ ID NO:114)具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的VH和VL氨基酸序列。
实施方案14:如实施方案1-13中任一项所述的分离的抗体,其包含:
-包含9G4的VH的氨基酸序列(SEQ ID NO:51残基20-135)的VH和包含9G4的VL的氨基酸序列(SEQ ID NO:50残基19-125)的VL;
-包含9C8的VH的氨基酸序列的VH和包含9C8的VL的氨基酸序列的VL(SEQ ID NO:55和SEQ ID NO:54);
-包含2H2的VH的氨基酸序列的VH和包含2H2的VL的氨基酸序列的VL(SEQ ID NO:58和SEQ ID NO:59);
-包含2E5的VH的氨基酸序列的VH和包含2E5的VL的氨基酸序列的VL(SEQ ID NO:63和SEQ ID NO:62);
-包含24E5的VH的氨基酸序列的VH和包含24E5的VL的氨基酸序列的VL(SEQ IDNO:67和SEQ ID NO:66);
-包含21D9的VH的氨基酸序列的VH和包含21D9的VL的氨基酸序列的VL(SEQ IDNO:71和SEQ ID NO:70);
-包含21D9.b的VH的氨基酸序列的VH和包含21D9.b的VL的氨基酸序列的VL(SEQID NO:74和SEQ ID NO:70);
-包含21D9.c的VH的氨基酸序列的VH和包含21D9.c的VL的氨基酸序列的VL(SEQID NO:75和SEQ ID NO:70);
-包含21D9.d的VH的氨基酸序列的VH和包含21D9.d的VL的氨基酸序列的VL(SEQID NO:78和SEQ ID NO:70);
-包含21D9.e的VH的氨基酸序列的VH和包含21D9.e的VL的氨基酸序列的VL(SEQID NO:80和SEQ ID NO:70);
-包含21A5的VH的氨基酸序列的VH和包含21A5的VL的氨基酸序列的VL(SEQ IDNO:83和SEQ ID NO:82);
-包含21A5.a的VH的氨基酸序列的VH和包含21A5.a的VL的氨基酸序列的VL(SEQID NO:87和SEQ ID NO:86);
-包含10F10的VH的氨基酸序列的VH和包含10F10的VL的氨基酸序列的VL(SEQ IDNO:91和SEQ ID NO:90);
-包含10F10.1的VH的氨基酸序列的VH和包含10F10.1的VL的氨基酸序列的VL(SEQID NO:91和SEQ ID NO:94);
-包含10F10.3的VH的氨基酸序列的VH和包含10F10.3的VL的氨基酸序列的VL(SEQID NO:91和SEQ ID NO:96);或
-包含10F10.4的VH的氨基酸序列的VH和包含10F10.4的VL的氨基酸序列的VL(SEQID NO:91和SEQ ID NO:114)。
实施方案15:如实施方案1-14中任一项所述的分离的抗体,其为IgG抗体。
实施方案16:如实施方案15所述的分离的抗体,其为IgG1、IgG2或IgG4抗体,其中所述IgG4任选包含S228P取代(EU编号)。
实施方案17:如实施方案1-16中任一项所述的分离的抗体,其中所述抗体为无效应物抗体。
实施方案18:如实施方案17所述的分离的抗体,其中所述重链恒定区包含另一野生型人类重链恒定区中的1、2、3、4或5个突变,这些突变使所述抗体的效应功能与无所述1、2、3、4或5个突变但具有相同氨基酸序列的抗体相比有所降低。
实施方案19:如实施方案1-18中任一项所述的分离的抗体,其中所述抗体的所述重链恒定区包含IgG1.3重链恒定区、IgG1.1重链恒定区,或具有P238K(EU编号)取代的IgG1重链恒定区,或包含SEQ ID NO:98、100、102、103或104中的任一个的氨基酸序列的IgG1重链恒定区。
实施方案20:如实施方案1-16或19中任一项所述的分离的抗体,其中所述抗体具有效应功能。
实施方案21:如实施方案20所述的分离的抗体,其中所述抗体为去岩藻糖基化抗体(例如去岩藻糖基化IgG1抗体)。
实施方案22:如实施方案20或21所述的分离的抗体,其中所述重链恒定区包含另一野生型人类重链恒定区中的1、2、3、4或5个突变,这些突变使所述抗体的所述效应功能与无所述1、2、3、4或5个突变但有相同氨基酸序列的抗体相比有所增强。
实施方案23:如实施方案1-22中任一项所述的分离的抗体,其包含抗ILT4抗体9G4、9C8、2H2、2E5、24E5、21D9、21D9.b、21D9.c、21D9.d、21D9.e、21A5、21A5.a、10F10、10F10.1或10F10.3的HC,其中所述HC的所述恒定区为IgG1(例如9G4.IgG1等)、IgG1.3(例如9G4.IgG1.3等)、IgG1.1f(例如9G4.IgG1.1f等)、IgG4(例如9G4.IgG4等)或IgG4 S228P(EU编号)(例如9G4.IgG4_S228P)。
实施方案24:如实施方案23所述的分离的抗体,其中所述抗体包含如下HC氨基酸序列:
-IgG1,例如9G4.IgG1,9G4(SEQ ID NO:2)、9C8(SEQ ID NO:4)、2H2(SEQ ID NO:6)、2E5(SEQ ID NO:8)、24E5(SEQ ID NO:10)、21D9(SEQ ID NO:12)、21D9.b(SEQ ID NO:74和SEQ ID NO:98)、21D9.c(SEQ ID NO:75和SEQ ID NO:98)、21D9.d(SEQ ID NO:78和SEQID NO:98)、21D9.e(SEQ ID NO:80和SEQ ID NO:98)、21A5(SEQ ID NO:83和SEQ ID NO:98)、21A5.a(SEQ ID NO:87和SEQ ID NO:98)、10F10(SEQ ID NO:91和SEQ ID NO:98)、10F10.1(SEQ ID NO:91和SEQ ID NO:98)、10F10.3(SEQ ID NO:91和SEQ ID NO:98)或10F10.4(SEQ ID NO:91和SEQ ID NO:98),
-IgG1,例如9G4.IgG1,9G4(SEQ ID NO:51,氨基酸20-135,和SEQ ID NO:102)、9C8(SEQ ID NO:55和SEQ ID NO:102)、2H2(SEQ ID NO:58和SEQ ID NO:102)、2E5(SEQ ID NO:63和SEQ ID NO:102)、24E5(SEQ ID NO:67和SEQ ID NO:102)、21D9(SEQ ID NO:71和SEQID NO:102)、21D9.b(SEQ ID NO:74和SEQ ID NO:102)、21D9.c(SEQ ID NO:75和SEQ IDNO:102)、21D9.d(SEQ ID NO:78和SEQ ID NO:102)、21D9.e(SEQ ID NO:80和SEQ ID NO:102)、21A5(SEQ ID NO:83和SEQ ID NO:102)、21A5.a(SEQ ID NO:87和SEQ ID NO:102)、10F10(SEQ ID NO:91和SEQ ID NO:102)、10F10.1(SEQ ID NO:91和SEQ ID NO:102)、10F10.3(SEQ ID NO:91和SEQ ID NO:102)或10F10.4(SEQ ID NO:91和SEQ ID NO:102),
-IgG1.3(例如9G4.IgG1.3等),9G4(SEQ ID NO:51,氨基酸20-135,和SEQ ID NO:100)、9C8(SEQ ID NO:55和SEQ ID NO:100)、2H2(SEQ ID NO:58和SEQ ID NO:100)、2E5(SEQ ID NO:63和SEQ ID NO:100)、24E5(SEQ ID NO:67和SEQ ID NO:100)、21D9((i)SEQID NO:113或(ii)SEQ ID NO:71和SEQ ID NO:100)、21D9.b(SEQ ID NO:36)、21D9.c(SEQID NO:38)、21D9.d(SEQ ID NO:40)、21D9.e(SEQ ID NO:13)、21A5(SEQ ID NO:15)、21A5.a(SEQ ID NO:17)、10F10(SEQ ID NO:19)、10F10.1(SEQ ID NO:91和SEQ ID NO:100)、10F10.3(SEQ ID NO:91和SEQ ID NO:100)或10F10.4(SEQ ID NO:91和SEQ ID NO:100);
-IgG1.1f(例如9G4.IgG1.1f等),9G4(SEQ ID NO:51,氨基酸20-135,和SEQ IDNO:103)、9C8(SEQ ID NO:55和SEQ ID NO:103)、2H2(SEQ ID NO:58和SEQ ID NO:103)、2E5(SEQ ID NO:63和SEQ ID NO:103)、24E5(SEQ ID NO:67和SEQ ID NO:103)、21D9(SEQ IDNO:71和SEQ ID NO:103)、21D9.b(SEQ ID NO:74和SEQ ID NO:103)、21D9.c(SEQ ID NO:75和SEQ ID NO:103)、21D9.d(SEQ ID NO:78和SEQ ID NO:103)、21D9.e(SEQ ID NO:80和SEQID NO:103)、21A5(SEQ ID NO:83和SEQ ID NO:103)、21A5.a(SEQ ID NO:87和SEQ ID NO:103)、10F10(SEQ ID NO:91和SEQ ID NO:103)、10F10.1(SEQ ID NO:91和SEQ ID NO:103)、10F10.3(SEQ ID NO:91和SEQ ID NO:103)或10F10.4(SEQ ID NO:91和SEQ ID NO:103),
-IgG1fa.P238K(例如9G4.IgG1fa.P238K等)9G4(SEQ ID NO:51,氨基酸20-135,和SEQ ID NO:104)、9C8(SEQ ID NO:55和SEQ ID NO:104)、2H2(SEQ ID NO:58和SEQ ID NO:104)、2E5(SEQ ID NO:63和SEQ ID NO:104)、24E5(SEQ ID NO:67和SEQ ID NO:104)、21D9(SEQ ID NO:71和SEQ ID NO:104)、21D9.b(SEQ ID NO:74和SEQ ID NO:104)、21D9.c(SEQID NO:75和SEQ ID NO:104)、21D9.d(SEQ ID NO:78和SEQ ID NO:104)、21D9.e(SEQ IDNO:80和SEQ ID NO:104)、21A5(SEQ ID NO:83和SEQ ID NO:104)、21A5.a(SEQ ID NO:87和SEQ ID NO:104)、10F10(SEQ ID NO:91和SEQ ID NO:104)、10F10.1(SEQ ID NO:91和SEQID NO:104)、10F10.3(SEQ ID NO:91和SEQ ID NO:104)或10F10.4(SEQ ID NO:91和SEQ IDNO:104),或
-IgG4 S228P(例如9G4.IgG4 S228P等),9G4(SEQ ID NO:51,氨基酸20-135,和SEQID NO:179)、9C8(SEQ ID NO:55和SEQ ID NO:179)、2H2(SEQ ID NO:58和SEQ ID NO:179)、2E5(SEQ ID NO:63和SEQ ID NO:179)、24E5(SEQ ID NO:67和SEQ ID NO:179)、21D9(SEQID NO:71和SEQ ID NO:179)、21D9.b(SEQ ID NO:74和SEQ ID NO:179)、21D9.c(SEQ IDNO:75和SEQ ID NO:179)、21D9.d(SEQ ID NO:78和SEQ ID NO:179)、21D9.e(SEQ ID NO:80和SEQ ID NO:179)、21A5(SEQ ID NO:83和SEQ ID NO:179)、21A5.a(SEQ ID NO:87和SEQID NO:179)、10F10(SEQ ID NO:91和SEQ ID NO:179)、10F10.1(SEQ ID NO:91和SEQ IDNO:179)、10F10.3(SEQ ID NO:91和SEQ ID NO:179)或10F10.4(SEQ ID NO:91和SEQ IDNO:179)。
实施方案25:如实施方案23所述的分离的抗体,其中所述抗体的所述HC无C端赖氨酸残基。
实施方案26:如实施方案23所述的分离的抗体,其中所述抗体的所述HC包含SEQID NO:98、100、102、103、104或179中的任一个的重链恒定区氨基酸序列。
实施方案27:如实施方案1-26中任一项所述的分离的抗体,其包含抗ILT4抗体9G4、9C8、2H2、2E5、24E5、21D9、21D9.b、21D9.c、21D9.d、21D9.e、21A5、21A5.a、10F10、10F10.1、10F10.3或10F10.4的LC。
实施方案28:如实施方案27所述的分离的抗体,其中所述轻链恒定区为人类κ轻链恒定区。
实施方案29:如实施方案27所述的分离的抗体,其中所述LC包含以下的序列:9G4(SEQ ID NO:1)、9C8(SEQ ID NO:3)、2H2(SEQ ID NO:5)、2E5(SEQ ID NO:7)、24E5(SEQ IDNO:9)、21D9(SEQ ID NO:11)、21D9.b、21D9.c、21D9.d、21D9.e、21A5(SEQ ID NO:14)、21A5.a(SEQ ID NO:16)、10F10(SEQ ID NO:18)、10F10.1(SEQ ID NO:20)、10F10.3(SEQ IDNO:21)或10F10.4(SEQ ID NO:116)。
实施方案30:如实施方案1-29中任一项所述的分离的抗体,其包含抗ILT4抗体9G4、9C8、2H2、2E5、24E5、21D9、21D9.b、21D9.c、21D9.d、21D9.e、21A5、21A5.a、10F10、10F10.1、10F10.3或10F10.4的HC和LC,其中所述HC的所述恒定区为IgG1(例如9G4.IgG1等)、IgG1.3(例如9G4.IgG1.3等)、IgG1.1f(例如9G4.IgG1.1f等)、IgG4(例如9G4.IgG4等)或IgG4 S228P(EU编号)(例如9G4.IgG4_S228P)。
实施方案31:如实施方案30所述的分离的抗体,其包含:
-包含9G4的重链的氨基酸序列((i)SEQ ID NO:2,或(ii)SEQ ID NO:51,氨基酸20-135,和SEQ ID NO:98、100、102、103、104或179中的一个)的重链(HC),和包含9G4的轻链氨基酸序列(SEQ ID NO:1)的轻链(LC);
-包含9C8的重链的氨基酸序列((i)SEQ ID NO:4或(ii)SEQ ID NO:55和SEQ IDNO:98、100、102、103、104或179中的一个)的重链,和包含9C8的轻链氨基酸序列(SEQ IDNO:3)的轻链;
-包含2H2的所述重链的氨基酸序列((i)SEQ ID NO:6或(ii)SEQ ID NO:58和SEQID NO:98、100、102、103、104或179中的一个)的重链,和包含2H2的轻链氨基酸序列(SEQ IDNO:5)的轻链;
-包含2E5的重链的氨基酸序列((i)SEQ ID NO:8或(ii)SEQ ID NO:63和SEQ IDNO:98、100、102、103、104或179中的一个)的重链,和包含2E5的轻链氨基酸序列(SEQ IDNO:7)的轻链;
-包含24E5的重链的氨基酸序列((i)SEQ ID NO:10或(ii)SEQ ID NO:67和SEQ IDNO:98、100、102、103、104或179中的一个)的重链,和包含24E5的轻链氨基酸序列(SEQ IDNO:9)的轻链;
-包含21D9的重链的氨基酸序列((i)SEQ ID NO:12或113,或(ii)SEQ ID NO:71和SEQ ID NO:98、100、102、103、104或179中的一个)的重链,和包含21D9的轻链氨基酸序列(SEQ ID NO:11)的轻链;
-包含21D9.b的重链的氨基酸序列(SEQ ID NO:74和SEQ ID NO:98、100、102、103、104或179中的一个)的重链,和包含21D9.b的轻链氨基酸序列(SEQ ID NO:11)的轻链;
-包含21D9.c的重链的氨基酸序列(SEQ ID NO:75和SEQ ID NO:98、100、102、103、104或179中的一个)的重链,和包含21D9.c的轻链氨基酸序列(SEQ ID NO:11)的轻链;
-包含21D9.d的重链的氨基酸序列(SEQ ID NO:78和SEQ ID NO:98、100、102、103、104或179中的一个)的重链,和包含21D9.d的轻链氨基酸序列(SEQ ID NO:11)的轻链;
-包含21D9.e的重链的氨基酸序列((i)SEQ ID NO:13、176、177或178;或(ii)SEQID NO:80和SEQ ID NO:98、100、102、103、104或179中的一个)的重链,和包含21D9.e的轻链氨基酸序列(SEQ ID NO:11)的轻链;
-包含21A5的重链的氨基酸序列((i)SEQ ID NO:15或(ii)SEQ ID NO:83和SEQ IDNO:98、100、102、103、104或179中的一个)的重链,和包含21A5的轻链氨基酸序列(SEQ IDNO:14)的轻链;
-包含21A5.a的重链的氨基酸序列((i)SEQ ID NO:17或(ii)SEQ ID NO:87和SEQID NO:98、100、102、103、104或179中的一个)的重链,和包含21A5.a的轻链氨基酸序列(SEQID NO:16)的轻链;
-包含10F10的重链的氨基酸序列((i)SEQ ID NO:19或(ii)SEQ ID NO:91和SEQID NO:98、100、102、103、104或179中的一个)的重链,和包含10F10的轻链氨基酸序列(SEQID NO:18)的轻链;
-包含10F10.1的重链的氨基酸序列((i)SEQ ID NO:19或(ii)SEQ ID NO:91和SEQID NO:98、100、102、103、104或179中的一个)的重链,和包含10F10.1的轻链氨基酸序列(SEQ ID NO:20)的轻链;
-包含10F10.3的重链的氨基酸序列((i)SEQ ID NO:19或(ii)SEQ ID NO:91和SEQID NO:98、100、102、103、104或179中的一个)的重链,和包含10F10.3的轻链氨基酸序列(SEQ ID NO:21)的轻链;或
-包含10F10.4的重链的氨基酸序列((i)SEQ ID NO:19或(ii)SEQ ID NO:91和SEQID NO:98、100、102、103、104或179中的一个)的重链,和包含10F10.4的轻链氨基酸序列(SEQ ID NO:116)的轻链。
实施方案32:一种特异性结合到人类ILT4的分离的抗体,其包含有包含SEQ IDNO:13的氨基酸序列的重链和包含SEQ ID NO:11的轻链氨基酸序列的轻链。
实施方案33:一种特异性结合到人类ILT4的分离的抗体,其包含有包含SEQ IDNO:176的氨基酸序列的重链和包含SEQ ID NO:11的轻链氨基酸序列的轻链。
实施方案34:一种特异性结合到人类ILT4的分离的抗体,其包含有包含SEQ IDNO:177的氨基酸序列的重链和包含SEQ ID NO:11的轻链氨基酸序列的轻链。
实施方案35:一种特异性结合到人类ILT4的分离的抗体,其包含有包含SEQ IDNO:178的氨基酸序列的重链和包含SEQ ID NO:11的轻链氨基酸序列的轻链。
实施方案36:如实施方案32-35中任一项所述的分离的抗体,其中所述抗体具有如实施方案1所述的抗体的一种或多种特性。
实施方案37:如实施方案1-36中任一项所述的分离的抗体,其为全长抗体。
实施方案38:如实施方案1-14中任一项所述的分离的抗体,其为抗体片段。
实施方案39:如实施方案1-38中任一项所述的分离的抗体,其为多聚(例如二聚或三聚)抗体。
实施方案40:如实施方案1-39中任一项所述的分离的抗体,其连接(例如共价连接)到另一分子。
实施方案41:如实施方案40所述的分离的抗体,其中所述另一分子为标记。
实施方案42:如实施方案40所述的分离的抗体,其中所述另一分子为肽。
实施方案43:如权利要求40所述的分离的抗体,其为抗体药物缀合物(ADC)。
实施方案44:一种分离的核酸,其编码如实施方案1-43中任一项所述的抗体。
实施方案45:一种分离的核酸,其编码如实施方案1-43中任一项所述的抗体的重链和/或轻链。
实施方案46:一种至少两种分离的核酸的集合,所述核酸编码如实施方案1-43中任一项所述的抗体的重链和轻链。
实施方案47:一种组合物,其包含编码如实施方案1-43中任一项所述的抗体的重链的核酸和编码如实施方案1-43中任一项所述的抗体的轻链的核酸。
实施方案48:一种细胞,其包含如实施方案44-46中任一项所述的分离的核酸或如实施方案47所述的组合物。
实施方案49:一种制备抗体的方法,其包括在表达所述抗体的条件下培养如实施方案48所述的细胞。
实施方案50:一种组合物,其包含如实施方案1-49中任一项所述的分离的抗体、核酸、组合物或细胞和药学上可接受的载剂。
实施方案51:如实施方案50所述的组合物,其包含第二治疗剂。
实施方案52:如实施方案51所述的组合物,其中所述第二治疗剂为免疫刺激剂。
实施方案53:如实施方案52所述的组合物,其中所述免疫刺激剂为免疫抑制分子的拮抗剂,例如PD-1/PD-L1、CTLA-4和LAG-3,或免疫刺激分子的激动剂,例如GITR和OX40。
实施方案54:一种治疗患有癌症的受试者的方法,其包括向所述受试者施用治疗有效量的如实施方案50-53中任一项所述的组合物或如实施方案1-43中任一项所述的分离的抗体,其刺激免疫反应和/或为ILT-4拮抗剂。
实施方案55:如实施方案54所述的方法,其中所述方法还包括施用第二疗法。
实施方案56:如实施方案55所述的方法,其中所述第二疗法为放射疗法、手术或施用第二剂。
实施方案57:如实施方案55所述的方法,其中所述第二疗法为第二剂,并且所述第二剂为免疫刺激剂。
实施方案58:如实施方案57所述的方法,其中所述免疫刺激剂为免疫抑制分子的拮抗剂,例如PD-1/PD-L1、CTLA-4和LAG-3,或免疫刺激分子的激动剂,例如GITR和OX40。
实施方案60:一种治疗受试者的传染病(例如病毒性疾病)的方法,其包括向所述受试者施用治疗有效量的如实施方案50-53中任一项所述的组合物或如实施方案1-43中任一项所述的分离的抗体,其刺激免疫反应和/或为ILT4拮抗剂。
实施方案61:一种检测样品中的ILT4的方法,其包括使所述样品与如实施方案1-43中任一项所述的ILT4抗体接触。
实施方案62:如实施方案1-43中任一项所述的分离的抗体,其具有以下特征:
a.例如以10
b.刺激单核细胞分化或活化成巨噬细胞,例如刺激单核细胞分化成促炎性巨噬细胞,例如如所述实施例中所描述的测定中所示;
c.具有如图27中所示的结合概况;和
d.结合到hILT4的Ig样结构域1、2或1和2,诸如包含hILT4的以下区域:(i)
实施方案63:如实施方案1-43中任一项所述的分离的抗体,其具有以下特征:
a.例如以10
b.不特异性结合到hILT2、hILT3和/或hILT5;
c.不特异性结合到LILRA和/或LILRB家族的一个或多个成员;
d.例如在混合淋巴细胞反应(MLR)测定中刺激T细胞活化,如通过增加的T细胞增殖或IFN-γ分泌所测量,例如如实施例中所描述的测定中所示;
e.刺激单核细胞分化或活化成巨噬细胞,例如刺激单核细胞分化成促炎性巨噬细胞,例如如所述实施例中所描述的测定中所示;
f.抑制hILT4与HLA-A和HLA-B的结合;
g.具有如图27中所示的结合概况;
h.结合到hILT4的Ig样结构域1、2或1和2,诸如包含hILT4的以下区域:(i)
i.促进巨噬细胞朝向M1巨噬细胞的促炎性极化;
j.不诱导(或触发)嗜碱性粒细胞活化;和
k.在于25℃下孵育3个月之后包含少于5%的高分子量物质和低分子量物质,和/或在于40℃下孵育3个月之后包含少于10%的高分子量物质和低分子量物质。
实施方案64:如实施方案1-43中任一项所述的分离的抗体,其具有以下特征:
a.促进CD83和CD86在人类单核细胞源性未成熟树突状细胞(Mo-iDC)上的表达,例如如所述实施例中所描述的测定中所示;
b.在巨细胞病毒(CMV)溶胞物测定中增强在抗原刺激后的IFN-γ分泌,例如如所述实施例中所描述的测定中所示;
c.在同种异体混合淋巴细胞反应(MLR)测定中增强在CD3刺激后通过CD4+和CD8+T细胞的IFN-γ和TNF-α分泌,例如如所述实施例中所描述的测定中所示;
d.抑制HLA-A和/或HLA-B与ILT4的结合;
e.结合到hILT4的Ig样结构域1、2或1和2,诸如包含以下的区域:(i)
f.与成熟hILT4的一个或多个(或全部)氨基酸残基Lys43、Ile49、Thr50和Arg51相互作用,或与成熟hILT4的一个或多个(或全部)氨基酸残基Gly117、Val119、Try120、Leu134、Lys136、Gln149、Pro150、Ile159、Ser161、Val162、Gly163、Pro164、Pro167、His173、Try178、Pro183和Tyr184相互作用,或与成熟hILT4的一个或多个(或全部)氨基酸残基Glu42、Lys43、Gly76、Cys77、Leu88、Pro91、Pro183和Tyr184相互作用,如通过例如所述实施例中所描述的卡宾足迹法测定;
g.与本文所描述的抗体竞争结合到hILT4;和
h.特异性结合到包含SEQ ID NO:118的食蟹猴ILT4,例如如所述实施例中所描述的结合测定中所示。
附图说明
本申请要求美国临时专利申请的优先权,所述美国临时专利申请包含来自下面列表的至少一幅彩色附图。一旦这个国际申请公布并且其优先权临时申请变得可供公众使用,则假定在请求和付清所需费用后,这些彩色附图将由美国专利和商标局提供。
图1展示抗hILT4抗体9G4的重链可变区(“VH”)的核苷酸和氨基酸序列,指示VHCmdr的位置。
图2展示抗hILT4抗体9G4的轻链可变区(“VL”)的核苷酸和氨基酸序列,指示VLCDR的位置。
图3展示抗hILT4抗体9C8的VH的核苷酸和氨基酸序列,指示VH CDR的位置。
图4展示抗hILT4抗体9C8的VL的核苷酸和氨基酸序列,指示VL CDR的位置。
图5展示抗hILT4抗体2H2的VH的核苷酸和氨基酸序列,指示VH CDR的位置。
图6展示抗hILT4抗体2H2的VL的核苷酸和氨基酸序列,指示VL CDR的位置。
图7展示抗hILT4抗体2E5的VH的核苷酸和氨基酸序列,指示VH CDR的位置。
图8展示抗hILT4抗体2E5的VL的核苷酸和氨基酸序列,指示VL CDR的位置。
图9展示抗hILT4抗体24E5的VH的核苷酸和氨基酸序列,指示VH CDR的位置。
图10展示抗hILT4抗体24E5的VL的核苷酸和氨基酸序列,指示VL CDR的位置。
图11展示抗hILT4抗体21D9的VH的核苷酸和氨基酸序列,指示VH CDR的位置。
图12展示抗hILT4抗体21D9的VL的核苷酸和氨基酸序列,指示VL CDR的位置。
图13A和图13C展示ILT4抗体21D9的重链可变结构域(VH)(图13A)和轻链可变结构域(VH)(图13C)的氨基酸序列分别与种系免疫球蛋白序列hIGHV3-23*01和hIGKV3-20*01的比对。箭头指向种系突变。AbM VH CDR1和Kabat VH CDR2、VH CDR3和VL CDR1-3序列以浅色文字展示。图13B展示具有IgG1.3重链恒定区(即,21D9.b-.e hIgG1.3)的四种种系回复突变体21D9.b、21D9.c、21D9.d和21D9.e的VH氨基酸序列。图13B中以大写字母表示的氨基酸残基为种系回复取代。
图14A和图14B展示ILT4抗体21A5的重链可变结构域和轻链可变结构域的氨基酸序列分别与种系免疫球蛋白序列hIGHV1-46*01(图14A)和hIGKV3-20*01(图14B)的比对。AbM VH CDR1和Kabat VH CDR2、VH CDR3和VL CDR1-3序列以浅色文字展示。箭头指向种系回复突变。
图15展示ILT4抗体10F10的重链可变结构域和轻链可变结构域的氨基酸序列分别与种系免疫球蛋白序列hIGHV3-30*01(顶部3个线条)和hIGKV1-13*02(底部3个线条)的比对。AbM VH CDR1和Kabat VH CDR2、VH CDR3和VL CDR1-3序列以浅色文字展示。箭头指向种系回复突变。
图16展示指示的抗hILT4抗体与hILT4的结合的传感图。所用方法的示意图展示于传感图画面上方。
图17展示抗hILT4抗体2H2、10F10野生型(WT,即亲本抗体)、21A5.a、21A5 WT、21D9WT、21D9e和同种型对照hIgG1.3与经hILT4转染的CHO细胞的结合,其随抗体浓度而变且如通过流式细胞术测定。EC
图18A展示指定的抗hILT4抗体和同种型对照与经hILT4转染的CHO细胞的结合,其随抗体浓度而变且如通过流式细胞术测定。EC
图19A展示抗hILT4抗体21D9、21D9.e、21A5、21A5.a、10F10和2H2(自左至右)与人类LILRA1、人类LILRA2、人类LILRA3、人类LILRA4、人类LILRA5、人类LILRA6、人类ILT2、人类ILT3、人类ILT4、人类ILT5和人类LIR8(自上至下)的结合的流式细胞术图式。图19B展示抗hILT4抗体21A5和种系回复突变体21A5.a与人类LIRA1、LIRA3和ILT4的结合的流式细胞术图式。
图20A和图20B展示指定的抗体21D9(“21D9 IgG1.1”)和21D9.e(图20A)以及21A5(“21A5WT”)和21A5.a(图20B)与指定的人类LILRA/LILRB家族成员(图20A中的LILRA5、ILT4和图20B中的LILRA1、LILRA3和ILT4)的最大结合百分比,其随抗体浓度而变,指示抗ILT4抗体21D9、21D9.e、21A5和21A5.a展示与其他LILRA家族成员的较弱交叉反应性。
图21A至图21D展示抗hILT4抗体的T细胞活性。图21A为与经hILT4和OKT3转染的CHO细胞共培养的T细胞的
图22A至图22D展示与T细胞共培养的单核细胞源性树突状细胞(MoDC)的同种异体MLR(混合淋巴细胞反应)中T细胞的增殖(图22A和图22C)和IFNγ产生(图22B和图22D)。在单核细胞分化成MoDC期间添加抗hILT4抗体21A5.a或21D9.e(图22A和图22B)、或者2H2或21D9(图22C和图22D)、或者同种型对照或不添加抗体(“未处理”),并且在同种异体MLR测定期间不添加各抗体。
图23A至图23D展示CD83和CD86在单核细胞源性树突状细胞(MoDC)上的表达量。在单核细胞分化成MoDC期间孵育抗hILT4抗体21D9.e、21A5.a(图23A)、21A5、10F10、21D9(图23B)或2H2(图23C和图23D)或同种型对照或者不进行处理(无抗体)。
图24A和图24B展示自通过脂多糖(LPS)(图24A)或STING激动剂2'3'-cGAMP(图24B)活化的体外分化的巨噬细胞分泌的TNF-α的水平。在活化期间包括抗ILT4抗体21D9、21D9.e、21A5、21A5.a、2H2和10F10或同种型对照。
图25A和图25B展示在抗hILT4抗体21D9、21D9.e、21A5或21A5.a或抗PD-L1抗体或同种型对照抗体存在下,CD4 T细胞增殖的百分比(图25A)和自与体外分化的巨噬细胞共培养的CD4 T细胞的同种异体MLR产生的IFN-γ的量(图25B)。图25A展示基于CFSE稀释通过FACS分析得到的CD4 T细胞增殖的百分比,并且图25B展示通过Alphalisa测量的IFNγ产生,两者都随ILT4抗体或对照而变。
图26A和图26B展示在巨噬细胞:CD4 T细胞同种异体MLR中,与单独的各抗体相比,抗ILT4抗体21D9与抗PD-L1抗体克隆29E.2A3的组合将IFNγ的产生增强到较高水平。图26A展示一个巨噬细胞:CD4 T同种异体对的一个实验。图26B展示多个同种异体对的反应,其中每一个线条表示一个同种异体对的一个实验。使用非参数单向Anova多重比较(弗里德曼检验;Friedman test)进行统计分析。*p<0.05,**p<0.01,***p<0.001,****p<0.0001。
图27A、图27B和图27C展示抗hILT4 Ab 21D9和2H2 Fab的HDX抗原决定基定位。图27A展示胃蛋白酶对hILT4序列的覆盖度。图27B展示21D9和2H2 Fab的不同HDX。在图中标示的序列部分中,加底线的那些部分的HDX保护比未加底线的那些部分少,如图示下方也加以标注。图27C展示定位至hILT4的线性序列的两个Fab的HDX抗原决定基。抗体21D9的抗原决定基通过单底线展示。抗体2H2的抗原决定基以双底线和序列的加阴影/加影线底线部分展示。
图28A、图28B、图28C和图28D展示抗体21D9(图28A)、2H2(图28B)、10F10(图28C)和21A5(图28D)对hILT4与HLA-A和HLA-B的结合的抑制。
图29A至图29D展示21D9e.IgG1.3增强通过CD4+和CD8+T细胞的IFN-γ和TNF-α两者的分泌,如通过细胞内IFN-γ和TNF-α染色所测定。图29A展示CD4+T细胞中的IFN-γ分泌;图29B展示CD4+T细胞中的TNF-α分泌;图29C展示CD8+T细胞中的IFN-γ分泌;且图29D展示CD8+T细胞中的TNF-α分泌。
图30展示抗ILT4抗体21D9、21A5、21D9 Fab在CMV溶胞物测定中增强在抗原刺激后的IFN-g分泌。纳武单抗(Nivolumab)用作阳性对照,且无抗体(“无Ab”)和同种型对照用作阴性对照。抗ILT4抗体的浓度自左至右为:0.00128μg/ml;0.0064μg/ml;0.032μg/ml;0.16μg/ml;0.8μg/ml;4μg/ml;和20μg/ml(各浓度的条形展示于直方图中)。抗体和对照以与直方图右侧所展示相同的次序自左至右展示(例如“无Ab”对应于左侧的条形,且“Nivo”对应于右侧的条形)。
图31展示IgG1.1f或Fab形式的抗ILT4抗体2H2和21D9在单核细胞:T同种异体MLR中增强T细胞增殖(通过
图32A至图32C展示抗ILT4抗体21D9e.IgG1.3(图中的“ILT4.8”)和9G4.IgG1.3(“ILT4.1”)(抗体的命名法参见表1)体外促进共刺激分子CD86(图32A)与CD80(图32B)和树突状细胞活化标记物CD83(图32C)在食蟹猴单核细胞源性树突状细胞上的表达。在食蟹猴单核细胞分化成单核细胞源性树突状细胞(DC)期间添加各抗体。
图33A和图33B展示自通过脂多糖(LPS)(图33A)或STING激动剂2'3'cGAMP(图33B)活化的体外分化的巨噬细胞分泌的TNF-α的水平。在活化期间包括抗ILT4抗体21D9.e和10F10.4或同种型对照。
图34展示在IgG1、IgG4或IgG1.3的情形下由与21D9.e一起孵育的体外分化的巨噬细胞分泌的TNF-α的水平类似。
图35展示在25℃或40℃下0、1、2和3个月之后,21D9.e.IgG1.3的单体物质、高分子量(HMW)物质和低分子量(LMW)物质的百分比。单体物质、HMW物质和LMW物质分别对应于直方图中的各条形的底部部分、中间部分和顶部部分。
图36展示总共8种供体在与21D9e.IgG1.3(图中的“ILT4.8”)、21A5.a.IgG1.3(“ILT4.9”)、同种型对照抗体“抗DT”、抗FcεRI或N-甲酰蛋氨酸-白氨酰基-苯丙氨酸(fMLP)一起孵育之后的活化的嗜碱性粒细胞的百分比,展示21D9e.IgG1.3(ILT4.8)和21A5.a.IgG1.3(“ILT4.9”)不具有嗜碱性粒细胞活化。
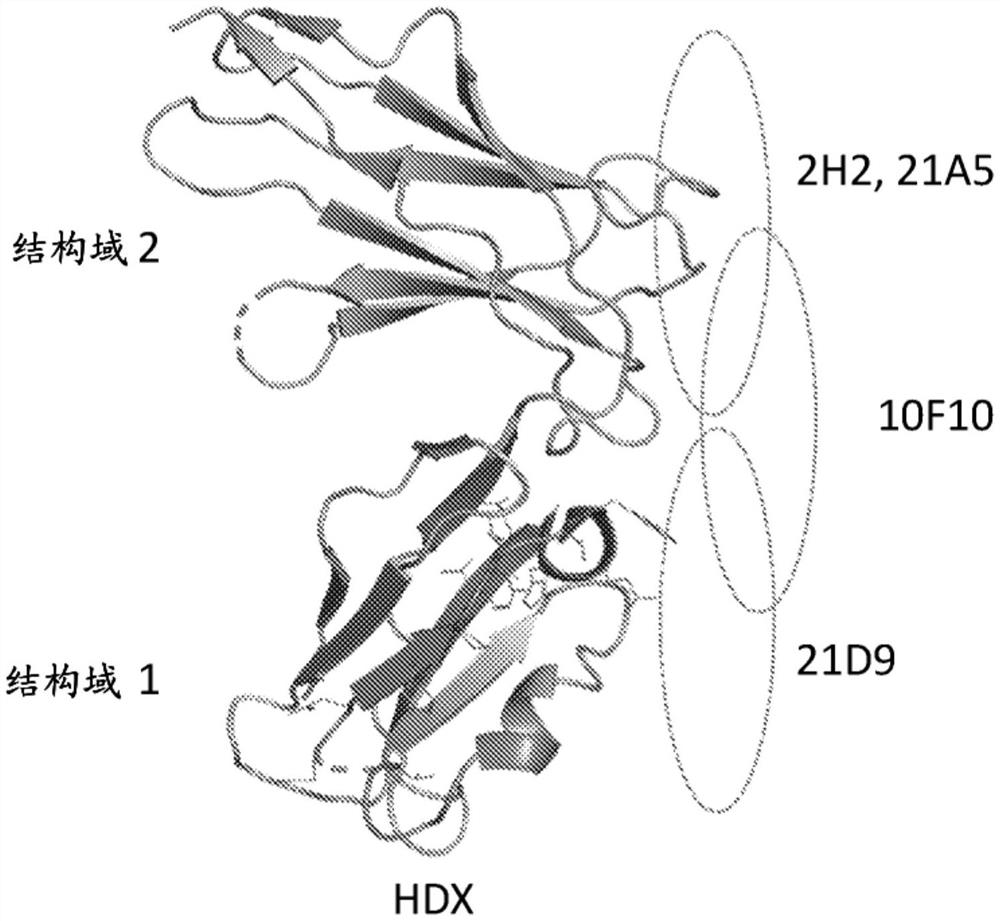
图37A至图37D展示用以确定某些抗体的抗原决定基的实验的结果。图37A和图37B通过表达在CHO细胞表面上的hILT4的10F10和21A5抗体展示2H2(图37A)和21D9(图37B)的竞争(或交叉阻断)测定结果。图37C为展示具有Ig样结构域1和2的位置且指示抗体21D9、29A5、2H2和10F10所结合的hILT4区域的hILT4的三维表示的图式。图37D展示具有Ig样结构域1和2的位置且指示抗体21D9、21A5和10F10所结合的hILT4区域的hILT4的另外三维表示。
具体实施方式
定义
除非另有定义,否则结合本发明使用的科学与技术术语将具有本领域的普通技术人员通常理解的含义。此外,除非上下文另有需要,否则单数术语应包括复数且复数术语应包括单数。
在本申请中,除非另有说明,否则使用“或”意指“和/或”。在多个附属项的情形下,“或”的使用仅以替代方式重新提及超过一个前述独立项或附属项。术语“包含”、“包括”和“具有”可在本文中互换使用。根据本发明,“分离的”分子是已自其天然环境移出的分子。因此,术语“分离的”不一定反映分子得以纯化的程度。
术语“多肽”是指氨基酸残基的聚合物,且不限于最小长度。“蛋白质”可包含一个或多个多肽。这类氨基酸残基的聚合物可含有天然或非天然氨基酸残基,且包括(但不限于)氨基酸残基构成的肽、寡肽、二聚体、三聚体和多聚体。全长蛋白质和其片段皆由这个定义涵盖。这些术语还包括多肽的表达后修饰,例如糖基化、唾液酸化、乙酰化、磷酸化和其类似修饰。此外,出于本发明的目的,“多肽”或“蛋白质”分别是指包括天然序列的诸如缺失、添加和取代(一般实质上为保守取代)的修饰的多肽或蛋白质,只要所述蛋白质维持所要活性即可。这些修饰可为有意的,如经由定点突变诱发,或者可为偶然的,诸如经由产生蛋白质的宿主的突变或因PCR扩增所致的错误。蛋白质可包含两个或更多个多肽。蛋白质名称前面的字母“h”表示本文中的天然人类蛋白质,例如“hILT4”。
除非另有特别指示(例如小鼠ILT4、食蟹猴ILT4等),否则术语“ILT4”、“人类ILT4”、“hILT4”、“免疫球蛋白样转录物4”、“Ig样转录物4”、“白细胞免疫球蛋白样受体B2”、“LIR2”、“LILRB2”、“MIR10”和“CD85d”皆可互换使用且是指天然人类ILT4。所述术语包括全长未处理的ILT4以及处理细胞所产生的任何形式的ILT4。所述术语涵盖天然存在的人类ILT4的变体,例如剪接变体或等位基因变体。在一些实施方案中,ILT4包含SEQ ID NO:107(前体,具有信号肽)或SEQ ID NO:108(成熟,无信号肽)的氨基酸序列或由其组成。在一些实施方案中,ILT4包含SEQ ID NO:110(前体,具有信号肽)或SEQ ID NO:111(成熟,无信号肽)的氨基酸序列。
如本文所用,术语“ILT4片段”是指具有自全长ILT4的N端和/或C端缺失的一个或多个残基的ILT4。所述ILT4片段可包括或可不包括N端信号肽,但保留结合到T细胞的能力。如本文所用,术语“ILT4变体”是指含有天然存在的氨基酸添加、缺失和取代,但保留结合到T细胞的能力的ILT4。
术语“拮抗剂”以最广泛含义使用,且包括任何部分或完全地抑制或中和诸如ILT4的多肽的生物活性的分子。示例性拮抗剂分子包括拮抗剂抗体。术语“ILT4拮抗剂”是指通过例如阻断或抑制ILT4与靶细胞(例如T细胞)和/或靶分子之间的相互作用来抑制或阻断ILT4的生物活性的分子。示例性ILT4拮抗剂包括阻断ILT4与靶细胞(例如T细胞)和/或靶分子的结合的抗体。当ILT4拮抗剂在细胞结合测定中将ILT4与靶细胞(例如T细胞)和/或靶分子中的至少一种的可检测结合量降低至少50%时,认为ILT4拮抗剂“阻断ILT4与靶细胞或靶分子的结合”。在一些实施方案中,ILT4拮抗剂将可检测结合量降低至少60%、至少70%、至少80%或至少90%。在一些这样的实施方案中,据称拮抗剂将配体结合阻断至少50%、至少60%、至少70%等。ILT4与靶细胞(例如T细胞)的结合阻断可例如通过在拮抗剂存在或不存在下经ILT4转染的细胞(例如ILT4 ECD和跨膜结构域)或重组ILT4 Fc融合蛋白(例如重组ILT4 ECD Fc融合蛋白)在诸如T细胞的细胞上的结合来展现。
术语“抑制”是指任何表型特征减少、降低或停止,或所述特征的发生率、程度或可能性减小、降低或停止。在一些实施方案中,“降低”或“抑制”意指导致减小20%或更多的能力。在另一实施方案中,“降低”或“抑制”意指导致减小50%或更多的能力。在又一实施方案中,“降低”或“抑制”意指导致总体减小75%、85%、90%、95%或更多的能力。
术语“增强T细胞活性”或“T细胞活性的增强”是指增强或提高受试者的T细胞活化、细胞因子分泌(诸如干扰素-γ(IFN-γ)分泌)或T细胞增殖中的至少一种。“增强T细胞活性”可通过使用作为T细胞活性的激动剂的剂和/或作为抑制T细胞活性的机制的拮抗剂(即,抑制或阻断)的剂来实现。T细胞活性的变化可通过例如如实施例中所描述的例如T细胞增殖测定或IFN-γELISA来测量。
如本文所用的术语“ILT4抗体”或“hILT4抗体”或“抗ILT4抗体”或“抗hILT4抗体”或“结合ILT4的抗体”是指结合到ILT4且诸如通过阻断或抑制ILT4与靶细胞(诸如T细胞)或靶分子的结合来任选抑制ILT4的生物活性的抗体。在一些实施方案中,如例如通过SPR
术语“前导肽”或“前导序列”或“信号肽”或“信号序列”是指位于多肽的N端有助于多肽自哺乳动物细胞的分泌的肽或氨基酸残基序列。前导序列可在自哺乳动物细胞输出多肽时裂解形成成熟蛋白。前导序列可为天然或合成的,并且其可与其所连接的蛋白质异源或同源。
本文中的术语“抗体”或“Ab”以最广泛含义使用且涵盖各种抗体结构,包括(但不限于)单克隆抗体、多克隆抗体、多特异性抗体(例如双特异性抗体)和抗体片段,只要其展现所要抗原结合活性即可。如本文所用,所述术语是指包含至少重链的互补决定区(CDR)1、CDR2和CDR3和至少轻链的CDR1、CDR2和CDR3的分子,其中所述分子能够结合到抗原。术语抗体还包括(但不限于)嵌合抗体、人源化抗体、人类抗体和诸如小鼠、食蟹猴等各种物种的抗体。术语“抗体片段”包括(但不限于)能够结合抗原的片段,诸如Fv、单链Fv(scFv)、Fab、Fab'和(Fab')
术语“重链”或“HC”是指包含至少重链可变区、具有或不具有前导序列的多肽。在一些实施方案中,重链包含重链恒定区的至少一部分。术语“全长重链”是指包含重链可变区和重链恒定区、具有或不具有前导序列和具有或不具有C端赖氨酸(K)的多肽。术语“成熟全长重链”是指包含重链可变区和重链恒定区、不具有前导序列和具有或不具有C端赖氨酸(K)的多肽。
术语“重链可变区”或“VH”是指包含重链的重链互补决定区(CDR)1、框架区(FR)2、CDR2、FR3和CDR3的区域。在一些实施方案中,重链可变区还包含FR1的至少一部分和/或FR4的至少一部分。在一些实施方案中,重链CDR如本文中,诸如下文序列表中或图1至图12中所指定。如本文所用,VH CDR1、CDR2和CDR3为如例如图1至图12中所提供的Kabat CDR。
术语“轻链”或“LC”是指包含至少一个轻链可变区、具有或不具有前导序列的多肽。在一些实施方案中,轻链包含轻链恒定区的至少一部分。术语“全长轻链”是指包含轻链可变区和轻链恒定区、具有或不具有前导序列的多肽。术语“成熟全长轻链”是指包含轻链可变区和轻链恒定区、不具有前导序列的多肽。
术语“轻链可变区”或“VL”是指包含轻链CDR1、FR2、HVR2、FR3和HVR3的区域。在一些实施方案中,轻链可变区还包含FR1和/或FR4。在一些实施方案中,轻链CDR如本文中,诸如下文序列表中或图1至图12中所指定。如本文所用,VL CDR1、CDR2和CDR3为如例如图1至图12中所提供的Kabat CDR。
“嵌合抗体”是指重链和/或轻链的一部分来源于特定来源或物种,而重链和/或轻链的其余部分来源于不同来源或物种的抗体。在一些实施方案中,嵌合抗体是指包含至少一个来自第一物种(诸如小鼠、大鼠、食蟹猴等)的可变区和至少一个来自第二物种(诸如人类、食蟹猴等)的恒定区的抗体。在一些实施方案中,嵌合抗体包含至少一个小鼠可变区和至少一个人类恒定区。在一些实施方案中,嵌合抗体包含至少一个食蟹猴可变区和至少一个人类恒定区。在一些实施方案中,嵌合抗体的所有可变区来自第一物种且嵌合抗体的所有恒定区来自第二物种。
“人源化抗体”是指非人类可变区的框架区中的至少一个氨基酸已由来自人类可变区的对应氨基酸置换的抗体。在一些实施方案中,人源化抗体包含至少一个人类恒定区或其片段。在一些实施方案中,人源化抗体为Fab、scFv、(Fab')
如本文所用的“人类抗体”是指人类中产生的抗体,非人类动物中产生的包含人类免疫球蛋白基因的抗体,诸如
在一些实施方案中,与特定指定序列相比,本文中的抗体可含有一个或多个“保守性取代”。本文中的“保守氨基酸取代”是指用具有类似侧链的氨基酸残基取代氨基酸残基。具有类似侧链的氨基酸残基的家族包括具有碱性侧链的氨基酸(例如赖氨酸、精氨酸、组氨酸)、具有酸性侧链的氨基酸(例如天冬氨酸、谷氨酸)、具有不带电极性侧链的氨基酸(例如甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸、色氨酸)、具有非极性侧链的氨基酸(例如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、蛋氨酸)、具有β分支侧链的氨基酸(例如苏氨酸、缬氨酸、异亮氨酸)和具有芳族侧链的氨基酸(例如酪氨酸、苯丙氨酸、色氨酸、组氨酸)。在某些实施方案中,本文中的抗体中的预测非必需氨基酸残基被来自同一侧链家族的另一氨基酸残基(例如碱性、酸性、β分支、芳族、不带电极性)置换。鉴别不消除抗原结合的核苷酸和氨基酸保守性取代的方法已描述于例如Brummell等人,Biochem.32:1180-1187(1993);Kobayashi等人,Protein Eng.12(10):879-884(1999);和Burks等人,Proc.Natl.Acad.Sci.USA 94:412-417(1997))中。
在一些实施方案中,本文中的抗体可含有一个或多个“回复取代(reversionsubstitution)”。实施例描绘于本文中的图13至图15中。回复取代为返回衍生出抗体重链或轻链的种系氨基酸序列的突变。
抗体与蛋白质(例如ILT4)的结合的“K
术语“特异性结合”或类似术语表示诸如抗体和其多肽目标的两种多肽结合的K
如本文所用的“肿瘤模型”是指可以用于研究ILT4抗体的生物活性的体内临床前测定,并且包括异种移植或天然小鼠肿瘤测定系统。在一些情况下,肿瘤模型可允许追踪用抗体处理时的肿瘤尺寸或生长,和/或追踪肿瘤中诸如特定类型的T细胞或NK细胞的免疫细胞的存在,以确定抗体是否触发或增强免疫反应。
如本文所用的术语“免疫刺激剂”是指通过充当免疫刺激分子(包括共刺激分子)的激动剂或充当免疫抑制分子(包括共抑制分子)的拮抗剂来刺激免疫系统的分子。免疫刺激分子或免疫抑制分子可为免疫检查点调节剂,诸如检查点抑制剂或检查点刺激剂。免疫刺激剂可为生物制剂,诸如抗体或抗体片段、其他蛋白质或疫苗,或者可为小分子药物。“免疫刺激分子”包括用以增强、刺激、诱导或以其他方式“开启”免疫反应的受体或配体。如本文所定义的免疫刺激分子包括共刺激分子。“免疫抑制分子”包括用以减少、抑制、抑止或以其他方式“关闭”免疫反应的受体或配体。如本文所定义的免疫抑制分子包括共抑制分子。这类免疫刺激和免疫抑制分子可为例如免疫细胞(诸如T细胞)上所发现或涉及先天免疫的细胞(诸如NK细胞)上所发现的受体或配体。
相对于肽、多肽或抗体序列的“氨基酸序列同一性百分比(%)”、“同一性%”、“氨基酸序列同源性百分比”和“同源性%”意指在必要时比对序列且引入间隙以达成最大序列同一性百分比且不将任何保守性取代视为序列同一性的部分之后,候选序列中的氨基酸残基与特定肽或多肽序列中的氨基酸残基一致的百分比。出于测定氨基酸序列同一性百分比的目的的比对可以在本领域的技能范围内的各种方式达成,例如使用公开可用的电脑软件,诸如BLAST、BLAST-2、ALIGN或MEGALIGNTM(DNASTAR)软件。本领域的技术人员可测定用于测量比对的适当参数,包括达成所比较序列的全长内的最大比对所需的任何算法。
如本文所用的“治疗”涵盖针对疾病的治疗剂在人类中的任何施用或应用,并且包括抑制疾病的疾病进展或一种或多种疾病症状,减缓疾病或其进展或其症状中的一种或多种,遏制其发展,部分或完全缓解疾病或其症状中的一种或多种,或预防疾病的一种或多种症状复发。
除非另有具体说明,否则术语“受试者”和“患者”在本文中可互换使用以指代人类。
术语“有效量”或“治疗有效量”是指对治疗受试者的疾病或病症有效,诸如以部分或完全地缓解一种或多种症状的药物的量。在一些实施方案中,有效量是指在给药时有效且持续必要时段以达成所要治疗或预防结果的量。
术语“癌症”在本文中用以指展现异常高水平的增殖和生长的细胞群。癌症可为良性(也称为良性肿瘤)、癌前或恶性的。癌细胞可为实体癌细胞或白血病癌细胞。术语“肿瘤生长”在本文中用以指导致癌症的尺寸或程度相应增加的包含癌症的一种或多种细胞的增殖或生长。
适用于本文中的治疗方法的癌症的实例包括(但不限于)癌瘤、淋巴瘤、胚细胞瘤、肉瘤和白血病。这类癌症的更特定非限制性实例包括鳞状细胞癌、小细胞肺癌、垂体癌、食道癌、星形细胞瘤、软组织肉瘤、非小细胞肺癌(包括鳞状细胞非小细胞肺癌)、肺腺癌、肺部鳞状细胞癌瘤、腹膜癌、肝细胞癌、胃肠癌、胰腺癌、胶质母细胞瘤、宫颈癌、卵巢癌、肝癌、膀胱癌、肝细胞瘤、乳腺癌、结肠癌、结直肠癌、子宫内膜或子宫癌、唾液腺癌瘤、肾癌、肾细胞癌瘤、肝癌、前列腺癌、外阴癌、甲状腺癌、肝脏癌瘤、脑癌、子宫内膜癌、睾丸癌、胆管癌、胆囊癌瘤、胃癌、黑色素瘤和各种类型的头颈癌(包括头颈部鳞状细胞癌)。
与一种或多种其他治疗剂“组合”施用包括同时(并行)和以任何次序连续(依序)施用。
“药学上可接受的载剂”是指本领域中常规的无毒固体、半固体或液体填充剂、稀释剂、囊封材料、配制助剂或载剂,其与治疗剂一起使用,一起构成“药物组合物”以供施用给受试者。药学上可接受的载剂在所用剂量和浓度下对接受者无毒且与制剂的其他成分相容。药学上可接受的载剂适于所用制剂。例如,如果治疗剂打算经口施用,则载剂可为凝胶胶囊。如果治疗剂打算皮下施用,则载剂理想地对于皮肤不具刺激性且不引起注射部位反应。
“化学治疗剂”为适用于治疗癌症的化合物。可在本文中的方法中施用的化学治疗剂的实例包括(但不限于):烷基化剂,诸如噻替派(thiotepa)和
可在本文中的方法中施用的其他非限制性示例性化学治疗剂包括用于调节或抑制对癌症的激素作用的抗激素剂,诸如抗雌激素和选择性雌激素受体调节剂(SERM),包括例如他莫昔芬(tamoxifen)(包括
“抗血管生成剂”或“血管生成抑制剂”是指直接或间接抑制血管生成、血小管生成或非所要血管通透性的小分子量物质、聚核苷酸(包括例如抑制性RNA(RNAi或siRNA))、多肽、分离的蛋白质、重组蛋白、抗体或其缀合物或融合蛋白。应理解,抗血管生成剂包括结合和阻断血管生成因子或其受体的血管生成活性的那些剂。例如,可在本文中的方法中施用的抗血管生成剂可包括血管生成剂的抗体或其他拮抗剂,例如VEGF-A的抗体(例如贝伐单抗(bevacizumab)
如本文所用的“生长抑制剂”是指体外或体内抑制细胞(诸如表达VEGF的细胞)的生长的化合物或组合物。因此,可在本文中的方法中施用的生长抑制剂可为显著降低S期中的细胞(诸如表达VEGF的细胞)的百分比的生长抑制剂。生长抑制剂的实例包括(但不限于)阻断细胞周期进程(除S期以外的时候)的剂,诸如诱导G1阻滞和M期阻滞的剂。经典M期阻断剂包括长春花(vincas)(长春新碱和长春碱(vinblastine))、紫杉烷(taxane)和II型拓朴异构酶抑制剂,诸如阿霉素、表柔比星、柔红霉素、依托泊苷和博莱霉素。阻滞G1的那些剂还深入到S期阻滞,例如DNA烷基化剂,诸如他莫西芬、泼尼松、达卡巴嗪、氮芥、顺铂、甲氨喋呤、5-氟尿嘧啶和ara-C。其他信息可见于Mendelsohn和Israel编,The Molecular Basisof Cancer,第1章,标题为“Cell cycle regulation,oncogenes,and antineoplasticdrugs”,Murakami等人(W.B.Saunders,Philadelphia,1995),例如第13页。紫杉烷(太平洋紫杉醇和多西他赛)为皆来源于紫杉树的抗癌药物。多西他赛(
术语“抗赘生性组合物”是指可用于治疗癌症的包含至少一种活性治疗剂的组合物。治疗剂的实例包括(但不限于)例如化学治疗剂、生长抑制剂、细胞毒性剂、用于放射疗法的剂、抗血管生成剂、癌症免疫治疗剂、细胞凋亡剂、抗微管蛋白剂和治疗癌症的其他剂,诸如抗HER-2抗体、抗CD20抗体、表皮生长因子受体(EGFR)拮抗剂(例如酪氨酸激酶抑制剂)、HER1/EGFR抑制剂(例如埃罗替尼
特异性结合到ILT4的抗体
以下序列表分别提供具有或不具有信号肽的人类ILT4的氨基酸序列(参见SEQ IDNO:107-108和110-111)。胞外结构域(ECD)包含SEQ ID NO:109和112中所示的氨基酸残基。耦接到His-Avi标签的示例性ECD包含SEQ ID NO:119的氨基酸序列。
抗ITL4抗体(Ab)可特异性结合到ILT4-ECD或其片段(参见SEQ ID NO:109和112以及119)。
本文提供以如例如在25℃下或在37℃下测量的为10
测定Ab结合到ILT4蛋白的程度可使用若干不同方法进行。例如,通过表面等离子体共振(SPR),诸如通过
Ab对于ILT4 ECD多肽的亲和力可使用于其表面上表达ILT4多肽的细胞测定,所述方法包括流式细胞术。示例性流式细胞术测定包括以下:将T细胞或异位表达ILT4的其他细胞再悬浮于缓冲液中,其中的Ab已自大约20μg/mL连续稀释且在4℃下与再悬浮细胞一起孵育30分钟。然后用相同缓冲液洗涤细胞两次,维持所要缓冲液条件,且与识别一抗(例如人类IgG)的缀合荧光团的二抗一起孵育。然后如前所述洗涤细胞且在无固定的情况下即刻在BD
在某些实施方案中,结合到ILT4的Ab阻断ILT4与靶细胞(诸如T细胞)的结合。抑制或阻断可为100%或至少99%、95%、90%、85%、80%、75%或50%。
ILT4与ILT4结合细胞(诸如T细胞)之间的结合的抑制可通过测量存在和不存在所述抗体下ILT4所结合的细胞的结合的抑制来测定。可用以确定抗体是否抑制ILT4与ILT4结合细胞的结合的示例性实验为流式细胞术测定,例如包括以下的测定:将来自供体血液的人类末梢血液单核细胞、白细胞层或白细胞(leukopak)再悬浮于由HBSS+1%BSA组成的缓冲液中。然后在4℃下用20μg/mL的例如ILT4 ECD或与人类IgG1 Fc融合的ILT4 ECD融合蛋白且以变化浓度的候选ILT4阻断抗体或对照抗体将细胞孵育30分钟。然后将细胞在相同缓冲液中洗涤两次并在4℃下与识别ILT4的缀合荧光团的二抗而非候选阻断抗体或对照抗体一起再孵育30分钟。然后如前所述洗涤细胞且在无固定的情况下即刻在BD
示例性ILT4结合Ab
本文提供特异性地结合到ILT4,例如ILT4 ECD的Ab。
在某些实施方案中,ILT4 Ab包含有包含本文所提供的任一种ILT4 Ab的VH CDR1、CDR2和/或CDR3的重链可变区(“VH”)。除非另有指定,否则本文中的VH CDR为如本文中图1、图3、图5、图7、图9和图11中所示的Kabat CDR(例如AbM CDR1等)。在某些实施方案中,ILT4Ab包含有包含本文所提供的任一种ILT4 Ab的VH CDR1、CDR2和/或CDR3的VH。在某些实施方案中,ILT4 Ab包含有包含9G4、9C8、2H2、2E5、24E5、21D9、21D9.b、21D9.c、21D9.d、21D9.e、21A5、21A5.a、10F10、10F10.1、10F10.3或10F10.4中的任一种的VH CDR1、CDR2和/或CDR3(即,9G4(SEQ ID NO:125-127)、9C8(SEQ ID NO:131-133)、2H2(SEQ ID NO:137-139)、2E5(SEQ ID NO:143-145)、24E5(SEQ ID NO:149-151)、21D9(SEQ ID NO:155-157)、21D9.b(SEQ ID NO:155-157)、21D9.c(SEQ ID NO:155-157)、21D9.d(SEQ ID NO:155-157)、21D9.e(SEQ ID NO:155-157)、21A5(SEQ ID NO:161-163)、10F10(SEQ ID NO:167-169)、10F10.1(SEQ ID NO:167-169)、10F10.3(SEQ ID NO:167-169)或10F10.4(SEQ ID NO:167-169))的VH。
在某些实施方案中,ILT4 Ab包含有包含本文所提供的任一种ILT4 Ab的VH CDR1、CDR2和CDR3的VH。在某些实施方案中,ILT4 Ab包含有包含9G4、9C8、2H2、25E5、24E5、21D9、21D9.b、21D9.c、21D9.d、21D9.e、21A5、21A5.a、10F10、10F10.1、10F10.3或10F10.4中的任一种的VH CDR1、CDR2和CDR3的VH。
在某些实施方案中,ILT4 Ab包含有包含本文所提供的任一种ILT4 Ab的VH CDR1、CDR2和/或CDR3的VH以及包含本文所提供的任一种ILT4 Ab的CDR1、CDR2和/或CDR3的VL。除非另有指明,否则本文中的VL CDR为如本文中图2、图4、图6、图8、图10和图12中所示的Kabat CDR(例如AbM CDR1等)。在某些实施方案中,ILT4 Ab包含有包含本文所提供的任一种ILT4 Ab的VH CDR1、CDR2和CDR3的VH以及包含本文所提供的任一种ILT4 Ab的CDR1、CDR2和CDR3的VL。在某些实施方案中,ILT4 Ab包含有包含9G4、9C8、2H2、25E5、24E5、21D9、21D9.b、21D9.c、21D9.d、21D9.e、21A5、21A5.a、10F10、10F10.1、10F10.3或10F10.4中的任一种的VH CDR1、CDR2和/或CDR3的VH以及包含9G4、9C8、2H2、25E5、24E5、21D9、21D9.b、21D9.c、21D9.d、21D9.e、21A5、21A5.a、10F10、10F10.1、10F10.3或10F10.4中的任一种的VLCDR1、CDR2和/或CDR3的VL(即,9G4(SEQ ID NO:128-130)、9C8(SEQ ID NO:134-136)、2H2(SEQ ID NO:140-142)、2E5(SEQ ID NO:146-148)、24E5(SEQ ID NO:152-154)、21D9(SEQID NO:158-160)、21D9.b(SEQ ID NO:158-160)、21D9.c(SEQ ID NO:158-160)、21D9.d(SEQID NO:158-160)、21D9.e(SEQ ID NO:158-160)、21A5(SEQ ID NO:164-166)、10F10(SEQ IDNO:170-172)、10F10.1(SEQ ID NO:170-172)、10F10.3(SEQ ID NO:170-172)或10F10.4(SEQ ID NO:170-172))。
在一些实施方案中,ILT4 Ab可包含:
(a)包含9G4的VH CDR1、CDR2和CDR3的氨基酸序列的VH,和包含9G4的VL CDR1、CDR2和CDR3的VL;
(b)包含9C8的VH CDR1、CDR2和CDR3的氨基酸序列的VH,和包含9C8的VL CDR1、CDR2和CDR3的VL;
(c)包含2H2的VH CDR1、CDR2和CDR3的氨基酸序列的VH,和包含2H2的VL CDR1、CDR2和CDR3的VL;
(d)包含25E5的VH CDR1、CDR2和CDR3的氨基酸序列的VH,和包含25E5的VL CDR1、CDR2和CDR3的VL;
(e)包含24E5的VH CDR1、CDR2和CDR3的氨基酸序列的VH,和包含24E5的VL CDR1、CDR2和CDR3的VL;
(f)包含21D9的VH CDR1、CDR2和CDR3的氨基酸序列的VH,和包含21D9的VL CDR1、CDR2和CDR3的VL;
(g)包含21D9.b的VH CDR1、CDR2和CDR3的氨基酸序列的VH,和包含21D9.b的VLCDR1、CDR2和CDR3的VL;
(h)包含21D9.c的VH CDR1、CDR2和CDR3的氨基酸序列的VH,和包含21D9.c的VLCDR1、CDR2和CDR3的VL;
(i)包含21D9.d的VH CDR1、CDR2和CDR3的氨基酸序列的VH,和包含21D9.d的VLCDR1、CDR2和CDR3的VL;
(j)包含21D9.e的VH CDR1、CDR2和CDR3的氨基酸序列的VH,和包含21D9.e的VLCDR1、CDR2和CDR3的VL;
(k)包含21A5的VH CDR1、CDR2和CDR3的氨基酸序列的VH,和包含21A5的VL CDR1、CDR2和CDR3的VL;
(l)包含21A5.a的VH CDR1、CDR2和CDR3的氨基酸序列的VH,和包含21A5.a的VLCDR1、CDR2和CDR3的VL;
(m)包含10F10的VH CDR1、CDR2和CDR3的氨基酸序列的VH,和包含10F10的VLCDR1、CDR2和CDR3的VL;
(n)包含10F10.1的VH CDR1、CDR2和CDR3的氨基酸序列的VH,和包含10F10.1的VLCDR1、CDR2和CDR3的VL;
(o)包含10F10.3的VH CDR1、CDR2和CDR3的氨基酸序列的VH,和包含10F10.3的VLCDR1、CDR2和CDR3的VL;或
(p)包含10F10.4的VH CDR1、CDR2和CDR3的氨基酸序列的VH,和包含10F10.4的VLCDR1、CDR2和CDR3的VL。
再次,下文序列表提供上文所列的抗体的重链和轻链可变区序列和全长重链和轻链序列。
在某些实施方案中,ILT4 Ab包含有包含本文所提供的任一种ILT4 Ab的VH的氨基酸序列的VH。本发明提供的特定抗体物种的个别VH序列列举在序列表中。在某些实施方案中,ILT4 Ab包含有包含9G4、9C8、2H2、25E5、24E5、21D9、21D9.b、21D9.c、21D9.d、21D9.e、21A5、21A5.a、10F10、10F10.1、10F10.3或10F10.4中的任一种的VH的氨基酸序列(即,9G4(SEQ ID NO:51,氨基酸20-135)、9C8(SEQ ID NO:55)、2H2(SEQ ID NO:58)、2E5(SEQ IDNO:63)、24E5(SEQ ID NO:67)、21D9(SEQ ID NO:71)、21D9.b(SEQ ID NO:74)、21D9.c(SEQID NO:75)、21D9.d(SEQ ID NO:78)、21D9.e(SEQ ID NO:80)、21A5(SEQ ID NO:83)、21A5.a(SEQ ID NO:87)、10F10(SEQ ID NO:91)、10F10.1(SEQ ID NO:91)、10F10.3(SEQ ID NO:91)或10F10.4(SEQ ID NO:91)中的任一种)的VH。
在一些实施方案中,ILT4 Ab包含有任何9G4、9C8、2H2、25E5、24E5、21D9、21D9.b、21D9.c、21D9.d、21D9.e、21A5、21A5.a、10F10、10F10.1、10F10.3或10F10.4中的任一种的,但在VH序列的框架区中具有1、2、3、4或5个氨基酸取代(诸如1、2、3、4或5个保守性取代)的VH。在一些实施方案中,ILT4 Ab包含有任何9G4、9C8、2H2、25E5、24E5、21D9、21D9.b、21D9.c、21D9.d、21D9.e、21A5、21A5.a、10F10、10F10.1、10F10.3或10F10.4中的任一种的,但在VH序列的框架区中具有1、2、3、4或5个回复取代的VH。
在一些实施方案中,ILT4 Ab包含本文所描述的任一种ILT4 Ab的VH CDR和VLCDR,其中这些CDR在所有CDR之中包含1、2或3个氨基酸添加、取代(例如保守性取代)或缺失。
在某些实施方案中,ILT4 Ab包含有包含本文所提供的任一种ILT4 Ab的VH CDR的氨基酸序列的VH CDR1、CDR2和CDR3且包含与本文所提供的任一种ILT4 Ab的VH具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的VH。在某些实施方案中,ILT4 Ab包含有包含与以下中的任一种的VH的氨基酸序列具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的氨基酸序列的VH:9G4、9C8、2H2、25E5、24E5、21D9、21D9.b、21D9.c、21D9.d、21D9.e、21A5、21A5.a、10F10、10F10.1、10F10.3或10F10.4。在某些实施方案中,所述抗体的VH由于VH序列的框架区中的1、2、3、4或5个氨基酸取代(诸如1、2、3、4或5个保守性取代)而不同于序列表中所示的VH序列的VH。在某些实施方案中,所述抗体的VH由于VH序列的框架区中的1、2、3、4或5个回复取代而不同于序列表中所示的VH序列的VH。
在某些实施方案中,ILT4 Ab包含由本文所提供的任一种ILT4Ab的VH的氨基酸序列组成的VH。在某些实施方案中,ILT4 Ab包含由9G4、9C8、2H2、25E5、24E5、21D9、21D9.b、21D9.c、21D9.d、21D9.e、21A5、21A5.a、10F10、10F10.1、10F10.3或10F10.4中的任一种的VH的氨基酸序列组成的VH。
在某些实施方案中,ILT4 Ab包含有包含本文所提供的任一种ILT4 Ab的VL的氨基酸序列的VL。在某些实施方案中,ILT4 Ab包含有包含9G4、9C8、2H2、25E5、24E5、21D9、21D9.b、21D9.c、21D9.d、21D9.e、21A5、21A5.a、10F10、10F10.1、10F10.3或10F10.4中的任一种的VL的氨基酸序列(即,9G4(SEQ ID NO:50,氨基酸19-125)、9C8(SEQ ID NO:54)、2H2(SEQ ID NO:59)、2E5(SEQ ID NO:62)、24E5(SEQ ID NO:66)、21D9(SEQ ID NO:70)、21D9.b(SEQ ID NO:70)、21D9.c(SEQ ID NO:70)、21D9.d(SEQ ID NO:70)、21D9.e(SEQ ID NO:70)、21A5(SEQ ID NO:82)、21A5.a(SEQ ID NO:86)、10F10(SEQ ID NO:90)、10F10.1(SEQID NO:94)、10F10.3(SEQ ID NO:96)或10F10.4(SEQ ID NO:114))的VL。在某些实施方案中,ILT4Ab包含有包含本文所提供的任一种ILT4 Ab的VL CDR的氨基酸序列的VL CDR1、CDR2和CDR3且包含与本文所提供的任一种ILT4Ab的VL具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的VL。在某些实施方案中,ILT4 Ab包含有包含与以下中的任一种的VL的氨基酸序列具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的氨基酸序列的VL:9G4、9C8、2H2、25E5、24E5、21D9、21D9.b、21D9.c、21D9.d、21D9.e、21A5、21A5.a、10F10、10F10.1、10F10.3或10F10.4。在某些实施方案中,所述抗体的VL由于VL序列的框架区中的1、2、3、4或5个氨基酸取代(诸如1、2、3、4或5个保守性取代)而不同于序列表中所示的VL序列的VL。在某些实施方案中,所述抗体的VL由于1、2、3、4或5个回复取代而不同于序列表中所示的VL序列的VL。
在某些实施方案中,ILT4 Ab包含有由本文所提供的任一种ILT4Ab的VL的氨基酸序列组成的VL。在某些实施方案中,ILT4 Ab包含由9G4、9C8、2H2、25E5、24E5、21D9、21D9.b、21D9.c、21D9.d、21D9.e、21A5、21A5.a、10F10、10F10.1、10F10.3或10F10.4中的任一种的VL的氨基酸序列组成的VL。
在某些实施方案中,ILT4 Ab包含有包含本文所提供的任一种ILT4 Ab的VH的氨基酸序列的VH且包含有包含本文所提供的任一种ILT4 Ab的VL的氨基酸序列的VL。在这些实施方案中的某些中,ILT4 Ab包含有包含9G4、9C8、2H2、25E5、24E5、21D9、21D9.b、21D9.c、21D9.d、21D9.e、21A5、21A5.a、10F10、10F10.1、10F10.3或10F10.4中的任一种的VH的氨基酸序列的VH以及包含9G4、9C8、2H2、25E5、24E5、21D9、21D9.b、21D9.c、21D9.d、21D9.e、21A5、21A5.a、10F10、10F10.1、10F10.3或10F10.4中的任一种的VL的氨基酸序列的VL。
然而,在某些实施方案中,所述抗体的VH为9G4、9C8、2H2、25E5、24E5、21D9、21D9.b、21D9.c、21D9.d、21D9.e、21A5、21A5.a、10F10、10F10.1、10F10.3或10F10.4中的任一种的,但在VH序列的框架区中具有1、2、3、4或5个氨基酸取代(诸如1、2、3、4或5个保守性取代)的VH,并且VL为来自上文清单的相同物种中的任一种的VL。然而,在某些实施方案中,所述抗体的VH为9G4、9C8、2H2、25E5、24E5、21D9、21D9.b、21D9.c、21D9.d、21D9.e、21A5、21A5.a、10F10、10F10.1、10F10.3或10F10.4中的任一种的,但在VH序列的框架区中具有1、2、3、4或5个回复取代的VH。
在某些实施方案中,ILT4 Ab包含有包含9G4、9C8、2H2、25E5、24E5、21D9、21D9.b、21D9.c、21D9.d、21D9.e、21A5、21A5.a、10F10、10F10.1、10F10.3或10F10.4中的任一种的VH和VL的氨基酸序列的VH和VL。
在某些实施方案中,ILT4 Ab包含有包含本文所提供的任一种ILT4 Ab的VH CDR的氨基酸序列的VH CDR1、CDR2和CDR3以及包含本文所提供的任一种ILT4 Ab的VL CDR的氨基酸序列的VL CDR1、CDR2和CDR3,并且还包含各自与本文所提供的任一种ILT4Ab的对应VH和VL具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的VH和VL。在某些实施方案中,所述抗体的VH和VL由于序列的框架区中的1、2、3、4或5个氨基酸取代(诸如1、2、3、4或5个保守性取代或诸如1、2、3、4或5个回复取代)而不同于序列表中所示的VH和VL序列。
在某些实施方案中,ILT4 Ab包含由本文所提供的任一种ILT4Ab的VH和VL的氨基酸序列组成的VH和VL。在某些实施方案中,ILT4 Ab包含各自由9G4、9C8、2H2、25E5、24E5、21D9、21D9.b、21D9.c、21D9.d、21D9.e、21A5、21A5.a、10F10、10F10.1、10F10.3或10F10.4中的任一种的VH和VL的氨基酸序列组成的VH和VL。
一种ILT4 Ab可包含:
(a)包含9G4的VH的氨基酸序列的VH和包含9G4的VL的氨基酸序列的VL;
(b)包含9C8的VH的氨基酸序列的VH和包含9C8的VL的氨基酸序列的VL;
(c)包含2H2的VH的氨基酸序列的VH和包含2H2的VL的氨基酸序列的VL;
(d)包含25E5的VH的氨基酸序列的VH和包含25E5的VL的氨基酸序列的VL;
(e)包含24E5的VH的氨基酸序列的VH和包含24E5的VL的氨基酸序列的VL;
(f)包含21D9的VH的氨基酸序列的VH和包含21D9的VL的氨基酸序列的VL;
(g)包含21D9.b的VH的氨基酸序列的VH和包含21D9.b的VL的氨基酸序列的VL;
(h)包含21D9.c的VH的氨基酸序列的VH和包含21D9.c的VL的氨基酸序列的VL;
(i)包含21D9.d的VH的氨基酸序列的VH和包含21D9.d的VL的氨基酸序列的VL;
(j)包含21D9.e的VH的氨基酸序列的VH和包含21D9.e的VL的氨基酸序列的VL;
(k)包含21A5的VH的氨基酸序列的VH和包含21A5的VL的氨基酸序列的VL;
(l)包含21A5.a的VH的氨基酸序列的VH和包含21A5.a的VL的氨基酸序列的VL;
(m)包含10F10的VH的氨基酸序列的VH和包含10F10的VL的氨基酸序列的VL;
(n)包含10F10.1的VH的氨基酸序列的VH和包含10F10.1的VL的氨基酸序列的VL;
(o)包含10F10.3的VH的氨基酸序列的VH和包含10F10.3的VL的氨基酸序列的VL;或
(p)包含10F10.4的VH的氨基酸序列的VH和包含10F10.4的VL的氨基酸序列的VL。
一种ILT4 Ab可包含:
(a)包含9G4的VH的VH CDR的VH和包含9G4的VL CDR的VL,以及与9G4的VH和VL具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的VH和VL氨基酸序列;
(b)包含9C8的VH的VH CDR的VH和包含9C8的VL CDR的VL,以及与9C8的VH和VL具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的VH和VL氨基酸序列;
(c)包含2H2的VH的VH CDR的VH和包含2H2的VL CDR的VL,以及与2H2的VH和VL具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的VH和VL氨基酸序列;
(d)包含25E5的VH的VH CDR的VH和包含25E5的VL CDR的VL,以及与25E5的VH和VL具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的VH和VL氨基酸序列;
(e)包含24E5的VH的VH CDR的VH和包含24E5的VL CDR的VL,以及与24E5的VH和VL具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的VH和VL氨基酸序列;
(f)包含21D9的VH的VH CDR的VH和包含21D9的VL CDR的VL,以及与21D9的VH和VL具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的VH和VL氨基酸序列;
(g)包含21D9.b的VH的VH CDR的VH和包含21D9.b的VL CDR的VL,以及与21D9.b的VH和VL具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的VH和VL氨基酸序列;
(h)包含21D9.c的VH的VH CDR的VH和包含21D9.c的VL CDR的VL,以及与21D9.c的VH和VL具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的VH和VL氨基酸序列;
(i)包含21D9.d的VH的VH CDR的VH和包含21D9.d的VL CDR的VL,以及与21D9.d的VH和VL具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的VH和VL氨基酸序列;
(j)包含21D9.e的VH的VH CDR的VH和包含21D9.e的VL CDR的VL,以及与21D9.e的VH和VL具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的VH和VL氨基酸序列;
(k)包含21A5的VH的VH CDR的VH和包含21A5的VL CDR的VL,以及与21A5的VH和VL具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的VH和VL氨基酸序列;
(l)包含21A5.a的VH的VH CDR的VH和包含21A5.a的VL CDR的VL,以及与21A5.a的VH和VL具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的VH和VL氨基酸序列;
(m)包含10F10的VH的VH CDR的VH和包含10F10的VL CDR的VL,以及与10F10的VH和VL具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的VH和VL氨基酸序列;
(n)包含10F10.1的VH的VH CDR的VH和包含10F10.1的VL CDR的VL,以及与10F10.1的VH和VL具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的VH和VL氨基酸序列;
(o)包含10F10.3的VH的VH CDR的VH和包含10F10.3的VL CDR的VL,以及与10F10.3的VH和VL具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的VH和VL氨基酸序列;或
(p)包含10F10.4的VH的VH CDR的VH和包含10F10.4的VL CDR的VL,以及与10F10.4的VH和VL具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的VH和VL氨基酸序列。
在以上实施方案中的一些中,VH和/或VL可由于存在1、2、3、4或5个氨基酸取代(诸如1、2、3、4或5个保守性取代)而与物种(a)至(p)中的每一种的序列不同。在一些实施方案中,VH可包含1、2、3、4或5个回复取代。
一种ILT4 Ab可包含:
(a)由9G4的VH的氨基酸序列组成的VH和由9G4的VL组成的VL;
(b)由9C8的VH的氨基酸序列组成的VH和由9C8的VL组成的VL;
(c)由2H2的VH的氨基酸序列组成的VH和由2H2的VL组成的VL;
(d)由25E5的VH的氨基酸序列组成的VH和由25E5的VL组成的VL;
(e)由24E5的VH的氨基酸序列组成的VH和由24E5的VL组成的VL;
(f)由21D9的VH的氨基酸序列组成的VH和由21D9的VL组成的VL;
(g)由21D9.b的VH的氨基酸序列组成的VH和由21D9.b的VL组成的VL;
(h)由21D9.c的VH的氨基酸序列组成的VH和由21D9.c的VL组成的VL;
(i)由21D9.d的VH的氨基酸序列组成的VH和由21D9.d的VL组成的VL;
(j)由21D9.e的VH的氨基酸序列组成的VH和由21D9.e的VL组成的VL;
(k)由21A5的VH的氨基酸序列组成的VH和由21A5的VL组成的VL;
(l)由21A5.a的VH的氨基酸序列组成的VH和由21A5.a的VL组成的VL;
(m)由10F10的VH的氨基酸序列组成的VH和由10F10的VL组成的VL;
(n)由10F10.1的VH的氨基酸序列组成的VH和由10F10.1的VL组成的VL;
(o)由10F10.3的VH的氨基酸序列组成的VH和由10F10.3的VL组成的VL;或
(p)由10F10.4的VH的氨基酸序列组成的VH和由10F10.4的VL组成的VL。
在某些实施方案中,ILT4 Ab包含上文和本文别处所描述的抗体的可变区和/或可变区CDR 1至3中的任一种,诸如:
(1)以下的VH CDR1、CDR2和CDR3中的一种或多种:9G4、9C8、2H2、25E5、24E5、21D9、21D9.b、21D9.c、21D9.d、21D9.e、21A5、21A5.a、10F10、10F10.1、10F10.3或10F10.4;
(2)以下的VH CDR1、CDR2和CDR3:9G4、9C8、2H2、25E5、24E5、21D9、21D9.b、21D9.c、21D9.d、21D9.e、21A5、21A5.a、10F10、10F10.1、10F10.3或10F10.4;
(3)以下的VH:9G4、9C8、2H2、25E5、24E5、21D9、21D9.b、21D9.c、21D9.d、21D9.e、21A5、21A5.a、10F10、10F10.1、10F10.3或10F10.4;
(4)以下的VH CDR1、CDR2和CDR3中的一种或多种以及VL CDR1、CDR2和CDR3中的一种或多种:9G4、9C8、2H2、25E5、24E5、21D9、21D9.b、21D9.c、21D9.d、21D9.e、21A5、21A5.a、10F10、10F10.1、10F10.3或10F10.4;
(5)以下的VH CDR1、CDR2和CDR3以及VL CDR1、CDR2和CDR3:9G4、9C8、2H2、25E5、24E5、21D9、21D9.b、21D9.c、21D9.d、21D9.e、21A5、21A5.a、10F10、10F10.1、10F10.3或10F10.4;
(6)以下的VH和VL:9G4、9C8、2H2、25E5、24E5、21D9、21D9.b、21D9.c、21D9.d、21D9.e、21A5、21A5.a、10F10、10F10.1、10F10.3或10F10.4;
或
(7)例外情况为在以下的VH和/或VL中具有1、2、3、4或5个回复或保守性取代的VL和VH:9G4、9C8、2H2、25E5、24E5、21D9、21D9.b、21D9.c、21D9.d、21D9.e、21A5、21A5.a、10F10、10F10.1、10F10.3或10F10.4;且所述ILT4 Ab还为IgG抗体,诸如IgG1、IgG2、IgG3或IgG4抗体或如以下部分中所描述的其修饰形式。在一些实施方案中,恒定区具有效应功能,并且在一些实施方案中,恒定区无效应。在某些实施方案中,恒定区为IgG1.3或IgG1.1f的恒定区或本文所描述的另一恒定区,例如IgG1和IgG1.238K。
在某些实施方案中,ILT4 Ab包含上文和本文别处所描述的抗体的可变区和/或可变区CDR 1至3中的任一种,诸如:
(1)以下的VH CDR1、CDR2和CDR3中的一种或多种:9G4、9C8、2H2、25E5、24E5、21D9、21D9.b、21D9.c、21D9.d、21D9.e、21A5、21A5.a、10F10、10F10.1、10F10.3或10F10.4;
(2)以下的VH CDR1、CDR2和CDR3:9G4、9C8、2H2、25E5、24E5、21D9、21D9.b、21D9.c、21D9.d、21D9.e、21A5、21A5.a、10F10、10F10.1、10F10.3或10F10.4;
(3)以下的VH:9G4、9C8、2H2、25E5、24E5、21D9、21D9.b、21D9.c、21D9.d、21D9.e、21A5、21A5.a、10F10、10F10.1、10F10.3或10F10.4;
(4)以下的VH CDR1、CDR2和CDR3中的一种或多种以及VL CDR1、CDR2和CDR3中的一种或多种:9G4、9C8、2H2、25E5、24E5、21D9、21D9.b、21D9.c、21D9.d、21D9.e、21A5、21A5.a、10F10、10F10.1、10F10.3或10F10.4;
(5)以下的VH CDR1、CDR2和CDR3以及VL CDR1、CDR2和CDR3:9G4、9C8、2H2、25E5、24E5、21D9、21D9.b、21D9.c、21D9.d、21D9.e、21A5、21A5.a、10F10、10F10.1、10F10.3或10F10.4;
(6)以下的VH和VL:9G4、9C8、2H2、25E5、24E5、21D9、21D9.b、21D9.c、21D9.d、21D9.e、21A5、21A5.a、10F10、10F10.1、10F10.3或10F10.4;
或
(7)9G4、9C8、2H2、25E5、24E5、21D9、21D9.b、21D9.c、21D9.d、21D9.e、21A5、21A5.a、10F10、10F10.1、10F10.3或10F10.4的VL和VH,例外情况为在VH和/或VL中具有1、2、3、4或5个回复或保守性取代;
且
所述抗体还包含以下特征中的一种或多种:
-例如以10
-不特异性结合到hILT2、hILT3、hILT5;
-不特异性结合到LILRA和/或LILRB家族的一个或多个成员;
-例如在MLR中刺激T细胞活化,如通过增加的T细胞增殖或IFN-g分泌所测量,例如如实施例中所描述的测定中所示;
-刺激单核细胞分化或活化成巨噬细胞,例如刺激单核细胞分化成促炎性巨噬细胞,例如如实施例中所描述的测定中所示;
-促进CD83和CD86在人类单核细胞源性未成熟树突状细胞(Mo-iDC)上的表达,例如如实施例中所描述的测定中所示;
-在CMV溶胞物测定中增强在抗原刺激后的IFN-γ分泌,例如如实施例中所描述的测定中所示;
-通过CD4+和CD8+T细胞在同种异体混合淋巴细胞反应(同种异体MLR)测定中增强在CD3刺激后的IFN-γ和TNF-α分泌,例如如实施例中所描述的测定中所示;
-不诱导(或触发)嗜碱性粒细胞活化;
-抑制HLA-A和/或HLA-B与ILT4的结合;
-具有如图27或图37C中所示的与hILT4的结合概况;
-结合到hILT4的Ig样结构域1、2或1和2(其分别对应于SE Q ID NO:107的氨基酸27-110和111-229),诸如结合到包含以下的区域:(i)
-不显著结合到ILT4的胞外结构域的其他区域,诸如位于氨基酸I70的N端的区域或残基;其中hILT4的氨基酸编号为未成熟hILT4(即,具有其信号序列的ILT4)的氨基酸编号;
-与本文所描述的抗体竞争结合到hILT4;
-特异性结合到包含SEQ ID NO:118的食蟹猴ILT4,例如如实施例中所描述的结合测定中所示;
-促进巨噬细胞朝向M1巨噬细胞的促炎性极化;
-不诱导(或触发)嗜碱性粒细胞活化;和
-在于25℃下孵育3个月之后包含少于5%的高分子量物质和低分子量物质,和/或在于40℃下孵育3个月之后包含少于10%的高分子量物质和低分子量物质。
在某些实施方案中,ILT4 Ab包含有包含本文所提供的任一种ILT4 Ab的重链的氨基酸序列的重链(HC)。在某些实施方案中,ILT4Ab包含有包含如下文在序列表中所示的9G4、9C8、2H2、25E5、24E5、21D9、21D9.b、21D9.c、21D9.d、21D9.e、21A5、21A5.a、10F10、10F10.1、10F10.3或10F10.4中的任一种的重链的氨基酸序列(即,如所述表所提供的完整HC序列,或抗体的VH序列与HC恒定区序列的复合序列,诸如如所述表中所提供的SEQ IDNO:98、100、102、103、104或179)的重链。
因此,例如,在一些实施方案中,所述抗体可包含以下类型中的一种的HC氨基酸序列,包含如下氨基酸序列:
a.IgG1,例如9G4.IgG1,9G4(SEQ ID NO:2)、9C8(SEQ ID NO:4)、2H2(SEQ ID NO:6)、2E5(SEQ ID NO:8)、24E5(SEQ ID NO:10)、21D9(SEQ ID NO:12)、21D9.b(SEQ ID NO:74和SEQ ID NO:98)、21D9.c(SEQ ID NO:75和SEQ ID NO:98)、21D9.d(SEQ ID NO:78和SEQID NO:98)、21D9.e(SEQ ID NO:80和SEQ ID NO:98)、21A5(SEQ ID NO:83和SEQ ID NO:98)、21A5.a(SEQ ID NO:87和SEQ ID NO:98)、10F10(SEQ ID NO:91和SEQ ID NO:98)、10F10.1(SEQ ID NO:91和SEQ ID NO:98)、10F10.3(SEQ ID NO:91和SEQ ID NO:98)或10F10.4(SEQ ID NO:91和SEQ ID NO:98),
b.IgG1,例如9G4.IgG1,9G4(SEQ ID NO:51,氨基酸20-135,和SEQ ID NO:102)、9C8(SEQ ID NO:55和SEQ ID NO:102)、2H2(SEQ ID NO:58和SEQ ID NO:102)、2E5(SEQ IDNO:63和SEQ ID NO:102)、24E5(SEQ ID NO:67和SEQ ID NO:102)、21D9(SEQ ID NO:71和SEQ ID NO:102)、21D9.b(SEQ ID NO:74和SEQ ID NO:102)、21D9.c(SEQ ID NO:75和SEQID NO:102)、21D9.d(SEQ ID NO:78和SEQ ID NO:102)、21D9.e(SEQ ID NO:80和SEQ IDNO:102)、21A5(SEQ ID NO:83和SEQ ID NO:102)、21A5.a(SEQ ID NO:87和SEQ ID NO:102)、10F10(SEQ ID NO:91和SEQ ID NO:102)、10F10.1(SEQ ID NO:91和SEQ ID NO:102)、10F10.3(SEQ ID NO:91和SEQ ID NO:102)或10F10.4(SEQ ID NO:91和SEQ ID NO:102),
c.IgG1.3(例如9G4.IgG1.3等),9G4(SEQ ID NO:51,氨基酸20-135,和SEQ ID NO:100)、9C8(SEQ ID NO:55和SEQ ID NO:100)、2H2(SEQ ID NO:58和SEQ ID NO:100)、2E5(SEQ ID NO:63和SEQ ID NO:100)、24E5(SEQ ID NO:67和SEQ ID NO:100)、21D9((i)SEQID NO:113,或(ii)SEQ ID NO:71和SEQ ID NO:100)、21D9.b(SEQ ID NO:36)、21D9.c(SEQID NO:38)、21D9.d(SEQ ID NO:40)、21D9.e(SEQ ID NO:13)、21A5(SEQ ID NO:15)、21A5.a(SEQ ID NO:17)、10F10(SEQ ID NO:19)、10F10.1(SEQ ID NO:91和SEQ ID NO:100)、10F10.3(SEQ ID NO:91和SEQ ID NO:100)或10F10.4(SEQ ID NO:91和SEQ ID NO:100);
d.IgG1.1f(例如9G4.IgG1.1f等),9G4(SEQ ID NO:51,氨基酸20-135,和SEQ IDNO:103)、9C8(SEQ ID NO:55和SEQ ID NO:103)、2H2(SEQ ID NO:58和SEQ ID NO:103)、2E5(SEQ ID NO:63和SEQ ID NO:103)、24E5(SEQ ID NO:67和SEQ ID NO:103)、21D9(SEQ IDNO:71和SEQ ID NO:103)、21D9.b(SEQ ID NO:74和SEQ ID NO:103)、21D9.c(SEQ ID NO:75和SEQ ID NO:103)、21D9.d(SEQ ID NO:78和SEQ ID NO:103)、21D9.e(SEQ ID NO:80和SEQID NO:103)、21A5(SEQ ID NO:83和SEQ ID NO:103)、21A5.a(SEQ ID NO:87和SEQ ID NO:103)、10F10(SEQ ID NO:91和SEQ ID NO:103)、10F10.1(SEQ ID NO:91和SEQ ID NO:103)、10F10.3(SEQ ID NO:91和SEQ ID NO:103)或10F10.4(SEQ ID NO:91和SEQ ID NO:103),
e.IgG1fa.P238K(例如9G4.IgG1fa.P238K等)9G4(SEQ ID NO:51,氨基酸20-135,和SEQ ID NO:104)、9C8(SEQ ID NO:55和SEQ ID NO:104)、2H2(SEQ ID NO:58和SEQ IDNO:104)、2E5(SEQ ID NO:63和SEQ ID NO:104)、24E5(SEQ ID NO:67和SEQ ID NO:104)、21D9(SEQ ID NO:71和SEQ ID NO:104)、21D9.b(SEQ ID NO:74和SEQ ID NO:104)、21D9.c(SEQ ID NO:75和SEQ ID NO:104)、21D9.d(SEQ ID NO:78和SEQ ID NO:104)、21D9.e(SEQID NO:80和SEQ ID NO:104)、21A5(SEQ ID NO:83和SEQ ID NO:104)、21A5.a(SEQ ID NO:87和SEQ ID NO:104)、10F10(SEQ ID NO:91和SEQ ID NO:104)、10F10.1(SEQ ID NO:91和SEQ ID NO:104)、10F10.3(SEQ ID NO:91和SEQ ID NO:104)或10F10.4(SEQ ID NO:91和SEQ ID NO:104),或
f.IgG4 S228P(例如9G4.IgG4 S228P等),9G4(SEQ ID NO:51,氨基酸20-135,和SEQ ID NO:179)、9C8(SEQ ID NO:55和SEQ ID NO:179)、2H2(SEQ ID NO:58和SEQ ID NO:179)、2E5(SEQ ID NO:63和SEQ ID NO:179)、24E5(SEQ ID NO:67和SEQ ID NO:179)、21D9(SEQ ID NO:71和SEQ ID NO:179)、21D9.b(SEQ ID NO:74和SEQ ID NO:179)、21D9.c(SEQID NO:75和SEQ ID NO:179)、21D9.d(SEQ ID NO:78和SEQ ID NO:179)、21D9.e(SEQ IDNO:80和SEQ ID NO:179)、21A5(SEQ ID NO:83和SEQ ID NO:179)、21A5.a(SEQ ID NO:87和SEQ ID NO:179)、10F10(SEQ ID NO:91和SEQ ID NO:179)、10F10.1(SEQ ID NO:91和SEQID NO:179)、10F10.3(SEQ ID NO:91和SEQ ID NO:179)或10F10.4(SEQ ID NO:91和SEQ IDNO:179)。
在某些实施方案中,ILT4 Ab包含有:包含本文所提供的任一种ILT4 Ab的重链的氨基酸序列的重链,其包含IgG1.3重链恒定区;和本文所提供的任一种ILT4 Ab的轻链的氨基酸序列。在某些实施方案中,ILT4 Ab包含有:包含9G4、9C8、2H2、25E5、24E5、21D9、21D9.b、21D9.c、21D9.d、21D9.e、21A5、21A5.a、10F10、10F10.1、10F10.3或10F10.4中的任一种的VH的氨基酸序列的重链,其包含IgG1.3 HC恒定区(其由命名9G4.IgG1.3等表示);和包含9G4、9C8、2H2、25E5、24E5、21D9、21D9.b、21D9.c、21D9.d、21D9.e、21A5、21A5.a、10F10、10F10.1、10F10.3或10F10.4中的任一种的轻链的氨基酸序列的轻链。在一些实施方案中,轻链为包含如下氨基酸序列的κ轻链:9G4(SEQ ID NO:1)、9C8(SEQ ID NO:3)、2H2(SEQ IDNO:5)、2E5(SEQ ID NO:7)、24E5(SEQ ID NO:9)、21D9(SEQ ID NO:11)、21D9.b、21D9.c、21D9.d、21D9.e、21A5(SEQ ID NO:14)、21A5.a(SEQ ID NO:16)、10F10(SEQ ID NO:18)、10F10.1(SEQ ID NO:20)、10F10.3(SEQ ID NO:21)或10F10.4(SEQ ID NO:116)。
一种ILT4 Ab可包含:
(a)包含9G4的重链的氨基酸序列的重链和包含9G4的轻链氨基酸序列的轻链;
(b)包含9C8的重链的氨基酸序列的重链和包含9C8的轻链氨基酸序列的轻链;
(c)包含2H2的重链的氨基酸序列的重链和包含2H2的轻链氨基酸序列的轻链;
(d)包含25E5的重链的氨基酸序列的重链和包含25E5的轻链氨基酸序列的轻链;
(e)包含24E5的重链的氨基酸序列的重链和包含24E5的轻链氨基酸序列的轻链;
(f)包含9G4的重链的氨基酸序列的重链和包含21D9的轻链氨基酸序列的轻链;
(g)包含21D9.b的重链的氨基酸序列的重链和包含21D9.b的轻链氨基酸序列的轻链;
(h)包含21D9.c的重链的氨基酸序列的重链和包含21D9.c的轻链氨基酸序列的轻链;
(i)包含21D9.d的重链的氨基酸序列的重链和包含21D9.d的轻链氨基酸序列的轻链;
(j)包含21D9.e的重链的氨基酸序列的重链和包含21D9.e的轻链氨基酸序列的轻链;
(k)包含21A5的重链的氨基酸序列的重链和包含21A5的轻链氨基酸序列的轻链;
(l)包含21A5.a的重链的氨基酸序列的重链和包含21A5.a的轻链氨基酸序列的轻链;
(m)包含10F10的重链的氨基酸序列的重链和包含10F10的轻链氨基酸序列的轻链;
(n)包含10F10.1的重链的氨基酸序列的重链和包含10F10.1的轻链氨基酸序列的轻链;
(o)包含10F10.3的重链的氨基酸序列的重链和包含10F10.3的轻链氨基酸序列的轻链;或
(p)包含10F10.4的重链的氨基酸序列的重链和包含10F10.4的轻链氨基酸序列的轻链。
一种ILT4 Ab可包含:
(a)包含9G4的HC的HC CDR的重链(HC)和包含9G4的LC CDR的轻链(LC),以及分别与9G4的HC和LC具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的HC和LC氨基酸序列;
(b)包含9C8的HC的HC CDR的HC和包含9C8的LC CDR的轻链(LC),以及分别与9C8的HC和LC具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的HC和LC氨基酸序列;
(c)包含2H2的HC的HC CDR的HC和包含2H2的LC CDR的轻链(LC),以及分别与2H2的HC和LC具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的HC和LC氨基酸序列;
(d)包含25E5的HC的HC CDR的HC和包含25E5的LC CDR的轻链(LC),以及分别与25E5的HC和LC具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的HC和LC氨基酸序列;
(e)包含24E5的HC的HC CDR的HC和包含24E5的LC CDR的轻链(LC),以及分别与24E5的HC和LC具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的HC和LC氨基酸序列;
(f)包含21D9的HC的HC CDR的HC和包含21D9的LC CDR的轻链(LC),以及分别与21D9的HC和LC具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的HC和LC氨基酸序列;
(g)包含21D9.b的HC的HC CDR的HC和包含21D9.b的LC CDR的轻链(LC),以及分别与21D9.b的HC和LC具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的HC和LC氨基酸序列;
(h)包含21D9.c的HC的HC CDR的HC和包含21D9.c的LC CDR的轻链(LC),以及分别与21D9.c的HC和LC具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的HC和LC氨基酸序列;
(i)包含21D9.d的HC的HC CDR的HC和包含21D9.d的LC CDR的轻链(LC),以及分别与21D9.d的HC和LC具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的HC和LC氨基酸序列;
(j)包含21D9.e的HC的HC CDR的HC和包含21D9.e的LC CDR的轻链(LC),以及分别与21D9.e的HC和LC具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的HC和LC氨基酸序列;
(k)包含21A5的HC的HC CDR的HC和包含21A5的LC CDR的轻链(LC),以及分别与21A5的HC和LC具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的HC和LC氨基酸序列;
(l)包含21A5.a的HC的HC CDR的HC和包含21A5.a的LC CDR的轻链(LC),以及分别与21A5.a的HC和LC具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的HC和LC氨基酸序列;
(m)包含10F10的HC的HC CDR的HC和包含10F10的LC CDR的轻链(LC),以及分别与10F10的HC和LC具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的HC和LC氨基酸序列;
(n)包含10F10.1的HC的HC CDR的HC和包含10F10.1的LC CDR的轻链(LC),以及分别与10F10.1的HC和LC具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的HC和LC氨基酸序列;
(o)包含10F10.3的HC的HC CDR的HC和包含10F10.3的LC CDR的轻链(LC),以及分别与10F10.3的HC和LC具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的HC和LC氨基酸序列;或
(p)包含10F10.3的HC的HC CDR的HC和包含10F10.4的LC CDR的轻链(LC),以及分别与10F10.4的HC和LC具有至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的HC和LC氨基酸序列。
在以上实施方案中的一些中,HC和/或LC可由于存在1、2、3、4或5个氨基酸取代(诸如1、2、3、4或5个保守性取代)而与物种(a)至(p)中的每一种的序列不同。在以上实施方案中的一些中,HC和/或LC可由于存在1、2、3、4或5个氨基酸取代(诸如1、2、3、4或5个回复取代)而不同于物种(a)至(p)中的每一种的序列。
在一些实施方案中,ILT4 Ab可包含:
(a)由9G4的重链的氨基酸序列组成的重链和由9G4的轻链的氨基酸序列组成的轻链;
(b)由9C8的重链的氨基酸序列组成的重链和由9C8的轻链的氨基酸序列组成的轻链;
(c)由2H2的重链的氨基酸序列组成的重链和由2H2的轻链的氨基酸序列组成的轻链;
(d)由25E5的重链的氨基酸序列组成的重链和由25E5的轻链的氨基酸序列组成的轻链;
(e)由24E5的重链的氨基酸序列组成的重链和由24E5的轻链的氨基酸序列组成的轻链;
(f)由21D9的重链的氨基酸序列组成的重链和由21D9的轻链的氨基酸序列组成的轻链;
(g)由21D9.b的重链的氨基酸序列组成的重链和由21D9.b的轻链的氨基酸序列组成的轻链;
(h)由21D9.c的重链的氨基酸序列组成的重链和由21D9.c的轻链的氨基酸序列组成的轻链;
(i)由21D9.d的重链的氨基酸序列组成的重链和由21D9.d的轻链的氨基酸序列组成的轻链;
(j)由21D9.e的重链的氨基酸序列组成的重链和由21D9.e的轻链的氨基酸序列组成的轻链;
(k)由21A5的重链的氨基酸序列组成的重链和由21A5的轻链的氨基酸序列组成的轻链;
(l)由21A5.a的重链的氨基酸序列组成的重链和由21A5.a的轻链的氨基酸序列组成的轻链;
(m)由10F10的重链的氨基酸序列组成的重链和由10F10的轻链的氨基酸序列组成的轻链;
(n)由10F10.1的重链的氨基酸序列组成的重链和由10F10.1的轻链的氨基酸序列组成的轻链;
(o)由10F10.3的重链的氨基酸序列组成的重链和由10F10.3的轻链的氨基酸序列组成的轻链;或
(p)由10F10.4的重链的氨基酸序列组成的重链和由10F10.4的轻链的氨基酸序列组成的轻链。
在一些实施方案中,ILT4 Ab可包含有包含本文中的抗体物种的VH氨基酸序列的重链氨基酸序列,而非如本文序列表中的HC序列中所提供(且参见SEQ ID NO:100)的IgG1.3重链恒定区,所述抗体可包含不同重链恒定区序列,诸如人类野生型IgG1恒定区,诸如SEQ ID NO:98和102-104中所提供的那些恒定区,或IgG4重链恒定区,或具有S228P取代(EU编号)的IgG4恒定区,或以下关于恒定区的部分中所描述的其他重链恒定区中的任一种。
在一些实施方案中,这类修饰的ILT4 Ab具有以下特征中的一种或多种:
-例如以10
-不特异性结合到hILT2、hILT3、hILT5中的一种、两种或全部三种;
-不特异性结合到LILRA和/或LILRB家族的一个或多个成员;
-例如在MLR测定中刺激T细胞活化,如通过增加的T细胞增殖或IFN-γ分泌所测量;且
刺激单核细胞分化或活化成巨噬细胞。
在一些实施方案中,所述抗体结合到hILT4的Ig样结构域1、2或1和2,其对应于序列SEQ ID NO:107上的氨基酸27-110(结构域1)和所述序列上的氨基酸111-229(结构域2),在这些位置包含
示例性抗体恒定区
在一些实施方案中,本文所描述的抗体包含一个或多个人类恒定区。在一些实施方案中,人类重链恒定区属于选自IgA、IgG和IgD的同种型。在一些实施方案中,人类轻链恒定区属于选自κ和λ的同种型。在一些实施方案中,本文所描述的抗体包含人类IgG恒定区,诸如IgG1、IgG2、IgG3或IgG4。在一些实施方案中,本文所描述的抗体包含人类IgG4重链恒定区。在一些这样的实施方案中,本文所描述的抗体包含人类IgG4恒定区中的S241P突变。在一些实施方案中,本文所描述的抗体包含人类IgG4恒定区和人类κ轻链。
重链恒定区的选择可决定抗体是否将具有体内效应功能。在一些实施方案中,这类效应功能包括抗体依赖性细胞介导的细胞毒性(ADCC)和/或补体依赖性细胞毒性(CDC),且可导致杀死抗体所结合的细胞。在一些治疗方法中,包括治疗一些癌症的方法中,例如当抗体结合到支援肿瘤的维持或生长的细胞时,可能需要杀死细胞。可支援肿瘤的维持或生长的示例性细胞包括(但不限于)肿瘤细胞本身、帮助将血管募集到肿瘤的细胞和提供支援或促进肿瘤生长或肿瘤存活的配体、生长因子或反受体的细胞。在一些实施方案中,当需要效应功能时,选择包含人类IgG1重链或人类IgG3重链的抗体。
在某些实施方案中,改变本文所提供的抗体以增加或减少抗体糖基化的程度。在抗体上添加糖基化位点或使抗体缺失糖基化位点可通过改变氨基酸序列以便产生或移除一个或多个糖基化位点来便利地实现。
在抗体包含Fc区的情况下,可改变连接到其上的碳水化合物。由哺乳动物细胞产生的天然抗体通常包含分支链双触角寡糖,其通常通过N键连接到Fc区的CH2结构域的Asn297。参见,例如,Wright等人,TIBTECH 15:26-32(1997)。寡糖可包括各种碳水化合物,例如甘露糖、N-乙酰基葡糖胺(GlcNAc)、半乳糖和唾液酸,以及连接到双触角寡糖结构的“主干”中的GlcNAc的岩藻糖。在一些实施方案中,可对本发明抗体中的寡糖进行修饰以便产生具有某些改善的特性的抗体。例如,在一些实施方案中,抗体可例如通过使通常经含有岩藻糖的糖基化或经由其他手段糖基化的诸如Asn297的残基突变来去岩藻糖基化。在一些实施方案中,本文中的抗体可包含去岩藻糖基化人类IgG1恒定区。
还提供具有等分寡糖的抗体,例如其中连接到抗体的Fc区的双触角寡糖由GlcNAc等分。这类抗体可具有减少的岩藻糖基化和/或改善的ADCC功能。这类抗体的实例描述于例如WO 2003/011878(Jean-Mairet等人);美国专利第6,602,684号(Umana等人);和US2005/0123546(Umana等人)中。还提供寡糖中的至少一个半乳糖残基与Fc区连接的抗体。这类抗体可具有改善的CDC功能。这类抗体描述于例如WO 1997/30087(Patel等人);WO 1998/58964(Raju,S.);和WO 1999/22764(Raju,S.)中。
还提供具有氨基端前导序列延伸部分的抗体。例如,氨基端前导序列的一个或多个氨基酸残基存在于抗体的任何一个或多个重链或轻链的氨基端。示例性氨基端前导序列延伸部分包含三个氨基酸残基VHS或由其组成,所述三个氨基酸残基存在于抗体的一个或两个轻链上。
可例如在施用具有变异Fc区的多肽的转基因小鼠、人类或非人类灵长类动物中测定人类FcRn高亲和力结合多肽的体内或血清半衰期。还参见例如Petkova等人,International Immunology 18(12):1759-1769(2006)。
在本发明的一些实施方案中,与包含岩藻糖的亲本抗体相比,去岩藻糖基化抗体在人类效应细胞存在下更有效地介导ADCC。通常,ADCC活性可使用如本文中公开的体外ADCC测定来测定,但涵盖例如在动物模型等中测定ADCC活性的其他测定或方法。
在某些实施方案中,Fc区通过用不同氨基酸残基置换至少一个氨基酸残基来改变,以改变抗体的一种或多种效应功能。例如,一个或多个选自氨基酸残基234、235、236、237、297、318、320、322、330和/或331的氨基酸可用不同氨基酸残基置换,以使得抗体对效应物配体的亲和力改变,但保留亲本抗体的抗原结合能力。亲和力改变的效应物配体可为例如Fc受体或补体的C1组分。这种方法还详细描述于Winter等人的美国专利第5,624,821号和第5,648,260号两者中。
在一些实施例中,一个或多个选自氨基酸残基329、331和322的氨基酸可用不同氨基酸残基置换,以使得抗体具有改变的C1q结合和/或降低或消除的补体依赖性细胞毒性(CDC)。这种方法还详细描述于Idusogie等人的美国专利第6,194,551号中。
在一些实施例中,改变氨基酸位置231和239内的一个或多个氨基酸残基,由此改变抗体固定补体的能力。这种方法还描述于例如Bodmer等人的PCT公开案WO 94/29351中。在一些实施例中,Fc区可通过修饰以下位置的一个或多个氨基酸而修饰以减小抗体依赖性细胞毒性(ADCC)和/或减小与Fcγ受体的亲和力:234、235、236、238、239、240、241、243、244、245、247、248、249、252、254、255、256、258、262、263、264、265、267、268、269、270、272、276、278、280、283、285、286、289、290、292、293、294、295、296、298、299、301、303、305、307、309、312、313、315、320、322、324、325、326、327、329、330、331、332、333、334、335、337、338、340、360、373、376、378、382、388、389、398、414、416、419、430、433、434、435、436、437、438或439。示例性取代包括236A、239D、239E、268D、267E、268E、268F、324T、332D和332E。示例性变体包括239D/332E、236A/332E、236A/239D/332E、268F/324T、267E/268F、267E/324T和267E/268F/324T。可针对Fcs进行的其他Fc修饰为降低或消除与FcγR和/或补体蛋白的结合的那些修饰,由此降低或消除Fc介导的效应功能,诸如ADCC、ADCP和CDC。示例性修饰包括(但不限于)位置234、235、236、237、267、269、325、328、330和/或331(例如330和331)处的取代、插入和缺失,其中编号根据EU索引进行。示例性取代包括(但不限于)234A、235E、236R、237A、267R、269R、325L、328R、330S和331S(例如330S和331S),其中编号根据EU索引进行。Fc变体可包含236R/328R。用于减少FcγR与补体相互作用的其他修饰包括取代297A、234A、235A、237A、318A、228P、236E、268Q、309L、330S、331S、220S、226S、229S、238S、233P和234V,以及位置297的糖基化通过突变或酶方式移除或通过在不使蛋白质糖基化的生物体(诸如细菌)中产生来移除。这些和其他修饰综述于Strohl,2009,Current Opinion in Biotechnology20:685-691中。例如,人类IgG1.3 Fc恒定区含有L234A、L235E和G237A取代。IgG1fa.P238K(或IgG1.P238K)含有P238K取代。IgG1.1f包含L234A、L235E、G237A、A330S和P331S取代。
还可使用增强对抑制性受体FcγRIIb的亲和力的Fc变体。这类变体可提供具有与FcγRIIb细胞,包括例如B细胞和单核细胞相关的免疫调节活性的Fc融合蛋白。在一个实施方案中,Fc变体提供相对于一种或多种活化受体,选择性增强的对FcγRIIb的亲和力。用于改变与FcγRIIb的结合的修饰包括在选自由以下组成的组的位置处的一个或多个修饰:根据EU索引的234、235、236、237、239、266、267、268、325、326、327、328、330、331和332。用于增强FcγRllb亲和力的示例性取代包括(但不限于)234A、234D、234E、234F、234W、235D、235E、235F、235R、235Y、236D、236N、237A、237D、237N、239D、239E、266M、267D、267E、268D、268E、327D、327E、328F、328W、328Y、330S、331S和332E。示例性取代包括235Y、236D、239D、266M、267E、268D、268E、328F、328W和328Y。用于增强与FcγRIIb的结合的其他Fc变体包括235Y/267E、236D/267E、239D/268D、239D/267E、267E/268D、267E/268E和267E/328F。
用于增强FcγR与补体相互作用的其他修饰包括(但不限于)取代298A、333A、334A、326A、2471、339D、339Q、280H、290S、298D、298V、243L、292P、300L、396L、3051和396L。这些和其他修饰综述于Strohl,2009,Current Opinion in Biotechnology 20:685-691中。增加与Fcγ受体的结合的Fc修饰包括在Fc区的以下氨基酸位置中的任一个或多个处的氨基酸修饰:238、239、248、249、252、254、255、256、258、265、267、268、269、270、272、279、280、283、285、298、289、290、292、293、294、295、296、298、301、303、305、307、312、315、324、327、329、330、335、337、338、340、360、373、376、379、382、388、389、398、414、416、419、430、434、435、437、438或439,其中Fc区中的残基的编号为如专利公开案第WO 00/42072号中的EU索引的编号。
任选地,Fc区可包含本领域的技术人员已知的额外和/或替代位置处的非天然存在的氨基酸残基(参见例如美国专利第5,624,821号、第6,277,375号、第6,737,056号、第6,194,551号、第7,317,091号、第8,101,720号;PCX专利公开案WO 00/42072、WO 01/58957、WO02/06919、WO 04/016750、WO 04/029207、WO 04/035752、WO04/074455、WO 04/099249、WO04/063351、WO 05/070963、WO05/040217、WO 05/092925和WO 06/020114)。
Fc区对其配体的亲和力和结合特性可通过本领域中已知的多种体外测定方法(基于生物化学或免疫的测定)来测定,这些方法包括(但不限于)平衡方法(例如酶联免疫吸附测定(ELISA)或放射免疫测定(RIA))或动力学(例如BIACORE分析)和其他方法,诸如间接结合测定、竞争性抑制测定、荧光共振能量转移(FRET)、凝胶电泳和色谱(例如凝胶过滤)。这些和其他方法可利用所检验的组分中的一种或多种上的标记和/或采用多种检测方法,包括(但不限于)显色、荧光、发光或同位素标记。结合亲和力和动力学的详细描述可见于Paul,W.E.编,Fundamental immunology,第4版,Lippincott-Raven,Philadelphia(1999),其聚焦于抗体-免疫原相互作用。
在某些实施方案中,抗体被修饰以延长其生物半衰期。各种方法皆可行。例如,这可通过增加Fc区对FcRn的结合亲和力实现。例如,以下残基中的一种或多种可发生突变:252、254、256、433、435、436,如美国专利第6,277,375号中所描述。具体示例性取代包括以下中的一种或多种:T252L、T254S和/或T256F。或者,为了增加生物半衰期,抗体可在CH1或CL区内改变以含有获自IgG的Fc区的CH2结构域的两个环的救助受体结合抗原决定基,如Presta等人的美国专利第5,869,046号和第6,121,022号中所描述。增加与FcRn的结合和/或改善药物动力学特性的其他示例性变体包括位置259、308、428和434处的取代,包括例如2591、308F、428L、428M、434S、4341 1.434F、434Y和434X1。增加Fc与FcRn的结合的其他变体包括:250E、250Q、428L、428F、250Q/428L(Hinton等人,2004,J.Biol.Chem.279(8):6213-6216,Hinton等人2006Journal of Immunology 176:346-356)、256A、272A、286A、305A、307A、307Q、311A、312A、376A、378Q、380A、382A、434A(Shields等人,Journal ofBiological Chemistry,2001,276(9):6591-6604)、252F、252T、252Y、252W、254T、256S、256R、256Q、256E、256D、256T、309P、311S、433R、433S、4331、433P、433Q、434H、434F、434Y、252Y/254T/256E、433K/434F/436H、308T/309P/311S(Dall Acqua等人,Journal ofImmunology,2002,169:5171-5180,Dall'Acqua等人,2006,Journal of BiologicalChemistry281:23514-23524)。用于调节FcRn结合的其他修饰描述于Yeung等人,2010,JImmunol,182:7663-7671中。
在某些实施方案中,可使用具有特定生物学特征的杂交IgG同种型。例如,IgG1/IgG3杂交变体可通过用来自两种同种型不同的位置处的IgG3的氨基酸取代CH2和/或CH3区中的IgG1位置来构建。因此,可构建包含一个或多个取代,例如274Q、276K、300F、339T、356E、358M、384S、392N、397M、4221、435R和436F的杂交变异IgG抗体。在本文所描述的一些实施方案中,IgG1/IgG2杂交变体可通过用来自两种同种型不同的位置处的IgG1的氨基酸取代CH2和/或CH3区中的IgG2位置来构建。因此,可构建包含一个或多个取代,例如以下氨基酸取代中的一种或多种的杂交变异IgG抗体:233E、234L、235L、-236G(是指在位置236处插入甘氨酸)和327A。
此外,人类IgG1上的针对FcγRI、FcγRII、FcγRIII和FcRn的结合位点已经定位且具有改善的结合的变体已有描述(参见Shields,R.L.等人(2001),J.Biol.Chem.276:6591-6604)。显示位置256、290、298、333、334和339的特异性突变改善与FcγRIII的结合。另外,显示以下组合突变体改善FcγRIII结合:T256A/S298A、S298A/E333A、S298A/K224A和S298A/E333A/K334A,已显示其展现增强的FcγRIIIa结合和ADCC活性(Shields等人,2001)。已鉴别强烈增强与FcγRIIIa的结合的其他IgG1变体,包括具有S239D/I332E和S239D/I332E/A330L突变的变体,其显示对FcγRIIIa的亲和力的最大增加、FcγRIIb结合的减小和在食蟹猴中的强烈细胞毒性活性(Lazar等人,2006)。将三重突变引入诸如阿仑单抗(alemtuzumab)(CD52特异性)、曲妥珠单抗(trastuzumab)(HER2/neu特异性)、利妥昔单抗(rituximab)(CD20特异性)和西妥昔单抗(cetuximab)(EGFR特异性)的抗体中转化成体外大大增强的ADCC活性,且S239D/I332E变体显示在猴中耗乏B细胞的能力增强(Lazar等人,2006)。另外,已鉴别在B细胞恶性病和乳腺癌的模型中在表达人类FcγRIIIa的转基因小鼠中的含有L235V、F243L、R292P、Y300L和P396L突变的IgG1突变体,其展现与FcγRIIIa的增强结合和伴随的增强ADCC活性(Stavenhagen等人,2007;Nordstrom等人,2011)。可使用的其他Fc突变体包括:S298A/E333A/L334A、S239D/I332E、S239D/I332E/A330L、L235V/F243L/R292P/Y300L/P396L和M428L/N434S。
在某些实施方案中,选择与FcγRs的结合减少的Fc。具有减少的FcγR结合的示例性Fc(例如IgG1 Fc)包含以下三个氨基酸取代:L234A、L235E和G237A。
在某些实施方案中,选择补体结合减少的Fc。具有减少的补体结合的示例性Fc(例如IgG1 Fc)具有以下两个氨基酸取代:A330S和P331S。
在某些实施方案中,选择基本上不具有效应功能的Fc,即其与FcγR的结合减少且补体结合减少。无效应的示例性Fc(例如IgG1 Fc)包含以下五个突变:L234A、L235E、G237A、A330S和P331S。
当使用IgG4恒定结构域时,其可包括取代S228P,其模拟IgG1中的铰链序列且由此使IgG4分子稳定。
还可使用WO 2017/087678或WO2016081746中所描述的Fc修饰。
在某些实施方案中,修改抗体的糖基化。例如,可产生非糖基化抗体(即,缺乏糖基化的抗体)。可改变糖基化以例如增加抗体对抗原的亲和力。这类碳水化合物修饰可通过例如改变抗体序列内的一个或多个糖基化位点来实现。例如,可进行一个或多个氨基酸取代,从而排除一个或多个可变区框架糖基化位点,由此消除所述位点的糖基化。这类非糖基化可增加抗体对抗原的亲和力。这种方法还详细描述于Co等人的美国专利第5,714,350号和第6,350,861号中。
N297上恒定区的糖基化可通过使N297残基突变为例如N297A的另一残基,和/或通过使例如298的相邻氨基酸突变来阻止,由此降低N297上的糖基化。
另外地或替代地,可产生糖基化类型改变的抗体,诸如岩藻糖基残基量降低的低岩藻糖基化抗体或等分GlcNac结构增加的抗体。已证实这类改变的糖基化模式增加抗体的ADCC能力。这类碳水化合物修饰可通过例如在糖基化机制改变的宿主细胞中表达抗体来实现。糖基化机制改变的细胞已描述于本领域中,且可用作表达本文所描述的重组抗体以由此产生糖基化改变的抗体的宿主细胞。例如,Hanai等人的EP 1,176,195描述一种细胞系,其中编码岩藻糖基转移酶的FUT8基因在功能上被破坏,使得这种细胞系中所表达的抗体展现低岩藻糖基化。Presta的PCT公开案WO 03/035835描述一种变异CHO细胞系Led 3细胞,其使岩藻糖连接到Asn(297)所连接碳水化合物的能力降低,还导致所述宿主细胞中表达的抗体发生低岩藻糖基化(还参见Shields,R.L.等人,(2002)J.Biol.Chem.277:26733-26740)。Umana等人的PCT公开案WO 99/54342描述一种细胞系,其经工程改造以表达糖蛋白修饰的糖基转移酶{例如β(1,4)-N-乙酰葡萄糖氨基转移酶III(GnTIII)),使得在工程改造的细胞系中表达的抗体展现增加的等分GlcNac结构,引起抗体的ADCC活性增加(还参见Umana等人(1999)Nat.Biotech.17:176-180)。
本文所描述的抗体的另一修饰为聚乙二醇化。抗体可经聚乙二醇化以例如增加抗体的生物(例如血清)半衰期。为使抗体发生聚乙二醇化,通常使抗体或其片段与聚乙二醇(PEG)(诸如PEG的反应性酯或醛衍生物)在使一个或多个PEG基团连接到抗体或抗体片段的条件下反应。在一些实施方案中,聚乙二醇化经由与反应性PEG分子(或类似反应性水溶性聚合物)的酰化反应或烷基化反应进行。如本文所用,术语“聚乙二醇”意欲涵盖已用于衍生得到其他蛋白质的任一种PEG形式,诸如单(CI-CIO)烷氧基-或芳氧基-聚乙二醇或聚乙二醇-顺丁烯二酰亚胺。在某些实施方案中,待聚乙二醇化的抗体为去糖基化抗体。蛋白质聚乙二醇化的方法为本领域中已知的且可应用于本文所描述的抗体。参见例如Nishimura等人的EP 0 154 316和Ishikawa等人的EP 0 401 384。
本文中的具体示例性抗体实施方案进一步列举于以下部分中。
实施方案1:一种结合到人类ILT4(hILT4)的分离的抗体(“Ab”),其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:155、156和157的VH CDR1、CDR2和CDR3且轻链包含有分别包含SEQ ID NO:158、159和160的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:80的VH且轻链包含有包含SEQ ID NO:70的VL。
实施方案2:结合到人类ILT4的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:155、156和157的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:158、159和160的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQID NO:80的VH且轻链包含有包含SEQ ID NO:70的VL,其中所述抗体例如刺激T细胞活化(或加强T细胞反应),(i)在混合淋巴细胞反应(MLR)测定中,如例如通过增强的T细胞增殖或IFN-γ分泌或TNF-α产生所证明,或(ii)在T细胞:CHO-OKT3-ILT4测定中(例如如实施例5中所描述)。
实施方案3:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:155、156和157的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:158、159和160的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:80的VH且轻链包含有包含SEQ ID NO:70的VL,其中所述Ab在单核细胞:T细胞同种异体MLR中增强T细胞活化。
实施方案4:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:155、156和157的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:158、159和160的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:80的VH且轻链包含有包含SEQ ID NO:70的VL,其中所述Ab在巨细胞病毒(CMV)溶胞物测定中增强在抗原刺激后自PBMC的IFN-γ分泌。
实施方案5:一种结合到人类ILT4的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:155、156和157的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:158、159和160的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:80的VH且轻链包含有包含SEQ ID NO:70的VL,其中所述抗体加强自巨噬细胞,例如分化的巨噬细胞的TNF-α分泌。
实施方案6:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:155、156和157的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:158、159和160的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:80的VH且轻链包含有包含SEQ ID NO:70的VL,其中所述抗体增加CD83和/或CD86在单核细胞源性树突状细胞(MoDC)上的表达。
实施方案7:一种结合到人类ILT4的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:155、156和157的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:158、159和160的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:80的VH且轻链包含有包含SEQ ID NO:70的VL,其中所述抗体抑制hILT4与T细胞和/或结合伴侣(例如HLA-A和/或HLA-B)的结合。
实施方案8:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:155、156和157的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:158、159和160的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:80的VH且轻链包含有包含SEQ ID NO:70的VL,其中所述Ab(a)结合到hILT4的Ig样结构域1和/或hILT4的包含
实施方案9:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:155、156和157的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:158、159和160的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:80的VH且轻链包含有包含SEQ ID NO:70的VL,其中所述Ab抑制包含有包含SEQ ID NO:12或13的HC和包含SEQ ID NO:11的轻链的抗体(或与其竞争)与hILT4的结合和/或抑制包含21D9.IgG1.1f和/或21D9.e.IgG1.3的VH和VL的抗体与hILT4的结合。
实施方案10:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:155、156和157的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:158、159和160的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:80的VH且轻链包含有包含SEQ ID NO:70的VL,其中所述Ab以10
实施方案11:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:155、156和157的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:158、159和160的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:80的VH且轻链包含有包含SEQ ID NO:70的VL,其中所述Ab以10
实施方案12:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:155、156和157的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:158、159和160的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:80的VH且轻链包含有包含SEQ ID NO:70的VL,其中所述Ab不显著结合到人类蛋白质LILRA1、LILRA2、LILRA3、LILRA4、LILRA6、ILT2、ILT3、ILT5或LIR8。
实施方案13:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:155、156和157的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:158、159和160的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:80的VH且轻链包含有包含SEQ ID NO:70的VL,其中所述Ab促进巨噬细胞向M1巨噬细胞的促炎性极化。
实施方案14:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:155、156和157的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:158、159和160的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:80的VH且轻链包含有包含SEQ ID NO:70的VL,其中所述Ab不诱导(或触发)嗜碱性粒细胞活化。
实施方案15:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:155、156和157的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:158、159和160的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:80的VH且轻链包含有包含SEQ ID NO:70的VL,其中包含所述Ab的组合物在于25℃下孵育3个月之后包含少于5%的高分子量物质和低分子量物质,和/或在于40℃下孵育3个月之后包含少于10%的高分子量物质和低分子量物质。
实施方案16:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:155、156和157的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:158、159和160的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:80的VH且轻链包含有包含SEQ ID NO:70的VL,其中所述Ab包含IgG重链恒定区,例如IgG1(例如SEQ ID NO:98或102)、IgG1.1f(SEQ ID NO:103)、IgG1.3(SEQ IDNO:100)、IgGP238K(SEQ ID NO:104)、IgG4或IgG4.S228P(SEQ ID NO:179)。
实施方案17:一种结合到hILT4的分离的抗体,其中所述Ab包含有包含SEQ ID NO:13的重链和包含SEQ ID NO:11的轻链,其中任选地,所述重链包含C端赖氨酸。
实施方案18:一种结合到hILT4的分离的抗体,其中所述Ab包含:两个重链,每个重链包含SEQ ID NO:13;和两个轻链,每个轻链包含SEQ ID NO:11,其中任选地,所述重链中的一个或两个包含C端赖氨酸。
实施方案19:一种结合到hILT4的分离的抗体,其中所述Ab包含有包含SEQ ID NO:13的重链和包含SEQ ID NO:11的轻链,其中任选地,所述重链包含C端赖氨酸,并且其中所述Ab包含至少一个连接重链的二硫键。
实施方案20:一种结合到hILT4的分离的抗体,其中所述Ab包含有包含SEQ ID NO:176的重链和包含SEQ ID NO:11的轻链,其中任选地,所述重链包含C端赖氨酸。
实施方案21:一种结合到hILT4的分离的抗体,其中所述Ab包含有包含SEQ ID NO:177的重链和包含SEQ ID NO:11的轻链,其中任选地,所述重链包含C端赖氨酸。
实施方案22:一种结合到hILT4的分离的抗体,其中所述Ab包含有包含SEQ ID NO:178的重链和包含SEQ ID NO:11的轻链,其中任选地,所述重链包含C端赖氨酸。
实施方案23:一种编码如实施方案1-22中任一项所述的抗体的分离的核酸或核酸集合。
实施方案24:一种用于产生实施方案1-22所述的抗体中的任一种的宿主细胞,例如其包含如实施方案23所述的分离的核酸或核酸集合。
实施方案25:一种治疗受试者的癌症的方法,其包括向所述受试者施用治疗有效剂量的如实施方案1-22中任一项所述的抗体或结合到人类ILT4(hILT4)的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:155、156和157的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:158、159和160的VL CDR1、CDR2和CDR3;(ii)重链包含有包含SEQ ID NO:80的VH且轻链包含有包含SEQ ID NO:70的VL;和/或(iii)重链包含SEQ ID NO:13且轻链包含SEQ ID NO:11。
实施方案26:一种治疗受试者的癌症的方法,其包括向所述受试者施用治疗有效剂量的:
(A)(1)如实施方案1-19中任一项所述的抗体或(2)结合到人类ILT4(hILT4)的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:155、156和157的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:158、159和160的VL CDR1、CDR2和CDR3;(ii)重链包含有包含SEQ ID NO:80的VH且轻链包含有包含SEQ ID NO:70的VL;和/或(iii)重链包含SEQ ID NO:13且轻链包含SEQ ID NO:11,和
(B)PD-1或PD-L1的拮抗剂,诸如结合到人类PD-1或人类PD-L1的拮抗剂抗体,例如纳武单抗、派姆单抗(pembrolizumab)、赛咪单抗(cemiplimab)、特瑞普利单抗(toripalimab)、信迪利单抗(sintilimab)、阿特珠单抗(atezolizumab)、德瓦鲁单抗(durvalumab)或阿维鲁单抗。
实施方案27:一种组合物,其包含:
(A)(1)如实施方案1-19中任一项所述的抗体或(2)结合到人类ILT4(hILT4)的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:155、156和157的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:158、159和160的VL CDR1、CDR2和CDR3;(ii)重链包含有包含SEQ ID NO:80的VH且轻链包含有包含SEQ ID NO:70的VL;和/或(iii)重链包含SEQ ID NO:13且轻链包含SEQ ID NO:11,和
(B)PD-1或PD-L1的拮抗剂,诸如结合到人类PD-1或人类PD-L1的拮抗剂抗体,例如纳武单抗、派姆单抗、赛咪单抗、特瑞普利单抗、信迪利单抗、阿特珠单抗、德瓦鲁单抗或阿维鲁单抗。
实施方案1:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:161、162和163的VH CDR1、CDR2和CDR3且轻链包含有分别包含SEQ ID NO:164、165和166的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:87的VH且轻链包含有包含SEQ ID NO:86的VL。
实施方案2:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:161、162和163的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:164、165和166的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:87的VH且轻链包含有包含SEQ ID NO:86的VL,其中所述抗体刺激T细胞活化(或加强T细胞反应),例如(i)在混合淋巴细胞反应(MLR)测定中,如例如通过增强的T细胞增殖或IFN-γ分泌或TNF-α产生所证明,或(ii)在T细胞:CHO-OKT3-ILT4测定中(例如如实施例5中所描述)。
实施方案3:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:161、162和163的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:164、165和166的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:87的VH且轻链包含有包含SEQ ID NO:86的VL,其中所述Ab在单核细胞:T细胞同种异体MLR中增强T细胞活化。
实施方案4:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:161、162和163的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:164、165和166的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:87的VH且轻链包含有包含SEQ ID NO:86的VL,其中所述Ab在CMV溶胞物测定中增强在抗原刺激后自PBMC的IFN-γ分泌。
实施方案5:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:161、162和163的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:164、165和166的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:87的VH且轻链包含有包含SEQ ID NO:86的VL,其中所述抗体加强自巨噬细胞,例如分化的巨噬细胞的TNF-α分泌。
实施方案6:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:161、162和163的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:164、165和166的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:87的VH且轻链包含有包含SEQ ID NO:86的VL,其中所述抗体增加CD83和/或CD86在单核细胞源性树突状细胞(Mo-DC)上的表达。
实施方案7:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:161、162和163的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:164、165和166的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:87的VH且轻链包含有包含SEQ ID NO:86的VL,其中所述抗体抑制hILT4与T细胞和/或结合伴侣(例如HLA-A和/或HLA-B)的结合。
实施方案8:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:161、162和163的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:164、165和166的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:87的VH且轻链包含有包含SEQ ID NO:86的VL,其中所述Ab(a)结合到hILT4的Ig样结构域2和/或hILT4的包含:
实施方案9:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:161、162和163的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:164、165和166的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:87的VH且轻链包含有包含SEQ ID NO:86的VL,其中所述Ab抑制包含有分别包含SEQ ID NO:15或17的HC和包含SEQ ID NO:14或16的轻链的抗体(或与其竞争)与hILT4的结合和/或抑制包含21D5或21D5.a的VH和VL的抗体与hILT4的结合。
实施方案10:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:161、162和163的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:164、165和166的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:87的VH且轻链包含有包含SEQ ID NO:86的VL,其中所述Ab以10
实施方案11:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:161、162和163的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:164、165和166的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:87的VH且轻链包含有包含SEQ ID NO:86的VL,其中所述Ab以10
实施方案12:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:161、162和163的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:164、165和166的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:87的VH且轻链包含有包含SEQ ID NO:86的VL,其中所述Ab不显著结合到人类蛋白质LILRA1、LILRA2、LILRA4、LILRA5、LILRA6、ILT2、ILT3、ILT5或LIR8。
实施方案13:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:161、162和163的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:164、165和166的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:87的VH且轻链包含有包含SEQ ID NO:86的VL,其中所述Ab促进巨噬细胞向M1巨噬细胞的促炎性极化。
实施方案14:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:161、162和163的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:164、165和166的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:87的VH且轻链包含有包含SEQ ID NO:86的VL,其中所述Ab不诱导(或触发)嗜碱性粒细胞活化。
实施方案15:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:161、162和163的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:164、165和166的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:87的VH且轻链包含有包含SEQ ID NO:86的VL,其中包含所述Ab的组合物在于25℃下孵育3个月之后包含少于5%的高分子量物质和低分子量物质,和/或在于40℃下孵育3个月之后包含少于10%的高分子量物质和低分子量物质。
实施方案16:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:161、162和163的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:164、165和166的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:87的VH且轻链包含有包含SEQ ID NO:86的VL,其中所述Ab包含IgG重链恒定区,例如IgG1(例如SEQ ID NO:98或102)、IgG1.1f(SEQ ID NO:103)、IgG1.3(SEQ IDNO:100)、IgGP238K(SEQ ID NO:104)、IgG4或IgG4.S228P(SEQ ID NO:179)。
实施方案17:一种结合到hILT4的分离的抗体,其中所述Ab包含有包含SEQ ID NO:17的重链和包含SEQ ID NO:16的轻链,其中任选地,所述重链包含C端赖氨酸。
实施方案18:一种结合到hILT4的分离的抗体,其中所述Ab包含:两个重链,每个重链包含SEQ ID NO:17;和两个轻链,每个轻链包含SEQ ID NO:16,其中任选地,所述重链中的一个或两个包含C端赖氨酸。
实施方案19:一种结合到hILT4的分离的抗体,其中所述Ab包含有包含SEQ ID NO:17的重链和包含SEQ ID NO:16的轻链,其中任选地,所述重链包含C端赖氨酸,并且其中所述Ab包含至少一个连接重链的二硫键。
实施方案20:一种结合到hILT4的分离的抗体,其中所述Ab包含有包含SEQ ID NO:15的重链和包含SEQ ID NO:14的轻链,其中任选地,所述重链包含C端赖氨酸。
实施方案21:一种结合到hILT4的分离的抗体,其中所述Ab包含有包含SEQ ID NO:17的重链和包含SEQ ID NO:16的轻链,其中任选地,所述重链包含C端赖氨酸。
实施方案22:一种结合到hILT4的分离的抗体,其中所述Ab包含有包含SEQ ID NO:15或17的重链和包含SEQ ID NO:14或16的轻链,其中任选地,所述重链包含C端赖氨酸。
实施方案23:一种编码如实施方案1-22中任一项所述的抗体的分离的核酸或核酸集合。
实施方案24:一种用于产生实施方案1-22所述的抗体中的任一种的宿主细胞,例如其包含如实施方案23所述的分离的核酸或核酸集合。
实施方案25:一种治疗受试者的癌症的方法,其包括向所述受试者施用治疗有效剂量的结合到人类ILT4(hILT4)的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:161、162和163的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQID NO:164、165和166的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:87的VH且轻链包含有包含SEQ ID NO:86的VL,和/或(iii)重链包含SEQ ID NO:17且轻链包含SEQ ID NO:16。
实施方案26:一种治疗受试者的癌症的方法,其包括向所述受试者施用治疗有效剂量的:(A)结合到人类ILT4(hILT4)的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:161、162和163的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:164、165和166的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:87的VH且轻链包含有包含SEQ ID NO:86的VL,和/或(iii)重链包含SEQ ID NO:17且轻链包含SEQ ID NO:16,和(B)PD-1或PD-L1的拮抗剂,诸如结合到人类PD-1或人类PD-L1的拮抗剂抗体,例如纳武单抗、派姆单抗、赛咪单抗、特瑞普利单抗、信迪利单抗、阿特珠单抗、德瓦鲁单抗或阿维鲁单抗。
实施方案27:一种组合物,其包含(A)结合到人类ILT4(hILT4)的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:161、162和163的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:164、165和166的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:87的VH且轻链包含有包含SEQ ID NO:86的VL,和/或(iii)重链包含SEQ ID NO:17且轻链包含SEQ ID NO:16,和(B)PD-1或PD-L1的拮抗剂,诸如结合到人类PD-1或人类PD-L1的拮抗剂抗体,例如纳武单抗、派姆单抗、赛咪单抗、特瑞普利单抗、信迪利单抗、阿特珠单抗、德瓦鲁单抗或阿维鲁单抗。
实施方案1:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:167、168和169的VH CDR1、CDR2和CDR3且轻链包含有分别包含SEQ ID NO:170、171和172的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:91的VH且轻链包含有包含SEQ ID NO:90、94、96或114的VL。
实施方案2:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:167、168和169的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:170、171和172的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:91的VH且轻链包含有包含SEQ ID NO:90、94、96或114的VL,其中所述抗体刺激T细胞活化(或加强T细胞反应),例如(i)在混合淋巴细胞反应(MLR)测定中,如例如通过增强的T细胞增殖或IFN-γ分泌或TNF-α产生所证明,或(ii)在T细胞:CHO-OKT3-ILT4测定中(例如如实施例5中所描述)。
实施方案3:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:167、168和169的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:170、171和172的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:91的VH且轻链包含有包含SEQ ID NO:90、94、96或114的VL,其中所述Ab在单核细胞:T细胞同种异体MLR中增强T细胞活化。
实施方案4:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:167、168和169的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:170、171和172的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:91的VH且轻链包含有包含SEQ ID NO:90、94、96或114的VL,其中所述Ab在CMV溶胞物测定中增强在抗原刺激后自PBMC的IFN-γ分泌。
实施方案5:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:167、168和169的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:170、171和172的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:91的VH且轻链包含有包含SEQ ID NO:90、94、96或114的VL,其中所述Ab抑制hILT4与T细胞和/或与结合伴侣(例如HLA-A和/或HLA-B)的结合。
实施方案6:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:167、168和169的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:170、171和172的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:91的VH且轻链包含有包含SEQ ID NO:90、94、96或114的VL,其中所述抗体加强自巨噬细胞,例如分化的巨噬细胞的TNF-α分泌。
实施方案7:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:167、168和169的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:170、171和172的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:91的VH且轻链包含有包含SEQ ID NO:90、94、96或114的VL,其中所述抗体增加CD83和/或CD86在单核细胞源性树突状细胞(MoDC)上的表达。
实施方案8:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:167、168和169的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:170、171和172的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:91的VH且轻链包含有包含SEQ ID NO:90、94、96或114的VL,其中所述Ab(i)结合到hILT4的靠近Ig样结构域1的Ig样结构域2,和/或(ii)与成熟hILT4的一个或多个(或所有)氨基酸残基Glu42、Lys43、Gly76、Cys77、Leu88、Pro91、Pro183和Tyr184相互作用,如通过卡宾足迹法测定。
实施方案9:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:167、168和169的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:170、171和172的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:91的VH且轻链包含有包含SEQ ID NO:90、94、96或114的VL,其中所述Ab结合包含有包含SEQ ID NO:19的HC和分别包含SEQ ID NO:18、20、21或116的轻链的抗体(或与其竞争)与hILT4的结合和/或抑制包含10F10、10F10.1、10F10.3和/或10F10.4的VH和VL的抗体与hILT4的结合。
实施方案10:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:167、168和169的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:170、171和172的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:91的VH且轻链包含有包含SEQ ID NO:90、94、96或114的VL,其中所述Ab以10
实施方案11:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:167、168和169的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:170、171和172的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:91的VH且轻链包含有包含SEQ ID NO:90、94、96或114的VL,其中所述Ab以10
实施方案12:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:167、168和169的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:170、171和172的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:91的VH且轻链包含有包含SEQ ID NO:90、94、96或114的VL,其中所述Ab促进巨噬细胞向M1巨噬细胞的促炎性极化。
实施方案13:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:167、168和169的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:170、171和172的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:91的VH且轻链包含有包含SEQ ID NO:90、94、96或114的VL,其中所述Ab不诱导(或触发)嗜碱性粒细胞活化。
实施方案14:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:167、168和169的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:170、171和172的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:91的VH且轻链包含有包含SEQ ID NO:90、94、96或114的VL,其中包含所述Ab的组合物在于25℃下孵育3个月之后包含少于5%的高分子量物质和低分子量物质,和/或在于40℃下孵育3个月之后包含少于10%的高分子量物质和低分子量物质。。
实施方案15:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:167、168和169的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:170、171和172的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:91的VH且轻链包含有包含SEQ ID NO:90、94、96或114的VL,其中所述Ab不显著结合到人类蛋白质LILRA1、LILRA2、LILRA3、LILRA4、LILRA5、LILRA6、ILT2、ILT3、ILT5或LIR8。
实施方案16:一种结合到人类ILT4(hILT4)的分离的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:167、168和169的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:170、171和172的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:91的VH且轻链包含有包含SEQ ID NO:90、94、96或114的VL,其中所述包含IgG重链恒定区,例如IgG1(例如SEQ ID NO:98或102)、IgG1.1f(SEQ ID NO:103)、IgG1.3(SEQ ID NO:100)、IgGP238K(SEQ ID NO:104)、IgG4或IgG4.S228P(SEQ ID NO:179)。
实施方案17:一种结合到hILT4的分离的抗体,其中所述Ab包含有包含SEQ ID NO:19的重链和包含SEQ ID NO:18、20、21或116的轻链,其中任选地,所述重链包含C端赖氨酸。
实施方案18:一种结合到hILT4的分离的抗体,其中所述Ab包含包含SEQ ID NO:19的重链和包含SEQ ID NO:18、20、21或116的轻链,其中任选地,所述重链中的一个或两个包含C端赖氨酸。
实施方案19:一种结合到hILT4的分离的抗体,其中所述Ab包含有包含SEQ ID NO:19的重链和包含SEQ ID NO:18、20、21或116的轻链,其中任选地,所述重链包含C端赖氨酸,并且其中所述Ab包含至少一个连接重链的二硫键。
实施方案20:一种结合到hILT4的分离的抗体,其中所述Ab包含有包含SEQ ID NO:19的重链和包含SEQ ID NO:18的轻链,其中任选地,所述重链包含C端赖氨酸。
实施方案21:一种结合到hILT4的分离的抗体,其中所述Ab包含有包含SEQ ID NO:19的重链和包含SEQ ID NO:20的轻链,其中任选地,所述重链包含C端赖氨酸。
实施方案22:一种结合到hILT4的分离的抗体,其中所述Ab包含有包含SEQ ID NO:19的重链和包含SEQ ID NO:21的轻链,其中任选地,所述重链包含C端赖氨酸。
实施方案23:一种结合到hILT4的分离的抗体,其中所述Ab包含有包含SEQ ID NO:19的重链和包含SEQ ID NO:116的轻链,其中任选地,所述重链包含C端赖氨酸。
实施方案24:一种编码如实施方案1-23中任一项所述的抗体的分离的核酸或核酸集合。
实施方案25:一种用于产生如实施方案1-23所述的抗体中的任一种的宿主细胞,例如其包含如实施方案24所述的分离的核酸或核酸集合。
实施方案26:一种治疗受试者的癌症的方法,其包括向所述受试者施用治疗有效剂量的结合到人类ILT4(hILT4)的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:167、168和169的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQID NO:170、171和172的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:91的VH且轻链包含有包含SEQ ID NO:90、94、96或114的VL,和/或(iii)重链包含SEQ ID NO:19且轻链包含SEQ ID NO:18、20、21或116。
实施方案27:一种治疗受试者的癌症的方法,其包括向所述受试者施用治疗有效剂量的结合到人类ILT4(hILT4)的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:167、168和169的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQID NO:170、171和172的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:91的VH且轻链包含有包含SEQ ID NO:90、94、96或114的VL,和/或(iii)重链包含SEQ ID NO:19且轻链包含SEQ ID NO:18、20、21或116,和(B)PD-1或PD-L1的拮抗剂,诸如结合到人类PD-1或人类PD-L1的拮抗剂抗体,例如纳武单抗、派姆单抗、赛咪单抗、特瑞普利单抗、信迪利单抗、阿特珠单抗、德瓦鲁单抗或阿维鲁单抗。
实施方案28:一种组合物,其包含(A)结合到人类ILT4(hILT4)的抗体,其中所述Ab包含重链和轻链,其中(i)重链包含有分别包含SEQ ID NO:167、168和169的VH CDR1、CDR2和CDR3,并且轻链包含有分别包含SEQ ID NO:170、171和172的VL CDR1、CDR2和CDR3,和/或(ii)重链包含有包含SEQ ID NO:91的VH且轻链包含有包含SEQ ID NO:90、94、96或114的VL,和/或(iii)重链包含SEQ ID NO:19且轻链包含SEQ ID NO:18、20、21或116,和(B)PD-1或PD-L1的拮抗剂,诸如结合到人类PD-1或人类PD-L1的拮抗剂抗体,例如纳武单抗、派姆单抗、赛咪单抗、特瑞普利单抗、信迪利单抗、阿特珠单抗、德瓦鲁单抗或阿维鲁单抗。
核酸和宿主细胞
还提供编码抗体或其重链或轻链或其部分的核酸。示例性核酸提供于序列表中。本文中涵盖与序列表中的核酸具有至少80%、85%、90%、95%、97%、98%或99%同一性的任何核酸。还涵盖包含编码本文所提供的抗体的核酸的组合物,还涵盖包含这些组合物的细胞以及用于制备抗体的方法,这些方法包括培养用编码ILT4抗体的核酸转化的细胞和自培养基或细胞分离抗体。
使用ILT4结合Ab的治疗方法和相关药物组合物
本文所描述的抗体可用于例如治疗癌症。在一些实施方案中,提供治疗癌症的方法,其包括向患者施用有效量的本文所描述的抗体。在一些实施方案中,Ab可触发或增强患者的免疫反应,诸如抗原特异性免疫反应。在一些实施方案中,Ab可刺激T细胞活性。在一些实施方案中,Ab可抑制患者的至少一种肿瘤的生长。
本文提供治疗患有癌症的受试者的方法,其包括向受试者施用治疗有效量的本文所描述的ILT4抗体,从而治疗受试者。ILT4抗体可单独使用。或者,ILT4抗体可结合如下文进一步描述的另一剂使用。
癌症可为具有实体肿瘤或血液恶性病(液体肿瘤)的癌症。
治疗的癌症的非限制性实例包括鳞状细胞癌(squamous cell carcinoma)、小细胞肺癌(small-cell lung cancer)、非小细胞肺癌(non-small cell lung cancer)、鳞状非小细胞肺癌(NSCLC)、非鳞状NSCLC、神经胶质瘤、胃肠癌、肾癌(例如透明细胞癌)、卵巢癌、肝癌、结直肠癌、子宫内膜癌、肾癌(例如肾细胞癌(renal cell carcinoma;RCC))、前列腺癌(例如激素难治性前列腺癌(hormone refractory prostate adenocarcinoma))、甲状腺癌、神经母细胞瘤、胰腺癌、胶质母细胞瘤(多形性胶质母细胞瘤)、宫颈癌、胃癌(stomachcancer)、膀胱癌、肝肿瘤、乳腺癌、结肠癌和头颈癌(或癌瘤);胃癌(gastric cancer)、生殖细胞肿瘤、儿科肉瘤(pediatric sarcoma)、鼻窦自然杀手(sinonasal natural killer)、黑色素瘤(例如转移性恶性黑色素瘤,诸如皮肤或眼内恶性黑色素瘤)、骨癌、皮肤癌、子宫癌、肛门区癌(cancer of the anal region)、睾丸癌、输卵管癌、子宫内膜癌、宫颈癌瘤、阴道癌瘤、外阴癌瘤、食道癌、小肠癌、内分泌系统癌、甲状旁腺癌、肾上腺癌、软组织肉瘤、尿道癌、阴茎癌、儿童实体肿瘤、输尿管癌、肾盂癌瘤、中枢神经系统(CNS)赘瘤、原发性CNS淋巴瘤、肿瘤血管生成(tumor angiogenesis)、脊椎肿瘤(spinal axis tumor)、脑癌、脑干神经胶质瘤、垂体腺瘤、卡波西氏肉瘤(Kaposi's sarcoma)、表皮样癌(epidermoid cancer)、鳞状细胞癌、T细胞淋巴瘤、环境诱发的癌症(包括由石棉诱发的那些癌症)、病毒相关癌症或病毒性来源的癌症(例如人类乳头状瘤病毒(HPV-相关或HPV引起的肿瘤))和来源于两个主要血细胞谱系(即,骨髓细胞系(其产生粒细胞、红细胞、血小板、巨噬细胞和肥大细胞)或淋巴细胞系(其产生B、T、NK和浆细胞))中的任一种的血液科恶性病,诸如所有类型的白血病、淋巴瘤和骨髓瘤,例如急性、慢性、淋巴细胞性和/或骨髓性白血病,诸如急性白血病(ALL)、急性骨髓性白血病(AML)、慢性淋巴细胞性白血病(CLL)和慢性骨髓性白血病(CML)、未分化AML(MO)、髓系白血病(myeloblastic leukemia)(M1)、髓系白血病(M2;细胞成熟)、前髓细胞性白血病(promyelocytic leukemia)(M3或M3变体[M3V])、骨髓单核细胞性白血病(myelomonocytic leukemia)(具有嗜酸性粒细胞增多症(eosinophilia)的M4或M4变体[M4E])、单核细胞性白血病(M5)、红白血病(erythroleukemia)(M6)、巨核母细胞白血病(megakaryoblastic leukemia)(M7)、分离的粒细胞肉瘤和绿色瘤(chloroma);淋巴瘤,诸如霍奇金氏淋巴瘤(Hodgkin's lymphoma;HL)、非霍奇金氏淋巴瘤(non-Hodgkin'slymphoma;NHL)、B细胞恶性血液病(例如B细胞淋巴瘤)、T细胞淋巴瘤、淋巴浆细胞样淋巴瘤(lymphoplasmacytoid lymphoma)、单核细胞样B细胞淋巴瘤、粘膜相关淋巴组织(MALT)淋巴瘤、间变性(例如Ki 1+)大细胞淋巴瘤(anaplastic large-cell lymphoma)、成人T细胞淋巴瘤/白血病(adult T-cell lymphoma)、套细胞淋巴瘤(mantle cell lymphoma)、血管免疫母细胞性T细胞淋巴瘤(angio immunoblastic T-cell lymphoma)、血管中心性淋巴瘤(angiocentric lymphoma)、肠道T细胞淋巴瘤、原发性纵隔B细胞淋巴瘤(primarymediastinal B-cell lymphoma)、前体T淋巴母细胞淋巴瘤(precursor T-lymphoblasticlymphoma)、T淋巴母细胞淋巴瘤/白血病(T-Lbly/T-ALL)、外周T细胞淋巴瘤(peripheralT-cell lymphoma)、淋巴母细胞淋巴瘤、移植后淋巴增生病(post-transplantationlymphoproliferative disorder)、真性组织细胞淋巴瘤(true histiocytic lymphoma)、原发性中枢神经系统淋巴瘤(primary central nervous system lymphoma)、原发性渗出性淋巴瘤(primary effusion lymphoma)、B细胞淋巴瘤、淋巴母细胞淋巴瘤(LBL)、淋巴谱系的造血性肿瘤、急性淋巴母细胞白血病、弥漫性大型B细胞淋巴瘤、伯基特氏淋巴瘤(Burkitt's lymphoma)、滤泡性淋巴瘤(follicular lymphoma)、弥漫性组织细胞淋巴瘤(diffuse histiocytic lymphoma;DHL)、免疫母细胞大细胞淋巴瘤(immunoblastic largecell lymphoma)、前体B淋巴母细胞淋巴瘤(precursor B-lymphoblastic lymphoma)、皮肤T细胞淋巴瘤(cutaneous T-cell lymphoma;CTLC)(也被称作蕈样霉菌病(mycosisfungoides)或塞扎里综合征(Sezary syndrome))和具有沃尔丹斯特伦巨球蛋白血症(Waldenstrom's macroglobulinemia)的淋巴浆细胞样淋巴瘤(LPL);骨髓瘤,诸如IgG骨髓瘤、轻链骨髓瘤(light chain myeloma)、非分泌性骨髓瘤(nonsecretory myeloma)、冒烟型骨髓瘤(smoldering myeloma)(也被称作惰性骨髓瘤)、孤立性浆细胞瘤(solitaryplasmocytoma)和多发性骨髓瘤、慢性淋巴细胞性白血病(CLL)、毛细胞淋巴瘤(hairy celllymphoma);骨髓谱系的造血性肿瘤、间叶细胞来源的肿瘤,包括纤维肉瘤(fibrosarcoma)和横纹肌肉瘤(rhabdomyoscarcoma);精原细胞瘤(seminoma)、畸胎上皮癌(teratocarcinoma)、中心和外周神经肿瘤(包括星形细胞瘤(astrocytoma)、神经鞘瘤(schwannomas));间叶细胞来源的肿瘤,包括纤维肉瘤、横纹肌肉瘤和骨肉瘤;和其他肿瘤,包括黑色素瘤、着色性干皮病(xeroderma pigmentosum)、角化棘皮瘤(keratoacanthoma)、精原细胞瘤、甲状腺滤泡癌和畸胎上皮癌;淋巴谱系的造血性肿瘤,例如T细胞和B细胞肿瘤,包括(但不限于)诸如T前淋巴细胞性白血病(T-PLL)的T细胞病症,包括小细胞和脑细胞类型;T细胞类大颗粒淋巴细胞性白血病(large granular lymphocyte leukemia;LGL);a/d T-NHL肝脾淋巴瘤(a/d T-NHL hepatosplenic lymphoma);胸腺外周/后T细胞淋巴瘤(peripheral/post-thymic T cell lymphoma)(多形性和免疫母细胞亚型);血管中心性(鼻部)T细胞淋巴瘤;头颈癌、肾癌、直肠癌、甲状腺癌;急性骨髓淋巴瘤;以及这些癌症的任何组合。本文所描述的方法还可用于治疗转移性癌症、不可切除的难治性癌症(例如难以用先前免疫疗法,例如用阻断CTLA-4或PD-1抗体治疗的癌症)和/或复发性癌症。
在某些实施方案中,向患有展现对先前治疗的不充分反应或有进展的癌症的患者施用本文所描述的抗体,所述先前治疗例如使用免疫肿瘤学或免疫疗法药物的先前治疗。在一些实施方案中,癌症具有难治性或对先前治疗有抵抗性,固有难治性或抵抗性(例如难以用PD-1路径拮抗剂治疗),或获得抗性或难治性状态。例如,可向对第一疗法无反应或反应不充分或在例如单独的或与另一疗法(例如与抗PD-1路径拮抗剂疗法)组合的抗PD-1路径拮抗剂治疗的治疗后具有疾病进展的受试者施用本文所描述的抗体。在其他实施方案中,向先前未接受肿瘤免疫剂(例如PD-1路径拮抗剂)(即,用其治疗)的患者施用本文所描述的抗体。
与免疫刺激剂的组合
在一些实施方案中,如本文所描述的抗体(例如本文所描述的ILT4抗体)与至少一种免疫刺激剂组合施用。例如,治疗剂可一起输注或在大致相同的时间注射。在一些实施方案中,依序施用抗体和至少一种免疫刺激剂。例如,在一些实施方案中,在至少一种免疫刺激剂之前或之后依序施用抗体,使得两种治疗剂相隔30分钟、60分钟、90分钟、120分钟、3小时、6小时、12小时、24小时、36小时、48小时、3天、5天、7天或两周施用。
在一些实施方案中,在施用至少一种免疫刺激剂之前,施用至少一次剂量、至少两次剂量、至少三次剂量、至少五次剂量或至少十次剂量的抗体。在一些实施方案中,在施用抗体之前,施用至少一次剂量、至少两次剂量、至少三次剂量、至少五次剂量或至少十次剂量的至少一种免疫刺激剂。在一些实施方案中,在施用第一剂量的抗体之前,最后一次剂量的免疫刺激剂施用至少一天、二天、三天、五天或十天,或一周、二周、三周、五周、十二周或二十四周。在一些实施方案中,在施用第一剂量的至少一种免疫刺激剂之前,最后一次剂量的抗体施用至少一天、二天、三天、五天或十天、或一周、二周、三周、五周、十二周或二十四周。在一些实施方案中,受试者已接受或正接受使用至少一种免疫刺激剂的疗法,并且将ILT4抗体添加至治疗方案。
在一些实施方案中,至少一种免疫刺激剂包含诸如T细胞的免疫细胞的活化抑制剂的拮抗剂,而在一些实施方案中,至少一种免疫刺激剂包含诸如T细胞的免疫细胞的活化刺激剂的激动剂。在一些实施方案中,至少一种免疫刺激剂包含CTLA4、LAG-3、PD-1、PD-L1、半乳糖凝集素1、半乳糖凝集素9、CEACAM-1、BTLA、CD25、CD69、TIGIT、CD113、GPR56、VISTA、B7-H3、B7-H4、2B4、CD48、GARP、PD1H、LAIR1、TIM1、TIM3、TIM4、IL-6、IL-10、TGFβ、VEGF、KIR、腺苷A2A受体、PI3Kδ或IDO的拮抗剂。在一些实施方案中,至少一种免疫刺激剂包含B7-1、B7-2、CD28、4-1BB(CD137)、4-1BBL、ICOS、ICOS-L、OX40、OX40L、GITR、GITRL、CD27、CD40、CD40L、DR3、CD28H、IL-2、IL-7、IL-12、IL-15、IL-21、IFNα、STING的激动剂,或Toll样受体激动剂,诸如TLR2/4激动剂。在一些实施方案中,至少一种免疫刺激剂包含结合到膜结合蛋白B7家族的另一成员(诸如B7-1、B7-2、B7-H2(ICOS-L)、B7-H3、B7-H4和B7-H6)的剂。在一些实施方案中,至少一种免疫刺激剂包含结合到TNF受体家族成员的剂或结合到TNF受体家族成员的共刺激或共抑制分子,所述TNF受体家族成员是诸如CD40、CD40L、OX40、OX40L、GITR、GITRL、CD70、CD27L、CD30、CD30L、4-1BBL、CD137(4-1BB)、TRAIL/Apo2-L、TRAILR1/DR4、TRAILR2/DR5、TRAILR3、TRAILR4、OPG、RANK、RANKL、TWEAKR/Fn14、TWEAK、BAFFR、EDAR、XEDAR、EDA1、EDA2、TACI、APRIL、BCMA、LTβR、LIGHT、DeR3、HVEM、VEGL/TL1A、TRAMP/DR3、TNFR1、TNFβ、TNFR2、TNFα、1β2、FAS、FASL、RELT、DR6、TROY或NGFβ。在一些实施方案中,至少一种免疫刺激剂包含拮抗或抑制对T细胞活化进行抑制的细胞因子(诸如IL-6、IL-10、TGFβ、VEGF)的剂。在一些实施方案中,至少一种免疫刺激剂包含刺激T细胞活化的细胞因子(诸如IL-2、IL-7、IL-12、IL-15、IL-21和IFNα)的激动剂。在一些实施方案中,至少一种免疫刺激剂包含趋化因子(诸如CXCR2、CXCR4、CCR2或CCR4)的拮抗剂。在一些实施方案中,至少一种免疫刺激剂包含抗体。在一些实施方案中,至少一种免疫刺激剂可包含疫苗,诸如间皮素靶向疫苗或减毒的李斯特菌(listeria)癌症疫苗,诸如CRS-207。
例如,本文所描述的ILT4抗体可与以下剂中的一种或多种一起施用:
(1)抑制T细胞活化的蛋白质的拮抗剂(抑制剂或阻断剂)(例如免疫检查点抑制剂),诸如CTLA-4、PD-1、PD-L1、PD-L2和LAG-3、半乳糖凝集素9、CEACAM-1、BTLA、CD69、半乳糖凝集素-1、TIGIT、CD113、GPR56、B7-H3、B7-H4、2B4、CD48、GARP、PD1H、LAIR1、TIM-1、TIM-3和TIM-4;和/或(2)刺激T细胞活化的蛋白质的激动剂,诸如B7-1、B7-2、CD28、4-1BB(CD137)、4-1BBL、GITR、ICOS、ICOS-L、OX40、OX40L、CD70、CD27、CD40、DR3和CD28H。
可与本文所描述的ILT4抗体组合用于治疗癌症的示例性剂包括:
可与ILT4抗体组合用于治疗癌症的其他分子包括NK细胞上的抑制受体的拮抗剂,或NK细胞上的活化受体的激动剂,例如KIR的拮抗剂(例如利瑞路单抗(lirilumab))。
T细胞活化还可通过可溶性细胞因子调节。在一些实施方案中,ILT4抗体可与用于抑制T细胞活化的细胞因子的拮抗剂或刺激T细胞活化的细胞因子的激动剂组合施用。例如,ILT4抗体可与以下组合使用:(i)抑制T细胞活化的IgSF家族或B7家族或TNF家族的蛋白质的拮抗剂(或抑制剂或阻断剂),或抑制T细胞活化的细胞因子(例如IL-6、IL-10、TGF-β、VEGF;“免疫抑制细胞因子”)的拮抗剂和/或(ii)IgSF家族、B7家族或TNF家族的刺激受体或刺激T细胞活化的细胞因子的激动剂。
用于组合疗法的其他剂包括抑制或耗乏巨噬细胞或单核细胞的剂,包括(但不限于):CSF-1R拮抗剂,诸如CSF-1R拮抗剂抗体,包括RG7155(WO11/70024、WO11/107553、WO11/131407、W013/87699、W013/119716、WO13/132044)或FPA-008(WO11/140249、W013169264、WO14/036357)。
ILT4抗体还可与抑制TGF-β信号传导的剂一起施用。
可与ILT4抗体组合的额外剂包括增强肿瘤抗原呈递的剂,例如树突状细胞疫苗、GM-CSF分泌细胞疫苗、CpG寡核苷酸和咪喹莫特(imiquimod),或增强肿瘤细胞的免疫原性的疗法(例如蒽环霉素)。
可与ILT4抗体组合的其他疗法包括耗乏或阻断Treg细胞的疗法,例如特异性结合到CD25的剂。
可与ILT4抗体组合的另一疗法为抑制诸如吲哚胺双加氧酶(IDO)、双加氧酶、精氨酸酶或氧化氮合成酶的新陈代谢酶的疗法。
可与ILT4抗体一起使用的另一类剂包括抑制腺苷形成的剂,例如CD73抑制剂,或抑制腺苷A2A受体的剂。
可与ILT4抗体组合用于治疗癌症的其他疗法包括逆转/防止T细胞无反应性(anergy)或耗竭(exhaustion)的疗法和在肿瘤位点处触发先天性免疫活化和/或发炎的疗法。
可与ILT4抗体组合用于治疗癌症的其他疗法包括例如使用
ILT4抗体可与超过一种肿瘤免疫剂组合,并且可例如与用于靶向免疫路径的多个元件的组合方法组合,所述组合方法是诸如以下中的一种或多种:增强肿瘤抗原呈递的疗法(例如树突状细胞疫苗、GM-CSF分泌细胞疫苗、CpG寡核苷酸、咪喹莫特);例如通过抑制CTLA-4和/或PD1/PD-L1/PD-L2路径和/或耗乏或阻断Treg或其他免疫抑制细胞来抑制负向免疫调节的疗法;例如使用刺激CD-137、OX-40和/或CD40或GITR路径和/或刺激T细胞效应功能的激动剂来刺激正向免疫调节的疗法;全身性增加抗肿瘤T细胞的出现率的疗法;例如使用CD25的拮抗剂(例如达利珠单抗)或通过离体抗CD25珠粒耗乏来耗乏或抑制Treg(诸如肿瘤中的Treg)的疗法;影响肿瘤中的抑制因子骨髓细胞的功能的疗法;增强肿瘤细胞的免疫原性的疗法(例如蒽环霉素);获得性T细胞或NK细胞转移,包括基因修饰的细胞,例如由嵌合抗原受体修饰的细胞(CAR-T疗法);抑制诸如吲哚胺双加氧酶(IDO)、双加氧酶、精氨酸酶或氧化氮合成酶的新陈代谢酶的疗法;逆转/防止T细胞无反应性或耗竭的疗法;在肿瘤位点处触发先天性免疫活化和/或发炎的疗法;免疫刺激性细胞因子的施用;或免疫抑制细胞因子的阻断。
本文所描述的ILT4抗体可与以下中的一种或多种一起使用:接合阳性共刺激受体的激动剂;减弱经由抑制受体的信号传导的阻断剂;拮抗剂;和全身性增加抗肿瘤T细胞的出现率的一种或多种剂;克服肿瘤微环境内的不同免疫抑制路径(例如阻断抑制性受体接合(例如PD-L1/PD-1相互作用)、耗乏或抑制Treg(例如使用抗CD25单克隆抗体(例如达利珠单抗)或通过离体抗CD25珠粒耗尽)、抑制诸如IDO的代谢酶或逆转/防止T细胞无反应性或耗竭)的剂;和在肿瘤位点处触发先天性免疫活化和/或发炎的剂。
在某些实施方案中,如果受试者为BRAF V600突变阳性的,则向受试者施用ILT4抗体以及BRAF抑制剂。
适用于本文所描述的组合疗法的PD-1拮抗剂包括(但不限于)配体、抗体(例如单克隆抗体和双特异性抗体)和多价剂。在一个实施方案中,PD-1拮抗剂为融合蛋白,例如Fc融合蛋白,诸如AMP-244。在一个实施方案中,PD-1拮抗剂为抗PD-1或抗PD-L1抗体。
示例性抗PD-1抗体为纳武单抗(BMS-936558)或WO2006/121168中所描述的包含抗体17D8、2D3、4H1、5C4、7D3、5F4和4A11中的一种的CDR或可变区的抗体。在某些实施方案中,抗PD-l抗体为WO2012/145493中所描述的MK-3475(拉立珠单抗(Lambrolizumab));WO2012/145493中所描述的AMP-514;或PDR001。其他已知的PD-1抗体和其他PD-1抑制剂包括WO2009/014708、WO 03/099196、WO 2009/114335、WO 2011/066389、WO 2011/161699、WO2012/145493、美国专利第7,635,757号和第8,217,149号以及美国专利公开案第2009/0317368号中所描述的PD-1抗体和PD-1抑制剂。还可使用WO2013/173223中所公开的任一抗PD-1抗体。与这些抗体中的一种竞争结合和/或结合到与这些抗体中的一种相同的PD-1上的抗原决定基的抗PD-L1抗体还可用于组合治疗中。
在一些实施方案中,可用于组合疗法的抗PD-L1抗体为BMS-936559(在WO 2007/005874和美国专利第7,943,743号中称为12A4),或包含3G10、12A4、10A5、5F8、10H10、1B12、7H1、11E6、12B7和13G4的CDR或可变区的抗体,其描述于PCT公开案WO07/005874和美国专利第7,943,743号中。在某一实施方案中,抗PD-L1抗体为MEDI4736(也称为德瓦鲁单抗和抗B7-H1)、MPDL3280A(也称为阿特珠单抗和RG7446)、MSB0010718C(也称为阿维鲁单抗;WO2013/79174)或rHigM12B7。还可使用WO2013/173223、WO2011/066389、WO2012/145493、美国专利第7,635,757号和第8,217,149号和美国公开案第2009/145493号中所公开的抗PD-L1抗体中的任一种。与这些抗体中的任一种竞争和/或结合到与这些抗体中的任一种相同的抗原决定基的抗PD-L1抗体还可用于组合治疗中。
在某些实施方案中,本发明的ILT4抗体可与CTLA-4拮抗剂(例如抗CTLA-4抗体)一起使用。在一个实施方案中,抗CTLA-4抗体为选自以下的组的抗体:
在一些实施方案中,本发明的ILT4抗体与LAG3拮抗剂组合使用。抗LAG3抗体的实例包括包含美国专利公开案第US2011/0150892号、第WO10/19570号和第WO2014/008218号中所描述的抗体25F7、26H10、25E3、8B7、11F2或17E5的CDR或可变区的抗体。在一个实施方案中,抗LAG-3抗体为BMS-986016。可使用的其他领域公认的抗LAG-3抗体包括US 2011/007023、WO08/132601和WO09/44273中所描述的IMP731和IMP-321。与这些抗体中的任一种竞争和/或结合到与这些抗体中的任一种相同的抗原决定基的抗LAG-3抗体还可用于组合治疗中。
在一些实施方案中,本发明的ILT4抗体可与CD137(4-1BB)激动剂(诸如激动性CD137抗体)组合施用。适合的CD137抗体包括例如优瑞路单抗(urelumab)和PF-05082566(W012/32433)。
在一些实施方案中,ILT4抗体可与OX40激动剂(诸如激动性OX40抗体)组合施用。适合的OX40抗体包括例如MEDI-6383、MEDI-6469或MOXR0916(RG7888;WO06/029879)。
在一个实施方案中,ILT4抗体与CD40激动剂(诸如激动性CD40抗体)组合施用。在某些实施方案中,肿瘤免疫剂为CD40拮抗剂,诸如拮抗性CD40抗体。适合的CD40抗体包括例如鲁卡木单抗(HCD122)、达西珠单抗(SGN-40)、CP-870,893或Chi Lob 7/4。
在一个实施方案中,ILT4抗体与CD27激动剂(诸如激动性CD27抗体)组合施用。适合的CD27抗体包括例如瓦里木单抗(varlilumab)(CDX-1127)。
在某些实施方案中,ILT4抗体与抗GITR抗体一起施用,抗GITR抗体是例如具有6C8的CDR序列的抗体,例如具有6C8的CDR的人源化抗体,如例如WO2006/105021中所描述;WO2011/028683中所描述的包含抗GITR抗体的CDR的抗体;JP2008278814中所描述的包含抗GITR抗体的CDR的抗体;WO2015/031667、WO2015/187835、WO2015/184099、WO2016/054638、WO2016/057841或WO2016/057846中所描述的包含抗GITR抗体的CDR的抗体;或本文中描述或提及的其他抗GITR抗体。
在一些实施方案中,ILT4抗体与MGA271(针对B7H3)(WO11/109400)组合施用。
在一些实施方案中,ILT4抗体与KIR拮抗剂(诸如利瑞路单抗)组合施用。
在一些实施方案中,ILT4抗体与IDO拮抗剂组合施用。适合的IDO拮抗剂包括例如INCB-024360(WO2006/122150、WO07/75598、WO08/36653、WO08/36642)、因多莫得(indoximod)、NLG-919(WO09/73620、WO09/1156652、WO11/56652、WO12/142237)或F001287。
在一些实施方案中,ILT4抗体与Toll样受体激动剂组合施用,所述Toll样受体激动剂是例如TLR2/4激动剂(例如卡介苗(Bacillus Calmette-Guerin);TLR7激动剂(例如希托洛(Hiltonol)或咪喹莫特);TLR7/8激动剂(例如雷西莫特(Resiquimod));或TLR9激动剂(例如CpG7909)。
在一个实施方案中,ILT4与TGF-β抑制剂(例如GC1008、LY2157299、TEW7197或IMC-TR1)组合施用。
额外组合疗法
本文中的Ab还可在其他模式的治疗(例如手术、化学疗法、放射疗法)或施用生物制剂(诸如另一治疗性抗体)之前、基本上同时或之后提供。在一些实施方案中,癌症在选自手术、化学疗法和放射疗法或其组合的疗法之后复发或进展。例如,当存在可存在微小转移灶的风险时和/或为了降低复发风险,如本文所描述的ILT4抗体可以辅助疗法形式施用。
对于癌症治疗,组合可结合一种或多种额外抗癌剂(诸如化学治疗剂、生长抑制剂、抗癌疫苗(诸如基因疗法疫苗)、抗血管生成剂和/或抗赘生性组合物)施用。可与本发明的抗体组合使用的化学治疗剂、生长抑制剂、抗癌疫苗、抗血管生成剂和抗赘生性组合物的非限制性实例在本文中提供于“定义”下方。
在一些实施方案中,消炎药(诸如类固醇或非类固醇消炎药(NSAID))可与所述组合一起施用。在需要结合使用本文所描述的ILT4抗体的治疗或在使用所述抗体的治疗前使异常增殖细胞休眠的情况下,还可向患者施用激素和类固醇(包括合成类似物),诸如17a-炔雌醇、己烯雌酚、睾固酮、泼尼松(Prednisone)、氟甲睾酮(Fluoxymesterone)、丙酸屈他雄酮(Dromostanolone propionate)、睾内酯(Testolactone)、乙酸甲地孕酮(Megestrolacetate)、甲基泼尼松龙(Methylprednisolone)、甲基-睾固酮、泼尼松龙、曲安西龙(Triamcinolone)、氯烯雌醚(Chlorotrianisene)、羟基孕酮(Hydroxyprogesterone)、氨鲁米特、雌莫司汀、乙酸甲羟孕酮(Medroxyprogesteroneacetate)、亮丙立德、氟他胺、托瑞米芬、
本文所描述的抗体还可与免疫原性剂,诸如癌细胞、纯化肿瘤抗原(包括重组蛋白、肽和碳水化合物分子)、细胞和经编码免疫刺激细胞因子的基因转染的细胞组合(He等人,(2004)J.Immunol.,173:4919-28)。可使用的肿瘤疫苗的非限制性实例包括黑色素瘤抗原的肽,诸如gp100、MAGE抗原、Trp-2、MART1和/或酪氨酸酶的肽,或经转染以表达细胞因子GM-CSF的肿瘤细胞(下文进一步论述)。
本文所描述的ILT4抗体还可与疫苗接种协议组合。已设计许多用于针对肿瘤的疫苗接种的实验策略(参见Rosenberg,S.,2000,Development of Cancer Vaccines,ASCOEducational Book Spring:60-62;Logothetis,C.,2000,ASCO Educational BookSpring:300-302;Khayat,D.2000,ASCO Educational Book Spring:414-428;Foon,K.2000,ASCO Educational Book Spring:730-738;还参见Restifo,N.和Sznol,M.,CancerVaccines,第61章,第3023-3043页,DeVita,V.等人(编),1997,Cancer:Principles andPractice of Oncology.第五版)。在这些策略中的一种中,使用自体或同种异体肿瘤细胞制备疫苗。已显示这些细胞疫苗在肿瘤细胞经转导以表达GM-CSF时最有效。已显示GM-CSF为用于肿瘤疫苗接种的抗原呈递的强力活化剂(Dranoff等人(1993)Proc.Natl.Acad.Sci.U.S.A.90:3539-43)。
各种肿瘤中的基因表达和大规模基因表达模式的研究已产生对所谓的肿瘤特异性抗原进行定义(Rosenberg,S A(1999)Immunity 10:281-7)。在许多情况下,这些肿瘤特异性抗原为在肿瘤中和出现肿瘤的细胞中表达的分化抗原,例如黑色素细胞抗原gp100、MAGE抗原和Trp-2。更重要地,可显示这些抗原中的许多为宿主中发现的肿瘤特异性T细胞的目标。ILT4抑制可与肿瘤中表达的一组重组蛋白和/或肽结合使用,以产生针对这些蛋白质的免疫反应。这些蛋白质通常通过免疫系统观测为自抗原且因此对其具耐受性。肿瘤抗原可包括蛋白质端粒酶,其为合成染色体的端粒所需的且表达在大于85%的人类癌症中且仅表达在有限数目的体细胞组织中(Kim等人(1994)Science266:2011-2013)。肿瘤抗原还可为因体细胞突变而在癌细胞中表达的“新抗原”,这些突变改变蛋白质序列或在两个不相关序列之间产生融合蛋白(即,费城染色体中的bcr-abl),或为来自B细胞肿瘤的个体基因型。
其他肿瘤疫苗可包括人类癌症中所牵涉的病毒的蛋白质,这些病毒是诸如人类乳头状瘤病毒(HPV)、肝炎病毒(HBV和HCV)和卡波西氏疱疹肉瘤病毒(KHSV)。可结合ILT4 Ab使用的另一形式的肿瘤特异性抗原为自肿瘤组织自身分离的纯化热休克蛋白(HSP)。这些热休克蛋白含有来自肿瘤细胞的蛋白质片段且这些HSP高效递送至抗原呈递细胞以引发肿瘤免疫性(Suot和Srivastava(1995)Science 269:1585-1588;Tamura等人(1997)Science278:117-120)。
树突状细胞(DC)为可用于引发抗原特异性反应的强力抗原呈递细胞。DC可离体产生且负载有各种蛋白质和肽抗原以及肿瘤细胞提取物(Nestle等人(1998)NatureMedicine 4:328-332)。DC还可通过基因方法转导以还表达这些肿瘤抗原。DC还已出于免疫的目的而与肿瘤细胞直接融合(Kugler等人,(2000)Nature Medicine 6:332-336)。作为一种疫苗接种方法,DC免疫可与ILT4抑制组合以活化更强力的抗肿瘤反应。
传染病治疗
本文所描述的方法还可用于治疗已暴露于特定毒素或病原体的患者。因此,本发明还涵盖治疗受试者的传染病的方法,其包括向受试者施用如本文所描述的抗体,例如ILT4抗体,从而治疗受试者的传染病。类似于其如上文所论述的针对肿瘤的应用,抗体介导的ILT4抑制可单独地或以佐剂形式与疫苗组合使用,以刺激对病原体、毒素和自抗原的免疫反应。这种治疗方法可能特别有用的病原体的实例包括当前无有效疫苗的病原体,或常规疫苗不完全有效的病原体。这些病原体包括(但不限于)HIV、肝炎(A、B和C)、流感、疱疹、梨形鞭毛虫(Giardia)、疟疾、利什曼原虫(Leishmania)、金黄色葡萄球菌(Staphylococcusaureus)、绿脓杆菌(Pseudomonas Aeruginosa)。ILT4抑制可用于抵抗诸如HIV的在感染过程中呈递改变的抗原的剂确定的感染。
引起可通过本文所描述的方法治疗的感染的病原性病毒的一些实例包括HIV、肝炎(A、B或C)、疱疹病毒(例如VZV、HSV-1、HAV-6、HSV-II和CMV、埃-巴二氏病毒(EpsteinBarr virus))、腺病毒、流感病毒、黄病毒(flaviviruses)、埃可病毒(echovirus)、鼻病毒(rhinovirus)、柯萨奇病毒(coxsackie virus)、冠状病毒(coronavirus)、呼吸道合胞体病毒(respiratory syncytial virus)、腮腺炎病毒(mumps virus)、轮状病毒(rotavirus)、麻疹病毒(measles virus)、风疹病毒(rubella virus)、细小病毒(parvovirus)、牛痘病毒(vaccinia virus)、HTLV病毒、登革热病毒(dengue virus)、乳突病毒(papillomavirus)、软疣病毒(molluscum virus)、脊髓灰质炎病毒(poliovirus)、狂犬病病毒(rabiesvirus)、JC病毒和虫媒脑炎病毒(arboviral encephalitis virus)。
引起可通过本文所描述的方法治疗的感染的病原性细菌的一些实例包括衣原体(chlamydia)、立克次体细菌(rickettsial bacteria)、分枝杆菌(mycobacteria)、葡萄球菌(staphylococci)、链球菌(streptococci)、肺炎球菌(pneumonococci)、脑膜炎球菌(meningococci)和淋球菌(conococci)、克雷伯氏菌(klebsiella)、变形杆菌(proteus)、沙雷氏菌(serratia)、假单胞菌(pseudomonas)、军团杆菌(legionella)、白喉(diphtheria)、沙门氏菌(salmonella)、杆菌(bacilli)、霍乱(cholera)、破伤风(tetanus)、肉毒杆菌毒素中毒(botulism)、炭疽(anthrax)、瘟疫(plague)、钩端螺旋体病(leptospirosis)和莱姆病细菌(Lymes disease bacteria)。
引起可通过本文所描述的方法治疗的感染的病原性真菌的一些实例包括念珠菌(Candida)(白色念珠菌(albicans)、克鲁斯念珠菌(krusei)、光滑念珠菌(glabrata)、热带念珠菌(tropicalis)等)、新型隐球菌(Cryptococcus neoformans)、曲霉菌(Aspergillus)(烟曲霉(fumigatus)、黑曲菌(niger)等)、毛霉菌属(Mucorales)(毛霉菌(mucor)、犁头霉(absidia)、根霉菌(rhizophus))、申克氏胞子丝菌(Sporothrix schenkii)、皮炎芽生菌(Blastomyces dermatitidis)、巴西副球孢子菌(Paracoccidioides brasiliensis)、粗球孢子菌(Coccidioides immitis)和荚膜组织胞浆菌(Histoplasma capsulatum)。
引起可通过本文所描述的方法治疗的感染的病原性寄生虫的一些实例包括溶组织内阿米巴(Entamoeba histolytica)、结肠小袋纤毛虫(Balantidium coli)、福氏耐格里阿米巴原虫(Naegleriafowleri)、棘阿米巴虫属(Acanthamoeba sp.)、蓝氏贾第虫(Giardia lambia)、隐胞子虫属(Cryptosporidium sp.)、卡氏肺孢子虫(Pneumocystiscarinii)、间日疟原虫(Plasmodium vivax)、微小巴倍虫(Babesia microti)、布氏锥虫(Trypanosoma brucei)、克氏锥虫(Trypanosoma cruzi)、杜氏利什曼原虫(Leishmaniadonovani)、刚地弓形虫(Toxoplasma gondi)和巴西日圆线虫(Nippostrongylusbrasiliensis)。
在所有以上方法中,ILT4抑制可与其他形式的免疫疗法,例如本文所描述的那些疗法,诸如细胞因子治疗(例如干扰素、GM-CSF、G-CSF、IL-2)或双特异性抗体疗法组合,这些疗法可提供增强的肿瘤抗原呈递(参见例如Holliger(1993)Proc.Natl.Acad.Sci.USA90:6444-6448;Poljak(1994)Structure 2:1121-1123)。
施用途径和载剂
在各种实施方案中,抗体可通过多种途径体内施用,这些途径包括(但不限于)静脉内(i.v.)、皮下、经口、动脉内、肠胃外、鼻内、肌肉内、心内、心室内、气管内、经颊、经直肠、腹膜内、皮内、局部、经皮和鞘内,或另外通过植入或吸入。本发明组合物可配制成呈固体、半固体、液体或气态形式的制剂;包括(但不限于)锭剂、胶囊、粉剂、颗粒、软膏、溶液、栓剂、灌肠剂、注射剂、吸入剂和喷雾剂。编码抗体的核酸分子可涂布到金微粒上且如文献中所描述通过粒子轰击装置或“基因枪”皮内递送(参见例如Tang等人,Nature 356:152-154(1992))。适当制剂和施用途径可根据预期应用选择。
在各种实施方案中,包含抗体的组合物与多种药学上可接受的载剂一起提供在制剂中(参见例如Gennaro,Remington:The Science and Practice of Pharmacy withFacts and Comparisons:Drugfacts Plus,第20版.(2003);Ansel等人,PharmaceuticalDosage Forms and Drug Delivery Systems,第7版,Lippencott Williams and Wilkins(2004);Kibbe等人,Handbook of Pharmaceutical Excipients,第3版,PharmaceuticalPress(2000))。可用各种药学上可接受的载剂,包括媒介物、佐剂和稀释剂。此外,还可用各种药学上可接受的辅助物质,诸如pH调整和缓冲剂、张力调整剂、稳定剂、润湿剂和其类似物。非限制性示例性载剂包括盐水、缓冲盐水、右旋糖、水、丙三醇、乙醇和其组合。
在各种实施方案中,可通过在水性或非水性溶剂中溶解、悬浮或乳化来配制包含抗体的组合物以用于注射(包括皮下施用),所述溶剂诸如植物油或其他油、合成脂族酸甘油酯、较高碳数脂族酸的酯、或丙二醇;且视需要使用常规添加剂,诸如增溶剂、等张剂、悬浮剂、乳化剂、稳定剂和防腐剂。在各种实施方案中,组合物可例如使用可接受的加压推进剂,诸如二氯二氟甲烷、丙烷、氮气和其类似物配制以用于吸入。在各种实施方案中,组合物还可诸如使用可生物降解或不可生物降解的聚合物配制成持续释放型微胶囊。非限制性示例性可生物降解制剂包括聚乳酸-乙醇酸聚合物。非限制性示例性非可生物降解制剂包括聚甘油脂肪酸酯。制备这类制剂的某些方法描述于例如EP 1 125 584 A1中。
还提供包含一个或多个容器的药物封装和试剂盒,其各自含有一个或多个剂量的抗体或抗体组合。在一些实施方案中,提供单位剂型,其中单位剂型含有预定量的包含抗体或抗体组合,具有或不具有一种或多种额外剂的组合物。在一些实施方案中,这类单位剂型供应于注射用的单次使用的载药注射器中。在各种实施方案中,单位剂型中所含的组合物可包含盐水、蔗糖或其类似物;缓冲液,诸如磷酸盐或其类似物;和/或在稳定和有效Ph范围内配制。或者,在一些实施方案中,组合物可以冻干粉末形式提供,所述冻干粉末可在添加适当液体(例如无菌水)时复原。在一些实施方案中,组合物包含一种或多种抑制蛋白质聚集的物质,包括(但不限于)蔗糖和精氨酸。在一些实施方案中,本发明的组合物包含肝素和/或蛋白聚糖。
药物组合物以有效治疗或预防具体适应症的量施用。治疗有效量通常取决于所治疗受试者的体重、其生理或健康状况、所治疗病况的延伸或所治疗受试者的年龄。一般而言,抗体可以每次给药约10μg/kg体重至约100mg/kg体重范围内的量施用。在一些实施方案中,抗体可以每次给药约50μg/kg体重至约5mg/kg体重范围内的量施用。在一些实施方案中,抗体可以每次给药约100μg/kg体重至约10mg/kg体重范围内的量施用。在一些实施方案中,抗体可以每次给药约100μg/kg体重至约20mg/kg体重范围内的量施用。在一些实施方案中,抗体可以每次给药约0.5mg/kg体重至约20mg/kg体重范围内的量施用。
需要时,可向受试者施用抗体组合物。可由本领域的技术人员,诸如主治医师,基于所治疗病况、所治疗受试者的年龄、所治疗病况的严重度、所治疗受试者的一般健康状况和其类似因素的考虑因素来决定施用频率。在一些实施方案中,一或多次向受试者施用有效剂量的抗体。在各种实施方案中,每月一次、少于每月一次(诸如每两个月一次或每三个月一次)向受试者施用有效剂量的抗体。在其他实施方案中,超过每月一次(诸如每三周一次、每两周一次或每周一次)施用有效剂量的抗体。在一些实施方案中,每1、2、3、4或5周一次施用有效剂量的抗体。在一些实施方案中,每周两次或三次施用有效剂量的抗体。至少一次向受试者施用有效剂量的抗体。在一些实施方案中,可多次施用有效剂量的抗体,包括持续至少一个月、至少六个月或至少一年的时间段。
在某些实施方案中,本文所论述的ILT4抗体与第二剂的组合可作为单一组合物在药学上可接受的载剂中同时施用,或作为含ILT4抗体和第二剂的单独的组合物在药学上可接受的载剂中同时施用。在一个实施方案中,ILT4抗体与第二剂的组合可依序施用。两种剂的施用可例如相隔30分钟、60分钟、90分钟、120分钟、3小时、6小时、12小时、24小时、36小时、48小时、3天、5天、7天或一周或多周的时间开始,或第二剂的施用可在施用第一剂之后例如30分钟、60分钟、90分钟、120分钟、3小时、6小时、12小时、24小时、36小时、48小时、3天、5天、7天或一周或多周开始。
实施例
下文所论述的实施例仅意欲例示本发明,且不应视为以任何方式限制本发明。这些实施例不意欲表示以下实验为所进行的所有实验或唯一实验。已努力确保关于所使用的数量(例如量、温度等)的准确性,但应当考量存在一些实验性误差和偏差。除非另有指示,否则份数为重量份,分子量为平均分子量,温度以摄氏度计,并且压力为大气压或接近大气压。
实施例1:结合到人类ILT4的抗体的产生
使用表达人类抗体基因的转基因小鼠产生抗人类ILT4单克隆抗体(ILT4抗体或hILT4抗体)。通过对2种类型的人类免疫球蛋白转基因动物进行免疫来产生针对人类ILT4的全人类单克隆抗体。用由hILT4的细胞外部分与C端小鼠Fc标签构成的hILT4-mFc重组蛋白对KM[M/K]小鼠进行免疫。将抗原与Ribi佐剂1:1混合,且每隔一周对小鼠进行腹膜内和皮下免疫。用由hILT4的胞外部分与C端的his标签构成的hILT4-his标记重组蛋白对HCo42:01[J/K]株进行免疫。将抗原与Ribi佐剂1:1混合,且每隔一周在脚掌处对小鼠进行免疫。在四次和六次注射后监测两者类型的小鼠的血清效价。小鼠在最终收获之前接受最终增强免疫。取决于免疫途径,收获引流淋巴结和脾脏以供后续融合。
自免疫的小鼠分离小鼠淋巴细胞。通过使用Cyto Pulse Hybrimmune大型腔室细胞融合电穿孔器(BTX/Harvard Apparatus)通过基于电场的电融合与小鼠骨髓瘤融合伴侣融合来产生融合瘤。将来自免疫小鼠的淋巴细胞的单细胞悬浮液与等量的P3X63 Ag8.6.53(ATCC)非分泌性小鼠骨髓瘤细胞融合(融合编号4865和6951)。将所得细胞涂铺于补充有氨基喋呤的培养基E(StemCell Technologies)中的平底微量滴定板中以供选择融合瘤(Sigma)。
在培养10至12天之后,使用均质HTRF测定针对人类IgG/人类κ轻链(hIgG/hK)抗体的存在筛选个别孔。通过FACS或通过FMAT测试来自hIgG/hK呈阳性的孔的融合瘤上清液,以结合到经hILT4转染的细胞或对照CHO细胞。进一步表征与hILT4特异性相互作用的以下抗体:9C8.A6、24E5.A7、2H2.H3、21D9.H11、2E5.A11和9G4。自稍后的免疫分离抗体21A5和10F10。
使用NGS高通量定序方法对来自融合瘤的抗体进行定序。简短地讲,针对96孔板的孔中的每个融合瘤克隆,使用独特的DNA条码进行VH区和VL区的PCR扩增以鉴别每个孔。使5'PCR引物与前导区杂交,从而获得整个可变区序列。通过匹配条码和板上的克隆的位置来鉴别特定融合瘤抗体序列。
抗ILT4抗体9G4、9C8、2H2、2E5、24E5、21D9、21A5和10F10在IgG1、IgG1.1或IgG1.3重链恒定区的情形下以重组方式表达,并且还认为提供于表1中。HC、LC、VH和VL的氨基酸序列和编码其的核苷酸序列提供于图1至图12和下文序列表中。每个CDR的位置提供于图中以及通过在序列表的可变区序列中加底线来指示,且还在接近序列表结尾处包括单独SEQ IDNO形式的CDR。
抗体21D9、21A5、2H2和10F10的可变结构域的氨基酸序列的分析指示不存在于任何人类种系中的某些框架氨基酸残基。为了减少将这些抗体施用给人类时的潜在免疫原性问题,产生这些ILT4抗体的种系回复突变体。
对于抗体21D9,鉴别出重链可变区中相对于种系序列的四个框架突变(V2G、G10D、A24T和V48I)且展示于图13中。在这些4个回复突变的各种组合中,产生四种回复突变体(21D9.b、21D9.c、21D9.d和21D9.e)(参见图13)且针对与hILT4的结合进行测试。所有4个回复突变体都包含N端EGQ至EVQ(或G2V)突变,其不大可能影响与ILT4的结合。除这种取代以外,突变体21D9.b、21D9.c和21D9.d各自包含图13中所展示的额外取代中的一种(D10G;I24A;和/或I48V),且21D9.e包含全部三个取代(参见图13)。在IgG1.3重链恒定区的情形下产生四种突变体以降低效应功能,所述IgG1.3重链恒定区为包含氨基酸取代L234A、L235E和G237A的IgG1恒定区。这些突变体被称为21D9.b.hIgG1.3(“21D9.VH-G2V/D10G8V.IgG1.3”)、21D9.c.hIgG1.3(“21D9.VH-G2V/T24A.IgG1.3”)、21D9.d.hIgG1.3(“21D9.VH-G2V/I48V”)和21D9.e.hIgG1.3(“21D9.VH-G2V/D10G/T24A/I48V.IgG1.3”),且包含21D9的轻链。未对轻链进行种系回复。
对于抗体21A5,在重链(T70I)和轻链(V3A)可变区中的每一个中鉴别出一个框架突变,如图14中所示。由于显示于A3V处的κ轻链中的N端回复不大可能影响结合,在IgG1.3(21A5.a.IgG1.3,也称为“21A5.VH-I70T.VK-A3V.IgG1.3”)的情形下产生且测试一个包含重链回复突变(I70T)和轻链回复突变(A3V)两者的突变体(具有21A5.1轻链的21A5.a)。
对于抗体10F10,在轻链可变区中鉴别出两个框架突变(Y36F和S63T),且展示于图15中。重链可变区中未发现框架突变。由于在位置36处的F至Y回复为微小差异,在IgG1.3(10F10.3.IgG1.3,也称为“10F10.VK-F36Y/T63S.IgG1.3”)的情形下产生且测试包含轻链回复突变F36Y和T63S两者的双重突变体(10F10.3)。还在IgG1.3(10F10.1.IgG1.3,也称为“10F10.VK-F36Y.IgG1.3”)的情形下产生且测试仅具有回复突变F36Y的突变体。两种回复突变体Ab皆包含10F10的重链。表1列举本文所描述的重组抗体的替代名称。
实施例2:抗hILT4抗体与可溶性hILT4的结合
使用
结果展示于表2和图16中。
结果显示21D9的4种回复突变体具有类似动力学和亲和力。21A5和其回复突变体21A5.a还具有类似动力学和亲和力。然而,两种10F10回复突变体10F10.1和10F10.3具有比其亲本10F10略快的解离速率,导致总体亲和力的约3倍损失。10F10.1和10F10.3的解离速率过快以至于不能以高置信度测定。
实施例3:抗hILT4抗体与hILT4表达细胞的结合
本实施例描述抗hILT4抗体与经hILT4转染的CHO细胞和与表达hILT4的人类单核细胞的结合特征。
CHO细胞用hILT4转染且用通过3倍连续稀释自20μg/ml滴定的个别抗hILT4抗体2H2、10F10(“10F10 WT”)、21A5(“21A5 WT”)、21A5.a、21D9(“21D9 WT”)和21D9e(皆在IgG1.3的情形下)染色,然后经PE缀合的二级抗人类IgG处理。使用用于几何平均荧光强度(GMFI)的FACS分析测定EC
结合曲线和EC值展示于图17和图18A中。
在图18B中,将选自正常健康供体的末梢血液的单核细胞用与Alexa67缀合的个别抗ILT4抗体染色。抗体通过3倍连续稀释自20μg/mL滴定,且通过用于计算EC50(图表下方的表格中所示)的FACS分析测定GMFI。
实施例4:抗ILT4抗体针对LILRA/B家族成员的选择性
ILT4为相关受体家族(也称为LILRA和LILRB家族)的成员。在本实施例中,测量hILT4抗体与各种LILRA/LILRB家族成员的结合。
个别ILT家族成员过度表达于293T细胞中。每种转染物用20μg/ml的抗ILT4抗体和随后的1μg/ml抗人类IgG二级mAb染色。通过流式细胞术来测量抗体与每种转染物的结合。在第二实验中,将LILRA1、LILRA3和ILT4转染物与各种浓度的21A5和21A5.a一起孵育。
展示于图19A和图19B以及表3中的结果指示,相对于其他LILRA和LILRB家族成员,抗hILT4抗体主要选择性结合到hILT4。LILRA3为LILRA/B家族中的唯一分泌蛋白质。更具体地讲,21D9和21D9.e并未显著结合到LILRA1、LILRA2、LILRA3、LILRA4、LILRA6、ILT2、ILT3、ILT5和LIR8,且仅较弱地结合到LILRA5。
表3中的“亲本”是指表达LILRA或LILRB分子的亲本细胞系。
如下进一步测试针对LILRA的其他家族成员的交叉反应性。进行抗体滴定流式细胞术结合测定以测定21D9、21D9.e、21A5和21A5.a与hILT4和其相应交叉反应ILT分子的结合效力。使用来自GraphPad
展示于表4和图20中的结果显示,抗ILT4抗体21D9、21D9.e、21A5和21A5.a显示与LILRA的其他家族成员的较弱交叉反应性:21D9和21D9.e与LILRA5以及21A5和21A5.a与LILRA1和LILRA3的较弱交叉反应性。
21D9和21D9.e以高亲和力结合到hILT4,但并未显著结合到hLILRA1、hLILRA2、hLILRA3、hLILRA4、hLILRA6、hILT2、hILT3、hILT5和hLIR8,且仅弱结合到hLILRA5。因此,相比与ILT5(LILRB3)和LILRA6交叉反应的其他抗ILT4抗体,诸如来自R&D系统的克隆287219,21D9和21D9.e结合到hILT4的特异性相对于其他hLILRA和hLIRB家族成员大得多。
实施例5:抗hILT4抗体强化T细胞反应
如下测定抗hILT4抗体对T细胞反应(尤其是T细胞增殖和干扰素γ(IFNγ)T细胞分泌)的作用。细胞质截短hILT4经转染至表达低水平的抗CD3抗体的单链可变片段的CHO细胞(CHO-OKT3细胞)中。转染的细胞系称为CHO-OKT3-ILT4。将自人类PBMC分离的全部T细胞与照射(生长停滞)的CHO-OKT3-ILT4细胞以4:1比率共培养。抗ILT4抗体21D9(“21D9 WT”)、21D9.e、21A5(“21A5 WT”)、21A5.a和10F10(“10F10 WT”)通过5倍连续稀释自20μg/ml滴定,且在37℃下孵育3天。收获上清液以通过ELISA评估IFNγ水平,且培养板用
展示于图21A至图21D中的结果指示,抗ILT4抗体21D9、21D9.e、21A5、21A5.a和10F10以剂量依赖方式刺激T细胞增殖和IFNγ分泌。在这种测定中未发现这些抗体之间的显著活性差异。
实施例6:在分化期间用抗ILT4抗体预处理单核细胞产生对同种异体T细胞更具刺激性的单核细胞源性树突状细胞(MoDC)
使用
展示于图22中的单独测定的结果指示,当在抗ILT4抗体21A5.a或21D9.e存在下自单核细胞分化MoDC时,同种异体MLR与MoDC测定中的CD4+T细胞增殖(图22A和图22C)和IFNγ分泌(图22B和图22D)增强。将来自两种不同供体的单核细胞用于单独的测定。
实施例7:自抗ILT4抗体预涂单核细胞分化的单核细胞源性树突状细胞(MoDC)增加共刺激或成熟分子的表达
使用
展示于图23中的结果指示,当在单核细胞分化成Mo-iDC期间存在抗ILT4抗体时,CD86和CD83(共刺激和成熟分子)分别在Mo-iDC上的表达增加。这些结果与实施例6的结果一起显示,在单核细胞分化成MoDC期间用抗hILT4抗体处理单核细胞如所展示通过上调CD83和CD86促进MoDC的促炎(图23A至图23D),其因此触发同种异体MLR测定中自同种异体T细胞的T细胞增殖和IFNγ产生增强(图22)。通过增强T细胞功能,用抗hILT4抗体处理可提供增强的抗癌免疫反应。
实施例8:抗ILT4抗体强化自体外分化的巨噬细胞的TNFα分泌
自人类PBMC分离的单核细胞在M-CSF存在下分化成巨噬细胞,持续5天。在10ng/ml的LPS(图24A)或5μg/ml的2'3'-cGAMP STING激动剂(图24B)存在下用指示浓度(紧邻其名称且以ng/ml计)的抗ILT4抗体21D9、21D9.e、21A5、21A5.a、2H2和10F10或同种型对照处理巨噬细胞。处理后24小时通过ELISA来测量TNFα产生,且紧靠曲线标注在每种抗体存在下的EC50值。
展示于图24中的结果指示,ILT4抗体21D9、21D9.e、21A5、21A5.a、2H2和10F10的存在通过LPS或STING激动剂增强体外分化的巨噬细胞的TNFα分泌。因此,免疫抑制巨噬细胞在ILT4被阻断时显示向更具促炎性表型的转变,其可潜在地提供增强的抗癌免疫反应。这些结果表明,抗ILT4抗体促进针对M1巨噬细胞的促炎性极化。
实施例9:抗ILT4抗体促进巨噬细胞:CD4+T细胞同种异体MLR中的CD4 T细胞反应
用M-CSF处理自末梢PBMC分离的单核细胞5天以分化成巨噬细胞。然后将巨噬细胞与自不同供体的PBMC分离且用CFSE染料标记的同种异体CD4+T细胞共培养。同种异体MLR共培养中包括1μg/ml的指示抗体(同种型对照、抗ILT4或抗PDL1)。在第6天,收集上清液用于分析IFNγ和D4+T细胞增殖,且通过基于CFSE稀释的FACS进行评估。
展示于图25A至图25B中的结果指示,抗ILT4抗体21D9、21D9.e、21A5或21A5.a在体外分化的巨噬细胞和CD4+T细胞的同种异体MLR中的存在促进CD4+T细胞增殖(图25A)和IFNγ产生(图25B)。这些结果表明,抗ILT4抗体经由调节巨噬细胞中的ILT4抑制信号传导或阻断其在T细胞中的直接抑制活性来促进T细胞活化。
实施例10:抗ILT4和抗PD-L1在巨噬细胞:CD4 T细胞同种异体MLR中的组合作用
用M-CSF处理自末梢PBMC分离的单核细胞5天以分化成巨噬细胞,然后将其与自同种异体供体的PBMC分离的同种异体CD4+T细胞共培养。同种异体MLR共培养中包括以10μg/ml单独或一起添加的抗ILT4抗体21D9和抗PD-L1抗体(同种型对照、抗ILT4、抗PD-L1或组合的抗ILT4和抗PD-L1)。在第6天,收集上清液用于分析IFNγ。
展示于图26中的结果指示,抗ILT4抗体21D9与抗PD-L1抗体的组合相对于单独的每种抗体刺激IFNγ自巨噬细胞:CD4+T细胞同种异体MLR的增强产生。
实施例11:抗hILT4 Ab 21D9和2H2 Fab的HDX抗原决定基定位
使用HDX-MS鉴别抗hILT4抗体21D9和2H2所结合的hILT4的区域。
HDX-MS通过监测主链酰胺氢原子的氘交换的速率和程度来探测溶液中的蛋白质构形和构形动力学(Huang和Chen(2014)Analytical and Bioanalytical Chem.406:6541以及Wei等人(2014)Drug Discovery Today 19:95)。HDX的水平视主链酰胺氢原子的溶剂可接近性和蛋白质氢键而定。可通过MS精确测量蛋白质在HDX后的质量增加。当将这种技术与酶消化相配对时,可在肽水平上解析结构特征,使得表面暴露的肽与折叠于内部的这些肽,或与蛋白质-蛋白质复合物界面处螯合的这些肽相区别。通常,进行氘标记和后续淬灭实验,接着进行酶消化、肽分离和MS分析。
在抗原决定基定位实验之前,进行非氘化实验以产生用于重组人类ILT4(15μM)的共有肽和具有Fab 21D9和2H2(1:1摩尔比)的ILT4的蛋白质复合物的清单。在HDX-MS实验中,将5μL的每种样品(具有Fab的ILT4或ILT4)稀释至55μL的D
人类ILT4(hILT4)经组氨酸标记且与21D9或2H2 Fab以1:1比率混合,且进行HDX 1分钟、10分钟或4小时。通过胃蛋白酶对hILT4的序列覆盖展示于图27A中。与每一Fab结合的hILT4(或hILT4肽)的区域展示于图27B和图27C中。具体地讲,HDX-MS实验提供对人类ILT4的85%序列覆盖。
对人类ILT4中的21D9和2H2的HDX-MS数据分析指示,21D9的抗原决定基由人类ILT4的一个区域(残基数目对应于天然人类IL T4序列):Ig结构域2中的区域:
HDX-MS数据分析指示,2H2的抗原决定基由人类ILT4的五个区域与为主要抗原决定基的区域2和5构成:
区域1:
区域2:
区域3:
区域4:
区域5:
(参见图27B,下图。)
实施例12:抗ILT4抗体阻断ILT4与I类MHC分子的结合
进行基于流式细胞术的抗体阻断测定来测定抗ILT4抗体阻断rhILT4-Fc与过度表达HLA-A或HLA-B的CHO细胞的结合的能力。产生含有鼠类Fc尾区的rhILT4-Fc融合蛋白。在固定30μg/ml浓度的rhILT4-Fc存在下滴定抗hILT4抗体21D9、2H2、10F10和21A5。将抗体和rhILT4-Fc混合物在冰上孵育30分钟,然后添加到经工程改造以过度表达HLA-A或HLA-B的CHO细胞。将CHO细胞在冰上染色30分钟,洗涤,然后用抗小鼠Ig二抗染色以检测结合的rhILT4-Fc。
展示于图28A至图28D中的结果指示,抗体21D9、2H2、10F10和21A5分别抑制hILT4与HLA-A和HLA-B的结合。
实施例13:21D9e.IgG1.3T增强通过T细胞实现的IFN-γ分泌和TNF-a分泌两者
本实施例展示,21D9e.IgG1.3增强单核细胞和T细胞的自体混合淋巴细胞反应(MLR)中的T细胞的IFN-γ和TNF-α分泌。
自末梢血液单核细胞(PBMC)分离T细胞和单核细胞且在20ng/mL抗CD3抗体(克隆:OKT3,BioLegend)存在下以1:1比率共培养。以10ug/mL添加21D9e.IgG1.3和同种型对照(DT-1D12-g1.3f)。进行细胞内染色以在88小时孵育时间段之后使用荧光染料缀合的IFN-γ抗体(克隆#B27,BioLegend)和TNF-α抗体(克隆#MAb11,BioLegend)测定每个样品中表达IFN-γ和TNF-α的T细胞的出现率。样品在
展示于图29A至图29D中的结果指示,21D9e.IgG1.3在自体同种异体MLR中增强在抗CD3刺激后通过CD4+和CD8+T细胞实现的IFN-γ分泌和TNF-α分泌两者。
实施例14:抗ILT4抗体在CMV溶胞物测定中增强在抗原刺激后的IFN-γ分泌
在0.3μg/mL的巨细胞病毒(CMV)溶胞物(CMV抗原2,Microbix Cat#EL-02-01-001)存在下将来自CMV反应性供体的末梢血液单核细胞(PBMC)以200,000个细胞/孔进行涂铺。用在20μg/mL下起始的抗ILT4抗体21D9.IgG1.3和21A5.IgG1.3的8点、5倍滴定处理细胞。以1μg/mL添加纳武单抗,作为阳性对照。以20μg/mL添加21D9-Fab和DT-1D12-g1.3。收获来自每种样品的上清液,且在孵育6天之后通过ELISA(人类IFN-γELISA试剂盒,BD OptEIACat.555142)测量IFN-γ水平。
展示于图30中的结果指示,抗ILT4抗体21D9.IgG1.3、21D9-Fab和21A5.IgG1.3在CMV溶胞物测定中增强在抗原刺激后的IFN-γ分泌。
实施例15:ILT4拮抗作用增强单核细胞:T同种异体MLR中的T细胞活化
将来自一个供体的T细胞(100,000)和同种异体单核细胞在96孔U形底培养板中以每孔2:1的比率共培养。将抗ILT4抗体2H2.IgG1.1f、2H2 Fab、21D9.IgG1.1f和21D9 Fab添加于以对于全长抗体为30μg/mL或对于Fab抗体为80μg/mL的浓度起始的4倍、7点滴定中。以30μg/mL添加抗KLH-g1.1f(抗血氰蛋白抗体),作为同种型对照。孵育细胞培养物6天。在最后16小时的培养期间通过
展示于图31中的结果指示,全长抗ILT4抗体21D9.IgG1.1f和2H2.IgG1.1f和其相应Fab片段皆诱导T细胞增殖。
实施例16:抗hILT4抗体与食蟹猴ILT4的结合
经由PCR自食蟹猴获得若干ILT家族成员。由于这些蛋白质的序列分析未清楚地指示其与hILT4最匹配,因此进行表达谱分析和功能性测定。这些测定将名为“9152”的克隆鉴别为在表达谱分析和功能特性方面与hILT4最匹配。包括His-Avi标签的9152的细胞外区的氨基酸序列如下:
QAGILPKPMLWAEPDRVITQGSPVTLRCQGNLEARGYHLYRERKSASWITLIRPELVKKGQFPIPSITWEDAGRYRCQYYSHSWWSEHSDPLELVVTGAYRKPTLSALPSPVVASGGNVTLQCDSRVALDGFILCKEGEDEHSQRLNSQPRTRGSSRAVFSVGPVSPSRRWSYRCYGYELHSRYVWSLPSDLLELLVPGVSKKPSLSVQPGPVVAGGDKLTLQCGSDAGYDRFALYKEGERDFLQRPGQQLQAGLAQANFTLDPVRGSHGGQYRCYGAHNLSSEWSAPSDPLDILISAGPHSGLRRECDPAVSVTGMDGHFLSDQGGSSSPGGGSGGGSEQKLISEEDLGHHHHHHGLNDIFEAQKIEWHE(SEQ ID NO:118)。对于与hILT4的结合,使用实施例2中所描述的hILT4-His-Avi标签的细胞外区(ECD);SEQ ID NO:119。
在比较SPR测定中分析使用以上ILT4构建体结合到食蟹猴和人类ILT4的21D9.e抗体的动力学。在Proteon XPR36仪器(BioRad)中将抗体胺偶联到GLC传感器芯片。将人类ILT4和食蟹猴ILT4 9152以1μM最大浓度(1.6nM最小浓度)作为分析物注入5元、5倍稀释系列中。所有数据使用由Karlsson等人(Karlsson等人(2005)Analytical Biochem.349:136)描述的动力学滴定模型用BIAevaluation软件4.1.1进行双重参考、导出和分析。运行缓冲液由10mM HEPES pH 7.4、150mM NaCl和0.05%Tween-20组成。测定温度为37℃。
展示于表5中的结果显示,相比人类ILT4,21D9.e以弱大约11倍的亲和力结合食蟹猴ILT4 9152(食蟹猴的K
实施例17:ILT4抗体体外促进共刺激分子和活化标记物在食蟹猴单核细胞源性树突状细胞上的表达
本实施例显示,ILT4抗体21D9.e.IgG1.3(图32中的ILT4.8;参见表1)和9G4.hIgG1.3(图32中的ILT4.1;参见表1)刺激CD80、CD83和CD86在单核细胞源性树突状细胞上的表达。
在62.5U/mL重组人类GM-CSF(Peprotech)和125U/mL重组人类IL-4(Peprotech)存在下培养自食蟹猴PBMC(非人类灵长类动物CD14微珠,Miltenyi)分离的单核细胞5天。在设置培养时,以10ug/mL将抗ILT4抗体添加到培养物。使用抗CD86(克隆#IT2.2,BioLegend)、抗CD80(克隆#L307)和抗CD83(克隆#HIB15e)对细胞染色以测定CD86、CD80和CD83在其表面的表达水平。样品在
展示于图32A至图32C中的结果指示,ILT4抗体21D9.e.IgG1.3(也称为ILT4.8.IgG1.3;图中的“ILT4.8”)和9G4.IgG1.3(也称为ILT4.1.IgG1.3;图中的“ILT4.1”)促进共刺激分子CD80和CD86以及树突状细胞成熟标记物CD83在单核细胞源性DC中的表达,如通过树突状细胞上的CD80、CD83和CD86的上调所证明。
实施例18:修饰的抗ILT4抗体10F10.4
10F10.1和10F10.3的轻链中的F36Y中的酪氨酸(参见实施例2)位于hILT4和10F10抗体的模型化中的重链CDR3附近。因此,用Y取代F36可引起与重链CDR3中的异亮氨酸抵触,如10F10.1和10F10.3相对于10F10的较快解离速率所证明(参见实施例2)。产生另一突变体,其中轻链的F36未突变且10F10中产生的唯一轻链框架区突变为T63S。重链未突变,且因此为10F10的重链。这种修饰的抗体称为10F10.4,且其轻链的氨基酸序列在序列表中列举为SEQ ID NO:116。
在37℃下使用
展示于表6中的结果指示,10F10.4的结合动力学与10F10的结合动力学极其类似。包括21A5、21A5a、21D9和21D9.e作为对照。绝对值略微不同于表2中所示的值,其是由于所述测定中使用不同捕获试剂所致。
展示10F10.4通过增强自体外分化的巨噬细胞的TNFα分泌而具功能活性。这是通过如实施例8中所描述将10F10.4与自PBMC单核细胞分化的巨噬细胞一起孵育来证实。还包括21D9.e以及同种型对照。展示于图33A和图33B中的结果指示,在单核细胞通过LPS或STING激动剂体外分化成巨噬细胞期间,ILT4抗体10F10.4的存在增强TNFα分泌。
实施例19:21D9.e在IgG1、IgG4和IgG1.3的情形下具有类似效力
本实施例展示21D9.e的效力在IgG1、IgG4(S228P)和IgG1.3重链的情形下类似。
21D9.e抗体在IgG1、IgG4(具有S228P)或IgG1.3(分别为SEQ ID NO:176、178和13)的情形下克隆且用于如下进行的测量TNFα分泌的测定中。
展示于图34中的结果指示,对于21D9.e.IgG1、21D9.e.IgG4.S228P和21D9.e.IgG1.3,分泌类似量的TNFα。因此,21D9.e可变区在这些不同Fc区的情形下具有类似功能性效力。DT-1D12为同种型对照。
实施例20:21D9e结合到hILT4等位基因
本实施例描述用于确定21D9.e是否结合到hILT4的替代性等位基因的测定。
仅考虑出现率超过1%的那些等位基因。进一步考虑在区域D1和D2中具有氨基酸变化的两个等位基因:E161D和R103H(根据SEQ ID NO:107编号,即具有信号序列的ILT4)。由于3维模型化展示两个氨基酸残基不靠近具有I类MHC的结合界面,所以预期这些残基处的氨基酸变化不影响抗体与hILT4的结合。为证实这种情况,进行具有取代E161D和R103H的hILT4蛋白(hILT4 E161D/R103H)且经由Octet BLI测试其与21D9.e.IgG1.3和21A5.a.IgG1.3(ILT4.9.IgG1.3;参见表1)的结合。发现两种蛋白质类似地结合到hILT4E161D/R103H和hILT4 E161/R103。
实施例21:21D9e.IgG1.3不显著触发嗜碱性粒细胞活化
用于通过抗ILT4抗体检测嗜碱性粒细胞活化的测定涉及以下步骤。通常如下通过使用用于Flow
基于这种测定,来自8个供体的Ccr3+CD63+活化的嗜碱性粒细胞在与21D9.e.IgG1.3(ILT4.8.IgG1.3;参见表1)、21.5Aa.IgG1.3(ILT4.9.IgG1.3)或抗DT以4.5μg/mL、45.45μg/mL或454.55μg/mL一起孵育180分钟之后通过FACS测量。阳性对照包括抗FcεRI和fMLP(N-甲酰蛋氨酸-白氨酰基-苯丙氨酸)。阴性对照为DT1DT12-IgG1.3,其靶向不相关的抗原白喉毒素。
展示于图36中的结果指示,21D9.e.IgG1.3(ILT4.8.IgG1.3)和21.5Aa.IgG1.3(ILT4.9.IgG1.3)在所测试的条件下未诱导嗜碱性粒细胞活化。缺乏嗜碱性粒细胞活化代表一种重要安全性特征。
实施例22:抗ILT4抗体21D9.e.IgG1.3是稳定的
本实施例描述用抗ILT4抗体21D9.e.IgG1.3(也称为ILT4.8.IgG1.3)进行的3个月稳定性研究,其数据展示抗体至少在3个月内是稳定的。
在25℃或40℃下以150mg/mL的浓度孵育21D9.e.IgG1.3的样品。将样品用流动相(40mM NaH2PO4,60mM Na2HPO4,0.1M Na2SO4,pH 6.8)稀释至1mg/mL,且使用Agilent 1200系列HPLC系统(Agilent Technologies,Santa Clara,CA)使用TSKgel Super3000SW管柱(4.6mm ID×30cm,4μm,Tosoh Bioscience,King of Prussia,PA)以等度梯度(0.1M磷酸钠,0.1M硫酸钠,pH 6.8,以0.2mL/min)分析四十微升。UV检测设定为280nM。
展示于图35中的结果指示,21D9.e.IgG1.3(ILT4.8)抗体组合物在25℃下孵育3个月之后包含少于5%的高分子量物质和低分子量物质且在40℃下孵育3个月之后包含少于10%的高分子量物质和低分子量物质。
实施例23:通过抗ILT4单克隆抗体交叉阻断2H2和21D9
首先将过度表达ILT4的CHO细胞与未缀合的抗ILT4抗体10F10.IgG1.3和21A5.IgG1.3的连续稀释液(3倍,12点,以40μg/mL起始)一起预孵育。添加抗KLH-g1.1f(抗血氰蛋白抗体)作为同种型对照,同时以40μg/mL添加未缀合的2H2.IgG1.1f或21D9.IgG1.1f作为阳性对照以证实阻断活性。30分钟孵育时间段之后,以1.5μg/mL加入缀合PE的2H2.IgG1.1f或21D9.IgG1.1f且再与细胞一起孵育30分钟。洗涤后,样品在FACSCanto
结果展示于图37A(2H2交叉阻断)和图37B(21D9交叉阻断)中。结果指示,10F10和21A5交叉阻断2H2(或与其竞争)结合到hILT4(图37A),且10F10而非21A5交叉阻断21D9(或与其竞争)结合到hILT4(图37B)。因此,(i)21A5和2H2处于同一划分组中(即,其彼此竞争结合到hILT4);(ii)21D9与21A5/2H2处于单独的划分组中;且(iii)10F10与21D9和2H2/21A5竞争结合到hILT4。
展示hILT4的晶体结构上的抗体的hILT4结合区的图式展示于图37C中。Ig样结构域1对应于SEQ ID NO:107的氨基酸残基27-110,而Ig样结构域2对应于SEQ ID NO:107的氨基酸残基111-229。这两个结构域以带状形式展示于图37C中。这些实验的结果指示,抗体21D9结合到Ig样结构域1,抗体2H2和21A5结合到Ig样结构域2,且抗体10F10结合到位于Ig样结构域2中靠近Ig样结构域1且可与结合到Ig样结构域1或Ig样结构域2的抗体竞争的区域。预期仅由于种系突变而不同于这些实验中所使用的抗体的抗体(例如21D9.e、29A5.a以及10F10.3和10F10.4)结合与其亲本抗体(分别为21D9、29A5和10F10)相同的区域。
实施例24:使用卡宾化学足迹法的抗原决定基定位
将用于人类ILT4和抗人类ILT4抗体Fab克隆10F10、21D9和21A5的试剂缓冲液交换成1mg/mL的100mM Tris-HCl和50mM NaCl,pH 7.5。通过以1:1比率混合制备人类ILT4和每一抗人类ILT4抗体Fab的个别复合物。将5ug ILT4和10ug复合物的三次重复实验与在100mMTris-HCl和50mM NaCl,pH 7.5中的20mM 4-[3-(三氟甲基)-3H-双吖丙啶-3-基]苯甲酸以1:1混合。将所得混合物在液氮中速冻。将所有样品置于干冰上,并用来自Atlas
双吖丙啶是可与所有20种氨基酸中的任何C-H键反应的光活性化合物。所得共价修饰可与同一肽中的其他氨基酸位点色谱分离。使用未修饰的肽和单一修饰的肽的三重峰面积的比较来确定抗体克隆10F10、21A5和21A9的双吖丙啶标记的差异,以鉴别抗体抗原决定基。认为在一种或多种复合物中标记减少>50%的肽是显著的,并用于定位抗体抗原决定基。将显著的肽,或在由于缺失酶裂解位点而不能与未修饰的肽进行比较的情况下,所有样品的修饰肽色谱图彼此比较,其中使用个别肽峰洗脱色谱图的>50%的减少来确定受抗体抗原决定基保护的差异修饰的氨基酸。通过MS/MS人工证实差异修饰的氨基酸的MS/MS谱,并在人类ILT4 x-射线晶体学结构(PDB:2DYP)上标记。(图37D。)发现克隆21D9的抗体抗原决定基在人类ILT4的结构域1中的1和3个氨基酸的两个个别位点具有差异标记,并以红色和紫色标记(由于与10F10的重叠位点)。发现克隆10F10的抗体抗原决定基在人类ILT4的结构域1和结构域2中的1-2个氨基酸的六个个别位点具有差异标记,并且如图37D中所标记(由于与21A5和21D9两者的重叠位点)。发现克隆21A5的抗体抗原决定基在人类ILT4的结构域2中的1-4个氨基酸的11个个别位点处具有差异标记,也如图37D中所标记(由于与两个10F10的重叠位点)。
关于抗体21A5,hILT4氨基酸残基Gly117、Val119、Try120、Leu134、Lys136、Gln149、Pro150、Ile159、Ser161、Val162、Gly163、Pro164、Pro167、His173、Try178、Pro183和Tyr184在图37D中描绘为球。关于抗体10F10,残基Glu42、Lys43、Gly76、Cys77、Leu88、Pro91、Pro183和Tyr184描绘在图37D中。关于抗体21A9,描绘了残基Lys43、Ile49、Thr50和Arg51。
序列表
以下为本申请中提及的某些序列的表格。下文多个序列还提供于图1至图15中,且抗体的VH和VL CDR标示于图1至图15中。在下文所提供的LC和HC序列内,组分VL和VH序列加底线且加粗。在以下VL和VH序列内,CDR加底线且加粗,还如图1至图12中所描绘,且在某些VH和VL序列内,描绘回复突变。(回复突变的描绘还参见图13至图15。)在一些情况下,回复突变经加阴影,或为粗体且加底线并加灰色阴影。
- 结合到ILT4的抗体
- 结合到抗N-甲基-D-天冬氨酸(NMDA)受体抗体的结合区的抗体或抗体片段或非Ig支架
