一种定量检测U2AF1基因突变的drop-off ddPCR方法和试剂盒
文献发布时间:2023-06-19 12:04:09
技术领域
本发明涉及生物技术领域,尤其涉及一种定量检测U2AF1基因突变的方法和试剂盒。
背景技术
U2AF1是U2核糖核蛋白辅助因子,定位于21号染色体长臂(21q22.3)上,属于RNA剪接体复合物蛋白的一种,包含有2个功能结构域,即RNA结合结构域和RS结构域,在将前体mRNA剪切成功能性mRNA中发挥作用。U2AF1基因在骨髓增生异常综合征(MDS)患者中突变率较高,8.7%~11.6%初发MDS患者伴U2AF1基因突变。研究显示,U2AF1基因突变与MDS预后相关,伴U2AF1基因突变的MDS患者有高风险向急性髓系白血病(AML)转化,且总体生存期(overall survival,OS)较短,通常提示预后不良。U2AF1等RNA剪接体编码基因有望成为MDS患者新的治疗靶点,且RNA剪接调节药物可能会提高MDS的疗效。
微小残留病(minimal residual disease,MRD)是指血液系统肿瘤在接受治疗后获得形态学缓解,无临床症状但仍然在体内存在的亚显微镜病变。MRD检测对于血液肿瘤的预后判断以及分层治疗具有重要的指导意义,对U2AF1基因突变负荷水平进行动态监测,可反映血液肿瘤亚克隆水平,从而指导治疗。
目前临床上有多种检测U2AF1基因突变的方法,主要方法有Sanger测序、二代测序、实时荧光定量PCR等。Sanger测序法被认为是检测基因突变的金标准,但灵敏度低,不适用于临床MRD检测。二代测序通量高、灵敏度高,但其成本高、操作难度大,难以在临床中应用于单基因的MRD监测。实时荧光定量PCR无法进行绝对定量,不适用于MRD监测。传统的ddPCR(微滴式数字PCR,Droplet Digital PCR)方法,灵敏度高,可直接反应U2AF1突变负荷水平,但检测的突变类型较为单一,且仅可检测已知突变,对于同一热点上的多种突变类型检测较为繁琐,容易遗漏。因此,对初诊患者U2AF1基因突变筛选以及MRD监测需要进一步优化。
发明内容
为克服上述现有技术的不足,本发明提出一种定量检测U2AF1基因突变的drop-off ddPCR方法和试剂盒。本发明提供的用于drop-off ddPCR技术检测U2AF1基因突变的引物和探针是根据U2AF1基因DNA序列设计的,针对U2AF1基因两个突变热点Q157、S34分别设计了两条野生型探针,一条位于突变热点上,一条位于突变热点外,当突变热点存在插入、替换、缺失等突变时,位于突变热点的野生型探针则不能与模板紧密结合,所以该试剂盒仅用两对引物探针即可检出U2AF1基因Q157、S34两个突变热点的多种突变,并且其灵敏度高,可用于MRD监测。
本发明提供了一种采用drop-off ddPCR定量检测U2AF1基因突变的试剂盒,包含针对U2AF1基因2个位点Q157和S34的特异性引物对和探针,其中引物的序列如下:
U2AF1 Q157正向引物:5’-CGTGACGGACTTCAGAGAA-3’
U2AF1 Q157反向引物:5’-GTGCTCAGTCACGTCACT-3’
U2AF1 S34正向引物:5’-TCTCATTTTCCCTTACAG-3’
U2AF1 S34反向引物:5’-GCTAAACGTCGGTTTATT-3’。
进一步的,所述探针序列如下:
U2AF1 Q157突变位点野生型探针:5’-FAM-CTGCTGCCGTCAGTATGA-BHQ1-3’
U2AF1 Q157突变位点外野生型探针:5’-VIC-TGGGGTGAGTGAGGAGTGG-BHQ1-3’
U2AF1 S34突变位点野生型探针:5’-FAM-AGGTGCTCTCGGTTGCA-BHQ1-3’
U2AF1 S34突变位点外野生型探针:5’-VIC-TCAAAATTGGAGCATGTCGTC-BHQ1-3’;
其中,Q157和S34突变位点探针5’端标记荧光基团FAM,探针3’端标记荧光淬灭基团BHQ1,Q157和S34突变位点外探针5’端标记荧光基团VIC,探针3’端标记荧光淬灭基团BHQ1。
进一步地,所述试剂盒还包括U2AF1突变型及野生型质粒分别作为阳性和阴性对照。
进一步地,所述Q157突变为Q157P突变或Q157R突变。
进一步地,所述S34突变为S34F突变或S34Y突变。
本发明还提供了一种定量检测U2AF1基因突变的drop-off ddPCR方法,包括如下步骤:
(1)提供一待测样本,获得待测样本的DNA;
(2)取上述样品DNA为模板与上述试剂盒中的引物对、探针混合,配置数字PCR反应混合液;
(3)利用步骤(2)所制备的数字PCR混合液与油相混合,通过微滴制备仪制备可独立进行PCR扩增反应的PCR微反应液滴,并导入芯片;
(4)对步骤(3)所制备的芯片中的PCR微反应液滴进行PCR扩增反应;
(5)对经步骤(4)PCR扩增反应后芯片中的微滴进行信号收集,从而计算得出样本中U2AF1基因的等位基因频率。
进一步地,所述待测样本为患者外周血或骨髓组织。
进一步地,FAM标记的突变位点野生型探针与VIC标记的突变位点外野生型探针在同一PCR反应体系内,根据微滴分析仪自动分析的结果,读取样本中FAM及VIC通道的拷贝数浓度,并计算出U2AF1基因的突变负荷水平。
进一步地,U2AF1基因等位基因频率(VAF)=1-FAM拷贝数/VIC拷贝数。
进一步地,ddPCR反应混合液配置体系如下:
。
进一步地,ddPCR反应程序如下:
。
进一步地,U2AF1基因Q157突变的空白限(LOB)为2.10拷贝/微升,最低检测下限为8.00拷贝/微升。
进一步地,U2AF1基因S34突变的空白限(LOB)为4.34拷贝/微升,最低检测下限为9.53拷贝/微升。
进一步地,所述定量检测U2AF1基因突变的drop-off ddPCR方法是非诊断目的的。
与现有技术相比,本发明的有益效果在于:
(1)本发明提供的基于drop-off ddPCR检测U2AF1基因突变的检测试剂盒,其引物和探针是根据U2AF1基因DNA序列设计的,特异性强。
(2)本发明提供的基于drop-off ddPCR检测U2AF1基因突变的检测方法,针对U2AF1基因每个突变热点仅需一对通用引物,一条位于突变热点上的野生型探针和一条位于突变热点外的野生型探针,即可检出该热点上出现的插入、替换、缺失等突变。
(3)本发明提供的基于drop-off ddPCR检测U2AF1基因突变的检测方法,Q157突变的最低检测下限为8.00拷贝/微升、S34突变最低检测下限为9.53拷贝/微升,灵敏度高,可用于初诊患者U2AF1基因突变筛选以及治疗后MRD监测,进一步指导治疗。
附图说明
图1示本发明实施例1的drop-off ddPCR检测结果图。左上象限代表Q157P突变型液滴,右上象限代表野生型液滴,左下象限代表双阴性液滴。
图2示本发明实施例2的drop-off ddPCR检测结果图,左上象限代表Q157R突变型液滴,右上象限代表野生型液滴,左下象限代表双阴性液滴。
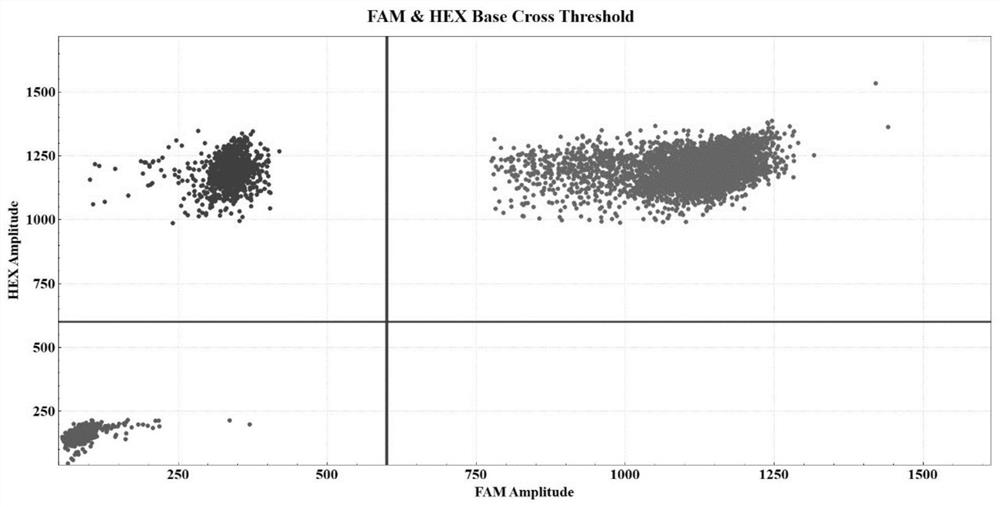
图3示本发明实施例3的drop-off ddPCR检测结果图,右上象限代表Q157野生型液滴,左下象限代表双阴性液滴。
图4示本发明实施例4的不同浓度U2AF1基因Q157突变drop-off ddPCR检测结果的线性分析。
图5示本发明实施例4的不同浓度U2AF1基因Q157突变drop-off ddPCR检测结果的FAM通道一维散点图。
图6示本发明实施例5的drop-off ddPCR检测结果图。左上象限代表S34F突变型液滴,右上象限代表野生型液滴,左下象限代表双阴性液滴。
图7示本发明实施例6的drop-off ddPCR检测结果图,左上象限代表S34Y突变型液滴,右上象限代表野生型液滴,左下象限代表双阴性液滴。
图8示本发明实施例7的drop-off ddPCR检测结果图,右上象限代表S34野生型液滴,左下象限代表双阴性液滴。
图9示本发明实施例8的不同浓度U2AF1基因S34突变drop-off ddPCR检测结果的线性分析。
图10示本发明实施例8的不同浓度U2AF1基因S34突变drop-off ddPCR检测结果的FAM通道一维散点图。
具体实施方式
下面结合具体实施例和附图,进一步阐述本发明。需说明的是,本发明中使用的原料均为普通市售产品,因此对其来源不做具体限定,实施例中未说明的常规条件和方法,通常按照所属领域实验人员常规采用方法,或者按照制造厂商所建议的步骤和条件。
实施例1
以U2AF1基因Q157P突变患者骨髓样本为例,详细说明该检测方法。
1.分离骨髓单个核细胞以及提取DNA
(1)骨髓样本加5ml红细胞裂解液混匀,静置1min;
(2)离心12000×rpm 20sec,弃上清,留沉淀;
(3)加1ml Trizol,充分吹打混匀;
(4)加200μl三氯甲烷,漩涡振荡器振荡20sec,静置10min,离心12000×rpm 1min,弃上清;
(5)再次12000×rpm离心后弃上清留沉淀,可见管底DNA白色沉淀;
(6)向管中加入1ml柠檬酸三钠,轻弹或颠倒混匀漂洗沉淀,静置20-30min后,12000×rpm离心5min,弃上清;
(7)加入1ml 70%乙醇,轻弹使其浮起洗脱,12000×rpm 5min,弃上清;
(8)加入1ml 100%乙醇,轻弹使其浮起洗脱,12000×rpm 5min,弃上清;
(9)将沉淀干燥后,加入适量DNA溶解液,置于65℃金属浴5min;
(10)通过紫外分光光度仪检测DNA样品的吸光度(A)值,并调整至50ng/μl,4℃保存。
2.使用上述DNA模板,配置ddPCR反应混合液,配置比例如下:
将上述反应液混合均匀,涡旋混匀30s,瞬时离心将反应液收集于管底后至于冰上待用。
3.按照如下比例配置油相混合液:
按上表配方反应油相混合后,涡旋或移液器吹打混匀30s,瞬时离心除去气泡,并将液体收集于管底,然后置于冰上待用,混合后的油相混合液请在30min以内使用。
4.微滴制备
(1)打开仪器前面板仓门,接通BioDigital Loader S100样本处理系统背面网电源和面板,启动电源,将数字PCR芯片置于Loader S100芯片仓,按照提示进行操作。
(2)用移液枪先后吸取25μL油相混合液、30μL ddPCR反应液,左手下压仓门然后通过右侧进样托对准芯片塞子中心孔,将吸头固定在进样托内。
(3)进样完成后,取出装有微滴的芯片。
5.PCR反应
将芯片置于Cycler S100 PCR扩增仪的芯片槽内,进行如下反应:
6.芯片阅读,数据分析
PCR扩增反应结束后将芯片移至Imager S100生物芯片阅读仪上,依据芯片的阅读结果进行数据分析后,可得到如图1的实验结果以及相关数据。
由结果可知,250ng样本DNA中,FAM浓度为3190.57copies/μl,VIC浓度为4082.37copies/μl,计算得到U2AF1 Q157突变模板浓度为891.8copies/μl,U2AF1等位基因频率为21.85%。
实施例2
以U2AF1基因Q157R突变患者骨髓样本为例。具体的检测过程与实施例1相同,在此不再赘述。数据分析后可得到如图2的实验结果以及相关数据。
250ng样本DNA中,FAM浓度为4712.85copies/μl,VIC浓度为4857.83copies/μl,计算得到U2AF1 Q157突变模板浓度为144.98copies/μl,U2AF1等位基因频率为2.98%。
实施例3
以U2AF1基因Q157突变阴性患者骨髓样本为例。具体的检测过程与实施例1相同,在此不再赘述。数据分析后可得到如图3的实验结果以及相关数据。
250ng样本DNA中,FAM浓度为4611.04copies/μl,VIC浓度为4612.77copies/μl,计算得到U2AF1 Q157突变模板浓度为1.73copies/μl,低于检测下限(8.00拷贝/微升),故患者U2AF1基因突变阴性。
实施例4
以U2AF1基因Q157突变型及野生型质粒进行ddPCR灵敏度实验
根据实施例1方法,重复检测野生型质粒模板51次,计算LOB为2.10copies/μl,重复检测低浓度质粒模板24次,计算LOD为8.00copies/μl.
根据实施例1方法将U2AF1基因Q157突变及野生型质粒定量并稀释至5000copies/μl,将突变型质粒掺入野生型质粒,使得U2AF1突变模板比例分别为50%、20%、10%、2.5%、0.5%、0.1%、0.05%,每个浓度模板重复检测三次,得到如下数据:
如图4和图5所示,理论值与实际检测值的线性关系好,因此本发明提供的U2AF1基因Q157突变drop-off ddPCR方法,最低检测下限为8.00拷贝/微升,且线性好。
实施例5
以U2AF1基因S34F突变患者骨髓样本为例,详细说明该检测方法。
1.分离骨髓单个核细胞以及提取DNA,方法同实施例1。
2.使用上述DNA模板,配置ddPCR反应混合液,配置比例如下:
将上述反应液混合均匀,涡旋混匀30s,瞬时离心将反应液收集于管底后至于冰上待用。
3.配置油相、制备微滴,具体方法同实施例1。
4.PCR反应
将芯片置于Cycler S100 PCR扩增仪的芯片槽内,进行如下反应:
5.芯片阅读,数据分析
PCR扩增反应结束后将芯片移至Imager S100生物芯片阅读仪上,依据芯片的阅读结果进行数据分析后,可得到如图6的实验结果以及相关数据。
250ng样本DNA中,FAM浓度为916.745copies/μl,VIC浓度为1662.55copies/μl,计算得到U2AF1 S34突变模板浓度为745.805copies/μl,U2AF1等位基因频率为44.86%。
实施例6
以U2AF1基因S34Y突变患者骨髓样本为例。具体的检测过程与实施例5相同,在此不再赘述。数据分析后可得到如图7的实验结果以及相关数据。
250ng样本DNA中,FAM浓度为1718.41copies/μl,VIC浓度为1730.81copies/μl,计算得到U2AF1 S34突变模板浓度为12.4copies/μl,U2AF1等位基因频率为0.72%。
实施例7
以U2AF1基因S34突变阴性患者骨髓样本为例。具体的检测过程与实施例5相同,在此不再赘述。数据分析后可得到如图8的实验结果以及相关数据。
250ng样本DNA中,FAM浓度为1844.24copies/μl,VIC浓度为1845.42copies/μl,计算得到U2AF1 S34突变模板浓度为1.18copies/μl,低于检测下限(9.53拷贝/微升),故患者U2AF1基因突变阴性。
实施例8
以U2AF1基因S34突变型及野生型质粒进行ddPCR灵敏度实验
根据实施例5方法,重复检测野生型质粒模板30次,计算LOB为4.34copies/μl,重复检测低浓度突变型模板25次,计算LOB为9.53copies/μl。
根据实施例5方法将U2AF1基因S34突变及野生型质粒定量并稀释至2000copies/μl,将突变型质粒掺入野生型质粒,使得U2AF1突变模板比例分别为50%、20%、5%、1%、0.2%、0.1%,每个浓度模板重复检测三次,得到如下数据:
如图9和图10所示,理论值与实际检测值的线性关系好,因此本发明提供的U2AF1基因S34突变drop-off ddPCR方法,最低检测下限为9.53拷贝/微升,且线性好。
序列表
<110> 镇江市第一人民医院
<120> 一种定量检测U2AF1基因突变的drop-off ddPCR方法和试剂盒
<160> 8
<170> SIPOSequenceListing 1.0
<210> 1
<211> 19
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 1
cgtgacggac ttcagagaa 19
<210> 2
<211> 18
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 2
gtgctcagtc acgtcact 18
<210> 3
<211> 18
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 3
tctcattttc ccttacag 18
<210> 4
<211> 18
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 4
gctaaacgtc ggtttatt 18
<210> 5
<211> 18
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 5
ctgctgccgt cagtatga 18
<210> 6
<211> 19
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 6
tggggtgagt gaggagtgg 19
<210> 7
<211> 17
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 7
aggtgctctc ggttgca 17
<210> 8
<211> 21
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 8
tcaaaattgg agcatgtcgt c 21
- 一种定量检测U2AF1基因突变的drop-off ddPCR方法和试剂盒
- 一种定量检测NPM1基因突变的drop-off ddPCR方法和试剂盒
