细胞培养物澄清的方法
文献发布时间:2023-06-19 12:16:29
技术领域
本发明涉及细胞培养物澄清的方法。具体地,本发明公开了可用于如抗体等生物医药分子的制造过程的细胞培养物澄清的方法。
背景技术
如抗体等生物医药分子的制造过程是复杂的,并且其包括不同步骤,每个步骤都需要广泛优化。所述过程开始于选择用于表达和分泌所关注生物分子的细胞系。一旦被选择,此细胞系就在生物反应器中以更大规模进行扩增和培养,其中在受控条件下产生了所关注生物分子。这些步骤被称为整个生物分子制造过程的上游过程(USP)部分。
为了从含有所关注生物分子的培养基中去除残余生物质和杂质,澄清过程是必要的。此过程是生物分子纯化的第一步骤,并且其通常被视为处于USP与纯化步骤(被称为下游过程(DSP))之间的接口处。细胞培养物澄清需要涉及去除跨广泛大小范围的不同类型的杂质,包含残余细胞、细胞碎屑以及最终的DNA和宿主细胞蛋白(HCP)的多个步骤。重要的是,澄清过程必须满足下游过程在产物稳定性和纯度的方面的要求,并且同时其需要强大到足以适应细胞培养物的最终变化。
澄清步骤的挑战是产生浊度低的经澄清细胞培养物,以便与随后的纯化过程相容;例如,由于杂质的存在,低质量的经澄清收获物可能会导致纯化柱快速磨损。这可能影响纯化树脂的寿命以及整个工艺设计,并且最终影响其产率和商品成本。鉴于细胞培养物澄清的重要性,必须高度了解所述过程和其严格控制;此外,关键的是优化细胞澄清步骤以有效降低细胞培养物的浊度并改善所制造生物分子的质量、产率、澄清过程的时间和成本与其还相对于其它USP和DSP步骤的稳健性之间的平衡。
发明内容
本发明涉及细胞培养物澄清的方法。在如治疗性抗体等所关注生物分子的制造过程中,细胞培养物澄清是允许从细胞培养基中去除如细胞、细胞碎屑和杂质等细胞培养材料以获得经澄清细胞培养物的步骤,其中主要所关注生物分子存在于细胞培养基中。重要的是,初始细胞培养物的浊度越高,就越难以有效地澄清细胞培养物。鉴于在生物反应器中制造生物分子的生产率如今已得以升高,这意味着培养物中的细胞浓度升高,生物质积累水平对澄清过程提出了挑战。因此,澄清系统在高通量下降低细胞培养物的浊度的能力是根本,当以高密度培养细胞时尤其如此。
具体地,本发明涉及一种用于澄清细胞培养物的方法,所述细胞培养物包括包含所关注生物分子并且浊度介于约1000NTU与约6000NTU之间的细胞培养物,所述方法的特征在于包括:(a)一级澄清步骤,所述一级澄清步骤去除大小等于或大于约0.2μm的细胞培养材料;以及(b)包括过滤的二级澄清步骤,所述二级澄清步骤去除大小等于或小于4μm的细胞培养材料,其中所述二级澄清步骤的最大通量等于或大于约80L/m
更具体地,根据本发明,一级澄清选自包括深度过滤、离心和絮凝的组。
在一个实施例中,一级澄清是通过排除范围介于约0.25μm与约30μm之间的第一深度过滤器执行的深度过滤。在更具体的实施例中,第一深度过滤器的排除范围介于约5μm与约30μm之间,或介于约0.5μm与约10μm之间。
在一级澄清的另一个实施例中是在介于约500G与约3000G之间的相对离心场下执行的持续介于1分钟与10分钟之间的时间的离心。
在另外的实施例中,一级澄清是用絮凝剂执行的絮凝,所述絮凝剂选自包括磷酸钙、辛酸、二价阳离子或带正电的聚合物,如聚胺、壳聚糖或聚二烯丙基二甲基氯化铵的组并且以约0.03v/v%的百分比添加到细胞培养物中。
根据本发明的方法,二级澄清通过排除范围等于或小于约3.5μm的第二深度过滤器执行。
在本发明的一个方面,当细胞培养物的浊度小于约3000NTU时,最大通量等于或大于约250L/m
在另一方面,当细胞培养物的浊度等于或大于约3000NTU时,最大通量等于或大于约80L/m
在另外的方面,当所述细胞培养物的浊度等于或小于3000NTU时,所述一级澄清步骤和所述二级澄清步骤通过排除范围介于约1μm与约20μm之间的单过滤器执行,所述最大通量等于或大于110L/m
在本发明的某些实施例中,一级澄清前面是声波分离的细胞培养物预处理步骤。
在一方面,本发明的方法还包括(c)生物负载降低步骤,所述生物负载降低步骤通过一个或多个排除范围等于或小于0.5μm的无菌过滤器执行,以获得包括所关注生物分子的经澄清细胞培养物。
在另一方面,本发明的方法包括在二级澄清之后通过排除范围等于小于0.2μm的膜吸收器执行的另外的过滤步骤。
在另一另外的方面,本发明的方法包括另外的步骤(d)使所述经澄清细胞培养物经受所述所关注生物分子的一个或多个纯化步骤。
根据本发明的一方面,细胞是哺乳动物细胞。
根据本发明的另一方面,所关注生物分子是抗体或其抗体片段。
本发明还公开了经受前述权利要求中任一项所述的方法的细胞培养物。
本发明还公开了一种产生药物物质的方法,所述方法包括以下步骤:
(i)在细胞培养基中接种表达所关注生物分子的细胞;
(ii)将所述细胞培养介于10天与18天的时间段,优选地培养14天;
(iii)使所获得细胞培养物经受根据本发明的澄清方法;
(iv)向经纯化所关注生物分子添加赋形剂。
除非另有定义,否则本公开中使用的所有术语,包含技术和科学术语,均具有如本公开所属领域的技术人员通常理解的含义。通过进一步指导,术语定义被包含以更好地理解本公开的教导。
如本文所用,以下术语具有以下含义:除非上下文另有明确规定,否则本文所用的“一个(a)”、“一种(an)”和“所述(the)”是指单数和复数两者。
如本文所用的术语“所关注生物分子”是指期望从可能存在于含有所关注产物的样品中的一种或多种不期望的实体,例如一种或多种杂质纯化或分离的所关注产物。在本发明的一个优选实施例中,所关注生物分子是多肽。在更优选的实施例中,所关注生物分子是蛋白质。在甚至更优选的实施例中,所关注生物分子是抗体或其抗体片段。在本发明的一个特别优选的实施例中,所关注生物分子是单克隆抗体或其单克隆抗体片段。
在本发明中,术语“抗体”和术语“免疫球蛋白”可互换使用。如本文所涉及的术语“抗体”包含全长抗体和抗体片段。抗体是通过浆细胞产生的在免疫应答中通过识别和灭活抗原分子发挥作用的糖蛋白。在哺乳动物体内,会产生五个类别的免疫球蛋白:IgM、IgD、IgG、IgA和IgE。在天然形式中,免疫球蛋白以由以下四个多肽链构成的Y形单元的一个或多个拷贝形式存在:两条相同重(H)链和两条相同轻(L)链。共价二硫键和非共价相互作用允许链间连接;具体地,重链彼此连接,而每条轻链与重链配对。重链和轻链两者都包括N末端可变(V)区和C末端恒定(C)区。在重链中,可变区由一个可变结构域(VH)构成,并且恒定区由三个或四个恒定结构域(CH1、CH2、CH3和CH4)构成,这取决于抗体类别;而轻链包括可变结构域(VL)和单个恒定结构域(CL)。可变区含有三个高变区,所述高变区被称为互补决定区(CDR)。这些形成抗原结合位点并为抗体赋予特异性。CDR位于四个更保守的区之间,所述更保守的区被称为限定CDR的位置的框架区(FR)。结构域位置的灵活性促进了抗原结合;例如,含有三个恒定重结构域的免疫球蛋白呈现了位于CH1与CH2之间的间隔子,所述间隔子被称为允许移动以用于与目标相互作用的“铰链区”。开始于呈其完整、天然形式的抗体,酶促消化可能导致抗体片段的生成。例如,IgG与内切肽链酶木瓜蛋白酶一起温育导致铰链区中的肽键破裂,并且导致随后产生了三个片段:两个抗体结合(Fab)片段,每个抗体结合片段都能够进行抗原结合;以及一个可结晶片段。相反,通过胃蛋白酶进行消化得到一个由通过二硫键连接的两个Fab单元构成的大片段F(ab')2以及由Fc区降解产生的许多小片段。
如本文所用的术语“抗体片段”包含全长抗体的一个或多个部分。抗体片段的非限制性实例包含:(i)由两个恒定重链片段构成的可结晶的片段(Fc),所述可结晶的片段由IgA、IgD和IgG中的CH2和CH3结构域以及IgE和IgM中的CH2、CH3和CH4结构域组成,并且通过二硫键和非共价相互作用配对;(ii)抗原结合的片段(Fab),所述抗原结合的片段由通过二硫键连接的VL、CL和VH、CH1组成;(iii)Fab',所述Fab'由通过二硫键连接的VL、CL和VH、CH1和来自铰链区的一个或多个半胱氨酸残基组成;(iv)Fab'-SH,所述Fab'-SH是半胱氨酸残基含有游离巯基的Fab'片段;(v)F(ab')2,所述F(ab')2由在铰链区处通过二硫键连接的两个Fab片段组成;(vi)可变片段(Fv),所述Fv由通过非共价相互作用配对在一起的VL和VH链组成;(vii)单链可变片段(scFv),所述scFv由通过接头配对在一起的VL和VH链组成;(ix)双特异性单链Fv二聚体;(x)scFv-Fc片段;(xi)Fd片段,所述Fd片段由VH和CH1结构域组成;(xii)单结构域抗体dAb,所述dAb由VH结构域或VL结构域组成;(xiii)双抗体,所述双抗体由两个scFv片段组成,其中VH和VL结构域通过短肽连接,所述短肽防止其在同一链中配对并且允许两个scFv非共价二聚化;(xiv)三价的10种三抗体,其中VH和VL结构域通过短肽连接的三个scFv形成三聚体。(xv)半IgG,所述半IgG包括单条重链和单条可变链。
取决于其性质,抗体和抗体片段可以是单体的或多体的、单价的或多价的、单特异性的或多特异性的。
如本文所用的术语“单特异性抗体”是指具有一个或多个结合位点且均结合同一表位的任何抗体或片段。
如本文所用的术语“多特异性抗体”是指具有可以结合同一抗原的不同表位或不同抗原的多于一个结合位点的任何抗体或片段。多特异性抗体的非限制性实例是具有可以结合同一抗原的两个不同表位或两个不同抗原的两个结合位点的双特异性抗体。
如本文所用的术语“单克隆抗体”(MAb)是指含有由独特轻链基因产物和独特重链基因产物组成的抗体分子的仅一个分子物种的抗体分子群。具体地,在群体的所有分子中,单克隆抗体的互补决定区(CDR)是相同的。MAb含有能够与抗原的其特征在于对其具有独特结合亲和力的特定表位免疫反应的抗原结合位点。
如抗体等所关注生物分子可以通过在宿主细胞中引入对所述所关注生物分子进行编码的遗传材料来产生。术语“宿主细胞”是指通过人工引入的遗传材料编码化的所关注生物分子所表达的所有细胞,包含直接引入外源核酸的那些细胞和其后代。在宿主细胞中,其可以被引入例如,通过转换、转染、感染或注射对所关注生物分子进行编码的表达载体(构建体),如质粒等。此类表达载体通常含有对所关注生物分子进行编码的序列的转录和翻译所必需的元件。本领域的技术人员众所周知并实践的方法可用于构建含有对所关注蛋白质进行编码的序列以及合适的转录和翻译控制元件的表达载体。这些方法包含体外重组DNA技术、合成技术和体内基因重组。适合作为宿主细胞的细胞系包含且不限于细菌、哺乳动物、昆虫、植物和酵母细胞。通常用于表达和产生治疗性抗体的细胞系包含哺乳动物细胞系,如中国仓鼠卵巢(CHO)细胞、NSO小鼠骨髓瘤细胞、人宫颈癌(HeLa)细胞和人胚胎肾(HEK)细胞。
在本发明的一个特定实施例中,所培养细胞是哺乳动物细胞,更具体地,其是CHO细胞。
如本文所用的术语“细胞培养”和“培养”可互换并且指代细胞在受控人工条件下的生长和/或传播和/或维持,并且其表示包括细胞培养基和细胞培养材料的细胞培养物,所述细胞培养材料包括细胞、细胞碎屑(例如在细胞死亡时生成的)、如DNA、RNA和宿主细胞蛋白(HCP)等胶体颗粒以及所培养细胞分泌的(生物)分子,如所关注生物分子。细胞培养物的细胞可以在包括细胞培养基的容器中悬浮培养或附着于固体基质。例如,细胞培养物可以在管、旋转管、烧瓶、袋、滚瓶、生物反应器中生长。在本发明的某些实施例中,在细胞培养结束时,所关注生物分子的所获得滴度低于10g/L,在其它实施例中,所关注生物分子的所获得滴度介于约1g/L与约10g/L之间。所关注生物分子的所获得滴度的非限制性实例包含:约0.1g/L、约0.5g/L、约1g/L、约1.5g/L、约2g/L、约2.5g/L、约3g/L、约3.5g/L、约4g/L、约4.5g/L、约5g/L、约5.5g/L、约6g/L、约6.5g/L、约7g/L、约7.5g/L、约8g/L、约8.5g/L、约9g/L、约9.5g/L、约10g/L。
待澄清的细胞培养物在本文中也称为细胞培养液(CCF)。
当所关注生物分子的产生具有商业目的时,宿主细胞通常在生物反应器中在有助于其生长和所述所关注生物分子的表达的条件下培养。如本文所用的术语“生物反应器”是指支持生物活性环境的任何所制造或所设计装置或系统。最优培养条件是通过控制和调整几个参数获得的,所述参数包含:细胞培养基的调配、生物反应器操作参数、营养供应模态和培养时间段。必须将培养基的调配优化到受欢迎的细胞活力和繁殖;细胞培养基的成分的实例包含但不限于必需的氨基酸、盐、葡萄糖、生长因子和抗生素。重要生物反应器操作参数包含:初始细胞接种密度、温度、pH、搅拌速度、氧化和二氧化碳水平。营养素可以以不同方式提供:在分批模式培养中,所有需要的营养素都存在于初始基础培养基中,并且在废物积累时使用直至耗尽为止;在分批进给培养物中,提供另外的进给培养基以防止营养素耗竭并延长培养;不同的是,在灌注模态中,为培养中的细胞不断补充含有在生物反应器中流动从而去除细胞废物的营养素的新鲜培养基。培养期很重要,因为其需要长到足以使细胞产生一致量的产物,但不能太长而损害其活力。通常使用的生物反应器通常是圆柱形的,大小范围为升到立方米,并且通常由不锈钢制成。在本文所述的实施例中,生物反应器由塑料或不锈钢制成。设想了生物反应器的总体积可以是范围为100mL到高达20000升或更多的任何体积,这取决于特定过程。生物反应器体积的非限制性实例包含约100mL、约200mL、约500mL、约800mL、约1L、约5L、约10L、约20L、约30L、约40L、约50L、约60L、约70L、约80L、约90L、约100L、约200L、约300L、约400L、约500L、约600L、约700L、约800L、约900L、约1000L、约2000L、约3000L、约4000L、约5000L、约6000L、约7000L、约8000L、约9000L、约10000L、约15000L、约20000L。
可用于本发明的生物反应器包含但不限于小规模生物反应器、一次性生物反应器(SUB)、摇瓶容器、大规模生物反应器、分批生物反应器、分批进给生物反应器。在本发明的一个特定实施例中,细胞在细胞培养基中以分批进给模式在3到5L或50L SUB中培养,持续一定数量的天数,所述天数为:介于10天与20天之间,优选地介于12天与18天之间,最优选地持续至少13天,甚至更优选地持续14天。
术语“细胞培养基”以及“培养基(culture medium)”和“培养基(medium)”在本文中可互换使用,并且其指代用于使如动物细胞(例如哺乳动物细胞)等细胞生长的营养液。此营养液通常包含细胞附着、生长和维持细胞环境所需的各种因素。例如,典型营养液可以包含基础培养基调配物、取决于细胞类型的各种补充剂以及有时抗生素。在细胞培养期间,细胞培养基还可以含有细胞培养材料,如细胞废物产物、宿主细胞蛋白(HCP)和来自裂解细胞的材料。在细胞培养过程期间,培养基的组成可随以时间推移而变化。
如本文所用的术语“澄清(clarify)”、“澄清(clarification)”、“澄清步骤”、“澄清过程”可互换,并且通常其是指有助于从细胞培养物中去除细胞培养材料的一部分,如去除细胞、细胞碎屑和胶体颗粒,以获得包括所关注生物分子的经澄清细胞培养物,在本文中也被称为经澄清细胞培养液(CCCF)的一个或多个步骤。
澄清步骤的效率对于促进所关注生物分子的纯化的随后下游处理步骤至关重要。细胞培养物的对澄清步骤有影响的特性包含总细胞浓度、细胞活力、待澄清的细胞培养物的初始浊度、通过所培养细胞产生的生物分子的浓度。术语“总细胞浓度”(TCC)是指给定体积的培养物中细胞的数量。术语“活细胞浓度”(VCC)是指给定体积的培养物中活细胞的数量,如通过标准活力测定(如台盼蓝染料排除方法(trypan blue dye exclusion method))所确定的。活细胞的百分比称为“活力”。一般而言,较高TCC意味着从细胞培养物中去除的生物质较高,并且因此对澄清的影响较大。这对于较低活力类似,条件是细胞碎屑的存在较高。术语“浊度”是指由大量单个颗粒引起的液体的混浊性或浑浊性。具体地,所述浊度表明液体内能够进行光漫射的材料和小颗粒的量。更具体地,细胞培养物的浊度可能是由于细胞、细胞碎屑、如DNA、RNA和宿主细胞蛋白(HCP)等胶体颗粒以及所关注生物分子存在。澄清步骤的目的可以被视为是将细胞培养物的初始浊度降低到经澄清细胞培养物的较低浊度,以获得具有最高浓度的所关注生物分子和存在较少其它细胞培养材料的经澄清细胞培养物。在本发明的一个实施例中,已经设置了经澄清细胞培养物(这里也被称为CCCF)的最大浊度的阈值。具体地,CCCF的浊度已被设置为等于或小于10NTU。尽管如此,在浊度高于10NTU时,澄清仍可能有效,但最终在澄清期间使用的无菌过滤器阻塞的风险会增加。细胞培养物的高浊度,如高于2500NTU或高于3000NTU可能表示困难的澄清攻击。本发明的细胞培养物的浊度介于约500NTU与约8000NTU之间,更具体地介于约1000NTU与约6000NTU之间,在某些实施例中,浊度介于约1000NTU与3000NTU之间,更具体地介于约1200NTU与约2500NTU之间;在其它实施例中,浊度介于约3000NTU与6000NTU之间,更具体地介于约3500NTU与约5800NTU之间。细胞培养物浊度的非限制性实例包含:约500NTU、约800NTU、约1000NTU、约1200NTU、约1400NTU、约1600NTU、约1800NTU、约2000NTU、约2200NTU、约2400NTU、约2600NTU、约2800NTU、约3000NTU、约3200NTU、约3400NTU、约3600NTU、约3800NTU、约4000NTU、约4200NTU、约4400NTU、约4600NTU、约4800NTU、约5000NTU、约5200NTU、约5400NTU、约5600NTU、约5800NTU、约6000NTU。在某些实施例中,细胞培养物的浊度小于约3000NTU,例如其介于1200NTU与2500NTU之间,更具体其选自包括约800NTU、约1000NTU、约1200NTU、约1400NTU、约1600NTU、约1800NTU、约2000NTU、约2200NTU、约2400NTU、约2600NTU、约2800NTU、约2900NTU的组。在某些其它实施例中,细胞的浊度等于或大于约3000NTU,例如等于或大于约3500NTU、等于或大于约4000NTU、等于或大于约4500NTU、等于或大于约5000NTU、等于或大于约5500NTU或介于约3000NTU与约8000NTU之间,更具体地介于约3000NTU与约6000NTU之间,甚至更具体地介于约3500NTU与约5800NTU之间,更具体地选自包括约3000NTU、约3200NTU、约3400NTU、约3600NTU、约3800NTU、约4000NTU、约4200NTU、约4400NTU、约4600NTU、约4800NTU、约5000NTU、约5200NTU、约5400NTU,约5600NTU、约5800NTU、约6000NTU的组。本发明还包含处于以上所述值的任何中间值处的浊度值。
为了使澄清方法有效,也重要的是使通量最大化。如本文所用,术语“通量”或“负载容量”或“容量”可互换并且表明通过澄清操作单元澄清的体积,例如通过过滤器过滤的体积,更具体地,由过滤器的面积归一化的体积(L/m
细胞培养物澄清可以开始于一级澄清步骤。如本文所用的术语“一级澄清”和“一级回收”可互换并且是指去除如全细胞和细胞碎屑等大颗粒。一级澄清之后可以是二级澄清步骤。如本专利申请所使用的术语“二级澄清”和“二级回收”可互换并且表明去除了较小颗粒。
一级澄清和二级澄清可能需要一个或多个澄清操作单元,如过滤器、离心机、声分离器等,以及其组合。
在一个实施例中,本发明公开了一种用于澄清包含所关注生物分子并且浊度介于约1000NTU与约6000NTU之间的细胞培养物的方法,所述方法的特征在于包括:(a)一级澄清步骤,所述一级澄清步骤去除大小等于或大于约0.2μm的细胞培养材料;以及(b)包括过滤的二级澄清步骤,所述二级澄清步骤去除大小等于或小于0.4μm的细胞培养材料,其中所述二级澄清步骤的最大通量等于或大于约80L/m
在本发明的一个更具体的实施例中,一级澄清步骤是包括深度过滤、离心和絮凝的组。
在本发明的一个甚至更具体的实施例中,一级澄清步骤是深度过滤。
如本文所用,术语“深度过滤”是指利用具有一定孔隙度的过滤器来将培养基的颗粒保留在整个培养基中而不是仅保留在表面上的技术。例如在生物医药产业中使用的深度过滤器的实例包含呈透镜状盘或筒形式的含有小规模的过滤板的一次性装置。盘或筒可以组装到更大规模的多层外壳中。深度过滤器通常由纤维素纤维和如一起结合成聚合树脂的硅藻土或珍珠岩等助滤剂构成。在一些情况下,纤维素纤维可以被完全合成聚合纤维,如聚丙烯或聚苯乙烯代替。这些纤维形成具有一定孔隙度的三维网络。过滤器的渗透性和保留特性与这些纤维的长度和压实度直接相关。过滤器矩阵的孔隙度可以随过滤器深度而变化,从而允许覆盖宽范围的颗粒排除。可用于本发明的深度过滤器的非限制性实例包括由纤维素和/或树脂和/或合成介质和/或聚丙烯和/或助滤剂制成的过滤器。深度过滤器可以适用于一级和/或二级回收两者,或适用于仅一级或二级回收。适用于一级和/或二级回收的过滤器也被称为“单过滤器”。单过滤器可以单独应用,以执行一级回收和二级回收两者,或者其可以用作用于一级回收并与用于二级回收的过滤器的后续使用联合的过滤器;或者其可以用作用于二级回收,例如在一级回收的离心步骤之后的过滤器。在本发明中,单过滤器也被称为“SF”,用于一级澄清的过滤器被称为“PCF”,并且用于二级澄清的过滤器被称为“SCF”。
在本发明中,术语“标称排除范围”、“排除范围”、“保留范围”和“等级”可互换,并且其是指过滤器保留特定大小的颗粒的能力。例如,排除范围介于1μm与10μm之间的过滤器,其能保留大小介于1μm与10μm之间的颗粒;大于排除范围的最高极限的颗粒不会进入到过滤器中,而是保持在表面上。深度过滤器的排除范围可以从高于60μm到低于0.1μm变化。过滤器的孔隙度,即孔径,允许采用大小排除机制,以去除如全细胞和细胞碎屑等大颗粒。在一定程度上,深度过滤器还可以去除小于孔径的胶体污染物,如HCP或DNA。这些污染物的去除通过带正电的过滤器矩阵进行。过滤器矩阵的正电荷由将过滤器组件结合在一起的聚合树脂带来。过滤器矩阵与胶体颗粒之间的电动相互作用导致去除那些小污染物,而较大颗粒则被过滤矩阵的孔隙捕获。
在本发明的一个方面,一级澄清由选自包括用于一级澄清的深度过滤器和单过滤器的组的第一深度过滤器执行。在本发明的另一方面,第一深度过滤器的排除范围等于或大于约0.1μm并且等于或小于约50μm,更具体地,排除范围介于约0.25μm与约30μm之间。在某些特定实施例中,排除范围介于约1μm与约20μm之间,或介于约5μm与约30μm之间,优选介于约6μm与约30μm之间,或介于约0.5μm与约10μm之间,优选地介于约0.55μm与约8μm之间,或介于约0.2μm与约2μm之间,或介于约1.5μm与约10μm之间,或介于约0.7μm与约5μm之间,或介于约0.25μm与约5μm之间。在具体方面,第一深度过滤器的排除范围选自包括至少约0.1μm、至少约0.2μm、至少约0.5μm、至少约0.7μm、至少约1μm、至少约1.5μm、至少约2μm、至少约5μm、至少约7μm、至少约10μm、至少约20μm、至少约30μm的组。本发明还包含排除范围在以上所述范围的任何中间值内的第一深度过滤器。
在本发明的另一个特定实施例中,一级澄清步骤是离心。
如本文所用,术语“离心”是指允许通过使细胞培养物经受离心力来分离颗粒的技术,并且其中颗粒是根据其密度进行分离的。
根据本发明的一方面,离心可以在介于约100G与约15000G之间的相对离心场下,更具体地在选自包括以下的组的相对离心场下进行:约100G、约200G、约400G、约500G、约600G、约800G、约1000G、约1200G、约1400G、约1500G、约1600G、约1800G、约2000G、约2200G、约2400G、约2500G、约2600G、约2800G、约3000G、约3200G、约3400G、约3500G、约3600G、约3800G、约4000G、约4200G、约4400G、约5500G、约5600G、约5800G、约6000G、约6200G、约6400G、约6500G、约6600G、约6800G、约7000G、约7200G、约7400G、约7500G、约7600G、约7800G、约8000G、约8200G、约8400G、约8500G、约8600G、约8800G、约9000G、约9200G、约9400G、约9500G、约9600G、约9800G、约10000G、约9200G、约9400G、约9500G、约9600G、约9800G、约10000G、约12000G、约12500G、约13000G、约13100G、约13500G、约14000G、约14500G、约15000G。根据本发明的离心可以以连续流动或持续设置时间运行。在本发明的某些方面,离心运行持续介于10秒与20分钟之间的时间,具体地持续选自包括以下的组的时间:约10秒、约30秒、约1分钟、约5分钟、约10分钟、约12分钟、约15分钟、约17分钟、约20分钟。在本发明的一个更具体的方面,离心在介于约100G与约6000G之间,更具体地在约500G与3000G之间的相对离心场下运行,持续介于10秒与20分钟之间的时间。在一个更具体的方面,离心在选自包括至少约100G、至少约500G、至少约1000G、至少约1500G、至少约2000G、至少约2500G、至少约3000G、至少约3500G、至少约4000G、至少约5000G的组的相对离心场下运行,持续选自包括至少约10秒、至少约30秒、至少约1分钟、至少约5分钟、至少约10分钟、至少约15分钟、至少约20分钟的组的时间。在一些实施例中,离心在等于或大于约500G并且等于或小于3000G的相对离心场下运行,持续介于1分钟与10分钟之间的时间。在一个优选实施例中,离心在约500G或约3000G的相对离心场下运行,更具体地离心在约500G的相对离心场下运行持续约1分钟,或在约3000G的相对离心场下运行持续约5分钟。本发明还包含处于以上所述范围的任何中间值的相对离心场下运行的离心。
在本发明的另一个具体实施例中,一级澄清步骤是絮凝。
术语“絮凝”是指通过向悬浮液添加合适的絮凝剂引起的不溶性颗粒的聚集、沉淀和/或附聚。通过增加悬浮液中存在的不溶性组分的粒度,提高了固体/液体分离(例如通过过滤)的效率。细胞培养物的絮凝导致“絮凝物”的形成,所述絮凝物包括宿主细胞杂质,如细胞材料,包含细胞、细胞碎屑、宿主细胞蛋白、DNA和存在于其中的其它组分。絮凝过程可以通过不同方法引发,包含降低细胞培养物pH或添加絮凝剂(flocculant,也被称为絮凝剂(flocculating agent))。絮凝剂的非限制性实例包含:由于其与细胞和细胞碎屑的带负电的表面相互作用而诱导颗粒聚集的磷酸钙、辛酸、二价阳离子或带正电的聚合物,如多胺、壳聚糖或聚二烯丙基二甲基氯化铵(例如,pDADMAC)。
在本发明的一个实施例中,絮凝剂是带正电的聚合物。在更具体的实施例中,絮凝剂是聚二烯丙基二甲基氯化铵,并且其以等于或大于约0.005v/v且等于或小于0.1v/v%的百分比添加到细胞培养物中。在具体聚二烯丙基二甲基氯化铵中,其以选自包括约0.005v/v%、约0.01v/v%、约0.03v/v%、约0.05v/v%、约0.08v/v%、约0.1v/v%的组的百分比添加到细胞培养物中。在一个优选实施例中,将聚二烯丙基二甲基氯化铵以约0.03v/v%的百分比添加到细胞培养物中。本发明还包含以以上所述范围的任何中间百分比值向细胞培养物中添加絮凝剂。
在本发明的另一个具体实施例中,二级澄清步骤通过第二深度过滤执行。
在本发明的一个方面,第二澄清由选自包括用于二级澄清的深度过滤器、单过滤器和后絮凝过滤器的组的第二深度过滤器执行。在本发明的另一方面,第二深度过滤器的排除范围介于约0.01μm与约10μm之间,更具体地介于约0.05μm与约5μm之间,甚至更具体地介于约0.1μm与约4μm之间,在另外的特定实施例中,第二深度过滤器的排除范围介于约0.2μm与约3.5μm之间。在一个具体方面,第二深度过滤器的排除范围等于或小于约3.5μm,或等于或小于约3μm,或等于或小于约2μm,或等于或小于约1μm,或等于或小于约0.5μm,或等于或小于约0.2μm,或等于或小于约0.1μm。本发明还包含排除范围为以上所述值的任何中间值的第二深度过滤器。
在本发明的一个方面,二级澄清步骤的最大通量等于或大于约50L/m
在另一方面,一级和二级澄清导致浊度降低等于或大于约80%,或等于或大于约85%,优选地等于或大于约90%,更优选等于或大于小于约95%,甚至更优选地等于或大于约98%,最优选地等于或大于约99%;更具体地,浊度降低选自包括80%、约81%、约82%、约83%、约84%、约85%、约86%、约87%、约88%、约89%、约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%、约99%、约100%的组。本发明的浊度降低还为以上所述值的任何中间值。
在本发明的某些实施例中,当细胞培养物的浊度小于约3000NTU,例如等于或小于约2500NTU,等于或小于约2000NTU,或介于800NTU与3000NTU之间,更具体地介于1200NTU与2500NTU之间时,在一级和二级澄清之后,最大通量等于或大于约100L/m
在其它实施例中,当细胞培养物的浊度等于或大于约3000NTU,例如等于或大于约3500NTU,等于或大于约4000NTU,等于或大于约4500NTU,等于或大于约5000NTU,等于或大于约5500NTU,或介于约3000NTU与约8000NTU之间,更具体地介于约3000NTU与约6000NTU之间,甚至更具体地介于约3500NTU与约5800NTU之间时,并且当使用用于一级澄清的深度过滤器和用于二级澄清的深度过滤器的组合时,最大通量等于或大于约50L/m
在本发明的某些实施例中,当使用用于一级澄清的深度过滤器和用于二级澄清的深度过滤器的组合时,第一深度过滤器和第二深度过滤器之间的表面比率选自包括1:1、2:1、1:2的组。
在本发明的另一方面,当细胞培养物的浊度小于3000NTU时,通过排除范围介于约1μm与约20μm之间的单过滤器执行一级澄清步骤和二级澄清步骤,使得最大通量等于或大于约80L/m
在本发明的一个实施例中,一级澄清前面是声波分离的细胞培养物预处理步骤。在本发明的另一方面,声波分离可以用于一级澄清步骤。
如本文所用的术语“声波分离”(AWS)是指通过迫使细胞培养物进入到施加捕获细胞并诱导其聚丛的声力的至少一个流动通道中,之后使细胞通过重力下落来降低所述细胞培养物的浊度的技术。在本发明的一个实施例中,通过颇尔公司(Pall)的Cadence
在本发明的一个实施例中,第二澄清之后是生物负载降低。
如本文所用的术语“生物负载降低”是指在一级和二级澄清之后获得的流体中的微生物的数量降低。通常,生物负载降低被视为澄清过程的最后步骤并且包括一个或多个无菌纯化步骤。在本发明的一个实施例中,生物负载降低通过排除范围等于或小于约0.5μm的至少一个无菌过滤器执行。在一个更具体的实施例中,生物负载降低通过排除范围为约0.2μm到约0.45μm的至少一个无菌过滤器执行。
在本发明的一个方面,二级深度过滤之后可以是通过排除范围等于小于0.2μm的膜吸收器执行的另外的过滤。
在澄清过程结束时,经澄清细胞培养物可以进一步经受一个或多个纯化步骤以分离和回收所关注生物分子。标准纯化方法包含使用如FPLC和HPLC等系统在大气压或高压下执行的色谱技术,所述色谱技术包含离子交换、疏水相互作用、亲和力、施胶或凝胶过滤以及反相。纯化方法还包含电泳、免疫学、沉淀、透析和色谱聚焦技术。超滤和渗滤技术与蛋白浓缩相结合还是有用的。
本发明还公开了经受前述权利要求中任一项所述的方法的细胞培养物。
本发明还公开了一种产生药物物质的方法,所述方法包括以下步骤:
(i)在细胞培养基中接种表达所关注生物分子的细胞;
(ii)将所述细胞培养介于10天与18天之间的时间段,例如培养选自包括约10天、约11天、约12天、约13天、约14天、约15天、约16天、约17天、约18天的组的时间段,优选地培养14天;
(iii)使所获得细胞培养物经受根据本发明的澄清方法;
(iv)向经纯化所关注生物分子添加赋形剂。
除非另有定义,否则本公开中使用的所有术语,包含技术和科学术语,均具有如本公开所属领域的技术人员通常理解的含义。通过进一步指导,术语定义被包含以更好地理解本公开的教导。
图1:允许确定对浊度的最优影响的pDADMAC剂量研究
图2:澄清过程中压力(巴)和通量(L/m
图3:澄清过程中浊度(NTU)和通量(L/m
图4:浊度(NTU)和通量(L/m
图5:压力(巴)和通量(L/m
图6:为确定在最坏情况CCF的情况下的限制的通量(L/m
图7:在一级过滤器的表征中压力(巴)和通量(L/m
图8:在一级过滤器的表征中浊度(NTU)和通量(L/m
图9:在二级过滤器表征中压力(巴)和通量(L/m
图10:在二级过滤器表征中浊度(NTU)和通量(L/m
图11:在代表性情况CCF的情况下一级澄清过滤器表征中压力(巴)和通量(L/m
图12:在代表性情况CCF的情况下一级澄清过滤器表征中浊度(NTU)和通量(L/m
图13:在代表性情况CCF的情况下二级澄清过滤器表征中压力(巴)和通量(L/m
图14:在代表性情况CCF的情况下二级澄清过滤器表征中浊度(NTU)和通量(L/m
图15:在一级澄清过滤器表征中压力(巴)和通量(L/m
图16:在一级澄清过滤器表征中浊度(NTU)和通量(L/m
图17:在二级澄清过滤器表征中压力(巴)和通量(L/m
图18:在二级澄清过滤器表征中浊度(NTU)和通量(L/m
图19:过滤器组合PCF2+SCF2和PCF1+SCF1的一级和二级入口压力(巴)与通量(L/m
图20:过滤器组合PCF2+SCF2和PCF1+SCF1的浊度(NTU)与通量(L/m
图21:在攻击性CCF的情况下一级和二级澄清过滤器表征中过滤器阻力(巴/LMH)和通量(L/m
图22:在攻击性CCF的情况下一级和二级澄清过滤器表征中浊度(NTU)与通量(L/m
图23:在过滤器全局比较中过滤器阻力(巴/LMH)和通量(L/m
图24:在过滤器全局比较中浊度(NTU)和通量(L/m
图25:在离心步骤的评价中浊度(NTU)和RCF(G)的相关性
图26:最佳所选过滤器之间的最大负载容量的比较
图27:在离心步骤的评价中活力(%)和RCF(G)的相关性
图28:在离心步骤的评价中LDH(U/L)和RCF(G)的相关性
图29:解冻之后直接由经解冻CCF提取的图像
图30:以500g离心1分钟之后由CCF提取的图像
图31:以3000g离心5分钟之后由CCF提取的图像
图32:使用最坏情况CCF和SF1过滤器作为离心步骤评价的一部分的压力(巴)和通量(L/m
图33:使用最坏情况CCF和SF1过滤器作为离心步骤评价的一部分的浊度和通量(L/m
图34:在离心评价中压力(巴)和通量(L/m
图35:在进行或不进行先前CCF离心的情况下过滤器中过滤器阻力(巴/LMH)和通量(L/m
图36:在进行或不进行先前CCF离心的情况下过滤器中浊度(NTU)和通量(L/m
图37:在絮凝研究中压力(巴)和通量(L/m
图38:在絮凝研究中浊度(NTU)和通量(L/m
图39:AWS对深度过滤、压力(巴)与通量(L/m
图40:AWS对深度过滤、浊度(NTU)与通量(L/m
图41:SF1过滤器的压力监测
图42:SF1过滤器的浊度监测
图43:SF1过滤器的LDH和滴度监测
图44:过滤器组合SF1+SCF1、PCF1+SCF1和PCF2+SCF2的压力监测
图45:过滤器组合SF1+SCF1、PCF1+SCF1和PCF2+SCF2的浊度监测
图46:过滤器组合PCF1+SCF1、PCF1+2xSCF1和PCF2+SCF2的压力监测
图47:过滤器组合PCF1+SCF1、PCF1+2xSCF1和PCF2+SCF2的浊度监测
图48:过滤器组合PCF1+SCF1、PCF1+2xSCF1和PCF2+SCF2的LDH监测
图49:与来自最佳(Exp2)、基本(Exp3和Exp4)和最坏情况(Exp5)实验的CCF的压力比较
图50:与来自最佳(Exp2)、基本(Exp3和Exp4)和最坏情况(Exp5)实验的CCF的浊度比较
图51:与来自基本(Exp3和Exp4)和最坏情况(Exp5)实验的CCF的LDH比较
图52:随时间推移用于计算Exp6试验中的实验流量的所收集重量
图53:小规模(Exp5)与工作台规模(Exp6)试验之间的压力比较
图54:小规模(Exp5)与工作台规模(Exp6)试验之间的浊度比较
图55:工作台规模试验的不同状态下的Vicell图片.A-1巴采样下的后PCF2,B-1巴采样下的后SCF2,C-在试验结束时采样的后SCF2
图56:小规模(Exp5)与工作台规模(Exp6)试验之间的LDH比较
图57:随时间推移用于计算Exp7和Exp8试验中的实验流量的所收集重量
图58:小规模(Exp9)与工作台规模(Exp7和Exp8)试验之间的压力比较
图59:小规模(Exp9)与工作台规模(Exp7和Exp8)试验之间的浊度比较
图60:试点规模澄清的实验流量
图61:试点规模澄清的通量
图62:试点规模澄清的压力
图63:试点规模澄清的浊度
图64:试点规模澄清的LDH
图65:试点规模澄清的CEDEX滴度
实例1:材料和方法
澄清实验的实施需要连续细胞培养液(CCF)生成,以不间断地执行研究。在这些研究中使用了表达具有不同物理和化学性质的抗体的CHO细胞系。使用3 L工作台规模生物反应器生成了另外的CCF。
细胞系的特性和培养14天之后典型细胞培养参数的实例在表1中进行了汇总。
表1:比较细胞系
细胞培养物状态的评估需要监测如细胞密度、活力和平均细胞直径等不同生物参数以及还有如代谢物定量或所关注产物的滴度等化学参数。为了进行澄清,监测参数为:培养过程结束时的活细胞浓度(VCC)、细胞培养物活力、浊度、滴度和乳酸脱氢酶(LDH)。对于浊度低的CFF,如浊度低于3000 NTU,将细胞活力用作将CCF分类为以下类别的关键因素:代表性CCF(活力>75)、攻击性CCF(60<活力<75)和最坏情况CCF(活力<60%)。
使用了细胞计数器Vi-Cell
来自罗氏公司(Roche)的Cedex Bio HT分析仪是基于与分光光度法联合的酶测定的高通量自动化代谢物分析仪,所述高通量自动化代谢物分析仪能够监测如葡萄糖、谷氨酰胺、谷氨酸、乳酸或氨等细胞肉汤的广泛范围的各种化合物。对来自细胞培养物的500μL样品进行离心,以便从上清液中分离残余生物质。还使用了此装置来监测细胞肉汤中的抗体滴度。此测定基于通过用抗血清沉淀IgG的比浊法。此方法与通常的蛋白质A HPLC方法具有高度可比性。还可以监测LDH速率。此细胞内酶涉及碳源的降解。细胞膜破裂引发了此酶释放到培养基中。因此,对细胞培养肉汤中的此酶的评估是用于监测细胞裂解速率的良好标志物。
对众多澄清替代方案的筛选需要能够并行执行不同澄清实验并监测如跨过滤器的压力和通量等过程参数的设置。
Scilog FilterTec泵是允许从同一起始CCF运行三次测量或利用三个过滤器以相同流速并行运行三个独立CCF的三头泵。将三个天平直接连接到泵上,以便随时间的推移对重量进行自动在线读取。通过Scilog传感器完成压力监测。也将传感器直接连接到泵,并且记录在线监测。将泵连接到能够监测和记录在线数据的计算机,所述在线数据包含压力、重量和流速。
对浊度进行离线跟踪以检测任何潜在堵塞或穿透。在所述过程期间通过LDH测定对细胞裂解进行评估。在关键点处对保留物进行采样,以便在需要时评估抗体质量。
由来自
对于50L一次性生物反应器(SUB)的澄清过程,目标通量为50L/m
表2:基于LMH按比例放大
深度过滤
为了通过深度过滤筛选澄清,对几种过滤器进行了测试。过滤器的特性具体在表3中进行了描述。
表3:深度过滤器的全局描述
离心
对所述实验使用了两个离心机。对于小规模实验,使用了Eppendorf离心机5810R。此离心机能够在15mL或50mL管中处理100到3000G的CCF。此离心机用于用摇瓶产生CCF的小规模离心实验。取决于在16000G的最大速度下所使用的转子,Hermle Z513离心机的最大容量为6×250ml或4×500ml,以对在生物反应器中产生的更大规模体积的CCF进行处理。
絮凝
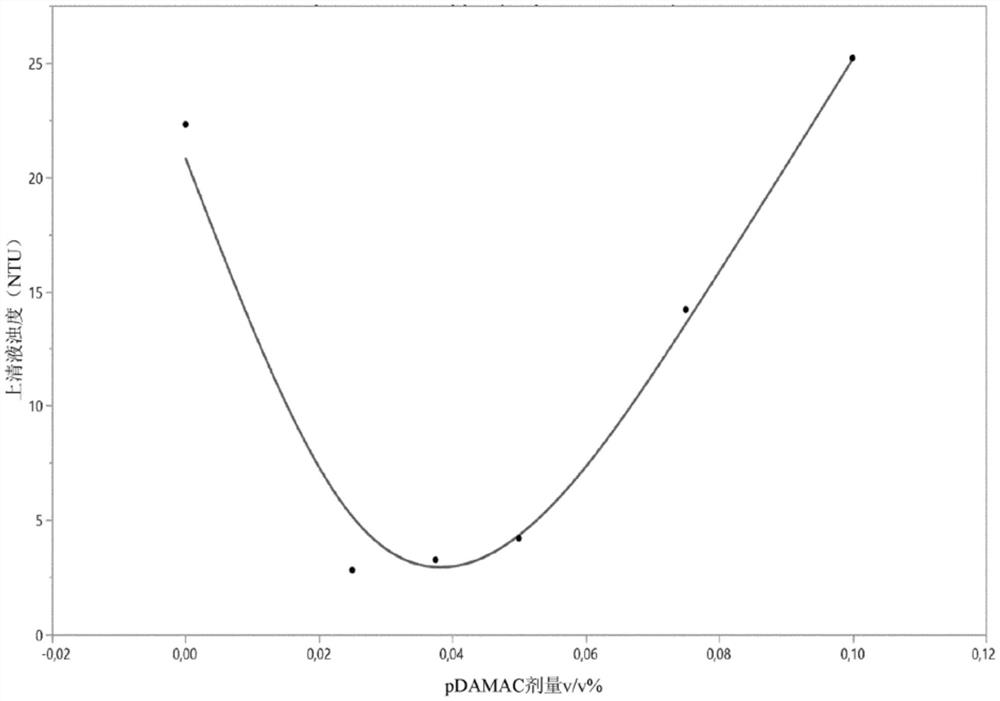
聚二烯丙基二甲基氯化铵(pDADMAC)是带正电的聚合物,其诱导带负电的颗粒(如细胞或细胞碎屑)之间的相互作用,从而引发后者的沉淀。默克密理博公司(MerckMillipore)提供了用于絮凝实验的pDADMAC 10%重量溶液。需要进行初步剂量研究以确定添加到进给溶液中的pDADMAC的合适数量。在此剂量研究期间,制备了六种具有占细胞的重量的0%到0.1%的絮凝剂的溶液。然后测量上清液的最低浊度,以确定添加到细胞肉汤中的聚合物的最佳剂量,如图1中所述。当pDADMAC的量足以引发细胞和细胞碎屑聚集时,达到最低浊度。在较高聚合物浓度下,聚集不会发生,因为聚合物本身往往会聚集。基于这些结果,决定将9mL 10%pDADMAC溶液添加到3000mL初始CCF中,以达到0.03v/v%,从而导致最低浊度。
声波分离
声波分离(AWS)是利用低频声力以跨流动通道生成三维驻波的技术。来自分批进给生物反应器的细胞培养物进入流动通道,并且当细胞通过3D驻波时,其会被声力捕获。所捕获细胞迁移到驻波的节点,并且开始聚丛在一起,直到其浮力降低并且其通过重力从悬浮液中沉淀出来的此时间为止。这允许浊度显著降低并减少对使用深度过滤和随后过滤进行生物负载控制的二级澄清的面积要求。使用来自颇尔公司的Cadence
生物负载降低
在工作台规模过滤中,生物负载降低是通过一个还原过滤器执行的,所述还原过滤器是0.45μm层和0.22μm层在单个盒中的组合(Sartopore 2)。在试点规模下,使用了两个Sartopore2过滤器来避免阻塞与无菌袋连接的第二过滤器。
实例2:通过单个深度过滤器进行的澄清方法的一级和第二回收
首先对由SF1深度过滤器构成的澄清系统的能力进行了评估。在深度过滤器之后,使用如前所述的两个无菌过滤器来完成生物负载降低。首先,使用22cm
在培养的第14天和第17天,用SF1 22cm
表4:使用的CCF的描述
如图2和图3所示,对于目标通量为50L/m
对于细胞系B,在50L/m
总而言之,在此实验中可以观察到两种不同行为,其中来自细胞密度和浊度高于细胞系B的细胞系A的CCF示出更快的穿透趋势。由于CCF A提供了与CCF B相比更大量的颗粒,尤其是全细胞和细胞碎屑,因此其会随着压力增加而诱导过滤器更快结垢,从而导致穿透。利用这两种不同CCF,可以确定对于细胞系A,SF1极限为50L/m
然后用经解冻CCF进行研究。这构成在活力方面的最坏情况研究CCF,因为冷冻会导致细胞死亡和细胞完整性丢失。因此,预期CCF有大量将可能堵塞过滤器的碎屑。此CCF可以被视为最坏情况。进行此研究以预测和了解最坏情况条件下的SF1行为,以确定另外的过程限制。
表5:使用的CCF的描述
在图4和图5中,仅在15L/m
通过监测随时间推移滤液重量来计算通量(图6)。对于代表性细胞系A CCF观察到相同通量趋势,这意味着过滤器的结垢不足以损害其内部流量。但是经解冻CCF示出通量随时间的推移降低,这意味着过滤器结垢足以导致过滤器堵塞增加。这可能是由于产生了阻止流的大量滤液饼。
综上所述,当初始CCF的活力高于70%时,SF1工作良好。然而,SF1在生物质积累以及随后的活力下降的情况下示出限制。此情况导致SF1阻塞问题和穿透。为了优化澄清过程,如下对当前平台的替代方案进行了研究。
实例3:通过单个深度过滤器或者两个或更多个深度过滤器的组合对澄清过程进行的一级和第二回收
首先测试了其它单个深度过滤器或者两个或更多个深度过滤器的组合。
用不同过滤器在小规模内进行了比较研究。根据SF1的比率为50L/m
深度过滤器PCF1和SCF1的表征
此研究基于来自细胞系B的在2.5L Thomson中在分批进给条件下产生、在第14天收获的代表性CCF。此培养物被视为表示平台过程中的CCF,并在表6中进行了描述。此实验评估了相比于SF1当前平台(过滤器的详细描述参见表3)过滤器PCF1和SCF1的性能。
表6:代表性CCF的描述
图7和图8示出了在50L/m
PCF1过滤器的孔比SF1更宽,这导致在正常条件下(无穿透)堵塞趋势较低,但滤液浊度较高。两个PCF1复制品示出相同行为,这反映了这些过滤器的等效性能。
然后,在两种样品中对利用SF1和PCF1的一级CCCF进行汇集,以制成要用二级澄清过滤器SCF1进行澄清的最佳情况一级CCCF和攻击性CCCF。最佳情况CCCF的浊度为24NTU(SCF1),并且攻击性CCCF的浊度为118NTU(SCF1_challenging CCF)。
在图9和图10中观察到两种不同行为。在目标通量下,过滤器压力在0.2巴左右保持相同。尽管如此,对于压力为2.6巴的攻击性CCCF,在测试结束时,在200L/m
尽管存在此高压差,但未观察到穿透,因为在3NTU左右的澄清期间,两种过滤器的滤液浊度保持相同,这示出PDPE2过滤器是对穿透不敏感的耐性过滤器。
代表性CCF的此研究的结果在以下表7中进行了描述。
表7:澄清结果汇总
未将PCF1过滤器设计为作为单过滤器工作,因为从澄清一开始,其滤液浊度就高。SCF1过滤器似乎被设计为容忍浊度高的经预澄清CCF,如具有代表性CCF的PCF1过滤器的输出。
深度过滤器SF2、SF3、PCF2、PCF3、SCF2和SCF3的表征
此研究基于在分批进给条件下在2.5L Thomson中产生的在第14天从细胞系B收获的两个代表性CCF。此CCF被视为表示平台过程并且在以下表8中进行了描述。在此研究中评价了不同过滤器类型,包含可以用于一级和二级澄清的过滤器、适用于仅一级澄清或仅二级澄清的过滤器。这些过滤器是23cm
表8:代表性情况CCF的描述
在过程期间,进给流量从当前流量逐渐增加,以挑战过滤容量。如图11和图12所述,在50L/m
在SF2过滤器之间观察到小的差异,因为最大负载容量(对应于浊度与通量曲线的拐点)对于试验1为125L/m
PCF2由于其合成组成示出比PCF3更好的性能,而PCF3具有有机组成。此外,PCF2在过滤器内部具有4层膜,而PCF3具有仅2层。
对于用如图13和图14所述的具有窄孔的过滤器(SCF2和SCF3)进行的二级过滤,选择了利用PCF3和SF3过滤器的一级CCCF。此CCCF的初始浊度为31.8NTU。
在50L/m
结果在表9中进行了汇总,此表中的浊度值对应于最大负载容量。
表9:澄清结果汇总
深度过滤器PCF4、PCF5、PCF6、SCF4和SCF5的表征
在14天分批进给中生成了代表性CCF,其特性在表10中进行了描述。研究的过滤器是一级澄清过滤器PCF4、PCF5和PCF6,然后是二级澄清过滤器SCF5和SCF4(详细过滤器描述参见表3)。
表10:代表性CCF的描述
在图15和图16中,在50L/m
未穿透的一级CCCF被汇集,以测试二级澄清深度过滤器SCF4和SCF5。获得的一级CCCF的初始浊度为30.3NTU。
在50L/m
SCF5过滤器示出最佳过滤性能,因为压力随着时间推移保持稳定,而对于SCF4过滤器,压力增加较快。
过滤器性能在表11中进行了汇总。
表11:澄清结果汇总*试验因为缺乏初始材料而停止。
深度过滤器组合的表征
基于以上报告的结果,示出最佳澄清性能的过滤器是PCF1和SCF1以及PCF2和SCF2,因此对其组合进行了测试。
使用了以分批进给模式在摇瓶中培养14天的代表性CCF来对过滤器的以下组合进行了测试:PCF1+SCF1和PCF2+SCF2;研究描述在表12中进行了报告。
表12:对深度过滤器组合研究中使用的代表性CCF的描述
用三头泵由同一代表性CCF执行了澄清,以便基于相同参数对一级过滤器进行比较。已选择了一级和二级过滤器的相同表面以具有可比性能。与在225L/m
如图19所示,一级过滤器的压力增加之后很快是二级过滤器的压力增加。在225L/m
如图20所示,用代表性CCF评估澄清性能(浊度)的结果表明,过滤器组合均未示出穿透,并且浊度保持低于5NTU。与PCF1+SCF1滤液浊度相比,PCF2+SCF2组合示出整体滤液浊度低于0.5NTU。而且,尽管存在过滤器阻塞问题,但二级过滤器均未展现出穿透。
总之,与PCF1+SCF1组合相比,PCF2+SCF2组合展现出最佳澄清性能,相比于PCF1+SCF1达到235L/m
研究了制造商指示为极限的1巴压力和用作最坏情况上限的3巴压力两者。
表13:深度过滤器组合研究的澄清结果汇总
用来自生物反应器的攻击性CCF对深度过滤器进行的表征
在14天期间以分批进给模式生成了活力低的攻击性CFF,以攻击过滤器并确认先前的筛选结果。此CCF在表14中进行了描述。研究了以下深度过滤器,以进行此表征:SF2、SF3、PCF2、PCF3、SCF2和SCF3。
表14:攻击性CCF的描述
在不同LMH下执行了研究,因为过滤表面不同,因此绘制了过滤器阻力(巴/LMH)而不是仅压力。如供应商推荐的2:1的比率将如PCF2(或PCF3)等一级澄清深度过滤器和如SCF3(或SCF2)等二级澄清过滤器直接串联组合。
在50L/m
PCF3+SCF3组合不得不在70L/m
表15:澄清结果汇总
深度过滤器的筛选允许识别当前平台过滤器的所关注替代方案。所测试过滤器的结果在以下表16中进行了汇总。根据先前定义的标准准则(一级澄清<20NTU并且二级澄清<10NTU)确定了最大通量。当未达到这些值时,继续实验直到压力达到供应商给定的作为极限的值。压力和浊度是在穿透之前达到最大时读取的值。
在图23和图24中,将一级澄清过滤器(和用于一级回收和二级回收的过滤器)进行了比较以确定具有最佳性能的过滤器。此图展示了PCF2过滤器在其它过滤器之中展现出最佳性能,对于最低过滤器阻力,在0.03巴/LMH(0.35巴)下最大通量为400L/m
表16:澄清性能汇总
PCF1也示出好的结果,对于0.005巴/LMH(0.8巴)的更高压力,最大通量为235L/m
组合PCF1+SCF1示出与关于制造商所推荐的在3巴的最大压力下最大负载容量为250L/m
实例4:对深度过滤之前的离心步骤的作用的评估
为了评估离心作为一级澄清步骤的可行性和效率,执行了小规模实验。这些小规模实验旨在展示在深度过滤之前添加离心步骤,以促进澄清过程的发展并克服过程限制的潜在益处。
执行了小规模离心研究以评估离心参数,如相对离心场(RCF)和离心时间以及其对如浊度、活力和细胞裂解等澄清指标的影响。此研究还允许建立离心参数与澄清指标之间的相关性。
通过Eppendorf离心机5810R以介于500g与3000g之间的各种RCF对来自细胞系B的在生物反应器中以分批进给模式培养14天,浊度为944NTU的初始CCF进行了处理,持续不同时间(1分钟到10分钟)。
如图26中所示,对于1分钟的离心步骤持续时间,浊度的下降与离心力之间有关。实际上,在500g时,与944NTU(100%)的初始值相比,浊度降低到175NTU(18.5%)。以同一方式,与944NTU(100%)的初始值相比,通过诱导导致浊度的大颗粒的沉降,在1分钟期间以2000G离心足以将初始浊度降低到45NTU(5%)。
在5分钟期间以3000G离心足以降低初始CCF的浊度,并且此条件是当离心与深度过滤以小规模组合时选择的。
先前CCF的初始活力为60%并且LDH浓度为3042U/L。在离心之后,将细胞团粒悬浮在PBS中以执行活力测量。
离心对活力和LDH未示出任何影响。根据这些结果,在10分钟期间,离心过程不会引入任何细胞破裂,即使在如3000G等极端离心条件下也是如此(描述于图27和图28)。
在5分钟期间以3000G离心足够降低初始CCF的浊度以确保更好的澄清,并且此条件不会诱导任何细胞裂解。然后选择此离心设置以用于接下来的实验。
此研究的目的是评估在利用攻击性CCF进行深度过滤之前添加离心步骤的益处,如表17所述。
表17:对用于离心和平台组合研究的CCF的描述
如所预期的,初始经解冻CCF示出可能会导致过滤器结垢的如图29所述的大量死细胞和大碎屑。在离心处理之后,CCF示出大碎屑完全消失,因为可以看到仅小囊泡。以500G、1分钟处理的CCF示出浊度在425NTU下降低到3380(100%)NTU时的初始值的12%并且示出少量的细胞和细胞碎屑,如在图30中观察到的。以同一方式在3000G下在5分钟期间,随后的CCF未示出可见的细胞和碎屑,但示出与3380NTU(100%)的初始值相比浊度在77.9NTU下降低到2%的仅小囊泡(图31)。离心过程对浊度和碎屑有显著影响,如图29、图30和图31所示。
在图32和图33中,在50L/m
在两种条件下用经离心CCF进行的澄清未示出穿透的迹象,其中浊度和压力不随时间推移增加。在分别为0.2巴和5NTU的可接受压力和浊度下,即使轻轻离心(1分钟,500G)也允许澄清负载在容量为100L/m
与90L/m
此实验展示了当深度过滤面临攻击性CCF的限制时,在深度过滤之前进行离心步骤的益处。
接下来的实验旨在将深度过滤器与离心步骤组合,以将其在离心和不离心的情况下的性能进行比较。对此研究使用了具有以下输入(表18)的攻击性CCF。在此研究中,对如SF2和SF3等单步骤澄清过滤器和如SCF2和SCF3等二级澄清过滤器两者进行了测试。
表18:对CCF的描述
基于先前评价,选择了以下离心参数:5分钟期间3000G。
在此实验中,当压力达到1.5巴时停止澄清。由于使用的过滤器未配备有相同过滤器表面,因此按升/米
过滤器可以合并在具有两个特定行为的两个组,如图34所述。紧密介质过滤器(具有窄孔),如SCF2和SCF3(标称排除范围概述参见表3)示出其入口压力的快速增加。然后,宽孔介质过滤器,如SF2和SF3示出较低堵塞趋势。在这两种过滤器之中,由于其合成组成,SF3示出与SF2相比加倍的更高的负载容量。由于离心步骤仅去除了大颗粒,因此预期看到紧密过滤器示出快速堵塞趋势,而更宽孔允许过滤更高体积。例如,相比于SCF3——具有窄孔的过滤器——的250L/m
通过将在未经处理的CCF的情况下的过滤器性能与在离心后CCF的情况下的过滤器性能进行比较展示了离心的益处。
将最佳离心条件与没有离心步骤的条件进行比较(图35和图36)。在50L/m
经离心CCF在实验期间未示出穿透的迹象,其中SF2和SF3过滤器两者的浊度保持在10NTU左右。在50L/m
与没有离心步骤的实验相比,离心步骤的添加将SF2过滤器的负载容量提高了17个系数并且将SF3过滤器的负载容量提高了12个系数,如以下表19所述。
此结果展示了离心的积极作用,但也展示了离心步骤之后选择过滤器的重要性。此过滤器应具有合适的标称排除范围,以去除离心本身无法去除的中尺寸和小尺寸的颗粒。
表19:澄清结果的汇总
总之,目前可用的结果示出离心步骤的实施将是提高深度过滤器性能的有效方式。
实例5:对深度过滤之前的絮凝步骤的作用的评估
使用攻击性CCF通过向表20中所述的细胞培养物添加0.03%(v/v)的pDADMAC对深度过滤之后的絮凝进行了研究。
表20:对絮凝研究中使用的攻击性CCF的描述
一旦执行了絮凝,就通过具体地被设计成对絮凝过程进行拟合的23cm
表21:对絮凝过滤器的描述
结果的汇总在表22中示出。在目标通量下,过滤器在压力和浊度方面几乎未展现出差异,如图37何图38所述。浊度保持低至3NTU左右,直到PFF2为200L/m
对于PFF2,穿透在0.2巴的压力下发生在220L/m
与SF1相比,絮凝过程使负载容量极大提高。例如,PFF1达到300L/m
两个过滤器不得不由于达到了浊度阈值而停止,并且压力达到0.75巴。对于PFF2,最大通量为275L/m
表22:絮凝结果汇总
实例6:对深度过滤之前AWS步骤的作用的评估
根据表23中的实验条件研来了声波分离作为一级澄清步骤对随后的深度过滤步骤的影响。
表23:对AWS研究中使用CCF的描述
图39中示出的SF1和PCF1+SCF1组合在未经处理的CCF和用AWS处理的CCF上的澄清性能(压力)的比较表明利用未经处理的CCF的SF1和PCF1+SCF1示出分别在89L/m
SF1和PCF1+SCF1组合在未经处理的CCF和用AWS处理的CCF上的澄清性能(浊度)的比较(图40)表明SF1在未经处理的CCF上示出47L/m
总之,从密度<10×10
表24:AWS结果汇总
实例7:对细胞系C细胞的小规模和工作台规模澄清
基于在先前实验中使用细胞系A和B获得的结果,已经通过对SF1过滤器和用于通过细胞系C获得的CFF的澄清的大多数有前途的过滤器组合进行测试执行了另外的研究。根据表25以小规模和工作台规模完成了执行的实验。
表25:实验和所测试过滤器的列表
初始CCF表征在表26中进行了描述。考虑了关键参数,如VCC、活力、浊度、滴度和LDH。为了对澄清进行攻击,延长了过程持续时间以增加浊度。
表26:所用使用的CCF的初始表征
使用三头泵FilterTec完成了所有小规模筛选。在此实验中,流量对于所测试条件是固定的。在工作台规模测试的情况下,取决于管道大小需要使用了经校准泵。所有计算均基于当前SUB平台过程完成,这在70升/平方米/小时(LMH)下的目标比率为50L/m
首先执行了如表25和表26中所述的Exp1,所获得压力趋势在图41中展示。在澄清结束时,在SF1的入口中达到的最大压力为0.4巴。其保持在1巴极限以下,因此入口压力不是限制因素。生物负载降低过滤器中的压力保持在0.1巴以下。总而言之,在没有明显压力增加的情况下已通过过滤器对所有可用材料进行了澄清,并且未达到过滤器最大容量(堵塞)。
浊度趋势示出在图42中。两种浊度趋势遵循同一模式。当SF1后的浊度增加时,生物负载降低过滤器的出口中的相关浊度也增加,偏移量为2NTU。浊度随着通量快速增加,以在28L/m
还监测了LDH和滴度。LDH酶是细胞内蛋白质。监测其在上清液中的水平是通过细胞裂解随访间接报告澄清功效。产物滴度也是用于定义步骤产率的关键参数,并且将示出过滤器是否可以保留所关注产物(通过与过滤器的相互作用)。两种趋势在图43中示出。当澄清开始时LDH持续增加,并且其克服了在19L/m
澄清产率进行了评估并且在表27中示出。
表27:澄清前和澄清后的产率和体积比较
PBS稀释之后,最终滴度从6.63g/L降低到2.45g/L。由于袋体积限制(5L),PBS冲洗停止。达到的稀释系数为68%。此高稀释通过过滤器的高死体积(2.3L)解释。即使稀释比率高,所计算产率也为仅63%,这对于澄清步骤来说较低(通常>95%)。可能有两种解释。某种产物可能仍保持在过滤器中,这意味着冲洗不充分,或者产物被吸附到膜上。通过监测一些代谢物浓度来评估如表28中所示的肉汤中的回收率来验证两种假设。
回收率计算如下:
表28:对关键代谢物的检测
关键代谢物参数与滴度之间的回收率相似(平均为64%)。这意味着产物没有吸附在过滤器上,而是其示出过滤器没有冲洗到足以回收所有产物。这证实了过滤器的高死体积(2.3L)是低体积的CCF可用时的限制因素。
接下来执行实验Exp2,根据表25和表26以小规模对过滤器组合进行测试。
小规模过滤器的压力在图44中示出。SF1+SCF1组合是用于在80L/m
相关联的浊度绘制在图45。在所有三种组合中,浊度始终保持低于10NTU阈值。这意味着作为紧密过滤器的二级过滤器保留了所有颗粒并限制浊度增加。观察到的PCF2+SCF2过滤器组合的趋势示出与PCF1+SCF1过滤器(<5NTU)相比更低的浊度,这可以由随着通量的较慢压力增加来解释。因此,在此实验中浊度不是限制因素。二级过滤器绝不会面临穿透,并且最大所容忍压力将成为实验的障碍。
对LDH和滴度进行了分析,LDH的最终水平和产物滴度在表29中示出。
表29:LDH和产物滴度的最终水平
3种过滤器之间的最终滴度相当,并且略微低于初始滴度。这可以通过用冲洗缓冲液和平衡缓冲液对肉汤进行的残余稀释来解释。LDH水平在所有三个过滤器中均高于初始水平,但在PCF2+SCF2组合中略低。细胞裂解现象在所有情况下都会发生。
还评估了CCCF中的抗体的产物质量,以确保过滤不会对抗体产生影响。如表30所示,在片段(Fgmt)、聚集物(Agg)和主要物种(Main)上在SE-HPLC方法上未观察到差异,这表明所测试过滤器均对产物的纯度无影响。
表30:通过SE-HPLC的产物纯度通过毛细管凝胶电泳(CGE)执行了另外的纯度分析,结果在表31和表32中示出。
表31:通过未经还原的CGE的纯度
表32:通过经还原的CGE的纯度
在未经还原的CGE中,在三种过滤器组合之间未观察到差异。与初始CCF相比,观察到略微差异,其中在完整IgG与125kDa片段之间观察到5%偏移。此差异可以通过以下事实来解释:随着澄清试验肉汤保持开放,并且在此温育时间段期间产物可能会略微片段化。
当对降低的谱进行比较时,未检测到差异。
还通过iCE3对电荷谱进行了表征,如表33所示。
表33:通过iCE3进行的电荷谱监测
在酸性物种、主要物种和碱性物种方面测试的三种过滤器之间未观察到差异。观察到与初始材料的略微差异,从主要物种到酸性物质偏移了2%。这也可以通过在试验期间肉汤在室温下保持开放的事实解释。
最后,通过HILIC-UPLC监测碳水化合物谱,如表34所展示的。
表34:通过HILIC-UPLC的碳水化合物谱
在所有主要碳水化合物物种中均未观察到差异,这证实了产物质量不受所测试过滤器的影响。
然后根据表25和表26执行实验Exp3,以当在与Exp2的肉汤相比浊度更高的情况下使用14天分批进给肉汤时,进一步测试过滤器PCF1+SCF1和PCF2+SCF2的组合以及PCF1后跟两个SCF1的组合(PCF1+2xSCF1)。
压力图在图46中。PCF1+SCF1组合是在80L/m
相关联的浊度在图47中。在所有三种组合中,浊度始终保持低于10NTU阈值。这意味着作为紧密过滤器的二级过滤器保留了所有颗粒并限制浊度增加。观察到的PCF2+SCF2过滤器的趋势示出与其它过滤器相比更低的浊度,这可以随着通量的较慢压力增加来解释。因此,在此实验中浊度不是限制因素。二级过滤器绝不会面临穿透,并且最大所容忍压力将成为实验的障碍。
评估了LDH动力,结果在图48中示出。所有过滤器中的LDH迅速增加并越过3000NTU的初始值,这意味着酶在上清液中释放细胞裂解发生。对此CCF的澄清示出随着所述过程LDH释放,这与施加到过滤器的压力相关。
研究的目的是确认用先前的分批进给获得的培养14天的结果,但还通过延长细胞培养过程持续时间来攻击澄清步骤,并且因此增加初始肉汤的浊度。根据表25和表26在实验Exp2到Exp5的条件下对过滤器PCF2+SCF2的组合和两个PCF2过滤器后跟SCF2的组合(2xPCF2+SCF2)进行了测试。
压力图在图49中。除了过滤器表现地比预期更差的Exp3之外,PCF2+SCF2比率1:1压力示出与初始肉汤状态的良好相关性。其可以通过小规模的过滤器可变性来解释。实际上,捕获在过滤器中的小气泡会使过滤表面减少并且因此影响性能。由于应用了低流量,因此PCF2+SCF2比率2:1直到最大容量才受到攻击。事实上,由于比率1:1和2:1是用同一三头泵并行运行的,因此不可能增加比率2:1的流量。由于表面加倍,这意味着通过过滤器的体积将多于两倍,并且时间将长于两倍。作为此比较的结论,在3巴下观察到通量197L/m
相关浊度趋势在图50中示出。除了Exp4之外,在比率1:1与2:1之间未观察到明显浊度差异,其中穿透在试验结束时在浊度为65NTU的情况下在比率1:1时发生。最差CCF的PCF2+SCF2浊度增加接近15NTU。小颗粒的增加开始,这可能是由于细胞裂解现象。因此,在此实验中浊度不是限制因素。
通过跟踪随着通量的LDH水平还监测到细胞裂解速率(图51)。酶的数量迅速越过初始水平(介于3000与4000U/L之间),以在试验结束时达到初始量的2到2.5倍左右。在Exp4中,比率1:1时的突然增加与压力(>1巴)和瓶更换相关。总之,即使浊度水平保持可接受,某种细胞裂解也会发生。
与小规模实验Exp5一起,根据表25和表26,利用相同CCF和2xPCF2+SCF2(Exp6)执行工作台规模试验。
流速和LMH验证是数据分析的第一步,尤其是要考虑按比例放大。即使对泵进行校准以匹配期望的流速,通过管的细胞也会增强对流量的略微修改。这是在图52中监测到的,以用于工作台规模试验。随时间推移测量到的实际流量为28.9毫升/分钟,而不是用水校准的32毫升/分钟的理论流量。其导致64.2到恒定LMH,而不是目标70LMH。
与过滤器相关联的压力趋势在图53中示出。在PCF2过滤器的入口和两个过滤器之间对压力进行监测。如果压力趋势是平行的,则这意味着两个过滤器在有效工作。这是小规模(Exp5)的情况,但检测到工作台规模试验(Exp6)中的更高压力增加。一级压力的拐点开始于60L/m
与压力趋势并行,如图54所示对浊度进行监测。在小规模(Exp5)与工作台规模(Exp6)之间达到(1巴)65L/m
提取了关于关键样品的Vicell图片,以监测穿透的状态。图片在图55中示出。在两个过滤器(A和B图片)中在1巴下完成的采样表明穿透在PCF2过滤器中在不影响SCF2性能的情况下开始。SCF2(C)后的以下采样示出SCF2过滤器也发生了动态穿透。
通过LDH测定监测到的细胞裂解水平在图56中示出。LDH水平在两个实验中在达到70L/m
在工作台规模下用最佳情况CCF对过滤器PCF2+SCF2的组合和两个PCF2过滤器后跟SCF2(2xPCF2+SCF2)的组合进行了测试。如先前所述,流速和LMH验证是数据分析的第一步,尤其是要考虑按比例放大。这是在图57中针对工作台规模试验Exp7和Exp8监测到的(实验条件参见表25和表26)。在两个实验中,随时间推移测量到的实际流量分别为26.9毫升/分钟和26.0毫升/分钟,这分别导致59.8和57.8的恒定LMH。作为提醒,目标LMH为70。在所有小规模实验中,理论LMH是匹配的,其中所计算值在比率1:1时为73.2LMH并且在比率2:1时为71.7LMH(图中未示出)。
在图58中对工作台规模和小规模实验两者中的相关联的压力趋势进行了比较。
对于PCF2+SCF2,可以看到的是在达到通量44L/m
与每个试验相关联的浊度在图59中示出。在所有试验中,CCCF浊度(澄清后)始终保持低于10NTU阈值。这意味着浊度不是实验中的限制因素。在比率1:1试验中,穿透开始在通量54L/m
在比率2:1时,观察到相似行为,其中在达到容量67L/m
实例8:对细胞系C细胞的试点规模澄清
在实例7的实验中,运行50L试点过程。对在50L SUB中生成的CCF进行了描述并且在表35中将其与工作台规模肉汤进行了比较。
表35:工作台规模和试点规模下的初始CCF描述
在14天培养之后,两种规模之间的初始浊度相似。试点下的活力和滴度略高,但整体肉汤比较保持相似。在试点下,添加了过滤器表面的安全裕度。然后如先前章节中所述的开始澄清,并且第一步骤为WFI和PBS冲洗。死体积表征是需要监测的第一步骤。
流量监测
用于验证澄清良好执行的第一步骤是测量步骤的实际流量。理论上,基于计算,流量应为0.898升/分钟。所容忍裕度为+/-5%,这被视为可接受澄清变化。实验流量在图60中进行了详述。所测量流量是线性的,其中校正的R
通量表征
为了验证过滤器不会随时间的推移而阻塞,绘制了随时间推移的通量(L/m
压力监测
接下来对压力进行监测。如先前所述,向设置中添加了三个压力传感器,以允许检测过程的三个过滤器中的任何压力增加,即一级澄清过滤器PCF2、二级澄清过滤器SCF2和Sartopore 2生物负载降低过滤器。压力趋势在图62中示出。PCF2入口过滤器压力随着通量略微增加,但保持低于0.326巴(图62,上图)。二级过滤器(图62,中图)和生物负载过滤器(图62,下图)的入口压力也保持未低,在最大值下对于SCF2为0.203并且对于Sartopore2无菌过滤器为0.100巴。在此实验中未全局观察到压力增加。其示出,对大小设定进行了良好估计,并且安全系数允许此压力控制。
浊度监测
根据先前的发展,作为最大值深度过滤后浊度应介于10NTU与20NTU之间,以避免0.22μm过滤器的阻塞问题。绘图在图63中示出。PCF2过滤器后浊度略微增加,因为此过滤器在去除细胞。其达到了22NTU,与在没有安全系数的情况下在工作台规模下观察到的值(1800NTU,未显示)相比,这不是关键的。
CCCF浊度始终保持为低(<4NTU),并且与在工作台规模(<8NTU)下观察到的相当。作为结论,在CCCF中未检测到浊度增加。安全裕度还允许控制PCF2一级过滤器后的浊度增加(在工作台规模试验中更高,对SCF2过滤器没有任何影响)。
通过LDH测量的细胞裂解评价
通过CEDEX代谢物分析仪测量的LDH趋势在图64中示出。通过LDH进行的细胞裂解在两种过滤器中增加到2400U/L左右,这接近初始值(2078U/L)。通量中达到最大值的延迟与过滤器的死体积有关。在实验结束时,LDH由于对肉汤进行稀释的PBS冲洗而降低。因此,此实验中澄清未诱导细胞裂解,因为LDH水平未增加到高度高于初始值。
产物滴度评价
随澄清的产物滴度在图65中示出。通过两个过滤器的产物恢复相似并且将后PBS连接降低以冲洗过滤器的死体积。在澄清结束时,仍有2g/L的产物在过滤器中。
澄清前/后的产物质量分子
为了评估澄清对产物质量的影响,通过SE-HPLC(表36)以及未经还原的表37)和经还原的CGE(表38)两者对抗体的纯度进行了分析。还通过cIEF对电荷进行了分析(表39)并且通过HILIC-UPLC对碳水化合物进行了分析(表40)。
表36:澄清之前和之后的SE-HPLC产物谱
如表36所示,主要%在两种条件下——离心之前和之后——相同。观察到随澄清从聚集物到片段的略微偏移(0.5%)。澄清过程通过使聚集物片段化增加了片段水平,这可能是由于澄清系统中的由泵流动速度诱导的压力。
表37:澄清之前和之后的未经还原的(NR)CGE产物谱
如表37所示,总体CGE谱在澄清之前和之后相似。此过程步骤不会诱导主要产物的任何显著片段化。在经还原的CGE中观察到相同总结(表38),其中未观察到差异。
表38:澄清之前和之后的经还原的CGE产物谱
电荷谱也不受澄清的影响,事实上,在澄清之前和之后在酸性物种、主要物种和碱性物种之间未观察到差异(表39)。
表39:澄清之前和之后的通过cIEF测量的电荷变化产物谱
总体碳水化合物谱在澄清之前和之后也相似,如表40所示。
表40:澄清之前和之后的碳水化合物产物谱
基于这些数据,在澄清步骤之前和之后未观察到产物质量的明显差异。
- 细胞培养物澄清的方法
- 深度过滤串联连续离心用以澄清哺乳动物细胞培养物的应用
