一种TiO2纳米线阵列基底及其制备方法和应用
文献发布时间:2023-06-19 12:21:13
技术领域
本发明属于循环肿瘤细胞的检测和释放领域,具体涉及一种TiO
背景技术
循环肿瘤细胞(CTCs)来源于原发性或转移性肿瘤,在外周血中循环,是肿瘤侵袭转移的主要形式。因此,从血液中捕获和分离循环肿瘤细胞对癌症的早期诊断和预后至关重要。然而,CTCs的检测依旧面临诸多困难与挑战。由于CTCs的浓度非常低,通常,1mL外周血中含有血细胞10
针对此问题,常规的解决方法有以下4种:第一种是膜过滤法(ISET法),利用改性的微珠与CTCs结合后尺寸与血细胞尺寸差异,使用纳米技术制作的聚碳酸酯多微孔滤膜装置对采集到的患者外周血进行过滤,CTCs因为较大的直径不能通过滤膜较小的孔径而被吸附在膜上从而达到分离的目的。但该方法一方面无法评估CTCs与微珠的结合率,另一方面过度依赖于肿瘤细胞的大小,血细胞众多可能会有部分细胞会因为突变导致细胞尺寸变大到与 CTCs的尺寸接近从而影响捕获纯度,造成肿瘤细胞检测时容易堵塞滤膜。此外,该方法捕获细胞的特异性不强。第二种是利用明胶涂覆的TiO
发明内容
针对上述问题,本发明提供一种TiO
为了达到上述目的,采用了一种TiO
制备TiO
涂覆明胶:在合成了TiO
修饰抗体:在涂覆了明胶的基底上修饰抗体。
所述制备方法中TiO
在其中一个实施例中,所述水热法包括以下步骤:
制备反应溶液:混合20-40ml浓度为12mol/L的浓盐酸、20-40ml水、1-3ml钛酸四丁酯,即得;
制备TiO
采用上述反应条件能获得比表面积更大的TiO
在其中一个实施例中,所述反应温度为155℃,反应时间为8小时。采用上述反应条件制备得到的TiO
在其中一个实施例中,所述修饰抗体包括以下步骤:
配制EDC/NHS溶液:将8±2mg的EDC和12±2mg的NHS溶解于1-3ml浓度为0.1-0.3mol/L 的MES溶液,即得;
激活:将所述涂覆了明胶的基底和所述EDC/NHS溶液孵育1-3小时;
修饰:将100±10μg/mL的链霉亲和素与激活后的基底孵育40-50分钟,然后和抗体孵育 1-2小时,即得。
上述反应条件修饰的抗体不易脱落,活性好,能较好地利用其特异性结合肿瘤细胞,提高捕获效率。
在其中一个实施例中,所述配制EDC/NHS溶液过程中的EDC为8mg,NHS为12mg,MES溶液的体积为2ml,浓度为0.1mol/L;所述激活过程中的孵育时间为2小时;所述修饰过程中的链霉亲和素为100μg/mL,激活后的基底和链霉亲和素的孵育时间为45分钟,和抗体的孵育时间为1小时。
在其中一个实施例中,所述明胶掺杂有金纳米棒。金纳米棒具有良好的光热转换特性,能使明胶随着温度的升高从凝胶态转变为液态。
在其中一个实施例中,所述金纳米棒的掺杂浓度为90-110μM。上述掺杂浓度的金纳米棒,能够将光能转换成足够的热能,使明胶从凝胶态转变成液态,从而释放肿瘤细胞。
在其中一个实施例中,所述金纳米棒的掺杂浓度为100μM。
在其中一个实施例中,所述抗体为生物素标记的anti-EpCAM抗体。采用上述抗体,能使所述基底具有特异性识别肿瘤细胞的能力。
本发明还提供了所述制备方法得到的TiO
本发明还提供了所述TiO
在其中一个实施例中,所述捕获过程包括将所述TiO
在其中一个实施例中,所述释放过程包括以下步骤:
限定光照区域:通过掩膜板来控制光照区域的大小和位置;
照射:采用近红外光照射5min。
上述操作中,采用近红外光照射更安全,不会降低肿瘤细胞的生物活性;采用掩膜板可以通过控制光照区域的大小和位置,按照需求局部释放肿瘤细胞;采用上述照射时间,能保证提供足够的光能给金纳米棒,转化成足够的热能,进而使明胶液态化,实现肿瘤细胞的释放。
与现有技术相比,本发明具有以下有益效果:
本发明的一种TiO
附图说明
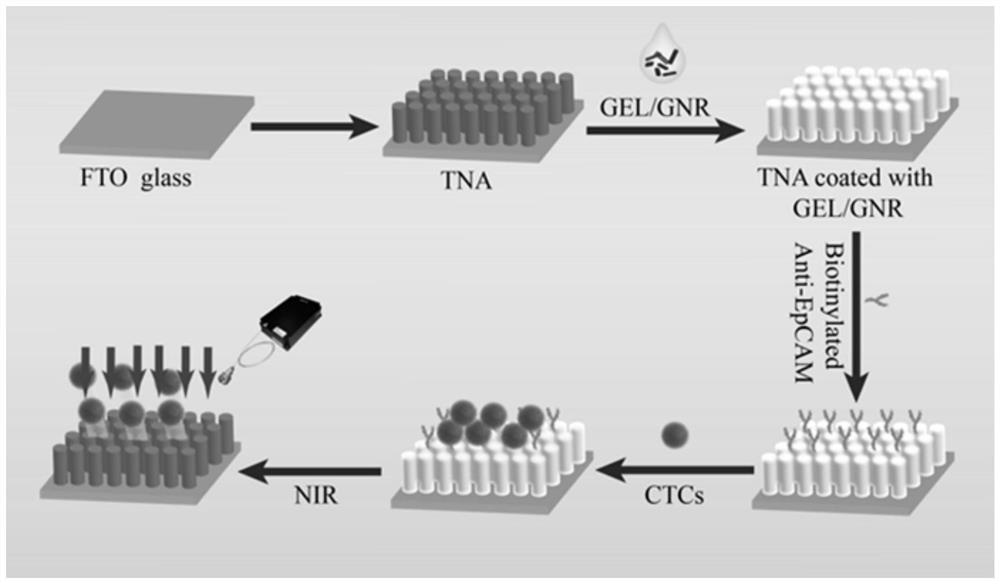
图1为实施例1的流程图;
图2为实施例2中不同基底上捕获到的MCF-7细胞的荧光图;
图3为实施例2中4种基底对MCF-7细胞的捕获效率;
图4为实施例3中修饰有Anti-EpCAM抗体的TNA基底对MCF-7,A549,Hela和WBC4 种细胞系的捕获效率;图5为NIR照射对涂覆/未涂覆有GNR掺杂的明胶的基底上的细胞的影响;
图6为在TNA/Anti基底上的细胞在NIR照射前后分布示意图以及经过NIR照射过后细胞在基底上不同区域分布的荧光图(比例尺:100μm);
图7为捕获在SG和TNA/Anti基底上的细胞NIR照射前后细胞数目的变化情况。
具体实施方式
为了便于理解本发明,下面将参照相关附图对本发明进行更全面的描述。附图中给出了本发明的较佳实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
定义:
本发明所述的纳米线阵列:指在横向上被限制在100纳米以下(纵向没有限制)的一维线状结构,排成的一个整齐有序的阵列结构。
TNA:即采用TiO
水热法:指一种在密封的压力容器中,以水作为溶剂、粉体经溶解和再结晶的制备材料的方法。
anti-EpCAM抗体:即上皮细胞粘附分子抗体,其高水平表达指示上皮细胞的癌变或肿瘤增生,现有研究显示anti-EpCAM抗体可作为靶向功能分子用以实现对循环肿瘤细胞的靶向识别和捕获。
近红外光(NIR):指介于可见光(VIS)和中红外光(MIR)之间的电磁波,按ASTM (美国试验和材料检测协会)定义是指波长在780-2526nm范围内的电磁波。
掩膜板:指在薄膜、塑料或玻璃基体材料上制作各种功能图形并精确定位,以便用于光致抗蚀剂涂层选择性曝光的一种结构,是微纳加工技术常用的光刻工艺所使用的图形母版。
来源:
金纳米棒(GNR):购自朗飞生物科技有限公司,规格为10mL;
anti-EpCAM抗体:购自索莱宝生物试剂有限公司,规格为100μL。
本实施例所用试剂、材料、设备如无特殊说明,均为市售来源;实验方法如无特殊说明,均为本领域的常规实验方法。
实施例1
制备修饰了抗体的TiO
1、制备TiO
(1)在基底上采用水热法合成TiO
(2)将清洗后的FTO玻璃置于65℃的烘箱中烘干;
(3)将30ml浓度为12mol/L的浓盐酸、30ml去离子水和1ml钛酸四丁酯依次倒入锥形瓶,混匀后得到反应溶液;
(4)将步骤(2)中烘干后的FTO玻璃置于反应釜中,再倒入步骤(3)得到的反应溶液,然后将反应釜置于155℃的温度下,反应8小时,即得。
2、涂覆明胶。
(1)在明胶中掺杂金纳米棒,金纳米棒的浓度为100μM;
(2)在步骤1得到的基底上涂覆明胶。
3、修饰抗体。
(1)将8mg的EDC和12mg的NHS溶解在2ml浓度为0.1mol/L的MES溶液中,形成稳定的反应液;
(2)将步骤(1)得到的反应液和步骤2得到的基底共孵育2小时,将孵育后的基底用PBS清洗3次;
(3)将100μg/ml的链霉亲和素和步骤(2)得到的基底共孵育45分钟,将孵育后的基底用PBS清洗3次;
(4)将步骤(3)得到的基底和生物素标记的anti-EpCAM抗体共孵育1小时,即得。
上述制备修饰了抗体的TiO
实验例2
细胞捕获实验。
1、将光滑玻璃组(SG),修饰了抗体的光滑玻璃组(SG/Anti)和TNA组设为实验对照;
2、将实施例1得到的TiO
3、具体孵育条件:MCF-7细胞的浓度为10
结果如图2、图3所示,其中图2中的a、b、c、d分别对应于图3中的光滑玻璃组(SG)、未修饰抗体的TiO
实施例3
特异性捕获细胞实验。
1、将实施例1得到的TiO
2、具体孵育条件为:MCF-7、A549、Hela、WBC细胞的浓度均为10
结果如图4所示,发现实施例1中修饰有Anti-EpCAM抗体的基底对特异性表达EpCAM 抗原的MCF-7和A549细胞高效捕获,而对不表达EpCAM抗原的Hela和WBC细胞细胞较少捕获。这说明基底有有具有特异性识别捕获细胞的能力。
实施例4
肿瘤细胞释放实验。
1、将光滑玻璃组(SG),表面涂有掺杂金纳米棒的明胶的光滑玻璃组(SG+GEL/GNR),为涂覆明胶的TiO
2、将实施例1得到的TiO
3、使用PBS冲洗3次TNA基底洗掉未捕获在基底上的细胞;
4、使用Hoechst染料对4种基底上捕获到的细胞染色30min;
5、对染色后的4种基底,使用PBS冲洗洗掉多余的染料;
6、再将上述捕获到细胞的4种基底分别置于上述确定的近红外光照射下,通过5min的照射后使用PBS冲洗3次洗掉经光照释放的细胞;
7、将上述经过光照处理后的基底置于荧光显微镜下观察。
结果如图5所示,比对近红外光照射前后基底表面的细胞留存情况可以发现,相较于在近红外光照射前的视野下的细胞,在近红外光照射后,涂覆有掺杂金纳米棒的明胶的光滑玻璃和TNA基底,荧光视野下几乎看不见细胞存在,这说明掺杂金纳米棒的明胶在近红外光照射下明胶温度上升融化导致了细胞被大量释放。而未涂覆掺杂金纳米棒的明胶的光滑玻璃和 TNA基底,近红外光照射前后视野里面的细胞密度几乎没有太大的变化,说明细胞没有被释放。这里直接证明了捕获在涂覆有掺杂金纳米棒的明胶的基底,上面的细胞可以在近红外光照射后被释放,且由于明胶和近红外光都具有较好的生物相容性,释放的细胞依然具有较高的活性。细胞释放必须要同时满足掺杂有金纳米棒的明胶基底和近红外光照射这两个条件。
实施例5
肿瘤细胞局部释放实验。
1、使用涂覆有掺杂100μM的金纳米棒的明胶的TNA基底与10
2、使用PBS冲洗未捕获的细胞并且使用Hoechst染料标定捕获到的细胞;
3、采用掩膜板来控制光照区域的大小和位置,掩膜板由透光部分和不透光部分组成,光只能通过透光区域,选取透光部分长为5mm,宽为2mm的掩膜板;
4、使用近红外光去透过掩膜板照射基底,基底表面会有一个同样尺寸大小的光斑。
5、近红外光照射5min后,分别选取未光照区域、光照与未光照的边界区域以及光照区域,对基底进行荧光观察表征。
结果如图6所示,在近红外光照射之前,细胞分布于基底表面的各个地方,在近红外光照射之后,会留下一个细胞很少的区域这对应于光照区域。近红外光照射前后不同区域的荧光图像对应图6(a1-a3),其中,图6(a1)展示的是未经光照的区域,从中看到基底表面仍然留存有大量的细胞,这说明细胞未被释放。图6(a3)展示的是被光照区域的中心,可以看到荧光视野下细胞几乎不可见,这是由于近红外光照射介导的明胶融化从而使得细胞被释放。图6(a2)展示的是光照与未光照区域的边界,可以发现视野里面存在一条很明显的分界线,分界线的一侧有大量的细胞,另一侧几乎没有细胞,这说明在近红外光照射下细胞可以被选择性的释放掉。这也表明了上述方法对循环肿瘤细胞的进行局部释放是可行的。
实施例6
近红外光照射后的细胞释放效率实验。
1、选取实施例1得到的TiO
2、将上述2种基底与10
3、使用PBS冲洗未捕获的细胞并且使用Hoechst染料标定捕获到的细胞;
5、对染色后的2种基底,使用PBS冲洗洗掉多余的染料;
6、再将上述捕获到细胞的2种基底分别置于上述确定的近红外光照射下,通过5min的照射后使用PBS冲洗3次洗掉经光照释放的肿瘤细胞;
7、将上述经过光照处理后的基底置于荧光显微镜下观察。
结果如图7所示,尽管肿瘤细胞在两个基底上捕获到的细胞数目相差较大,但是在近红外光照射后,细胞均能被较大程度的释放,经统计并且计算发现,细胞在表面涂有掺杂金纳米棒的明胶的光滑玻璃组上的释放效率在93.4%,在实施例1得到的TiO
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 一种TiO2纳米线阵列基底及其制备方法和应用
- 一种应用于光解水制氢的有序Pt‑TiO2/InP纳米线阵列电极材料及其制备方法
