多因素联合提高发芽糙米γ-氨基丁酸含量的方法
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及一种发芽糙米的生产方法,具体涉及一种多因素联合提高发芽糙米Y-氨基丁酸含量的方法,属于农产品深加工技术领域。
背景技术
γ-氨基丁酸是一种游离的四碳非蛋白氨基酸,半个多世纪前首次在植物中发现。后来证明在哺乳动物大脑中,γ-氨基丁酸是一种重要的中枢神经系统抑制性神经递质,具有缓解压力、预防糖尿病和抑制癌细胞增殖等作用。发芽糙米是一种重要的γ-氨基丁酸产品。对发芽糙米采用某种胁迫方式处理,加工成富含γ-氨基丁酸的功能产品已成为研究热点。但是,传统的化学胁迫处理不仅会引起种子的应激反应,激活多种分解酶,造成大量营养物质的分解,而且化学试剂的大量使用还会造成严重的环境污染和食品安全隐患。
与化学法相比,磁场是一种安全、绿色和廉价的发芽技术,可减少或避免化学试剂的使用。通常认为磁场可通过产生洛伦兹力等改变蛋白构象和酶活力,从而影响动植物的生长代谢。CN113039890B公开了一种利用磁场提高发芽藜麦的γ-氨基丁酸的方法,证实静磁场撤离可显著促进藜麦发芽及γ-氨基丁酸的富集。然而,对于发芽糙米而言,在保证其GABA含量的同时,还需将芽长控制在较短范围内(<3mm),从而防止加工过程中芽的脱落、提高其加工性能。因此,如何在尽可能短的时间内实现γ-氨基丁酸富集,同时避免芽的过快生长极为重要。
发明内容
本发明的主要目的在于提供一种多因素联合提高发芽糙米Y-氨基丁酸含量的方法,以克服现有技术的不足。
为实现前述发明目的,本发明采用的技术方案包括:
本发明的一个方面提供了一种多因素联合提高发芽糙米Y-氨基丁酸含量的方法,其包括:
S1、对糙米依次进行除杂、避光消毒和清洗处理,之后在25~35℃于水中浸泡6~8h;
S2、在温度不超过35℃的条件下,将经步骤S1处理后的糙米以磁场强度为5~20mT的磁场处理30~90min;
S3、采用浓度为0.1~5mmol/Lγ-氨基丁酸溶液间歇性喷淋经步骤S2处理后的糙米,并在28~32℃萌发24~30h,制得发芽糙米。
在本发明中利用磁场处理联合γ-氨基丁酸培养制备富含γ-氨基丁酸发芽糙米的机理主要在于:利用生物磁效应,促进糙米细胞对γ-氨基丁酸的内源合成及外源吸收,一方面可通过增加细胞膜通透性诱导糙米主动吸收累积γ-氨基丁酸,另一方面还可抑制γ-氨基丁酸分解酶GABA-T酶的代谢活动,促进内源γ-氨基丁酸的累积。
在一个实施例中,步骤S1具体包括:利用次氯酸钠溶液对经除杂处理后的糙米进行避光消毒,之后以蒸馏水清洗干净,然后在25~35℃于蒸馏水中浸泡6~8h。
在一个实施例中,所述次氯酸钠溶液的浓度为0.2~2v/v%。
在一个实施例中,所述糙米的品种包括粳米、籼米或糯米等,且不限于此。
在一个实施例中,步骤S2中所述磁场的强度为10~15mT。
在一个实施例中,步骤S2中采用的磁场处理时间为60~90min。
在一个实施例中,所述磁场包括静磁场、交变磁场、旋转磁场或脉冲磁场,且不限于此。
在本发明中所述磁场处理的作用至少包括:有效提高发芽糙米细胞的细胞膜通透性,从而显著增加发芽糙米对外源γ-氨基丁酸的吸收,例如,经磁场处理后相对电导率提高了9.4%-18.3%;改变γ-氨基丁酸合成分解代谢相关的酶活力,例如可以使其中γ-氨基丁酸分解酶GABA-T酶活力降低0.08%-16.3%。
在一个实施例中,步骤S3具体包括:每隔1~2h使用所述γ-氨基丁酸溶液喷淋经步骤S2处理后的糙米1~3min,喷淋液流量为50~200mL/min,且每12~24h更换一次一次培养液,所述培养液为所述Y-氨基丁酸溶液,在28~32℃萌发24~30h,制得发芽糙米。
在本发明中利用磁场处理联合γ-氨基丁酸培养,可以有效减小甚至消除对糙米的发芽指数(如根长、芽长等)的影响。
在一个实施例中,所述γ-氨基丁酸溶液的浓度为0.1~5mmol/L。
在一个实施例中,所述喷淋液流量为50~200mL/min。
在一个实施例中,所述发芽糙米的根长、芽长均小于3mm。
在一个较为优选的实施例中,步骤S2中采用的磁场强度为10~15mT、磁场处理时间为60~90min;以及,在步骤S3中采用的γ-氨基丁酸溶液的浓度为3.0~5.0mmol/L,这样可利用生物磁效应获得最大的γ-氨基丁酸富集量,并更好地节约成本。
本发明的另一个方面提供了一种发芽糙米,其由所述磁场联合外源γ-氨基丁酸处理提高发芽糙米γ-氨基丁酸含量的方法制得,其中γ-氨基丁酸含量可高达43.55mg/100g,且根长、芽长均小于3mm,符合NY/T 3216-2018等的要求。
与现有技术相比,本发明至少具有以下优点:
(1)本发明利用磁场对糙米进行预处理,并联合外源作为培养液的Y-氨基丁酸溶液进行培养,制得的发芽糙米营养价值高,例如其中的γ-氨基丁酸含量可以高达25.64~43.55mg/100g,既远高于糙米未发芽前的γ-氨基丁酸含量(约9.22mg/100g),也明显高于仅采用磁场处理后培养所获发芽糙米的γ-氨基丁酸含量(低于20mg/100g)。
(2)本发明利用磁场诱导技术增加细胞膜通透性及降低γ-氨基丁酸分解酶GABA-T的酶活促进γ-氨基丁酸的富集,同时联合外源γ-氨基丁酸进行培养,对糙米萌发的发芽指标和能量代谢影响较小,避免了营养物质的大量分解和快速生长,可以充分满足NY/T3216-2018等对发芽糙米功能性食品的要求。
附图说明
图1示出了不同γ-氨基丁酸浓度下磁场诱导发芽糙米细胞膜通透性变化的测试结果;
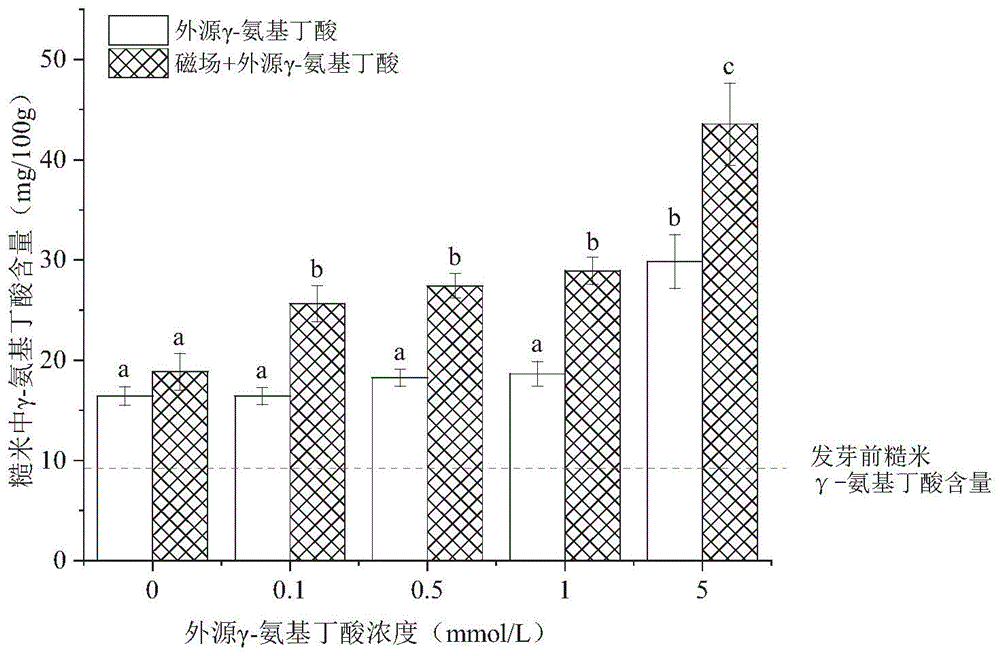
图2示出了不同γ-氨基丁酸浓度下磁场诱导发芽糙米的γ-氨基丁酸含量的测试结果。
具体实施方式
如前所述,鉴于现有技术的不足,本申请人提出了本申请的技术方案,其主要包括:首先采用磁场对糙米进行诱导处理,再将处理后的糙米在28~32℃下萌发24~30h,然后每隔1~2h使用浓度为0.1~5mmol/Lγ-氨基丁酸溶液喷淋经消毒浸泡处理后的糙米1~3min,从而制得高γ-氨基丁酸发芽糙米。在本发明的技术方案中,在磁场预处理后加入外源作为培养液的Y-氨基丁酸溶液处理,使发芽糙米中的Y-氨基丁酸含量大幅度提高,增量远高于单独磁场或Y-氨基丁酸处理下的增量;富集原理一方面可能是由于γ-氨基丁酸的合成分解主要与γ-氨基丁酸支路中的γ-氨基丁酸合成酶GAD酶、γ-氨基丁酸分解酶GABA-T酶、SSADH酶活有关,磁场能够降低GABA-T酶活力,减少γ-氨基丁酸的分解,促进γ-氨基丁酸富集(内源合成,表1);但更为重要的应该是,磁场预处理增加了细胞膜通透性,增加了糙米对外源培养液中γ-氨基丁酸的吸收(参阅图1),外源吸收起主导作用。
下面对本发明的具体实施例作进一步说明,但本发明要求保护的范围不局限于实施例表述的范围。若非特别说明,则如下实施例中所采用的各种原料、生产设备、测试方法、测试设备均是本领域常用的,其中各种原料、生产设备、测试设备等还均可以从市场途径获得。例如,如下实施例及对比例使用的糙米是从南京周边市场上购得的同一批次粳米。
γ-氨基丁酸含量测定方法:γ-氨基丁酸含量的测定采用高效液相色谱法。精确称取不同γ-氨基丁酸浓度下磁场诱导后的发芽糙米粉1.0g,加入5mL的7%乙酸溶液,涡旋仪混匀。于30℃下200r/min摇床提取1h后,4℃离心8000rpm,20min,上清液取出后加入5mL无水乙醇,置入4℃冰箱中醇沉过夜,以沉淀多糖和杂蛋白。待上清液清晰透明后,4℃离心8000rpm,20min。于90℃水浴中蒸干30min后,溶于1mL 1mol/L Na
发芽指标测定方法:使用游标卡尺测量发芽糙米的根长和芽长,每个平行中随机选取10粒取平均值。在每个平行中随机选取100粒称量鲜重,在105℃下以恒重干燥12h称量确定干重。
还原糖测定方法:首先,将发芽糙米粉(1.0g)与蒸馏水(10mL)混合,在50℃下孵育30min,然后以3600×g离心5min。接着,用10mL蒸馏水提取得到的沉淀物,离心后,混合上清液,最后加入蒸馏水定容至50mL。取1mL上清液与2mL的3,5-二硝基水杨酸(DNS)试剂混合,煮沸10min,冷却,最后加入去离子水定容至20mL。在分光光度计上测定波长为540nm下的吸光度。使用葡萄糖作为标准获得标准曲线(y=8.8667x-0.0226,R
α-淀粉酶测定方法:首先,将糙米粉悬浮在10mL蒸馏水中,并在25℃下提取20min。在3600×g离心10min后,将上清液(1mL)在70℃下加热15min以灭活β淀粉酶,然后在40℃下孵育10min。接着,将1%(w/v)的可溶淀粉溶液(1mL)加入上清液中,在40℃下反应5min,并用0.2mmol/L氢氧化钠溶液(1mL)终止反应。之后,通过DNS法测定混合物中的还原糖含量。α-淀粉酶活性(U/g)定义为40℃下每克干重每分钟下分解产生的还原糖的毫克量。
GABA-T酶活测定方法:使用检测试剂盒(中国南京建成生物工程研究所有限公司)测定GABA-T和SSADH活性。一个单位的GABA-T活性表示为每分钟450nm处变化,并表示为μg/g。得到GABA-T活性(y=0.0047x,R
相对电导率测定方法:随机选择发芽前后的20颗种子,并浸入含有20mL去离子水的锥形瓶中,在150rpm的摇床中孵育2h,然后测量溶液的电导率(C
激光共聚焦显微镜观察根尖细胞:用PBS(pH值7.2)洗涤发芽糙米根尖组织(0.7-1cm)。将每个样品浸泡并在新鲜稀释的1%PI溶液(PBS,pH值7.2)(p-4170,Sigma)中染色5min。然后用蒸馏水洗掉它们并在共聚焦显微镜下观察。参数选择如下:放大倍数200倍;激光颜色红色;激发波长536nm;最大发射波长617nm。
实施例1
将市售糙米除杂后,用浓度约0.2%的次氯酸钠溶液对其进行避光消毒,然后用蒸馏水清洗干净。糙米在约25℃下浸泡约6h后,在磁场强度约为5mT,暴露时间约为30min,温度约为28℃下进行磁场诱导。每隔约1h使用浓度约为0.1mmol/L的γ-氨基丁酸溶液喷淋经消毒浸泡处理后的糙米约1min,喷淋液流量约为200mL/min,每隔约12h更换一次培养液(即所述γ-氨基丁酸溶液),在约28℃下萌发约24h,制得高γ-氨基丁酸含量的发芽糙米。
实施例2
将市售糙米除杂后,用浓度约1%的次氯酸钠溶液对其进行避光消毒,然后用蒸馏水清洗干净;糙米在约30℃下浸泡约8h后,在磁场强度约为10mT,暴露时间约为60min,温度约为30℃下进行磁场诱导;然后每隔约2h使用浓度约为0.5mmol/L的γ-氨基丁酸溶液喷淋经消毒浸泡处理后的糙米约2min,喷淋液流量约为100mL/min,每隔约12h更换一次培养液,在约30℃下萌发约30h,制得高γ-氨基丁酸含量的发芽糙米。
实施例3
将市售糙米除杂后,用浓度约2%的次氯酸钠溶液对其进行避光消毒,然后用蒸馏水清洗干净;糙米在约35℃下浸泡约6h后,在磁场强度约为10mT,暴露时间约为60min,温度约为30℃下进行磁场诱导;然后每隔约2h使用浓度约为5mmol/Lγ-氨基丁酸溶液喷淋经消毒浸泡处理后的糙米约3min,喷淋液流量约为50mL/min,每隔约24h更换一次培养液,在约32℃下萌发约24h,制得高γ-氨基丁酸含量的发芽糙米。
实施例4
将市售糙米除杂后,用浓度约1%的次氯酸钠溶液对其进行避光消毒,然后用蒸馏水清洗干净;糙米在约25℃下浸泡约8h后,在磁场强度约为15mT,暴露时间约为90min,温度约为30℃下进行磁场诱导;然后每隔约2h使用浓度约为3mmol/L的γ-氨基丁酸溶液喷淋经消毒浸泡处理后的糙米约2min,喷淋液流量约为150mL/min,每隔约18h更换一次培养液,在约28℃下萌发约24h,制得高γ-氨基丁酸含量的发芽糙米。
实施例5
将市售糙米除杂后,用浓度约1%的次氯酸钠溶液对其进行避光消毒,然后用蒸馏水清洗干净;糙米在约30℃下浸泡约8h后,在磁场强度约为20mT,暴露时间约为90min,温度约为30℃下进行磁场诱导;然后每隔约2h使用浓度约为5mmol/L的γ-氨基丁酸溶液喷淋经消毒浸泡处理后的糙米约2min,喷淋液流量约为100mL/min,每隔约12h更换一次培养液,在约30℃下萌发约24h,制得高γ-氨基丁酸含量的发芽糙米。
对比例1
将市售糙米除杂后,用浓度约0.2%的次氯酸钠溶液对其进行避光消毒,然后用蒸馏水清洗干净,再在约25℃下浸泡约6h后,用获得的糙米进行后续指标的测定。
对比例2
将市售糙米除杂后,用浓度约1%的次氯酸钠溶液对其进行避光消毒,然后用蒸馏水清洗干净,再在约30℃下浸泡约8h后,然后每隔约1h使用蒸馏水喷淋经消毒浸泡处理后的糙米约1min,喷淋液流量约为100mL/min,每隔约12h更换一次培养液,在约30℃下萌发约24h,制得高γ-氨基丁酸含量的发芽糙米。
对比例3
将市售糙米除杂后,用浓度约1%的次氯酸钠溶液对其进行避光消毒,然后用蒸馏水清洗干净,再在约30℃下浸泡约8h后,然后每隔约lh使用蒸馏水喷淋经消毒浸泡处理后的糙米约1min,喷淋液流量约为100mL/min,每隔约12h更换一次培养液,在约30℃下萌发约36h,制得高γ-氨基丁酸含量的发芽糙米。
对比例4
将市售糙米除杂后,用浓度约1%的次氯酸钠溶液对其进行避光消毒,然后用蒸馏水清洗干净;糙米在约30℃下浸泡约6h后,在温度约为30℃、磁场强度约为10mT、暴露时间约为60min的条件下进行磁场诱导;然后每隔约1h使用蒸馏水喷淋经消毒浸泡处理后的糙米约1min,喷淋液流量约为100mL/min,每隔约12h更换一次培养液,在约30℃下萌发约24h,制得发芽糙米。
对比例5
将市售糙米除杂后,用浓度约1%的次氯酸钠溶液对其进行避光消毒,然后用蒸馏水清洗干净;糙米在约25℃下浸泡约6h后,每隔约2h使用浓度约为0.5mmol/Lγ-氨基丁酸溶液喷淋经消毒浸泡处理后的糙米约2min,喷淋液流量约为100mL/min,每隔约12h更换一次作为培养液的Y-氨基丁酸溶液,在约30℃下萌发约24h,制得高γ-氨基丁酸含量的发芽糙米。
实施例1-实施例5及对比例1-对比例5所获发芽糙米中γ-氨基丁酸的含量、发芽指标等分别如下表1所示。可以看到,实施例1所获发芽糙米中γ-氨基丁酸的含量与对比例2相比提高了约31.71%,根长和芽长等也均在NY/T 3216-2018规定的0.5-3mm范围内。
实施例2-实施例5所获发芽糙米中γ-氨基丁酸的含量均显著高于对比例3,且根长和芽长等也均在NY/T 3216-2018规定的0.5-3mm范围内。
实施例2所获发芽糙米中γ-氨基丁酸含量与对比例5相比提高了57.45%以上。实施例3所获发芽糙米中γ-氨基丁酸含量与对比例1相比提高了约5倍。
通过表1可以看到,在同一外源Y-氨基丁酸浓度培养下,实施例2中的GABA-T酶活显著低于对比例5,而GABA-T酶是γ-氨基丁酸分解关键酶,GABA-T酶活性降低说明磁场预处理能减少γ-氨基丁酸的降解,进而促进富集。另一方面,实施例中的相对电导率明显高于对照例,说明磁场预处理对细胞膜的通透性明显造成了影响。糙米发芽过程中主要是通过α-淀粉酶分解淀粉产生的还原糖来提供能量,在同一发芽时间下,实施例中的还原糖含量和α-淀粉酶活力与对照例相比有所提高,但是实施例中发芽糙米芽长依然小于3mm。
另外,参照对比例5的方法,分别采用浓度为0、0.1、0.5、1、5mmol/L的外源γ-氨基丁酸溶液培养获得发芽糙米,并将其命名为对照组。以及,参照实施例2的方法,采用磁场预处理联合浓度分别为0、0.1、0.5、1、5mmol/L的外源γ-氨基丁酸溶液培养获得发芽糙米,并将其命名为实验组。以激光共聚焦显微镜分别观察对照组及实验组所获各发芽糙米的根尖细胞,结果如图1所示,这反映了各发芽糙米细胞膜通透性的变化,并证明实验组所获发芽糙米具有更高的细胞膜通透性。一般来说,完整的细胞膜可以阻挡染色剂进入细胞导致的细胞核染色,因此细胞核染色情况越深细胞膜通透性越强,磁场联合γ-氨基丁酸处理后细胞核染色更明显,说明磁场提高了糙米细胞膜通透性,通过促进吸收来促进了γ-氨基丁酸的富集。在图1中,字母不同表示差异显著(p<0.05),BG、0.1G、0.5G、1G、5G分别为0、0.1、0.5、1、5mmol/L外源γ-氨基丁酸培养下的对照组;MF、0.1GM、0.5GM、1GM、5GM分别为磁场联合0、0.1、0.5、1、5mmol/L外源γ-氨基丁酸培养下的实验组。
再对对照组及实验组所获各发芽糙米的γ-氨基丁酸含量进行检测,结果如图2所示。
表1不同的处理方式获得的发芽糙米各指标的变化
此外,参照以上实施例1-实施例5的方法,采用市售的其它多种粳米、籼米、糯米进行试验,均可以获得高γ-氨基丁酸含量的发芽糙米,且这些发芽糙米均满足NY/T 3216-2018对发芽糙米功能性食品的要求。
上述的实施例仅为本发明的优选技术方案,而不应视为对于本发明的限制。本发明的保护范围应以权利要求记载的技术方案,包括权利要求记载的技术方案中技术特征的等同替换方案为保护范围,即在此范围内的等同替换改进,也在本发明的保护范围之内。
