敲除JAMs基因提高番茄对南方根结线虫抗性
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及生物技术领域,具体涉及一种通过敲除JAMs(JAM1,JAM2)基因提高番茄对南方根结线虫抗性的方法。
背景技术
目前,我们对茉莉酸(JA)的研究中的一个重要问题涉及激素的许多化学衍生物的生物学功能,非生物活性JA是活性JA的前体或失活形式。茉莉酸可以调节广泛的植物过程,包括生长和发育,以及针对生物和非生物胁迫的防御系统。尽管乙烯(ET)、水杨酸(SA)和其他植物激素对于控制植物-病原体相互作用很重要,但与JA相比,这些信号对寄主抗性的贡献相对较小。
对拟南芥(Arabidopsis thaliana)和番茄(Solanum lycopersicum)模型系统的数十年研究阐明了一个核心JA信号通路,该通路由多个相互连接的蛋白质-蛋白质相互作用模块组成,这些模块控制激素反应基因的转录状态。JA-Ile由F-box蛋白CORONATINEINSENSITIVE1(COI1)和JASMONATE ZIM DOMAIN(JAZ)蛋白组成的蛋白质复合物感知,导致泛素依赖性降解JAZ蛋白质从而激活MYC转录因子以调节JA响应基因。目前研究最多的JA诱导型转录因子是基本的螺旋-环-螺旋(bHLH)蛋白MYC2,它在拟南芥中充当JA的主要调节因子,此外MYC相关DNA结合蛋白的bHLH亚支,称为JA-ASSOCIATED MYC2-LIKE1(JAM1)、JAM2和JAM3,通过与MYC2的DNA结合能力竞争,在JA介导的防御反应中发挥负面作用。有研究表明JASMONATE ASSOCIATED MYC2-LIKE1(JAM1)、JAM2和JAM3编码其他基本螺旋-环-螺旋转录因子,参与不同的多防御反应,在拟南芥中以依赖COI1和MYC2的方式正调控防御反应。然而,与myc2相反,jam1/jam2/jam3三重突变体在用茉莉酸甲酯(MeJA)处理时表现出较短的根,表明对JA的反应增强。在MeJA处理后,关键的茉莉酸代谢基因以及一组编码调节JA反应性代谢基因的转录因子的基因受到JAMs的负调控。虽然研究已表明JAM1、JAM2和JAM3是在JA信号传导中主要拮抗MYC2的新因子,调节番茄对昆虫的抗性,但JAMs是否参与根结线虫的防御以及其中的机制还不清楚。
根结线虫(RKNs;Melodogyne spp.)是一类病原性寄生虫,主要侵染植物根部,对农业造成威胁。虽然目前有很多研究控制根结线虫,但有效控制根结线虫很困难,线虫对环境的威胁仍然不可小觑。所以,研究通过JA途径抵御病原体侵袭为今后植物-病原体防御提供理论基础,并有效抑制线虫对番茄的侵害。
为了探究JAMs如何参与根结线虫的抗性,我们创建了jam1,jam2单突突变体和jam1/jam2双突突变体植株,并发现了JAMs在番茄对南方根结线虫的防御中发挥负调控作用,这为JA途径与番茄对线虫的防御反应的研究提供了理论支撑,并创造了提高抗性的材料,对提高番茄的生产和产量具有重大意义。
发明内容
本发明通过CRISPR/CAS9技术构建了jams突变体植株,并且在野生型番茄(WT)和jams突变体植株中接种线虫4周后发现jams突变体植株的根结数目较野生番茄少,野生型番茄根结也比jams突变体的根结更为明显。据此,本发明提供了一种通过敲除JAMs基因提高番茄对南方根结线虫抗性的方法。
一种通过敲除JAMs基因提高番茄对南方根结线虫抗性的方法,所述JAMs基因为JAM1基因和/或JAM2基因;
所述JAM1基因选自以下两种中任意一种:
A、所述JAM1基因的碱基序列如SEQ ID NO:1所示;
B、任一其碱基序列与SEQ ID NO:1所示序列有90%以上同源性且编码如SEQ IDNO:2所示氨基酸序列的DNA分子;
所述JAM2基因选自以下两种中任意一种:
a、所述JAM2基因的碱基序列如SEQ ID NO:3所示;
b、任一其碱基序列与SEQ ID NO:3所示序列有90%以上同源性且编码如SEQ IDNO:4所示氨基酸序列的DNA分子。
JAMs基因在番茄中的表达量越低,在根结线虫侵染时根结数目越少,植株根结线虫抗性增强;JAMs基因在番茄中的表达量越高,在根结线虫侵染时根结数目越多,对根结线虫侵染越敏感。
一种通过敲除JAMs基因提高番茄对南方根结线虫抗性的优选方法,具体包括步骤:
(1)构建含所述JAMs基因CRISPR/Cas9载体的根癌农杆菌(Agrobacteriumtumefaciens)工程菌;
(2)将所述根癌农杆菌工程菌介导转化目标番茄外植体,制备得到JAMs基因敲除的jams突变体植株。
步骤(1)中,所述根癌农杆菌工程菌的制备方法如下:
(a)从野生型番茄幼嫩叶片中提取总RNA;
(b)将步骤(a)中获得的番茄总RNA反转录成cDNA;
(c)在CRISPR-P网站(http://cbi.hzau.edu.cn/cgi-bin/CRISPR)设计番茄JAMs基因的靶序列,为了对基因的大片段进行删除编辑,设计引物。本体系用的U6启动子,所以分别在sgRNA识别序列两端加上接头序列,理论上,当两个sgRNA同时发挥作用时,它们之间的大片段将被删除。将合成的sgRNA正反向引物进行退火形成含有粘性末端接头的双链sgRNA,稀释200倍后与经过BasI酶切过的sgRNA-Cas9骨架载体进行16℃过夜连接。连接产物转化大肠杆菌DH5α感受态细胞,在含有氨苄(Amp
以AtU6-F-KpnI为前引物,AtsgR-R-EcoRI为后引物,扩增第二个sgRNA序列,然后连入含有Cas9序列的骨架载体。将测序正确的阳性质粒用HindIII和EcoRI双酶切,将回收的片段和线性化的pCAMBIA1300进行过夜连接,转化到DH5α感受态中,在含有50mg/L卡那霉素的固体LB培养基中37℃过夜培养,挑单克隆培养,用1300-seq-R和AtUBQ-seq-R引物进行菌液PCR鉴定阳性克隆后测序。
(d)将步骤(c)获得的CRISPR/Cas9载体转入根癌农杆菌GV3101中,获得含番茄JAMs基因CRISPR/Cas9载体的根癌农杆菌工程菌。
步骤(2)中,所述番茄外植体可为番茄子叶。
可将所述JAMs基因敲除的jams突变体植株进行正常生长管理,获得稳定遗传的转基因F2代及以后种子。
可将所述JAMs基因敲除的jams突变体植株接种南方根结线虫,记录植株根结数目和表型。
接种南方根结线虫胁迫处理具体可为:当所述JAMs基因敲除的jams突变体植株长至五叶一心时,接种南方根结线虫。
接种的南方根结线虫可为处于J2期、具有侵染活力的南方根结线虫。
接种南方根结线虫处理的时间可为4周。
本发明中南方根结线虫的培养与接种处理的步骤为:
1)南方根结线虫由中国农业科学院彭德良教授馈赠,在农业试验站温室中用普通栽培番茄在沙壤土中繁殖线虫,室温维持在22~26℃。
2)将收获的根结用自来水冲洗干净后,用0.5%的次氯酸钠水溶液浸泡5min,再用蒸馏水清冲洗至没有次氯酸钠的刺鼻味为止。
3)将根系绞碎,将匀浆混合液依次过80目、200目、325目、500目筛子,继续用无菌水反复冲洗根系碎渣3次后过滤,最后在500目筛子上富集根结线虫虫卵。
4)将虫卵悬浮液搅拌均匀,吸取10μ于载玻片上,在50倍光学显微镜下观察统计虫卵数目并估算虫卵总量。按照10%~20%的孵化率计算本次所得线虫数量。
5)将卵悬浮液吸打到铺于10cm×10cm的方形培养皿中的灭菌吸水纸,置于28℃恒温培养箱中,期间注意保持吸水纸呈湿润状态。
6)2~3天后,获得J2期线虫,为避免虫体死亡,尽量在24h内接种使用。
7)在jams突变体植株长至五叶一心时进行接种,每株约接种1500条J2期线虫,期间正常浇水。
植株栽培在装有高温灭菌的河沙的塑料杯中。生长条件为:日夜温度23℃/20℃,14h光周期和600μmol m
jams突变体植株以番茄栽培品种Ailsa Craig为空白对照。
线虫处理结束后与相同种植条件下未进行线虫处理的对照组进行比对,观察jams突变体植株及其空白对照与未经胁迫处理的植株间的差异。
根结数目的观察方法如下:
采用酸性品红染色法,用于根结线虫感染的根系表型观察。具体方法为:
(A)将根结线虫侵染过的番茄根系用自来水冲洗干净后,根据根系的幼嫩程度,选用1.5%~5%的次氯酸钠溶液对根系漂白5分钟;
(B)用自来水反复冲洗直至没有次氯酸钠的刺鼻味;
(C)用吸水纸将根系水分吸干,在3.5%的酸性品红溶液中加热煮沸后室温冷却;
(D)用自来水冲洗根系,除去表面多余的品红液体;
(E)转移到常温酸性甘油中保存;
(F)24h后进行拍照和根结数统计。
本研究表明,jams突变体植株对南方根结线虫具有明显更高的抗性。
附图说明
图1为根结线虫侵染野生型植株0h、24h、36h、48h、72h后JAM1、JAM2、JAM3的基因表达图。
图2为根结线虫侵染野生型植株0h、24h、36h、48h、72h后JAM1蛋白水平变化图。
图3为jam突变体测序结果。
图4为野生型和jams突变体植株接种RKN四周后根结数目统计结果图,其中jam1代表敲除JAM1基因的突变体植株,jam2代表敲除JAM2基因的突变体植株,jam1/jam2代表同时敲除JAM1和JAM2基因的突变体植株。
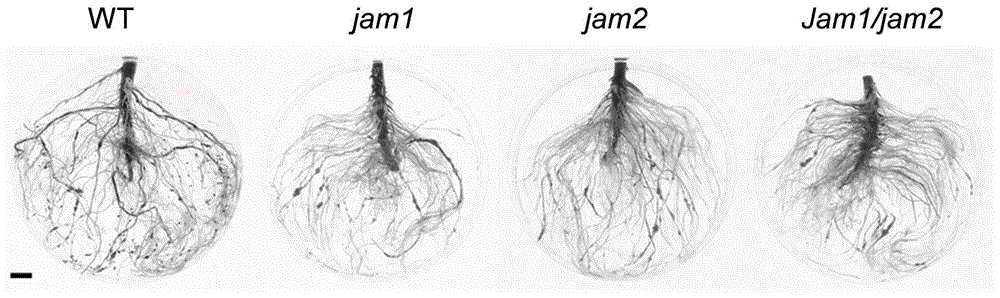
图5为野生型和jams突变体植株接种RKN四周后根结表型图,图中标尺为1cm,其中jam1代表敲除JAM1基因的突变体植株,jam2代表敲除JAM2基因的突变体植株,jam1/jam2代表同时敲除JAM1和JAM2基因的突变体植株。
具体实施方式
下面结合附图及具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的操作方法,通常按照常规条件,或按照制造厂商所建议的条件。
下述实施例中所用实验材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1
番茄jams突变体植株构建及检测
1.番茄总RNA提取
采用Tiangen Plant total RNA extraction kit提取番茄嫩根的总RNA,其步骤与上述总RNA提取方法相同。
2.基因克隆及根癌农杆菌工程菌构建
在CRISPR-P网站(http://cbi.hzau.edu.cn/cgi-bin/CRISPR)设计番茄JAMs(JAM1,JAM2)基因的靶序列,为了对基因的大片段进行删除编辑,设计引物。本体系用的U6启动子,所以分别在sgRNA识别序列两端加上接头序列,理论上,当两个sgRNA同时发挥作用时,它们之间的大片段将被删除。将合成的sgRNA正反向引物进行退火形成含有粘性末端接头的双链sgRNA,稀释200倍后与经过BasI酶切过的sgRNA-Cas9骨架载体进行16℃过夜连接。连接产物转化大肠杆菌DH5α感受态细胞,在含有氨苄(Amp
以AtU6-F-KpnI为前引物,AtsgR-R-EcoRI为后引物,扩增第二个sgRNA序列,然后连入含有Cas9序列的骨架载体。将测序正确的阳性质粒用HindIII和EcoRI双酶切,将回收的片段和线性化的pCAMBIA1300进行过夜连接,转化到DH5α感受态中,在含有50mg/L卡那霉素的固体LB培养基中37℃过夜培养,挑单克隆培养,用1300-seq-R和AtUBQ-seq-R引物进行菌液PCR鉴定阳性克隆后测序。
将获得的CRISPR/Cas9载体转入根癌农杆菌GV3101中,获得含番茄JAMs基因CRISPR/Cas9载体的根癌农杆菌工程菌。
所用引物序列如下:
sgRNA-JAM1-F1:CTGGTCTCTATTGaacaaagcaccagtggtctagtg(SEQ ID NO:5)
sgRNA-JAM1-R1:CTGGTCTCTAAAACAGACGCCACCATAGCtgcaccagccgggaa(SEQ ID NO:6)
sgRNA-JAM2-F1:GCTGGTCTCTTTTTgttttagagctagaaatagcaagtta(SEQ ID NO:7)
sgRNA-JAM2-R1:CTGGTCTCTCCATAGTCTTATCCTCATCAtgcaccagccgggaa(SEQ ID NO:8)
3.构建番茄jams突变体植株
通过农杆菌介导侵染番茄子叶,将目的载体转化进番茄子叶,利用潮霉素初步筛选出候选转基因植株。以潮霉素基因序列的正向引物和反向引物配对,PCR扩增方法筛选所获得的转基因植株。关于培养基的制备及无菌苗的培养方法与上述过表达植株相同,转化再生时采用含有目的载体质粒的根癌农杆菌工程菌菌液,通过生根培养、移栽,最后得突变体植株。
4.番茄jams突变体植株的PCR检测
在番茄JAMs基因的sgRNAs的序列位置附近设计特异性引物检测靶基因序列的变化情况。引物如下,检测片段长度,可以根据PCR产物条带的大小及测序结果筛选出JAMs敲除基因植株中的纯合突变体。
M13F:TGTAAAACGACGGCCAGT(SEQ ID NO:9)
M36-R:ggtattggtttatctcatcggaactgca(SEQ ID NO:10)
jam突变体测序结果见图3。
实施例2
对jams突变体植株和野生型番茄进行接种RKN处理。
番茄jams突变体植株和野生型番茄接种根结线虫处理的具体方法如下:
将野生型WT和突变体植株均分为两组,一组为对照组,一组为实验组。
当番茄长至五叶一心时,对实验组进行接种线虫处理,每株约接种1500条J2期线虫,期间正常浇水。
植株栽培在装有高温灭菌的河沙的塑料杯中。生长条件为:日夜温度23℃/20℃,14h光周期和600μmol m
线虫处理时间为4周。
实施例3
RKN侵染植株0h、24h、36h、48h、72h后JAM1、JAM2、JAM3在野生型中的基因表达。
具体方法如下:
当番茄长至五叶一心时,对植株进行接种线虫处理,每株约接种1500条J2期线虫后取根样进行qRT-PCR检测JAM1,JAM2,JAM3的表达水平。
实时荧光定量PCR(qRT-PCR)使用Roche
表1实时荧光定量PCR引物
实施例4
RKN处理野生型番茄,具体方法如下:当番茄长至五叶一心时,进行接种线虫处理,每株约接种1500条J2期线虫,期间正常浇水。
在接种0h、24h、36h、48h、72h后取番茄根样,提取蛋白,进行Western Blot,具体方法如下:
取0.3g蛋白样品于1.5mL离心管中,放入钢珠,在磨样仪中研磨成粉末,加入适量的蛋白提取液混合成匀浆,在冰上放置15min,4℃,12000g离心20min,取上清。用考马斯亮蓝法测定蛋白浓度SDS-PAGE胶分离蛋白转移至硝酸纤维素膜上,用含5%脱脂奶粉的TBS缓冲液(20mM Tris,pH 7.5,150mM NaCl,0.1%Tween 20)室温封闭1h,用JAM1抗体孵育1h,再用羊抗兔(Cell Signaling Technology,7074)的HRP二抗室温孵育1h,抗原抗体复合物利用鲁米诺化学发光检测试剂盒(Thermo Fisher Scientific,34080)检测。
实施例5
JAMs在番茄对根结线虫抗性中的作用
JAMs作为识别JA响应的新调节因子,与MYC2高度相似,其表达模式与JA反应基因的表达模式密切相关。拟南芥包含两个紧密的JAM1同源物分别为JAM2和JAM3。与myc2不同的是,jam1jam2jam3三重突变体显示出增强的JA响应表型,例如更短的根、更高的JA含量和花青素积累,以及调节JA响应代谢途径的转录因子的更高表达。JAM1、JAM2和JAM3在JA信号传导中主要与MYC2发挥拮抗作用,调节拟南芥中的各种代谢途径。由于MYC2被报道在番茄中参与根结线虫的防御,于是,在番茄中我们找到了JAM1及其同源蛋白JAM2和JAM3,在根结线虫侵染后48h诱导了JAM1,JAM2和JAM3的基因表达(图1),为了进一步探究JAMs的蛋白水平在根结线虫侵染后是如何变化的,我们定制了JAM1抗体,并发现在根结线虫侵染后蛋白水平却是下降的(图2)。
由此,我们创建了jams突变体植株,并验证了抗性。如图4、图5所示,我们发现jams突变体比野生型的根结数目显著性减少,且根结小于野生型。这些结果表明JAMs参与了RKN的抗性,且JAM1负向调控番茄对南方根结线虫的抗性。
此外应理解,在阅读了本发明的上述描述内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
