一种基于W/G/W结构的益生菌微胶囊、制备方法和应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于微胶囊制剂技术领域,尤其是一种基于W/G/W结构的益生菌微胶囊、制备方法和应用。
背景技术
益生菌是指服用足够量时能对人体产生有益作用的一类活的微生物。自从在牛奶中分离出乳酸菌开始,人类对益生菌的探索从未停止。目前,益生菌活性的保持,尤其是在加工、储存及在胃肠道中的存活率和稳定性等方面仍需大幅度提高。
为了提高益生菌的活性和储存稳定性,已经有很多方法用于保护益生菌免受不利条件的影响,其中微胶囊技术是保护菌体活力最为有效的方法。在目前可实现大规模生产的微胶囊制备方法中,喷雾干燥是较为常见的方法。但是在喷雾干燥过程中存在益生菌活力损失大,微胶囊粒径分布广且不均匀、微胶囊在体内的降解不可控,同时与食物基质复合不相容等问题。而乳化法制备的微胶囊更为稳定,微胶囊的粒径较小且均一,同时也可进行大规模生产。
具有生物相容性、无毒的壁材对于有效包埋是必不可少的。目前常用的包埋材料有蛋白类、多糖类和脂类,并取得了一定的进展,但是气体作为壁材一直被大家所忽视。
通过检索,尚未发现与本发明专利申请相关的专利公开文献。
发明内容
本发明的目的在于针对现有技术的不足之处,提供一种基于W/G/W结构的益生菌微胶囊、制备方法和应用,旨在研究气体作为壁材对益生菌的包埋保护。
本发明解决技术问题所采用的技术方案是:
一种基于W/G/W结构的益生菌微胶囊,所述微胶囊包括益生菌、低聚果糖、没食子酸、油相和疏水性乳化剂;其中,所述低聚果糖、没食子酸为用于包埋益生菌的水相,低聚果糖和没食子酸的质量比为5:4。
进一步地,所述油相为正己烷、十六烷、柠檬烯或乙酸乙酯等;所述疏水性乳化剂为固体纳米粒子、纤维素纳米晶体或玉米醇溶蛋白等。
进一步地,所述油相为分析纯试剂;所述固体纳米粒子为无机纳米粒子,如SiO
如上所述的基于W/G/W结构的益生菌微胶囊的制备方法,包括如下步骤:
(1)将益生菌在MRS液体培养基中静置培养,取培养后的菌液离心得到菌泥;
(2)将离心得到的菌泥重悬于含有低聚果糖和没食子酸的水相中,形成含有益生菌的内水相;
(3)将疏水性乳化剂与油相在超声条件下混合,以制备乳化剂分散均匀的有机油相;
(4)将步骤(2)制备得到的含有益生菌的内水相与步骤(3)所得有机油相在高速剪切机的作用下制备得到包埋益生菌的单层W/O乳液;
(5)将疏水性乳化剂与含有低聚果糖和没食子酸的水相进行超声处理,得到益生菌包埋的外水相;
(6)将步骤(4)制备的单层W/O乳液与步骤(5)的外水相混合,通过高速剪切制备包埋益生菌的W/O/W乳液;
(7)将步骤(6)得到的W/O/W乳液经过冷冻干燥,移除油相后,得到益生菌微胶囊粉,再将其复溶于含有低聚果糖和没食子酸的水相中,以获得W/G/W结构的益生菌微胶囊。
进一步地,所述步骤(1)中静置培养条件为37℃恒温培养箱静置培养16-18h,活菌数达到1×10
进一步地,所述步骤(3)中疏水性乳化剂与油相以质量比1:100进行超声混合,以250W的功率超声持续2min。
进一步地,所述步骤(4)中制备得到的内水相与步骤(3)所得有机油相以质量比为1:3进行混合,混合溶液在10krmp/min条件下剪切混合,持续2min。
进一步地,所述步骤(5)中疏水性乳化剂的添加量为水相总质量的2.5%,并在超声功率为250W的条件下持续2min;
或者,所述步骤(6)中单层W/O乳液与步骤(5)的外水相的体积比为1:1;混合溶液在6krmp/min条件下剪切混合,持续2min。
进一步地,所述步骤(7)中W/O/W乳液于-80℃冷藏24h后,置于真空冷冻干燥机中冷冻干燥24-48h移除油相,于水相中复溶后得到具有气体保护层的益生菌微胶囊。
如上所述的基于W/G/W结构的益生菌微胶囊在益生菌活性保持方面中的应用。
本发明取得的有益效果是:
1、本发明微胶囊的内水相包含益生元低聚果糖和活性物质没食子酸,二者发挥了协同作用,显著的提高了益生菌的存活能力,分别是单一添加的3.84倍和5.77倍,同时低聚果糖和没食子酸的协同作用增强了益生菌在胃肠道环境中的耐受性,在模拟肠液中孵育4h后益生菌的存活率达到102.9%。
2、本发明提供了一种以气体为壁材的益生菌微胶囊的制备方法,以含有低聚果糖和没食子酸的水溶液为水相,分别以添加益生菌和疏水性乳化剂的水相为内水相和外水相,正己烷为油相,通过剪切乳化制备W/O/W乳液,并利用真空冷冻干燥技术去除油相获得完整气体层包埋的益生菌微胶囊。相较于传统的蛋白类、多糖类壁材,本发明方法根据皮克林乳液界面稳定性构建W/G/W结构微胶囊,实现气体对益生菌的包埋。
3、本发明制备的W/G/W结构益生菌微胶囊在胃中不易被破坏,到达肠道后释放的益生菌的活性有所增强,益生菌数增加了约0.17Logcfu/g;同时本发明制备的微胶囊可以更好的保护菌体,延长益生菌在常温储存条件下的稳定性和活性。
4、本发明制备方法在制备时,不需要使用特殊的设备,所需原料易获得,均可从商业途径获得,因而更易加工获取。
5、本发明微胶囊的气体外壳不仅可以阻隔外界环境对益生菌的影响,还能快速触发释放,是一种益生菌或活性物质靶向递送的良好载体。通过气体包裹液体构成的W/G/W结构制备的益生菌微胶囊可以减缓益生菌的生长速度,增加益生菌对胃肠道环境的抗性,提高其保存活性。因此,以气体为壁材,利用乳化法包埋益生菌实现其微胶囊化具有广阔的应用前景。
附图说明
图1为本发明中低聚果糖和没食子酸的协同作用对益生菌生长的促进作用图;
图2为本发明中W/G/W结构微胶囊的荧光显微镜图;
图3为本发明中W/G/W结构微胶囊在模拟胃液中的降解图;
图4为本发明中W/G/W结构微胶囊在模拟胃液中的存活图;
图5为本发明中W/G/W结构微胶囊在模拟肠液中的释放图;
图6为本发明W/G/W结构微胶囊在-20℃的稳定性图;
图7为本发明中W/G/W结构微胶囊在4℃的稳定性图;
图8为本发明中W/G/W结构微胶囊在常温(25℃)的稳定性图。
具体实施方式
为更好理解本发明,下面结合实施例对本发明做进一步地详细说明,但是本发明要求保护的范围并不局限于实施例所表示的范围。
本发明中所使用的原料,如无特殊说明,均为常规市售产品,本发明中所使用的方法,如无特殊说明,均为本领域常规方法,本发明所使用的各物质质量均为常规使用质量。
一种基于W/G/W结构的益生菌微胶囊,所述微胶囊包括益生菌、低聚果糖、没食子酸、油相和疏水性乳化剂;其中,所述低聚果糖、没食子酸为用于包埋益生菌的水相,低聚果糖和没食子酸的质量比为5:4。
较优地,所述油相为正己烷、十六烷、柠檬烯或乙酸乙酯等;所述疏水性乳化剂为固体纳米粒子、纤维素纳米晶体或玉米醇溶蛋白等。
较优地,所述油相为分析纯试剂;所述固体纳米粒子为无机纳米粒子,如SiO
如上所述的基于W/G/W结构的益生菌微胶囊的制备方法,包括如下步骤:
(1)将益生菌在MRS液体培养基中静置培养,取培养后的菌液离心得到菌泥;
(2)将离心得到的菌泥重悬于含有低聚果糖和没食子酸的水相中,形成含有益生菌的内水相;
(3)将疏水性乳化剂与油相在超声条件下混合,以制备乳化剂分散均匀的有机油相;
(4)将步骤(2)制备得到的含有益生菌的内水相与步骤(3)所得有机油相在高速剪切机的作用下制备得到包埋益生菌的单层W/O乳液;
(5)将疏水性乳化剂与含有低聚果糖和没食子酸的水相进行超声处理,得到益生菌包埋的外水相;
(6)将步骤(4)制备的单层W/O乳液与步骤(5)的外水相混合,通过高速剪切制备包埋益生菌的W/O/W乳液;
(7)将步骤(6)得到的W/O/W乳液经过冷冻干燥,移除油相后,得到益生菌微胶囊粉,再将其复溶于含有低聚果糖和没食子酸的水相中,以获得W/G/W结构的益生菌微胶囊。
较优地,所述步骤(1)中静置培养条件为37℃恒温培养箱静置培养16-18h,活菌数达到1×10
较优地,所述步骤(3)中疏水性乳化剂与油相以质量比1:100进行超声混合,以250W的功率超声持续2min。
较优地,所述步骤(4)中制备得到的内水相与步骤(3)所得有机油相以质量比为1:3进行混合,混合溶液在10krmp/min条件下剪切混合,持续2min。
较优地,所述步骤(5)中疏水性乳化剂的添加量为水相总质量的2.5%,并在超声功率为250W的条件下持续2min;
或者,所述步骤(6)中单层W/O乳液与步骤(5)的外水相的体积比为1:1;混合溶液在6krmp/min条件下剪切混合,持续2min。
较优地,所述步骤(7)中W/O/W乳液于-80℃冷藏24h后,置于真空冷冻干燥机中冷冻干燥24-48h移除油相,于水相中复溶后得到具有气体保护层的益生菌微胶囊。
如上所述的基于W/G/W结构的益生菌微胶囊在益生菌活性保持方面中的应用。
具体地,相关的制备及检测如下:
1、实验材料
发酵乳杆菌CECT5716,如可以购于上海百施生物科技有限公司。
低聚果糖,购买于上海源叶生物科技有限公司;没食子酸,购买于天津希恩思生化科技有限公司;正己烷、疏水性气相二氧化硅均购买于麦克林生化科技股份有限公司。
2、实验设备
培养箱;离心机;真空冷冻干燥机;高速剪切机。
实施例1
一种基于W/G/W结构的益生菌微胶囊,所述微胶囊包括益生菌、低聚果糖、没食子酸、油相和疏水性乳化剂;其中,所述低聚果糖、没食子酸为用于包埋益生菌的水相,低聚果糖和没食子酸的质量比为5:4。
具体地,按照如下配方制备W/G/W结构的益生菌微胶囊:
上述的基于W/G/W结构的益生菌微胶囊的制备方法,包括如下步骤:
(1)将活化后的发酵乳杆菌CECT5716接种到MRS液体培养基中,于37℃静置培养18h,此时活菌数为1×10
(2)将疏水性气相二氧化硅与油相正己烷在超声条件(250W持续超声处理2min)下混合,制备乳化剂分散均匀、稳定的有机油相;
将疏水性气相二氧化硅与含有低聚果糖和没食子酸的水相进行超声处理(250W持续超声处理2min),得到用于益生菌包埋的稳定外水相溶液体系;
(3)将步骤(1)的含有发酵乳杆菌CECT5716内水相与步骤(2)中的油相按照质量比为1:3(w/w)的比例进行混合,并在10krmp/min的条件下剪切分散2min,得到W/O乳液;再将W/O乳液与步骤(2)中的制备得到的外水相溶液以体积比为1:1的比例混合,并在6krmp/min的条件下剪切分散2min,最终得到稳定的W/O/W乳液体系;
(4)将步骤(3)制备得到的稳定的W/O/W乳液于-80℃冷藏24h后,置于真空冷冻干燥机中冷冻干燥24-48h移除油相得到益生菌微胶囊粉末,再将其复溶于含有低聚果糖和没食子酸的水相中,得到W/G/W结构益生菌微胶囊。
对比例1
对比例1的制备步骤与实施例1相同,不同的是,对比例1中没食子酸的添加量为0,研究其对益生菌生长的促进作用。
对比例2
对比例2的制备步骤与实施例1相同,不同的是,对比例2中低聚果糖的添加量为0,研究其对益生菌生长的促进作用。
相关检测如下:
1、实施例1中所选水相组分有促进益生菌生长的作用。作为优选,选择益生元低聚果糖和活性物质没食子酸的混合溶液作为水相组分。结果如图1所示,添加益生元低聚果糖和活性物质没食子酸对发酵乳杆菌CECT5716的生长有促进作用,尤其集中在前6h内,随后对益生菌的生长促进作用增长缓慢,到24h后处于平稳。孵育48h后,发酵乳杆菌CECT5716两种物质上OD
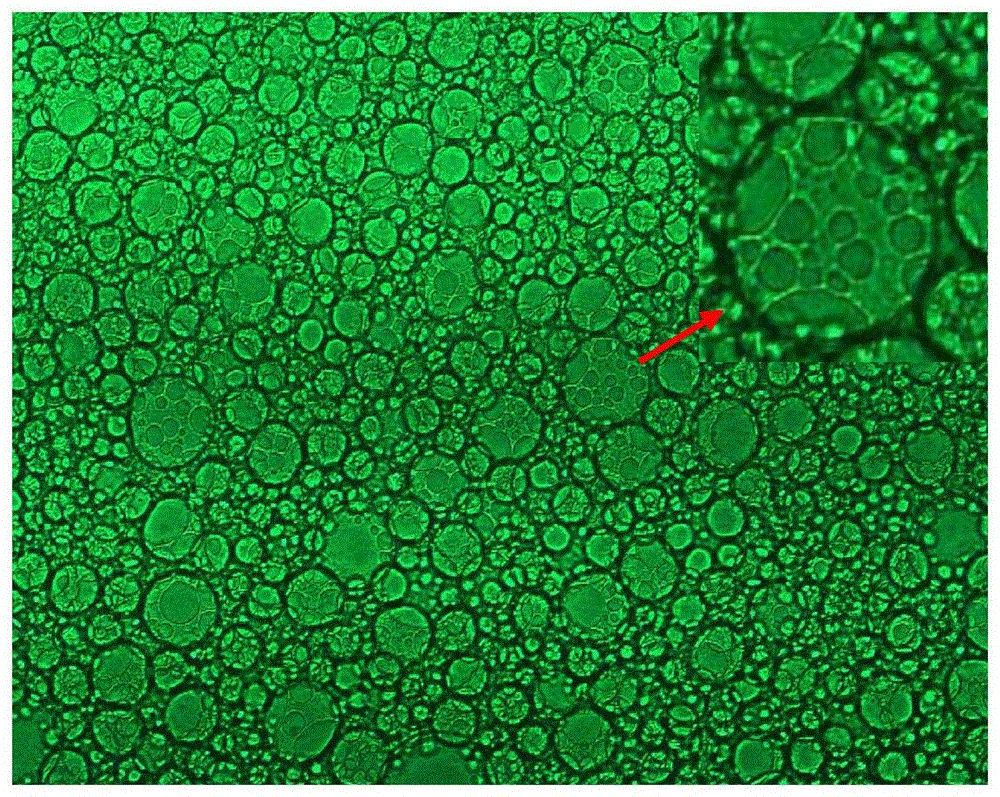
2、实施例1制备得到的W/G/W结构益生菌微胶囊的粒径为42.18μm;包埋率为66.71%。W/G/W结构益生菌微胶囊的结构图见图2。通过荧光显微镜可以清晰地观察到益生菌微胶囊呈现出稳定的“泡中泡”结构且乳液整体均匀分布。这是由于颗粒界面层通过在油水界面上的不可逆吸附,形成了一个刚性的物理屏障,阻止了表面活性剂的扩散和油滴的聚结,从而提高了乳液的稳定性。
其中,包埋率的测定方法为将制备的0.1g微胶囊粉置于20mL外水相溶液(加入了疏水性气相二氧化硅的低聚果糖和没食子酸的混合溶液)中,静置10min。取上清液进行平板计数,以计算未包埋的细菌数量。
包埋率(%)=(X-Y)/X×100%,其中X为活菌总数,Y是微胶囊粉中未被包埋的活菌数。
3、对实施例1制得的W/G/W结构益生菌微胶囊进行了模拟体外胃肠道消化实验以及储存稳定性实验。
(1)模拟胃部条件
测试方法为:将0.5g微胶囊粉和0.5mL游离菌悬液分别置于4.5mLpH2的模拟胃液(将2.0g氯化钠溶于7mL盐酸中,并加蒸馏水定容至1000mL,用0.1mol/L的盐酸调节pH为1.2后加入胃蛋白酶使其浓度达到3.2g/L,通过0.22μm滤膜进行过滤除菌)中,涡旋震荡使其混合均匀后于250W超声2min以破坏微胶囊的W/G/W结构。随后,将其以150r/min的速度在37℃恒温振荡培养箱中温育120min。在第0、60和120min分别取出相应的样品,梯度稀释后进行平板计数测定益生菌的存活率。
微胶囊在胃液中稳定存在是发挥其保护作用的前提。益生菌在模拟胃液中的稳定性可以参考图3。微胶囊在模拟胃液中比较稳定,孵育过程中基本没有益生菌的释放,初步满足了微胶囊在胃液中不被释放的条件。此外,这一结果也表明益生元低聚果糖和活性物质没食子酸的添加不会影响微胶囊在模拟胃液中的稳定性。
益生菌在模拟胃液中的存活率见表1和图4,其中以0min时益生菌的存活率为基准。
表1W/G/W结构微胶囊在模拟胃液中的存活
由表1和图4可知,游离菌株在模拟胃液中的活力持续下降,经过2h孵育后,游离菌株的存活率将至47.3%;W/G/W结构微胶囊中的益生菌经过2h模拟胃液处理后的存活率为78.4%,是游离菌株的1.66倍;结果表明,本实施例的W/G/W结构益生菌微胶囊在模拟胃液消化的环境中结构相对稳定,耐胃酸能力较强,能够相对有效地抵抗胃酸的作用,保持微胶囊良好的稳定性与完整性,从而显著提高W/G/W结构微胶囊中益生菌的存活率。
(2)模拟肠道消化条件
测试方法为:将0.5g微胶囊粉和0.5mL游离菌株悬液分别置于4.5mL、pH6.8的模拟肠液(将6.8g磷酸二氢钾溶于250mL蒸馏水中,再加入77mL0.2mol/L的氢氧化钠和10g胰蛋白酶,混合后用0.2mol/L的氢氧化钠或0.2mol/L的盐酸调节pH至6.8±0.1,用蒸馏水定容至1000mL,通过0.22μm滤膜进行过滤除菌)中,涡旋震荡使其混合均匀后于250W超声2min以破坏微胶囊的W/G/W结构。随后,以150r/min的速度在37℃恒温振荡培养箱中温育4h。在第0、1、2、3和4h分别取出相应的样品,梯度稀释后进行平板计数测定益生菌的存活率。
益生菌在模拟肠液中的存活率见表2和图5,其中以0min时益生菌的存活率为基准。
表2W/G/W结构微胶囊在模拟肠液中的释放
由表2和图5可知,游离菌株在模拟肠液中经过4h孵育后会有所失活,在4h后存活率降至98.46%。但是W/G/W结构微胶囊保护的益生菌菌株在模拟肠液条件下反而有所增长,在4h后达到102.9%。一般来说,包埋益生菌的微胶囊在经过模拟胃肠到消化环境之后,益生菌的存活率在25%-75%不等。而本发明中包埋益生菌的W/G/W结构微胶囊的气体屏障更加稳定,保护了益生菌在强酸和高胆盐条件下的活力,同时低聚果糖和没食子酸的协同作用,促进了发酵乳杆菌CECT 5716的存活率,对于益生菌的活性保持起到了更加积极地作用。
(3)W/G/W结构益生菌微胶囊的储存稳定性实验
测试方法为:将游离菌株与益生菌微胶囊分装到密封的西林瓶中,并于-20℃、4℃和25℃进行储存,每隔7天进行一次平板计数,确定活菌数。
如图6至图8所示,在三个不同的储存温度下,游离菌株的活菌数均存在较大程度的降低,尤其在常温条件下游离菌株数量急剧下降,4周之后基本无存活菌株;W/G/W结构微胶囊中的活菌数保持相对较好,经过10周的储存期之后,4℃条件下活菌数减少了2.99LogCFU/g;-20℃条件下活菌数减少了2.48Log CFU/g;常温条件下(25℃)活菌数减少了4.11Log CFU/g。由此可知,温度越低越有利于微胶囊的储存。其中,在常温条件下储存49天时,W/G/W结构微胶囊的活菌数仍然≥10
尽管为说明目的公开了本发明的实施例,但是本领域的技术人员可以理解:在不脱离本发明及所附权利要求的精神和范围内,各种替换、变化和修改都是可能的,因此,本发明的范围不局限于实施例所公开的内容。
