一种中性粒细胞外囊泡基因递送系统及在骨关节炎治疗中的应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及基因递送与骨关节炎治疗技术领域,具体涉及中性粒细胞外囊泡基因递送系统的构建以及在骨关节炎治疗中的应用。
背景技术
骨关节炎是一种患病率高、致残率高且以关节软骨不可逆损伤和滑膜炎症为特征的慢性关节疾病。目前尚无治愈药物。其中,软骨细胞合成分解代谢不平衡是加剧软骨不可逆损伤的关键。在骨关节炎进程中,骨关节炎化软骨细胞合成软骨基质的能力逐渐丧失;并且会分泌更多的软骨降解酶,如基质金属蛋白酶、蛋白聚糖酶等,进一步加剧软骨基质损伤;此外,还会产生大量的促炎因子,分泌损伤相关分子模式,进一步加重滑膜炎症。若从根源克服软骨细胞合成分解代谢不平衡,可能是骨关节炎的有效治疗手段。
基因药物可从基因层面发挥调控作用,是治疗骨关节炎的潜在药物。然而由于关节滑膜下毛细血管与淋巴管丰富,基因药物难以在关节腔滞留;且软骨基质是致密的无血管无神经的负电性三维网状结构,其孔隙大小仅为60nm,而软骨细胞离散分布在软骨基质,造成基因药物难以在极为致密的负电性软骨基质中穿行并到达软骨细胞。
随着纳米材料技术的发展,纳米药物载体能够将基因药物包载至纳米颗粒中,提高基因药物稳定性,在疾病的诊断和治疗中展现了巨大的优势。常用的纳米药物载体主要包括脂质体和聚合物胶束等。利用其小粒径的渗透作用,部分纳米制剂可渗透致密的软骨基质到达软骨细胞。但是这些传统的纳米药物载体存在易被机体清除,软骨细胞靶向效率不高等问题,达不到预期治疗的效果。进而需要重复多次的关节腔注射,存在患者顺应性不佳的问题。因此,亟需研究安全高效的基因药物递送载体以增强基因药物在骨关节中的长期滞留,并提高对软骨细胞的递送效率。
发明内容
本发明的目的在于克服现有载体关节滞留能力差和软骨细胞靶向递送效率不佳的问题,提供一种新型的基因药物递送载体中性粒细胞外囊泡。
本发明的另一目的是提供以中性粒细胞外囊泡为载体的新型中性粒细胞外囊泡基因递送系统。
本发明的又一目的是提供中性粒细胞外囊泡基因递送系统在骨关节炎治疗中的应用。
一种中性粒细胞外囊泡基因递送系统,由中性粒细胞细胞外囊泡及其中荷载的基因药物组成。
作为本发明的一种优选,所述的中性粒细胞细胞外囊泡是中性粒细胞在炎症因子刺激下出芽产生的具有双层膜结构的细胞微泡。
作为本发明的一种优选,所述的中性粒细胞外囊泡粒径在100~1000nm范围,电位在-5~-25mV,并以Annexin A1为特征蛋白。
作为本发明的一种优选,所述的炎症因子选自肿瘤细胞坏死因子TNFα,白介素IL-8,或佛波酯PMA。
作为本发明的一种优选,所述的基因药物选自siRNA,miRNA,mRNA或pDNA,优选miRNA。
作为本发明的一种优选,所述的中性粒细胞外囊泡基因递送系统,通过电穿孔法将基因药物导入到中性粒细胞外囊泡中。
作为本发明的一种优选,所述基因药物与中性粒细胞细胞外囊泡的药载比为100-1500pmol/μg,优选500-1000pmol/μg。
作为本发明的一种优选,所述的中性粒细胞外囊泡基因递送系统,粒径在100~1000nm范围,电位在-5~-25mV,包封率在40~90%。
本发明所述的中性粒细胞外囊泡作为基因递送载体的应用。
本发明所述的中性粒细胞外囊泡基因递送系统在制备骨关节炎的药物中的应用。
本发明利用中性粒细胞外囊泡保留的中性粒细胞的炎性关节趋向性,提高了基因药物在炎性关节中的富集和滞留;同时克服了中性粒细胞自身的促炎作用,可与基因药物协同发挥骨关节炎治疗作用。本发明将弥补目前无治愈骨关节炎药物的空白,为基因药物提供新型递送载体,为骨关节炎治疗提供新策略和新药物。
本发明公开一种制备高产率高活性的中性粒细胞外囊泡的技术方案,具体步骤如下:
(1)提取分离中性粒细胞:提取分离SPF级C57BL6小鼠股骨和胫骨,用注射器吸取1640培养基将骨髓吹出,加入红细胞裂解液,于4℃静置3-10min,200-500g离心后用1640培养基重悬得到细胞悬液。平铺等体积的一系列浓度梯度的Percoll分层液,分别为50-60%,60-70%,70-80%。最后平铺上述得到的细胞悬液,500-1500g离心20-60min。取50-60%与60-70%Percoll分层液交界处的细胞得到中性粒细胞。
(2)将20-100ng/mL炎症因子如肿瘤细胞坏死因子TNFα,白介素IL-8或佛波酯PMA等与分离得到的中性粒细胞(1×10
(3)收集(2)所述细胞上清液,于4℃,500-1500g离心1-20min,取上清;再次于4℃,10000-15000g离心1-20min取上清;最后再于4℃,20000-25000g离心0.5-4h。收集沉淀,用PBS洗涤三遍后,得到所需的中性粒细胞外囊泡。
本发明公开的上述中性粒细胞外囊泡的提取分离方法可用于生产大量高纯度且高表达功能蛋白Annexin A1的中性粒细胞外囊泡。
本发明一种中性粒细胞外囊泡基因递送系统的制备方法。通过电穿孔方法将基因药物载入上述的中性粒细胞外囊泡中,由此构建得到中性粒细胞外囊泡基因递送系统。具体步骤如下:
(1)预转染溶液的配置:将基因药物与中性粒细胞外囊泡用PBS或培养基混合。置于电穿孔板中,得到预转染溶液;其中,基因药物包括但不限于siRNA,miRNA,mRNA和pDNA,优选miRNA;基因药物与中性粒细胞外囊泡的混合比例为100-1500pmol/μg,优选500-1000pmol/μg。
(2)电穿孔:将步骤(1)中所述预转染溶液进行电穿孔处理,其中电穿孔方法为CA-137、DS-150、CM-138、DS-120、CM-137、EH-100、CM-150、EO-100、DN-100、EN-138、DS-138、EN-150、DS-137、EW-113、DS-130(电穿孔仪器:LONZA 4D-Nucleofector)。
(3)超高速离心收集中性粒细胞外囊泡基因递送系统:收集(2)所述液体,4℃,20000-25000g离心0.5-4h。收集沉淀,用PBS洗涤三遍后,得到中性粒细胞外囊泡基因递送系统。
本发明的中性粒细胞外囊泡基因递送系统粒径在100-1000nm之间,电位在-5--25mV之间。包封率在40%-90%。
本发明所述的中性粒细胞外囊泡基因递送系统,可保持中性粒细胞的炎性关节靶向性。此外,还证明可有效滞留在炎性关节、并能在软骨组织中渗透和靶向软骨细胞,同时该中性粒细胞外囊泡自身还具有一定的抗炎能力。
本发明所述的中性粒细胞外囊泡基因递送系统在骨关节炎治疗中的应用。
有益效果:
本发明开发了中性粒细胞外囊泡作为新型基因药物递送载体,以电穿孔的方法将基因药物荷载在中性粒细胞外囊泡内,得到相应的中性粒细胞外囊泡基因递送系统,在骨关节炎治疗效果中显著优于单一的中性粒细胞外囊泡和游离基因药物。中性粒细胞外囊泡这种新型的基因递送载体,内部无富酶细胞器且免疫原性较低,可实现基因药物的稳定荷载;且中性粒细胞外囊泡具备软骨细胞趋向性,软骨组织渗透能力和抗炎能力,可有效在骨关节炎部位滞留,具有安全高效的递送效率;并能协同基因药物发挥骨关节炎治疗作用;可作为一种优异的骨关节炎基因药物递送载体。
本发明公开的中性粒细胞外囊泡提取分离技术,可成功提取高纯度、高产率和高稳定性的中性粒细胞外囊泡(实施例1-8)。本发明公开的中性粒细胞外囊泡基因递送系统的构建方法,简便、快捷、通用,可用于多种基因药物的荷载,包括siRNA(实施例9),miRNA(实施例10),mRNA(实施例11)和pDNA(实施例12)。成功构建的中性粒细胞外囊泡递送系统(实施例13-15)具有较好的包封率(实施例16)和载药量(实施例17),且体外稳定性良好(实施例18)。此外,基因药物荷载后不会影响中性粒细胞外囊泡Annexin A1的表达(实施例19),并证明具有良好的关节滞留(实施例20)和软骨细胞靶向能力(实施例21)。为基因药物的递送提供了新的技术平台,具有广阔的应用前景。
本发明公开的上述中性粒细胞外囊泡基因递送系统相比单一的中性粒细胞外囊泡或基因药物具有最佳的治疗效果(实施例22),为骨关节炎的治疗提供新载体和新药物。
附图说明
图1为本发明中性粒细胞外囊泡的透射电子显微镜图(比例尺:100nm)。
图2为本发明中性粒细胞外囊泡Annexin A1和Alix的表达结果图。
图3为本发明中性粒细胞外囊泡在4℃PBS中储存10天的粒径和电位结果图。
图4本发明中性粒细胞外囊泡基因递送系统的透射电子显微镜结果图(比例尺:100nm)。
图5为本发明中性粒细胞外囊泡和中性粒细胞外囊泡基因递送系统在4℃储存10天的粒径和电位结果图。
图6为本发明中性粒细胞外囊泡载药前后Annexin A1的表达结果图。
图7为本发明中性粒细胞外囊泡基因递送系统在小鼠关节处的长期表达情况
图8为本发明中性粒细胞外囊泡基因递送系统在小鼠关节处Cy5的荧光强度图。
图9为本发明中性粒细胞外囊泡基因递送系统在小鼠关节处DIR的荧光强度图。
图10为本发明中性粒细胞外囊泡基因递送系统在小鼠软骨组织中的渗透情况。
图11为本发明中性粒细胞外囊泡基因递送系统递送至关节处的基因表达水平,ns,无显著性差,****P<0.0001,单向方差分析。
图12为本发明利用番红固绿染色技术检测骨关节炎小鼠关节腔注射中性粒细胞外囊泡基因递送系统的软骨保护作用结果图(比例尺:100μm)。
图13为本发明利用H&E染色技术检测骨关节炎小鼠关节腔注射中性粒细胞外囊泡基因递送系统的抗炎作用结果图(比例尺:100μm)。
具体实施方式
下面结合附图并通过具体实施例对本发明作进一步详述,但这些实施例不对本发明构成任何限制。
实施例1:中性粒细胞的制备和表征
提取分离SPF级C57BL6小鼠股骨和胫骨,用注射器吸取1640培养基将骨髓吹出。离心(500g,3min),弃上清,加入1mL红细胞裂解液,于4℃静置3min,离心(500g,3min),弃上清,用1mL 1640培养基重悬得到细胞悬液。平铺等体积的一系列浓度梯度的Percoll分层液,分别为55%,65%,75%。最后平铺上述得到的细胞悬液,1000g离心30min。取55%与65%Percoll分层液交界处的细胞,用PBS洗涤3次,得到中性粒细胞。经测定,中性粒细胞纯度为91.6%,总凋亡率仅为8.1%,说明本方法提取的中性粒细胞纯度较高,活力较好,可在一定程度上避免凋亡小体的产生,有利于后续中性粒细胞外囊泡的提取分离。
实施例2:中性粒细胞外囊泡的制备
将中性粒细胞用PBS重悬至浓度为1×10
实施例3:中性粒细胞外囊泡的形貌表征
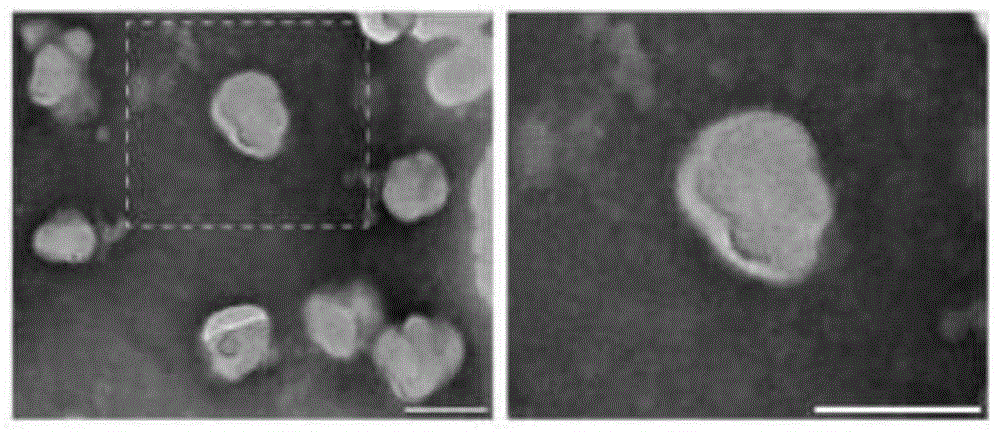
将实施例2制备的中性粒细胞外囊泡PBS悬液滴加至铺有碳膜的铜网上,室温静置,用滤纸吸取多余的溶液。以0.1%磷钨酸钠溶液负染5min,滤纸吸取多余的染液,室温干燥后应用HT-7700透射电子显微镜观察拍照(电压100kV)。透射电镜图像如图1,结果显示中性粒细胞外囊泡为典型的细胞外囊泡“茶托状”结构,粒径约为100nm。
实施例4:中性粒细胞外囊泡的粒径和浓度表征
将实施例2制备的中性粒细胞外囊泡PBS悬液采用纳米粒子跟踪分析仪分析,设置仪器灵敏度为80.0,帧频为30.0,快门速度为100。结果表明中性粒细胞外囊泡水合粒径为142nm,每10
实施例5:中性粒细胞外囊泡的电位表征
将实施例2制备的中性粒细胞外囊泡PBS悬液采用电位仪检测其电位。结果表明中性粒细胞外囊泡的平均电位为-15mV。
实施例6:中性粒细胞外囊泡的蛋白量表征
通过BCA蛋白定量试剂盒测定中性粒细胞外囊泡的蛋白浓度,结果表明10
实施例7:中性粒细胞外囊泡的纯度
Annexin A1是中性粒细胞外囊泡的标志物,Alix为外泌体的标志物。因此,通过Wes全自动蛋白质表达定量分析系统检测实施例2制备的中性粒细胞外囊泡上Annexin A1和Alix的表达,结果如图2所示。表明50ng/mL TNFα刺激中性粒细胞1h所得中性粒细胞外囊泡上Annexin A1表达较高,同时相比外泌体,Alix表达较低,说明此时中性粒细胞外囊泡活性较好,纯度较高。
实施例8:中性粒细胞外囊泡的体外稳定性表征
将实施例2制备的中性粒细胞外囊泡PBS悬液于4℃保存,每天测量其粒径和电位(如图3所示),结果表明中性粒细胞外囊泡在4℃的PBS中,粒径和电位在10天内无显著性差异,具有良好的储存稳定性。
实施例9:中性粒细胞外囊泡基因递送系统(siRNA@MV)的制备
向电穿孔板中加入2μg中性粒细胞外囊泡和1600pmol的荧光FAM标记的无功能siRNA(FAM-siRNA),使用PBS混合均匀,使得终体积为20μL,用LONZA 4D-Nucleofector的DS137程序进行电穿孔。随后回收孔板中的样品,于4℃,20000g离心1h,弃去上清,PBS洗涤沉淀3次,PBS重悬得到中性粒细胞外囊泡基因递送系统,即siRNA@MV。
实施例10:中性粒细胞外囊泡miRNA递送系统(miRNA@MV)的制备
向电穿孔板中加入2μg中性粒细胞外囊泡和1600pmol的miRNA-140,使用PBS混合均匀,使得终体积为20μL,用LONZA 4D-Nucleofector的DS137程序进行电穿孔。随后回收孔板中的样品,于4℃,20000g离心1h,弃去上清,PBS洗涤沉淀3次,PBS重悬得到中性粒细胞外囊泡基因递送系统,即miR140@MV。
实施例11:中性粒细胞外囊泡mRNA递送系统(mRNA@MV)的制备
向电穿孔板中加入2μg中性粒细胞外囊泡和1600pmol的绿色荧光蛋白GFP-mRNA,使用PBS混合均匀,使得终体积为20μL,用LONZA 4D-Nucleofector的DS137程序进行电穿孔。随后回收孔板中的样品,于4℃,20000g离心1h,弃去上清,PBS洗涤沉淀3次,PBS重悬得到中性粒细胞外囊泡基因递送系统,即mRNA@MV。
实施例12:中性粒细胞外囊泡pDNA递送系统(pDNA@MV)的制备
向电穿孔板中加入2μg中性粒细胞外囊泡和1600pmol的pDNA(pmaxGFP),使用PBS混合均匀,使得终体积为20μL,用LONZA 4D-Nucleofector的DS137程序进行电穿孔。随后回收孔板中的样品,于4℃,20000g离心1h,弃去上清,PBS洗涤沉淀3次,PBS重悬得到中性粒细胞外囊泡基因递送系统,即pDNA@MV。
实施例13:中性粒细胞外囊泡基因递送系统的形貌表征
将实施例10所得中性粒细胞外囊泡基因递送系统(miR140@MV)的PBS悬液滴加至铺有碳膜的铜网上,室温静置,用滤纸吸取多余的溶液。以0.1%磷钨酸钠溶液负染5min,滤纸吸取多余的染液,室温干燥后应用HT-7700透射电子显微镜观察拍照(电压100kV)。透射电镜图像如图4。结果显示中性粒细胞外囊泡基因递送系统为具有双层膜结构的球形囊泡,且相比载药前,载药后中性粒细胞外囊泡粒径明显增加约50nm,并呈现更为饱满的球形结构。
实施例14:中性粒细胞外囊泡基因递送系统的粒径和浓度表征
将实施例10所得中性粒细胞外囊泡基因递送系统(miR140@MV)的PBS悬液采用纳米粒子跟踪分析仪分析,设置仪器灵敏度为80.0,帧频为30.0,快门速度为100。结果表明中性粒细胞外囊泡基因递送系统的水合粒径为200nm,10
实施例15:中性粒细胞外囊泡基因递送系统的电位表征
将中性粒细胞外囊泡基因递送系统的PBS悬液采用电位仪检测其电位。实施例9-12制备的中性粒细胞外囊泡基因递送系统的平均电位如下表所示:
表1中性粒细胞外囊泡基因递送系统的平均电位
实施例16:中性粒细胞外囊泡基因递送系统包封率的测定
以Cy3标记的miR140(Cy3-miR140)为例,按照实施例10的方法制备得到Cy3-miR140@MV。其中MV量为2μg,miRNA量为1600pmol,电转方法为DS137。将电转后的样品,于4℃,20000g离心1h,收集上清,用酶标仪检测上清的荧光量,酶标仪激发波长为532nm,发射波长为580nm,绘制Cy3-miR140的荧光标准曲线,根据拟合公式计算出上清中的Cy3-miR140含量,并根据下列公式计算出包封率:包封率(%)=(Cy3-miR140总摩尔量-上清Cy3-miR140摩尔量)/Cy3-miR140总摩尔量×100%。结果表明,中性粒细胞外囊泡基因递送系统(Cy3-miR140@MV)包封率为56%。
实施例17:中性粒细胞外囊泡基因递送系统载药量的测定
以Cy3标记的miR140(Cy3-miR140)为例,按照实施例10的方法制备得到Cy3-miR140@MV。其中MV量为2μg,miRNA量为1600pmol,电转方法为DS137。将电转后的样品,于4℃,20000g离心1h,收集沉淀。记录空白超滤管外管重量,将离心所得的细胞外囊泡沉淀转移至超滤管(截留分子量为3000Da)中除盐,其中加入一同体积PBS的超滤管作为对照。回收超滤管中制剂进行冻干,记录冻干后的超滤管重量。并在每管中加入含有1%Triton X-100的100μL PBS复溶,后转移至96孔板中酶标仪检测荧光强度,计算冻干后的Cy3-miR140@MV中Cy3-miR140的质量,按照下述公式计算载药量:载药量(%)=冻干后的Cy3-miR140@MV中Cy3-miR140质量/(冻干后超滤管重量-空白超滤管重量)×100%。结果表明,中性粒细胞外囊泡基因递送系统载药量为0.1%。
实施例18:中性粒细胞外囊泡基因递送系统的体外稳定性
将实施例10所得中性粒细胞外囊泡基因递送系统(miR140@MV)的PBS悬液于4℃保存,每天测量其粒径和电位(如图5所示),结果表明中性粒细胞外囊泡基因递送系统的粒径和电位在4℃的PBS中10天内无显著性差异,具有良好的储存稳定性。
实施例19:中性粒细胞外囊泡基因递送系统Annexin A1蛋白相对表达量的测定
通过Wes全自动蛋白质表达定量分析系统检测实施例10所得中性粒细胞外囊泡(miR140@MV)载药前后Annexin A1的表达,如图6所示,结果表明载药前后中性粒细胞外囊泡上Annexin A1表达量无显著性差异,说明电穿孔操作不会影响细胞外囊泡上Annexin A1蛋白的含量。
实施例20:中性粒细胞外囊泡基因递送系统在关节的滞留能力
选取SPF级雄性8周C57BL6小鼠,在异氟烷麻醉下,对小鼠的右腿膝关节进行前交叉韧带横断术,待4周后,小鼠骨关节炎模型构建完毕。将骨关节炎小鼠分为以下几组:Normal(正常组)、Sham(假手术组)、Single Saline(单次生理盐水组)、Multiple miR140@MV(每周一次膝关节注射1.5μg miR140@MV,共给药四次)、Single miR140@MV(单次膝关节注射1.5μg miR140@MV)。并按照组别进行不同给药处理。于第1、2、3、7、9、14、19、21、24、28天取小鼠膝关节组织,经液氮浸泡后进行研磨,用RNA提取试剂盒提取关节总RNA。经逆转录后,通过qPCR仪进行扩增,以Normal为对照组进行归一处理,考察各组在不同时间点的相对miR140表达,其中U6的表达作为内参。
结果表明(如图7所示),骨关节炎小鼠单次生理盐水组miR140表达显著降低,约为Normal组miR140水平的10%。单次给药和多次给药组小鼠关节miR140水平约为正常组小鼠水平3-4倍,且显著高于生理盐水组。说明miR140@MV的有效递送,显著提高了关节处miR140的表达。值得注意的是,单次给药即可使miR140在关节处表达长达28天,证明了miR140@MV在关节的长期滞留作用,有利于提高患者顺应性。
实施例21:中性粒细胞外囊泡基因递送系统的软骨细胞靶向能力
选取SPF级雄性8周C57BL6小鼠,在异氟烷麻醉下,对小鼠的右腿膝关节进行前交叉韧带横断术,待4周后,小鼠骨关节炎模型构建完毕。
以Cy5标记的miR140(Cy5-miR140)为例,将MV经DIR染色,按照实施例10的方法制备得到Cy5-miR140@DIR-MV。同时游离药物Cy5-miR140和空白细胞外囊泡DIR-MV作为对照。将药物经关节腔注射至小鼠右膝关节中,每只1.5μg,通过小动物活体成像系统观察实验小鼠右侧膝关节处Cy5(如图8所示)和DIR(如图9所示)的荧光强度随时间的变化。结果表明,中性粒细胞外囊泡基因递送系统在体内滞留时间长达48h,有利于其发挥治疗作用。
于给药48h后提取每组小鼠的关节软骨,用冰冻切片机进行切片,切片厚度为8μm,载玻片吸附切片组织后,浸于4%多聚甲醛中固定1h。使用90%甘油封片,于共聚焦显微镜下观察制剂分布(如图10所示)。结果表明,给药48h后Cy5-miR140组软骨组织中无Cy5-miR140存在,说明该组小鼠关节处Cy5-miR140已被完全清除;DIR-MV小鼠软骨组织中可观察到DIR-MV分布其中,说明MV可穿透致密的软骨基质;Cy5-miR140@DIR-MV组小鼠的软骨组织可观察到分布于软骨深处的共定位荧光信号,说明Cy5-miR140@DIR-MV在体内可以穿透致密的软骨基质。鉴于软骨组织中仅有软骨细胞,进一步证明Cy5-miR140@DIR-MV具备软骨细胞靶向性。
实施例22:中性粒细胞外囊泡基因递送系统对骨关节炎的治疗作用
以miR140为基因药物,按照实施例10构建中性粒细胞外囊泡基因递送系统(miR140@MV)。
选取SPF级雄性8周C57BL6小鼠,在异氟烷麻醉下,对小鼠的右腿膝关节进行前交叉韧带横断术,待4周后,小鼠骨关节炎模型构建完毕。随机将骨关节炎小鼠分为5组,每组5只,分组如下:生理盐水(Saline)、游离miR140(700pmol/只)、空白中性粒细胞外囊泡(MV,1.5μg)、无功能的中性粒细胞外囊泡基因递送系统(miRNC@MV,1.5μg)、中性粒细胞外囊泡基因递送系统(miR140@MV,1.5μg,相当于700pmol miR140)。同时,将与上述构建模型小鼠一同购入的健康小鼠(Normal)作为对照组。除此之外,构建仅切开关节囊的假手术组小鼠(Sham)进行比较,避免模型构建操作对实验的影响。每7天给药一次,共给药四次,于最后一次给药后4天检测各项指标。
(1)基因递送效率:在研究终点,对小鼠实施安乐死,收集小鼠关节,提取RNA,以U6的表达作为内参,通过RT-qPCR方法检测各组小鼠膝关节miR140表达水平(如图11所示)。结果表明miR140@MV可以更为显著地提高关节处miR140水平,约为游离miR140的两倍。说明本发明制备的miR140@MV可显著提高miR140的体内递送效率,拮抗因骨关节炎引起的关节miR140降低,同时可以协同MV发挥上调miR140的作用,最终显著提高关节处的miR140水平。所用RT-qPCR检测引物见表2:
表2RT-qPCR检测引物列表
(2)小鼠关节的软骨组织染色:在研究终点,对小鼠实施安乐死,收集小鼠关节,置于4%多聚甲醛中室温固定48h。制备关节石蜡切片,并进行番红O-固绿染色,通过正置荧光显微镜观察切片。结果如图12所示,生理盐水组由于软骨损伤严重,番红O染料出现失染的情况,而miR140,MV,miRNC@MV和miR140@MV组均在一定程度上减少了软骨的磨损,其中miR140@MV番红O染色面积较大,软骨基本完好。说明miR140@MV具备软骨修复能力。除此之外,生理盐水组和miRNC@MV组观察到了明显的骨赘,miR140和MV组观察到了明显的滑膜侵袭,说明游离miR140和空白MV治疗骨关节炎的效果有限。而miR140@MV组软骨边缘平滑,未观察到骨赘和滑膜侵袭,具有良好的骨关节炎治疗效果,治疗效果显著优于miR140和MV组。
(3)小鼠关节的滑膜组织染色:在研究终点,收集小鼠关节,置于4%多聚甲醛中室温固定48h。石蜡包埋后,使用石蜡切片机对组织进行切片,组织切片厚度为4μm。通过苏木精伊红染色分析膝关节滑膜组织切片,使用正置荧光显微镜观察切片。结果如图13所示,相比于正常组和假手术组的单层滑膜内衬细胞,生理盐水组滑膜显著增厚,细胞数量显著增加,并呈现密集的带状炎症浸润,而miR140、空白MV和miRNC@MV组滑膜炎症浸润程度虽然有所缓解,但滑膜都有一定程度增厚,并仍伴随着向半月板和软骨侵袭的情况。然而,miR140@MV组滑膜呈现单层的滑膜内衬细胞,无明显炎症浸润,且无滑膜侵袭的情况,滑膜未见明显炎症,抗炎效果显著优于miR140和MV组。
以上实施例仅是对本发明技术方案和技术效果的举例说明,不能因此限定本发明保护范围。本发明也利用IL-8、PMA制备了miRNA-140@MV,也具有与上述实施例极其相近似的效果,对骨关节炎具有良好的治疗效果。
- 一种超顺磁修饰中性粒细胞外泌体仿生囊泡药物递送生物制剂及其制备方法
- 一种超顺磁修饰中性粒细胞外泌体仿生囊泡药物递送生物制剂及其制备方法
