一种新型稳定剂薄膜水化法制备高包封率Nisin纳米脂质体的方法及其应用
文献发布时间:2024-04-18 19:58:53
技术领域
本发明属于Nisin纳米脂质体制备和应用技术领域,具体涉及一种新型稳定剂薄膜水化法制备高包封率Nisin纳米脂质体的方法及其应用。
背景技术
细菌素因其高安全性和有效的抗菌活性而成为食品生物防腐剂的重要来源。其中,乳酸链球菌素(Nisin)是最具代表性的细菌素,Nisin对革兰氏阳性致病菌(如金黄色葡萄球,Yusuf,2018)有很强的抑制作用。Nisin被美国食品和药物管理局(FDA)列为"公认安全"(GRAS)(Ucar,Ozogul,Ozogul,Durmus,
现有几种制备纳米脂质体的方法,其中薄膜水化法相对简单(Khorasani,Danaei,&Mozafari,2018)。另外,薄膜水化法允许使用毒性较小的有机溶剂(如乙醇),可以与水混溶(Penoy,Grignard,Evrard,&Piel,2021),因此该法较其它制备方法的安全性相对较高。然而,在制备过程中,水相细菌素能否被有效地包封到纳米脂质体中,主要取决于细菌素和磷脂层之间的相互作用(Mozafari,Johnson,Hatziantoniou,&Demetzos,2008)。但是,磷脂层存在易积累等缺陷,导致纳米脂质体存在大小不均和分布不均等问题,甚至影响包封效率,限制它的应用(Ajeeshkumar,Aneesh,Raju,Suseela,Ravishankar,&Benjakul,2021)。目前,在制备纳米脂质体时,通过添加稳定剂对改善磷脂层的缺陷至关重要。由于胆固醇是两亲性的,可以结合到磷脂层中,从而调节其流动性,提高所产生的纳米脂质体的稳定性(Bondu&Yen,2022)。因此,胆固醇是目前最常用的纳米脂质体稳定剂(Thabet,Elsabahy,&Eissa,2022)。然而,考虑到高胆固醇饮食造成的健康风险(Gorjian,RaftaniAmiri,Mohammadzadeh Milani,&Ghaffari Khaligh,2021;H.Ma,2004),因此筛选更安全的化合物替代胆固醇以提高纳米脂质体的稳定性与提高包封率成为研究的重点。
此外,作为纳米脂质体磷脂层的重要组成部分,稳定剂与细菌素之间的相互作用也值得关注。通过筛选制备过程中使用的新型稳定剂,并采用薄膜水化法制备安全性高、封装效率高的细菌素纳米脂质体。
发明内容
针对现有技术的不足,本发明的目的是提供一种以薄膜水化法制备Nisin纳米脂质体的方法。本发明以Nisin为模型细菌素,采用薄膜水化法制备Nisin负载的纳米脂质体。三种天然具有两亲性基团的化合物(姜黄素、白藜芦醇和柚皮苷),被用作Nisin纳米脂质体的潜在稳定剂。筛选出新型稳定剂可以改善Nisin纳米脂质体的特性和提高封率,通过测量Nisin纳米脂质体的粒径、PDI、Zeta电位和封装效率进行筛选。随后,通过傅里叶交换红外光谱(FT-IR)和分子对接技术研究了新型稳定剂(姜黄素)和Nisin之间的相互作用,以阐明其提高Nisin纳米脂质体封装效率的机制。最后,还评估了Nisin纳米脂质体对牛奶中金黄色葡萄球菌的抑制效果。
为了实现上述目的,本发明采用以下技术方案:
一种薄膜水化法制备Nisin纳米脂质体的方法,先将蛋黄卵磷脂、稳定剂和溶剂混合溶解,然后除去溶剂,得到混合物;然后将Nisin溶解在缓冲液中,再加入上述混合物中,进行常规薄膜水化法制备Nisin纳米脂质体;所述稳定剂为姜黄素、白藜芦醇或柚皮苷中的一种或多种。
优选地,蛋黄卵磷脂和稳定剂的混合比例是10~20:1。
优选地,将Nisin溶解在PBS缓冲液中,得到浓度为0.5~1mg/mL的nisin溶解液。
优选地,PBS缓冲液的pH值为6~7。
优选地,Nisin与稳定剂的质量比1:0.01~2。
优选地,所述稳定剂为姜黄素或白藜芦醇。
与现有技术相比,本发明的有益效果体现在:
本发明筛选了可以作为薄膜水化法制备纳米脂质体的新型稳定剂,提高了纳米脂质体对Nisin的包封效率,尤其是当姜黄素作为稳定剂时制备的纳米脂质体(Cu-NLs)效果最好。制备的Cu-NLs具有粒径小、粒径分布均匀、zeta电位绝对值高、稳定性好等特点。在牛奶防腐实验中,Cu-NLs避免了脂肪对乳酸链球菌素的不良影响,有效地保护了乳酸链球菌素(Nisin)的活性。
附图说明
图1为电镜结果(a)NL和(b,c)Cu-NL。
图2为BL、Ch-BL、Cu-BL和Cu-NL的DSC热力学图。
图3为(a)Cu-BL与蛋黄卵磷脂和姜黄素以及(b)Cu-NL和Nisin的FT-IR光谱比较。
图4为(a)Cu-BL与蛋黄卵磷脂和姜黄素、(b)Cu-NL和Nisin的XRD谱图比较。
图5为Nisin与姜黄素的分子对接结果(a)Nisin与姜黄素结合位点的三维图,(b)Nisin与姜黄素相互作用残基的二维图。
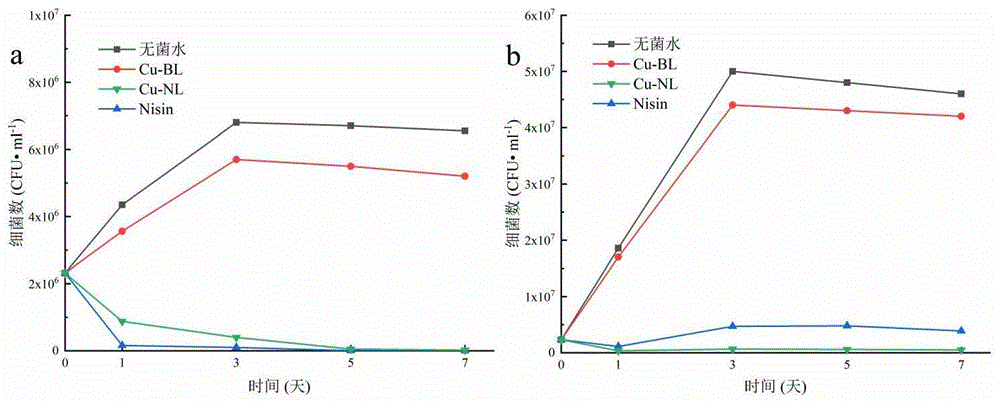
图6为(a)脱脂牛奶和(b)全脂牛奶中Cu-NL、Cu-BL、Nisin和无菌水对金黄色葡萄球菌的活性比较。
具体实施方式
以下结合具体实施例对本发明进行详细说明,但不限制本发明的范围。应当理解的是,对本领域普通技术人员来说,可根据上述说明加以改进或变换,而所有这些改进和变换都应属于本发明所附权利要求的保护范围。
实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行制备。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
实施例1Nisin纳米脂质体的制备
分别使用胆固醇、姜黄素、白藜芦醇和柚皮苷作为稳定剂,采用薄膜水化法制备纳米脂质体(Lopes,Pinilla,&Brandelli,2017)。将蛋黄卵磷脂(70毫克)、稳定剂(5毫克)和无水乙醇(5毫升)置于棕色烧瓶中,密封并涡旋,直到固体完全溶解。然后在30℃下通过旋转蒸发除去乙醇,在烧瓶底部留下高度粘稠的有机胶体。将Nisin溶解在PBS缓冲液(0.01mol/mL,pH6.8)中,得到Nisin溶液(0.5mg/mL)。然后将Nisin溶液(5毫升)加入棕色烧瓶中,将所得混合物超声处理,直到粘稠的有机凝胶完全分散在溶液中。重复超声处理(37kHz)用于缩小纳米脂质体的粒径,使用超声处理1分钟,再停止1分钟,连续处理10个循环(Sarabandi,Jafari,Mohammadi,Akbarbaglu,Pezeshki,&Khakbaz Heshmati,2019)。然后使用脂质体挤出机(LiposoFast,Avestin,加拿大)将纳米脂质体悬浮液来回通过200纳米的聚碳酸酯薄膜11次,分别获得胆固醇Nisin纳米脂质体(Ch-NLs)、姜黄素Nisin纳米脂质体(Cu-NLs)、白藜芦醇Nisin纳米脂质体(Re-NLs)和柚皮苷Nisin纳米脂质体(Na-NLs)。同样的程序也用于制备不添加稳定剂的Nisin纳米脂质体(NLs)。NLs被用作空白对照,Ch-NLs被用作阳性对照。
性能测试:
1、Nisin纳米脂质体的尺寸、PDI和Zeta电位
使用纳米粒子分析仪(NANO ZSE,Malvern,UK)测量纳米脂质体的粒径、多分散指数(PDI)和Zeta电位。用超纯水稀释制备的纳米脂质体悬浮液至10
2、Nisin纳米脂质体的封装效率
使用PBS缓冲液(0.01mol/mL,pH=6.8)溶解Nisin,得到梯度浓度的Nisin溶液。然后,用紫外分光光度计(U-3900H,Hitachi,Ltd.,Japan)测量Nisin溶液在220纳米处的吸光度,并拟合和建立Nisin-吸光度标准曲线。(Lopes et al.,2017)。
将制备好的Nisin纳米脂质体悬液马上加入Ultra-15离心过滤装置(10kDa,MWCO,Millipore,USA),使用冷冻离心机(UNIVERSAL 320R,Hettich,German)在4℃下以9,000rpm离心10分钟,收集滤液。随后,将制备好的Nisin纳米脂质体悬浮液首次加入Ultra-15离心过滤装置(10kDa,Millipore,美国),然后用冷冻离心机(UNIVERSAL 320R,Hettich,德国)在4℃下以9,000rpm离心10分钟,收集其滤液。随后,用紫外分光光度计测量滤液在220纳米处的吸光度,并结合标准曲线计算滤液中的Nisin浓度。随后,根据公式(1)计算纳米脂质体的封装效率。
3、Nisin纳米脂质体的形貌结构观察
通过透射电子显微镜(TEM)观察Cu-NL和NL的形貌和结构。将制备的NL和Cu-NL悬液使用超纯水进行稀释,然后滴在有碳膜支撑的200目铜网上,用2%醋酸铀溶液负染30s,自然晾干。样品制备完成后用透射电子显微镜(JEM1400,JEOL,日本)在电压80kV条件下进行观察。
4、纳米脂质体的热力学分析
制备空白的纳米脂质体以研究姜黄素与磷脂和Nisin的相互作用。用2.2节所述的相同方法制备空白纳米脂质体,但在PBS缓冲液(0.01mol/mL,pH=6.8)中不添加nisin。制备了空白纳米脂质体(BLs,无稳定剂)、胆固醇空白纳米脂质体(Ch-BLs,使用胆固醇作为稳定剂)和姜黄素空白纳米脂质体(Cu-BLs,使用姜黄素作为稳定剂)。
差示扫描量热法(DSC;214Polyma,NETZSCH,德国)被用来确定Cu-NLs、Cu-BLs、Ch-BLs和BLs相变过程中的热力学变化。每个样品(3毫克)被放置在一个铝坩埚中,然后将其密封并置于氮气环境中,用一个空的铝坩埚作为参考。将样品温度调整到25℃并保持5分钟,然后以10℃/min
5、纳米脂质体的FT-IR分析
将Cu-NLs、Cu-BLs、蛋黄卵磷脂、Nisin和姜黄素分别与KBr粉末混合,用压片机在12.5MPa的压力下压成薄片,时间大于1分钟。然后用FT-IR光谱仪(Tensor 27,Bruker,USA)在4000到400cm-1范围内对这些薄片进行扫描。
6、纳米脂质体的XRD分析
X射线衍射(XRD)系统(D8 Advance,德国布鲁克公司)设置在40kV和40mA下,分析Cu-NLs、Cu-BLs、蛋黄卵磷脂、Nisin和姜黄素。以10°/min
7、姜黄素与Nisin的结合模式的模拟分析
通过分子对接模拟进一步研究了姜黄素和Nisin之间的相互作用。nisin的X射线晶体结构(PDB ID:5XHB)是从RCSB蛋白质数据库(http://www.rcsb.org)中获得的。姜黄素的结构(PubChem CID:969516)从PubChem数据库(https://pubchem.ncbi.nlm.nih.gov)中获得。使用AutoDockVina 4.2软件进行分子对接,将Nisin设定为刚性受体,姜黄素设定为柔性配体。最后,选择具有最低结合能量的对接结果作为最佳模型(Li,Yang,Wang,Ma,&Peng,2023),并使用Discovery Studio 4.5可视化姜黄素和nisin之间的结合模式。
8、Nisin纳米脂质体对全脂和脱脂牛奶中金黄色葡萄球菌的抑制作用
通过菌落计数法(Li等,2023)评估Cu-NLs和游离的Nisin对液态全脂牛奶(脂肪=4.0g/100mL,蛋白质=3.2g/100mL)和脱脂牛奶(脂肪=0g/100mL,蛋白质=3.2g/100mL)中金黄色葡萄球菌的抑制效果。将金黄色葡萄球菌悬浮液(2×106CFU/min,100μL)加入到含有脱脂或全脂牛奶(10mL)的试管中。然后,加入Cu-NL(1mL)、Cu-BL(1mL)、Nisin溶液(0.5mg/min,1mL)或无菌水(1mL)。然后将所有试管保存在4℃,在0、1、3、5和7天通过菌落计数检测金黄色葡萄球菌数量。将培养物十进制稀释,分成三份,接种到含有菌落计数琼脂的平板上,在37℃培养24小时。
9、数据处理和统计分析
结果用SPSS22(IBM,美国)进行单因素方差分析。在P<0.05的情况下,数值被认为有显著差异。图像用Image J处理,而线性拟合和制图用Origin 9.65(Origin Lab,美国)进行。分子对接模型用Discovery Studio 4.5(Biovia,美国)进行可视化和分析。
试验结果
1、Nisin纳米脂质体的粒径、PDI、Zeta电位和包封率(EE)
粒径、PDI和Zeta电位是三个重要的指标,用于评估纳米脂质体的均匀性和稳定性。尺寸是指纳米脂质体的平均直径。较小的纳米脂质体有利于将活性物质更好地输送到食品系统的各个部分,提高其利用率(Weiss,Takhistov,&McClements,2006)。如表1所示,所有的Nisin纳米脂质体都小于200纳米。与NLs的尺寸(162.63纳米)相比,Ch-NLs(153.93纳米)、Re-NLs(153.73纳米)和Cu-NLs(155.00纳米)明显更小,但Na-NLs(173.03纳米)更大。PDI反映了纳米脂质体的粒径分布,数值越小说明纳米脂质体的均匀性越好(da Silva等人,2014)。Re-NLs(0.137)、Ch-NLs(0.131)和Cu-NLs(0.121)的PDI与NLs(0.199)相比明显降低,但是Na-NLs的PDI(0.200)没有降低。因此,Cu-NLs和Re-NLs在尺寸和PDI方面与Ch-NLs相似,没有明显的差异。
此外,Zeta电位反映了纳米脂质体表面的电荷。更高的绝对值表明纳米脂质体之间的静电排斥力更大,使它们不太可能聚集在一起(Li等人,2023)。与NLs的zeta电位(-34.17mV)相比,Cu-NLs(-47.10mV)、Re-NLs(-45.00mV)、Ch-NLs(-39.07mV)和Na-NLs(-36.73mV)的Zeta电位更负。此外,Cu-NLs和Re-NLs的Zeta电位的绝对值都明显高于Ch-NLs,表明Cu-NL和Re-NL系统更加均匀和稳定。
包封率(EE)是确定生物活性成分装载量的一个重要参数。表1显示了NLs、Cu-NLs、Re-NLs、Na-NLs和Ch-NLs的包封率。与NLs的EE(62.74%)相比,Cu-NLs(95.94%)、Re-NLs(92.55%)、Ch-NLs(90.65%)和Na-NLs(64.58%)的EE值明显更高,表明添加稳定剂可以提高纳米脂质体的包封率。然而,Na-NLs的EE明显低于Ch-NLs,表明柚皮苷不适合替代胆固醇作为稳定剂。而分别以姜黄素和白藜芦醇作为稳定剂的Cu-NLs(95.94%)和Re-NLs(92.55%)被发现明显比Ch-NLs更有效,其中Cu-NLs的EE最高。
迄今为止,Nisin是研究得最多的细菌素,但Malheiros制备的包封率仅34%(daSilva Malheiros等人,2010)。Pinilla等人使用薄膜水化法制备了使用胆固醇作为稳定剂的Nisin纳米脂质体,EE最高也只有80.7%。(Pinilla,Reque,&Brandelli,2020)。
使用姜黄素作为稳定剂Cu-NLs拥有最高的包封率,还具有良好的特性(粒径、PDI和Zeta点位)。因此,姜黄素被选为具有潜力的新型稳定剂,用于制备具有良好性能和高EE的Nisin纳米脂质体。
表1Nisin纳米脂质体的大小、PDI、Zeta电位和包封率
注:同一列中的不同字母表示在P<0.05的水平上存在显著性差异
2、Nisin纳米脂质体的形貌结构
通过TEM观察NLs和Cu-NLs的微观结构,以及Nisin在纳米脂质体中的分布(图1)。NLs(160.04nm,图1a)和Cu-BLs(155.24nm,图1b,c)的粒径与DLS方法得到的结果一致。从图1a可以看出,NLs和Cu-NLs具有球形的形态。值得注意的是,可以看到与Amjadi,Almasi,Hamishehkar,Alisadeh Khaledabad,&Lim(2022)报告的类似的双层结构,外层是磷脂层(浅灰色),内层是含有Nisin的均匀水层(深灰色)。Cu-NLs的内层与NLs的内层相似,是含有Nisin的水核心(深灰色)。然而,与NLs相比,Nisin(黑色)更集中在Cu-NLs的边缘。这推测是姜黄素(作为纳米脂质体稳定剂)和Nisin之间存在相互作用,导致溶液中的Nisin集中在磷脂双分子层的边缘,导致了Cu-NLs的高包封率。
3、纳米脂质体的热力学结果
差示扫描量热法(DSC)是研究磷脂双分子层的热行为和纳米脂质体的稳定性的有效方法(Demetzos,2008)。纳米脂质体相变过程的热力学变化与磷脂双分子层的分子排列有关(Demetzos,2008;Klopfenstein,de Kruyff,Verkleij,Demel,&van Deenen,1974)。BLs、Ch-BLs、Cu-BLs和Cu-NLs的热力学数据显示在图2。磷脂的相变焓(△E)受到分子间相互作用的强烈影响。Cu-BLs的相变焓(18.089J/g)比BLs的相变焓(21.475J/g)低。此外,Cu-BLs的△E(18.089J/g)与BL(21.475J/g)相比有所降低,这是由于姜黄素的插入和姜黄素与磷脂分子之间的相互作用导致磷脂层的分子排列改变。
相变温度的峰值(Tpeak)指示了磷脂层的流动性(Zhang,Gu等人,2022)。随着温度的增加,磷脂层从固体变为液体,流动性增加(Demetzos,2008)。Cu-BLs的Tpeak(7.68℃)明显低于BLs(16.07℃)。这表明Cu-BL磷脂层在实际应用中具有更好的流动性,这有利于封装的活性物质的释放。
作为一种非结晶物质,卵磷脂有较宽的相变温度范围,而不是具体的相变温度。Ch-BLs的相变温度范围(-2.66至23.14℃)比BLs(-20.78至29.82℃)窄,因为胆固醇和磷脂双层之间的相互作用消除了后者的预过渡阶段(Matsingou&Demetzos,2007)。Cu-BLs的相变温度范围(-16.97至26.84℃)也比BLs窄。姜黄素含有一些与胆固醇相似的化学基团(如羰基);因此,姜黄素与磷脂的相互作用可能与胆固醇相似。所以,温度范围和焓值的变化表明姜黄素改变了Cu-BLs中磷脂双分子层的结构。
同样,负载了Nisin的Cu-NLs也有一个宽的相变温度范围(-14.03至27.01℃)和一个低的Tpeak(7.50℃)。因此,Cu-NL的磷脂层也具有良好的流动性。DSC结果表明,姜黄素的加入改变了磷脂双分子层的结构,基于Cu-BL体系的Cu-NL也很理想。
4、纳米脂质体的FT-IR分析
为了确认姜黄素和Nisin分别存在于Cu-BL和Cu-NL中,并研究姜黄素和Nisin之间的相互作用,进行了FT-IR光谱分析。蛋黄卵磷脂、姜黄素、Cu-BL、Nisin和Cu-NL的FT-IR光谱见图3。蛋黄卵磷脂的光谱包含六个特征峰(图3a):不饱和酰基链的烯烃=C-H伸展(3010cm
蛋黄卵磷脂在3420cm
图3b显示了3,439cm
Nisin有两个特征吸收峰,来自酰胺I的C=O基团的拉伸(1,651cm
5、纳米脂质体的XRD分析
比较了蛋黄卵磷脂、姜黄素、Cu-BL、Nisin和Cu-NLs的XRD衍射图(图4),以验证姜黄素插入到Cu-BL,Nisin细菌素被负载到Cu-NLs中。如图4a所示,蛋黄卵磷脂的XRD衍射图在2θ10-30°有一个宽峰,表明其非结晶性质。相比之下,姜黄素的XRD衍射图在2θ=10-30°范围内含有一系列尖锐的峰,表明其具有结晶性(Huang等人,2017)。在Cu-BLs的XRD衍射图中,对应于蛋黄卵磷脂的宽峰减少,姜黄素的尖峰明显变弱,表明姜黄素插入了磷脂层,改变了磷脂的结晶结构。XRD和DSC的结果结合起来有力地表明,姜黄素的加入改变了磷脂层的结构。
如图4b所示,Nisin的XRD谱包含一些尖锐的特征峰,表明其结晶性质。值得注意的是,在Cu-NL的XRD图谱中仍然可以观察到Nisin的两个主要特征峰(2θ=31.67°和45.41°),但这些峰明显变弱,表明Nisin在Cu-NL中的结晶度降低了。
7、姜黄素与Nisin结合的模拟
图5显示了姜黄素-Nisin系统的最佳模拟分子对接结果。三维视图(图5a)显示姜黄素弯曲折叠进入Nisin结合袋。姜黄素与20个氨基酸残基相互作用,包括THR-36、ANS-37、GLU-115、LYS-118和GLY-119。其中,二维视图(图5b)显示,三个氨基酸残基(GLU-115,LYS-118,GLY-119)与姜黄素形成常规氢键(深绿色),长度分别为2.08,2.98和
利用AutoDockVina 4.2计算和模拟姜黄素和Nisin之间的氢键、疏水相互作用和范德华力。这与Racz等人(2023)在AutoDock Vina 4.2模拟中得到的结果相似,后者揭示了姜黄素和β-乳球蛋白之间存在氢键、疏水相互作用和π-π堆积。Liu等人利用AutoDock研究了姜黄素和卵清蛋白之间的相互作用,发现了氢键和范德华力(Liu,Cai,Ying,Fu,Xiong,&Le,2018)。
据报道,姜黄素与蛋白质之间的结合主要通过疏水相互作用发生,在某些情况下涉及氢键和范德华力(Tang,2020)。Zhang等(2020)通过圆二色性和分子动力学模拟证实了姜黄素与肌球蛋白之间的氢键和疏水相互作用。Rajabi等人利用热变性和分子对接证实了姜黄素和牛胰蛋白酶之间存在氢键和范德华力(Rajabi,Farhadian,Shareghi,Asgharzadeh,&Momeni,2019)。因此,本研究揭示的姜黄素与Nisin之间的相互作用与上述报道相似。
值得注意的是,通过FT-IR也证实了Nisin和姜黄素之间存在氢键和疏水相互作用。这两种相互作用模式,可能与额外的范德华力,被认为是Nisin向磷脂层聚集和Nisin-姜黄素纳米脂质体的高包封率。此外,模拟结果显示Nisin与姜黄素结合的能量为-6.7kcal。这与之前关于姜黄素与其他蛋白质结合的报道相似(Racz et al.,2023),结合能小于0kmol/mol
8、Nisin纳米脂质体在脱脂和全脂牛奶中的抗菌活性
金黄色葡萄球菌是一种常见的食源性病原体。它产生毒素(Lin et al.,2023),导致食物变质和人类食物中毒,是鸡蛋和牛奶乳制品中常见的革兰氏阳性污染物(Zhang,Wang,etal.,2022)。Nisin是一种安全的天然防腐剂,对许多革兰氏阳性细菌具有很强的抑制作用,包括那些导致食物腐败和致病的细菌(Kirazli&Tunca,2022)。然而,Nisin往往会与食物成分(如脂肪)相互作用,从而降低其抗菌活性(Chollet et al.,2008)。为了验证Cu-NLs对Nisin细菌抑制活性的保护作用,评价了Nisin和Cu-NLs对全脂牛奶和脱脂牛奶中金黄色葡萄球菌抑制效果。
图6为金黄色葡萄球菌在4℃牛奶中的生长曲线。在没有Nisin的情况下,由于姜黄素的抑制作用,Cu-BL处理组的菌落少于阴性对照组(无菌水)(Ma,Moser,Han,Leonhard,Schneider-Stickler,&Tan,2020)。然而,无菌水与Cu-BL两组金黄色葡萄球菌的生长趋势相同,均在第3天达到峰值,金黄色葡萄球菌的生长不受影响(图6a)。7d后,乳中添加Nisin或Cu-NLs后,金黄色葡萄球菌的生长受到抑制,细菌数量持续减少。第3天,全脂牛奶中使用Nisin组的金黄色葡萄球菌菌落数量出现反弹,在脱脂牛奶中继续减少(图6b),这主要是因为Nisin被脂肪吸附,使其无法发挥抑制金黄色葡萄球菌的生长。最重要的是,在全脂牛奶中,Cu-NL组金黄色葡萄球菌的总数没有反弹,细菌的生长一直受到抑制,这表明Cu-NL保护了含脂肪牛奶中的Nisin。
本发明的上述实施例仅仅是为了清楚地说明本发明技术方案的所作的举例,而并非是对本发明的具体实施方式的限定。凡在本发明权利要求书的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
