用于检测癌症相关细胞群体、进行转移性癌症筛查及治疗的方法
文献发布时间:2023-06-19 10:32:14
根据《美国法典》第35章第119节(e)项的规定,本专利申请案主张于2018年7月2日提交的编号为62/693,235以及于2019年1月14日提交的编号为62/792,045的美国临时专利申请案提交日期的优先权;这些专利中的内容以引用方式并入本文中。
癌症仍然是全球范围内一个主要的致死病因,据估计,全世界每年癌症病例为1270万,男女患癌比例相当。预计到2030年,这一数字将增至2100万。例如,在美国甚至是全球,肺癌是导致男女因癌症死亡的第一大病因。非小细胞肺癌(NSCLC)是最常见的肺癌类型,约占全部肺癌病例的80-85%。大多数NSCLC病例预后较差,因为大多数患者在确诊时通常已处于癌症发展的晚期。
传统上,肺癌通过手术切除、放射疗法和化学疗法进行治疗。这些治疗进展非常缓慢,并且对肺癌患者5年生存率的改善作用较为有限。但是,另一方面,近年来,靶向疗法和免疫疗法取得显著进步。
在新近确诊的肺癌患者中,近40%的患者已发生癌症转移。在癌症发展过程中,肿瘤上皮细胞转化为间充质细胞(EMT),并进入血液循环,变成循环肿瘤细胞(CTC)。CTC被视为是肿瘤扩散和转移的前兆。
发明内容
本发明提供了涉及已标记细胞悬液测定以检测癌症相关细胞及其群体和/或进行转移性癌症筛查等的方法。可以对已标记细胞悬液进行测定,以检测受试者的细胞悬液中是否存在肿瘤浸润性淋巴细胞(TIL)群体。目的癌症相关细胞群体包括诸如表达一种或更多种标志物的细胞群体,包括其中所述标志物是标志物组的成员。所测定的标志物可以根据上下文而变化,并且可以包括蛋白标志物、核酸标志物、细胞周期标志物、DNA含量标志物等。有用的标志物包括一种或更多种免疫检查点标志物和/或一种或更多种免疫细胞类型标志物,包括其中所测定的标志物是一个或更多个标志物组的一部分。本发明还提供了基于来自受试者的已标记细胞悬液样本的测定结果来治疗受试者的瘤形成的方法。本发明还提供了用于实施所述方法的试剂盒。
附图说明
结合附图阅读以下详细说明,可获得对本发明最全面的理解。本专利或申请文件含有至少一张彩色附图。专利局将在必要费用已付的情况下根据要求提供具有彩色附图的本专利或专利申请公开说明书副本。需要强调的是,根据惯例,附图的各个特征未按比例绘制。相反,为了清楚起见,可任意扩大或缩小各个特征的尺寸。附图中包括以下图示:
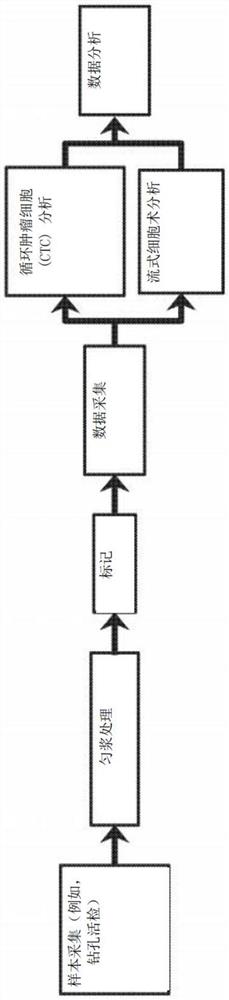
图1A-1B提供了适用于实体瘤处理和分析以及循环肿瘤细胞(CTC)分离和分析的实验工作流程。
图2描绘了细胞癌标志物的表达和流式分析。
图3描绘了细胞免疫标志物的表达和流式分析。
图4A-4B描绘了含有免疫检查点标志物、免疫活化标志物和癌细胞标志物的CTC的相关分析。
图5描绘了患者样本聚类分析。
图6提供了表1。
图7提供了表2。
图8提供了表3。
图9提供了表4。
图10提供了表5。
图11提供了本文所述的补充表。
图12展示了从表达CCR5的肺肿瘤组织中分离出的调节性T细胞群体的检测。
图13提供了包括多种可检测标志物结合成员(包括可检测CCR5结合成员)的标志物组。
本发明提供了涉及已标记细胞悬液测定以检测癌症相关细胞及其群体和/或进行转移性癌症筛查等的方法。可以对已标记细胞悬液进行测定,以检测受试者的细胞悬液中是否存在肿瘤浸润性淋巴细胞(TIL)群体。目的癌症相关细胞群体包括诸如表达一种或更多种标志物的细胞群体,包括其中所述标志物是标志物组的成员。所测定的标志物可以根据上下文而变化,并且可以包括蛋白标志物、核酸标志物、细胞周期标志物、DNA含量标志物等。有用的标志物包括一种或更多种免疫检查点标志物和/或一种或更多种免疫细胞类型标志物,包括其中所测定的标志物是一个或更多个标志物组的一部分。本发明还提供了基于来自受试者的已标记细胞悬液样本的测定结果来治疗受试者的瘤形成的方法。本发明还提供了用于实施所述方法的试剂盒。
在更加详细地描述本发明之前,应当理解,本发明不限于所描述的特定实施例,因为在实际实施中一定会存在差异。还应当理解,本文中使用的术语仅用于描述特定实施例,而无意限制本发明构思,本发明的范围将仅由所附权利要求书限定。
在提供数值范围的情况下,应当理解,该范围的上限和下限之间的每个中间值以及在该范围内的任何其他规定值或中间值都包含在本发明的范围内。除非上下文另有明确规定,否则每个中间值应低至下限单位的十分之一。这些较小范围的上限和下限可独立地包括在较小范围内,并且也包括在本发明内,需遵守所述范围内任何特别排除的限值的要求。在所述范围包括一个或两个限值的条件下,排除了那些所包括限值中的任一个或两个的范围也包括在本发明内。
本文中提出的某些范围在数值前带有术语“大约”。本文中使用术语“大约”的目的是为其后的精确数字以及与该术语之后数字接近或近似的数字提供文字支持。在确定某一数字是否接近或近似于具体列举的数字时,接近或近似的未列举数字在其出现的上下文中可以是基本上等同于所具体列举数字的数字。
除非另有定义,否则本文所用的所有技术和科学术语的含义与本发明所属领域的普通技术人员通常理解的含义相同。尽管与本文所描述的方法和材料类似或等同的方法和材料也可用于本发明的实施或测试中,但下文描述了具有代表性的示例性方法和材料。
在本说明书中引用的所有出版物和专利通过引用方式并入本文中,犹如每一单独出版物或专利被具体地和单独地表明通过引用方式并入,且通过引用并入本文的目的是公开和描述与引用的出版物相关的方法和/或材料。任何出版物的引用均是针对其在申请日之前公开的内容,并且不应将其解释为承认由于之前的发明使得本发明无权早于此类出版物。此外,所提供的出版日期可能与实际出版日期不同,可能需要单独确认。
需要注意的是,如本文和所附权利要求书中所使用的,单数形式的“一”、“一个”和“所述/该”包括复数指代对象,除非上下文另有明确说明。还应注意,可以起草权利要求以排除任何可选要素。因此,该陈述旨在作为使用诸如“单独”、“仅”等与陈述权利要求要素有关的专用术语或使用“否定”限制的前置基础。
在阅读本发明后,以下内容对所属领域的技术人员来说是显而易见的,本文所描述和列出的每个单独的实施例都具有分层的组分和特征,这些组分和特征可在不脱离本发明的范围和精神的情况下与其他几个实施例中任一实施例的特征进行快速分解或合并。可按陈述的事件顺序或逻辑上可能的任何其他顺序实施任何陈述的方法。
尽管为了语法的流畅性已经或将要描述该设备和方法,并进行功能上的说明,但应明确理解,除非《美国法典》第35章有明确规定,否则任何情况下都不得将权利要求解释为必须受“方式”或“步骤”的限制,而应按照等效物的司法原则与权利要求中所述定义的含义和等效物的完整范围相符,当明确按照《美国法典》第35章第112节的规定编写权利要求时,权利要求应与《美国法典》第35章第112节中的法定等效物完全相符。
方法
如上所述,本发明的方法可以包括在细胞悬液中检测一种或更多种癌症相关细胞类型和/或癌症相关细胞群体,包括肿瘤浸润性淋巴细胞(TIL)类型和/或TIL群体。此类检测可以涉及对所述细胞类型和/或所述细胞群体的细胞上各种标志物的表达进行测定。可测定的标志物类型包括但不限于,例如,蛋白标志物、核酸(例如,DNA或RNA(例如,mRNA))标志物、细胞周期标志物、DNA含量标志物等。可测定的有用标志物可以包括免疫检查点标志物、免疫细胞类型标志物、免疫活化标志物、黏附相关标志物、间充质细胞标志物、上皮细胞标志物及其组合。
细胞表达的标志物可以在所述蛋白或mRNA水平下进行测定。例如,免疫检查点标志物、免疫细胞类型标志物、免疫活化标志物、黏附相关标志物、间充质细胞标志物、上皮细胞标志物可以在所述蛋白或mRNA水平下进行测定。在所述蛋白水平下进行测定可以包括,例如,诸如通过使所述细胞与对所述蛋白标志物具有特异性的结合成员接触,检测由所述细胞表达的所述蛋白的存在和/或对所述蛋白的量进行量化。在所述mRNA水平下进行测定可以包括,例如,诸如通过使所述细胞与对所述mRNA标志物具有特异性的结合成员接触,检测编码所述标志物(由所述细胞表达)的mRNA的存在和/或对所述mRNA的量进行量化。用于检测和/或量化所述蛋白标志物和/或mRNA标志物的量的有用结合成员在下文中作了更为详细的描述,并且包括但不限于,例如,抗体和核酸探针。在下文中,在描述使用适用于所述蛋白标志物的结合成员对特定蛋白标志物进行检测/量化的情况下,其可适于使用mRNA结合成员来检测/量化编码所述蛋白标志物的mRNA。类似地,在描述使用适用于所述mRNA标志物的结合成员对特定mRNA标志物进行检测/量化的情况下,其可适于使用蛋白结合成员来检测/量化由所述mRNA标志物编码的所述蛋白。
可能需要进行癌症相关细胞类型检测程序的目的细胞悬液会发生变化,并且可以包括从瘤形成组织和/或疑似含有瘤形成的组织中获取的或用所述组织制备的细胞悬液。例如,在一些情况下,细胞悬液可以从癌组织(例如肿瘤)中获取或用所述组织制备,并且需要进行癌症相关细胞类型检测程序,例如,以检测表达各种标志物(例如免疫检查点标志物、免疫细胞类型标志物和/或其组合)的一个或更多个TIL群体。可以从中获取或用来制备细胞悬液的组织和样本(包括癌组织和样本)包括但不限于,例如,生物样本、活检组织等,下文对此提供了更为详细的描述。
如上所述,可以用本文所述的方法检测到的癌症相关细胞和/或其癌症相关细胞群体(包括例如,TIL细胞和/或其群体)可以表达免疫检查点标志物、免疫细胞类型标志物或其组合。下文对此类标志物提供了更为详细的描述。在一些情况下,所检测到的细胞或细胞群体既表达免疫检查点标志物也表达免疫细胞类型标志物。在一些情况下,细胞和/或其群体可以表达两种或更多种标志物。例如,细胞和/或其群体可以表达多种免疫检查点标志物,包括但不限于3种或更多种、4种或更多种、5种或更多种、6种或更多种、7种或更多种、8种或更多种、9种或更多种、10种或更多种等。在一些情况下,细胞和/或其群体可以表达多种免疫细胞类型标志物,包括但不限于3种或更多种、4种或更多种、5种或更多种、6种或更多种、7种或更多种、8种或更多种、9种或更多种、10种或更多种等。
在一些情况下,细胞和/或其群体可以表达多种免疫检查点标志物和多种免疫细胞类型标志物的组合。例如,细胞和/或其群体可以表达2种或更多种免疫检查点标志物和2种或更多种免疫细胞类型标志物,包括例如,其中所述细胞和/或其群体表达2种或更多种、3种或更多种、4种或更多种、5种或更多种、6种或更多种、7种或更多种、8种或更多种、9种或更多种、10种或更多种等免疫检查点标志物和免疫细胞类型标志物的任何组合。
本文中使用的术语“免疫检查点标志物”通常是指属于免疫信号传导途径(调节免疫活化)的组成部分的标志物,例如,蛋白或编码此类蛋白的mRNA。免疫检查点蛋白可以诸如通过刺激或防止免疫活化来维持免疫稳态和/或防止自身免疫。有用的免疫检查点标志物包括但不限于,例如,程序性细胞死亡蛋白1(PD-1)、T细胞免疫球蛋白黏蛋白受体3(TIM-3)、淋巴细胞活化基因3(LAG-3)和细胞毒性T淋巴细胞相关蛋白4(CTLA-4)。
本文中使用的术语“免疫细胞类型标志物”通常是指在所述细胞谱系的一个或更多个点处识别、定义或区分(基于其存在或不存在)所述免疫细胞谱系的一种或更多种免疫细胞类型或其群体的标志物,例如,蛋白或编码此类蛋白的mRNA。例如,免疫细胞类型标志物可以区分髓样细胞与淋巴样细胞、彼此不同的髓样细胞类型、彼此不同的淋巴样细胞类型(例如,T淋巴细胞、B淋巴细胞、NK细胞、调节性T细胞(Treg)等)、祖细胞与定向祖细胞、祖细胞与已分化细胞类型等。因此,在一些情况下,标志物可以指所述标志物区分的所述细胞群体或亚群。例如,标志物可被识别为淋巴样标志物、T淋巴细胞标志物、B淋巴细胞标志物、NK细胞标志物、Treg标志物等。在一些情况下,免疫细胞类型标志物可以识别由所述标志物的表达定义的免疫细胞的特定群体或亚群。例如,检测CD4可以帮助识别CD4
免疫检查点标志物和免疫细胞类型标志物的各种组合可用于检测采用本发明的方法测定的细胞和/或细胞群体。此类组合可以包括:含或不含一种或更多种其他免疫检查点标志物的PD-1与一种或更多种免疫细胞类型标志物组合;或含或不含一种或更多种免疫细胞类型标志物的PD-1与一种或更多种其他免疫检查点标志物组合。此类有用组合的非限制性示例可以包括,例如,PD-1与CTLA-4组合;PD-1与CTLA-4和CD4组合;PD-1与CTLA-4和CD8组合;PD-1与CD4组合;PD-1与TIM-3组合;PD-1与TIM-3和CD4组合;PD-1与LAG-3和CD4组合;等等。
在一些情况下,有用的标志物组合可以包括:含或不含一种或更多种其他免疫检查点标志物的TIM-3与一种或更多种免疫细胞类型标志物组合;或含或不含一种或更多种免疫细胞类型标志物的TIM-3与一种或更多种其他免疫检查点标志物组合。此类有用组合的非限制性示例可以包括,例如,TIM-3与CD4组合;TIM-3与CD4和LAG3组合;TIM-3与CTLA-4组合;TIM-3与CTLA-4和CD4组合;TIM-3与CTLA-4和CD8组合;TIM-3与NK细胞标志物组合;等等。
在一些情况下,有用的标志物组合可以包括:含或不含一种或更多种其他免疫检查点标志物的LAG-3与一种或更多种免疫细胞类型标志物组合;或含或不含一种或更多种免疫细胞类型标志物的LAG-3与一种或更多种其他免疫检查点标志物组合。此类有用组合的非限制性示例可以包括,例如,LAG-3与CD4组合;LAG-3与CD4和CTLA-4组合;等等。
在一些情况下,有用的标志物组合可以包括:含或不含一种或更多种其他免疫检查点标志物的CTLA-4与一种或更多种免疫细胞类型标志物组合;或含或不含一种或更多种免疫细胞类型标志物的CTLA-4与一种或更多种其他免疫检查点标志物组合。此类有用组合的非限制性示例可以包括,例如,上述含有CTLA-4的组合中的任何一种,等等。
在一些情况下,有用的标志物组合可以包括:含或不含一种或更多种其他免疫细胞类型标志物的CCR5与一种或更多种免疫检查点标志物组合;或含或不含一种或更多种免疫检查点标志物的CCR5与一种或更多种其他免疫细胞类型标志物组合。此类有用组合的非限制性示例可以包括,例如,CCR5与本文所述的免疫检查点标志物中的任何一种或更多种和/或本文所述的免疫细胞类型标志物中的任何一种或更多种组合,包括CCR5与本文所述的标志物组合中的任何组合进行组合,包括但不限于,例如,上文具体列明的组合。
本发明的方法还可以包括对细胞悬液进行测定,以确定所述细胞悬液中是否存在两种或更多种不同的细胞类型和/或两种或更多种不同的细胞群体。例如,在一些情况下,本发明的方法可以包括对细胞悬液进行测定,以确定所述细胞悬液中是否存在两种或更多种不同的TIL群体。在标的方法包括测定以检测两种或更多种细胞类型和/或两种或更多种细胞群体的情况下,可以采用细胞类型和/或细胞群体的各种组合。例如,所述方法可以包括对第一群体(其表达一种或更多种免疫检查点标志物和/或一种或更多种免疫细胞类型标志物的第一组合)和第二群体(其表达一种或更多种免疫检查点标志物和/或一种或更多种免疫细胞类型标志物的第二组合)进行测定。
采用标的方法测定的两种或更多种细胞群体可以共用也可以不共用一种或更多种共同的免疫检查点标志物。换句话说,采用标的方法测定的两种群体可以表达也可以不表达相同的免疫检查点标志物,包括例如,其中所述两种或更多种群体共同表达或不共同表达,例如,PD-1、TIM-3、LAG-3和/或CTLA-4。
另外,采用标的方法测定的两种或更多种细胞群体可以共用也可以不共用一种或更多种共同的免疫细胞类型标志物。换句话说,采用标的方法测定的两种群体可以表达也可以不表达相同的免疫细胞类型标志物,包括例如,其中所述两种或更多种群体共同表达或不共同表达,例如,CD3、CD4、CD8、CD16、CD19、CD25、CD56、CD127和/或CCR5。
在一些情况下,本文所述的方法的标志物组合可以包括一种或更多种免疫活化标志物。本文中使用的术语“免疫活化标志物”通常是指由活化的免疫细胞(例如,响应于通过免疫活化信号传导途径的信号传导)表达或上调的标志物,例如,蛋白或编码此类蛋白的mRNA。可以在免疫信号传导中活化的细胞会发生变化,并且可以包括例如,抗原呈递细胞(即,APC,例如树突细胞、巨噬细胞、B细胞等)、T细胞、NK细胞等。有用的免疫活化标志物包括但不限于,例如,人白细胞抗原—抗原D相关(HLA-DR)。
在一些情况下,本文所述的方法的标志物组合可以包括或不包括一种或更多种黏附相关标志物。本文中使用的术语“黏附相关标志物”通常是指由细胞表达以调节所述细胞与邻近细胞(例如,细胞—细胞相互作用)和/或所述细胞环境组成部分(例如,细胞外基质(ECM))的附着的标志物,例如,蛋白或编码此类蛋白的mRNA。因此,黏附相关标志物可以在维持或增加对周围细胞和/或ECM的黏附的细胞中表达和/或上调,而不在游走细胞类型中表达和/或下调。黏附相关标志物可以视情况在对邻近细胞和/或所述细胞环境组成部分的附着性能降低的细胞中表达,例如,在游走细胞类型中表达和/或上调,而不在维持或增加对周围细胞和/或ECM的黏附的细胞中表达和/或下调。黏附相关标志物可以包括参与一种细胞类型与另一种细胞类型的接合的标志物,例如免疫细胞与癌细胞的接合,并且因此,在一些情况下,某些黏附相关标志物可以被称为接合标志物。有用的黏附相关标志物包括但不限于,例如,E钙黏蛋白、CD44和CD103。
在一些情况下,有用的标志物组合可以包括第一黏附相关标志物的表达和第二黏附相关标志物的不存在或不可检测的表达。例如,在一些情况下,有用的标志物组合可以包括例如,其中所述标的细胞和/或细胞群体表达CD44,并且不表达可检测水平的E钙黏蛋白,即,所述细胞或其群体是CD44阳性和E钙黏蛋白阴性。在一些情况下,有用的标志物组合可以包括两种或更多种黏附相关标志物的表达,包括但不限于,例如,本文所述的两种或更多种黏附相关标志物的表达。
在一些情况下,本文所述的方法的标志物组合可以包括或不包括一种或更多种间充质或上皮细胞标志物。本文中使用的术语“间充质细胞标志物”通常是指由间充质细胞(即,所述间充质的细胞,所述间充质是一种弥散性细胞网络,能够形成结缔组织、血液和血管、所述淋巴系统以及其他系统的细胞)表达的标志物,例如,蛋白或编码此类蛋白的mRNA。有用的间充质细胞标志物包括但不限于,例如,波形蛋白等。有用的间充质标志物包括在不存在于细胞群体中时,有助于将所述细胞群体识别为间充质细胞的标志物。换言之,可以基于所述细胞未被适用于标志物(可区分间充质细胞与其他类型的细胞(例如上皮细胞))的可检测结合成员标记,将细胞群体识别为间充质细胞。用于此类目的的有用标志物可以包括但不限于,例如,上皮细胞标志物,例如但不限于,例如,细胞角蛋白标志物,例如,Pan CK(即,广谱细胞角蛋白)。在一些情况下,标的标志物组合可以包括两种或更多种间充质细胞标志物,包括但不限于,例如,包括Pan CK和波形蛋白的组合,包括例如,其中可以基于一种或更多种所述组合(例如,Pan CK(-)和波形蛋白(+))的存在和/或不存在,将细胞识别为间充质细胞。在一些情况下,可以通过既表达间充质标志物又表达上皮标志物,将细胞识别为由上皮细胞转化为间充质细胞(即,经历上皮细胞—间充质转化,EMT),包括但不限于,例如,Pan CK(-)和波形蛋白(+)EMT细胞。
有用的标志物组合可以包括一种或更多种标志物的组合,其中上述多个标志物类别中的每种标志物可以存在或不存在,所述组合包括例如,包括一种或更多种黏附相关标志物以及一种或更多种免疫活化标志物的组合;包括一种或更多种黏附相关标志物以及一种或更多种免疫细胞类型标志物的组合;包括一种或更多种免疫细胞类型标志物以及一种或更多种免疫活化标志物的组合;包括一种或更多种黏附相关标志物、一种或更多种免疫活化标志物以及一种或更多种免疫细胞类型标志物的组合;等等。例如,在一些情况下,有用的标志物组合可以包括,例如,CD103和HLA-DR;CD103、HLA-DR和NK细胞标志物;等等。
在一些情况下,有用的组合可以包括两种或更多种标志物的同时表达。同时表达的标志物的有用组合可以包括,例如,黏附相关标志物和免疫活化标志物的同时表达。例如,在一些情况下,有用的标志物组合可以包括但不限于,例如,CD103与HLA-DR同时表达。标志物的同时表达通常是指在同一细胞中和/或由同一细胞同时表达两种或更多种标志物。
用本发明的方法检测癌症相关细胞类型和/或其群体(例如TIL群体)可以指示所述受试者中转移性疾病的存在。例如,在一些情况下,通过检测来自所述受试者的样本中的癌症相关细胞群体,本发明的方法可以间接检测和/或预测所述受试者中转移性癌症的存在。相应地,通过检测来自所述受试者的样本中癌症相关细胞群体的不存在,本发明的方法可以间接检测和/或预测所述受试者中转移性癌症的不存在。
因此,受试者中转移性癌症的存在或不存在的间接检测和/或预测可以基于用于测定来自所述受试者的样本中一种或更多种癌症相关细胞类型和/或其群体的一种或更多种细胞计量术检测的参数,例如,表达标志物或标志物组合(例如,如上所述)的一种或更多种TIL细胞群体。在一些情况下,所检测到的癌症相关细胞群体的大小可以指示所述受试者中癌症转移的程度。在一些情况下,所检测到的癌症相关细胞群体的数量可以指示所述受试者中癌症转移的程度。
用本发明的方法检测癌症相关细胞类型和/或其群体(例如TIL群体)可以指示所述受试者中循环肿瘤细胞(CTC)的存在。例如,在一些情况下,通过检测来自所述受试者的样本中的癌症相关细胞群体,本发明的方法可以间接检测和/或预测所述受试者中CTC的存在。相应地,通过检测来自所述受试者的样本中癌症相关细胞群体的不存在,本发明的方法可以间接检测和/或预测所述受试者中CTC的不存在。因此,受试者中CTC的存在或不存在的间接检测和/或预测可以基于用于测定来自所述受试者的样本中一种或更多种癌症相关细胞类型和/或其群体的一种或更多种细胞计量术检测的参数,例如,表达标志物或标志物组合(例如,如上所述)的一种或更多种TIL细胞群体。在一些情况下,所检测到的癌症相关细胞群体的大小可以指示所述受试者中CTC的数量。在一些情况下,所检测到的癌症相关细胞群体的数量可以指示所述受试者中CTC的数量。
在一些情况下,通过检测来自所述受试者的样本中的癌症相关细胞群体,本发明的方法可以间接检测和/或预测所述受试者中临床相关转移性癌症和/或CTC的不存在。换句话说,特定癌症相关细胞群体的检测可以与转移性癌症和/或CTC的存在负相关,因此通过对所述群体进行检测指示转移性癌症和/或CTC的存在是不可能的。作为非限制性示例,特定表达一种或更多种黏附相关标志物的癌症相关细胞群体的存在(例如,表达CD44但不表达E钙黏蛋白的群体)可以与转移性癌症和/或CTC的存在负相关,因此通过对所述群体进行检测间接指示所述受试者无转移性疾病和CTC。相应地,通过检测来自所述受试者的样本中癌症相关细胞群体的不存在,本发明的方法可以间接检测和/或预测所述受试者中转移性癌症的存在。
如上所述,本发明提供了涉及已标记细胞悬液测定的方法。因此,本发明可以涉及获取和/或提供细胞悬液或已标记细胞悬液。所获取和/或所提供的细胞悬液可以是已标记细胞悬液(即,先前已标记)或可以用所述方法标记,例如,通过使未标记细胞悬液与一种或更多种标记试剂接触进行标记。
在一些情况下,本发明的方法可以包括制备所述细胞悬液。细胞悬液可以利用多种来源制备,包括但不限于,例如,含有细胞的生物学样本,例如但不限于,例如,活检标本、瘤形成样本等。
“生物学样本”涵盖从个体获取的各种样本类型,并且可用于诊断或监测测定。所述定义涵盖生物来源的血液和其他液体样本、固体组织样本(例如活检标本)、组织培养物或由其衍生的细胞及其后代。术语“生物学样本”包括尿液、唾液、脑脊液、间质液、眼内液、滑液、血液组分(例如血浆和血清等;但是,对于本发明,生物学样本通常包括细胞,并且因此可以包括固体组织样本(例如固体组织活检切片、半固体组织及其活检切片)、液体活检切片、细胞样本(例如抽吸的细胞样本)等。
本文所述的方法适用于各种瘤形成样本,其中瘤形成样本可以包括任何赘生性(即,异常生长)组织或细胞群体或细胞的样本。异常组织生长可以通过各种方式确定,包括例如,通过将所述受试者组织的生长情况与适当的正常或健康组织的生长情况进行比较来确定。赘生物包括良性赘生物、原位赘生物、恶性赘生物和行为不确定或不明赘生物。恶性赘生物包括癌症。
在一些情况下,用于制备细胞悬液的生物学样本可以是获取自患有癌症或疑似患有癌症的受试者的样本。例如,本方法可以适用于来自患有或疑似患有各种不同癌症中的任何一种或更多种的受试者的样本,所述癌症包括但不限于,例如,急性淋巴细胞白血病(ALL)、急性髓样白血病(AML)、肾上腺皮质癌、AIDS相关癌症(例如,卡波西肉瘤、淋巴瘤等)、肛门癌、阑尾癌、星形细胞瘤、非典型畸胎样/横纹肌样瘤、基底细胞癌、胆管癌(肝外)、膀胱癌、骨癌(例如,尤因肉瘤、骨肉瘤和恶性纤维组织细胞瘤等)、脑干神经胶质瘤、脑瘤(例如,星形细胞瘤、中枢神经系统胚胎肿瘤、中枢神经系统生殖细胞瘤、颅咽管瘤、室管膜瘤等)、乳腺癌(例如,女性乳腺癌、男性乳腺癌、儿童乳腺癌等)、支气管肿瘤、伯基特淋巴瘤、类癌瘤(例如,儿童类癌瘤、胃肠道类癌等)、原发灶不明癌、心脏(心脏)肿瘤、中枢神经系统(例如,非典型畸胎样/横纹肌样瘤、胚胎瘤、生殖细胞肿瘤、淋巴瘤等)、宫颈癌、儿童癌症、脊索瘤、慢性淋巴细胞白血病(CLL)、慢性髓细胞性白血病(CML)、慢性骨髓增殖性肿瘤、结肠癌、结肠直肠癌、颅咽管瘤、皮肤T细胞淋巴瘤、导管(例如,胆管、肝外等)、导管原位癌(DCIS)、胚胎性肿瘤、子宫内膜癌、室管膜瘤、食管癌、鼻腔神经胶质瘤、尤因肉瘤、颅外生殖细胞瘤、性腺外生殖细胞瘤、肝外胆管癌、眼癌(例如,眼内黑色素瘤、视网膜母细胞瘤等)、骨纤维组织细胞瘤(例如,骨恶性纤维组织细胞瘤、骨肉瘤等)、胆囊癌、胃(胃)癌、胃肠道类癌、胃肠道间质瘤(GIST)、生殖细胞肿瘤(例如,颅外、性腺外、卵巢、睾丸等)、妊娠滋养细胞疾病、神经胶质瘤、毛细胞白血病、头颈癌、心脏肿瘤、肝细胞(肝)癌、组织细胞增多症(例如,朗格汉斯细胞等)、霍奇金淋巴瘤、下咽癌、眼内黑色素瘤、胰岛细胞瘤(例如,胰腺神经内分泌肿瘤等)、卡波西肉瘤、肾癌(例如,肾细胞癌、维尔姆斯瘤、儿童肾脏肿瘤等)、朗格汉斯细胞组织细胞增生症、喉癌、白血病(例如,急性淋巴细胞白血病(ALL)、急性髓样白血病(AML)、慢性淋巴细胞白血病(CLL)、慢性髓细胞性白血病(CML)、毛细胞白血病等)、唇及口腔癌、肝癌(原发性)、小叶原位癌(LCIS)、肺癌(例如,非小细胞肺癌、小细胞肺癌等)、淋巴瘤(例如,AIDS相关淋巴瘤、伯基特淋巴瘤、皮肤T细胞淋巴瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、原发性中枢神经系统(CNS)淋巴瘤等)、巨球蛋白血症(例如,
用于本文所述的方法中的样本可以是获取自原发性肿瘤(例如,获取自活检切片或手术切除部分或非肿瘤组织)的样本。可以出于各种原因评估非肿瘤组织,包括但不限于出于癌症监测目的,作为对照等。可以评估固体和流体非肿瘤样本。可以评估的有用固体组织包括但不限于,例如,与现有癌症相邻的组织(例如,皮肤组织、肺组织、乳腺组织等)、淋巴结组织等。可以评估的有用流体样本基本上包括任何体液样本,包括但不限于,例如,血液样本、淋巴液样本等。
可以评估的癌症和肿瘤组织同样包括固体和液体样本。例如,对于造血系统癌症,可以评估血液样本或骨髓样本。在一些情况下,根据本文所述的方法评估的样本是实体瘤样本。实体瘤样本可以获取自各种不同的癌症,包括例如,以上列出的癌症中的任何一种。在一些情况下,实体瘤样本可以是上皮组织癌症或上皮癌。
上皮癌包括癌。癌的非限制性示例包括腺泡癌、腺泡细胞癌、腺泡状癌、腺囊性癌、腺样囊性癌、腺鳞状癌、附属器癌、肾上腺皮质癌、肺泡癌、成釉细胞癌、大汗腺癌、基底细胞癌、细支气管肺泡癌、支气管癌、胆管细胞癌、绒毛膜癌、透明细胞癌、胶样癌、筛状癌、导管原位癌、胚胎癌、铠甲状癌、子宫内膜样癌、表皮样癌、癌前瘤混合瘤、癌前多形性腺瘤、甲状腺滤泡性癌、肝细胞癌、原位癌、导管内癌、何氏细胞癌、炎性乳腺癌、大细胞癌、浸润性小叶癌、小叶癌、小叶原位癌(LCIS)、髓样癌、脑膜癌、梅克尔细胞癌、粘液癌、粘液表皮样癌、鼻咽癌、非小细胞癌、非小细胞肺癌(NSCLC)、燕麦细胞癌、乳头状癌、肾细胞癌、硬癌、皮脂腺癌、单纯癌、印戒细胞癌、小细胞癌、小细胞肺癌、梭形细胞癌、鳞状细胞癌、终末导管癌、移行细胞癌、管状癌、疣状癌等。
在一些情况下,本文所述的方法可用于检测上皮性肿瘤样本中是否存在癌症相关细胞类型和/或其群体,所述上皮肿瘤包括例如,上皮性肺癌肿瘤、上皮性乳腺癌肿瘤等。在一些情况下,本文所述的方法可用于检测非小细胞肺癌(NSCLC)肿瘤中癌症相关细胞类型和/或其群体的存在或不存在。在一些情况下,所述上皮性肿瘤是鳞状细胞癌、腺癌或腺鳞状癌,并且所检测到的细胞包括鳞状细胞癌细胞、腺癌细胞或腺鳞状癌细胞。
可以采用任何合适的样本采集方法来获取含有癌症相关细胞或疑似含有癌症相关细胞的样本,所述方法包括但不限于用于获取固体组织活检切片和活检抽吸物的活检方法。在一些情况下,可以将样本获取作为出于所述样本获取以外的目的而执行的单独医疗程序的一部分,包括但不限于外科手术。在其他情况下,可以独立获取样本,例如,不作为单独医疗程序的一部分。样本采集方法会发生变化,并且取决于,例如,所述采集是否作为其他医疗程序的一部分执行、待获取的样本的特定类型、获取样本的主要目的和/或用于处理和/或分析样本的方法。
本发明的方法中使用的样本可以通过任何合适的方法采集。在一些情况下,样本用活检切片制备。基于癌症类型和/或所执行的活检类型,所述样本可以用固体组织活检切片或液体活检切片制备。
在一些情况下,样本用外科活检切片制备。根据本文所述的方法,对于待评估的样本采集,可以采用适用于外科活检的任何合适且适当的技术,包括但不限于,例如,切除活检、切口活检、导丝定位活检等。在一些情况下,可以将外科活检切片获取作为具有所述样本获取以外的主要目的的外科手术的一部分,例如,包括但不限于肿瘤切除术、乳房切除术、淋巴结手术、腋窝淋巴结清扫术、前哨淋巴结手术等。
在一些情况下,样本可以通过穿刺活检切片获取。根据本文所述的方法,对于待分析的样本采集,可以采用适用于穿刺活检的任何合适且适当的技术,包括但不限于,例如,细针抽吸(FNA)、芯针活检、立体定位核芯针活检、真空辅助活检等。
FNA活检可以在可触及和不可触及病灶上进行,并且涉及将小号针(例如,18至25号规格针)引入所述肿块或可疑区域和所述细胞材料提取物。是在执行还是在不执行共成像的情况下进行FNA一事可能发生变化,并且取决于各种因素,包括所述病灶是否可触及。在共成像的同时进行FNA的情况下,所述技术可以被称为图像引导的FNA,并且可以包括但不限于放射成像技术,例如超声、计算机断层扫描(CT)、荧光检查、乳房X线摄影术、MRI等。用于收集本文所述的样本的FNA技术及其变体会发生变化,并且特定技术的选择取决于各种因素,包括但不限于,例如,所述受试者的特征、所述特定检测到的病灶的特征、所述分析程序等。此类FNA技术的变体包括但不限于,例如,末端开口针(即,“法国技术”)、负压技术、成像引导的FNA等。因此,特定FNA技术可以包括也可以不包括负吸。例如,在所述法国技术FNA中,所述病灶内短暂而快速的行程使得细胞发生移位,并且允许通过毛细管作用在所述针内进行有效采集,且无需负吸。在一些情况下,例如,流体过多(例如,囊性病灶的流体)时,可以使用柱塞已移除的注射器来通过FNA采集样本。在一些情况下,可以利用负压将所述样本吸入注射器中。在一些情况下,可以使用注射器支座或抽吸枪或抽吸手柄。
芯针活检可以在可触及和不可触及病灶上进行,并且涉及将空心针引入所述肿块或可疑区域和所述细胞材料提取物。是在执行还是在不执行共成像的情况下进行芯针活检一事可能发生变化,并且取决于各种因素,包括所述病灶是否可触及。在共成像的同时进行芯针活检的情况下,所述技术可以被称为图像引导的芯针活检或立体定位核芯针活检,并且可以包括但不限于放射成像技术,例如超声、计算机断层扫描(CT)、荧光检查、乳房X线摄影术、MRI等。此类芯针活检技术的变体包括但不限于,例如,真空辅助针芯活检、成像引导的针芯活检等。因此,特定芯针活检技术可以包括也可以不包括在插入所述取芯活检针之前于所述皮肤上所作的切口。例如,在真空辅助针芯活检中,作一个小切口,使空心探针穿过所述切口并将其引导至所述病灶部位,然后通过真空压力将圆条形组织拉入所述探针内。通常情况下,芯针活检相较于所述的FNA技术能够获取更多的组织。
在一些情况下,术语“针穿活检”通常可以指无需麻醉或只需局部麻醉即可进行的不被视为外科手术的任何活检。在一些情况下,此类活检可以利用除“针”以外的设备,例如但不限于可以用于获取钻孔活检切片(例如,皮肤钻孔活检切片)的设备。此类设备包括但不限于,例如,用于采集皮肤钻孔活检切片的设备。
根据所采用的特定活检方法,并基于特定受试者和/或受试者的特定病灶的具体情况,可以进行一次活检或多次活检。例如,在一些情况下,可以进行单次活检,例如,单次FNA活检或单次芯针活检,以对特定受试者或特定受试者的病灶进行适当采样。在其他情况下,可以进行多次活检,例如,多次FNA活检或多次芯针活检,以从受试者或受试者的病灶中采集单个样本或多个样本。在采集多个活检切片的情况下,所述活检切片的实际数目将根据所述特定受试者和/或所述受试者的特定病灶而变化,因此所述数目范围可以为2至10个或更多个活检切片,包括但不限于,例如,2个活检切片、3个活检切片、4个活检切片、5个活检切片、6个活检切片、7个活检切片、8个活检切片、9个活检切片、10个活检切片等。可以同时采集多个活检切片,也可以在预先确定的时间段内采集多个活检切片,例如,作为监测方案的一部分。
根据本文所述的方法采集的样本可以是固体、半固体或液体样本。例如,在一些情况下,根据所采用的采集技术的性质,例如,引起细胞解离或抽吸的技术,所采集的样本在采集时可以是液体样本。在其他情况下,根据所采用的采集技术的性质,例如,外科手术采集或芯样采集,所采集的样本可以是固体或半固体样本。在所采集的样本是固体或半固体样本的实施例中,所述样本的所述细胞可以在采集后解离以形成液体样本。使固体和半固体组织样本解离的方法包括但不限于机械解离、化学解离、酶解离及其组合。
在一些情况下,可以对实体瘤样本进行机械匀浆处理。任何合适的机械匀浆处理方法都可以用于制备固体组织样本以供下游步骤使用,包括但不限于使用市售匀浆处理设备进行的匀浆处理,所述匀浆处理设备包括,例如,可从IncellDx(加利福尼亚州门洛帕克)处获取的匀浆处理设备,例如提供incellPREP(IncellDx,Inc)试剂盒的匀浆处理设备;可从Claremont BioSolutions(加利福尼亚州阿普兰)处获取的匀浆处理设备,包括例如,microHomogenizer(Claremont BioSolutions)、microDisruptor(ClaremontBioSolutions)等。机械匀浆处理可以在任何合适的溶液(包括例如,缓冲液)中进行。在一些情况下,机械匀浆处理可与化学或酶匀浆处理结合使用。在一些情况下,在匀浆处理过程中加入固定试剂。在一些情况下,在匀浆处理之后(包括紧随其后)加入固定试剂。可以在匀浆处理之后加入的固定试剂(详见下文)包括但不限于,例如,incellPREP(IncellDx,Inc)。在一些情况下,固定溶液可以是组合固定/透化试剂。在一些情况下,固定溶液可以是纯固定溶液。
细胞样本的匀浆处理或解离可以采用也可以不采用酶来促进和/或协助形成经匀浆处理或解离的细胞悬液。因此,所采用的匀浆处理或解离方法可以是酶促法或非酶促法。因此,本发明的方法可以包括或特别地不包括使样本(包括液体样本或固体样本,例如组织)与用于使所述样本的所述细胞匀浆化或解离的酶接触。
在采集或制备所述样本(例如,解离或匀浆处理)时,可以固定所得液体细胞悬液中的所述细胞。因此,所述方法的方面可以包括通过使所述样本与合适的固定试剂接触来固定所述悬液中的所述细胞。目的固定试剂是在所需时间点固定所述细胞的试剂。可以使用任何合适的固定试剂,其中适合的固定试剂包括但不限于轻度交联剂。在一些情况下,轻度交联剂可以是基于甲醛的固定剂,包括但不限于,例如,甲醛、多聚甲醛、甲醛/丙酮、IncellMAX(也被称为IncellFP;IncellDx,Inc)等。在一些情况下,可以使用基于醇的固定剂,包括但不限于,例如,甲醇/丙酮、乙醇等。在一些情况下,可以使用最终浓度为约1至2%的基于甲醛的固定剂。
对本发明的方法中使用的样本进行细胞计量术测定。因此,在一些情况下,可以对样本进行处理以得到适于进行细胞计量术测定的细胞悬液。得到适于进行细胞计量术测定的样本的处理可以包括或不包括,例如,上述步骤中的任何单个步骤或步骤组合,包括例如,匀浆处理、解离、固定、透化、组合固定/透化等(如适用)。所需的处理量取决于各种因素,包括所述样本的来源,其中固体组织样本相较于液体样本通常需要更多的处理。例如,液体样本(例如造血系统样本)处理可能不需要匀浆处理或解离,因此可能只需根据需要进行固定和/或透化。
在一些情况下,所述样本中的所述细胞通过与透化试剂接触而透化。目的透化试剂是允许标志物结合成员(例如,如本文中更为详细的描述所示)进入细胞内环境的试剂。可以采用各种有用的透化试剂,其中合适的试剂包括但不限于:温和清洁剂,例如TritonX-100、NP-40、皂苷等;甲醇等等。
在一些情况下,本发明的方法可以包括制备已标记细胞悬液。已标记细胞悬液可以通过所获取的细胞悬液或细胞悬液制备程序的一部分制备,例如,通过样本(例如固体组织活检切片)、细胞抽吸物等制备。制备已标记细胞悬液的方法可以发生变化,并且可以包括,例如,使细胞悬液与一种或更多种结合成员接触,以用所述一种或更多种结合成员标记所述细胞悬液中的所述细胞。有用的结合成员通常对标志物具有特异性,并且是可检测的,包括例如,其中所述结合成员以可检测的方式标记,下文对此提供了更为详细的描述。
细胞悬液与结合成员接触可以单独进行,即,其中所述悬液中的所述细胞用适用于单一标志物(基本上每次一种)的结合成员标记;或者平行进行,即,其中所述悬液中的所述细胞用适用于两种或更多种标志物(基本上同时进行)的结合成员标记。因此,如上所述,在一些情况下,细胞悬液的标记可以通过使所述细胞悬液与一个或更多个标志物组接触来进行,其中每个组包括适用于多种不同标志物的结合成员,以便同时用所述组中的所有标志物对所述细胞进行标记。在一些情况下,细胞悬液可以同时与适用于至少两种不同标志物且至多25或30种或更多种不同标志物的结合成员接触,包括但不限于,例如,至少5种不同的标志物、至少6种不同的标志物、至少7种不同的标志物、至少8种不同的标志物、至少9种不同的标志物、至少10种不同的标志物、至少11种不同的标志物、至少12种不同的标志物、至少13种不同的标志物、至少14种不同的标志物、至少15种不同的标志物、至少16种不同的标志物、至少17种不同的标志物、至少18种不同的标志物、至少19种不同的标志物、至少20种不同的标志物等。
在一些情况下,使细胞悬液与结合成员接触可以包括使所述细胞悬液与免疫检查点组接触,所述免疫检查点组包括适用于多种不同免疫检查点标志物的可检测结合成员,所述标志物包括但不限于,例如,至少2种不同的免疫检查点标志物、至少3种不同的免疫检查点标志物、至少4种不同的免疫检查点标志物等。在一些情况下,所述多种标志物的所述结合成员是可以不同方式检测到的结合成员,例如,通过使用不同的标记(例如,不同的荧光染料),以便在测定时单独评估每种不同的免疫检查点标志物。
在一些情况下,使细胞悬液与结合成员接触可以包括使所述细胞悬液与免疫细胞类型组接触,所述免疫细胞类型组包括适用于多种不同的免疫细胞类型标志物的可检测结合成员,所述标志物包括但不限于,例如,至少2种不同的免疫细胞类型标志物、至少3种不同的免疫细胞类型标志物、至少4种不同的免疫细胞类型标志物、至少5种不同的免疫细胞类型标志物、至少6种不同的免疫细胞类型标志物、至少7种不同的免疫细胞类型标志物、至少8种不同的免疫细胞类型标志物、至少9种不同的免疫细胞类型标志物、至少10种不同的免疫细胞类型标志物等。在一些情况下,所述多种标志物的所述结合成员是可以不同方式检测到的结合成员,例如,通过使用不同的标记(例如,不同的荧光染料),以便在测定时单独评估每种不同的免疫细胞类型标志物。
可以采用各种标志物组,包括可检测结合成员的各种组合。标志物组可以,例如,由本文所述的任何标志物的各种组合组装而成,所述标志物包括但不限于,例如,蛋白标志物、核酸标志物、细胞周期标志物、DNA含量标志物、免疫检查点标志物、免疫细胞类型标志物、免疫活化标志物、黏附相关标志物、间充质细胞标志物、上皮细胞标志物及其组合。例如,在一些情况下,可以将对不同免疫细胞类型标志物和不同免疫检查点标志物具有特异性的标志物组合成“免疫标志物组”。此类免疫标志物组会发生变化,并且可以包括例如,共计至少5种不同的标志物、共计至少6种不同的标志物、共计至少7种不同的标志物、共计至少8种不同的标志物、共计至少9种不同的标志物、共计至少10种不同的标志物、共计至少11种不同的标志物、共计至少12种不同的标志物、共计至少13种不同的标志物、共计至少14种不同的标志物、共计至少15种不同的标志物等。
接触可以通过任何合适且适当的方式进行,例如,使细胞悬液中的细胞与特异性结合成员接触。在一些情况下,细胞悬液中的细胞可以通过向所述细胞悬液中加入等分的特异性结合成员来与所述特异性结合成员接触。所接触的细胞悬液可以根据需要进行孵育和/或后固定。可以在适于用所述结合成员标记所述标志物的条件下使特异性结合成员与细胞接触。适于进行所述标记的条件可以根据所采用的所述特定结合成员而变化。例如,抗体结合成员可以在适合的条件下与细胞接触,所述条件可以包括,在一些情况下,在室温下、高于或低于室温的温度下孵育;在适当的培养基或缓冲液中;并且含有或不含适当的阻断剂(例如牛血清白蛋白(BSA)、胎牛血清(FBS)等)。
在一些情况下,可以在适合的条件(可以包括杂交条件)下接触核酸结合成员。有用的杂交条件包括严格杂交条件。本文中使用的术语“严格杂交条件”是指适于产生互补性足以在所述测定中提供所需特异性水平的核酸标志物与核酸结合成员的结合对,而较不适于在互补性不足以提供所需特异性的结合成员之间形成的结合对的条件。严格测定条件是杂交和洗涤条件的总和或组合(总体)。
在核酸杂交(例如,阵列杂交、Southern或Northern杂交、原位杂交等)环境中,“严格杂交”和“严格杂交洗涤条件”具有序列依赖性,并且在不同的实验参数下是不同的。可以使用的严格杂交条件可能包括,例如,在43±1℃下于包含30%甲酰胺、5×SSC、有或无清洁剂(例如,1%SDS)的缓冲液中杂交等。有用的严格杂交条件可以发生变化,并且还可以包括在37℃下于加盐(例如,1M NaCl)、有或无清洁剂(例如,1%SDS)的40%甲酰胺缓冲液中杂交,以及在45℃下于1×SSC中洗涤。其他严格杂交条件包括在60℃或更高温度下于3×SSC中杂交,或在42℃下于含有30%甲酰胺、1M NaCl、0.5%肌氨酸钠、50mM MES、pH 6.5的溶液中孵育。普通技术人员应当认识到,可以利用替代但相当的杂交和洗涤条件来提供具有相似严格性的条件。
在一些情况下,可以将标志物组中的单个结合成员分别添加至细胞悬液中进行标记。在其他情况下,所述组中单个结合成员的全部或部分可以,例如,在单根管或混合物中预先混合。在一些情况下,可以对结合成员进行分组,例如,按类型分为两个或更多个混合物组,包括但不限于,例如,靶向多种蛋白标志物的抗体混合物、靶向多种mRNA标志物的核酸探针混合物等。
本发明的方法可以包括使所述样本和/或细胞悬液与一种或更多种其他试剂接触。有用的其他试剂会发生变化,并且可以包括但不限于,例如,DNA标记/染色试剂、细胞悬液固定溶液、固定试剂、缓冲液、稀释剂等。可使用于制备分析用细胞悬液的试剂在单个步骤中与所述细胞接触,例如,通过采用一个或更多个洗涤和/或采集步骤实现,使得所述溶液中不存在两种或更多种试剂。可使用于制备分析用细胞悬液的试剂在组合(即,在同一步骤执行期间)中与所述细胞接触,使得所述两种或更多种试剂在所述接触步骤执行期间一同存在于溶液中。因此,可以采用各种方法来制备分析用已标记细胞悬液。
如上所述,本发明的方法可以包括对已标记细胞悬液进行测定。可以采用各种已标记细胞悬液测定方法,包括例如,其中对所述细胞悬液进行细胞计量术测定。
本文中使用的术语“细胞计量术测定”是指在逐个细胞的基础上对细胞参数进行的测量,其中此类测量允许检测具有特定细胞参数或一组参数的单个细胞或对共用特定细胞参数或一组参数的细胞群体进行计数。可在标的方法中用细胞计数法测定的此类参数包括,例如,免疫检查点标志物的每个细胞表达、免疫细胞类型标志物的每个细胞表达等。
对已标记细胞悬液进行细胞计量术测定的各种方法可用于本文所述的方法中,所述方法包括但不限于,例如,使用流式细胞仪进行流式细胞术测定、诸如使用细胞计数仪等对已标记细胞悬液进行细胞计量术测定。可以测定已标记细胞悬液样本的标志物表达和/或多种标志物(例如,标志物组中的所述标志物)的所述表达。在一些情况下,通过细胞计量术测定的其他细胞参数还可用于检测本发明的赘生性细胞。因此,可以采用对已标记细胞悬液进行细胞计量术测定的各种方法来测量各种细胞参数。
在一些实施例中,可以采用流式细胞术来对细胞样本进行细胞计量术测定。流式细胞术是一种利用多参数数据来识别和区分不同颗粒(例如,细胞)类型(即在流体介质中在标记(波长、强度)、大小等方面彼此不同的颗粒)的方法。在对样本进行流式细胞术分析时,首先将所述样本的等分试样引入所述流式细胞仪的所述流路中。流经所述流路时,所述样本中的所述细胞(基本上一次一个)穿过一个或更多个感测区域,其中每个所述细胞分别单独暴露于单一波长的光源(或者,在一些情况下,两个或更多个不同的光源)下,并且每个细胞的细胞参数(例如,光散射参数)和/或标志物参数(例如,荧光发射)的测量结果根据需要单独予以记录。对每个细胞的记录数据进行实时分析,或者根据需要将所述数据存储于数据存储器和分析工具(例如,计算机)中供以后分析使用。
在基于流式细胞术的方法中,悬液中的所述细胞(在流路中基本上一次一个)穿过一个或更多个感测区域,其中在每个区域中,每个细胞均被能量源照射。所述能量源可以包括发射单一波长的光的照明器,例如由激光器(例如,He/Ne或氩)或汞弧灯或具有适当滤光片的LED提供的光。例如,在具有单个感测区域的流式细胞仪中,可以将光波长488nm用作发射波长。对于以两种不同的波长发射光的流式细胞仪,可以采用其他波长的发射光,其中目的特定波长包括但不限于:405nm、535nm、561nm、635nm、642nm等。在通过能量源激发与多肽结合的已标记特异性结合成员后,所述已激发的标记发出荧光,并且在细胞穿过一个或更多个感测区域时,每个细胞上所述多肽的定量水平可以用一个或更多个荧光检测器进行检测。
在流式细胞术中,除了检测由用荧光标志物标记的细胞发出的荧光外,还使用检测器(例如,集光器,例如光电倍增管(或“PMT”)、雪崩光电二极管(APD)等)记录所述细胞穿过所述感测区域且被所述能量源照射时,穿过每个细胞的光(通常被称为前向光散射)以及经反射与穿过所述感测区域的所述细胞的流向正交的光(通常被称为正交或侧向光散射)。所获取的每种数据类型(例如,前向光散射(或FSC)、正交光散射(SSC)和荧光发射(FL1、FL2等))均包含每个细胞(或每个“事件”)的单独参数。
流式细胞仪可进一步包括一个或更多个电检测器。在某些实施例中,可以使用电检测器来检测由颗粒或细胞穿过电场(通过所述颗粒/细胞路径中的孔传播)所引起的干扰。具有电检测器的此类流式细胞仪含有相应的电能发射源,所述电能发射源将通过流路或引导细胞通过的孔传播电场。任何合适的电场和/或场与适当的检测器的组合都可以用于检测和/或测量穿过所述场的颗粒(或细胞),所述场包括但不限于直流电场、交流电场、射频场等。
流式细胞仪进一步包括数据采集、分析和记录装置,例如计算机,其中多个数据通道记录每个细胞穿过所述感测区域时由每个检测器针对每个细胞提供的数据。所述分析系统的目的是对细胞进行分类和计数(其中每个细胞本身以一组数字化参数值呈现),并累加整个样本的数据。
基于针对整个群体采集的数据,通过“设门”来分析特定目的细胞亚群。为了选择适当的门,将所述数据绘制成图,以实现亚群的适当分离,例如,通过调整所述仪器的所述配置,包括例如,励磁参数、采集参数、补偿参数等。在一些情况下,可以通过在二维点阵图上绘制前向光散射(FSC)与侧向(即正交)光散射(SSC)的关系来执行此步骤。然后,所述流式细胞仪操作员选择所需的细胞亚群(即,所述门内的细胞),并排除不在所述门内的细胞。如有需要,所述操作员可以利用计算机界面上的光标在所需亚群周围画一条线来选择所述门。然后,通过将所述细胞的其他参数(例如荧光)绘制成图来进一步分析所述门内的细胞。
可以采用能够获取荧光数据(例如,如上所述)的任何流式细胞仪。有用的流式细胞仪包括利用各种不同的手段使细胞流经所述感测区域(基本上一次一个)的流式细胞仪,包括例如,流动池、微流控芯片等。目的流式细胞仪系统的非限制性示例是可从商业供应商处获得的流式细胞仪系统,所述供应商包括但不限于,例如,Becton-Dickenson(新泽西州富兰克林湖)、Life Technologies(纽约格兰德岛)、Acea Biosciences(加利福尼亚州圣地亚哥)、Beckman-Coulter,Inc.(印第安纳州印第安纳波利斯)、Bio-Rad Laboratories,Inc.(加利福尼亚州赫拉克勒斯)、Cytonome,Inc.(马萨诸塞州波士顿)、AmnisCorporation(华盛顿州西雅图)、EMD Millipore(马萨诸塞州比勒利卡)、SonyBiotechnology,Inc.(加利福尼亚州圣何塞)、Stratedigm Corporation(加利福尼亚州圣何塞)、Union Biometrica,Inc.(马萨诸塞州霍利斯顿)、Cytek Development(加利福尼亚州菲蒙市)、Propel Labs,Inc.(科罗拉多州柯林斯堡)、Orflow Technologies(爱达荷州凯彻姆)、handyem inc.(加拿大魁北克)、Sysmex Corporation(日本神户)、Partec Japan,Inc.(日本土浦)、Bay bioscience(日本神户)、Furukawa Electric Co.Ltd.(日本东京)、On-chip Biotechnologies Co.,Ltd(日本东京)、Apogee Flow Systems Ltd.(英国赫特福德郡)等。
在一些实施例中,可以采用细胞计数仪来对细胞样本进行细胞计量术测定。本文中使用的术语“细胞计数仪”(也称为“成像型细胞计数仪”或“自动成像型细胞计数仪”)通常是指能够对沉积于成像器皿上或成像器皿中的细胞进行成像以采集样本中全部或大部分细胞的数据的自动或半自动细胞成像设备。在细胞计量术中,可以依据各种不同的方法进行成像。在一些情况下,细胞计数仪可以低倍率(例如,5X、10X等)采集存在于成像器皿上或成像器皿中的细胞的宽视场图像,以识别所述细胞的位置和/或针对特定参数(例如,大小、形状、颜色、荧光等)筛选所述细胞。在识别出所述细胞的位置之后,细胞计数仪可以通过诸如靶向方式继续采集所有或部分所述已识别细胞的更高倍率(例如,20X、40X、60X、100X等)图像。
在其他情况下,细胞计数仪可以通过扫描所述成像器皿来对存在于成像器皿上或成像器皿中的细胞进行成像。可以在低倍率或高倍率下进行扫描。在一些情况下,在高倍率下进行扫描以捕获全部或大部分细胞的图像。在一些情况下,在低倍率下进行扫描以识别所述成像器皿上或成像器皿中所述细胞的位置。在识别出所述细胞的位置之后,细胞计数仪可以通过诸如靶向方式继续采集所有或部分所述已识别细胞的更高倍率图像,或者可以在高倍率下重新扫描所定位的细胞。
细胞计数仪系统中使用的所述成像器皿会发生变化。在一些情况下,常用的实验室成像设备(例如,显微镜载玻片)可以用作细胞计数仪系统中的成像器皿。在一些情况下,细胞计数仪成像器皿可以被专门设计用于与特定细胞计数仪结合使用。有用的成像器皿包括但不限于,例如,载玻片(例如,显微镜载玻片)、培养皿(例如,玻璃底成像培养皿)、培养板(例如,多孔成像培养板)等。成像器皿通常具有可依据显微镜检查进行修正的光学性质,例如,光学透明度(在至少一部分所述器皿中)。成像器皿可能有也可能无单独隔室。例如,用作成像器皿的显微镜载玻片通常不具有单独隔室,并且沉积于载玻片上的细胞可以散布在所述载玻片的表面。或者,用作成像器皿的多孔成像培养板确实具有可在其中沉积一个或更多个细胞的单独隔室(即,孔)。
细胞计数仪包括成像组件,例如,自动显微镜。细胞计数仪的所述成像组件可以包括一个或更多个具有各种放大倍率(例如,5X、10X、20X、40X、60X、100X等)的物镜,以便采集由被成像物体(例如,细胞)透射、反射或发射的光。由所述物镜采集的光通常通过一面或更多面二向色镜、滤光镜或透镜进行处理,然后再导向图像捕获设备。
合适的图像捕获设备可以包括一个或更多个能够捕获数字图像的数字相机(包括彩色和单色相机),以及用于存储所述数字图像和/或将所述图像传输至所连接的图像处理电路或所连接的存储设备(以便之后传输至图像处理电路)的装置。合适的数字彩色相机会发生变化,并且通常包括任何数字相机(例如,具有一个或更多个CCD或CMOS传感器的相机)。合适的数字相机包括但不限于,例如,定制数字相机、消费级数字彩色相机(例如,转换为显微镜用途的消费级数字彩色相机)以及可从各制造商处购得的数字显微镜彩色相机,所述制造商包括但不限于,例如,Dino-Eye、Dino-Lite、Jenoptik ProgRes、KoPa、Leica、Motic、Olympus、Omano、OptixCam、PixelLINK、Zeiss等。
细胞计数仪进一步包括数据采集、分析和记录装置,例如计算机,其中一个或更多个数据通道记录一个或更多个图像捕获设备针对所述成像器皿中的每个细胞或大部分细胞提供的数据。所述分析系统的目的是对细胞进行分类和计数(其中每个细胞本身以一组数字化参数值呈现),并累加整个样本的数据。在一些情况下,细胞计数仪记录每个细胞的图像,并且可与用户界面连接,其中所述设备的用户可以查看此类图像。
用于检测表达特定多肽的细胞的基于细胞计数仪的方法可以包括使样本中的所述细胞与荧光标记的特异性结合成员接触,并利用所述细胞计数仪通过成像来检测荧光标记的细胞。在一些情况下,可以对每个已标记细胞的所述荧光进行细胞计量术量化,以确定特定标志物的所述每个细胞表达水平。
可以采用能够获取荧光数据(例如,如上所述)的任何细胞计数仪。有用的细胞计数仪包括利用各种不同的自动细胞计量术成像手段来分析样本中的全部或大部分细胞的细胞计数仪。目的细胞计数仪系统的非限制性示例是可从商业供应商处获得的细胞计数仪系统,所述供应商包括但不限于,例如,Nexcelom Bioscience LLC(马萨诸塞州劳伦斯)、Molecular Devices,LLC(加利福尼亚州桑尼维尔)、Thorlabs Inc.(新泽西州牛顿)、TTPLabtech Ltd.(英国)等。
如上所述,可以进行细胞计量术测定的所述参数其中一项是所述受分析细胞的DNA含量(也称为DNA指数),例如,通过使用在所述测定之前施用于所述细胞的DNA染色试剂测定。例如,在一些情况下,可以对细胞的所述DNA含量进行定性或定量评估,包括但不限于,例如,基于所述DNA染色试剂量化所述每个细胞DNA含量。此类程序可用于确定所评估的细胞的所述相对和/或绝对DNA含量。因此,在本文所述的测定中,DNA含量可以用作标志物,包括标志物组的标志物。
可以采用各种方法确定细胞的所述DNA含量,例如,所述每个细胞DNA含量。在一些情况下,可以采用DNA标记试剂(例如,含有固有荧光的核酸染料或染色剂)标记所述细胞的所述DNA,并且可以基于所述标记的强度测量来量化DNA的量。在一实施例中,例如,不管采用何种细胞计数法(例如,流式细胞术、细胞计量术等),都可以在所述血细胞计数器上分析用DNA标记试剂标记的细胞的所述荧光强度,并将相应结果绘制在直方图上。根据所述直方图可以确定每个细胞的DNA含量的所述相对量。
在一些情况下,细胞的DNA含量可以表达为所述细胞非整倍性的量度。在标的方法中可以采用任何合适的细胞计量术非整倍性测量方法。在一些情况下,可以根据所测得的所述细胞的DNA含量将细胞识别为非整倍体,其中非整倍体细胞通常具有异常高水平的DNA含量,其表明所述细胞的基因组全部或部分重复。对于DNA含量,可以采用与上述用于评估DNA含量的方法相似的方法来检测非整倍性。在一些情况下,正常细胞的相对DNA含量大于或等于DNA含量阈值可以表明所述细胞是非整倍体,其中所述阈值可以大于或等于正常细胞DNA含量的(≥)1.05倍,包括但不限于,例如,正常细胞DNA含量的≥1.06倍、≥1.07倍、≥1.08倍、≥1.09倍、≥1.10倍、≥1.11倍、≥1.12倍和≥1.13倍。
倍性评估(例如,评估细胞的所述倍性,包括例如,细胞是非整倍体还是二倍体等)可用于各种目的。例如,在一些情况下,可以采用倍性评估来确定群体中的细胞是非整倍体还是二倍体,包括例如,确定赘生性细胞是非整倍体还是二倍体、免疫细胞是非整倍体还是二倍体,等等。在一些情况下,倍性评估可以,例如,基于所检测到的细胞的所述倍性状态与所述受试者中可能存在的其他细胞类型之间的关系来告知所述样本和/或所述受试者的其他特征。
如上所述,可以进行细胞计量术测定的所述参数其中一项是所述受分析细胞的细胞周期,例如,通过使用细胞周期分析评估,包括其中用于评估细胞周期的试剂在所述测定之前施用于所述细胞。例如,在一些情况下,可以对细胞的所述细胞周期进行定性或定量评估,包括但不限于,例如,其中细胞(或多个细胞)的所述细胞周期位置基于所添加以测定细胞周期的试剂确定或量化。因此,在本文所述的测定中,细胞周期可以用作标志物,包括标志物组的标志物。
在一些情况下,细胞周期数据可以包括但不限于确定细胞是否处于所述细胞周期的G
在一些情况下,用于评估细胞周期的标志物可以包括但不限于,例如,细胞周期和/或增殖标志物(例如,Ki-67、磷酸组蛋白H3、增殖细胞核抗原(PCNA)、细胞周期蛋白、细胞周期蛋白依赖性激酶、视网膜母细胞瘤等),等等。此类标志物可以通过使用对所述标志物具有特异性的结合成员来检测,包括其中所述标志物允许在所述蛋白质或mRNA水平下测定所述标志物的所述表达。
在一些情况下,本发明的方法可以包括确定标的细胞是否是免疫细胞。在一些情况下,本发明的方法可以包括确定标的细胞是否是特定类型的免疫细胞(例如,淋巴细胞或其祖细胞、髓样祖细胞、粒细胞、胸腺细胞、髓样前体、T细胞、B细胞、NK细胞、辅助性T细胞、Treg、嗜中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、肥大细胞、单核细胞、树突细胞、巨噬细胞、记忆细胞、浆细胞、造血干细胞等)。可以采用各种方法来确定标的细胞是否是免疫细胞或确定细胞是否是特定类型的免疫细胞,包括例如,通过检测一种或多种标志物(包括免疫细胞标志物和非免疫细胞标志物)的存在或不存在来确定;通过使所述细胞与对所述标志物具有特异性的已标记特异性结合成员接触来确定。在一些情况下,免疫细胞类型确定可以包括评估细胞是否在高或低水平下表达特定标志物或标志物群组。此类水平可以是相对的(例如,基于在所述分析的其他细胞中的标志物表达水平),也可以是绝对的(例如,基于预先确定的阈值表达水平)。
有用的标志物可以包括但不限于,例如,本文所述的一种或更多种免疫细胞类型标志物。在一些情况下,可以采用一种或更多种标志物(包括免疫细胞标志物和非免疫细胞标志物)(例如,且不论、除了或取代一种或更多种本文所述的免疫细胞类型标志物)的所述表达(例如,表达的存在或不存在)。有用标志物的非限制性示例包括单独使用或组合使用的CD45、CD15、CD3、CD4、CD8、CD25,CD19、CD20、CD11c、CD123、CD56、CD34、CD38、CD14、CD39、CD33、CD66b、CD41、CD61、CD62、CD235a、CD146、CD326、FoxP3等。
在一些情况下,所检测到的细胞群体大小可以相对值表示。例如,所述群体的所述大小可以所述样本中所有所述细胞的百分比、受分析的所有所述细胞的百分比、所述样本中特定类型的所有所述细胞的百分比、受分析的特定类型的所有所述细胞的百分比等表示。在一些情况下,所检测到的群体大小可能会超过所述细胞悬液样本中所述赘生性细胞的0.01%或更多,包括但不限于例如,0.1%或更多、1%或更多、10%或更多等。
如上所述,本发明的方法包括检测表达一种或更多种标志物的癌症相关细胞类型和/或其群体,因此包括可用于实施所述方法的各种试剂。例如,本发明的方法通常包括通过使所述细胞悬液与已标记特异性结合成员试剂接触以便进行细胞计量术测定,从而检测表达或不表达一种或更多种标志物的癌症相关细胞类型或其群体。
目的特定结合剂包括但不限于抗体结合剂、蛋白、肽、半抗原、核酸等。本文中使用的术语“抗体结合剂”包括足以与目的分析物结合的多克隆或单克隆抗体或片段。所述抗体片段可以是,例如,单体Fab片段、单体Fab'片段或二聚F(ab)'
有用的核酸结合成员与所述标志物特异性结合,所述标志物包括蛋白标志物和核酸标志物。例如,有用的核酸结合成员可以包括但不限于,例如,与蛋白标志物特异性结合的核酸结合成员(例如适配体)以及与核酸标志物特异性结合的核酸探针(例如与靶核酸生物标志物特异性杂交的核酸探针)。核酸结合成员与其对应的核酸标志物的特异性结合可以涉及所述核酸结合成员与所述核酸标志物在严格杂交条件下的杂交。核酸结合成员可以被直接或间接标记,下文对此提供了更为详细的描述。核酸结合成员的间接标记可以包括也可以不包括信号放大,例如但不限于,例如,分支状核酸(例如,bDNA)信号放大、酪胺信号放大等。
本文所述的特异性结合成员可以直接或间接地以可检测的方式标记(即,具有附着的可检测标记、与可检测标记结合等)。因此,除了与目的生物标志物特异性结合的特异性结合域之外,所述特异性结合剂可以进一步包括可检测标记或与其结合或附着于可检测标记。作为可检测标记,受关注的是荧光染料。荧光染料(荧光团)可能选自适用于成像应用(例如,荧光显微镜检查术)和细胞计数法应用的多种染料中的任何一种。大量染料可从各种来源处购得,例如,Molecular Probes(Molecular Probes(美国马萨诸塞州沃尔瑟姆Thermo Fisher Scientific的分公司)和Exciton(俄亥俄州代顿)。目的荧光团的示例包括但不限于4-乙酰氨基-4'-异硫氰酸芪-2,2'二磺酸;吖啶及其衍生物,例如吖啶、吖啶橙、吖啶黄、吖啶红和吖啶异硫氰酸酯;5-(2'-氨乙基)萘胺-1-磺酸(EDANS);4-氨基-N-[3-乙烯基磺酰基)苯基]萘二甲酰亚胺-3,5-二磺酸盐(荧光黄VS);N-(4-苯胺基-1-萘基)马来酰亚胺;邻氨基苯甲酰胺;亮黄(Brilliant Yellow);香豆素及其衍生物;例如香豆素、7-氨基-4-甲基香豆素(AMC、Coumarin 120)、7-氨基-4-三氟甲基香豆素(Coumaran 151);青色素及其衍生物,例如青色素、Cy3、Cy5、Cy5.5和Cy7;4',6-二脒基-2-苯基吲哚(DAPI);5',5”-二溴邻苯三酚-磺酞(溴邻苯三酚红);7-二乙基氨基-3-(4'-异硫氰酸基苯基)-4-甲基香豆素;二乙基氨基香豆素;二亚乙基三胺五乙酸酯;4,4'-二异硫氰酸基二氢-芪-2,2'-二磺酸;4,4'-二异硫氰酸芪-2,2'-二磺酸;5-[二甲基氨基]萘-1-磺酰氯(DNS、丹磺酰氯);4-(4'-二甲氨基苯基偶氮)苯甲酸(DABCYL);4-二甲氨基偶氮苯-4'-异硫氰酸酯(DABITC);曙红及其衍生物,例如曙红和曙红异硫氰酸酯;赤藓红及其衍生物,例如赤藓红B和赤藓红异硫氰酸酯;乙啡啶;荧光素及其衍生物,例如5-羧基荧光素(FAM)、5-(4,6-二氯三嗪-2-基)氨基荧光素(DTAF)、2'7'-二甲氧基-4'5'-二氯-6-羧基荧光素(JOE)、异硫氰酸荧光素(FITC)、荧光素氯代三嗪基、萘基荧光素和QFITC(XRITC);荧光胺;IR144;IR1446;绿色荧光蛋白(GFP);珊瑚礁荧光蛋白(RCFP);Lissamine
本发明的方法可以包括使用对标志物(例如,免疫检查点标志物、免疫细胞类型标志物、免疫活化标志物、黏附相关标志物、间充质细胞标志物、上皮细胞标志物等)具有特异性的已标记结合成员,以标记所述细胞悬液中的细胞,从而产生可以进行细胞计量术测定的已标记细胞悬液。在一些情况下,根据上下文,可以采用对以下标志物其中一项具有特异性的已标记结合成员:PD-1、TIM-3、LAG-3、CTLA-4、CD3、CD4、CD8、CD16、CD19、CD56、HLA-DR、E钙黏蛋白、CD44、CD103、Pan CK或波形蛋白。在一些情况下,可以采用各自对以下标志物其中一项具有特异性的已标记结合成员:PD-1、TIM-3、LAG-3、CTLA-4、CD3、CD4、CD8、CD16、CD19、CD56、HLA-DR、E钙黏蛋白、CD44、CD103、Pan CK或波形蛋白。在一些情况下,各自对特定标志物具有特异性的已标记结合成员的组合可以包括适用于以下一种或更多种标志物的已标记结合成员:CD4、CD25、CD103、CD127和/或CCR5。在一些情况下,可以采用各自对以下标志物其中一项具有特异性的已标记结合成员:CD8、CD4、CD45、CCR5、CD39、CD103、CD3、CD56、LAG-3、CD14、Pan CK、PD-1、FoxP3、TIM-3、CD19、CTLA-4、PD-L1、CD16或HLA-DR。在一些情况下,对标志物(例如,本文所述的标志物其中一项)具有特异性的已标记结合成员可与在细胞(例如,人细胞)表面表达的所述标志物蛋白特异性结合。
PD-1(CD279)是在免疫细胞上表达的免疫检查点标志物,当其作为免疫检查点时,PD-1下调所述免疫应答,从而降低自身免疫性并增强自身耐受性。PD-1在免疫细胞类型上表达,包括位于外周组织中的大多数成熟T细胞。在免疫应答过程中,PD-1具有两个配体:PD配体1(PDL-1)(也被称为B7-H1和CD274)和PD配体2(PDL-2)(也被称为B7-DC和CD273。抗PD-1的抗体示例请见第7,488,802号美国专利;第8,217,149号美国专利;以及(Topalian,S.L.,Hodi,F.S.,Brahmer,J.R.,Gettinger,S.N.,Smith,D.C.,McDermott,D.F.,…Sznol,M.(2012).抗PD-1抗体在癌症中的安全性、活性和免疫相关性.新英格兰医学杂志,366(26),2443–2454)。靶向PD-1的合适抗体包括但不限于来自Abcam Inc.的抗PD1抗体[克隆号:NAT105](ab52587)。在人体中,所述PD-1蛋白(参考序列ID NP_005009.2,对应于NCBI参考序列NM_005018.2;Uniprot ID Q15116)由所述PDCD1基因(UniGene ID 155258)编码。TIM-3(也被称为T细胞免疫球蛋白黏蛋白受体3、T细胞免疫球蛋白和含有黏蛋白结构域的蛋白3、甲型肝炎病毒细胞受体2、HAVcr-2等)是由免疫细胞表达的免疫检查点标志物,包括CD4+和CD8+T细胞,并在许多其他组织中表达。与半乳凝素结合后,TIM-3可以启动许多涉及所述免疫应答负调控的信号传导途径,例如:使T细胞功能降低,使CD4
LAG-3(CD223)是免疫检查点标志物,也是在免疫细胞上表达的细胞表面受体。活化的T细胞(CD4+和CD8+)和NK细胞表达LAG-3,并上调其表达来响应促炎性细胞因子(例如干扰素γ(IFN-γ))。LAG-3与II类MHC结合,从而阻止II类MHC与所述TCR结合,抑制T细胞刺激。LAG-3与树突细胞(DC)上的II类MHC结合可能激活上调TNF-α和IL-12的信号传导途径。抗LAG-3的抗体示例请见第20110150892号美国专利申请案;第20150259420号美国专利申请案;(Goldberg,M.V.和Drake,C.G.(2011).癌症免疫治疗中的LAG-3。微生物学和免疫学最新话题,344,269-278.);以及(Andrews,L.P.,Marciscano,A.E.,Drake,C.G.和Vignali,D.A.A.(2017).LAG3(CD223)作为癌症免疫治疗靶标。免疫学综述,276(1),80–96.)。靶向LAG-3的合适抗体包括但不限于来自Abcam Inc.的抗LAG 3抗体[克隆号:11E3](ab40465)以及来自Bristol Meyers Squibb Co.的抗LAG3单克隆抗体(BMS-986016)。在人体中,所述LAG-3蛋白(参考序列ID NP_002277.4,对应于NCBI参考序列NM_002286.5;Uniprot IDP18627)由所述淋巴细胞活化基因3(LAG3)基因(UniGene ID 221341)编码。
CTLA-4(CD152)是免疫检查点标志物,也是在免疫细胞(包括T细胞,例如,CD4
CD3(分化簇3)是免疫细胞类型标志物,也是T细胞共受体,参与免疫细胞应答的激活,包括细胞毒性T细胞(CD8+幼稚T细胞)和辅助性T细胞(CD4+幼稚T细胞)的相应激活。CD3是蛋白质复合体,由四条不同的链(在哺乳动物中,一条CD3γ链、一条CD3δ链和两条CD3ε链)组成。所述CD3链与所述T细胞受体(TCR)和所述ζ链(zeta链)缔合,以在T淋巴细胞中产生活化信号。所述TCR、ζ链和CD3分子一起构成所述TCR复合体。靶向CD3的合适抗体包括但不限于来自Abcam Inc.的抗CD3抗体(ab5690)以及来自BioLegend的抗人CD3抗体(克隆号:OKT3)。CD3抗体可以定向于任何单独的CD3链(即,CD3γ链、CD3δ链或CD3ε链。在人体中,所述T细胞表面糖蛋白CD3ε链(CD3E)(参考序列ID NP_000724.1,对应于NCBI参考序列NM_000733.3;Uniprot ID P07766)由所述CD3e分子ε(CD3-TCR复合体)(CD3E)基因(UniGeneID 131335)编码。在人体中,所述T细胞表面糖蛋白CD3γ链(CD3G)(参考序列ID NP_000064.1,对应于NCBI参考序列NM_000073.2;Uniprot ID P09693)由所述CD3g分子γ(CD3-TCR复合体)(CD3G)基因(UniGene ID 131196)编码。在人体中,所述T细胞表面糖蛋白CD3δ链(CD3D)可能以由所述CD3d分子δ(CD3-TCR复合体)(CD3D)基因(UniGene ID 719207)编码的多种同种型(例如,参考序列ID NP_000723.1和NP_038515.3,对应于NCBI参考序列NM_000732.4和NM_001040651.1;Uniprot ID P04234)形式存在。
CD4(分化簇4)是免疫细胞类型标志物,也是所述免疫球蛋白超家族的成员,其具有四个暴露于所述细胞的细胞外表面的免疫球蛋白结构域(D1至D4)。CD4通过其D1结构域与MHC II类分子的β2结构域相互作用。CD4是见于免疫细胞(例如,辅助性T细胞、单核细胞、巨噬细胞和树突细胞)表面的糖蛋白。靶向CD4的合适抗体包括但不限于来自Abcam Inc.的抗CD4抗体[克隆号:EPR6855](ab133616)和来自BioLegend的APC抗人CD4抗体(克隆号:RPA-T4)。在人体中,所述CD4蛋白(参考序列ID NP_000607.1,对应于NCBI参考序列NM_000616.4;Uniprot ID P01730)由所述CD4分子(CD4)基因(UniGene ID 2138553)编码。
CD8(分化簇8)是免疫细胞类型标志物,也是跨膜糖蛋白,可作为T细胞受体(TCR)的共受体。CD8与主要组织相容性复合体(MHC)分子结合,并对所述MHC I类蛋白具有特异性。所述CD8共受体主要在细胞毒性T细胞的表面表达,并且可作为此群体的标志物。CD8在各种免疫细胞上表达,所述免疫细胞包括,例如,自然杀伤细胞、皮质胸腺细胞和树突细胞。靶向CD8的合适抗体包括但不限于来自Abcam Inc.的抗CD8抗体(ab4055)以及来自BioLegend的PE抗人CD8抗体(克隆号:SK1)。所述CD8蛋白由CD8α和CD8β链组成。CD8抗体可以定向于α链或β链。在人体中,所述T细胞表面糖蛋白CD8α链(CD8A)可能以由所述CD8a分子(CD8A)基因(UniGene ID 140849)编码的多种同种型(例如,参考序列ID NP_001139345.1、NP_001759.3和NP_741969.1,对应于NCBI参考序列NM_001145873.1、NM_001768.6和NM_171827.3;Uniprot ID P01732)形式存在。在人体中,所述T细胞表面糖蛋白CD8β链(CD8B)可能以由所述CD8b分子(CD8B)基因(UniGene ID 219625)编码的多种同种型(例如,参考序列ID NP_001171571.1、NP_004922.1、NP_742099.1、NP_742100.1和NP_757362.1,对应于NCBI参考序列NM_004931.4、NM_172101.3、NM_172102.3和NM_172213.3;Uniprot IDP10966)形式存在。
CD14(分化簇14,也被称为单核细胞分化抗原CD14和髓样细胞特异性富亮氨酸糖蛋白)以两种形式存在:通过糖基磷脂酰肌醇尾部锚定于所述膜上的细胞表面表达形式(mCD14)和可溶形式(sCD14)。CD14的所述表面表达形式可作为见于免疫细胞表面的免疫细胞类型标志物,所述免疫细胞包括巨噬细胞、嗜中性粒细胞和树突细胞。CD14
CD16(分化簇16,也被称为FcγRIII)是见于免疫细胞表面的免疫细胞类型标志物,所述免疫细胞包括,例如,自然杀伤细胞、嗜中性粒细胞、多形核白细胞、单核细胞和巨噬细胞。CD16具有包括两个免疫球蛋白样结构域的保守免疫球蛋白样(Ig样)结构。CD16参与抗体依赖性细胞毒性(ADCC)作用,并且可用于通过荧光激活细胞分选(FACS)或磁性激活细胞分选(MACS)分离特异性免疫细胞群体。靶向CD16的合适抗体包括但不限于来自BioLegend的抗人CD16抗体(克隆号:3G8)以及来自Abcam Inc.的抗CD16抗体[克隆号:SP175](ab183354)。CD16已被识别为Fc受体FcγRIIIa(CD16a)和FcγRIIIb(CD16b),并且CD16抗体可以定向于上述任一形式。在人体中,所述低亲和力免疫球蛋白γFc区域受体III-A(FCGR3A、CD16s)蛋白可能以由所述IgG Fc片段低亲和力受体IIIa(CD16a)(FCGR3A)基因(UniGene ID 199972)编码的多种同种型(例如,参考序列ID NP_000560.6、NP_001121064.2、NP_001121065.1、NP_001121067.1、NP_001121068.1和NP_001316049.1,对应于NCBI参考序列NM_000569.7、NM_001127592.2、NM_001127593.1、NM_001127595.1、NM_001127596.1和NM_001329120.1;Uniprot ID P08637)形式存在。在人体中,所述低亲和力免疫球蛋白γFc区域受体III-B(FCGR3B、CD16b)蛋白可能以由IgG Fc片段低亲和力受体IIIb(CD16b)(FCGR3B)基因(例如,UniGene ID 2845101或5800047)编码的多种同种型(例如,参考序列ID NP_000561.3、NP_001231682.1、NP_001257964.1、NP_001257965.1和NP_001257966.1,对应于NCBI参考序列NM_000570.4、NM_001244753.1、NM_001271035.1、NM_001271036.1和NM_001271037.1;Uniprot ID O75015)形式存在。
CD19(分化簇19;也被称为B淋巴细胞抗原CD19、B淋巴细胞表面抗原B4、T细胞表面抗原Leu-12、CVID3等)是免疫细胞类型标志物,也是在人体中由位于16号染色体短臂上的所述基因CD19编码的跨膜蛋白。CD19是所述免疫球蛋白超家族(IgSF)中的95kd I型跨膜糖蛋白,具有两个细胞外C2组Ig样结构域和一个在哺乳动物物种中高度保守的胞质尾区。CD19在B细胞发育的各个阶段广泛表达,直到最终分化为浆细胞。靶向CD19的合适抗体包括但不限于来自Abcam Inc.的抗CD19抗体[克隆号:6D5](ab25232)以及来自BioLegend的FITC抗人CD19抗体(克隆号:HIB19)。在人体中,所述CD19蛋白可能以由所述CD19分子(CD19)基因(UniGene ID 2559235)编码的多种同种型(例如,参考序列ID NP_001171569.1和NP_001761.3,对应于NCBI参考序列NM_001178098.1和NM_001770.5;Uniprot IDP15391)形式存在。
CD39(分化簇39,也被称为由胞外核苷三磷酸二磷酸水解酶-1(ENTPD1)基因和NTPDase1表达的蛋白)是免疫细胞类型标志物,也是典型的细胞表面定位酶,具有面向细胞外的催化位点。靶向CD39的合适抗体包括但不限于来自Enzo Life Sciences,Inc.的CD39(人)单克隆抗体(AC2.5);来自BioLegend的FITC和PE/Cy7 CD39抗体;来自MiltenyiBiotec的APC和FITC cd39抗体;来自R&D Systems的CD39/ENTPD1 Alexa Fluor 350共轭抗体;等等。所述CD39蛋白是将细胞外ATP和ADP水解成AMP的质膜蛋白,并且抑制其活性可赋予抗癌效应。现已发现多种编码不同同种型的转录变体。在人体中,所述CD39蛋白可能以由所述ENTPD1基因(UniGene ID:Hs.655070、Hs.656955、Hs.720540)编码的多种同种型(例如,参考序列ID IDsNP_001240.1、NP_001308914.1、NP_001308915.1、NP_001308916.1、NP_001308917.1,分别对应于NCBI参考序列NM_001249.3、NM_001321985.1、NM_001321986.1、NM_001321987.1和NM_001321988.1;Uniprot ID O75356)形式存在。
CCR5(5型C-C趋化因子受体,也被称为CD195)是免疫细胞类型标志物,也是位于白细胞表面的蛋白,其由于充当趋化因子的受体而参与免疫系统。靶向CCR5的合适抗体包括但不限于来自MBL International的抗CD195(CCR5)(人)mAb-FITC;来自R&D Systems的CCR5 Alexa Fluor 350共轭抗体;来自Miltenyi Biotec的APC重组抗CD195(CCR5)抗体;来自BioLegend的Alexa Fluor647和700 CD195(CCR5)抗体;来自Abcam的抗CCR5抗体[HEK/1/85a](FITC);等等。所述CCR5蛋白是所述β趋化因子受体家族的成员,其预计是与G蛋白偶联受体类似的七次跨膜蛋白。所述蛋白由T细胞和巨噬细胞表达,并且已知是巨噬细胞嗜性病毒(包括HIV)进入宿主细胞的重要共受体。所述基因的缺陷型等位基因与所述HIV感染抵抗力有关。在人体中,所述CCR5蛋白可能以由所述CCR5基因(UniGene ID Hs.450802)编码的多种同种型(例如,参考序列ID NP_000570.1和NP_001093638.1,分别对应于NCBI参考序列NM_000579.3和NCBI参考序列NM_001100168.1;Uniprot ID P51681)形式存在。
CD56(也被称为神经细胞黏附分子(NCAM))是免疫细胞类型标志物,也是在各种细胞(包括自然杀伤(NK)细胞)表面表达的亲同种抗原结合糖蛋白。已在其他淋巴样细胞(包括γδT细胞和活化的CD8+T细胞)以及树突细胞上检测到CD56。靶向CD56的合适抗体包括但不限于来自BioLegend的PE抗人CD56抗体(克隆号:HCD56)以及来自Bio-Rad的抗CD56抗体(克隆号:123C3)。在人体中,所述CD56蛋白可能以由神经细胞黏附分子1(NCAM1)基因(例如,UniGene ID:719037、3323442和5796848)编码的多种同种型(例如,参考序列ID NP_000606.3、NP_001070150.1、NP_001229537.1和NP_851996.2,对应于NCBI参考序列NM_000615.6、NM_001076682.3、NM_001242608.1和NM_181351.4;Uniprot ID P13591)形式存在。
FoxP3(叉头框P3,也被称为scurfin)是免疫细胞类型标志物,也是所述FOX蛋白家族的成员,能在调节性T细胞的发育和功能中充当调控途径的主要调控剂。靶向FoxP3的合适抗体包括但不限于来自Abeomics的FOXP3 FITC共轭抗体(Mouse mAb);来自MiltenyiBiotec的APC抗FoxP3抗体;来自Novus Biologicals的FoxP3抗体(3G3)[Alexa Fluor405];来自MilliporeSigma的Anti-FOXP3-Alexa
HLA-DR(人白细胞抗原–抗原D相关)是免疫活化标志物,也是MHC II类分子,由α链(36kDa)和β链(27kDa)组成的跨膜糖蛋白。它主要在抗原呈递细胞上表达,例如,B淋巴细胞、单核细胞、巨噬细胞、胸腺上皮细胞和活化的T淋巴细胞。HLA-DR是由所述人白细胞抗原复合体在6号染色体6p21.31区域编码的细胞表面受体。靶向HLA-DR的合适抗体包括但不限于HLA-DR/DQ单克隆抗体(49.1);来自ThermoFisher Scientific的FITC;来自BioLegend的PE抗人HLA-DR抗体抗HLA-DR L243;来自ThermoFisher Scientific的HLA-DR单克隆抗体(L243),PE,eBioscience
E钙黏蛋白(也被称为CD324(分化簇324)、CAM 120/80、上皮钙黏蛋白、桑椹黏着蛋白等)是由CDH1基因编码的黏附相关标志物。E钙黏蛋白是所述钙黏蛋白超家族的典型成员。E-钙黏蛋白水平在EMT(上皮—间充质转化)和MET(间充质—上皮转化)中改变。靶向E钙黏蛋白的合适抗体包括但不限于来自BioLegend的FITC抗人CD324 E-钙黏蛋白抗体67A4;来自BD Biosciences的PE小鼠抗E-钙黏蛋白(克隆号:36/E-钙黏蛋白);来自R&D Systems的人E-钙黏蛋白PE共轭抗体FAB18381P;等等。在人体中,所述E钙黏蛋白可能以由钙黏蛋白1——1型E钙黏蛋白(上皮)(CDH1)基因(UniGene ID 676245)编码的多种同种型(例如,参考序列NP_001304113.1、NP_001304114.1、NP_001304115.1和NP_004351.1,对应于NCBI参考序列NM_001317184.1、NM_001317185.1、NM_001317186.1和NM_004360.4;Uniprot IDP12830)形式存在。
CD44(也被称为HCAM(归巢细胞黏附分子)、Pgp-1(吞噬细胞糖蛋白-1)、Hermes抗原、淋巴细胞归巢受体、ECM-III、HUTCH-1等)是黏附相关标志物,也是参与细胞间相互作用、细胞黏附和迁移的细胞表面糖蛋白,由所述CD44基因在11号染色体上编码。CD44在许多哺乳动物细胞类型中表达。靶向CD44的合适抗体包括但不限于来自Abcam Inc.的抗CD44抗体[F10-44-2](ab6124);来自BioLegend的FITC抗人CD44抗体BJ18;来自R&D Systems的人/小鼠CD44抗体MAB6127;等等。在人体中,所述CD44蛋白可能以由CD44分子(印度血型)(CD44)基因(UniGene ID 717487)编码的多种同种型(例如,参考序列NP_000601.3、NP_001001389.1、NP_001001390.1、NP_001001391.1、NP_001001392.1、NP_001189484.1、NP_001189485.1和NP_001189486.1,对应于NCBI参考序列NM_000610.3、NM_001001389.1、NM_001001390.1、NM_001001391.1、NM_001001392.1、NM_001202555.1、NM_001202556.1和NM_001202557.1;Uniprot ID P16070)形式存在。
CD103(分化簇103;也被称为整合素、αE(ITGAE))是黏附相关标志物,也是在人体中由所述ITGAE基因编码的整合素蛋白。CD103与整合素β7(β7–ITGB7)结合形成所述完整的异二聚体整合素分子αEβ7。CD103在各种细胞类型(包括例如,上皮内淋巴细胞(IEL)T细胞(αβT细胞和γδT细胞))以及某些外周调节性T细胞(Tregs)上表达。CD103表达可以表明免疫细胞与癌症接合。靶向CD103的合适抗体包括但不限于来自BD Biosciences的BDHorizon
Pan CK(广谱细胞角蛋白)是指细胞角蛋白的集合,它们共同充当上皮细胞类型的标志物,并且基于其不存在,在一些情况下,充当间充质标志物。细胞角蛋白作为整体包括至少29种不同的蛋白,这些蛋白具有上皮细胞和毛囊细胞的特征。有两种类型的细胞角蛋白:酸性I型细胞角蛋白和碱性或中性II型细胞角蛋白。细胞角蛋白通常成对出现,所述对包含I型细胞角蛋白和II型细胞角蛋白。抗广谱细胞角蛋白抗体具有广泛反应性,可识别大多数人上皮组织中存在的表位,从而有助于正常、化生和赘生性细胞的分型。靶向Pan CK的合适抗体包括但不限于来自Abcam Inc.的抗广谱细胞角蛋白抗体[AE1/AE3+5D3](ab86734);来自Millipore-Sigma的单克隆抗细胞角蛋白泛-FITC抗体;来自BioLegend的纯化抗广谱细胞角蛋白抗体(克隆号:AE-1/AE-3);来自Cell Signaling Technology Inc.的Pan-Keratin(C11)小鼠单克隆抗体(Alexa
波形蛋白(也被称为VIM、CTRCT30、HEL113等)是间充质标志物,也是在人体中由所述VIM基因编码的结构蛋白。波形蛋白是在间充质细胞中表达的III型中间丝状体(IF)蛋白。波形蛋白可用作在正常发育和转移发展中间充质来源细胞或经历上皮细胞—间充质转化(EMT)的细胞的标志物。靶向波形蛋白的合适抗体包括但不限于来自Abcam Inc.的抗波形蛋白抗体[EPR3776];来自Abcam Inc.的抗波形蛋白抗体(ab24525);来自Abcam Inc.的抗波形蛋白抗体[RV202];来自BioLegend的Alexa
对上述标志物中的任何一种具有特异性的有用结合成员包括但不限于对所述相关人蛋白具有特异性的抗体(即,抗人-[标志物]抗体),包括例如,在各种宿主物种(例如,兔、小鼠、山羊、大鼠、仓鼠等)中产生的多克隆抗体和单克隆抗体。此类适用于细胞计量术分析的抗体可从各种商业供应商处获得,所述供应商包括但不限于,例如,Cell SignalingTechnology,Inc.(CST,马萨诸塞州丹弗斯);Thermo Fisher Scientific(马萨诸塞州沃尔瑟姆);BD Biosciences(加利福尼亚州圣何塞);BioLegend(加利福尼亚州圣地亚哥);Tonbo Biosciences(加利福尼亚州圣地亚哥);MBL International(马萨诸塞州沃本);LifeSpan BioSciences(华盛顿州西雅图);Bio-Rad(原名AbD Serotec,加利福尼亚州赫拉克勒斯);Origene Technologies Inc.(马里兰州罗克维尔);MyBioSource.com(加利福尼亚圣地亚哥);Miltenyi Biotec(德国贝尔吉施格拉德巴赫);MilliporeSigma(马萨诸塞州伯灵顿);Beckman Coulter Life Sciences(印第安纳州印第安纳波利斯);AffinityImmuno Inc.(加拿大PE夏洛特敦);ProSci,Inc.(加利福尼亚州波威);Bio XCell(新罕布什尔州西莱巴嫩);EXBIO Praha,a.s(捷克共和国);enQuire BioReagents(科罗拉多州丹佛);Biogems International,Inc.(加利福尼亚州西湖村);United StatesBiological(马萨诸塞州塞勒姆);R&D Systems(明尼苏达州明尼阿波利斯);Santa CruzBiotechnology(加利福尼亚州圣克鲁斯);Abcam Inc.(英国剑桥);等等。
所述的标志物包括细胞表面标志物。本文中使用的术语“细胞表面标志物”是指至少部分或完全暴露于细胞质膜外表面的细胞组分,因此可在不调节细胞透性的情况下(例如,未使用本文所述的一种或更多种透化试剂)触及到。在一些情况下,细胞表面标志物包括具有暴露于所述细胞膜外表面的部分但还含有细胞内部分和/或跨膜部分的细胞组分。
所述的标志物包括细胞内标志物。本文中使用的术语“细胞内标志物”是指位于所述细胞内部(即,在所述细胞质膜的细胞外表面内)并且未暴露于所述质膜外表面的细胞组分。细胞内标志物的非限制性示例包括核酸标志物,例如mRNA标志物、DNA标志物(例如,DNA含量标志物,作为细胞周期标志物的组分的DNA等)等。依据用于检测细胞内标志物的所述结合成员,用细胞内标志物标记细胞可能涉及也可能不涉及用一种或更多种透化试剂使所述细胞透化。例如,在一些情况下,可以采用一种或更多种细胞可渗透性结合成员,例如,细胞可渗透性染料或染色剂,例如但不限于,例如,DNA染料/染色剂、细胞质染料等,因此可能不一定需要进行透化处理。在一些情况下,可以采用一种或更多种细胞不可渗透性结合成员,例如,细胞不可渗透性核酸或蛋白结合成员,例如但不限于,例如,抗体、核酸(例如,mRNA)探针等,因此可以采用透化处理。
如上所述,例如,对于DNA含量的检测,本文所述的方法可以包括使用一种或更多种DNA标记试剂检测DNA。各种DNA标记试剂可用于本文所述的方法,所述试剂包括但不限于:Hoechst 33342(2'-(4-乙氧苯基)-5-(4-甲基-1-哌嗪基)-1H,1'H-2,5'-联苯并咪唑三盐酸盐)和Hoechst 33258(4-[6-(4-甲基-1-哌嗪基)-1',3'-二氢-1H,2'H-2,5'-联苯并咪唑-2'-亚烷基]-2,5-环己二烯-1-酮三盐酸盐)以及所述Hoechst系列中的其他项;SYTO40、SYTO 11、12、13、14、15、16、20、21、22、23、24、25(绿色);SYTO 17、59(红色)、DAPI、DRAQ5
在一些情况下,本发明的方法可以包括出于各种目的使用一种或更多种活性染料。例如,在一些情况下,可以采用活性染料来确定标的细胞是活细胞还是死细胞。在一些情况下,活性染料可以用作上述细胞标志物测定的一部分,包括例如,作为DNA含量测定的一部分、作为细胞周期测定的一部分等。有用的活性染料包括但不限于,例如,DNA染料、DNA嵌入染料、小瓶染料、碘化丙啶、钙黄绿素、Hoechst染料等,以及碘化丙啶(PI)、7-氨基放线菌素D(7-AAD)及可从商业分销商处获取的染料,例如,可固定活性染料eFluor455UV/450/506/520/660/780(Affymetrix eBioscience,加利福尼亚州圣地亚哥)、LIVE/DEAD可固定蓝色/紫色/浅绿色/黄色染料(Life Technologies,纽约州格兰德岛)、Zombie Aqua/Green/NIR/RED/UV/Violet/Yellow(BioLegend,加利福尼亚州圣地亚哥)等。
如本文所述,对于本领域普通技术人员而言显而易见的是,本文所述的试剂和标记的任何组合均可用于所述方法中,前提是所述组合是适当的,并且所述组分在物理上或光学上不会产生干涉。例如,本领域普通技术人员可以和/或应当变更或替换特定标记,以便采用两种或更多种所需组分的组合。作为非限制性示例,在生物标志物的特定荧光标记在光学上干涉(例如,具有重叠的发射光谱)具有特定发射波长的所需DNA标记试剂的情况下,所述生物标志物的荧光标记可以用与所需DNA标记试剂无或有较少发射光谱重叠的荧光标记替代。
如上所述,本发明包括对受试者进行筛查的方法。此类筛查可以包括,例如,通过检测一种或更多种细胞类型和/或细胞群体来对受试者进行转移性癌症筛查。可以基于本文所述的一种或更多种标志物的表达来检测所检测到的细胞类型和/或细胞群体,所述标志物包括,例如,一种或更多种免疫检查点标志物、一种或更多种免疫细胞类型标志物、一种或更多种其他标志物和/或其组合。所检测到的用于对受试者进行转移性癌症筛查的细胞类型和/或细胞群体包括表达免疫检查点和免疫细胞类型标志物的组合的TIL。
在不受理论束缚的情况下,本发明的发明人已经发现存在和/或不存在某些癌症相关细胞群体,例如,具有某些标志物表达谱的某些TIL群体,和/或多种癌症相关细胞群体的组合指示受试者中转移性癌症的存在和/或所述受试者中循环肿瘤细胞(CTC)的存在。在一些方面,这些发现的细胞群体的检测可以实际用于在患有或可能患或发展转移性癌症和/或CTC的受试者的检测、筛查和治疗方面提供技术改进。
在一些情况下,一种或更多种癌症相关细胞类型或其细胞群体的存在或不存在可以指示所述受试者中CTC的相对存在或不存在,并且由此可以推论出所述受试者中转移性癌症的存在或不存在。例如,在一些情况下,一种或更多种癌症相关细胞类型或其细胞群体的存在或不存在可以指示在CTC测定中很可能检测到五种或更少的CTC,包括例如,在CTC测定中很可能检测到四种或更少的CTC、三种或更少的CTC、两种或更少的CTC、一种或未检测到CTC或未检测到CTC。
一种或更多种癌症相关细胞类型或其细胞群体不存在的受试者可以被认定为无转移性癌症或很可能无转移性癌症。相应地,可以预计一种或更多种癌症相关细胞类型或其细胞群体不存在的受试者的CTC水平(可通过CTC测定检测到)等于或低于预先确定的阈值(例如,五种、四种、三种、两种或一种CTC),表明所述受试者无或很可能无转移性癌症。一种或更多种癌症相关细胞类型或其细胞群体的水平等于或低于已确定阈值的受试者可被认定为无转移性癌症或很可能无转移性癌症。相应地,可以预计一种或更多种癌症相关细胞类型或其细胞群体的水平等于或低于已确定阈值的受试者的CTC水平(可通过CTC测定检测到)等于或低于预先确定的阈值(例如,五种、四种、三种、两种或一种CTC),表明所述受试者无或很可能无转移性癌症。
具有一种或更多种癌症相关细胞类型或其细胞群体的受试者可以被认定为具有转移性癌症或很可能具有转移性癌症。相应地,可以预计具有一种或更多种癌症相关细胞类型或其细胞群体的受试者的CTC水平(可通过CTC测定检测到)高于预先确定的阈值(例如,五种、四种、三种、两种或一种CTC),表明所述受试者具有或很可能具有转移性癌症。一种或更多种癌症相关细胞类型或其细胞群体的水平高于已确定阈值的受试者可被认定为具有转移性癌症或很可能具有转移性癌症。相应地,可以预计一种或更多种癌症相关细胞类型或其细胞群体的水平高于已确定阈值的受试者的CTC水平(可通过CTC测定检测到)高于预先确定的阈值(例如,五种、四种、三种、两种或一种),表明所述受试者具有或很可能具有转移性癌症。
等于或高于其便可认定受试者具有或很可能具有转移性癌症的癌症相关细胞类型或其细胞群体的有用阈值水平可以基于各种因素而变化,所述因素包括例如,所测定的特定癌症相关细胞类型或其细胞群体。相应地,等于或低于其便可认定受试者无或很可能无转移性癌症的癌症相关细胞类型或其细胞群体的有用阈值水平可以类似方式发生变化。例如,在一些情况下,癌症相关细胞群体的阈值水平可以设为15%,其中例如,当所述标的群体占经测定细胞的15%或更多时,存在或很可能存在转移,以及当所述标的群体占比低于15%时,不存在或很可能不存在转移。在一些情况下,此类阈值水平可以是15%或低于15%,包括但不限于,例如,14%或更低、13%或更低、12%或更低、11%或更低、10%或更低、9%或更低、8%或更低、7%或更低、6%或更低、5%或更低、4%或更低、3%或更低、2.5%或更低、2%或更低、1.5%或更低、1%或更低或0.5%或更低。在一些情况下,目的群体占一定百分比的经测定的细胞可以是所述样本中所有经测定的细胞或其部分,包括但不限于,例如,所述样本中经测定的免疫细胞、所述样本中经测定的淋巴细胞等。
在一些实施例中,确定受试者中存在或不存在转移和/或CTC可以包括表达PD-1和CTLA-4的癌症相关细胞群体的阈值为15%或更低,包括但不包括限于,例如,14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2.5%、2%、1.5%、1%或0.5%。例如,在表达PD-1和CTLA-4的癌症相关细胞群体占比大于或等于所述经测定的免疫细胞的百分比阈值(在一些情况下,独立计量或与其他癌症相关细胞群体组合计量)的情况下,确定所述受试者具有或很可能具有转移和/或CTC。相应地,在表达PD-1和CTLA-4的癌症相关细胞群体占比小于所述经测定的免疫细胞的百分比阈值(在一些情况下,独立计量或与其他癌症相关细胞群体组合计量)的情况下,确定受试者无或很可能无转移和/或CTC。
在一些实施例中,确定受试者中存在或不存在转移和/或CTC可以包括表达PD-1、CTLA-4和CD4的癌症相关细胞群体的阈值为15%或更低,包括但不包括限于,例如,14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2.5%、2%、1.5%、1%或0.5%。例如,在表达PD-1、CTLA-4和CD4的癌症相关细胞群体占比大于或等于所述经测定的免疫细胞的百分比阈值(在一些情况下,独立计量或与其他癌症相关细胞群体组合时)的情况下,确定所述受试者具有或很可能具有转移和/或CTC。相应地,在表达PD-1、CTLA-4和CD4的癌症相关细胞群体占比小于所述经测定的免疫细胞的百分比阈值(在一些情况下,独立计量或与其他癌症相关细胞群体组合计量)的情况下,确定受试者无或很可能无转移和/或CTC。
在一些实施例中,确定受试者中存在或不存在转移和/或CTC可以包括表达PD-1、CTLA-4和CD8的癌症相关细胞群体的阈值为15%或更低,包括但不包括限于,例如,14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2.5%、2%、1.5%、1%或0.5%。例如,在表达PD-1、CTLA-4和CD8的癌症相关细胞群体占比大于或等于所述经测定的免疫细胞的百分比阈值(在一些情况下,独立计量或与其他癌症相关细胞群体组合时)的情况下,确定所述受试者具有或很可能具有转移和/或CTC。相应地,在表达PD-1、CTLA-4和CD8的癌症相关细胞群体占比小于所述经测定的免疫细胞的百分比阈值(在一些情况下,独立计量或与其他癌症相关细胞群体组合计量)的情况下,确定受试者无或很可能无转移和/或CTC。
在一些实施例中,确定受试者中存在或不存在转移和/或CTC可以包括表达PD-1和CD4的癌症相关细胞群体的阈值为15%或更低,包括但不包括限于,例如,14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2.5%、2%、1.5%、1%或0.5%。例如,在表达PD-1和CD4的癌症相关细胞群体占比大于或等于所述经测定的免疫细胞的百分比阈值(在一些情况下,独立计量或与其他癌症相关细胞群体组合计量)的情况下,确定所述受试者具有或很可能具有转移和/或CTC。相应地,在表达PD-1和CD4的癌症相关细胞群体占比小于所述经测定的免疫细胞的百分比阈值(在一些情况下,独立计量或与其他癌症相关细胞群体组合计量)的情况下,确定受试者无或很可能无转移和/或CTC。
在一些实施例中,确定受试者中存在或不存在转移和/或CTC可以包括表达PD-1和TIM-3的癌症相关细胞群体的阈值为15%或更低,包括但不包括限于,例如,14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2.5%、2%、1.5%、1%或0.5%。例如,在表达PD-1和TIM-3的癌症相关细胞群体占比大于或等于所述经测定的免疫细胞的百分比阈值(在一些情况下,独立计量或与其他癌症相关细胞群体组合计量)的情况下,确定所述受试者具有或很可能具有转移和/或CTC。相应地,在表达PD-1和TIM-3的癌症相关细胞群体占比小于所述经测定的免疫细胞的百分比阈值(在一些情况下,独立计量或与其他癌症相关细胞群体组合计量)的情况下,确定受试者无或很可能无转移和/或CTC。
在一些实施例中,确定受试者中存在或不存在转移和/或CTC可以包括表达PD-1、TIM-3和CD4的癌症相关细胞群体的阈值为15%或更低,包括但不包括限于,例如,14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2.5%、2%、1.5%、1%或0.5%。例如,在表达PD-1、TIM-3和CD4的癌症相关细胞群体占比大于或等于所述经测定的免疫细胞的百分比阈值(在一些情况下,独立计量或与其他癌症相关细胞群体组合时)的情况下,确定所述受试者具有或很可能具有转移和/或CTC。相应地,在表达PD-1、TIM-3和CD4的癌症相关细胞群体占比小于所述经测定的免疫细胞的百分比阈值(在一些情况下,独立计量或与其他癌症相关细胞群体组合计量)的情况下,确定受试者无或很可能无转移和/或CTC。
在一些实施例中,确定受试者中存在或不存在转移和/或CTC可以包括表达PD-1、LAG-3和CD4的癌症相关细胞群体的阈值为15%或更低,包括但不包括限于,例如,14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2.5%、2%、1.5%、1%或0.5%。例如,在表达PD-1、LAG-3和CD4的癌症相关细胞群体占比大于或等于所述经测定的免疫细胞的百分比阈值(在一些情况下,独立计量或与其他癌症相关细胞群体组合时)的情况下,确定所述受试者具有或很可能具有转移和/或CTC。相应地,在表达PD-1、LAG-3和CD4的癌症相关细胞群体占比小于所述经测定的免疫细胞的百分比阈值(在一些情况下,独立计量或与其他癌症相关细胞群体组合计量)的情况下,确定受试者无或很可能无转移和/或CTC。
在一些实施例中,确定受试者中存在或不存在转移和/或CTC可以包括表达TIM-3和CD4的癌症相关细胞群体的阈值为15%或更低,包括但不包括限于,例如,14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2.5%、2%、1.5%、1%或0.5%。例如,在表达TIM-3和CD4的癌症相关细胞群体占比大于或等于所述经测定的免疫细胞的百分比阈值(在一些情况下,独立计量或与其他癌症相关细胞群体组合计量)的情况下,确定所述受试者具有或很可能具有转移和/或CTC。相应地,在表达TIM-3和CD4的癌症相关细胞群体占比小于所述经测定的免疫细胞的百分比阈值(在一些情况下,独立计量或与其他癌症相关细胞群体组合计量)的情况下,确定受试者无或很可能无转移和/或CTC。
在一些实施例中,确定受试者中存在或不存在转移和/或CTC可以包括表达TIM-3、CD4和LAG3的癌症相关细胞群体的阈值为15%或更低,包括但不包括限于,例如,14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2.5%、2%、1.5%、1%或0.5%。例如,在表达TIM-3、CD4和LAG3的癌症相关细胞群体占比大于或等于所述经测定的免疫细胞的百分比阈值(在一些情况下,独立计量或与其他癌症相关细胞群体组合时)的情况下,确定所述受试者具有或很可能具有转移和/或CTC。相应地,在表达TIM-3、CD4和LAG3的癌症相关细胞群体占比小于所述经测定的免疫细胞的百分比阈值(在一些情况下,独立计量或与其他癌症相关细胞群体组合计量)的情况下,确定受试者无或很可能无转移和/或CTC。
在一些实施例中,确定受试者中存在或不存在转移和/或CTC可以包括表达TIM-3和CTLA-4的癌症相关细胞群体的阈值为15%或更低,包括但不包括限于,例如,14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2.5%、2%、1.5%、1%或0.5%。例如,在表达TIM-3和CTLA-4的癌症相关细胞群体占比大于或等于所述经测定的免疫细胞的百分比阈值(在一些情况下,独立计量或与其他癌症相关细胞群体组合计量)的情况下,确定所述受试者具有或很可能具有转移和/或CTC。相应地,在表达TIM-3和CTLA-4的癌症相关细胞群体占比小于所述经测定的免疫细胞的百分比阈值(在一些情况下,独立计量或与其他癌症相关细胞群体组合计量)的情况下,确定受试者无或很可能无转移和/或CTC。
在一些实施例中,确定受试者中存在或不存在转移和/或CTC可以包括表达TIM-3、CTLA-4和CD4的癌症相关细胞群体的阈值为15%或更低,包括但不包括限于,例如,14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2.5%、2%、1.5%、1%或0.5%。例如,在表达TIM-3、CTLA-4和CD4的癌症相关细胞群体占比大于或等于所述经测定的免疫细胞的百分比阈值(在一些情况下,独立计量或与其他癌症相关细胞群体组合时)的情况下,确定所述受试者具有或很可能具有转移和/或CTC。相应地,在表达TIM-3、CTLA-4和CD4的癌症相关细胞群体占比小于所述经测定的免疫细胞的百分比阈值(在一些情况下,独立计量或与其他癌症相关细胞群体组合计量)的情况下,确定受试者无或很可能无转移和/或CTC。
在一些实施例中,确定受试者中存在或不存在转移和/或CTC可以包括表达TIM-3、CTLA-4和CD8的癌症相关细胞群体的阈值为15%或更低,包括但不包括限于,例如,14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2.5%、2%、1.5%、1%或0.5%。例如,在表达TIM-3、CTLA-4和CD8的癌症相关细胞群体占比大于或等于所述经测定的免疫细胞的百分比阈值(在一些情况下,独立计量或与其他癌症相关细胞群体组合时)的情况下,确定所述受试者具有或很可能具有转移和/或CTC。相应地,在表达TIM-3、CTLA-4和CD8的癌症相关细胞群体占比小于所述经测定的免疫细胞的百分比阈值(在一些情况下,独立计量或与其他癌症相关细胞群体组合计量)的情况下,确定受试者无或很可能无转移和/或CTC。
在一些实施例中,确定受试者中存在或不存在转移和/或CTC可以包括表达TIM-3和NK细胞标志物的癌症相关细胞群体的阈值为15%或更低,包括但不包括限于,例如,14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2.5%、2%、1.5%、1%或0.5%。例如,在表达TIM-3和NK细胞标志物的癌症相关细胞群体占比大于或等于所述经测定的免疫细胞的百分比阈值(在一些情况下,独立计量或与其他癌症相关细胞群体组合计量)的情况下,确定所述受试者具有或很可能具有转移和/或CTC。相应地,在表达TIM-3和NK细胞标志物的癌症相关细胞群体占比小于所述经测定的免疫细胞的百分比阈值(在一些情况下,独立计量或与其他癌症相关细胞群体组合计量)的情况下,确定受试者无或很可能无转移和/或CTC。
在一些实施例中,确定受试者中存在或不存在转移和/或CTC可以包括表达LAG-3和CD4的癌症相关细胞群体的阈值为15%或更低,包括但不包括限于,例如,14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2.5%、2%、1.5%、1%或0.5%。例如,在表达LAG-3和CD4的癌症相关细胞群体占比大于或等于所述经测定的免疫细胞的百分比阈值(在一些情况下,独立计量或与其他癌症相关细胞群体组合计量)的情况下,确定所述受试者具有或很可能具有转移和/或CTC。相应地,在表达LAG-3和CD4的癌症相关细胞群体占比小于所述经测定的免疫细胞的百分比阈值(在一些情况下,独立计量或与其他癌症相关细胞群体组合计量)的情况下,确定受试者无或很可能无转移和/或CTC。
在一些实施例中,确定受试者中存在或不存在转移和/或CTC可以包括表达LAG-3、CD4和CTLA-4的癌症相关细胞群体的阈值为15%或更低,包括但不包括限于,例如,14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2.5%、2%、1.5%、1%或0.5%。例如,在表达LAG-3、CD4和CTLA-4的癌症相关细胞群体占比大于或等于所述经测定的免疫细胞的百分比阈值(在一些情况下,独立计量或与其他癌症相关细胞群体组合时)的情况下,确定所述受试者具有或很可能具有转移和/或CTC。相应地,在表达LAG-3、CD4和CTLA-4的癌症相关细胞群体占比小于所述经测定的免疫细胞的百分比阈值(在一些情况下,独立计量或与其他癌症相关细胞群体组合计量)的情况下,确定受试者无或很可能无转移和/或CTC。
在一些实施例中,确定受试者中存在或不存在转移和/或CTC可以包括表达HLA-DR的癌症相关细胞群体的阈值为15%或更低,包括但不包括限于,例如,14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2.5%、2%、1.5%、1%或0.5%。例如,在表达HLA-DR的癌症相关细胞群体占比大于或等于所述经测定的免疫细胞的百分比阈值(在一些情况下,独立计量或与其他癌症相关细胞群体组合计量)的情况下,确定所述受试者具有或很可能具有转移和/或CTC。相应地,在表达HLA-DR的癌症相关细胞群体占比小于所述经测定的免疫细胞的百分比阈值(在一些情况下,独立计量或与其他癌症相关细胞群体组合计量)的情况下,确定受试者无或很可能无转移和/或CTC。
在一些实施例中,确定受试者中存在或不存在转移和/或CTC可以包括表达HLA-DR和CD103的癌症相关细胞群体的阈值为15%或更低,包括但不包括限于,例如,14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2.5%、2%、1.5%、1%或0.5%。例如,在表达HLA-DR和CD103的癌症相关细胞群体占比大于或等于所述经测定的免疫细胞的百分比阈值(在一些情况下,独立计量或与其他癌症相关细胞群体组合计量)的情况下,确定所述受试者具有或很可能具有转移和/或CTC。相应地,在表达HLA-DR和CD103的癌症相关细胞群体占比小于所述经测定的免疫细胞的百分比阈值(在一些情况下,独立计量或与其他癌症相关细胞群体组合计量)的情况下,确定受试者无或很可能无转移和/或CTC。
在一些实施例中,确定受试者中存在或不存在转移和/或CTC可以包括表达CCR5的免疫细胞(包括例如,表达CCR5的Treg细胞)的癌症相关细胞群体的阈值为15%或更低,包括但不包括限于,例如,14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2.5%、2%、1.5%、1%或0.5%。例如,在表达CCR5的癌症相关细胞群体占比大于或等于所述经测定的免疫细胞的百分比阈值(在一些情况下,独立计量或与其他癌症相关细胞群体组合计量)的情况下,确定所述受试者具有或很可能具有转移和/或CTC。相应地,在表达CCR5的癌症相关细胞群体占比小于所述经测定的免疫细胞的百分比阈值(在一些情况下,独立计量或与其他癌症相关细胞群体组合计量)的情况下,确定受试者无或很可能无转移和/或CTC。
在一些实施例中,确定受试者中存在或不存在转移和/或CTC可以包括表达至少一种免疫检查点标志物和CCR5的免疫细胞(包括例如,表达CCR5的Treg细胞)的癌症相关细胞群体的阈值为15%或更低,包括但不包括限于,例如,14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2.5%、2%、1.5%、1%或0.5%。例如,在表达至少一种免疫检查点标志物和CCR5的癌症相关细胞群体占比大于或等于所述经测定的免疫细胞的百分比阈值(在一些情况下,独立计量或与其他癌症相关细胞群体组合计量)的情况下,确定所述受试者具有或很可能具有转移和/或CTC。相应地,在表达至少一种免疫检查点标志物和CCR5的癌症相关细胞群体占比小于所述经测定的免疫细胞的百分比阈值(在一些情况下,独立计量或与其他癌症相关细胞群体组合计量)的情况下,确定受试者无或很可能无转移和/或CTC。
上述是特定癌症相关细胞群体的阈值水平的非限制性示例,高于或低于其所述群体(单独使用或与其他癌症相关细胞群体组合使用)的存在或不存在便可以指示转移性癌症和/或CTC的存在或不存在。这些示例不具有限制性,并且在一些情况下,可以在本发明的测定中以相似和/或相应的阈值采用其他癌症相关的细胞群体。
在一些情况下,例如,在采用多种不同的癌症相关细胞群体进行转移性疾病筛查和/或筛查CTC的存在/不存在的情况下,可以针对每种不同的癌症相关细胞群体采用不同的阈值。例如,可以针对第一癌症相关细胞群体采用第一阈值水平2%以及针对第二癌症相关细胞群体采用第二阈值水平12%,使得检测到的所述第一癌症相关细胞群体超过2%和/或所述第二癌症相关细胞群体超过12%可指示存在或很可能存在转移。
在一些情况下,可针对两种或更多种不同的癌症相关细胞群体采用同一阈值。例如,在一些情况下,可针对多种群体采用单个阈值(例如,阈值为1%),使得,例如,所述多种群体的存在全部等于或高于1%可指示转移和/或CTC的存在,以及所述多种群体的存在全部低于1%可指示转移和/或CTC的不存在。在针对多种不同群体采用同一阈值的情况下,所述实际阈值可能会根据所述群体和环境而变化,并且可能包括但不限于,例如,15%或更少,包括但不限于,例如,14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2.5%、2%、1.5%、1%或0.5%。
如本文所述,在确定转移的存在/不存在时,可以单独或组合采用单种癌症相关细胞类型和/或其群体的检测。因此,在一些情况下,在确定转移和/或CTC的存在/不存在时,可以采用高于或低于特定阈值的单一癌症相关细胞类型和/或其群体的检测。在一些情况下,在确定转移和/或CTC的存在/不存在时,可以采用高于或低于特定阈值的多种不同癌症相关细胞类型和/或其群体的检测。例如,在一些情况下,确定存在转移和/或CTC可能要求两种或更多种(包括例如,三种或更多种、四种或更多种、五种或更多种、六种或更多种等)不同的癌症相关细胞类型和/或其群体全部等于或高于其各自特定阈值。相应地,确定存在转移和/或CTC可能要求两种或更多种(包括例如,三种或更多种、四种或更多种、五种或更多种、六种或更多种等)不同的癌症相关细胞类型和/或其群体全部等于或低于其各自特定阈值。
在一些情况下,在转移/CTC确定中组合使用多种不同的癌症相关细胞类型和/或其群体,可以提高预测能力。例如,采用多种不同的癌症相关细胞类型和/或其群体的测定相较于测定单种癌症相关细胞类型和/或其群体,可以更好地预测转移和/或CTC的存在/不存在。在一些情况下,用于进行转移/CTC确定的多种不同癌症相关细胞类型和/或其群体的组合可以包括单独使用可能无法独立地区分转移和/或CTC的存在与不存在的一种或更多种癌症相关细胞类型和/或其群体和/或其检测阈值。在一些情况下,癌症相关细胞类型和/或其群体和/或其检测阈值可以独立地区分转移和/或CTC的存在与不存在。
本文所述的许多有用的阈值包括其中所述癌症相关细胞群体占所述相关测定细胞(例如,免疫细胞、淋巴细胞等)的15%或更低。但是,这不应被视为是限制性的,并且在一些情况下,可以采用高于15%的一个或更多个阈值,包括但不限于,例如,20%、25%、30%、35%、40%、45%、50%等。此类更高的阈值可以在各种情况下使用,包括例如,其中所述相关测定细胞组(所述癌症相关细胞群体是其组成部分)相对较小和/或具有特异性。例如,在所述相关测定细胞(所述癌症相关群体是其组成部分)仅限于CD4+细胞、CD8+细胞、NK细胞、Treg细胞等时。
因此,本发明中提供的筛查方法可以包括检测一种或更多种癌症相关细胞类型或其细胞群体,包括例如,检测上述此类细胞类型和群体的方法。标的筛查方法可以包括也可以不包括筛查程序后的测试步骤,并且可以取决于所述筛查程序的结果。例如,标的方法可以包括检测来自受试者的样本中是否存在特定TIL群体,然后基于所述筛查结果进一步测试所述受试者是否患有转移性癌症,例如,在检测到所述TIL群体存在时,对所述受试者进行测试。
对受试者进行的测试(例如,用于确定和/或确认是否存在转移性癌症的测试)会发生变化。例如,在一些情况下,对受试者进行的测试可以包括从所述受试者中获取样本以进行测试。用于测试的有用样本会发生变化,并且可以包括,例如,液体样本(例如,血液、淋巴液等)、组织样本、活检样本(例如,肿瘤活检样本、淋巴结活检样本等)等。在一些情况下,对受试者进行的测试可以包括淋巴结活检,包括对受试者的一种或更多种淋巴结进行的活检,例如,前哨淋巴结活检、局部淋巴结活检等。在一些情况下,对受试者进行的测试可以包括医学成像,包括但不限于,例如,用于检测转移性癌症的成像。
在一些情况下,对受试者进行的测试可以包括检测和/或确认循环肿瘤细胞(CTC)的存在/不存在的测定,其在本文中被称为循环肿瘤细胞(CTC)测定。在一些情况下,可以对获取自受试者的液体样本进行CTC测定,包括其中仅在首先如上所述测定和检测了一种或更多种癌症相关细胞群体后,才获取所述液体样本和/或对其进行CTC测定。
在一些情况下,CTC测定可以包括测定一种或更多种CTC标志物。本文中使用的术语“CTC”通常是指已从肿瘤(例如,肿瘤边缘)上脱落,并且已被所述血流或淋巴系统清除,从而导致所述CTC在体内循环的赘生性细胞。CTC标志物包括例如,用于识别所述血流中CTC的标志物,包括但不限于,例如,上皮细胞黏附分子(EpCAM)、细胞角蛋白8、细胞角蛋白18和细胞角蛋白19。在一些情况下,源自非免疫相关癌症的CTC可以进一步被表征为对一种或更多种免疫细胞标志物呈阴性,所述标志物包括但不限于,例如,本文所述的免疫细胞标志物中的一种或更多种。例如,在一些情况下,所检测到的CTC可以对CD45呈阴性。在一些情况下,源自免疫相关癌症的CTC可以进一步被表征为对一种或更多种免疫细胞标志物呈阳性,所述标志物包括但不限于,例如,本文所述的免疫细胞标志物中的一种或更多种。
在一些情况下,可以基于一种或更多种癌症抗原和/或一种或更多种癌症相关抗原的表达进一步识别和/或表征CTC。癌症抗原的非限制性示例包括但不限于,例如,CD19、CD20、CD38、CD30、Her2/neu、ERBB2、CA125、MUC-1、前列腺特异性膜抗原(PSMA)、CD44表面黏附分子、间皮素、癌胚抗原(CEA)、表皮生长因子受体(EGFR)、EGFRvIII、血管内皮生长因子受体2(VEGFR2)、高分子量黑色素瘤相关抗原(HMW-MAA)、MAGE-A1、IL-13R-a2、GD2等。癌症相关抗原还包括,例如,4-1BB、5T4、腺癌抗原、甲胎蛋白、BAFF、B淋巴瘤细胞、C242抗原、CA-125、碳酸酐酶9(CA-IX)、C-MET、CCR4、CD152、CD19、CD20、CD200、CD22、CD221、CD23(IgE受体)、CD28、CD30(TNFRSF8)、CD33、CD4、CD40、CD44 v6、CD51、CD52、CD56、CD74、CD80、CEA、CNTO888、CTLA-4、DRS、EGFR、EpCAM、CD3、FAP、纤连蛋白外结构域B、叶酸受体1、GD2、GD3神经节苷脂、糖蛋白75、GPNMB、HER2/neu、HGF、人扩散因子受体激酶、IGF-1受体、IGF-I、IgG1、L1-CAM、IL-13、IL-6、胰岛素样生长因子I受体、整合素α5β1、整合素αvβ3、MORAb-009、MS4A1、MUC1、黏蛋白CanAg、N-乙醇酰神经氨酸、NPC-1C、PDGF-Rα、PDL192、磷脂酰丝氨酸、前列腺癌细胞、RANKL、RON、ROR1、SCH 900105、SDC1、SLAMF7、TAG-72、腱生蛋白C、TGFβ2、TGF-β、TRAIL-R1、TRAIL-R2、肿瘤抗原CTAA16.88、VEGF-A、VEGFR-1、VEGFR2和波形蛋白。
有用的CTC测定包括但不限于,例如,微微流控CTC测定。现已开发了各种分离和表征CTC的微流控方法,包括但不限于,例如,以下出版物中所述的方法:Yu等人(细胞生物学杂志(2011)192,373–382);Esmaeilsabzali等人(生物技术进展(2013)31,1063–1084);以及Zhang等人(癌症生物学和疗法(2016)17:11,1177-1187),这些出版物中的内容以引用方式全文并入本文。在一些情况下,CTC测定可能涉及从以下公司获取用于CTC检测和/或分离的系统、设备和/或一种或更多种试剂:Vortex Biosciences(加利福尼亚州门洛帕克),例如VTX-1系统及相关试剂;Clearbridge BioMedics(新加坡),例如
如上所述,可以基于待验证的结果,依据任何合适且适当的方法采用诸如用于验证本文所述的检测测定结果的测试程序。例如,在检测测定表明所述受试者中存在CTC的情况下,可以建议受试者接受或向受试者提供进一步的测试以验证所述CTC的存在。相应地,在一些情况下,在检测测定表明所述受试者中不存在CTC的情况下,可以建议受试者接受或向受试者提供进一步的测试以验证所述CTC的不存在。在检测测定表明存在/不存在转移性癌症的情况下,可以建议受试者接受或向受试者提供进一步的测试以验证所述转移性癌症的存在/不存在,包括例如,其中此类进一步测试包括一种或更多种转移性癌症测试,例如医学成像、活检(包括初级、二级和/或淋巴结活检)等。
如上所述,本发明包括治疗受试者的瘤形成的方法。术语“受试者”、“个人”、“宿主”和“患者,指的是需要诊断、治疗或疗法治疗的任何哺乳动物受试者,尤其是人类。
标的方法可以包括检测来自受试者的样本中一种或更多种细胞类型和/或细胞群体的存在或不存在,并基于所检测到的所述一种或更多种细胞类型和/或细胞群体的存在或不存在来治疗所述受试者。例如,在一些情况下,可以检测TIL群体的存在或不存在,包括例如,具有特定标志物表达组合中的特定标志物表达的TIL群体,并且可以基于所检测到的所述TIL群体的存在或不存在来治疗所述受试者。
在一些情况下,所采用的治疗方式可以基于是否检测到一种或更多种特定细胞类型和/或细胞群体确定。例如,在一些情况下,当检测到存在或不存在特定细胞类型和/或细胞群体时,可以用全身性治疗方案来治疗受试者。在一些情况下,当检测到存在或不存在特定细胞类型和/或细胞群体时,可以用局部治疗方案来治疗受试者。
本文中使用的“全身性治疗”是指不仅仅针对特定肿瘤(例如,原发性肿瘤或确定的继发性肿瘤)或含有特定癌症的组织(例如,如果是肝癌,则为肝脏;如果是血癌,则为血液等)的治疗。全身性治疗通常针对所述受试者的整个身体,并且可以包括但不限于,例如,全身性放射疗法、全身性化学疗法、全身性免疫疗法或其组合等。
在就癌症相关细胞类型或其群体的存在对受试者进行评估之前、期间或之后可以对所述受试者施行的全身性疗法会基于许多因素而变化,所述因素包括例如,瘤形成的类型、所述受试者的病史、总体健康状况和/或任何合并症等。在一些情况下,可以基于根据本文所述的方法检测到的癌症相关细胞类型或其群体(例如TIL群体)的缺失来施以全身性疗法。换句话说,当诸如表达标志物或其组合的TIL群体不存在时,可以进行一种或更多种全身性治疗。诸如在本发明的评估之后可以施行的有用的全身性疗法包括但不限于,例如,全身性放射疗法、化学疗法、免疫疗法、其组合等。
本文中使用的“局部治疗”是指专门针对特定肿瘤(例如,原发性肿瘤或确定的继发性肿瘤)所在位置或专门针对含有癌症的组织(例如,如果是肝癌,则为肝脏;如果是血癌,则为血液等)的治疗。在一些情况下,也可以影响肿瘤周围环境(例如所述肿瘤周围的组织,例如紧邻所述肿瘤的组织)的方式进行局部治疗。局部治疗通常不影响或不靶向远离所述癌症部位(包括肿瘤部位,例如原发性肿瘤)的组织。诸如在本发明的评估之后可以施行的有用的局部治疗包括但不限于外科手术、局部放射疗法、局部冷冻疗法、局部激光疗法、局部外用疗法、其组合等。在一些情况下,局部疗法还可以包括局部施行的靶向疗法(即,未全身性施行或不会对受试者造成全身性影响的靶向疗法)。
与癌症有关的靶向疗法可以包括靶向癌症特定基因、蛋白或有助于所述癌症生长和存活的组织环境的治疗。靶向疗法的示例包括但不限于,例如,靶向EGFR(例如阿法替尼)和ALK(例如艾乐替尼)的药物。EGFR是在所述细胞表面表达的受体酪氨酸激酶,可激活下游细胞内信号传导来促进细胞增殖。EGFR基因在NSCLC细胞中的频繁扩增、过表达和/或突变可能引起癌细胞生长的过度激活。ALK是另一种受体酪氨酸激酶,通常在NSCLC中出现异常。约3-7%的肺癌出现ALK融合。ALK融合导致ALK过度激活,从而促进癌症生长。在大多数情况下,未发现ALK重排与NSCLC中发现的其他致癌突变重叠。
免疫疗法作为本文所述方法中的一种治疗方案,可以诸如依据给药途径和/或特定治疗制剂而局部或全身性施行。根据上下文,局部给药途径可以包括,例如,直接注射、外用给药、吸入等。根据上下文,全身性给药途径可以包括,例如,静脉内给药、口服给药等。
免疫疗法是多种癌症(包括肺癌)的治疗方案。可以针对NSCLC免疫疗法采用所述PD-1和PD-L1途径。PD-1,也被称为CD279,是免疫检查点标志物,可在活化的T、B和NK细胞表面表达。PD-L1是PD-1的主要配体,并且在多种癌症类型(包括NSCLC)中予以上调。PD-1/PD-L1途径激活下调免疫应答。癌症利用此途径抑制靶向所述癌症的免疫应答。已开发了经FDA批准用于NSCLC治疗的靶向PD-1的抗体(例如,纳武单抗(Opdivo)和派姆单抗(Keytruda))以及靶向PD-L1的抗体(例如,阿特珠单抗(Tecentriq)),以成功阻断PD-1和PD-L1相互作用。
免疫疗法还包括抗PD-1/PD-L1免疫疗法,其包括但不限于,例如,包括向受试者施用有效量的一种或更多种抗PD-1/PD-L1治疗性拮抗剂的疗法,其中所述拮抗剂包括但不限于,例如,
纳武单抗
有用的抗PD-L1拮抗剂(包括例如,抗体)包括但不限于,例如,编号如下的美国专利中所述的拮抗剂:7,722,868;7,794,710;7,892,540;7,943,743;8,168,179;8,217,149;8,354,509;8,383,796;8,460,927;8,552,154;8,741,295;8,747,833;8,779,108;8,952,136;8,981,063;9,045,545;9,102,725;9,109,034;9,175,082;9,212,224;9,273,135和9,402,888;这些出版物中的内容以引用方式全文并入本文。
有用的抗PD-1拮抗剂(包括例如,抗体)包括但不限于,例如,以下出版物中所述的拮抗剂:6,808,710;7,029,674;7,101,550;7,488,802;7,521,051;8,008,449;8,088,905;8,168,757;8,460,886;8,709,416;8,951,518;8,952,136;8,993,731;9,067,998;9,084,776;9,102,725;9,102,727;9,102,728;9,109,034;9,181,342;9,205,148;9,217,034;9,220,776;9,308,253;9,358,289;9,387,247和9,402,899;这些出版物中的内容以引用方式全文并入本文。
标的治疗方法可以采用其他免疫检查点标志物(例如CTLA-4、LAG-3和TIM-3)。CTLA-4,也被称为CD152,与CD80和CD86结合。靶向CTLA-4的抗体已获批用于治疗某些类型的癌症。CTLA-4和PD-1的共同抑制作用使CTLA-4成为与抗PD-1组合治疗某些癌症的良好候选药物。LAG-3仍处于临床试验阶段,可用于治疗癌症,包括NSCLC。TIM-3也可用于适用于多种癌症类型(包括例如,NSCLC)的免疫疗法中。
拮抗剂LAG-3抗体既可以活化效应性T细胞(下调预先活化的LAG-3+细胞的LAG-3抑制信号),也可以抑制诱导的(即,抗原特异性)Treg抑制活性。有用的LAG-3拮抗抗体包括瑞拉特利单抗(BMS-986016;由Bristol-Myers Squibb开发)、IMP701(由Immutep开发)、TSR-033(抗LAG-3mAb;由TESARO,Inc.开发)等。
免疫疗法还包括基于T细胞的免疫疗法,例如,过继细胞疗法(ACT)和嵌合抗原受体(CAR)T细胞疗法。例如,可以向受试者施用经工程改造以靶向由所述受试者的癌症表达的抗原的CAR T细胞群体。在一些情况下,基于T细胞的疗法可能涉及从受试者中获取细胞样本(例如,血液样本或肿瘤活检切片),以及离体培养来自所述样本中的免疫细胞(已对或未对所述经培养的免疫细胞进行基因修饰)。例如,对于肺癌,可以从受试者中获取免疫细胞,进行离体培养,并用对由所述肺癌表达的抗原(例如,间皮素)具有特异性的CAR修饰,以产生CAR T细胞群体。然后,可以将所述CAR T细胞重新引入受试者中以靶向所述肺癌。基于T细胞的免疫疗法可以各种方式配置,例如,通过靶向各种抗原配置,通过采集/培养各种细胞类型等配置,具体取决于待治疗的特定癌症。另外,基于T细胞的免疫疗法可以全身性施行(例如,通过静脉内注射施行)或局部施行(例如,通过输注(例如,腹膜内输注、胸膜导管输注等)、直接注射等施行)。
有用的疗法还可包括靶向CCR5表达细胞的疗法,包括例如,在检测到CCR5表达细胞群体的情况下,可采用CCR5靶向疗法。CCR5靶向疗法以及检测CCR5表达癌细胞的方法请见第1 20180303830、20170231991、20140109245和20130303512号美国专利申请公开出版物;这些出版物中的内容以引用方式全文并入本文。
在一些情况下,靶向CCR5的有用药物可以包括CCR5拮抗剂,例如但不限于,小分子(包括肽和非肽小分子)抑制剂、抗体等。CCR5拮抗剂的非限制性示例包括:马拉韦罗(又名Selzentry或Celsentri)、INCB-9471((4,6-二甲基嘧啶-5-基)-[4-[(3S)-4-[(1R,2R)-2-乙氧基-5-(三氟甲基)-2,3-二氢-1H-茚-1-基]-3-甲基哌嗪-1-基]-4-甲基哌啶-1-基]甲酮;口服CCR5拮抗剂;PubChem CID:49871007)、Leronlimab(PRO-140,针对CCR5的人源化单克隆抗体)、阿拉韦罗(4-(4-{[(3R)-1-丁基-3-[(R)-环己基(羟基)甲基]-2,5-二氧-1,4,9-三氮杂螺[5.5]十一烷-9-基]甲基}苯氧基)苯甲酸;有效的CCR5受体非竞争性变构拮抗剂)、维克韦罗(5-{4-[(3S)-4-[(1R)-2-甲氧基-1-[4-(三氟甲基)-苯基]乙基]-3-甲基哌嗪-1-基]-4-甲基哌啶-1-羰基}-4,6-二甲基嘧啶;CCR5进入抑制剂(原名SCH 417690和SCH-D)、靶向CCR5的全人源单克隆抗体(例如,以下出版物中所述的HGS004:Lalezari等人,传染病杂志.(2008)197(5):721-7),等等。
组合物可以每天施用一次、每天施用几次或数次,甚至每天施用多次,具体(除其他外)取决于所治疗的适应证和处方医师的判断。例如,在一些情况下,包括一种或更多种免疫治疗剂的组合物可以每天施用一次、每天施用几次或数次,甚至每天施用多次,具体(除其他外)取决于所治疗的适应证和处方医师的判断。
在一些情况下,可以在开始治疗过程之前对受试者进行评估。例如,在一些情况下,在施予疗法之前,医学专业人员可以根据本文所述的方法,对受试者进行测定,以确定所述受试者是否含有癌症相关细胞类型或其群体,例如TIL群体,并且如适当,只有在识别出或未识别出所述癌症相关细胞类型或其群体的情况下,所述医学专业人员才可以施以特定疗法(例如,全身性或局部疗法)。
疗程开始之前可以对受试者进行评估的时间量可以发生变化,并且其范围可以是1天或更短时间至一个月或更长时间,包括但不限于,例如,1天、2天、3天、4天、5天、6天、1周、2周、3周、1个月等。在一些情况下,可以在进行评估的同一天开始疗程治疗。
在一些情况下,可以在疗程已开始或已施予疗程之后评估受试者中癌症相关细胞类型或其群体(例如,TIL群体)的存在情况。例如,在一些情况下,可以疗程中测定受试者的瘤形成,例如,作为监测方案的一部分,并且可以根据评估结果改变疗程。例如,可以对经历针对瘤形成的局部治疗疗程的受试者进行评估,并且如果所述评估检测到癌症相关细胞类型或其群体存在,则可以改变或修改疗程,例如,通过停止所述局部治疗疗程、通过开始全身性治疗疗程(局部治疗除外)、通过开始全身性治疗疗程来替代局部治疗疗程等。
在另一实施例中,可以对经历针对瘤形成的全身性治疗疗程的受试者进行评估,并且如果所述评估检测到癌症相关细胞类型或其群体不存在,则可以改变或修改疗程,例如,通过停止所述全身性治疗疗程、通过开始局部治疗疗程(全身性治疗除外)、通过开始局部治疗疗程来替代全身性治疗疗程等。
在一些情况下,可以在疗程之后对受试者的瘤形成进行测定,例如,作为确定是否需要进一步治疗和/或需要哪种类型的进一步治疗的手段。因此,在一些情况下,根据所述评估结果可以进行也可以不进行进一步治疗。在一些情况下,在施予疗法之后进行的测定可以是监测疾病状态的进展或变化的手段。
疗程结束之后可以对受试者进行评估的时间量可以发生变化,并且其范围可以是1天或更短时间至一个月或更长时间,包括但不限于,例如,1天、2天、3天、4天、5天、6天、1周、2周、3周、1个月等。在一些情况下,可以在疗程结束当天进行评估。在一些情况下,可以在对受试者进行长期随访评估期间进行评估。在疗程之后进行长期随访的持续时间会发生变化,并且其范围可以是3个月或更短时间至10年或更长时间,包括但不限于,例如,3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、1年、1.5年、2年、3年、4年、5年、6年、7年、8年、9年、10年等。
本文所述的治疗方法可以靶向各种细胞群体,包括例如,根据本发明的方法识别的一种或更多种细胞群体。基本上,可通过适当的疗法靶向本文所述的任何细胞类型和/或细胞群体。例如,在一些情况下,可以诸如采用抗PD-1/PD-L1免疫疗法来靶向PD-1或PD-L1表达细胞类型或细胞群体。
在一些情况下,可以诸如采用抗LAG-3疗法(例如但不限于抗LAG-3抗体,例如如上所述的瑞拉特利单抗、TSR-033或IMP701)靶向LAG-3表达细胞类型或细胞群体。在一些实施例中,靶向LAG-3表达细胞群体可以是LAG-3表达Treg群体,例如但不限于,例如,CD4
在一些情况下,可以诸如采用CCR5靶向疗法(包括但不限于,例如,上述各种CCR5靶向疗法中的一种或更多种)靶向CCR5表达细胞类型或细胞群体。在一些实施例中,靶向CCR5表达细胞群体可以是CCR5表达FOXP3-表达群体(包括例如,CCR5表达FOXP3-表达Treg群体),例如但不限于,例如,CD4
基于全身性和/或局部治疗的选择,还可以根据所治疗的病症和所施用的药物组合物来选择给药方法。可以各种方式向所述受试者施用有效量(一剂或多剂)的标的药剂,所述给药方式包括但不限于皮下给药、静脉内给药、腹膜内给药、肌内给药、直接注射至特定器官或肿瘤、全身给药等。药物组合物可以通过单一途径或同时通过多种途径施用。
“有效量”是指足以产生治疗效果的量。治疗瘤形成的有效量通常可调节所述瘤形成的症状和/或大小和/或生长速率,调节幅度至少约为1%,包括但不限于例如,至少约为10%;至少约为20%;至少约为30%;至少约为50%。这可使,例如,受影响的细胞数量具有统计显著性且发生可量化的变化。这可能是所述原发性肿瘤的大小缩少、所述原发性肿瘤的生长速率降低、一种或更多种转移瘤的生长速率降低、远隔脏器转移瘤数量减少、复发转移性疾病减少等。
在一些情况下,治疗受试者的瘤形成的方法可以包括对所述受试者进行测试,例如,以检测和/或确认转移的存在或不存在和/或CTC的存在或不存在。例如,在一些情况下,可以基于癌症相关细胞检测测定的结果对受试者进行测试,以确认转移的存在或不存在和/或CTC的存在或不存在。可以采用对受试者进行测试的任何合适的方法,包括但不限于,例如,如上所述的测试步骤中的任何方法,其可以在筛查程序之后进行。在一些情况下,除本文所述的癌症相关细胞检测测定之外,治疗受试者的方法还可以不包括进一步测试。例如,可以基于如本文所述的癌症相关细胞检测测定的结果来治疗受试者,而无需进一步确认性测试。
试剂盒
本发明还提供了用于实施一种或更多种上述方法的试剂盒。标的试剂盒可能存在较大差异。标的试剂盒中包括的试剂和设备可以包括上述有关癌症相关细胞类型和/或其群体(例如TIL群体)检测方法、受试者筛查方法、受试者治疗方法等的试剂和设备。
在一些实施例中,本发明的试剂盒可以包括与免疫检查点标志物特异性结合的可检测结合成员,或者此类试剂盒可以包括各自与免疫检查点标志物特异性结合的多种可检测结合成员。例如,在一些情况下,本发明的试剂盒可以包括免疫检查点组,所述免疫检查点组包括多种可检测免疫检查点标志物结合成员。
在一些实施例中,本发明的试剂盒可以包括与免疫细胞类型标志物特异性结合的可检测结合成员,或者此类试剂盒可以包括各自与免疫细胞类型标志物特异性结合的多种可检测结合成员。例如,在一些情况下,本发明的试剂盒可以包括免疫细胞类型组,所述免疫细胞类型组包括多种可检测免疫细胞类型标志物结合成员。
基本上,可以采用用于检测任何标志物组合的可检测结合成员的任何组合,包括例如,本文所述的组合。例如,在一些情况下,本发明的试剂盒可以包括与PD-1、TIM-3、LAG-3或CTLA-4特异性结合的可检测结合成员。在一些情况下,本发明的试剂盒可以包括多种可检测结合成员,其中所述多种可检测结合成员中的每种与PD-1、TIM-3、LAG-3或CTLA-4中的其中一种结合。在一些情况下,即,在采用适用于免疫检查点标志物的多种结合成员的情况下,可以假设本发明的标的试剂盒包括免疫检查点标志物组。因此,所述多种结合成员可以被配置成与所述组中的所述标志物结合,从而帮助检测表达所述组中一种或更多种标志物的细胞。
在一些情况下,本发明的试剂盒可以包括与CD3、CD4、CD8、CD16、CD19、CD25、CD56、CD127和/或CCR5特异性结合的可检测结合成员。在一些情况下,本发明的试剂盒可以包括多种可检测结合成员,其中所述多种可检测结合成员中的每种与CD3、CD4、CD8、CD16、CD19、CD25、CD56、CD127和/或CCR5中的其中一种结合。在一些情况下,即,在采用适用于免疫细胞类型标志物的多种结合成员的情况下,可以假设本发明的标的试剂盒包括免疫细胞类型标志物组。因此,所述多种结合成员可以被配置成与所述组中的所述标志物结合,从而帮助检测表达所述组中一种或更多种标志物的细胞。
标志物组中的所述单种特异性结合成员可以预先混合的配置提供,例如,在单个容器(例如管)中预先混合,或者在待由使用者根据需要混合的单个容器中预先混合。在一些情况下,不同标志物组中的多种组分可以预先混合的配置在标的试剂盒中提供,包括例如,其中一种或更多种免疫检查点标志物特异性结合成员或其组或所述组的一部分可以与一种或更多种免疫细胞类型标志物特异性结合成员或其组或所述组的一部分预先混合的方式提供。
在一些情况下,本发明的免疫细胞类型标志物组可以包括免疫活化标志物。因此,标的试剂盒可以包括对免疫活化标志物具有特异性的可检测结合成员,包括但不限于例如,对人HLA-DR具有特异性的可检测结合成员。
在一些情况下,标的试剂盒可以包括一种或更多种对黏附相关标志物具有特异性的可检测结合成员。可以包括在标的试剂盒中的对黏附相关标志物具有特异性的有用可检测结合成员包括但不限于例如,对E钙黏蛋白、CD44或CD103具有特异性的可检测结合成员。在一些情况下,试剂盒可以包括各自对不同的黏附相关标志物具有特异性的多种不同的可检测结合成员,包括例如,两种或更多种不同的可检测结合成员等。
本发明的试剂盒可以包括用于制备处理和/或测定用样本的一种或更多种试剂和/或设备,包括例如,用于以本文所述的方法进行处理和/或测定的样本。可以包括在标的试剂盒中的有用试剂和/或设备包括但不限于例如,固定试剂、包括至少一种固定试剂的固定溶液、匀浆处理设备、用于生成细胞悬液的设备、用于孵育细胞悬液的设备、DNA标记试剂、用于获取样本的装置(例如,血液采集设备、活检设备、抽吸针等)等。
例如,在一些实施例中,试剂盒可以进一步包括一种或更多种样本制备试剂,包括但不限于,例如,细胞固定剂、细胞透化试剂、细胞标记试剂、缓冲液、稀释剂等。上述组分可以装在单独容器中,也可以一种或多种组分合并装在单个容器中,例如,玻璃或塑料瓶。在一些情况下,本发明的试剂盒可以进一步包括样本制备设备,例如匀浆器。
试剂盒可以进一步包括样本获取设备,例如血液采集设备或活检切片采集设备。活检采集设备的非限制性示例包括但不限于,例如,针穿活检设备、取芯活检设备、钻孔活检设备、外科活检设备、真空辅助活检设备等。在一些情况下,试剂盒可以进一步包括一种或更多种用于细胞解离的试剂和/或设备,包括但不限于,例如,酶、酶抑制剂、清洁剂、细胞解离介质或缓冲液、涡旋设备、章动设备、摇动设备等。标的试剂盒可以进一步包括对照试剂和样本,包括但不限于,例如,对照细胞样本(例如,阳性对照细胞样本、阴性对照细胞样本等)、校准试剂(例如荧光珠、预标记细胞等)。
除上述组成部分外,标的试剂盒可能进一步包括用于实施标的方法的说明书。这些说明书可能以各种形式存在于标的试剂盒中,其中一种或多种可能存在于所述试剂盒中。这些说明书可能存在的一种形式是印在适合的介质或基底(例如,其上印有信息的一张纸或多张纸)、试剂盒包装、包装说明书等之上的印刷信息。其存在的另一种形式是其上已记录有信息的计算机可读介质,例如,软盘、CD等。这些说明书还可能存在的一种形式是网址,可以借此通过互联网访问远程网站上的信息。所述试剂盒中可能存在任何合适的装置。
以下示例仅用于举例说明而非限制。
示例
提出以下示例是为了向本领域普通技术人员完整地公开并叙述构建及使用本发明的方法,并且无意限制发明人所认为其发明的范围,也无意表示以下实验是全部或唯一进行的实验。已经努力确保所使用数字(例如数量、温度等)的准确性,但是应该考虑到一些实验误差和偏差。除非另有说明,否则份数为重量份数,分子量为重均分子量,温度为摄氏度,压力指大气压或接近大气压。
分子学和细胞生物化学的一般检查方法可参阅以下标准教材:分子克隆:实验室手册,第3版(Sambrook等人,HaRBor Laboratory Press 2001);精编分子生物学实验指南,第4版(编辑:Ausubel等人,John Wiley&Sons 1999);蛋白质方法(Bollag等人,JohnWiley&Sons 1996);用于基因治疗的非病毒载体(编辑:Wagner等人,Academic Press1999);病毒载体(编辑:Kaplift和Loewy,Academic Press 1995);免疫学方法手册(编辑:I.Lefkovits,Academic Press 1997);细胞与组织培养:生物技术实验室程序(Doyle和Griffiths,John Wiley&Sons 1998),出版物中的内容以引用方式并入本文。本发明中提及的用于基因操纵的试剂、克隆载体和试剂盒可从商业供货商处获得,例如,BioRad、Stratagene(Agilent Technologies)、Invitrogen(Thermo Fisher Scientific)、Sigma-Aldrich和Clontech(Takara Bio USA,Inc.)。
样本
新鲜组织由Folio Biosciences(俄亥俄州鲍威尔)在获得相应知情同意书后,从10例NSCLC病例中获取,并附上配对的外周血样本。记录采集日期、年龄、性别、种族、诊断、原发性肿瘤大小和美国癌症联合委员会(AJCC)分类。切下组织,然后将其保存在2-8℃的Roswell Park Memorial Institute(RPMI)1640培养基中,然后用冰袋将其隔夜运送至IncellDx Inc.。将来自同一患者的血液样本运送至Celsee Inc.(密歇根州普利茅斯)并在此进行处理。
使用IncellPREP进行组织解离
将至少2cm的肿瘤活检切片放入RPMI以便运输,然后在各组织上打上4mm的孔,并放入2mL Eppendorf管中,管中装有800μL Dulbecco磷酸盐缓冲盐水(DPBS)。将IncellPREP(IncellDx,Inc.)组织匀浆器插入各管中,并设置为在1V下运行,直到上清液变浑浊(5-10分钟)
单细胞悬液的免疫检查点和癌症标志物组染色
在IncellMAX(也被称为IncellFP;IncellDx,Inc.)中固定1小时后,将500μL样本(相当于500,000个细胞)等分至12×75mm管中,然后用1mL DPBS洗涤。接着,用溶于DPBS+2%牛血清白蛋白(BSA)中的免疫组(见表1和图6)对样本进行染色,然后将其置于室温下避光孵育30分钟。接下来,向每根管中加入1mL DPBS+2%BSA,并在室温下孵育5分钟,然后在600×g下离心5分钟。吸出上清液,并再用DPBS+2%BSA洗涤一次。洗涤后,向各样本中加入300μL DPBS。(CST:Cell Signaling Inc.,马萨诸塞州丹佛斯)
对于癌症标志物组,按照上列相同步骤,针对每根管对200,000个细胞进行染色,另外的步骤是向各样本中加入200μL 4',6-二脒基-2-苯基吲哚(DAPI)(在DPBS中,浓度为1μg/mL),然后置于室温下避光孵育30分钟。癌症标志物组请见表2和图7。除CD36(BioLegendInc.)外,使用的所有抗体均来自Cell Signaling Inc.。细胞周期染料由IncellDx提供。
流式细胞术
在配有3个激光器的Cytek Aurora
实体瘤组织处理和分析的工作流程请见图1A。
DNA指数计算
用癌细胞DAPI MFI(中位荧光强度)除以二倍体细胞(本研究中的淋巴细胞)MFI来计算DNA指数。
CTC分离与枚举
将患者外周血样本放入Streck cfDNA BCT中,并置于环境温度下保存。使用Celsee预固定缓冲液对4mL血液样本进行预固定。然后,使用Celsee全面单细胞制备芯片、Genesis自动化平台和枚举协议对每个样本进行处理。完成后,在Celsee分析仪上扫描芯片,并生成最终报告。对于各个细胞,对CD45、PD-L1和DNA含量(DAPI)标志物检测进行评估。
CTC分离和分析的工作流程请见图1B。
统计分析
对针对CTC采集的所有样本数据进行比较。使用Spearman分析确定统计显著性。
癌症标志物表达
使用光散射和DAPI染色对单个有核细胞进行设门(见图2)。DAPI染色还用于从具有正常DNA含量的细胞(二倍体细胞)中分离出具有高DNA含量的细胞(非整倍体细胞)。“非整倍体”门包括具有较高DNA含量的细胞,这归因于导致染色体增加的染色体水平突变或归因于细胞增殖增加。DAPI染色还为DNA指数计算提供了MFI值。CD45充当免疫细胞标志物。癌细胞是CD45-和Pan CK+上皮细胞。间充质或基质细胞是CD45-和波形蛋白+。裂解的半胱天冬酶3是死亡受体和线粒体细胞死亡的常见凋亡途径,由此可知,经历活性凋亡的细胞对裂解的半胱天冬酶3呈阳性。组蛋白pH2A.x(ser 139)被视为是DNA损伤标志物。DNA受损的细胞对pH2A.x染色呈阳性。总EGFR的过表达是肺癌表型,其中超过80%的NSCLC表现出EGFR过表达。ALK融合蛋白是特异性疗法的靶标。E钙黏蛋白是α整合素,以细胞间黏着见长,其在一些情况下,会在CTC中丢失。CD44在具有二倍体DNA含量的癌症干细胞(CSC)上高度表达。CD36是脂肪分子,其被视为与转移所必需的能量转移有关。
10个NSCLC癌症样本的结果汇总请见表3和图8。
在所有研究的癌症样本中均观察到EGFR过表达。在二倍体和非整倍性细胞中均观察到过表达,这表明EGFR的基因变异或其他信号传导途径可能促使EGFR过表达。在一癌症样本中观察到ALK突变,这与其他观察结果一致,即3-7%的NSCSC样本出现ALK突变。ALK突变的细胞也出现EGFR过表达,并且具有较高的DNA含量(非整倍体细胞)。该观察结果表明其他基因变异的存在与先前被忽略的ALK融合同时发生。
淋巴细胞确实表现出DNA损伤,这表明淋巴细胞并非是癌症形成过程的直接组成部分。与之形成鲜明对比的是,如裂解的半胱天冬酶3染色结果所示,很大一部分淋巴细胞发生凋亡。这与癌症所利用的免疫抑制机制是一致的,该机制会导致淋巴细胞死亡。pH2A.x染色阳性表明,与淋巴细胞相比,癌组织表现出更高水平的DNA损伤。在大多数情况下,与淋巴细胞相比,发生凋亡的癌细胞更少。
大多数癌细胞是上皮细胞(pan CK+)。较小部分的组织细胞是间充质/基质细胞(波形蛋白+)。在这些癌症样本中,一些细胞呈pan CK和波形蛋白双阳性,表明可能与上皮—间充质细胞转化有关
在相同的样本中,具有二倍体DNA含量的CD44+E-cad-细胞分布处于不同水平。在这种情况下,CD44可以充当癌症干细胞标志物。E钙黏蛋白在上皮细胞黏附中起重要作用,并且E钙黏蛋白功能的丧失被视为是上皮间充质转化(EMT)
所有样本均显示出各种低百分比的CD36+癌细胞。这些脂肪细胞可能为肿瘤转移提供能量。
肿瘤微环境中的免疫检查点标志物表达
免疫系统在癌症发展中起着双重作用。它不仅可以通过破坏癌细胞或抑制癌细胞的生长来抑制癌症,还可以通过选择可以逃避免疫监测的癌细胞来促进癌细胞生长
在本研究中,使用3激光器Cytek Aurora进行光谱高参数流式细胞术,以便同时询问共计14种标志物。在一管中,癌症单细胞悬液样本用有助于设门以分离癌症免疫细胞亚群的标志物、免疫检查点标志物、HLA-DR(免疫活化标志物)和CD103(指示免疫细胞与癌细胞接合的标志物)进行染色。
从10个样本中的每个样本中获取了4万至35万个单核细胞。通过设门标志物将细胞分为免疫细胞亚群。询问免疫检查点标志物、HLA-DR和CD103标志物表达(图3)。
在癌症微环境中检测到的B细胞很少。在10个NSCLC样本中观察到各种百分比的CD4+、CD8+T细胞和低百分比的NK细胞。PD-1、CTLA-4、LAG-3、TIM-3、HLA-DR和CD103在这些细胞亚群上表现出差异表达。数据汇总请见表4和图9。
CTC分离与分析
在分析癌症组织样本的同时,将外周血样本运送至Celsee Inc.以进行CTC分析。如材料和方法中所述,分离CTC。所分离的CTC用CD45、PD-L1和DAPI染色以便表征。每个癌症患者的CTC数目汇总请见表5和图10。
TIM-3和PD-1表达CD4+T细胞与CTC密切相关
为了更好地理解癌症和免疫标志物表达与潜在癌症转移之间的关系,对所采集的流数据进行统计分析。由于有10个NSCLC样本,因此运用Spearman相关性分析进行数据分析,衡量两个变量(而非绝对值)等级之间的等级相关性。将表达每种癌症标志物和免疫标志物的细胞百分比与CTC数量进行比较。还将多种双重标志物表达细胞群体与CTC进行了比较。
Spearman分析表明,例如,CTC与TIM-3和PD-1表达淋巴细胞,尤其是CD4+淋巴细胞之间存在很强的相关性(图4A,并且补充表显示Spearman R绝对值大于0.5,详见图11)。
在CTC与CD103和HLA-DR双阳性淋巴细胞之间也观察到相关性。CD44+Ecad-癌症干细胞与CTC反向相关(图4B,并且补充表显示Spearman R绝对值大于0.5,详见图11)。PD-L1表达癌细胞和癌细胞DNA含量也显示出与CTC的相关性。
无监督Spearman聚类分析将CTC较低或无CTC的患者(3号、6号和5号患者)进行聚类,并将这些患者与CTC数目较高的患者分开(图5)。
转移占所有癌症死亡病因的90%。引起转移的完整机制尚不清楚
在本研究中,NSCLC实体癌组织被解离成单细胞,并且这些细胞用癌症和免疫标志物染色。用高参数流式细胞术分析已解离且已染色的细胞。该工作流程允许同时研究多种免疫标志物和癌症标志物。同时,还采集了来自同一患者的外周血样本,以分离、枚举和分析CTC,作为癌症转移的指标。
与研究癌症标志物或免疫标志物在癌症转移中的作用的早期工作相反,本研究旨在研究癌症和癌症微环境中的免疫应答。统计数据分析显示,癌症标志物和免疫标志物表达与CTC发生率之间存在相关性。
我们的结果表明,免疫检查点标志物(例如,TIM-3和PD-1)对CTC有很大影响。有趣的是,与正常识别的CD8+细胞毒性T细胞
此外,CD103和HLA-DR的表达与CTC高度相关。这表明,尽管免疫检查点分子具有较强的免疫阻断活性,但免疫系统仍在积极参与抗击癌症。该观察结果表明,癌症活化可能是由于免疫阻断与免疫活化之间平衡遭到破坏所引起。
癌细胞上的DNA不稳定性(如DNA指数所示)和PD-L1表达与癌症转移呈显著相关性。与之形成鲜明对比的是,癌症干细胞(CD44+E-cad-)与CTC发生率显著反向相关,这表明在相同质量中存在大量的休眠癌症干细胞。
此外,无监督Spearman聚类分析将CTC高的患者与CTC低的患者分开。这表明,利用多参数流数据生成的算法可以为患者管理提供可预测、可操作的信息。
多参数流式细胞术与单细胞解离配对,可在单细胞水平上同时分析实体瘤样本上的多种免疫和癌症标志物。从这些研究中获得的知识将增进我们对癌症免疫系统、癌细胞以及免疫系统与癌症之间的相互作用的了解。此类信息可以改变患者的诊断、疾病监测和新药研发。这项研究表明,研究实体瘤的有效方法将为富有成效的疗法(例如精确癌症免疫疗法)提供重要信息。
基本上如上所述,将肺肿瘤组织的冷冻样本解冻、解离并用标志物组染色,以进行多参数流式细胞术分析。所采用的标志物组包括适用于CD4、CD25、CD103、CD127和CCR5(CD195)的可检测结合成员。可用于多参数分析以询问肿瘤相关免疫细胞中CCR5表达的标志物组的示例请见图13。
使用上述多参数流式细胞术技术对已染色的细胞悬液进行流式细胞术分析。就Treg对事件设门,详情请见图12。具体而言,基于CD4染色以及针对淋巴细胞的前向散射和侧向散射门,区分CD4阳性T细胞。基于高CD25染色和低CD127染色,在CD4
1.Chargin A等人。使用非酶组织解离和流式细胞术量化非小细胞肺癌(NSCLC)中肿瘤和免疫细胞上的PD-L1和PD-1表达。癌症免疫学与免疫疗法。65(11):1317-1323.2016
2.Gonzalez等人。通过单细胞大量细胞计数法识别出高级别浆液性卵巢肿瘤中常见的细胞亚群。细胞报告22,1875-1888.2018
3.Nieto MA等人。EMT:2016.细胞.166:21.2016
4.Heerboth S等人。EMT和肿瘤转移。临床和转化医学。4:6,2015
5.Schreiber DS等人。癌症免疫编辑:整合免疫在癌症抑制和促进中的作用。科学.331:1565.2011
6.Mittal D等人。对癌症免疫编辑及其三个阶段——消除、平衡和逃逸的新见解。免疫学新见。27:16.2014
7.Seyfriend TN等人。关于癌症转移的起源。肿瘤形成评论综述。18(1-2):43-73.2013
8.Yi JS等人。T细胞耗竭:特征、原因和转化。免疫学。129:474-481。2010
虽然本文附有权利要求书,但本发明的范围还受以下条款限定:
1.一种方法,其包含:
使利用从受试者的肿瘤中收集的活检切片制备的细胞悬液与以下各项接触:
包含多种可检测免疫检查点标志物结合成员的免疫检查点组;以及
包含多种可检测免疫细胞类型标志物结合成员的免疫细胞类型组,
制备已标记细胞悬液;以及
用细胞计数法对所述已标记细胞悬液进行测定,检测所述细胞悬液中是否存在表达所述免疫检查点组中的免疫检查点标志物和所述免疫细胞类型组中的免疫细胞类型标志物的肿瘤浸润性淋巴细胞(TIL)群体。
2.根据条款1所述的方法,其中所述多种可检测免疫细胞类型标志物结合成员包含适用于选自由以下各项组成的群组的两种或更多种免疫检查点标志物的特异性结合成员:程序性细胞死亡蛋白1(PD-1)、T细胞免疫球蛋白黏蛋白受体3(TIM-3)、淋巴细胞活化基因3(LAG-3)和细胞毒性T淋巴细胞相关蛋白4(CTLA-4)。
3.根据条款1或2所述的方法,其中所述多种可检测免疫细胞类型标志物结合成员包含适用于选自由CD3、CD4、CD8、CD16、CD19、CD25、CD56、CD127和CCR5组成的群组的两种或更多种免疫细胞类型标志物的特异性结合成员。
4.根据前述条款中任一项所述的方法,其中由所述TIL群体表达的所述免疫检查点标志物是PD-1。
5.根据条款4所述的方法,其中所述TIL群体表达选自由以下各项组成的群组的标志物的组合:
PD-1和CTLA-4;
PD-1、CTLA-4和CD4;
PD-1、CTLA-4和CD8;
PD-1和CD4;
PD-1和TIM-3;
PD-1、TIM-3和CD4;以及
PD-1、LAG-3和CD4。
6.根据条款1至3中任一项所述的方法,其中由所述TIL群体表达的所述免疫检查点标志物是TIM-3。
7.根据条款6所述的方法,其中所述TIL群体表达选自由以下各项组成的群组的标志物的组合:
TIM-3和CD4;
TIM-3、CD4和LAG3;
TIM-3和CTLA-4;
TIM-3、CTLA-4和CD4;
TIM-3、CTLA-4和CD8;以及
TIM-3和NK细胞标志物。
8.根据条款1至3中任一项所述的方法,其中所述TIL群体表达LAG-3和CD4的组合。
9.根据条款8所述的方法,其中所述TIL群体表达LAG-3、CD4和CTLA-4的组合。
10.根据前述条款中任一项所述的方法,其中所述方法包含用细胞计数法对所述细胞悬液进行测定,确定所述细胞悬液中是否存在两种或更多种不同的TIL群体。
11.根据前述条款中任一项所述的方法,其中所述免疫细胞类型组进一步包含适用于免疫活化标志物和/或黏附相关标志物的可检测结合成员。
12.根据条款11所述的方法,其中所述免疫活化标志物是人白细胞抗原—抗原D相关(HLA-DR)。
13.根据前述条款中任一项所述的方法,其中所述细胞悬液进一步与对黏附相关标志物具有特异性的可检测结合成员接触。
14.根据条款13所述的方法,其中所述黏附相关标志物选自由以下各项组成的群组:E钙黏蛋白、CD44和CD103。
15.根据条款13或14所述的方法,其中所述细胞悬液与各自对黏附相关标志物具有特异性的多种可检测结合成员接触。
16.根据前述条款中任一项所述的方法,其中所述方法包含对呈E钙黏蛋白阴性并表达CD44的附加TIL群体的存在或不存在进行细胞计量术测定。
17.根据前述条款中任一项所述的方法,其中所述方法包含对所述细胞悬液进行细胞计量术测定,以进一步确定所述细胞悬液中是否存在表达CD103和HLA-DR的TIL群体。
18.根据条款17所述的方法,其中所述附加TIL群体表达CD103、HLA-DR和NK细胞标志物。
19.根据前述条款中任一项所述的方法,其中所述方法进一步包含解离所述活检切片或由此制成的样本,以制备所述细胞悬液。
20.根据条款19所述的方法,其中所述解离包含非酶组织匀浆处理。
21.根据前述条款中任一项所述的方法,其中所述细胞悬液进一步与固定试剂接触。
22.根据前述条款中任一项所述的方法,其中所述活检切片是固体组织活检切片。
23.根据前述条款中任一项所述的方法,其中所述肿瘤是肺癌肿瘤。
24.根据条款23所述的方法,其中所述肺癌肿瘤是非小细胞肺癌(NSCLC)肿瘤。
25.根据前述条款中任一项所述的方法,其中所述细胞悬液进一步与DNA染色试剂接触。
26.根据条款25所述的方法,其中所述细胞计量术测定进一步包含基于所述DNA染色试剂量化每个细胞DNA含量。
27.根据前述条款中任一项所述的方法,其中所述方法进一步包含使所述细胞悬液与至少一种对间充质细胞标志物或上皮细胞标志物具有特异性的可检测结合成员接触。
28.根据条款27所述的方法,其中所述至少一种对间充质细胞标志物或上皮细胞标志物具有特异性的可检测结合成员包含:对Pan CK具有特异性的可检测结合成员;对波形蛋白具有特异性的可检测结合成员;或两者皆有。
29.一种试剂盒,其包含:
包含多种可检测免疫检查点标志物结合成员的免疫检查点组;以及
包含多种可检测免疫细胞类型标志物结合成员的免疫细胞类型组。
30.根据条款29所述的试剂盒,其中所述多种可检测免疫细胞类型标志物结合成员包含适用于选自由以下各项组成的群组的两种或更多种免疫检查点标志物的特异性结合成员:PD-1、TIM-3、LAG-3和CTLA-4。
31.根据条款29或30所述的试剂盒,其中所述多种可检测免疫细胞类型标志物结合成员包含适用于选自由CD3、CD4、CD8、CD16、CD19、CD25、CD56、CD127和CCR5组成的群组的两种或更多种免疫检查点标志物的特异性结合成员。
32.根据条款29至31中任一项所述的试剂盒,其中所述免疫细胞类型组进一步包含适用于免疫活化标志物和/或黏附相关标志物的可检测结合成员。
33.根据条款32所述的试剂盒,其中所述免疫活化标志物是人HLA-DR。
34.根据条款29至33中任一项所述的试剂盒,进一步包含对黏附相关标志物具有特异性的可检测结合成员。
35.根据条款34所述的试剂盒,其中所述黏附相关标志物选自由以下各项组成的群组:E钙黏蛋白、CD44和CD103。
36.根据条款34或35所述的试剂盒,其中所述试剂盒包含各自对黏附相关标志物具有特异性的多种可检测结合成员。
37.根据条款29至36中任一项所述的试剂盒,进一步包含细胞悬液固定溶液,所述溶液包含固定试剂。
38.根据条款29至37中任一项所述的试剂盒,进一步包含匀浆处理设备。
39.根据条款29至38中任一项所述的试剂盒,进一步包含DNA标记试剂。
40.根据条款29至39中任一项所述的试剂盒,进一步包含活检采集设备。
41.一种对受试者进行转移性癌症筛查的方法,所述方法包含:
根据条款1至28中任一项所述的方法,检测所述TIL群体的存在;以及
基于所检测到的所述TIL群体的存在,测试所述受试者是否患有转移性癌症。
42.根据条款41所述的方法,其中所述测试包含从所述受试者中采集样本。
43.根据条款42所述的方法,其中所述样本是包含血液或淋巴液的液体样本。
44.根据条款43所述的方法,其中所述液体样本经受循环肿瘤细胞(CTC)测定。
45.根据条款44所述的方法,其中所述CTC测定是微流控CTC测定。
46.根据条款41至45中任一项所述的方法,其中所述测试包含淋巴结活检。
47.根据条款41至46中任一项所述的方法,其中所述测试包含医学成像。
48.一种治疗受试者的瘤形成的方法,所述方法包含:
根据条款1至28中任一项所述的方法,检测所述TIL群体的存在或不存在;以及
治疗所述受试者的瘤形成,其中所述治疗包含:
当检测到所述TIL群体存在时,对所述瘤形成进行全身性治疗;或
当检测到所述TIL不存在时,对所述瘤形成进行局部治疗。
49.根据条款48所述的方法,其中所述方法进一步包含对所述受试者进行测试,确认转移的存在或不存在。
50.根据条款49所述的方法,其中所述测试包含确认收集自所述受试者的样本中CTC的存在或不存在。
51.根据条款48至50中任一项所述的方法,其中对所述瘤形成进行的所述全身性治疗包含全身性放射疗法、化学疗法、免疫疗法或其组合。
52.根据条款48至51中任一项所述的方法,其中对所述瘤形成进行的所述局部治疗包含手术、局部放射疗法、冷冻疗法、激光疗法、外用疗法或其组合。
53.根据条款48至52中任一项所述的方法,其中所述TIL群体不存在时,所述治疗不包括一种或更多种全身性治疗。
在至少一些前述实施例中,一实施例中使用的一个或更多个元件可以在另一实施例中互换使用,除非这种替换在技术上不可行。本领域技术人员应当理解,在不脱离所主张的标的的情况下,可对上述方法和结构进行各种其他省略、添加和修改。所有这些修改和变更内容都旨在被所附权利要求书中定义的标的范围覆盖。
本领域技术人员应当理解,一般而言,本文使用的术语,特别是所附权利要求书中(例如,在所附权利要求书的主体部分中)使用的术语,通常应理解为“开放”术语(例如,术语“包括”应解释为“包括但不限于”,术语“具有”应解释为“至少具有”等)。本领域技术人员还应理解,如果意在所引入的权利要求中标明具体数目,则这种意图将在该权利要求中明确指出,而在无这种明确标明的情况下,则视为不存在这种意图。例如,为帮助理解,所附权利要求可能使用了引导短语“至少一个”和“一个或更多个”来引入权利要求中的特征。然而,这种短语的使用不应被解释为暗示着由不定冠词“一”或“一个”引入的权利要求特征将含有该特征的任意特定权利要求限制为仅含有一个该特征的实施例,即便是该权利要求既包括引导短语“一个或更多个”或“至少一个”又包括不定冠词如“一”或“一个”(例如,“一”和/或“一个”应当被解释为意指“至少一个”或“一个或更多个”);在使用定冠词来引入权利要求中的特征时,同样如此。另外,即使明确指出了所引入权利要求特征的具体数目,本领域技术人员应当认识到,这种列举应解释为意指至少是所列数目(例如,不存在其他修饰语的短语“两个特征”意指至少两个该特征,或者两个或更多该特征)。另外,在使用类似于“A、B和C等中至少一个”这样的表述的情况下,一般来说应该按照本领域技术人员通常理解该表述的含义来予以解释(例如,“具有A、B和C中至少一个的系统”应包括但不限于单独具有A、单独具有B、单独具有C、具有A和B、具有A和C、具有B和C和/或具有A、B和C的系统等)。在使用类似于“A、B或C等中至少一个”这样的表述的情况下,一般来说应该按照本领域技术人员通常理解该表述的含义来予以解释(例如,“具有A、B或C中至少一个的系统”应包括但不限于单独具有A、单独具有B、单独具有C、具有A和B、具有A和C、具有B和C和/或具有A、B和C的系统等)。本领域技术人员还应当理解,实质上任意表示两个或更多可选项目的转折连词和/或短语,无论是在说明书、权利要求书还是附图中,都应被理解为给出了包括这些项目之一、这些项目任一方或两个项目的可能性。例如,短语“A或B”应当被理解为包括“A”或“B”或“A和B”的可能性。
另外,在以马库什组描述本发明的特征或方面的情况下,本领域技术人员应当认识到,本发明因此也是以该马库什组中的任意单独成员或成员子组来描述的。
本领域技术人员应当理解,出于任意和所有目的,例如为了提供书面说明,本文所揭示的所有范围也包含任意及全部可能的子范围及其子范围的组合。任意列出的范围可被轻易地视作充分描述且实现了将该范围至少进行二等分、三等分、四等分、五等分、十等分等。作为非限制性示例,在此所讨论的每一范围均可被轻易地分成下三分之一、中三分之一和上三分之一等。本领域技术人员应当理解,所有诸如“直至”、“至少”、“大于”、“小于”之类的语言包括所列数字,并且指代了随后可以如上所述被分成子范围的范围。最后,本领域技术人员应当理解,范围包括每一单独数字。因此,例如具有1-3个单元的组是指具有1、2或3个单元的组。类似地,具有1-5个单元的组是指具有1、2、3、4或5个单元的组,以此类推。
尽管为了达到清晰理解的目的采用图示和示例的方式详细描述了前述发明,但是鉴于本发明的教学意义,对于本领域普通技术人员而言显而易见的是,在不脱离所附权利要求书的精神或范围的情况下,可对其进行特定的变更和修改。
因此,前述内容仅说明了本发明的原理。应当理解,本领域技术人员能够设计出各种结构,尽管这里没有明确表述或示出,但这些设计反应了本发明的原理,未超出本发明的精神和范围。此外,本文列举的所有示例和条件语言主要为了帮助读者理解本发明的原理和发明人为进一步拓展本领域所提供的构想,并且应解释为不受这些具体列举的示例和条件的限制。而且,本文中引用本发明的原理、方面和实施例及其特定示例的所有陈述旨在涵盖其在结构和功能上的等同物。此外,所述等同物拟包括目前已知的等同物和日后待开发的等同物,即,开发出的任何功能相同且不考虑其结构的元件。而且,无论在权利要求书中是否明确叙述了本发明的公开内容,都不会向公众披露其中的任何内容。
因此,本发明的范围并不限于本文中显示和描述的示例性实施例。相反,本发明的范围和精神通过所附权利要求书体现。在权利要求书中,只有当权利要求书的限制内容开头明确使用短语“用于……的手段”或“用于……的步骤”时,《美国法典》第35章第112节(f)或《美国法典》第35章第112节(6)明确定义为被援引;如果权利要求书的限制内容中未使用所述短语,则《美国法典》第35章第112节(f)或《美国法典》第35章第112节(6)未被援引。
- 用于检测癌症相关细胞群体、进行转移性癌症筛查及治疗的方法
- 使用高级糖化终产物(AGE)的抗体治疗癌症、杀死转移性癌细胞和预防癌症转移的方法和组合物
