GCA中和抗体的应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及生物医学技术领域,具体涉及GCA中和抗体在制备预防和/或治疗肥胖、与肥胖相关的疾病、与肥胖相关的代谢炎症和以及胰岛素抵抗药物中的应用。
背景技术
根据相关标准,BMI≧25Kg/m
胰岛素抵抗与肥胖发展密切相关,目前提升胰岛素敏感性,改善胰岛素抵抗,主要策略是控制饮食、适度运动、降血糖和降脂药物等,然而大多数降血糖和降脂药物会带来胃肠反应大、皮肤过敏、乳酸中毒等不良副作用。
颗粒钙蛋白(Grancalcin,GCA)是一组具有5个EF手形模体的钙结合蛋白Penta-EF-hand(PEF)蛋白质家族的一员,GCA-Nab,即GCA neutralizing antibody(GCA中和抗体),可阻断GCA的生物活性,但迄今为止尚未见到有关GCA中和抗体用于制备治疗肥胖相关代谢性炎症和胰岛素抵抗的报道。
发明内容
本发明所解决的技术问题在于克服现有技术中无针对预防和/或治疗肥胖、与肥胖相关的疾病、与肥胖相关的代谢炎症和以及胰岛素抵抗药物的特效药,采用控制饮食等方式治疗周期长疗效不明显,而采用降血糖、血脂等药物辅助治疗则会带来乳酸中毒等不良副作用的缺陷,进而提供一种GCA-NAb在制备预防和/或治疗肥胖、与肥胖相关的疾病、与肥胖相关的代谢炎症和以及胰岛素抵抗药物中的应用。
本发明所解决的技术问题采用以下技术方案来实现:
GCA-NAb在制备预防和/或治疗肥胖、与肥胖相关的疾病、与肥胖相关的代谢炎症和以及胰岛素抵抗药物中的应用。
优选的,与肥胖相关的疾病包括II型糖尿病、非酒精性脂肪肝病、动脉粥样硬化、高血糖、高血脂和高血压中的至少一种。
进一步地,所述药物包括GCA-Nab单克隆抗体或分泌GCA-Nab单克隆抗体的杂交瘤细胞株。
进一步地,所述GCA-Nab单克隆抗体由保藏编号为CCTCC NO:C2021182的杂交瘤细胞株分泌。
进一步地,所述GCA的基因序列如SEQ ID No.1所示。
进一步地,所述GCA的蛋白序列如SEQ ID No.2所示。
进一步地,所述药物减少脂肪组织eWAT中炎症细胞因子基因以及SVF中促炎Th1标志基因的表达水平。
进一步地,所述药物增加胰岛素诱导的AKT磷酸化。
有益效果:本发明意外的的发现GCA中和抗体可有效阻断GCA对脂肪组织炎症和胰岛素抵抗的促进作用,从而明显改善肥胖相关胰岛素抵抗和代谢性炎症,延缓代谢综合征的发展,从而为开发预防和/或治疗肥胖、与肥胖相关的疾病、与肥胖相关的代谢炎症和以及胰岛素抵抗药物提供研究基础和理论依据。
具体的:
GCA中和抗体能拮抗GCA对脂肪组织eWAT的促炎作用,改善肥胖相关代谢性炎症,减少肥胖小鼠eWAT中炎症细胞因子基因的表达水平以及SVF中促炎Th1标志基因的表达水平。
GCA中和抗体能减少SVF中促炎Th1细胞数量。
GCA中和抗体能改善葡萄糖稳态和胰岛素敏感性,增加胰岛素诱导的AKT磷酸化。
生物材料保藏信息:
本发明的杂交瘤细胞系,于2021年08月03日保藏在中国典型培养物保藏中心(CCTCC),保藏地址:中国湖北省武汉市武昌珞珈山武汉大学,邮编430072,保藏编号为CCTCC NO:C2021182,培养物名称为杂交瘤细胞株GCA-NAB4。
附图说明
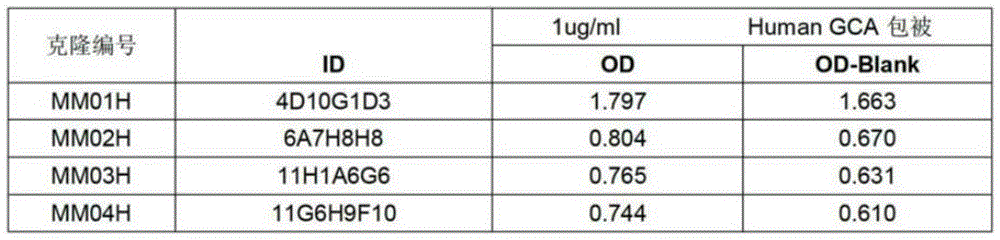
图1为经过筛选的GCA-Nab单克隆抗体。
图2为GCA-Nab对鼠eWAT中炎症因子基因表达影响的qPCR结果示意图(n=6)。
图3为GCA-Nab对SVF中Th1基因表达的qPCR结果示意图(n=6)。
图4-a为流式分析GCA-Nab对SVF细胞中CD4+TBET+Th1细胞数目影响的统计分析图(一)。
图4-b为GCA-Nab对SVF中CD4+TBET+Th1细胞数目影响示意图(二)。
图5为F4/80巨噬细胞免疫组织化学实验的染色示意图,箭头表示巨噬细胞。
图6a为GCA-Nab对空腹血糖影响示意图。
图6b为GCA-Nab对空腹胰岛素水平影响示意图。
图6c为GCA-Nab对HOMA-IR指数影响示意图。
图7a为ipGTT试验的血糖变化过程图。
图7b为ipGTT实验曲线下面积统计分析图。
图7c为ipITT实验的血糖变化过程图。
图7d为ipITT实验曲线下面积统计分析图。
图8为eWAT中胰岛素刺激的AKT磷酸化的免疫印迹分析结果示意图。
图9a为静脉注射GCA-NAb后老鼠体重增加的统计结果示意图。
图9b为静脉注射GCA-NAb后静脉注射GCA-NAb后留取肝脏、eWAT、iWAT和BAT的重量示意图。
图9c为静脉注射GCA-NAb后进行每日摄食量记录的结果示意图。
具体实施方式
为了使本发明实现的技术手段、创作特征、达成目的与功效易于明白了解,下面结合具体实施例进一步阐述本发明。
(一)GCA中和抗体制备。
S1、免疫原制备及动物免疫
(1)通过PCR扩增如SEQ ID No.1所示目的基因序列,将目的基因插入对应表达载体;测序得到含有正确序列的质粒;质粒放大生产传递下游表达。
(2)从含有重组杆粒的E coli细胞中提取杆粒DNA,感染昆虫细胞后得到P1重组杆状病毒。P1代病毒随即被转入sf9昆虫细胞继续扩增得到高滴度P2代重组病毒。
(3)将高滴度P2代重组病毒按一定感染复数(MOI)感染处于对数生长期的high-five昆虫细胞。感染后的细胞在27摄氏度下继续培养2-3天以表达目的蛋白。
(4)适用平衡缓冲液平衡层析柱,将离心过滤后的发酵液上清或细胞裂解上清液加样后用平衡缓冲液淋洗去除部分杂蛋白,随后使用含有不同洗脱剂(Nacl或咪唑)浓度的缓冲液洗脱目标蛋白。收集洗脱组分后将蛋白脱盐至储存缓冲液中。对于不溶蛋白,裂解细胞过程中可能加入尿素等变性剂溶解目标蛋白后进行层析柱纯化,层析柱洗脱含目标蛋白的洗脱组分采用逐级透析法去除变性剂并复性蛋白,最终将复性后蛋白脱盐至储存缓冲液中。
(5)获取的蛋白样本采取SDS-PAGE和UV OD 280等方法进行纯度检测和定量。即可产生所需的免疫原GCA,其蛋白序列如SEQ ID No.1所示。
(6)免疫Balb/c小鼠5只(每只体重约16-20g),剂量50μg/只(以“免疫原+佐剂”的混合液计),将免疫原与等体积的佐剂(完全/不完全弗氏佐剂,分别购自Sigma公司(货号F5881)、BD公司(货号263910))混合,腹部皮下多点注射,间隔2周第二次免疫,再间隔3周第三次免疫,三次免疫后取血测定血清效价。挑选小鼠进行加强免疫,于加强免疫3天后取小鼠脾脏进行杂交瘤融合。
以下为GCA基因及蛋白序列
GCA基因序列(SEQ ID No.1):
ATGCATCATCACCATCACCACCACCATCACCATCTGGAAGTCCTGTTTC AGGGACCCATGGCCTACCCGGGATACGGAGGAGGGTTTGGAAATTTTA GCATTCAGGTGCCAGGAATGCAGATGGGACAGCCAGTGCCAGAAACA GGCCCAGCTATACTCCTCGATGGATACTCTGGGCCAGCATATTCAGACA CTTATTCCTCAGCTGGTGACTCCGTGTATACTTACTTCAGTGCTGTTGCT GGACAGGATGGTGAAGTGGATGCTGAAGAACTTCAGAGATGTTTGACACAGTCTGGAATTAATGGAACTTACTCTCCCTTCAGTTTGGAAACCTGC AGAATTATGATTGCCATGTTGGATAGAGATCACACAGGAAAAATGGGAT TTAATGCATTCAAAGAGCTATGGGCAGCTCTTAATGCCTGGAAGGAAA ACTTCATGACTGTTGATCAAGATGGAAGTGGCACAGTAGAACATCATG AGTTGCGTCAAGCCATTGGTCTTATGGGTTATAGGTTGAGTCCTCAAAC ATTAACTACTATTGTTAAACGTTATAGCAAGAATGGCAGAATTTTCTTTG ATGATTATGTTGCTTGCTGTGTGAAGCTTCGAGCATTGACAGATTTCTTT AGGAAAAGAGACCACTTGCAACAAGGGTCTGCGAATTTCATATATGAC GATTTTTTGCAGGGCACTATGGCAATTTAA。
GCA蛋白序列(SEQ ID No.2):
MHHHHHHHHHHLEVLFQGPMAYPGYGGGFGNFSIQVPGMQMGQPVPE TGPAILLDGYSGPAYSDTYSSAGDSVYTYFSAVAGQDGEVDAEELQRCLT QSGINGTYSPFSLETCRIMIAMLDRDHTGKMGFNAFKELWAALNAWKEN FMTVDQDGSGTVEHHELRQAIGLMGYRLSPQTLTTIVKRYSKNGRIFFDD YVACCVKLRALTDFFRKRDHLQQGSANFIYDDFLQGTMAI。
GCA蛋白基本理化性质为:长度236分子量(KDa)26.4等电点5.91不稳定指数33.07总平均亲水性(Grand average of hydropathicity(GRAVY)-0.33。
S2、采血及效价检测
于末次免疫后一周,经小鼠眶静脉丛取血50~60μL,4℃静置过夜后,离心分离上层血清备检;
适量检测用蛋白,用包被缓冲液稀释成5μg/mL,然后用单道移液器在96孔板每孔中加入100μL,轻拍板子使样品混匀,用保鲜膜封严,4℃下包被过夜;用洗涤液按200μL/孔洗板1次,扣干酶标板;再用封闭液按300μL/孔封闭酶标板,室温下封闭1小时;用洗涤液按400μL/孔洗板2次后加样(将经过梯度稀释的样品及样品稀释剂以100μL/孔加样),同时加入检测抗体,以100μL/孔加至96孔板内,室温下作用2小时;用洗涤液按400μL/孔洗板5次,以200μL/孔加入显色液室温放置12min;以50μL/孔加入终止液终止反应;用酶标仪进行检测:测定波长为450nm。
S3、融合及筛选
取免疫后小鼠全部脾细胞,按1:1比例与小鼠骨髓瘤细胞混合,利用电融合法进行融合,获得杂交瘤细胞。使用抗原蛋白进行包被,用ELISA法测定细胞上清液,选取阳性孔通过有限稀释进行克隆化,直至得到稳定分泌单克隆抗体的杂交瘤细胞株,筛选后共获得4株杂交瘤细胞,其上清均与免疫原结合,即单克隆抗体GCA-Nab制备成功(见图1),后续选择克隆编号MM04H的杂交瘤细胞进行抗体制备(保藏编号为CCTCC NO:C2021182)。
S4、杂交瘤小量培养
将1mL杂交瘤细胞转入100mL培养瓶中,定期加入一定量的培养基进行细胞扩增,培养10~12天。
S5、纯化
Protein A亲和层析柱用超纯水冲洗,然后用平衡缓冲液平衡;将处理好的杂交瘤细胞上清上样亲和层析柱,上样完毕后,用平衡缓冲液淋洗。洗脱缓冲液洗脱,收集洗脱峰,用Tris缓冲液中和,脱盐至PBS7.4,得GCA-Nab。
(二)GCA-NAb通过拮抗GCA减少肥胖相关炎症,改善胰岛素抵抗试验。
将8周龄的小鼠予以高脂喂养12周,诱导为DIO小鼠模型(HFD-induced obesity),随机分为对照组和实验组,随后对照组予以鼠尾静脉注射PBS,实验组通过鼠尾静脉注射GCA-NAb(剂量1mg/kg),每周2次,持续注射2个月,同时记录体重和食物摄入量,2个月后进行ipGTT和ipITT实验并记录空腹血糖和胰岛素水平计算HOMA-IR指数,后处死各组小鼠,称量肝脏、eWAT、iWAT和BAT的重量,留取全部内脏脂肪。一部分用甲醛固定及酒精梯度脱水,经石蜡包埋、切片后,进行免疫组织化学染色,一部分用于提取SVF细胞进行流式分析,余下部分直接提取蛋白和RNA,制成蛋白样本和cDNA样本,用于Western Blot分析和qPCR分析。
(三)试验结果分析。(各数值表示为三次检测的平均值±SD。*,标记为与经PBS处理的对照组细胞相比,P<0.05,**,标记为与经PBS处理的对照组细胞相比P<0.01)
表1 GCA-Nab对鼠eWAT中炎症因子基因表达影响的实验结果表
如表1及图2所示,实验组与PBS处理的对照组相比,鼠尾静脉注射GCA-NAb的小鼠eWAT中炎症因子基因表达明显下降,表明GCA-Nab处理可以减少内脏脂肪组织炎症。
表2 GCA-Nab对SVF中Th1基因表达影响的实验结果表
如表2及图3所示,实验组与PBS处理的对照组相比,鼠尾静脉注射GCA-NAb的SVF中Th1基因表达明显下降,表明GCA-Nab处理可以减少促炎Th1细胞mRNA的表达。
表3 GCA-Nab对SVF中CD4+TBET+Th1细胞数目影响的实验结果表
如表3及图4-a、图4-b可知,实验组与PBS处理的对照组相比,鼠尾静脉注射GCA-NAb的SVF细胞中的CD4+TBET+Th1细胞数目下降,表明GCA-Nab处理可以减少促炎Th1细胞的产生。
表4 GCA-Nab对ewat组织切片中F4/80巨噬细胞数目影响的试验结果表
如表4及图5所示,实验组与PBS处理的对照组相比,鼠尾静脉注射GCA-NAb后的ewat组织切片中F4/80巨噬细胞数目下降。
表5 GCA-Nab对空腹血糖和空腹胰岛素水平以及HOMA-IR指数影响的试验结果表
由表5及图6a、图6b、图6c所示,实验组与PBS处理的对照组相比,鼠尾静脉注射GCA-NAb的空腹血糖和空腹胰岛素水平以及HOMA-IR指数明显下降;表明GCA-Nab处理可以改善肥胖小鼠血糖和胰岛素水平。
表6 ipGTT试验结果表
表7 ipGTT曲线下面积结果表
表8 ipITT试验结果表
表9 ipITT曲线下面积结果表
由表6-9及图7a、7b、7c、7d可知,实验组与PBS处理的对照组相比,鼠尾静脉注射GCA-NAb的实验组ipGTT和ipITT实验显示出血糖降低,胰岛素敏感性增加,表明GCA-Nab治疗可以改善肥胖小鼠胰岛素抵抗。
表10 GCA-Nab对eWAT中胰岛素刺激的AKT磷酸化的实验结果表
由表10及图8可知,实验组与PBS处理的对照组相比,鼠尾静脉注射GCA-NAb后的eWAT中胰岛素刺激的AKT磷酸化的免疫印迹灰度值下降。
表11 GCA-Nab对体重影响的实验结果表
表12 GCA-Nab对白色脂肪、棕色脂肪质量影响的实验结果表
表13 GCA-Nab对食物摄入量影响的实验结果表
由表11~13以及图9a、9b、9c可知,实验组与PBS处理的对照组相比,鼠尾静脉注射GCA-NAb的老鼠在体重、白色脂肪、棕色脂肪质量或食物摄入量方面与对照组没有明显区别。
综上可知,GCA-Nab可有效阻断GCA对脂肪组织炎症和胰岛素抵抗的促进作用,从而明显改善肥胖相关胰岛素抵抗和代谢性炎症,延缓代谢综合征的发展。
以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
