基于人工智能的硼中子俘获治疗剂量分布预测方法及其应用和装置
文献发布时间:2023-06-19 09:49:27
技术领域
本发明涉及放射治疗技术领域,具体地,涉及一种基于人工智能的硼中子俘获治疗剂量分布预测方法、该预测方法在硼中子俘获治疗中的应用、装置及非瞬时性计算机存储介质。
背景技术
癌症已成为威胁人类生命健康的头号杀手。放射治疗作为一种局部、无创的治疗方式,其优异的治疗效果已在临床上得到验证,目前已成为癌症治疗的三大手段之一。光子治疗虽然是目前最为成熟的放射治疗技术,但受限于光子的能量沉积方式,必然会对靶区内的危及器官产生剂量沉积,增加了辐射二次癌风险。因此,新型的放疗技术需被进一步的研究。
硼中子俘获治疗(Boron Neutron Capture Therapy,BNCT)作为一种新型的肿瘤靶向治疗方法,其优越的治疗效果已受到越来越多科研人员的关注。BNCT的治疗原理是在治疗前向病人体内注射入肿瘤靶向硼药,依据药物的药代动力学特性,硼药会在肿瘤组织内聚集,当肿瘤组织中的硼药浓度达到可治疗浓度时,使用热/超热中子束对患者靶区进行体外照射。中子在人体组织的穿行过程中会与肿瘤内浓集的
BNCT治疗过程中产生的总剂量主要包括:①硼剂量(中子与硼俘获反应产生的辐射剂量,约占BNCT总剂量的60%-80%),②中子剂量(中子和氢/氮产生次级质子的辐射剂量),③伽马剂量(次级伽马射线产生的辐照剂量),由于病人的个体差异以及药物的动态分布,导致BNCT治疗过程中的实时剂量也存在动态变化。目前临床上对于治疗剂量的评估仍采用治疗前获取的硼药在患者体内的分布,结合治疗计划系统进行治疗全程中患者靶区内沉积剂量的计算,对实际的治疗效果也是通过预估来确定。这种评估方法势必会受到治疗过程中患者靶区内硼药浓度分布变化的影响。此外,由于患者个体化差异较大,计算剂量沉积所需要的计算时间较长,效率较低,制约了BNCT技术的临床发展。
背景技术部分的内容仅仅是发明人所知晓的技术,并不当然代表本领域的现有技术。
发明内容
为了解决现有硼中子俘获治疗过程中无法准确对剂量分布进行精准预测的问题,本申请提出了一种基于人工智能的硼中子俘获治疗剂量分布预测方法。
具体地,该方法包括:
获取患者的CT图像、特征瞬发伽马射线产额分布样本和剂量分布样本;
使用所述特征瞬发伽马射线产额分布样本、所述剂量分布样本和所述CT图像对人工智能网络模型进行训练和测试;
在硼中子俘获治疗过程中,利用辐射探测装置对特征瞬发伽马射线进行探测,并重建出靶区内的特征瞬发伽马射线产额分布;以及
基于训练好的所述人工智能网络模型、重建出的所述特征瞬发伽马射线产额分布及所述CT图像,预测剂量分布。
根据本申请的一些实施例,所述特征瞬发伽马射线产额分布包括478keV瞬发伽马射线产额分布和2.224MeV瞬发伽马射线产额分布,所述剂量分布包括总生物剂量分布、硼剂量分布、中子剂量分布和伽马剂量分布。
根据本申请的一些实施例,获取特征瞬发伽马射线产额分布样本、剂量分布样本和患者的CT图像包括:
获取所述CT图像;以及
使用蒙特卡罗方法模拟硼中子俘获治疗过程中的粒子输运过程,获取特征瞬发伽马射线产额分布样本和剂量分布样本。
根据本申请的一些实施例,使用蒙特卡罗方法模拟硼中子俘获治疗过程中的粒子输运过程,获取特征瞬发伽马射线产额分布样本和剂量分布样本包括:
使用蒙特卡罗方法,基于所述CT图像对硼中子俘获治疗过程进行建模,模拟不同治疗方案下的能量沉积与粒子输运过程,获得不同肿瘤形状、不同肿瘤类型、不同肿瘤位置及不同硼浓度分布下靶区内的特征瞬发伽马射线产额分布图和三维剂量分布图。
根据本申请的一些实施例,使用所述特征瞬发伽马射线产额分布样本、所述剂量分布样本和所述CT图像对人工智能网络模型进行训练和测试包括:
采用所述硼剂量分布与所述478keV瞬发伽马射线产额分布,对所述人工智能网络模型进行训练和测试;
采用所述中子剂量分布与所述2.224MeV瞬发伽马射线产额分布及所述CT图像,对所述人工智能网络模型进行训练和测试;以及
采用所述CT图像与所述光子剂量分布,对所述人工智能网络模型进行训练和测试。
根据本申请的一些实施例,在硼中子俘获治疗过程中,利用辐射探测装置对特征瞬发伽马射线进行探测,并重建出靶区内的特征瞬发伽马射线产额分布包括:
在硼中子俘获治疗过程中,利用辐射探测装置对478keV瞬发伽马射线和2.224MeV瞬发伽马射线进行探测,获得478keV瞬发伽马射线信息和2.224MeV瞬发伽马射线信息;以及
通过图像重建算法与所述CT图像,对所述478keV瞬发伽马射线信息和所述2.224MeV瞬发伽马射线信息进行重建,获得靶区内的478keV瞬发伽马射线产额分布和2.224MeV瞬发伽马射线产额分布。
根据本申请的一些实施例,基于训练好的所述人工智能网络模型、重建出的所述特征瞬发伽马射线产额分布及所述CT图像,预测剂量分布包括:
将重建出的478keV瞬发伽马射线产额分布输入训练好的所述人工智能网络模型,获得硼剂量分布;
将重建出的2.224MeV瞬发伽马射线产额分布、所述CT图像分别输入训练好的所述人工智能网络模型,获得第一中子剂量分布和第二中子剂量分布;
将所述CT图像输入训练好的所述人工智能网络模型,获得伽马剂量分布;
由所述硼剂量分布、所述第一中子剂量分布、所述第二中子剂量分布、所述伽马剂量分布计算获得总生物剂量分布。
本申请进一步地还提供了上述预测方法在硼中子俘获治疗中的应用,包括:
获取治疗前由治疗计划系统计算得到的剂量沉积结果;以及
将所述剂量分布和所述剂量沉积结果进行对比,分析此次治疗效果与预期效果的差异度。
进一步地,本申请还提供了一种装置,其包括:
处理器;以及
存储器,存储有计算机指令,当所述计算机指令被所述处理器执行时,使得所述处理器执行上述预测方法。
此外,本申请还提供了一种非瞬时性计算机存储介质,存储有计算机程序,当所述计算机程序被一个或多个处理器执行时,使得所述处理器执行上述预测方法。
本申请的预测方法使用患者的CT图像、特征瞬发伽马射线产额分布样本和剂量分布样本训练深度学习网络模型,针对已经训练好的网络模型结构,可以实现不同年龄不同性别不同病例的患者在治疗过程中所受辐照剂量的准确评估。本发明具有快速、准确、简单、易行等特点,能有效解决BNCT治疗过程中剂量预测不准确的难题,有效保障了BNCT的治疗效果。
本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
图1为本发明一实施例中的基于人工智能的硼中子俘获治疗剂量分布预测方法的示意图。
图2为本发明一实施例中的使用蒙特卡罗方法模拟硼中子俘获治疗过程中的粒子输运过程的示意图。
图3为本发明一实施例中的人工智能网络模型的框架图。
图4为本发明一实施例中的对不同组织深度硼剂量分布预测图像的评估结果图。
具体实施方式
以下结合附图和实施例,对本发明的具体实施方式进行更加详细的说明,以便能够更好地理解本发明的方案以及其各个方面的优点。然而,以下描述的具体实施方式和实施例仅是说明的目的,而不是对本发明的限制。
特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
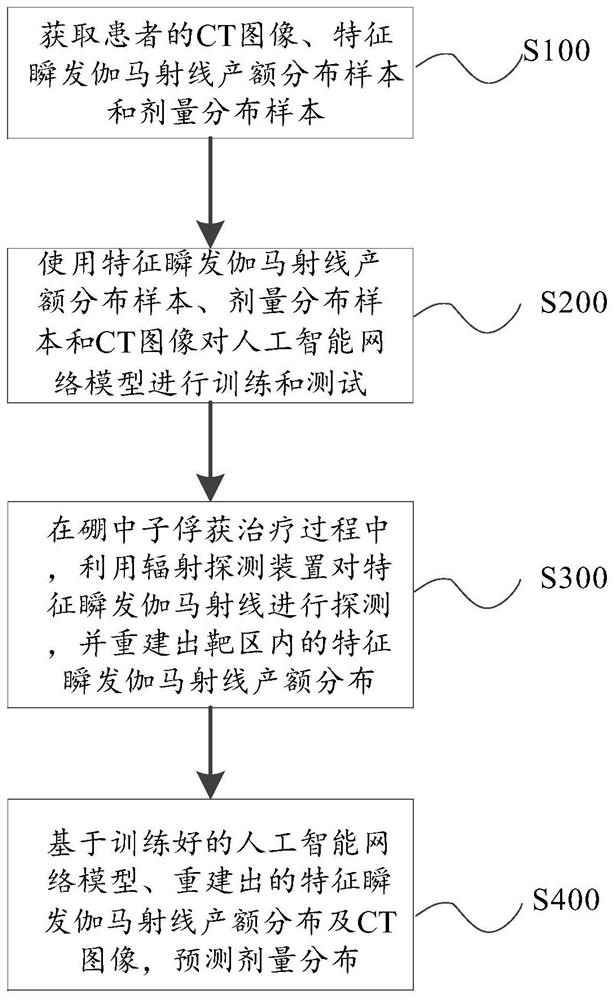
图1为本发明提供的一种基于人工智能的硼中子俘获治疗剂量分布预测方法,包括步骤S100~S400。
S100:获取患者的CT图像、特征瞬发伽马射线产额分布样本和剂量分布样本。
可选地,特征瞬发伽马射线产额分布包括478keV瞬发伽马射线产额分布和2.224MeV瞬发伽马射线产额分布,剂量分布包括总生物剂量分布、硼剂量分布、中子剂量分布和伽马剂量分布。
可选地,使用蒙特卡罗方法模拟硼中子俘获治疗过程中的粒子输运过程,获取特征瞬发伽马射线产额分布样本和剂量分布样本。
具体地,使用蒙特卡罗方法,基于CT图像对硼中子俘获治疗过程进行建模,模拟不同治疗方案下的能量沉积与粒子输运过程,获得不同肿瘤形状、不同肿瘤类型、不同肿瘤位置及不同硼浓度分布下靶区内的特征瞬发伽马射线产额分布图和三维剂量分布图。
蒙特卡罗方法又叫随机抽样法或统计实验法,属于计算数学的一个分支,可以真实地模拟实际粒子输运的物理过程,解决实际问题。可选地,使用蒙特卡罗程序基于患者的CT图像与不同组织的材料组成对其模型进行构建,并确定其对不同粒子的响应。蒙特卡罗程序是基于蒙特卡罗方法的用于计算三维复杂几何结构中的中子、光子、电子或多粒子输运问题的通用软件包。蒙特卡罗程序可采用MCNP、GEANT4、TOPAS、GATE、FLUKA、SuperMC或Phits中的一种或几种。使用蒙特卡罗程序模拟不同治疗方案下的能量沉积与粒子输运过程,获得不同肿瘤形状、不同肿瘤类型、不同肿瘤位置及不同硼浓度分布下靶区内的特征瞬发伽马射线产额分布图和三维剂量分布图。
图2所示的实施例采用GEANT4模拟BNCT治疗不同头部脑胶质瘤情况下的特征瞬发伽马射线产额分布与不同组分剂量分布信息,获取数量充足的训练样本。
如图2所示,在体模中设置头部肿瘤,并在GEANT4程序中设计相应的体素化人体模型,并设置肿瘤内的硼浓度为80ppm,皮肤的硼浓度为25ppm,其它组织内的硼浓度为18ppm。设计一超热中子束流对该病例进行治疗,并追踪每一个粒子的输运过程,记录每个体素内不同能量的特征瞬发伽马射线的产额与不同粒子的能量沉积信息。
根据能量沉积与剂量的计算方法,根据公式(1)~(3)获得不同剂量组分信息,根据公式(4)获得总生物剂量分布。
Dose
Dose
Dose
其中,Dose
同时,记录478keV瞬发伽马射线产额分布和2.224MeV瞬发伽马射线产额分布。
本发明采用蒙特卡罗模拟方法为人工智能模型的训练提供样本,扩大了人工智能方法的应用范围,提升了人工智能方法的适用性。
S200:使用特征瞬发伽马射线产额分布样本、剂量分布样本和CT图像对人工智能网络模型进行训练和测试。
可选地,包括:
采用由S100步骤获得的硼剂量分布与478keV瞬发伽马射线产额分布,对人工智能网络模型进行训练和测试,使人工智能网络模型生成的硼剂量分布接近S100步骤获得的硼剂量分布。
采用由S100步骤获得的中子剂量分布与2.224MeV瞬发伽马射线产额分布及CT图像,对人工智能网络模型进行训练和测试,使人工智能网络模型生成的中子剂量分布接近S100步骤获得的中子剂量分布。
以及采用由S100步骤获得的CT图像与光子剂量分布,对人工智能网络模型进行训练和测试,使人工智能网络模型生成的光子剂量分布接近S100步骤获得的光子剂量分布。本发明可使用的人工智能算法采用的框架为DeepLearnToolbox、Caffe、CNTK、TensorFlow、Theano、Torch、Keras、Lasagne、DSSTNE、MXNet、DeepLearning4J、ConvNetJs、Chainer、Scikit-Learn、Matlab中的一种或多种,人工智能网络模型采用深度置信网络、深度神经网络、卷积神经网络、堆叠式自动编码器或卷积自动编码器中的一种或几种。
图3所示的实施例采用Pix2pix人工智能网络。通过模拟计算得到了不同肿瘤形状、硼浓度分布的情况下的样本对后,将样本带入人工智能网络框架Pix2pix中进行训练。
Pix2pix是一种基于GAN网络的人工智能网络,主要可以实现图像到图像的预测。例如,通过向生成器(图3中的G)输入478keV特征瞬发伽马射线产额分布的图像,生成器依据该图像生成一张预测的剂量分布图像,并将生成器生成的图像与真实的硼剂量分布图像输入到鉴别器中(图3中的D),鉴别器会对两张图像的相似度进行评价。当两张图像差别较大时,鉴别器会判定生成器生成的图像为“假”的图像,并给此次生成图像的质量进行打分。生成器会依据鉴别器的评价结果对自身算法的权重参数进行调整,从而生成更加相似的图像。随着训练次数的增加,生成器生成的剂量分布图与真实的剂量分布图越来越像,鉴别器逐渐无法鉴别出图像的真伪,此时由生成器生成的硼剂量分布与真实的硼剂量分布基本一致。
对于中子剂量分布,通过向生成器输入2.224MeV瞬发伽马射线产额分布和CT图像,生成器依据2.224MeV瞬发伽马射线产额分布和CT图像分别生成预测的剂量分布图像,并将生成器生成的图像与真实的中子剂量分布图像输入到鉴别器中,鉴别器会分别对其相似度进行评价。同样地,当图像差别较大时,鉴别器会判定生成器生成的图像为“假”的图像,并给此次生成图像的质量进行打分。生成器会依据鉴别器的评价结果对自身算法的权重参数进行调整,从而生成更加相似的图像。随着训练次数的增加,生成器生成的剂量分布图与真实的剂量分布图越来越像,鉴别器逐渐无法鉴别出图像的真伪,此时由生成器生成的硼剂量分布与真实的硼剂量分布基本一致。
类似地,对于光子剂量分布,通过向生成器输入CT图像,生成器依据CT图像生成预测的剂量分布图像,并将生成器生成的图像与真实的光子剂量分布图像输入到鉴别器中,鉴别器会分别对其相似度进行评价。同样地,当图像差别较大时,鉴别器会判定生成器生成的图像为“假”的图像,并给此次生成图像的质量进行打分。生成器会依据鉴别器的评价结果对自身算法的权重参数进行调整,从而生成更加相似的图像。随着训练次数的增加,生成器生成的剂量分布图与真实的剂量分布图越来越像,鉴别器逐渐无法鉴别出图像的真伪,此时由生成器生成的硼剂量分布与真实的硼剂量分布基本一致。
对于生成器生成的图像,还需要结合相关的评估参数来对生成图像的治疗进行更为准确与客观的评价。以下结合图4对生成图像评估方法进行说明:
以模拟得到的不同组织深度处的硼剂量分布结果为标准,分析由人工智能网络预测得到的硼剂量分布图与标准图像之间的相似度,重点分析结构相似性(SSIM)与峰值信噪比(PSNR)两个参数。SSIM是一种衡量两幅图像相似度的指标,其值的范围为0到1,当两张图像一模一样时,SSIM的值等于1。SSIM的计算如公式(5)所示,其中μ
除了对生成的剂量分布图像与模拟得到的真实剂量分布图像之间的相似性进行评估外,还需要对生成的图像的质量进行准确的评估,峰值信噪比(PSNR)是一种评价图像的客观标准,其值越大说明图像失真越小,定义如公式(6)所示,其中MSE表示当前图像与参考图像的均方误差,定义如公式(7)所示:
依据这两个图像评价参数对Pix2pix网络预测的图像进行分析,结果如图4可以看出,不同深度层面的下,网络预测得到的剂量分布与模拟方法得到的剂量分布图像的SSIM基本都大于0.96,且浅层图像的SSIM值接近0.99,表明该网络预测得到的剂量分布图像与真实剂量分布图像基本一致。此外,通过PSNR参数可以看出,由该网络预测的剂量分布图像的质量较好。因此,说明该方法在由特征瞬发伽马射线产额分布预测剂量分布的应用可行,准确度高,计算时间少,且可以实现训练样本中没有的参数条件,拓宽了该方法的应用面。
S300:在硼中子俘获治疗过程中,利用辐射探测装置对特征瞬发伽马射线进行探测,并重建出靶区内的特征瞬发伽马射线产额分布。
可选地,包括:
在硼中子俘获治疗过程中,利用辐射探测装置对478keV瞬发伽马射线和2.224MeV瞬发伽马射线进行探测,获得478keV瞬发伽马射线信息和2.224MeV瞬发伽马射线信息;以及
通过图像重建算法与CT图像,对478keV瞬发伽马射线信息和2.224MeV瞬发伽马射线信息进行重建,获得靶区内的478keV瞬发伽马射线产额分布和2.224MeV瞬发伽马射线产额分布。
上述的图像重建算法包括:SBP、ART、SART、MLEM、List Mode-MLEM或OSEM中的一种或者多种。
将辐射探测装置探测得到的不同能量的瞬发伽马射线分布信息及患者的CT图像输入到重建算法,从而重建出患者靶区内的不同能量的瞬发伽马射线产额分布。
S400:基于训练好的人工智能网络模型、重建出的特征瞬发伽马射线产额分布及CT图像,预测剂量分布。
可选地,包括:
将重建出的478keV瞬发伽马射线产额分布输入训练好的人工智能网络模型,获得硼剂量分布。
将重建出的2.224MeV瞬发伽马射线产额分布、CT图像分别输入训练好的人工智能网络模型,获得第一中子剂量分布和第二中子剂量分布。
将CT图像输入训练好的人工智能网络模型,获得伽马剂量分布。
由硼剂量分布、第一中子剂量分布、第二中子剂量分布、伽马剂量分布计算获得总生物剂量分布。
可选地,可对第一中子剂量分布和第二中子剂量分布取平均值,从而获得最终预测的中子剂量分布。可通过公式(4)计算总生物剂量分布。
进一步地,本申请进一步地还提供了上述预测方法在硼中子俘获治疗中的应用,包括:
获取治疗前由治疗计划系统计算得到的剂量沉积结果;以及
将所述剂量分布和所述剂量沉积结果进行对比,分析此次治疗效果与预期效果的差异度。
具体地,针对由人工智能网络模型预测得到的靶区内实时受照剂量情况,结合在治疗前由治疗计划系统计算得到的剂量沉积结果,从而对此次治疗效果做出准确评估,并准确指导后续治疗方案的开展。例如,当肿瘤区域实际接收的剂量低于计划时,根据当前治疗结果,设定进一步的治疗方案。其中,治疗计划系统可为NCTplan、SERA、JCDS、THORplan或NeubronPlan中的一种或多种。
本发明利用已经训练好的网络对治疗过程中实时的剂量分布结果进行预测,加快了预测速度,并且对重建伪影不敏感,提高了剂量预测的准确度。本发明基于人工智能算法,通过大量CT图像与特征瞬发瞬发伽马射线产额分布样布的训练可以实现不同位置不同病灶在不同治疗方案下的硼剂量分布、中子剂量分布、光子剂量分布与总剂量分布的准确预测。本发明针对已经训练好的网络结构,可以实现不同年龄不同性别不同病例的患者在治疗过程中所受辐照剂量的准确评估,提高了本发明的实用性和便利性。本发明将人工智能的预测结果与治疗计划系统计算得到的结果进行比对,提高了治疗效果评估的准确性。
本申请进一步提供一种装置,该装置包括:处理器;以及存储器。其中,存储器存储有计算机指令,当所述计算机指令被所述处理器执行时,使得所述处理器执行上述基于人工智能的硼中子俘获治疗剂量分布预测方法。
此外,本申请还提供了一种非瞬时性计算机存储介质,其存储有计算机程序,当计算机程序被一个或多个处理器执行时,使得所述处理器执行上述基于人工智能的硼中子俘获治疗剂量分布预测方法。
需要说明的是,本申请实施例中对单元的划分是示意性的,仅仅为一种逻辑功能划分,实际实现时可以有另外的划分方式。
另,本领域技术人员应该很容易意识到,结合本文中所提供的实施例描述的各示例的单元及算法步骤,本申请能够以硬件或硬件和计算机软件的结合形式来实现。某个功能究竟以硬件还是计算机软件驱动硬件的方式来执行,取决于技术方案的特定应用和设计约束条件。专业技术人员可以对每个特定的应用使用不同方法来实现所描述的功能,但是这种实现不应认为超出本申请的范围。
需要说明的是,对于前述的各方法实施例,为了简单描述,故将其都表述为一系列的动作组合,但是本领域技术人员应该知悉,本申请并不受所描述的动作顺序的限制,因为依据本申请,某些步骤可以采用其他顺序或者同时进行。其次,本领域技术人员也应该知悉,说明书中所描述的实施例均属于可选实施例,所涉及的动作和模块并不一定是本申请所必须的。
在上述实施例中,对各个实施例的描述都各有侧重,某个实施例中没有详述的部分,可以参见其他实施例的相关描述。
在本申请所提供的几个实施例中,应该理解到,所揭露的装置,可通过其它的方式实现。例如,以上所描述的装置实施例仅仅是示意性的,例如所述单元的划分,仅仅为一种逻辑功能划分,实际实现时可以有另外的划分方式,例如多个单元或组件可以结合或者可以集成到另一个系统,或一些特征可以忽略,或不执行。另一点,所显示或讨论的相互之间的耦合或直接耦合或通信连接可以是通过一些接口,装置或单元的间接耦合或通信连接,可以是电性或其它的形式。
所述作为分离部件说明的单元可以是或者也可以不是物理上分开的,作为单元显示的部件可以是或者也可以不是物理单元,即可以位于一个地方,或者也可以分布到多个网络单元上。可以根据实际的需要选择其中的部分或者全部单元来实现本实施例方案的目的。
另外,在本申请各个实施例中的各功能单元可以集成在一个处理单元中,也可以是各个单元单独物理存在,也可以两个或两个以上单元集成在一个单元中。上述集成的单元既可以采用硬件的形式实现,也可以采用软件程序模块的形式实现。
集成的单元如果以软件程序模块的形式实现并作为独立的产品销售或使用时,可以存储在一个计算机可读取存储器中。基于这样的理解,本申请的技术方案本质上或者说对现有技术做出贡献的部分或者该技术方案的全部或部分可以以软件产品的形式体现出来,该计算机软件产品存储在一个存储器中,包括若干插件用以使得一台计算机设备(可为个人计算机、服务器或者网络设备等)执行本申请各个实施例所述方法的全部或部分步骤。而前述的存储器包括:U盘、只读存储器(ROM,Read-Only Memory)、随机存取存储器(RAM,Random Access Memory)、移动硬盘、磁碟或者光盘等各种可以存储程序代码的介质。
本领域普通技术人员可以理解上述实施例的各种方法中的全部或部分步骤是可以通过程序来插件相关的硬件来完成,该程序可以存储于一计算机可读存储器中,存储器可以包括:闪存盘、只读存储器(英文:Read-Only Memory,简称:ROM)、随机存取器(英文:Random Access Memory,简称:RAM)或光盘等。
以上对本申请实施例进行了详细介绍,本文中应用了具体个例对本申请的原理及实施方式进行了阐述,以上实施例的说明只是用于帮助理解本申请的方法及其核心思想;同时,对于本领域的一般技术人员,依据本申请的思想,在具体实施方式及应用范围上均会有改变之处,综上所述,本说明书内容不应理解为对本申请的限制。
- 基于人工智能的硼中子俘获治疗剂量分布预测方法及其应用和装置
- 硼氮掺杂石墨烯量子点的制备及其在硼中子俘获治疗药物中的应用
