新型化合物及利用其的有机发光器件
文献发布时间:2023-06-19 11:32:36
技术领域
本申请主张基于2019年6月4日的韩国专利申请第10-2019-0066108号的优先权,包含该韩国专利申请的文献中公开的全部内容作为本说明书的一部分。
本发明涉及新型化合物及包含其的有机发光器件。
背景技术
通常情况下,有机发光现象是指利用有机物质将电能转换为光能的现象。利用有机发光现象的有机发光器件具有宽视角、优异的对比度、快速响应时间,亮度、驱动电压和响应速度特性优异,因此正在进行大量的研究。
有机发光器件通常具有包括阳极和阴极以及位于上述阳极与阴极之间的有机物层的结构。为了提高有机发光器件的效率和稳定性,上述有机物层大多情况下由分别利用不同的物质构成的多层结构形成,例如,可以由空穴注入层、空穴传输层、发光层、电子传输层、电子注入层等形成。对于这样的有机发光器件的结构而言,如果在两电极之间施加电压,则空穴从阳极注入有机物层,电子从阴极注入有机物层,当所注入的空穴和电子相遇时会形成激子(exciton),该激子重新跃迁至基态时就会发出光。
对用于如上所述的有机发光器件的有机物,持续要求开发新的材料。
[现有技术文献]
专利文献1:韩国专利公开号第10-2000-0051826号
发明内容
技术课题
本发明涉及新型化合物及包含其的有机发光器件。
课题的解决方法
本发明提供由下述化学式1表示的化合物:
[化学式1]
在上述化学式1中,
X各自独立地为N或CH,但X中的2个以上为N,
Ar
R
R
R
n为1至3的整数。
另外,本发明提供一种有机发光器件,其中,包括:第一电极;与上述第一电极对置而设置的第二电极;以及设置在上述第一电极与上述第二电极之间的1层以上的有机物层,上述有机物层中的1层以上包含由上述化学式1表示的化合物。
发明效果
由上述化学式1表示的化合物可以用作有机发光器件的有机物层的材料,在有机发光器件中可以实现效率的提高、低的驱动电压和/或寿命特性的提高。特别是,由上述化学式1表示的化合物可以用作空穴注入、空穴传输、空穴注入和传输、电子抑制、发光、电子传输、或电子注入的材料。
附图说明
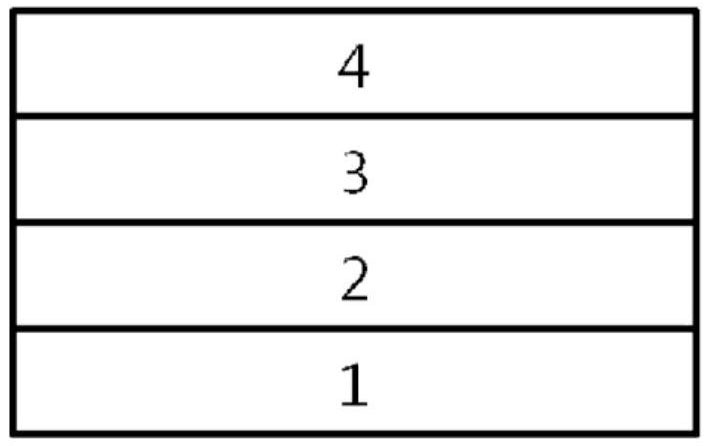
图1图示了由基板1、阳极2、有机物层3、阴极4构成的有机发光器件的例子。
图2图示了由基板1、阳极2、空穴注入层5、空穴传输层6、电子抑制层7、发光层8、空穴抑制层9、电子传输层10、电子注入层11和阴极4构成的有机发光器件的例子。
具体实施方式
下面,为了帮助理解本发明而更详细地进行说明。
本发明提供由上述化学式1表示的化合物。
在本说明书中,
在本说明书中,“取代或未取代的”这一用语是指被选自氘;卤素基团;腈基;硝基;羟基;羰基;酯基;酰亚胺基;氨基;氧化膦基;烷氧基;芳氧基;烷基硫基(
在本说明书中,羰基的碳原子数没有特别限定,但优选碳原子数为1至40。具体而言,可以为如下结构的化合物,但并不限定于此。
在本说明书中,酯基中,酯基的氧可以被碳原子数1至25的直链、支链或环状的烷基、或者碳原子数6至25的芳基取代。具体而言,可以为下述结构式的化合物,但并不限定于此。
在本说明书中,酰亚胺基的碳原子数没有特别限定,但优选碳原子数为1至25。具体而言,可以为如下结构的化合物,但并不限定于此。
在本说明书中,甲硅烷基具体有三甲基甲硅烷基、三乙基甲硅烷基、叔丁基二甲基甲硅烷基、乙烯基二甲基甲硅烷基、丙基二甲基甲硅烷基、三苯基甲硅烷基、二苯基甲硅烷基、苯基甲硅烷基等,但并不限定于此。
在本说明书中,硼基具体有三甲基硼基、三乙基硼基、叔丁基二甲基硼基、三苯基硼基、苯基硼基等,但并不限定于此。
在本说明书中,作为卤素基团的例子,有氟、氯、溴或碘。
在本说明书中,上述烷基可以为直链或支链,碳原子数没有特别限定,但优选为1至40。根据一实施方式,上述烷基的碳原子数为1至20。根据另一实施方式,上述烷基的碳原子数为1至10。根据另一实施方式,上述烷基的碳原子数为1至6。作为烷基的具体例,有甲基、乙基、丙基、正丙基、异丙基、丁基、正丁基、异丁基、叔丁基、仲丁基、1-甲基-丁基、1-乙基-丁基、戊基、正戊基、异戊基、新戊基、叔戊基、己基、正己基、1-甲基戊基、2-甲基戊基、4-甲基-2-戊基、3,3-二甲基丁基、2-乙基丁基、庚基、正庚基、1-甲基己基、环戊基甲基、环己基甲基、辛基、正辛基、叔辛基、1-甲基庚基、2-乙基己基、2-丙基戊基、正壬基、2,2-二甲基庚基、1-乙基-丙基、1,1-二甲基-丙基、异己基、2-甲基戊基、4-甲基己基、5-甲基己基等,但并不限定于此。
在本说明书中,上述烯基可以为直链或支链,碳原子数没有特别限定,但优选为2至40。根据一实施方式,上述烯基的碳原子数为2至20。根据另一实施方式,上述烯基的碳原子数为2至10。根据另一实施方式,上述烯基的碳原子数为2至6。作为具体例,有乙烯基、1-丙烯基、异丙烯基、1-丁烯基、2-丁烯基、3-丁烯基、1-戊烯基、2-戊烯基、3-戊烯基、3-甲基-1-丁烯基、1,3-丁二烯基、烯丙基、1-苯基乙烯-1-基、2-苯基乙烯-1-基、2,2-二苯基乙烯-1-基、2-苯基-2-(萘-1-基)乙烯-1-基、2,2-双(二苯-1-基)乙烯-1-基、茋基、苯乙烯基等,但并不限定于此。
在本说明书中,环烷基没有特别限定,但优选为碳原子数3至60的环烷基,根据一实施方式,上述环烷基的碳原子数为3至30。根据另一实施方式,上述环烷基的碳原子数为3至20。根据另一实施方式,上述环烷基的碳原子数为3至6。具体而言,有环丙基、环丁基、环戊基、3-甲基环戊基、2,3-二甲基环戊基、环己基、3-甲基环己基、4-甲基环己基、2,3-二甲基环己基、3,4,5-三甲基环己基、4-叔丁基环己基、环庚基、环辛基等,但并不限定于此。
在本说明书中,芳基没有特别限定,但优选为碳原子数6至60的芳基,可以为单环芳基或多环芳基。根据一实施方式,上述芳基的碳原子数为6至30。根据一实施方式,上述芳基的碳原子数为6至20。关于上述芳基,作为单环芳基,可以为苯基、联苯基、三联苯基等,但并不限定于此。作为上述多环芳基,可以为萘基、蒽基、菲基、芘基、苝基、
在本说明书中,芴基可以被取代,2个取代基可以
在本说明书中,杂环基是包含O、N、Si和S中的1个以上作为杂原子的杂环基,碳原子数没有特别限定,但优选碳原子数为2至60。作为杂环基的例子,有噻吩基、呋喃基、吡咯基、咪唑基、噻唑基、
在本说明书中,芳烷基、芳烯基、烷基芳基、芳基胺基中的芳基与上述芳基的例示相同。在本说明书中,芳烷基、烷基芳基、烷基胺基中的烷基与上述烷基的例示相同。在本说明书中,杂芳基胺基中的杂芳基可以适用上述关于杂环基的说明。在本说明书中,芳烯基中的烯基与上述烯基的例示相同。在本说明书中,亚芳基为2价基团,除此以外,可以适用上述关于芳基的说明。在本说明书中,亚杂芳基为2价基团,除此以外,可以适用上述关于杂环基的说明。在本说明书中,烃环不是1价基团,而是2个取代基结合而成,除此以外,可以适用上述关于芳基或环烷基的说明。在本说明书中,杂环不是1价基团,而是2个取代基结合而成,除此以外,可以适用上述关于杂环基的说明。
在上述化学式1中,优选地,X均为N。
优选地,Ar
更优选地,Ar
优选地,R
优选地,R
另一方面,R
[化学式1-1]
由上述化学式1表示的化合物的代表性的例子如下所示:
另外,本发明提供如下述反应式1那样的由上述化学式1表示的化合物的制造方法。
[反应式1]
在上述反应式中,X、Ar
上述反应式1作为胺取代反应,优选在钯催化剂和碱的存在下进行,用于胺取代反应的反应基团能够根据该领域中已知的技术进行变更。上述制造方法可以在后述的合成例中更具体化。
另一方面,本发明提供包含由上述化学式1表示的化合物的有机发光器件。作为一个例子,本发明提供一种有机发光器件,其中,包括:第一电极;与上述第一电极对置而设置的第二电极;以及设置在上述第一电极与上述第二电极之间的1层以上的有机物层,上述有机物层中的1层以上包含由上述化学式1表示的化合物。
本发明的有机发光器件的有机物层可以由单层结构形成,还可以由层叠有2层以上的有机物层的多层结构形成。例如,本发明的有机发光器件可以具有包括空穴注入层、空穴传输层、发光层、电子传输层、电子注入层等作为有机物层的结构。但是,有机发光器件的结构并不限定于此,可以包括更少数量的有机层。
另外,上述有机物层可以包括发光层,上述发光层包含由上述化学式1表示的化合物。特别是,根据本发明的化合物可以用作发光层的主体。
另外,上述有机物层可以包括空穴注入层、空穴传输层或电子抑制层,上述空穴注入层、空穴传输层或电子抑制层包含由上述化学式1表示的化合物。
另外,上述电子传输层、电子注入层、或同时进行电子传输和电子注入的层包含由上述化学式1表示的化合物。
另外,根据本发明的有机发光器件可以为在基板上依次层叠有阳极、1层以上的有机物层和阴极的结构(正常型(normal type))的有机发光器件。此外,根据本发明的有机发光器件可以为在基板上依次层叠有阴极、1层以上的有机物层和阳极的逆向结构(倒置型(inverted type))的有机发光器件。例如,根据本发明的一实施例的有机发光器件的结构例示于图1和2。
图1图示了由基板1、阳极2、有机物层3、阴极4构成的有机发光器件的例子。在如上所述的结构中,由上述化学式1表示的化合物可以包含在上述有机物层中。
图2图示了由基板1、阳极2、空穴注入层5、空穴传输层6、电子抑制层7、发光层8、空穴抑制层9、电子传输层10、电子注入层11和阴极4构成的有机发光器件的例子。在如上所述的结构中,由上述化学式1表示的化合物可以包含在上述空穴注入层、空穴传输层、电子抑制层、发光层、空穴抑制层、电子传输层和电子注入层中的1层以上中。
根据本发明的有机发光器件除了上述有机物层中的1层以上包含由上述化学式1表示的化合物以外,可以利用该技术领域中已知的材料和方法进行制造。此外,在上述有机发光器件包括复数个有机物层的情况下,上述有机物层可以由相同的物质或不同的物质形成。
例如,根据本发明的有机发光器件可以通过在基板上依次层叠第一电极、有机物层和第二电极而制造。这时可以如下制造:利用溅射法(sputtering)或电子束蒸发法(e-beam evaporation)之类的PVD(physical Vapor Deposition:物理气相沉积)方法,在基板上蒸镀金属或具有导电性的金属氧化物或它们的合金而形成阳极,然后在该阳极上形成包括空穴注入层、空穴传输层、发光层和电子传输层的有机物层,之后在该有机物层上蒸镀可用作阴极的物质而制造。除了这种方法以外,也可以在基板上依次蒸镀阴极物质、有机物层、阳极物质而制造有机发光器件。
另外,由上述化学式1表示的化合物在制造有机发光器件时不仅可以利用真空蒸镀法,还可以利用溶液涂布法来形成有机物层。在这里,所谓溶液涂布法是指旋涂法、浸涂法、刮涂法、喷墨印刷法、丝网印刷法、喷雾法、辊涂法等,但不仅限于此。
除了这些方法以外,还可以在基板上依次蒸镀阴极物质、有机物层、阳极物质而制造有机发光器件(WO 2003/012890)。但是,制造方法并不限定于此。
作为一个例子,上述第一电极为阳极,上述第二电极为阴极,或者上述第一电极为阴极,上述第二电极为阳极。
作为上述阳极物质,通常为了使空穴能够顺利地向有机物层注入,优选为功函数大的物质。作为上述阳极物质的具体例,有钒、铬、铜、锌、金等金属或它们的合金;氧化锌、氧化铟、氧化铟锡(ITO)、氧化铟锌(IZO)等金属氧化物;ZnO:Al或SNO
作为上述阴极物质,通常为了使电子容易地向有机物层注入,优选为功函数小的物质。作为上述阴极物质的具体例,有镁、钙、钠、钾、钛、铟、钇、锂、钆、铝、银、锡和铅等金属或它们的合金;LiF/Al或LiO
上述空穴注入层是注入来自电极的空穴的层,作为空穴注入物质,优选为如下化合物:具有传输空穴的能力,具有注入来自阳极的空穴的效果,具有对于发光层或发光材料的优异的空穴注入效果,防止发光层中生成的激子向电子注入层或电子注入材料迁移,而且薄膜形成能力优异的化合物。优选空穴注入物质的HOMO(最高占有分子轨道,highestoccupied molecular orbital)介于阳极物质的功函数与周围有机物层的HOMO之间。作为空穴注入物质的具体例,有金属卟啉(porphyrin)、低聚噻吩、芳基胺系有机物、六腈六氮杂苯并菲系有机物、喹吖啶酮(quinacridone)系有机物、苝(perylene)系有机物、蒽醌及聚苯胺和聚噻吩系导电性高分子等,但不仅限于此。
上述空穴传输层是接收来自空穴注入层的空穴并将空穴传输至发光层的层,作为空穴传输物质,是能够接收来自阳极或空穴注入层的空穴并将其转移至发光层的物质,对空穴的迁移率大的物质是合适的。作为具体例,有芳基胺系的有机物、导电性高分子、以及同时存在共轭部分和非共轭部分的嵌段共聚物等,但不仅限于此。
作为上述发光物质,是能够从空穴传输层和电子传输层分别接收空穴和电子并使它们结合而发出可见光区域的光的物质,优选对于荧光或磷光的量子效率高的物质。作为具体示例,有8-羟基喹啉铝配合物(Alq
上述发光层可以包含主体材料和掺杂剂材料。主体材料有芳香族稠环衍生物或含杂环化合物等。具体而言,作为芳香族稠环衍生物,有蒽衍生物、芘衍生物、萘衍生物、并五苯衍生物、菲化合物、荧蒽化合物等,作为含杂环化合物,有咔唑衍生物、二苯并呋喃衍生物、梯型呋喃化合物
作为掺杂剂材料,有芳香族胺衍生物、苯乙烯基胺化合物、硼配合物、荧蒽化合物、金属配合物等。具体而言,芳香族胺衍生物是具有取代或未取代的芳基氨基的芳香族稠环衍生物,有具有芳基氨基的芘、蒽、
上述电子传输层是从电子注入层接收电子并将电子传输至发光层的层,作为电子传输物质,是能够从阴极良好地接收电子并将其转移至发光层的物质,对电子的迁移率大的物质是合适的。作为具体例,有8-羟基喹啉的Al配合物、包含Alq
上述电子注入层是注入来自电极的电子的层,优选为如下化合物:具有传输电子的能力,具有注入来自阴极的电子的效果,具有对于发光层或发光材料的优异的电子注入效果,防止发光层中生成的激子向空穴注入层迁移,而且薄膜形成能力优异的化合物。具体而言,有芴酮、蒽醌二甲烷、联苯醌、噻喃二氧化物、
作为上述金属配位化合物,有8-羟基喹啉锂、双(8-羟基喹啉)锌、双(8-羟基喹啉)铜、双(8-羟基喹啉)锰、三(8-羟基喹啉)铝、三(2-甲基-8-羟基喹啉)铝、三(8-羟基喹啉)镓、双(10-羟基苯并[h]喹啉)铍、双(10-羟基苯并[h]喹啉)锌、双(2-甲基-8-喹啉)氯化镓、双(2-甲基-8-喹啉)(邻甲酚)镓、双(2-甲基-8-喹啉)(1-萘酚)铝、双(2-甲基-8-喹啉)(2-萘酚)镓等,但并不限定于此。
根据所使用的材料,根据本发明的有机发光器件可以为顶部发光型、底部发光型或双向发光型。
另外,由上述化学式1表示的化合物除有机发光器件以外,也可以包含在有机太阳能电池或有机晶体管中。
由上述化学式1表示的化合物及包含其的有机发光器件的制造在以下实施例中具体地进行说明。但是,下述实施例用于例示本发明,本发明的范围并不限定于此。
[合成例]
合成例1
在氮气氛下,将物质(sub)6(10g,20.7mmol)、化合物B(6.1g,22.7mmol)、叔丁醇钠(sodium tert-butoxide)(4g,41.3mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(bis(tri-tert-butylphosphine)palladium(0))(0.2g,0.4mmol)。3小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了7.7g的化合物1。(收率52%,MS:[M+H]+=715)。
合成例2
在氮气氛下,将物质2(10g,17.9mmol)、化合物B(5.3g,19.6mmol)、叔丁醇钠(3.4g,35.7mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.2g,0.4mmol)。2小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了8.6g的化合物2。(收率61%,MS:[M+H]+=791)。
合成例3
在氮气氛下,将物质3(10g,16.9mmol)、化合物A(4.1g,18.6mmol)、叔丁醇钠(3.3g,33.9mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.2g,0.3mmol)。3小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了8.7g的化合物3。(收率67%,MS:[M+H]+=771)。
合成例4
在氮气氛下,将物质4(10g,15.8mmol)、化合物C(4.6g,17.3mmol)、叔丁醇钠(3g,31.5mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.2g,0.3mmol)。2小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了8g的化合物4。(收率59%,MS:[M+H]+=865)。
合成例5
在氮气氛下,将物质5(10g,15.6mmol)、化合物B(4.6g,17.2mmol)、叔丁醇钠(3g,31.2mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.2g,0.3mmol)。2小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了8.7g的化合物5。(收率64%,MS:[M+H]+=871)。
合成例6
在氮气氛下,将物质6(10g,14.3mmol)、化合物A(3.4g,15.7mmol)、叔丁醇钠(2.7g,28.6mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.1g,0.3mmol)。2小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了8.7g的化合物6。(收率69%,MS:[M+H]+=880)。
合成例7
在氮气氛下,将物质7(10g,15.1mmol)、化合物B(4.5g,16.7mmol)、叔丁醇钠(2.9g,30.3mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.2g,0.3mmol)。2小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了8.5g的化合物7。(收率63%,MS:[M+H]+=891)。
合成例8
在氮气氛下,将物质8(10g,15mmol)、化合物B(4.4g,16.5mmol)、叔丁醇钠(2.9g,30mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.2g,0.3mmol)。3小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了8.3g的化合物8。(收率62%,MS:[M+H]+=897)。
合成例9
在氮气氛下,将物质9(10g,15.4mmol)、化合物B(4.5g,16.9mmol)、叔丁醇钠(3g,30.8mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.2g,0.3mmol)。3小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了7.3g的化合物9。(收率54%,MS:[M+H]+=881)。
合成例10
在氮气氛下,将物质10(10g,15mmol)、化合物C(4.4g,16.5mmol)、叔丁醇钠(2.9g,30mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.2g,0.3mmol)。3小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了7g的化合物10。(收率52%,MS:[M+H]+=897)。
合成例11
在氮气氛下,将物质11(10g,16.4mmol)、化合物D(4.8g,18mmol)、叔丁醇钠(3.2g,32.8mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.2g,0.3mmol)。2小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了6.5g的化合物11。(收率55%,MS:[M+H]+=725)。
合成例12
在氮气氛下,将物质12(10g,16.4mmol)、化合物C(4.8g,18mmol)、叔丁醇钠(3.2g,32.8mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.2g,0.3mmol)。2小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了7.3g的化合物12。(收率55%,MS:[M+H]+=815)。
合成例13
在氮气氛下,将物质13(10g,16.4mmol)、化合物A(3.9g,18mmol)、叔丁醇钠(3.2g,32.8mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.2g,0.3mmol)。3小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了6.8g的化合物13。(收率54%,MS:[M+H]+=771)。
合成例14
在氮气氛下,将物质14(10g,16.4mmol)、化合物A(3.9g,18mmol)、叔丁醇钠(3.2g,32.8mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.2g,0.3mmol)。3小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了7.8g的化合物14。(收率60%,MS:[M+H]+=791)。
合成例15
在氮气氛下,将物质15(10g,16.4mmol)、化合物A(3.9g,18mmol)、叔丁醇钠(3.2g,32.8mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.2g,0.3mmol)。2小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了7.4g的化合物15。(收率57%,MS:[M+H]+=791)。
合成例16
在氮气氛下,将物质16(10g,16.4mmol)、化合物D(4.8g,18mmol)、叔丁醇钠(3.2g,32.8mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.2g,0.3mmol)。2小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了7.5g的化合物16。(收率53%,MS:[M+H]+=867)。
合成例17
在氮气氛下,将物质17(10g,16.4mmol)、化合物A(3.9g,18mmol)、叔丁醇钠(3.2g,32.8mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.2g,0.3mmol)。3小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了7.7g的化合物17。(收率52%,MS:[M+H]+=906)。
合成例18
在氮气氛下,将物质18(10g,16.4mmol)、化合物C(4.8g,18mmol)、叔丁醇钠(3.2g,32.8mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.2g,0.3mmol)。2小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了9.1g的化合物18。(收率58%,MS:[M+H]+=956)。
合成例19
在氮气氛下,将物质19(10g,16.4mmol)、化合物B(4.8g,18mmol)、叔丁醇钠(3.2g,32.8mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.2g,0.3mmol)。2小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了8.9g的化合物19。(收率61%,MS:[M+H]+=891)。
合成例20
在氮气氛下,将物质20(10g,16.4mmol)、化合物C(4.8g,18mmol)、叔丁醇钠(3.2g,32.8mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.2g,0.3mmol)。3小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了9.1g的化合物20。(收率58%,MS:[M+H]+=956)。
合成例21
在氮气氛下,将物质21(10g,16.4mmol)、化合物A(3.9g,18mmol)、叔丁醇钠(3.2g,32.8mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.2g,0.3mmol)。2小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了5.9g的化合物21。(收率54%,MS:[M+H]+=665)。
合成例22
在氮气氛下,将物质22(10g,16.4mmol)、化合物C(4.8g,18mmol)、叔丁醇钠(3.2g,32.8mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.2g,0.3mmol)。2小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了7.1g的化合物22。(收率57%,MS:[M+H]+=765)。
合成例23
在氮气氛下,将物质23(10g,16.4mmol)、化合物B(4.8g,18mmol)、叔丁醇钠(3.2g,32.8mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.2g,0.3mmol)。2小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了8g的化合物23。(收率60%,MS:[M+H]+=815)。
合成例24
在氮气氛下,将物质24(10g,16.4mmol)、化合物B(4.8g,18mmol)、叔丁醇钠(3.2g,32.8mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.2g,0.3mmol)。3小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了7.5g的化合物24。(收率52%,MS:[M+H]+=880)。
合成例25
在氮气氛下,将物质25(10g,16.4mmol)、化合物A(3.9g,18mmol)、叔丁醇钠(3.2g,32.8mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.2g,0.3mmol)。3小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了9.3g的化合物25。(收率70%,MS:[M+H]+=815)。
合成例26
在氮气氛下,将物质26(10g,16.4mmol)、化合物B(4.8g,18mmol)、叔丁醇钠(3.2g,32.8mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.2g,0.3mmol)。2小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了7.4g的化合物26。(收率52%,MS:[M+H]+=871)。
合成例27
在氮气氛下,将物质27(10g,16.4mmol)、化合物A(3.9g,18mmol)、叔丁醇钠(3.2g,32.8mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.2g,0.3mmol)。3小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了7.9g的化合物27。(收率60%,MS:[M+H]+=805)。
合成例28
在氮气氛下,将物质28(10g,16.4mmol)、化合物B(4.8g,18mmol)、叔丁醇钠(3.2g,32.8mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.2g,0.3mmol)。3小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了9.9g的化合物28。(收率68%,MS:[M+H]+=891)。
合成例29
在氮气氛下,将物质29(10g,16.4mmol)、化合物A(3.9g,18mmol)、叔丁醇钠(3.2g,32.8mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.2g,0.3mmol)。2小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了8g的化合物29。(收率58%,MS:[M+H]+=841)。
合成例30
在氮气氛下,将物质30(10g,16.4mmol)、化合物D(4.8g,18mmol)、叔丁醇钠(3.2g,32.8mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.2g,0.3mmol)。3小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了11g的化合物30。(收率70%,MS:[M+H]+=956)。
合成例31
在氮气氛下,将物质31(10g,16.4mmol)、化合物B(4.8g,18mmol)、叔丁醇钠(3.2g,32.8mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.2g,0.3mmol)。2小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了7.8g的化合物31。(收率67%,MS:[M+H]+=715)。
合成例32
在氮气氛下,将物质32(10g,16.4mmol)、化合物D(4.8g,18mmol)、叔丁醇钠(3.2g,32.8mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.2g,0.3mmol)。3小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了8.5g的化合物32。(收率64%,MS:[M+H]+=815)。
合成例33
在氮气氛下,将物质33(10g,16.4mmol)、化合物D(4.8g,18mmol)、叔丁醇钠(3.2g,32.8mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.2g,0.3mmol)。2小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了7.2g的化合物33。(收率54%,MS:[M+H]+=815)。
合成例34
在氮气氛下,将物质34(10g,16.4mmol)、化合物D(4.8g,18mmol)、叔丁醇钠(3.2g,32.8mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.2g,0.3mmol)。3小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了9g的化合物34。(收率64%,MS:[M+H]+=855)。
合成例35
在氮气氛下,将物质35(10g,16.4mmol)、化合物B(4.8g,18mmol)、叔丁醇钠(3.2g,32.8mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.2g,0.3mmol)。3小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了9g的化合物35。(收率64%,MS:[M+H]+=855)。
合成例36
在氮气氛下,将物质36(10g,16.4mmol)、化合物C(4.8g,18mmol)、叔丁醇钠(3.2g,32.8mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.2g,0.3mmol)。3小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了7.1g的化合物36。(收率53%,MS:[M+H]+=815)。
合成例37
在氮气氛下,将物质37(10g,16.4mmol)、化合物A(3.9g,18mmol)、叔丁醇钠(3.2g,32.8mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.2g,0.3mmol)。2小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了7.8g的化合物37。(收率54%,MS:[M+H]+=880)。
合成例38
在氮气氛下,将物质38(10g,16.4mmol)、化合物B(4.8g,18mmol)、叔丁醇钠(3.2g,32.8mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.2g,0.3mmol)。3小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了9.4g的化合物38。(收率65%,MS:[M+H]+=881)。
合成例39
在氮气氛下,将物质39(10g,16.4mmol)、化合物A(3.9g,18mmol)、叔丁醇钠(3.2g,32.8mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.2g,0.3mmol)。3小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了9g的化合物39。(收率65%,MS:[M+H]+=841)。
合成例40
在氮气氛下,将物质40(10g,16.4mmol)、化合物D(4.8g,18mmol)、叔丁醇钠(3.2g,32.8mmol)加入到200ml的二甲苯中,搅拌及回流。然后,投入双(三叔丁基膦)钯(0)(0.2g,0.3mmol)。3小时后,反应结束,冷却至常温,减压而去除溶剂。然后,将化合物再次完全溶解于氯仿,用水洗涤2次后,将有机层分离,用无水硫酸镁处理后过滤,将滤液减压蒸馏。将浓缩的化合物用硅胶柱层析进行纯化,从而得到了8.3g的化合物40。(收率53%,MS:[M+H]+=956)
[实施例]
比较例1
将ITO(氧化铟锡,indium tin oxide)以
在这样准备的ITO透明电极上,作为空穴注入层,将下述HI-1化合物以
在上述过程中,有机物的蒸镀速度维持
比较例2至10
作为红色发光层主体材料,分别使用下述化合物RH-2至RH-10代替RH-1,除此以外,通过与比较例1相同的方法制作了有机发光器件。
实施例1至40
作为红色发光层主体材料,分别使用上述合成例的化合物1至40代替比较例1,除此以外,通过与比较例1相同的方法制作了有机发光器件。
实验例
将上述比较例1至10和实施例1至40的有机发光器件在110℃烘箱中保存30分钟而进行了热处理后,施加电流而测定了驱动电压、电流效率和寿命(T95),将其结果示于下述表1。这时,电压和效率是施加10mA/cm
[表1]
参考上述表1,可以确认将本发明的化学式1的化合物用作红色发光层主体材料的有机发光器件显示出低的驱动电压,电流效率和寿命特性优异。
符号说明
1:基板2:阳极
3:有机物层4:阴极
5:空穴注入层6:空穴传输层
7:电子抑制层8:发光层
9:空穴抑制层10:电子传输层
11:电子注入层。
- 新型化合物和利用该化合物的有机发光器件(3)
- 新型有机化合物和包括该新型有机化合物的有机发光器件
