多酶体系供给α-酮戊二酸及其用于合成4-羟基异亮氨酸
文献发布时间:2023-06-19 11:42:32
技术领域
本发明涉及多酶体系供给α-酮戊二酸及其用于合成4-羟基异亮氨酸,属于生物催化技术领域。
背景技术
4-羟基异亮氨酸的化学结构为:
4-羟基异亮氨酸((2S,3R,4S)-4-hydroxyisoleucine,4-HIL)来源于葫芦巴植物,是一种新型的胰岛素分泌促进剂,具有刺激β-胰岛细胞分泌胰岛素的作用,可用于治疗II型糖尿病。
除了从葫芦巴种子中提取分离,4-HIL的合成方法主要有化学-酶法和酶催化法。Wang等发明八步化学-酶合成法合成4-HIL:首先以2-甲基乙酰乙酸乙酯为原料,在地霉菌的作用下得到(2S,3S)-3-羟基-2-甲基丁酸乙酯,再经过7个步骤转变成4-HIL。Fulcrand等提出六步化学-酶合成法合成4-HIL:第一步以溴乙酸叔丁酯为底物,在二苄胺的催化下得到二-N-苯甲基甘氨酸叔丁酯,经过开环、色层分析等步骤分离得到外消旋4-HIL内酯,最后在青霉素酰基转移酶作用下水解N-苯乙酰内酯衍生物得到4-HIL。
化学-酶法合成4-HIL的步骤复杂,中间副产物多且转化效率较低。Kodera等为了追求更有效率的4-HIL合成方法,获得苏云金芽孢杆菌来源的具有L-异亮氨酸羟基化活性的L-异亮氨酸双加氧酶,可将L-异亮氨酸转变为4-HIL。CN104152505A披露了通过筛选获得一株具有L-异亮氨酸双加氧酶活性的枯草芽孢杆菌,克隆了其异亮氨酸双加氧酶基因,然后构建带有目的基因的重组菌株,通过重组菌催化转化底物L-异亮氨酸得到4-HIL。L-异亮氨酸双加氧酶属于Fe(II)/α-KG依赖型双加氧酶超家族,该家族酶利用分子氧激活C-H键来参加生物体内很多重要反应,包括羟基化、脱氧、扩环和去饱和等,这些反应常常同时伴随着α-酮戊二酸氧化脱羧形成CO
在以L-异亮氨酸双加氧酶为催化中心的反应体系中需要提供大量的α-酮戊二酸,并且作为辅底物α-酮戊二酸的量直接影响酶的催化效率。考虑到过程经济性和工业可行性,耦联高效、低成本的α-酮戊二酸再生系统很有必要。Smirnov等将4-HIL的生成与三羧酸循环耦联起来,利用大肠杆菌产生L-异亮氨酸双加氧酶,以100mM L-异亮氨酸为底物进行生物转化24h后,4-HIL转化率可达82%。Zhang等通过代谢工程对产生L-异亮氨酸双加氧酶的谷氨酸棒状杆菌进行改造,将工程菌株进行发酵转化64h后,4-HIL产量为34.21g·L
发明内容
[技术问题]
本发明要解决的技术问题是,现有通过对菌株代谢工程改造实现α-酮戊二酸供给并用于4-HIL合成的方法中,重构TCA循环会抑制细胞生长,且对转化效率提高有限,反应周期较长。
[技术方案]
本发明基于Fe(II)/α-KG依赖型双加氧酶超家族催化C-H键氧化反应特征,构建一种由廉价底物出发的多酶级联体系以及该体系在合成4-HIL中的应用。本发明不仅仅构建一种经济的多酶级联体系用于4-HIL的合成,还通过精准调整和优化反应条件实现良好的反应相容性和反应的协同作用,进一步建立转化羟基氨基酸的高效共性的反应体系。
本发明目的是提供一种多酶级联体系转化生产4-HIL的方法,以L-异亮氨酸及L-谷氨酸为底物,利用L-异亮氨酸双加氧酶、L-谷氨酸氧化酶和过氧化氢酶同步级联催化生成4-HIL;具体是以一水合谷氨酸钠为底物,通过L-谷氨酸氧化酶将一水合谷氨酸钠转化为α-酮戊二酸作为共底物用于Fe(II)/α-KG依赖型双加氧酶超家族催化C-H键氧化反应,并利用过氧化氢酶消除伴随α-酮戊二酸生成的H
(1)一锅法
L-异亮氨酸、一水合L-谷氨酸钠、L-抗坏血酸、FeSO
(2)两阶段转化法
L-异亮氨酸、一水合L-谷氨酸钠、L-抗坏血酸、FeSO
(3)两阶段分批次转化法
L-异亮氨酸、一水合L-谷氨酸钠、L-抗坏血酸、FeSO
进一步地,所述转化体系(1)、(2)或(3)将底物及酶添加到pH 7.0~8.0的Tris-HCl溶液中进行转化反应。
进一步地,所述转化体系(1)中转化的温度为25~35℃,pH为7.0~8.0,转化时间为0.5~2h,转速为200~400rpm。
进一步地,所述转化体系(2)中转化的温度为25~35℃,pH为7.0~8.0,第一阶段转化时间为2~5h,第二阶段转化时间为2~9h,转速为200~400rpm。
进一步地,所述转化体系(3)中转化的温度为25~35℃,pH为7.0~8.0,第一阶段转化时间为2~5h,第二阶段转化时间为2~9h,转速为200~400rpm。
进一步地,所述用于4-HIL合成的L-异亮氨酸双加氧酶的来源包括但不限于枯草芽孢杆菌(Bacillus subtilis)或者利用大肠杆菌表达得到,例如以大肠杆菌BL21(DE3)为宿主,以pET28a为载体。进一步地,所述L-异亮氨酸双加氧酶的氨基酸序列如SEQ ID NO:3所示,编码所述L-异亮氨酸双加氧酶的基因的核苷酸序列如SEQ ID NO:1所示。
进一步地,转化过程中所述L-谷氨酸氧化酶的来源包括但不限于加纳链霉菌(Streptomyces ghanaensis)或者利用大肠杆菌表达得到,例如以大肠杆菌BL21(DE3)为宿主,以pET28a为载体。进一步地,所述L-谷氨酸氧化酶的氨基酸序列如SEQ ID NO:4所示,编码所述L-谷氨酸氧化酶的基因的核苷酸序列如SEQ ID NO:2所示。
进一步地,所述过氧化氢酶来源于牛肝脏(bovine liver)。
[有益效果]
本发明利用酶催化合成α-酮戊二酸以促进双加氧酶介导的羟基化反应,并通过精准调整和优化反应条件实现良好的反应相容性和反应的协同作用,实现4-HIL更经济的生物转化。
本发明利用多酶级联催化L-异亮氨酸生产4-HIL,并通过分批补料解除底物抑制,4-HIL达到465.61mM,最终转化率达到93.12%。根据Fe(II)/α-KG依赖型双加氧酶超家族催化C-H键氧化反应特征,共底物α-酮戊二酸由价格低廉的一水合谷氨酸钠出发,发酵后通过亲和层析大量制备转化所需的L-异亮氨酸双加氧酶和L-谷氨酸氧化酶,操作简便,副产物少,下游纯化简易,可建立一个高效共性的生物酶法合成4-HIL的工艺。
附图说明
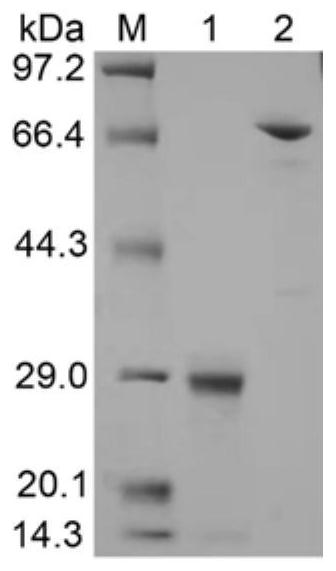
图1:多酶级联反应体系中蛋白纯化后的SDS-PAGE电泳结果;其中,M为蛋白分子量标准;1为L-异亮氨酸双加氧酶(IDO)纯化后的SDS-PAGE电泳结果;2为L-谷氨酸氧化酶(LGOX)纯化后的SDS-PAGE电泳结果;
图2:多酶级联反应体系合成4-HIL的路线。
具体实施方式
样品预处理:取反应液于12000rpm离心10min收集上清液,配制4-HIL及α-酮戊二酸标准溶液。将适度稀释后的反应上清液和标准溶液用高效液相色谱法检测。
反应液中氨基酸的含量测定。衍生方法:吸取上述离心后上清液,稀释到一定浓度范围后取250μL样品,加入250μL 0.2mol·L
反应液中有机酸的含量测定:吸取上述离心后上清液,稀释到一定浓度范围后用0.22μm的水系滤头过滤进行检测。采用waters T3柱,紫外吸收波长210nm,柱温40℃,流动相:20mM KH
重组L-异亮氨酸双加氧酶酶活测定方法:酶活测定体系:10mM L-异亮氨酸,0.5mMFeSO
重组L-谷氨酸氧化酶酶活测定方法:取在30℃下孵育的0.2mL反应液(含5mM L-谷氨酸,6mM苯酚,6mM 4-氨基安替比林,1U辣根过氧化物酶,0.1M Tris-HCl,pH7.0),随后加入一定量的酶液,采用酶标仪进行吸光值的在线测定。1个酶活力单位是指在30℃下,每分钟生成1μmol过氧化氢所需要的酶量定义为一个酶活单位(U)。
表达L-异亮氨酸双加氧酶的工程菌E.coli pET28a-L-异亮氨酸双加氧酶的构建:来源于Bacillus subtilis(CCTCC:M2013373)的L-异亮氨酸双加氧酶(L-异亮氨酸双加氧酶)的基因编码序列如SEQ ID NO:1所示,编码的氨基酸序列如SEQ ID NO:3所示。将人工合成的含有NcoI和SalI酶切位点的L-异亮氨酸双加氧酶基因片段进行双酶切,将该基因连接至同样进行双酶切后的表达载体pET28a,得到表达质粒pET28a-L-异亮氨酸双加氧酶;将构建好的表达质粒pET28a-L-异亮氨酸双加氧酶导入E.coli BL21(DE3),在含有卡那霉素的LB平板中培养过夜,筛选阳性克隆进行测序验证,最终获得表达L-异亮氨酸双加氧酶的工程菌E.coli pET28a-L-异亮氨酸双加氧酶构建成功。
表达L-谷氨酸氧化酶的工程菌E.coli pET28a-L-谷氨酸氧化酶的构建:来源于Streptomyces ghanaensis(ATCC14672)的L-谷氨酸氧化酶(GenBank:EFE71695.1)基因编码序列如SEQ ID NO:2所示,编码的氨基酸序列如SEQ ID NO:4所示。将人工合成的含有NcoI和XhoI酶切位点的L-谷氨酸氧化酶基因片段进行双酶切,将该基因连接至同样进行双酶切后的表达载体pET28a,得到表达质粒pET28a-L-谷氨酸氧化酶;将构建好的表达质粒pET28a-L-谷氨酸氧化酶导入E.coli BL21(DE3),在含有卡那霉素的LB平板中培养过夜,筛选阳性克隆进行测序验证,最终获得表达L-谷氨酸氧化酶的工程菌E.coli pET28a-L-谷氨酸氧化酶构建成功。
实施例1:L-异亮氨酸双加氧酶、L-谷氨酸氧化酶的制备
1基因工程菌株的发酵培养
(1)重组大肠杆菌E.coli pET28a-L-异亮氨酸双加氧酶的细胞培养
以2%(体积分数)的接种量转接至含有50mg/L卡那抗生素的50mL LB培养基中,37℃,200r/min下培养OD600至0.6~0.8;加入1mM IPTG变温25℃诱导12~14h。在4℃,8000r/min下离心收集菌体,并用生理盐水洗涤菌体2次备用。
(2)重组大肠杆菌E.coli pET28a-L-谷氨酸氧化酶的细胞培养
以2%(体积分数)的接种量转接至含有50mg/L卡那抗生素的50mL LB培养基中,37℃,200r/min下培养OD
2重组蛋白的分离纯化
(1)L-异亮氨酸双加氧酶的分离纯化
将步骤1获得的重组菌E.coli pET28a-L-异亮氨酸双加氧酶重悬于20mM、pH 7.5的Tris-HCl缓冲液,高压匀浆破碎后,12000r/min离心30min收集上清。采用Ni-NTA亲和层析法对重组蛋白分离纯化:在4℃条件下,先后用20mL乙醇和40mL去离子水冲洗层析柱,然后用20mL的结合缓冲液(40mM咪唑、0.3mM NaCl、20mM Tris-HCl,pH 7.5)平衡层析柱;细胞破碎上清液经0.22μm滤膜过滤后缓慢注入层析柱中,先用洗脱缓冲液1(60mM咪唑、20mMTris、0.3M NaCl,pH 7.5)洗下杂蛋白后,利用洗脱缓冲液2(280mM咪唑、20mM Tris、0.3MNaCl,pH 7.5)洗脱目的蛋白;目的蛋白洗脱液经脱盐柱和脱盐缓冲液(5mM DTT、10mMTris、0.1M NaCl,pH 7.5)处理后获得纯蛋白L-异亮氨酸双加氧酶(5.84±0.07U·mg
(2)L-谷氨酸氧化酶的分离纯化
将步骤1获得的重组菌E.coli pET28a-L-谷氨酸氧化酶重悬于20mM、pH 7.5的Tris-HCl缓冲液,高压匀浆破碎后,12000r/min离心30min收集上清。采用Ni-NTA亲和层析法对重组蛋白分离纯化:在4℃条件下,先后用20mL乙醇和40mL去离子水冲洗层析柱,然后用20mL的结合缓冲液(40mM咪唑、0.3mM NaCl、20mM Tris-HCl,pH 7.5)平衡层析柱;细胞破碎上清液经0.22μm滤膜过滤后缓慢注入层析柱中,先用洗脱缓冲液1(60mM咪唑、20mMTris、0.3M NaCl,pH 7.5)洗下杂蛋白后,利用洗脱缓冲液2(600mM咪唑、20mM Tris、0.3MNaCl,pH 7.5)洗脱目的蛋白;目的蛋白洗脱液经脱盐柱和脱盐缓冲液(5mM DTT、10mMTris、0.1M NaCl,pH 7.5)处理后获得纯蛋白L-谷氨酸氧化酶(2.67±0.09U·mg
实施例2:过氧化氢酶浓度对α-酮戊二酸生成的影响
(1)将实施例1中获得的L-谷氨酸氧化酶用于生成α-酮戊二酸,转化体系为200mM一水合L-谷氨酸钠、0.5mg·mL
(2)将实施例1中获得的L-谷氨酸氧化酶用于生成α-酮戊二酸,转化体系为200mM一水合L-谷氨酸钠、0.5mg·mL
(3)将实施例1中获得的L-谷氨酸氧化酶用于生成α-酮戊二酸,转化体系为200mM一水合L-谷氨酸钠、0.5mg·mL
(4)将实施例1中获得的L-谷氨酸氧化酶用于生成α-酮戊二酸,转化体系为200mM一水合L-谷氨酸钠、0.5mg·mL
(5)将实施例1中获得的L-谷氨酸氧化酶用于生成α-酮戊二酸,转化体系为200mM一水合L-谷氨酸钠、0.5mg·mL
实施例3:底物浓度对α-酮戊二酸生成的影响
(1)将实施例1中获得的L-谷氨酸氧化酶用于生成α-酮戊二酸,转化体系为300mM一水合L-谷氨酸钠、0.5mg·mL
(2)将实施例1中获得的L-谷氨酸氧化酶用于生成α-酮戊二酸,转化体系为350mM一水合L-谷氨酸钠、0.5mg·mL
(3)将实施例1中获得的L-谷氨酸氧化酶用于生成α-酮戊二酸,转化体系为400mM一水合L-谷氨酸钠、0.5mg·mL
(4)将实施例1中获得的L-谷氨酸氧化酶用于生成α-酮戊二酸,转化体系为450mM一水合L-谷氨酸钠、0.5mg·mL
(5)将实施例4中获得的L-谷氨酸氧化酶用于生成α-酮戊二酸,转化体系为550mM一水合L-谷氨酸钠、0.5mg·mL
实施例4:底物浓度对4-HIL生成的影响
(1)将实施例1中获得的L-异亮氨酸双加氧酶用于生成4-HIL,转化体系为100mML-异亮氨酸、100mMα-酮戊二酸、50mM抗坏血酸、5mM FeSO
(2)将实施例1中获得的L-异亮氨酸双加氧酶用于生成4-HIL,转化体系为200mML-异亮氨酸、200mMα-酮戊二酸、50mM抗坏血酸、5mM FeSO
(3)将实施例1中获得的L-异亮氨酸双加氧酶用于生成4-HIL,转化体系为300mML-异亮氨酸、300mMα-酮戊二酸、50mM抗坏血酸、5mM FeSO
(4)将实施例1中获得的L-异亮氨酸双加氧酶用于生成4-HIL,转化体系为500mML-异亮氨酸、500mMα-酮戊二酸、50mM抗坏血酸、5mM FeSO
实施例5:L-异亮氨酸双加氧酶浓度对4-HIL生成的影响
(1)实施例1中获得的L-异亮氨酸双加氧酶用于生成4-HIL,转化体系为500mM L-异亮氨酸、500mMα-酮戊二酸、50mM抗坏血酸、5mM FeSO
(2)实施例1中获得的L-异亮氨酸双加氧酶用于生成4-HIL,转化体系为500mM L-异亮氨酸、500mMα-酮戊二酸、50mM抗坏血酸、5mM FeSO
实施例6:“一锅法”催化生产4-HIL
(1)“一锅法”多酶级联合成4-HIL(不添加Fe
将实施例1中获得的L-异亮氨酸双加氧酶及L-谷氨酸氧化酶用于催化生产4-HIL,转化体系为100mM L-异亮氨酸、50mM抗坏血酸、100mM一水合L-谷氨酸钠、1mg·mL
将催化剂与底物一次性加于转化体系中,随着转化进行,由于体系中不添加Fe
(2)“一锅法”多酶级联合成4-HIL(添加Fe
将实施例1中获得的L-异亮氨酸双加氧酶及L-谷氨酸氧化酶用于催化生产4-HIL,转化体系为100mM L-异亮氨酸、50mM抗坏血酸、100mM一水合L-谷氨酸钠、1mg·mL
将催化剂与底物一次性加于转化体系中,随着转化进行,由于L-谷氨酸氧化酶催化L-谷氨酸生成α-酮戊二酸的同时伴随着H
实施例7:分步级联催化生产4-HIL
将实施例1中获得的L-异亮氨酸双加氧酶及L-谷氨酸氧化酶用于催化生产4-HIL,转化体系为:第一阶段为将550mM一水合L-谷氨酸钠,0.5mg·mL
转化结果如下:第一阶段,550mM的一水合L-谷氨酸钠,转化5h,中间产物α-酮戊二酸的产量为497.41mM,转化率为90.4%。此时反应到达终点,进行第二阶段的反应,进一步转化6h,4-HIL的产量为434.45mM;转化9h后4-HIL为464.96mM,最终转化率为92.97%。
实施例8:分步级联催化生产4-HIL
将实施例1中获得的L-异亮氨酸双加氧酶及L-谷氨酸氧化酶用于催化生产4-HIL,转化体系为:第一阶段为将550mM一水合L-谷氨酸钠,0.5mg·mL
转化结果如下:第一阶段,550mM的一水合L-谷氨酸钠,转化5h,中间产物α-酮戊二酸的产量为497.41mM,转化率为90.4%。此时反应到达终点,将体系pH调为7.0,进行第二阶段的反应,转化9h后4-HIL为465.61mM,最终转化率为93.12%。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
SEQUENCE LISTING
<110> 江南大学
<120> 多酶体系供给α-酮戊二酸及其用于合成4-羟基异亮氨酸
<130> BAA210457A
<160> 4
<170> PatentIn version 3.3
<210> 1
<211> 723
<212> DNA
<213> 枯草芽孢杆菌Bacillus subtilis (CCTCC:M2013373)
<400> 1
atgaaaatga gtggctttag catagaagaa aaggtacatg aatttgaatc taagggattc 60
cttgaaatct caaatgaaat ctttttacaa gaggaagaga atcatcgttt attaacacaa 120
gcacagttag attattataa tttggaagat gatgcgtacg gtgaatgccg tgctggatct 180
tattcaaggt atataaagta tgttgattca ccagattata ttttagataa tagtaatgat 240
tacttccaat ctaaagaata taactatgat gatggcggta aagttagaca gttccatagc 300
ataaatgata gttttttata taatccttta attcaaaata tcgtgcgttt cgatactgaa 360
tttgcattta aaacaaatat aatagataca agtaaagatt taattatagg tttacatcaa 420
gtaagatata aagctactaa agaaagacca tcttttagtt cacctatttg gttacataaa 480
gatgatgaac cagtagtgtt tttacacctt atgaatttaa gtaatacagc tattggcgga 540
gataatttaa tagctaattc tccaagggaa attaatcagt ttataagttt gaaggagcct 600
ttagaaactt tagtatttgg acaaaaggtt ttccatgccg taacgccact tggaacagaa 660
tgtagtactg aagcttttcg tgatatttta ttagtaacat tttcttataa ggagacaaaa 720
taa 723
<210> 2
<211> 1995
<212> DNA
<213> 加纳链霉菌Streptomyces ghanaensis (ATCC14672)
<400> 2
atgactgaag atcacgcggt ggtgcgttcg gacggcggtc tgtcccggag gagcttcgcg 60
gcggtggccg gcacagccac ggtcgccaca gccctgacca gcggtgtcgc cgcggccctg 120
cccgcaccgg ccgcctcggg cgacagccgt ggcgccgact tcgaccggtg cctggccgtc 180
gctcgcgcac tcctcgtcct ggactccgac gaccgccccc tcgtcccgcg ttaccagagc 240
gtcctccaga agggactgcc ggctcaacga cggacacggc ccaagaacgt cctggtcatc 300
ggcgccggcc cggccgggct ggtggccgcc tggttgctga agagggcagg tcaccgggtg 360
acggtgctgg aggccaacgg caaccgagcg ggcggacgcg tcaagacctt ccggagcggt 420
ggccacgaac gcgccgagca gcccttcgcc gatccccgtc agtacgccga agcgggcgcg 480
atgcgcatcc cgggcagcca ccccctggtg atggagctga tcgaccagtt cgagctgaag 540
aagcggcgtt tccactacgt cgacgtcgac agcgagggac gtcccgccaa ccgcacctgg 600
atccacgtca acggcatccg cgtgcggcgc gccgactacg cccgcgcgcc ccggcgcgtg 660
aaccggtcct tcggtgtccc ccgggcccac tgggacaccc ccgccgccgc catcctgcgc 720
tccgtgctgg acccggtgcg cgacgagttc agccgcgtcg gccgcgacgg caagcgggtc 780
gacaagccgc tcccggagcg gctgcagggc tgggcccggg tggtgcagcg cttcggtgac 840
tggtcgatgt tccgctttct caccgaacac gccggcctcg acgaacggac catcgacctg 900
atcggcaccc tggagaacct cacctcccgt ctccctctgt ccttcatcca cagcttcatc 960
ggctcctccc tcatcagccc cgacacgccc ttctacgagc tggagggcgg cacggccgta 1020
ctaccggacg ccctgctgga gcgcgtgcgc aaggacgtgc ggttcgaccg ccgtgtcacg 1080
cgcatccagt accaccaccc cgaccgcccg tcgccggacg tcgagcaggt ccggagcaag 1140
ggcccgcacg tgtgggtgga caccgtgtcg gagggccgcg acggacctgt cgtacgcgag 1200
cagttcaccg cggacgtcgc cgtggtcacg gtgccgttct ccggactgcg ccacgtacag 1260
atcgccccgc ccctgtcgta cggcaagcgt cgggcggtct gcgagttgca ctacgacagc 1320
gcgaccaagg tgctgctgga gttcagccgc cgctggtggg agttcgacga ggccgactgg 1380
aaacgggagc tgcgcgccgt cgacccgggg ctgtacgacg cctaccgcac cggccgggcc 1440
gccgcggacg gcagcctgct cggcgcccat ccctccgtgc ccgccgggca catcacagcg 1500
ggtcagcgca cccactacgc cgccaaccgc gcggtcgcgc gcgaccagcc ggaggccgtc 1560
gacgtcgtag ggggcggatc ggtgtcggac aacgccaacc ggttcatgtt ccatccctcc 1620
catccggttc cgggcagcgc cgggggcgtg gtcctggcct cctacagctg ggcggacgac 1680
gcgctgcgct gggactccct ggacgacgag gcacggtacc cccacgctct gtgcggcctc 1740
cagcaggtct acggccagcg catcgaggtc ttctacaccg gcgcgggccg cacgcagagc 1800
tggttgcgcg acccctacgc ctacggagag gcgtccgtgc tcctgcccgg gcagcacacg 1860
gagttgttgt ccgccatccc cgtggctgag gggccgttgc acttcgccgg ggaccacacg 1920
tccgtcaagc cggcatggat cgagggagct gtggagtccg ccgtgcgtgc cgccttggag 1980
atccacacag cgtga 1995
<210> 3
<211> 240
<212> PRT
<213> 枯草芽孢杆菌Bacillus subtilis (CCTCC:M2013373)
<400> 3
Met Lys Met Ser Gly Phe Ser Ile Glu Glu Lys Val His Glu Phe Glu
1 5 10 15
Ser Lys Gly Phe Leu Glu Ile Ser Asn Glu Ile Phe Leu Gln Glu Glu
20 25 30
Glu Asn His Arg Leu Leu Thr Gln Ala Gln Leu Asp Tyr Tyr Asn Leu
35 40 45
Glu Asp Asp Ala Tyr Gly Glu Cys Arg Ala Gly Ser Tyr Ser Arg Tyr
50 55 60
Ile Lys Tyr Val Asp Ser Pro Asp Tyr Ile Leu Asp Asn Ser Asn Asp
65 70 75 80
Tyr Phe Gln Ser Lys Glu Tyr Asn Tyr Asp Asp Gly Gly Lys Val Arg
85 90 95
Gln Phe His Ser Ile Asn Asp Ser Phe Leu Tyr Asn Pro Leu Ile Gln
100 105 110
Asn Ile Val Arg Phe Asp Thr Glu Phe Ala Phe Lys Thr Asn Ile Ile
115 120 125
Asp Thr Ser Lys Asp Leu Ile Ile Gly Leu His Gln Val Arg Tyr Lys
130 135 140
Ala Thr Lys Glu Arg Pro Ser Phe Ser Ser Pro Ile Trp Leu His Lys
145 150 155 160
Asp Asp Glu Pro Val Val Phe Leu His Leu Met Asn Leu Ser Asn Thr
165 170 175
Ala Ile Gly Gly Asp Asn Leu Ile Ala Asn Ser Pro Arg Glu Ile Asn
180 185 190
Gln Phe Ile Ser Leu Lys Glu Pro Leu Glu Thr Leu Val Phe Gly Gln
195 200 205
Lys Val Phe His Ala Val Thr Pro Leu Gly Thr Glu Cys Ser Thr Glu
210 215 220
Ala Phe Arg Asp Ile Leu Leu Val Thr Phe Ser Tyr Lys Glu Thr Lys
225 230 235 240
<210> 4
<211> 664
<212> PRT
<213> 加纳链霉菌Streptomyces ghanaensis (ATCC14672)
<400> 4
Met Thr Glu Asp His Ala Val Val Arg Ser Asp Gly Gly Leu Ser Arg
1 5 10 15
Arg Ser Phe Ala Ala Val Ala Gly Thr Ala Thr Val Ala Thr Ala Leu
20 25 30
Thr Ser Gly Val Ala Ala Ala Leu Pro Ala Pro Ala Ala Ser Gly Asp
35 40 45
Ser Arg Gly Ala Asp Phe Asp Arg Cys Leu Ala Val Ala Arg Ala Leu
50 55 60
Leu Val Leu Asp Ser Asp Asp Arg Pro Leu Val Pro Arg Tyr Gln Ser
65 70 75 80
Val Leu Gln Lys Gly Leu Pro Ala Gln Arg Arg Thr Arg Pro Lys Asn
85 90 95
Val Leu Val Ile Gly Ala Gly Pro Ala Gly Leu Val Ala Ala Trp Leu
100 105 110
Leu Lys Arg Ala Gly His Arg Val Thr Val Leu Glu Ala Asn Gly Asn
115 120 125
Arg Ala Gly Gly Arg Val Lys Thr Phe Arg Ser Gly Gly His Glu Arg
130 135 140
Ala Glu Gln Pro Phe Ala Asp Pro Arg Gln Tyr Ala Glu Ala Gly Ala
145 150 155 160
Met Arg Ile Pro Gly Ser His Pro Leu Val Met Glu Leu Ile Asp Gln
165 170 175
Phe Glu Leu Lys Lys Arg Arg Phe His Tyr Val Asp Val Asp Ser Glu
180 185 190
Gly Arg Pro Ala Asn Arg Thr Trp Ile His Val Asn Gly Ile Arg Val
195 200 205
Arg Arg Ala Asp Tyr Ala Arg Ala Pro Arg Arg Val Asn Arg Ser Phe
210 215 220
Gly Val Pro Arg Ala His Trp Asp Thr Pro Ala Ala Ala Ile Leu Arg
225 230 235 240
Ser Val Leu Asp Pro Val Arg Asp Glu Phe Ser Arg Val Gly Arg Asp
245 250 255
Gly Lys Arg Val Asp Lys Pro Leu Pro Glu Arg Leu Gln Gly Trp Ala
260 265 270
Arg Val Val Gln Arg Phe Gly Asp Trp Ser Met Phe Arg Phe Leu Thr
275 280 285
Glu His Ala Gly Leu Asp Glu Arg Thr Ile Asp Leu Ile Gly Thr Leu
290 295 300
Glu Asn Leu Thr Ser Arg Leu Pro Leu Ser Phe Ile His Ser Phe Ile
305 310 315 320
Gly Ser Ser Leu Ile Ser Pro Asp Thr Pro Phe Tyr Glu Leu Glu Gly
325 330 335
Gly Thr Ala Val Leu Pro Asp Ala Leu Leu Glu Arg Val Arg Lys Asp
340 345 350
Val Arg Phe Asp Arg Arg Val Thr Arg Ile Gln Tyr His His Pro Asp
355 360 365
Arg Pro Ser Pro Asp Val Glu Gln Val Arg Ser Lys Gly Pro His Val
370 375 380
Trp Val Asp Thr Val Ser Glu Gly Arg Asp Gly Pro Val Val Arg Glu
385 390 395 400
Gln Phe Thr Ala Asp Val Ala Val Val Thr Val Pro Phe Ser Gly Leu
405 410 415
Arg His Val Gln Ile Ala Pro Pro Leu Ser Tyr Gly Lys Arg Arg Ala
420 425 430
Val Cys Glu Leu His Tyr Asp Ser Ala Thr Lys Val Leu Leu Glu Phe
435 440 445
Ser Arg Arg Trp Trp Glu Phe Asp Glu Ala Asp Trp Lys Arg Glu Leu
450 455 460
Arg Ala Val Asp Pro Gly Leu Tyr Asp Ala Tyr Arg Thr Gly Arg Ala
465 470 475 480
Ala Ala Asp Gly Ser Leu Leu Gly Ala His Pro Ser Val Pro Ala Gly
485 490 495
His Ile Thr Ala Gly Gln Arg Thr His Tyr Ala Ala Asn Arg Ala Val
500 505 510
Ala Arg Asp Gln Pro Glu Ala Val Asp Val Val Gly Gly Gly Ser Val
515 520 525
Ser Asp Asn Ala Asn Arg Phe Met Phe His Pro Ser His Pro Val Pro
530 535 540
Gly Ser Ala Gly Gly Val Val Leu Ala Ser Tyr Ser Trp Ala Asp Asp
545 550 555 560
Ala Leu Arg Trp Asp Ser Leu Asp Asp Glu Ala Arg Tyr Pro His Ala
565 570 575
Leu Cys Gly Leu Gln Gln Val Tyr Gly Gln Arg Ile Glu Val Phe Tyr
580 585 590
Thr Gly Ala Gly Arg Thr Gln Ser Trp Leu Arg Asp Pro Tyr Ala Tyr
595 600 605
Gly Glu Ala Ser Val Leu Leu Pro Gly Gln His Thr Glu Leu Leu Ser
610 615 620
Ala Ile Pro Val Ala Glu Gly Pro Leu His Phe Ala Gly Asp His Thr
625 630 635 640
Ser Val Lys Pro Ala Trp Ile Glu Gly Ala Val Glu Ser Ala Val Arg
645 650 655
Ala Ala Leu Glu Ile His Thr Ala
660
- 多酶体系供给α-酮戊二酸及其用于合成4-羟基异亮氨酸
- 用于立体选择性生产(4S)-3-(5S)-5-(4-氟苯基)-5-羟基戊酰基-4-苯基-1,3-噁唑烷-2-酮的酮还原酶多肽
