一种泡沫分离β-葡萄糖苷酶融合蛋白的方法
文献发布时间:2023-06-19 13:48:08
技术领域
本发明属于重组蛋白分离纯化领域,具体公开了一种泡沫分离β-葡萄糖苷酶融合蛋白的方法。
背景技术
β-葡萄糖苷酶(β-Glu)是一种能够水解结合于末端非还原性的β-D-葡萄糖苷键的水解酶,它可以将植物中的一些风味前体物质分解为拥有自然气味的香气物质,还可以协助其它纤维素酶降解纤维素。此外,它还参与生物体的糖代谢,对维持生物体的正常生理功能具有重要作用。因此,研究分离纯化β-Glu 具有重要的现实意义。
目前常用的分离纯化β-Glu的方法主要有:硫酸铵/丙酮分级沉淀、凝胶过滤、葡聚糖凝胶柱层析、高效液相色谱和DEAE阴离子交换层析等方法。这些方法的缺陷在于需要多种方法结合使用,单一的方法并不能完成β-Glu的分离纯化。这些方法操作工艺复杂,且成本较高,产量和纯化倍数较低,因而具有一定的局限性。
发明内容
针对现有技术不足,本发明提供一种运用疏水性标签性能构建泡沫分离体系,同时结合融合酶的温敏性能进行ITC从而对β-Glu融合蛋白进行分离纯化的方法。
本发明包括以下技术方案:
一种泡沫分离β-葡萄糖苷酶融合蛋白的方法,包括以下步骤:
S1.制备含有融合蛋白GLEGB的粗酶液:构建表达融合蛋白GLEGB的质粒,转入表达菌中诱导表达;破碎菌体后离心取上清,即为含有融合蛋白GLEGB的粗酶液;所述融合蛋白GLEGB为将类弹性蛋白ELP,石墨烯结合肽GB用连接肽 linker连接至葡萄糖苷酶Glu所融合形成的Glu-linker-ELP-GB融合蛋白 GLEGB;
S2.粗酶液的泡沫性能测定;使用泡沫分析仪分析不同浓度粗酶液样品泡沫高度和泡沫形态随时间的变化;
S3.使用泡沫分离设备初步分离纯化粗酶液中的融合蛋白GLEGB;
S4.结合ITC对融合蛋白GLEGB的进一步分离纯化。
进一步的,上述一种泡沫分离β-葡萄糖苷酶融合蛋白的方法,所述步骤 S1中,所述Glu的氨基酸序列如SEQ.ID.NO.1所示;所述linker的氨基酸序列如SEQ.ID.NO.2所示;所述ELP的氨基酸序列如SEQ.ID.NO.3所示;所述GB 的氨基酸序列如SEQ.ID.NO.4所示。
进一步的,上述一种泡沫分离β-葡萄糖苷酶融合蛋白的方法,所述步骤 S1中,所述构建的表达融合蛋白GLEGB的质粒为pET-GLEGB,所述表达菌为大肠杆菌BL21。
进一步的,上述一种泡沫分离β-葡萄糖苷酶融合蛋白的方法,所述步骤 S2中,粗酶液的泡沫性能测定包括以下步骤:将一定体积的待测溶液缓慢倒入 DFA-100泡沫分析仪中,打开鼓气装置,固定气速鼓气一定时间后,将其关闭;等待泡沫消泡;测量过程中,调整发酵液的浓度,用泡沫分析仪器软件ADVANCE 在线记录各样品泡沫高度和泡沫形态随时间的变化。
进一步的,上述一种泡沫分离β-葡萄糖苷酶融合蛋白的方法,步骤S3 中的泡沫分离设备包括空气压缩机、气体流量计、进料口、阀门、泡沫分离柱、残留液体出口和泡沫收集装置;所述气体流量计的输入端与空气压缩机用软管相连,输出端与泡沫分离柱底端相连;所述进料口通过所述阀门连通所述泡沫分离柱侧壁的中上部;所述残留液体出口设置在所述泡沫分离柱的下方的侧壁上,所述泡沫收集装置位于泡沫分离柱的顶端出口处。
进一步的,上述一种泡沫分离β-葡萄糖苷酶融合蛋白的方法,所述泡沫分离柱可以连接循环水浴以控制其温度,其材质为有机玻璃,且泡沫分离柱的直径为30mm,高度为600mm,其内部设有气体分布器,孔径为200μm。
进一步的,上述一种泡沫分离β-葡萄糖苷酶融合蛋白的方法,所述步骤 S3具体包括以下步骤:
取适量的GLEGB粗酶液将其用50mM,pH8.0的Tris-HCl缓冲溶液稀释为一定的蛋白浓度,将稀释后的酶液注入泡沫分离柱,打开气体流量计,设置合适的气体流速,进行泡沫分离,收集泡沫,直到泡沫不能连续鼓出时停止收集;将收集到的泡沫进行破泡处理,之后准确记录消泡液的体积并测定蛋白浓度和比酶活。
进一步的,上述一种泡沫分离β-葡萄糖苷酶融合蛋白的方法,所述步骤 S3还包括如下工艺:
a.实验为间歇操作,采用GLEGB粗酶液为研究对象,用50mM,pH8.0 的Tris-HCl缓冲溶液将其浓度稀释为0.3g/L,作为泡沫分离的进料液;
b.一定浓度的GLEGB粗酶液从泡沫分离柱的进料口注入,进液量为200 ml,气速为300ml/min,实验的温度维持在25℃;
c.该分离技术的分离效果由富集比E、回收率R,纯化倍数PF和酶活回收率Ye来表示,如下式所示:
式中,C
进一步的,上述一种泡沫分离β-葡萄糖苷酶融合蛋白的方法,所述步骤 S4具体包括以下步骤:
将一定量的硫酸铵加入到从步骤S3中收集的泡沫液中进行ITC进一步纯化融合蛋白GLEGB,水浴加热一定时间后离心弃上清,用Tris-HCl缓冲液重悬沉淀,在低温下孵育一定时间,离心收集上清液,此上清液即为纯化的目标酶溶液。
在本发明中的泡沫分离中,融合蛋白GLEGB依靠GB标签的疏水作用吸附在气泡表面,气泡离开液相并相互聚集在液相上方形成泡沫层,收集泡沫并将其消泡得到消泡液,从而实现了融合蛋白GLEGB与液相主体的分离。本发明通过GB和ELP标签与β-Glu融合,利用GB标签的疏水作用和ELP标签的温敏特性对融合蛋白进行纯化。
进一步的,由上述方法制备获得的β-葡萄糖苷酶融合蛋白。
本发明具有以下有益效果:
1、在本发明中,目标物质是融合蛋白GLEGB,即在β-Glu中加入了一种二元标签,ELP和GB。ELP是合成的基于肽的聚合物,是热响应性多肽,其在临界温度以上会发生可逆聚集,此温度称为相变温度(Tt)。而当温度低于Tt时, ELP再次变得可溶。重组ELP融合蛋白会继续维持ELP的可逆相变特性,这种特性被用于蛋白纯化,称为可逆相变循环(inversetransition cycling,ITC)。石墨烯结合肽(GB)His-Asn-Trp-Tyr-His-Trp-Trp-Pro-His由于其富含疏水性芳香族氨基酸残基而使自身表面具有强亲和力,因而可吸附在气泡表面,可用于疏水性或表面活性较差的目标物的分离纯化,因此在泡沫分离中可以提高分离效率。
2、泡沫分离技术因具有能耗低,操作简单和无污染等特点日益受到研究者的重视,该技术需要满足两个条件:一是目标物质具有表面活性或具有与表面活性剂相结合的能力,从而可以吸附到气泡表面;二是液相主体中可以产生大量稳定的微气泡,目标物质可以吸附在气泡表面,形成泡沫后将其与主体液相分离即可。本发明利用GB标签的疏水性对融合蛋白进行分离纯化,GB标签可连带融合酶吸附在气泡表面,使融合酶随气泡进入到泡沫相,收集泡沫便可达到分离纯化的目的。仅使用泡沫分离技术,目标蛋白的富集比富集比E为1.18,回收率R 为83.72%,纯化倍数PF为1.15,酶活回收率Ye为96.23%。
3、本发明通过泡沫分离与ITC相结合,对融合酶GLEGB进行两步纯化,大大提高了纯化效率,最终目标酶的纯化倍数PF高达35.16。且整个纯化过程操作简单,成本低,无污染。
附图说明
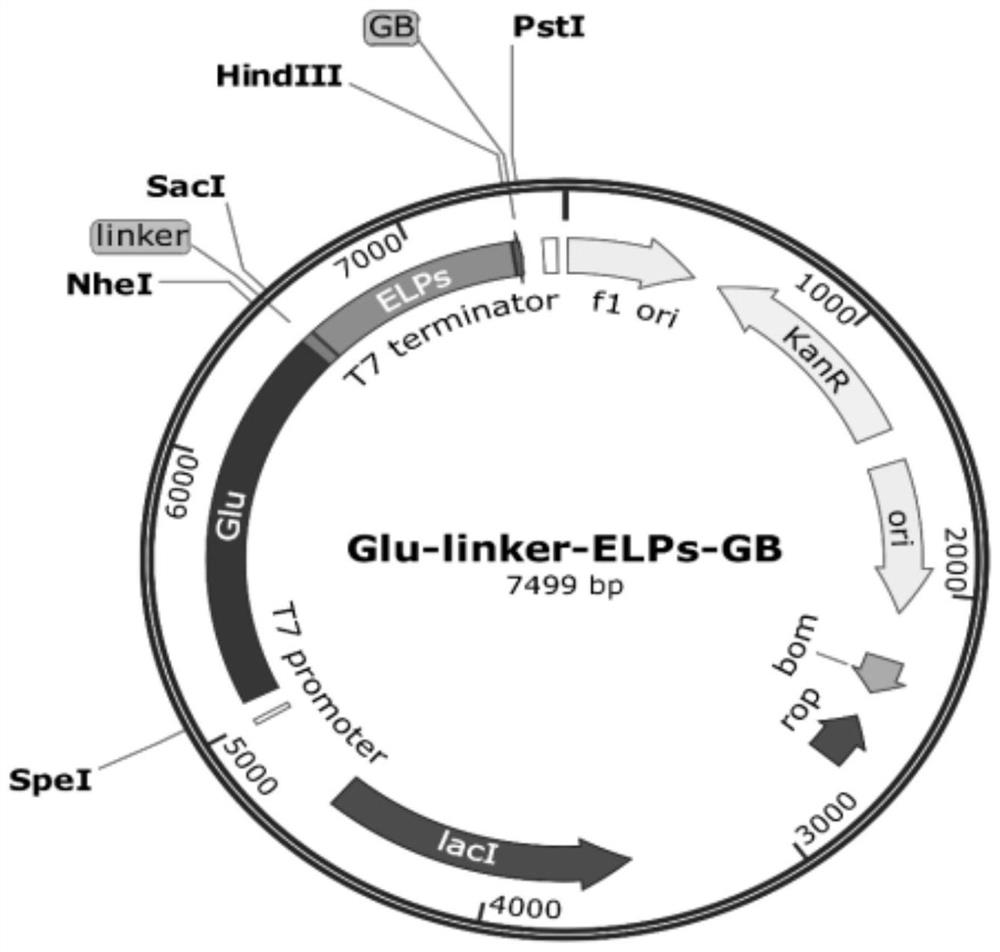
图1是重组质粒pET-GLEGB(含有ELP和GB标签)的结构示意图;
图2是不同浓度GLEGB融合蛋白的最大泡沫高度和泡沫半衰期随时间变化的曲线;
图3是泡沫分离设备示意图;其中:1空气压缩机、2气体流量计、3进料口、4 阀门、5泡沫分离柱、6残留液体出口、7泡沫收集装置;
图4是泡沫分离结合ITC分离纯化GLEGB融合蛋白的SDS-PAGE凝胶电泳图,其中:泳道M:分子量标准蛋白;
泳道1:含有空载体pET28a(+)的BL21诱导表达后裂解液的上清;
泳道2:0.3g/L的进料液;
泳道3:0.3g/L的进料液产生的泡沫液;
泳道4:进料液使用0.3M的(NH
泳道5:进料液使用0.5M的(NH
泳道6:进料液使用0.7M的(NH
泳道7:进料液使用1.0M的(NH
泳道8:泡沫液使用0.3M的(NH
泳道9:泡沫液使用0.5M的(NH
泳道10:泡沫液使用0.7M的(NH
泳道11:泡沫液使用1.0M的(NH
具体实施方式
下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。本发明中所述的适量,为本领域内普通技术人员根据国家技术规范和生产实际情况所决定的用量。本发明中所述的原料如无特殊说明,均为商业购得。
总体实施方式如下:
(1)制备融合蛋白GLEGB的粗酶液
编码设计ELP(elastin-like polypeptides,类弹性蛋白)氨基酸序列和 GB(Graphene binding,石墨烯结合肽)多肽,用连接肽linker连接至葡萄糖苷酶(Glu),构建重组质粒pET-GLEGB(这里的GLEGB为Glu-linker-ELP-GB的简写);在大肠杆菌BL21细胞中进行重组质粒的诱导表达。首先挑取目标转化体的单克隆菌于含有卡那霉素的LB液体培养基中,在37℃,200rpm下过夜培养。将活化后的菌株按照1:100的比例再接种到含有卡那抗生素的液体LB培养基中扩大培养4h。将其取出在冰上静置20min,加入终浓度为0.2mM的异丙基-β-D-硫代吡喃半乳糖苷(IPTG)诱导剂,25℃,200rpm条件下培养16h。大量细菌液体在4℃,3000rpm下离心40min,收集沉淀,加入预冷的Tris-HCl 缓冲液(50mM,pH8.0)重悬沉淀后再次以同样的条件离心,弃去上清,洗涤两次。将洗涤后的菌体沉淀加入适量50mM,pH8.0Tris-HCl缓冲液重悬菌体,加入终浓度为1mM的PMSF在冰水浴下进行超声破碎。在4℃,10000rpm下离心10min,将上清液移至新的离心管内,再次离心,尽量完全分离上清和沉淀。此上清液即为GLEGB粗酶液。
(2)GLEGB粗酶液的泡沫性能测定
将一定体积的待测溶液缓慢倒入DFA-100泡沫分析仪中,打开鼓气装置,固定气速鼓气一定时间后,将其关闭。等待泡沫消泡。测量过程中,调整发酵液的浓度,用泡沫分析仪器软件ADVANCE在线记录各样品泡沫高度和泡沫形态随时间的变化。
(3)泡沫分离对融合蛋白GLEGB的分离纯化
泡沫分离设备主要包括空气压缩机1、气体流量计2、泡沫分离柱5和泡沫收集装置7,所述气体流量计2的输入端与空气压缩机1用软管相连,输出端与泡沫分离柱5底端相连,所述泡沫分离柱5连接循环水浴以控制柱温,所述泡沫收集装置7位于泡沫分离柱5的顶端出口处。取适量的GLEGB粗酶液将其用50mM, pH8.0的Tris-HCl缓冲溶液稀释为一定的蛋白浓度,将稀释后的酶液注入泡沫分离柱5,打开气体流量计2,设置合适的气体流速,进行泡沫分离,收集泡沫,直到泡沫不能连续鼓出时停止收集。将收集到的泡沫进行破泡处理,之后准确记录消泡液的体积并测定蛋白浓度和比酶活。
优选的,所述泡沫分离柱5可以连接循环水浴以控制其温度,其材质为有机玻璃,且泡沫分离柱的直径为30mm,高度为600mm,气体分布器的孔径为200 μm。
优选的,所述工艺的具体过程如下:
a.实验为间歇操作,采用GLEGB粗酶液为研究对象,用50mM,pH8.0的 Tris-HCl缓冲溶液将其浓度稀释为0.3g/L,作为泡沫分离的进料液;
b.一定浓度的GLEGB粗酶液从泡沫分离柱的顶端注入,进液量为200ml,气速为300ml/min,实验的温度维持在25℃。
c.该分离技术的分离效果由富集比E、回收率R,纯化倍数PF和酶活回收率 Ye来表示。
式中,C
(4)泡沫分离结合ITC(可逆相变循环)对融合蛋白GLEGB的分离纯化
将一定量的硫酸铵加入到从步骤(3)中收集的泡沫液中进行ITC进一步纯化融合蛋白GLEGB,水浴加热一定时间后离心弃上清。用Tris-HCl缓冲液重悬沉淀,在低温下孵育一定时间,离心收集上清液,此时上清液即为纯化的目标酶溶液。
其中:硫酸铵加入到泡沫液中,使硫酸铵的终浓度为0.3~1.0M。
水浴加热时间为10min,温度25℃。
两次离心条件均为:12000rpm,15min。
Tris-HCl缓冲液:使用前需预冷,50mM,pH8.0。
重悬后的溶液孵育条件:4℃,30min。
在本发明中的泡沫分离中,融合蛋白GLEGB依靠GB标签的疏水作用吸附在气泡表面,气泡离开液相并相互聚集在液相上方形成泡沫层,收集泡沫并将其消泡得到消泡液,从而实现了融合蛋白GLEGB与液相主体的分离。本发明通过GB 和ELP标签与β-Glu融合,利用GB标签的疏水作用和ELP标签的温敏特性对融合蛋白进行纯化。
实施例1
(1)融合蛋白GLEGB的诱导表达
编码设计ELP氨基酸序列,表示为ELP(VPGVG)50,插入GB多肽,用连接肽linker连接至Glu,构建重组质粒pET-GLEGB(Glu-linker-ELP-GB)。
图1为重组质粒pET-GLEGB(含有ELP和GB标签)的结构示意图。
所述Glu的氨基酸序列如SEQ.ID.NO.1所示;所述linker的氨基酸序列如SEQ.ID.NO.2所示;所述ELP的氨基酸序列如SEQ.ID.NO.3所示;所述GB的氨基酸序列如SEQ.ID.NO.4所示。各氨基酸序列如下:
SEQ.ID.NO.1(Glu):
MDDVDNDTLVTFPDDFKLGAATASYQIEGGWDADGKGPNIWDTLTHERPHLVVDRSTGDVADDSY HLYLEDVRLLKDMGAEVYRFSISWARILPEGHDNNVNEAGIEYYNKLIDALLRNGIEPMVTMYHWDLPQ KLQDLGGWPNRILAKYAENYARVLFSNFGDRVKQWLTFNEPLTFMDAYASDTGMAPSVDTPGIGDYLTA HTVILAHANIYRLYEREFREEQQGQVGIALNIHWCEPETGSPKDVEACERYQQFNLGIYAHPIFSENGD YPSVLKARVDANSASEGYTTSRLPKFTPEEVAFVNGTYDFLGLNFYTAVVGRDGVEGEPPSRYRDMGTI TSQDPEWPESASSWLRVVPWGFRKELNWIANEYGNPPIFITENGFSDYGGVNDTNRVLYYTEHLKEMLK AIHIDGVNVIGYTAWSLIDNFEWLRGYTERFGIHAVNFIDPSRPRTPKESARVLTEIFKTRQIPERFRD AS
SEQ.ID.NO.2(linker):GGGGSGGGGSGGGGSEL
SEQ.ID.NO.3(ELP):
VPGVGVPGVGVPGVGVPGVGVPGVGVPGVGVPGVGVPGVGVPGVGVPGVGVPGVGVPGVGVPGVG VPGVGVPGVGVPGVGVPGVGVPGVGVPGVGVPGVGVPGVGVPGVGVPGVGVPGVGVPGVGVPGVGVPGV GVPGVGVPGVGVPGVGVPGKGVPGVGVPGVGVPGVGVPGVGVPGVGVPGVGVPGVGVPGVGVPGVGVPG VGVPGVGVPGVGVPGVGVPGVGVPGVGVPGVGVPGVGVPGVGVPGVGKL
SEQ.ID.NO.4(GB):HNWYHWWPH
在大肠杆菌BL21细胞中进行重组质粒的诱导表达:首先挑取目标转化体的单克隆菌接种于3mL卡那霉素浓度为50ug/mL的LB液体培养基中,于25℃、 200rpm下培养12h。取活化后的菌液2mL转接至200mL含卡那霉素浓度为 50ug/mL的LB液体培养基中扩大培养4h。将菌液置于冰上静置20min,并加入IPTG使溶液终浓度达到0.2mM,25℃,200rpm下培养16h。而后于4℃, 3000rpm离心4 0min收集菌体沉淀。并用预冷的50mM,pH8.0的Tris-HCl缓冲液悬浮沉淀,以同样的条件离心去除上清,洗涤两次。将洗涤后的菌体沉淀加入适量50mM,pH8.0Tris-HCl缓冲液重悬菌体,加入终浓度为1mM的PMSF 在冰水浴下进行超声破碎。之后在4℃,10000rpm下离心10min,将上清液移至新的离心管内,再次离心,尽量完全分离上清和沉淀。收集上清液至新的 EP管中于-80℃下保存。得到的菌体若不立即破碎,需置于-80℃冰箱保存。
超声破碎仪的参数设置为:功率35W,破碎时间6s,间隔时间6s,总工作时间25min。
(2)GLEGB粗酶液的泡沫性能测定
取50ml的一定浓度的GLEGB粗酶液缓慢倒入DFA-100泡沫分析仪中,打开鼓气装置,固定气速为300ml/min,鼓气25s后,将其关闭。等待泡沫消泡,用泡沫分析仪器软件ADVANCE在线记录各样品泡沫高度和泡沫形态随时间的变化。测量过程中,调整粗酶液的浓度分别为0.1g/L、0.3g/L、1.0g/L、2.0g/L、 3.27g/L(原浓度),分别记录各样品泡沫高度和泡沫形态随时间的变化。
通常用最大泡沫高度和泡沫半衰期来表征待分离物质的起泡性和泡沫稳定性,其中泡沫半衰期是指泡沫高度降低到初始高度的一半所用的时间。图2是不同浓度GLEGB融合蛋白的最大泡沫高度和泡沫半衰期随时间变化的曲线。随着蛋白浓度的增加,最大泡沫高度和泡沫半衰期逐渐升高。这是因为随着蛋白浓度的增加,会有更多的表面活性物质吸附在气液界面,液膜的厚度变厚,气泡小而密集,比较稳定,不利于泡沫排液,气泡破裂速度较慢,所以最大泡沫高度和泡沫半衰期逐渐升高。通过表征GLEGB粗酶液的起泡性和泡沫稳定性,可以看出该酶液适合作为泡沫分离的目标物质。
(3)泡沫分离对融合蛋白GLEGB的分离纯化
图3是泡沫分离设备示意图。循环水浴温度设置为25℃,用50mM,pH8.0 的Tris-HCl缓冲溶液将GLEGB粗酶液稀释为0.3g/L的蛋白浓度,取200ml 该浓度的酶液注入泡沫分离柱5,打开气阀气体流量计2,设置气体流速为300 ml/min,进行浮选,从泡沫分离柱5顶端收集泡沫,直到泡沫不能连续鼓出时停止收集。将收集到的泡沫进行破泡处理,之后准确记录消泡液的体积并测定蛋白浓度和比酶活。测定富集比E为1.18,回收率R为83.72%,纯化倍数PF为1.15,酶活回收率Ye为96.23%。
(4)泡沫分离结合ITC对融合蛋白GLEGB的分离纯化
取泡沫液2mL,加入0.132g硫酸铵使酶液中硫酸铵浓度为0.5M,使其溶解。之后将混合液在25℃下孵育10min,12000rpm条件下离心15min 除去上清。再用预冷的Tris-HCl缓冲液(50mM,pH8.0)重悬沉淀,并将重悬后的溶液在4℃下孵育30min,再次于12000rpm条件离心15min,将上清液转移至新的离心管中。此时上清液即为最终纯化的目标酶溶液。
对使用不同浓度(NH
泳道1:含有空载体pET28a(+)的BL21诱导表达后裂解液的上清;
泳道2:0.3g/L的进料液;
泳道3:0.3g/L的进料液产生的泡沫液;
泳道4:进料液使用0.3M的(NH
泳道5:进料液使用0.5M的(NH
泳道6:进料液使用0.7M的(NH
泳道7:进料液使用1.0M的(NH
泳道8:泡沫液使用0.3M的(NH
泳道9:泡沫液使用0.5M的(NH
泳道10:泡沫液使用0.7M的(NH
泳道11:泡沫液使用1.0M的(NH
重组酶GLEGB的分子量约为78kDa,与图2中泳道4至11的结果一致,这说明重组酶GLEGB被成功分离。测得(NH
对比例1:
(1)融合蛋白GLEGB的诱导表达
按照实施例1中步骤(1)的方法进行融合蛋白GLEGB的诱导表达,获得GLEGB 粗酶液。
(2)GLEGB粗酶液的泡沫性能测定
按照实施例1中步骤(2)的方法进行不同浓度GLEGB粗酶液的泡沫性能测定,通过表征GLEGB粗酶液的起泡性和泡沫稳定性,可以看出该酶液适合作为泡沫分离的目标物质。
(3)泡沫分离对融合蛋白GLEGB的分离纯化
循环水浴温度设置为25℃,用50mM,pH8.0的Tris-HCl缓冲溶液将GLEGB 粗酶液稀释为0.1~0.5g/L的蛋白浓度,取200ml该浓度的酶液注入分离柱,打开气阀,设置气体流速为300ml/min,进行浮选,从泡沫分离柱顶端收集泡沫,直到泡沫不能连续鼓出时停止收集。将收集到的泡沫进行破泡处理,之后准确记录消泡液的体积并测定蛋白浓度和比酶活。实验结果如表1所示。
表1蛋白浓度对泡沫分离效果的影响
由以上数据可知,随着蛋白浓度升高,基本上富集比和纯化倍数越来越低,回收率和酶活回收率越来越高,浓度较高时差别较小。这是因为蛋白浓度越高,酶液的起泡性越强,更多的目标物质吸附在气泡表面,故回收率和酶活回收率越来越高,液膜的厚度变厚,气泡小而密集,比较稳定,不利于泡沫排液,气泡破裂速度较慢,使得富集比和纯化倍数越来越低。当蛋白浓度较高而又浓度差较小时,其起泡性和泡沫稳定性差别不大,故泡沫分离效果差别不大。综合各因素考虑,蛋白质浓度选取0.3g/L比较合适。
对比例2:
(1)融合蛋白GLEGB的诱导表达
按照实施例1中步骤(1)的方法进行融合蛋白GLEGB的诱导表达,获得GLEGB 粗酶液。
(2)GLEGB粗酶液的泡沫性能测定
按照实施例1中步骤(2)的方法进行不同浓度GLEGB粗酶液的泡沫性能测定,通过表征GLEGB粗酶液的起泡性和泡沫稳定性,可以看出该酶液适合作为泡沫分离的目标物质。
(3)泡沫分离对融合蛋白GLEGB的分离纯化
循环水浴温度设置为25℃,用50mM,pH8.0的Tris-HCl缓冲溶液将GLEGB 粗酶液稀释为0.3g/L的蛋白浓度,取50~250ml该浓度的酶液注入分离柱,打开气阀,设置气体流速为300ml/min,进行浮选,从泡沫分离柱顶端收集泡沫,直到泡沫不能连续鼓出时停止收集。将收集到的泡沫进行破泡处理,之后准确记录消泡液的体积并测定蛋白浓度和比酶活。实验结果如表2所示。
表2进液量对泡沫分离效果的影响
由以上数据可知,随着进液量增加,基本上富集比和纯化倍数越来越低,回收率和酶活回收率越来越高。这是因为进液量越多,目标物质会有更长的时间充分吸附在气泡表面,泡沫排液的时间越短,因此富集比和纯化倍数基本上越来越低,回收率和酶活回收率越来越高。综合各因素考虑,进液量选取200ml比较合适。
对比例3:
(1)融合蛋白GLEGB的诱导表达
按照实施例1中步骤(1)的方法进行融合蛋白GLEGB的诱导表达,获得GLEGB 粗酶液。
(2)GLEGB粗酶液的泡沫性能测定
按照实施例1中步骤(2)的方法进行不同浓度GLEGB粗酶液的泡沫性能测定,通过表征GLEGB粗酶液的起泡性和泡沫稳定性,可以看出该酶液适合作为泡沫分离的目标物质。
(3)泡沫分离对融合蛋白GLEGB的分离纯化
循环水浴温度设置为25℃,用50mM,pH8.0的Tris-HCl缓冲溶液将GLEGB 粗酶液稀释为0.3g/L的蛋白浓度,取200ml该浓度的酶液注入泡沫分离柱5,打开气体流量计2,设置气体体积流速为100~600ml/min,进行浮选,从泡沫分离柱5顶端收集泡沫,直到泡沫不能连续鼓出时停止收集。将收集到的泡沫进行破泡处理,之后准确记录消泡液的体积并测定蛋白浓度和比酶活。实验结果如表3所示。
表3气体体积流速对泡沫分离效果的影响
由以上数据可知,随着气体体积流速的增加,富集比和纯化倍数基本上越来越低,回收率和酶活回收率基本上越来越高。这是因为气体体积流速越快,泡沫排液的时间越短,大量的目标物质连同间隙液一起进入泡沫液中,因此富集比和纯化倍数基本上越来越低,回收率和酶活回收率越来越高。综合各因素考虑,气体体积流速选取300ml/min比较合适。
对比例4:
(1)融合蛋白GLEGB的诱导表达
按照实施例1中步骤(1)的方法进行融合蛋白GLEGB的诱导表达,获得GLEGB 粗酶液。
(2)GLEGB粗酶液的泡沫性能测定
按照实施例1中步骤(2)的方法进行不同浓度GLEGB粗酶液的泡沫性能测定,通过表征GLEGB粗酶液的起泡性和泡沫稳定性,可以看出该酶液适合作为泡沫分离的目标物质。
(3)泡沫分离对融合蛋白GLEGB的分离纯化
循环水浴温度设置为25~45℃,用50mM,pH8.0的Tris-HCl缓冲溶液将 GLEGB粗酶液稀释为0.3g/L的蛋白浓度,取200ml该浓度的酶液注入分离柱,打开气阀,设置气体流速为300ml/min,进行浮选,从泡沫分离柱顶端收集泡沫,直到泡沫不能连续鼓出时停止收集。将收集到的泡沫进行破泡处理,之后准确记录消泡液的体积并测定蛋白浓度和比酶活。实验结果如表4所示。
表4温度对泡沫分离效果的影响
由以上数据可知,随着温度的升高,富集比和纯化倍数基本上越来越高,回收率和酶活回收率基本上越来越低。这是因为温度越高,分子的热运动加剧,气泡表面吸附的分子相对减少,液膜厚度会变薄,而且溶液粘度下降,气体更容易在气泡间扩散,导致气泡增大,比表面积减小,目标物质的吸附量减少,且促进了泡沫排液,因此富集比和纯化倍数基本上越来越高,回收率和酶活回收率基本上越来越低。综合各因素考虑,温度选取25℃比较合适。
以上仅为本发明的较佳实施例而已,不能以此限定本发明的保护范围,即大凡依本发明权利要求书及发明内容所做的简单的等效变化与修改,皆仍属于本发明专利申请的保护范围。
SEQUENCE LISTING
<110> 苏州健雄职业技术学院
<120> 一种泡沫分离β-葡萄糖苷酶融合蛋白的方法
<130> 2021
<160> 4
<170> PatentIn version 3.5
<210> 1
<211> 481
<212> PRT
<213> 人工
<400> 1
Met Asp Asp Val Asp Asn Asp Thr Leu Val Thr Phe Pro Asp Asp Phe
1 5 10 15
Lys Leu Gly Ala Ala Thr Ala Ser Tyr Gln Ile Glu Gly Gly Trp Asp
20 25 30
Ala Asp Gly Lys Gly Pro Asn Ile Trp Asp Thr Leu Thr His Glu Arg
35 40 45
Pro His Leu Val Val Asp Arg Ser Thr Gly Asp Val Ala Asp Asp Ser
50 55 60
Tyr His Leu Tyr Leu Glu Asp Val Arg Leu Leu Lys Asp Met Gly Ala
65 70 75 80
Glu Val Tyr Arg Phe Ser Ile Ser Trp Ala Arg Ile Leu Pro Glu Gly
85 90 95
His Asp Asn Asn Val Asn Glu Ala Gly Ile Glu Tyr Tyr Asn Lys Leu
100 105 110
Ile Asp Ala Leu Leu Arg Asn Gly Ile Glu Pro Met Val Thr Met Tyr
115 120 125
His Trp Asp Leu Pro Gln Lys Leu Gln Asp Leu Gly Gly Trp Pro Asn
130 135 140
Arg Ile Leu Ala Lys Tyr Ala Glu Asn Tyr Ala Arg Val Leu Phe Ser
145 150 155 160
Asn Phe Gly Asp Arg Val Lys Gln Trp Leu Thr Phe Asn Glu Pro Leu
165 170 175
Thr Phe Met Asp Ala Tyr Ala Ser Asp Thr Gly Met Ala Pro Ser Val
180 185 190
Asp Thr Pro Gly Ile Gly Asp Tyr Leu Thr Ala His Thr Val Ile Leu
195 200 205
Ala His Ala Asn Ile Tyr Arg Leu Tyr Glu Arg Glu Phe Arg Glu Glu
210 215 220
Gln Gln Gly Gln Val Gly Ile Ala Leu Asn Ile His Trp Cys Glu Pro
225 230 235 240
Glu Thr Gly Ser Pro Lys Asp Val Glu Ala Cys Glu Arg Tyr Gln Gln
245 250 255
Phe Asn Leu Gly Ile Tyr Ala His Pro Ile Phe Ser Glu Asn Gly Asp
260 265 270
Tyr Pro Ser Val Leu Lys Ala Arg Val Asp Ala Asn Ser Ala Ser Glu
275 280 285
Gly Tyr Thr Thr Ser Arg Leu Pro Lys Phe Thr Pro Glu Glu Val Ala
290 295 300
Phe Val Asn Gly Thr Tyr Asp Phe Leu Gly Leu Asn Phe Tyr Thr Ala
305 310 315 320
Val Val Gly Arg Asp Gly Val Glu Gly Glu Pro Pro Ser Arg Tyr Arg
325 330 335
Asp Met Gly Thr Ile Thr Ser Gln Asp Pro Glu Trp Pro Glu Ser Ala
340 345 350
Ser Ser Trp Leu Arg Val Val Pro Trp Gly Phe Arg Lys Glu Leu Asn
355 360 365
Trp Ile Ala Asn Glu Tyr Gly Asn Pro Pro Ile Phe Ile Thr Glu Asn
370 375 380
Gly Phe Ser Asp Tyr Gly Gly Val Asn Asp Thr Asn Arg Val Leu Tyr
385 390 395 400
Tyr Thr Glu His Leu Lys Glu Met Leu Lys Ala Ile His Ile Asp Gly
405 410 415
Val Asn Val Ile Gly Tyr Thr Ala Trp Ser Leu Ile Asp Asn Phe Glu
420 425 430
Trp Leu Arg Gly Tyr Thr Glu Arg Phe Gly Ile His Ala Val Asn Phe
435 440 445
Ile Asp Pro Ser Arg Pro Arg Thr Pro Lys Glu Ser Ala Arg Val Leu
450 455 460
Thr Glu Ile Phe Lys Thr Arg Gln Ile Pro Glu Arg Phe Arg Asp Ala
465 470 475 480
Ser
<210> 2
<211> 17
<212> PRT
<213> 人工
<400> 2
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu
1 5 10 15
Leu
<210> 3
<211> 252
<212> PRT
<213> 人工
<400> 3
Val Pro Gly Val Gly Val Pro Gly Val Gly Val Pro Gly Val Gly Val
1 5 10 15
Pro Gly Val Gly Val Pro Gly Val Gly Val Pro Gly Val Gly Val Pro
20 25 30
Gly Val Gly Val Pro Gly Val Gly Val Pro Gly Val Gly Val Pro Gly
35 40 45
Val Gly Val Pro Gly Val Gly Val Pro Gly Val Gly Val Pro Gly Val
50 55 60
Gly Val Pro Gly Val Gly Val Pro Gly Val Gly Val Pro Gly Val Gly
65 70 75 80
Val Pro Gly Val Gly Val Pro Gly Val Gly Val Pro Gly Val Gly Val
85 90 95
Pro Gly Val Gly Val Pro Gly Val Gly Val Pro Gly Val Gly Val Pro
100 105 110
Gly Val Gly Val Pro Gly Val Gly Val Pro Gly Val Gly Val Pro Gly
115 120 125
Val Gly Val Pro Gly Val Gly Val Pro Gly Val Gly Val Pro Gly Val
130 135 140
Gly Val Pro Gly Val Gly Val Pro Gly Lys Gly Val Pro Gly Val Gly
145 150 155 160
Val Pro Gly Val Gly Val Pro Gly Val Gly Val Pro Gly Val Gly Val
165 170 175
Pro Gly Val Gly Val Pro Gly Val Gly Val Pro Gly Val Gly Val Pro
180 185 190
Gly Val Gly Val Pro Gly Val Gly Val Pro Gly Val Gly Val Pro Gly
195 200 205
Val Gly Val Pro Gly Val Gly Val Pro Gly Val Gly Val Pro Gly Val
210 215 220
Gly Val Pro Gly Val Gly Val Pro Gly Val Gly Val Pro Gly Val Gly
225 230 235 240
Val Pro Gly Val Gly Val Pro Gly Val Gly Lys Leu
245 250
<210> 4
<211> 9
<212> PRT
<213> 人工
<400> 4
His Asn Trp Tyr His Trp Trp Pro His
1 5
- 一种泡沫分离β-葡萄糖苷酶融合蛋白的方法
- 一种蜂王幼虫葡萄糖苷酶抑制活性肽的制备方法及蜂王幼虫葡萄糖苷酶抑制活性肽和应用
