白介素10缀合物及其用途
文献发布时间:2023-06-19 12:11:54
交叉引用
本申请要求2018年11月8日提交的美国临时申请序列号62/757,690和2019年10月4日提交的美国临时申请序列号62/911,036的权益,将二者通过引用以其整体并入本文。
序列表
本申请含有已经以ASCII格式电子版形式提交并且通过引用以其整体特此并入的序列表。2019年11月4日创建的所述ASCII副本被命名为46085-727_851_SL.txt并且大小为4,157字节。
背景技术
不同的T细胞群体调节免疫系统以维持免疫稳态和耐受性。例如,调节性T(Treg)细胞通过防止病理性自身反应性来防止免疫系统的不适当反应,而细胞毒性T细胞靶向并且破坏感染的细胞和/或癌细胞。在一些情况下,不同T细胞群体的调节为治疗疾病或适应症提供了选择。
发明内容
在某些实施方案中,本文公开了白介素10(IL-10)缀合物及其在治疗一种或多种适应症中的用途。在一些实施方案中,本文公开了IL-10缀合物,其用于治疗癌症。在另外的情况下,本文公开了包含本文所述的IL-10缀合物的药物组合物和试剂盒。
在一些实施方案中,本文公开了经修饰的白介素10(IL-10)多肽,其包含含有与至少一个缀合部分结合的至少一个非天然氨基酸的氨基酸序列,其中所述氨基酸序列与SEQID NO:1的氨基酸33至158是99.0%相同的。在一些实施方案中,所述氨基酸序列与SEQ IDNO:1的氨基酸1至160至少95.0%相同。在一些实施方案中,所述氨基酸序列与SEQ ID NO:1的氨基酸1至160至少97.0%相同。在一些实施方案中,所述氨基酸序列与SEQ ID NO:1的氨基酸1至160至少98.0%相同。在一些实施方案中,所述氨基酸序列包含13个赖氨酸氨基酸残基。在一些实施方案中,所述非天然氨基酸位于选自在SEQ ID NO:1内的E67、Q70、E74、E75、Q79、N82、K88、K125、N126、N129、K130、或Q132的氨基酸位置。在一些实施方案中,所述至少一个非天然氨基酸的位置选自E67、Q70、E74、E75、Q79、或N82,其中所述残基位置对应于如SEQ ID NO:1中所示的位置67、70、74、75、79、和82。在一些实施方案中,所述至少一个非天然氨基酸的位置选自K88、K125、N126、N129、K130、或Q132,其中所述残基位置对应于如SEQ ID NO:1中所示的位置88、125、126、129、130、和132。在一些实施方案中,所述至少一个非天然氨基酸的位置选自K125、N126、N129、K130、或Q132,其中所述残基位置对应于如SEQID NO:1中所示的位置125、126、129、130、和132。在一些实施方案中,所述至少一个非天然氨基酸的位置选自Q70、E74、N82、K88、N126、K130、或Q132,其中所述残基位置对应于如SEQID NO:1中所示的位置70、74、82、88、126、130、和132。在一些实施方案中,所述至少一个非天然氨基酸位于N-末端的近端。在一些实施方案中,所述至少一个非天然氨基酸位于从N-末端起的前10、20、30、40、或50个残基内。在一些实施方案中,所述至少一个非天然氨基酸位于C-末端的近端。在一些实施方案中,所述至少一个非天然氨基酸位于从C-末端起的前10、20、30、40或50个残基内。在一些实施方案中,所述至少一个非天然氨基酸:a)是赖氨酸类似物;b)包含芳族侧链;c)包含叠氮基团;d)包含炔基;或e)包含醛或酮基团。在一些实施方案中,所述至少一个非天然氨基酸不包含芳族侧链。在一些实施方案中,所述至少一个非天然氨基酸包括N6-((2-叠氮基乙氧基)-羰基)-L-赖氨酸(AzK)。在一些实施方案中,所述至少一个非天然氨基酸包括N6-((2-叠氮基乙氧基)-羰基)-L-赖氨酸(AzK)、N6-(炔丙基乙氧基)-L-赖氨酸(PraK)、BCN-L-赖氨酸、降冰片烯赖氨酸、TCO-赖氨酸、甲基四嗪赖氨酸、烯丙氧基羰基赖氨酸、2-氨基-8-氧代壬酸、2-氨基-8-氧代辛酸、对-乙酰基-L-苯丙氨酸、对-叠氮基甲基-L-苯丙氨酸(pAMF)、对-碘-L-苯丙氨酸、间-乙酰基苯丙氨酸、2-氨基-8-氧代壬酸、对-炔丙基氧基苯丙氨酸、对-炔丙基-苯丙氨酸、3-甲基-苯丙氨酸、L-多巴、氟化苯丙氨酸、异丙基-L-苯丙氨酸、对-叠氮基-L-苯丙氨酸、对-酰基-L-苯丙氨酸、对-苯甲酰基-L-苯丙氨酸、对-溴苯丙氨酸、对-氨基-L-苯丙氨酸、异丙基-L-苯丙氨酸、O-烯丙基酪氨酸、O-甲基-L-酪氨酸、O-4-烯丙基-L-酪氨酸、4-丙基-L-酪氨酸、磷酰酪氨酸、三-O-乙酰基-GlcNAcp-丝氨酸、L-磷酸丝氨酸、磷酰丝氨酸、L-3-(2-萘基)丙氨酸、2-氨基-3-((2-((3-(苄氧基)-3-氧丙基)氨基)乙基)硒基)丙酸、2-氨基-3-(苯基硒基)丙酸或硒代半胱氨酸。在一些实施方案中,所述至少一个非天然氨基酸通过正交tRNA合成酶/tRNA对掺入经修饰的IL-10多肽中。在一些实施方案中,所述正交合成酶/tRNA对的正交tRNA包含至少一个非天然核碱基。在一些实施方案中,将经修饰的IL-10多肽与第二经修饰的IL-10多肽二聚化,从而产生包含两个非天然氨基酸的IL-10二聚体。在一些实施方案中,所述经修饰的IL-10多肽的非天然氨基酸位于与第二经修饰的IL-10多肽的非天然氨基酸不同的残基位置。在一些实施方案中,这两个非天然氨基酸在各自的IL-10多肽中位于相同的残基位置。在一些实施方案中,将经修饰的IL-10多肽与不包含非天然氨基酸的IL-10多肽二聚化。在一些实施方案中,将经修饰的IL-10多肽与野生型IL-10多肽二聚化。在一些实施方案中,所述至少一个缀合部分包含水溶性聚合物、脂质、蛋白质、或肽。在一些实施方案中,所述水溶性聚合物包含聚乙二醇(PEG)分子。在一些实施方案中,所述水溶性聚合物包含聚乙二醇(PEG)、聚(丙二醇)(PPG)、乙二醇和丙二醇的共聚物、聚(氧乙基化多元醇)、聚(烯烃醇)、聚(乙烯基吡咯烷酮)、聚(羟烷基甲基丙烯酰胺)、聚(甲基丙烯酸羟烷基酯)、聚(糖类)、聚(α-羟基酸)、聚(乙烯醇)、聚磷腈、聚噁唑啉(POZ)、聚(N-丙烯酰吗啉)或其组合。在一些实施方案中,所述水溶性聚合物包含PEG分子。在一些实施方案中,所述PEG分子是线性PEG。在一些实施方案中,所述PEG分子是支化PEG。在一些实施方案中,所述水溶性聚合物包含多糖。在一些实施方案中,所述多糖包括葡聚糖、聚唾液酸(PSA)、透明质酸(HA)、直链淀粉、肝素、硫酸乙酰肝素(HS)、糊精或羟乙基淀粉(HES)。在一些实施方案中,所述脂质包括脂肪酸。在一些实施方案中,所述脂肪酸包含约6至约26个碳原子、约6至约24个碳原子、约6至约22个碳原子、约6至约20个碳原子、约6至约18个碳原子、约20至约26个碳原子、约12至约26个碳原子、约12至约24个碳原子、约12至约22个碳原子、约12至约20个碳原子或约12至约18个碳原子。在一些实施方案中,所述脂肪酸是饱和脂肪酸。在一些实施方案中,所述蛋白质包括白蛋白、转铁蛋白或运甲状腺素蛋白。在一些实施方案中,所述蛋白质包括抗体或其结合片段。在一些实施方案中,所述抗体或其结合片段包括抗体的Fc部分。在一些实施方案中,所述肽包括XTEN肽、富含甘氨酸的高氨基酸聚合物(HAP)、PAS多肽、弹性蛋白样多肽(ELP)、CTP肽或明胶样蛋白(GLK)聚合物。在一些实施方案中,所述缀合部分通过接头与所述经修饰的IL-10的至少一个非天然氨基酸间接结合。在一些实施方案中,所述接头包括同双官能接头、异双官能接头、零长度接头、可切割或不可切割二肽接头、马来酰亚胺基团、间隔基或其组合。在一些实施方案中,所述经修饰的IL-10多肽是:a)全长IL-10多肽的功能活性片段;b)重组IL-10多肽;或c)重组人IL-10多肽。在一些实施方案中,所述经修饰的IL-10多肽包含N-末端缺失、C-末端缺失或其组合。在一些实施方案中,所述N-末端缺失包括从所述N-末端起缺失前1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、20、25或30个残基,其中所述残基位置参考SEQ ID NO:1中的位置。在一些实施方案中,所述C-末端缺失包括从所述C-末端起缺失最后1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、20或更多个残基,其中所述残基位置参考SEQ ID NO:1中的位置。在一些实施方案中,所述经修饰的IL-10多肽包括与SEQ ID NO:1约80%、85%、90%、95%、96%、97%、98%、或99%的序列同一性。在一些实施方案中,所述IL-10二聚体与IL-10R结合以形成IL-10/IL-10R复合物。在一些实施方案中,所述IL-10二聚体的增强的血浆半衰期是至少90分钟、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、18小时、24小时、36小时、48小时、3天、4天、5天、6天、7天、10天、12天、14天、21天、28天、30天、或长于野生型IL-10二聚体的血浆半衰期。在一些实施方案中,所述IL-10二聚体的增强的血浆半衰期是约90分钟、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、18小时、24小时、36小时、48小时、3天、4天、5天、6天、7天、10天、12天、14天、21天、28天、或30天。在一些实施方案中,所述至少一个非天然氨基酸的位置基本上不干扰IL-10多肽的二聚化。在一些实施方案中,所述至少一个非天然氨基酸的位置不显著干扰IL-10二聚体与IL-10R的结合。在一些实施方案中,所述至少一个非天然氨基酸的位置对IL-10R的信号传导的损害少于90%、80%、70%、60%、50%、40%、30%、20%、10%、5%、4%、3%、2%、1%、或更少。在一些实施方案中,所述至少一个非天然氨基酸的位置不显著损害如通过细胞磷酸化Stat3和/或激活IL-10R信号传导的能力所定义的IL-10R的信号传导。在一些实施方案中,所述经修饰的IL-10多肽是分离和纯化的。在一些实施方案中,所述经修饰的IL-10多肽被配制为包含药学上可接受的赋形剂的药物配制品。在一些实施方案中,所述药物配制品被配制用于全身递送。
在一些实施方案中,本文公开了一种经修饰的IL-10同二聚体,其包含两个根据权利要求1所述的经修饰的IL-10多肽。
在一些实施方案中,本文公开了包含与IL-10受体(IL-10R)结合的本公开文本的经修饰的同二聚体的复合物的组合物。
在一些实施方案中,本文公开了中治疗有需要的受试者的增殖性疾病或病症的方法,所述方法包括向所述受试者施用治疗有效量的本公开文本的经修饰的IL-10多肽。在一些实施方案中,所述增殖性疾病或病症是癌症。在一些实施方案中,所述癌症是实体瘤癌症。在一些实施方案中,所述实体瘤癌症是膀胱癌、骨癌、脑癌、乳腺癌、结直肠癌、食道癌、眼癌、头颈癌、肾癌、肺癌、黑色素瘤、卵巢癌、胰腺癌或前列腺癌。
在一些实施方案中,本文公开了编码本公开文本的经修饰的IL-10多肽的核酸分子。
在一些实施方案中,本文公开了包含本公开文本的核酸分子的载体。
在某些实施方案中,本文公开了一种经分离和修饰的白介素10(IL-10)多肽,其在所述多肽上的增强血浆半衰期而不显著改变与IL-10受体的相互作用的位置处包含至少一个非天然氨基酸,其中所述增强的血浆半衰期是与野生型IL-10蛋白的血浆半衰期相比的。在一些实施方案中,所述至少一个非天然氨基酸位于螺旋C、D、或E中。在一些实施方案中,所述至少一个非天然氨基酸位于螺旋C、D、或E中的表面暴露位置。在一些实施方案中,所述至少一个非天然氨基酸的位置选自E67、Q70、E74、E75、Q79、N82、K88、K125、N126、N129、K130、或Q132,其中所述残基位置对应于如SEQ ID NO:1中所示的位置67、70、74、75、79、82、88、125、126、129、130、和132。在一些实施方案中,所述至少一个非天然氨基酸的位置选自E67、Q70、E74、E75、Q79、或N82,其中所述残基位置对应于如SEQ ID NO:1中所示的位置67、70、74、75、79、和82。在一些实施方案中,所述至少一个非天然氨基酸的位置选自K88、K125、N126、N129、K130、或Q132,其中所述残基位置对应于如SEQ ID NO:1中所示的位置88、125、126、129、130、和132。在一些实施方案中,所述至少一个非天然氨基酸的位置选自K125、N126、N129、K130、或Q132,其中所述残基位置对应于如SEQ ID NO:1中所示的位置125、126、129、130、和132。在一些实施方案中,所述至少一个非天然氨基酸的位置选自Q70、E74、N82、K88、N126、K130、或Q132,其中所述残基位置对应于如SEQ ID NO:1中所示的位置70、74、82、88、126、130、和132。在一些实施方案中,所述氨基酸序列与SEQ ID NO:1的氨基酸33至158至少或约99.0%相同。在一些实施方案中,所述氨基酸序列包含至少1、2、3、4、5、6、7、8、9、10、11、12、或13个野生型赖氨酸。在一些实施方案中,所述氨基酸序列在K34、K40、K49、K57、K88、K99、K117、K119、K125、K130、K134、K138、和K157中的一个或多个处包含野生型赖氨酸。在一些实施方案中,所述氨基酸序列在K34、K40、K49、K57、K88、K99、K117、K119、K125、K130、K134、K138、和K157中的至少2、3、4、5、6、7、8、9、10、11、或12个处包含野生型赖氨酸。在一些实施方案中,所述氨基酸序列在K34、K40、K49、K57、K88、K99、K117、K119、K125、K130、K134、K138、和K157处包含野生型赖氨酸。在一些实施方案中,所述至少一个非天然氨基酸位于N-末端的近端。在一些实施方案中,所述至少一个非天然氨基酸位于从N-末端起的前10、20、30、40、或50个残基内。在一些实施方案中,所述至少一个非天然氨基酸位于C-末端的近端。在一些实施方案中,所述至少一个非天然氨基酸位于从C-末端起的前10、20、30、40或50个残基内。在一些实施方案中,所述至少一个非天然氨基酸:a)是赖氨酸类似物;b)包含芳族侧链;c)包含叠氮基团;d)包含炔基;或e)包含醛或酮基团。在一些实施方案中,所述至少一个非天然氨基酸不包含芳族侧链。在一些实施方案中,所述至少一个非天然氨基酸包括N6-((2-叠氮基乙氧基)-羰基)-L-赖氨酸(AzK)、N6-(炔丙基乙氧基)-L-赖氨酸(PraK)、BCN-L-赖氨酸、降冰片烯赖氨酸、TCO-赖氨酸、甲基四嗪赖氨酸、烯丙氧基羰基赖氨酸、2-氨基-8-氧代壬酸、2-氨基-8-氧代辛酸、对-乙酰基-L-苯丙氨酸、对-叠氮基甲基-L-苯丙氨酸(pAMF)、对-碘-L-苯丙氨酸、间-乙酰基苯丙氨酸、2-氨基-8-氧代壬酸、对-炔丙基氧基苯丙氨酸、对-炔丙基-苯丙氨酸、3-甲基-苯丙氨酸、L-多巴、氟化苯丙氨酸、异丙基-L-苯丙氨酸、对-叠氮基-L-苯丙氨酸、对-酰基-L-苯丙氨酸、对-苯甲酰基-L-苯丙氨酸、对-溴苯丙氨酸、对-氨基-L-苯丙氨酸、异丙基-L-苯丙氨酸、O-烯丙基酪氨酸、O-甲基-L-酪氨酸、O-4-烯丙基-L-酪氨酸、4-丙基-L-酪氨酸、磷酰酪氨酸、三-O-乙酰基-GlcNAcp-丝氨酸、L-磷酸丝氨酸、磷酰丝氨酸、L-3-(2-萘基)丙氨酸、2-氨基-3-((2-((3-(苄氧基)-3-氧丙基)氨基)乙基)硒基)丙酸、2-氨基-3-(苯基硒基)丙酸或硒代半胱氨酸。在一些实施方案中,所述至少一个非天然氨基酸通过正交tRNA合成酶/tRNA对掺入经修饰的IL-10多肽中。在一些实施方案中,所述正交合成酶/tRNA对的正交tRNA包含至少一个非天然核碱基。在一些实施方案中,将经修饰的IL-10多肽与第二经修饰的IL-10多肽二聚化,从而产生包含两个非天然氨基酸的IL-10二聚体。在一些实施方案中,所述经修饰的IL-10多肽的非天然氨基酸位于与第二经修饰的IL-10多肽的非天然氨基酸不同的残基位置。在一些实施方案中,这两个非天然氨基酸在各自的IL-10多肽中位于相同的残基位置。在一些实施方案中,将经修饰的IL-10多肽与不包含非天然氨基酸的IL-10多肽二聚化。在一些实施方案中,将经修饰的IL-10多肽与野生型IL-10多肽二聚化。在一些实施方案中,所述经修饰的IL-10多肽通过至少一个非天然氨基酸共价附接至缀合部分。在一些实施方案中,所述缀合部分包括水溶性聚合物、脂质、蛋白质、或肽。在一些实施方案中,所述水溶性聚合物包含聚乙二醇(PEG)、聚(丙二醇)(PPG)、乙二醇和丙二醇的共聚物、聚(氧乙基化多元醇)、聚(烯烃醇)、聚(乙烯基吡咯烷酮)、聚(羟烷基甲基丙烯酰胺)、聚(甲基丙烯酸羟烷基酯)、聚(糖类)、聚(α-羟基酸)、聚(乙烯醇)、聚磷腈、聚噁唑啉(POZ)、聚(N-丙烯酰吗啉)或其组合。在一些实施方案中,所述水溶性聚合物包含PEG分子。在一些实施方案中,所述PEG分子是线性PEG。在一些实施方案中,所述PEG分子是支化PEG。在一些实施方案中,所述水溶性聚合物包含多糖。在一些实施方案中,所述多糖包括葡聚糖、聚唾液酸(PSA)、透明质酸(HA)、直链淀粉、肝素、硫酸乙酰肝素(HS)、糊精或羟乙基淀粉(HES)。在一些实施方案中,所述脂质包括脂肪酸。在一些实施方案中,所述脂肪酸包含约6至约26个碳原子、约6至约24个碳原子、约6至约22个碳原子、约6至约20个碳原子、约6至约18个碳原子、约20至约26个碳原子、约12至约26个碳原子、约12至约24个碳原子、约12至约22个碳原子、约12至约20个碳原子或约12至约18个碳原子。在一些实施方案中,所述脂肪酸是饱和脂肪酸。在一些实施方案中,所述蛋白质包括白蛋白、转铁蛋白或运甲状腺素蛋白。在一些实施方案中,所述蛋白质包括抗体或其结合片段。在一些实施方案中,所述抗体或其结合片段包括抗体的Fc部分。在一些实施方案中,所述肽包括XTEN肽、富含甘氨酸的高氨基酸聚合物(HAP)、PAS多肽、弹性蛋白样多肽(ELP)、CTP肽或明胶样蛋白(GLK)聚合物。在一些实施方案中,所述缀合部分通过接头与所述经修饰的IL-10的至少一个非天然氨基酸间接结合。在一些实施方案中,所述接头包括同双官能接头、异双官能接头、零长度接头、可切割或不可切割二肽接头、马来酰亚胺基团、间隔基或其组合。在一些实施方案中,所述经修饰的IL-10多肽是:a)全长IL-10多肽的功能活性片段;b)重组IL-10多肽;或c)重组人IL-10多肽。在一些实施方案中,所述经修饰的IL-10多肽包含N-末端缺失、C-末端缺失或其组合。在一些实施方案中,所述N-末端缺失包括从所述N-末端起缺失前1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、20、25或30个残基,其中所述残基位置参考SEQID NO:1中的位置。在一些实施方案中,所述C-末端缺失包括从所述C-末端起缺失最后1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、20或更多个残基,其中所述残基位置参考SEQ ID NO:1中的位置。在一些实施方案中,所述经修饰的IL-10多肽包括与SEQ ID NO:1约80%、85%、90%、95%、96%、97%、98%、或99%的序列同一性。在一些实施方案中,所述IL-10二聚体与IL-10R结合以形成IL-10/IL-10R复合物。在一些实施方案中,所述IL-10二聚体的增强的血浆半衰期是至少90分钟、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、18小时、24小时、36小时、48小时、3天、4天、5天、6天、7天、10天、12天、14天、21天、28天、30天、或长于野生型IL-10二聚体的血浆半衰期。在一些实施方案中,所述IL-10二聚体的增强的血浆半衰期是约90分钟、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、18小时、24小时、36小时、48小时、3天、4天、5天、6天、7天、10天、12天、14天、21天、28天、或30天。在一些实施方案中,所述至少一个非天然氨基酸的位置基本上不干扰IL-10多肽的二聚化。在一些实施方案中,所述至少一个非天然氨基酸的位置不显著干扰IL-10二聚体与IL-10R的结合。在一些实施方案中,所述至少一个非天然氨基酸的位置对IL-10R的信号传导的损害少于90%、80%、70%、60%、50%、40%、30%、20%、10%、5%、4%、3%、2%、1%、或更少。在一些实施方案中,所述至少一个非天然氨基酸的位置不显著损害如通过细胞磷酸化Stat3和/或激活IL-10R信号传导的能力所定义的IL-10R的信号传导。
在某些实施方案中,本文公开了所述至少一个非天然氨基酸的位置选自N82、K88、N129、K130、或Q132,其中所述残基位置对应于如SEQ ID NO:1中所示的位置82、88、129、130、和132。在一些实施方案中,所述至少一个非天然氨基酸的位置选自N82、N129、K130、或Q132,其中所述残基位置对应于如SEQ ID NO:1中所示的位置82、129、130、和132。在一些实施方案中,所述至少一个非天然氨基酸的位置选自N82、N129、K130、或Q132,其中所述残基位置对应于如SEQ ID NO:1中所示的位置82、129、130、和132。在一些实施方案中,所述至少一个非天然氨基酸的位置选自N82、N129、或Q132,其中所述残基位置对应于如SEQ ID NO:1中所示的位置82、129、132。在一些实施方案中,所述至少一个非天然氨基酸的位置选自N82或N129,其中所述残基位置对应于如SEQ ID NO:1中所示的位置82和129。在一些实施方案中,所述至少一个非天然氨基酸的位置选自N82,其中所述残基位置对应于如SEQ ID NO:1中所示的位置82。在一些实施方案中,所述至少一个非天然氨基酸的位置选自N129,其中所述残基位置对应于如SEQ ID NO:1中所示的位置129。
在某些实施方案中,本文公开了所述至少一个非天然氨基酸包括N6-((2-叠氮基乙氧基)-羰基)-L-赖氨酸(AzK)、N6-(炔丙基乙氧基)-L-赖氨酸(PraK)、N6-(((2-叠氮基苄基)氧基)羰基)-L-赖氨酸、N6-(((3-叠氮基苄基)氧基)羰基)-L-赖氨酸、或N6-(((4-叠氮基苄基)氧基)羰基)-L-赖氨酸。在一些实施方案中,所述至少一个非天然氨基酸包括N6-((2-叠氮基乙氧基)-羰基)-L-赖氨酸(AzK)。在一些实施方案中,所述至少一个非天然氨基酸包括N6-(炔丙基乙氧基)-L-赖氨酸(PraK)。在一些实施方案中,所述至少一个非天然氨基酸包括N6-(((2-叠氮基苄基)氧基)羰基)-L-赖氨酸。在一些实施方案中,所述至少一个非天然氨基酸包括N6-(((3-叠氮基苄基)氧基)羰基)-L-赖氨酸。在一些实施方案中,所述至少一个非天然氨基酸包括N6-(((4-叠氮基苄基)氧基)羰基)-L-赖氨酸。
在某些实施方案中,本文公开了所述至少一个非天然氨基酸的位置选自N82、K88、N129、K130、或Q132,其中所述残基位置对应于如SEQ ID NO:1中所示的位置82、88、129、130、和132,并且所述至少一个非天然氨基酸包括N6-((2-叠氮基乙氧基)-羰基)-L-赖氨酸(AzK)、N6-(炔丙基乙氧基)-L-赖氨酸(PraK)、N6-(((2-叠氮基苄基)氧基)羰基)-L-赖氨酸、N6-(((3-叠氮基苄基)氧基)羰基)-L-赖氨酸、或N6-(((4-叠氮基苄基)氧基)羰基)-L-赖氨酸。在一些实施方案中,所述至少一个非天然氨基酸的位置选自N82、N129、K130、或Q132,其中所述残基位置对应于如SEQ ID NO:1中所示的位置82、129、130、和132,并且所述至少一个非天然氨基酸包括N6-((2-叠氮基乙氧基)-羰基)-L-赖氨酸(AzK)、N6-(炔丙基乙氧基)-L-赖氨酸(PraK)、N6-(((2-叠氮基苄基)氧基)羰基)-L-赖氨酸、N6-(((3-叠氮基苄基)氧基)羰基)-L-赖氨酸、或N6-(((4-叠氮基苄基)氧基)羰基)-L-赖氨酸。在一些实施方案中,所述至少一个非天然氨基酸的位置选自N82、N129、K130、或Q132,其中所述残基位置对应于如SEQ ID NO:1中所示的位置82、129、130、和132,并且所述至少一个非天然氨基酸包括N6-((2-叠氮基乙氧基)-羰基)-L-赖氨酸(AzK)、N6-(炔丙基乙氧基)-L-赖氨酸(PraK)、N6-(((2-叠氮基苄基)氧基)羰基)-L-赖氨酸、N6-(((3-叠氮基苄基)氧基)羰基)-L-赖氨酸、或N6-(((4-叠氮基苄基)氧基)羰基)-L-赖氨酸。在一些实施方案中,所述至少一个非天然氨基酸的位置选自N82、N129、或Q132,其中所述残基位置对应于如SEQ ID NO:1中所示的位置82、129、132,并且所述至少一个非天然氨基酸包括N6-((2-叠氮基乙氧基)-羰基)-L-赖氨酸(AzK)、N6-(炔丙基乙氧基)-L-赖氨酸(PraK)、N6-(((2-叠氮基苄基)氧基)羰基)-L-赖氨酸、N6-(((3-叠氮基苄基)氧基)羰基)-L-赖氨酸、或N6-(((4-叠氮基苄基)氧基)羰基)-L-赖氨酸。在一些实施方案中,所述至少一个非天然氨基酸的位置选自N82或N129,其中所述残基位置对应于如SEQ ID NO:1中所示的位置82和129,并且所述至少一个非天然氨基酸包括N6-((2-叠氮基乙氧基)-羰基)-L-赖氨酸(AzK)、N6-(炔丙基乙氧基)-L-赖氨酸(PraK)、N6-(((2-叠氮基苄基)氧基)羰基)-L-赖氨酸、N6-(((3-叠氮基苄基)氧基)羰基)-L-赖氨酸、或N6-(((4-叠氮基苄基)氧基)羰基)-L-赖氨酸。在一些实施方案中,所述至少一个非天然氨基酸的位置选自N82,其中所述残基位置对应于如SEQ ID NO:1中所示的位置82,并且所述至少一个非天然氨基酸包括N6-((2-叠氮基乙氧基)-羰基)-L-赖氨酸(AzK)、N6-(炔丙基乙氧基)-L-赖氨酸(PraK)、N6-(((2-叠氮基苄基)氧基)羰基)-L-赖氨酸、N6-(((3-叠氮基苄基)氧基)羰基)-L-赖氨酸、或N6-(((4-叠氮基苄基)氧基)羰基)-L-赖氨酸。在一些实施方案中,所述至少一个非天然氨基酸的位置选自N129,其中所述残基位置对应于如SEQ ID NO:1中所示的位置129,并且所述至少一个非天然氨基酸包括N6-((2-叠氮基乙氧基)-羰基)-L-赖氨酸(AzK)、N6-(炔丙基乙氧基)-L-赖氨酸(PraK)、N6-(((2-叠氮基苄基)氧基)羰基)-L-赖氨酸、N6-(((3-叠氮基苄基)氧基)羰基)-L-赖氨酸、或N6-(((4-叠氮基苄基)氧基)羰基)-L-赖氨酸。
在某些实施方案中,本文公开了所述至少一个非天然氨基酸的位置选自N82、N129、或Q132,其中所述残基位置对应于如SEQ ID NO:1中所示的位置82、129、132,并且所述至少一个非天然氨基酸包括N6-((2-叠氮基乙氧基)-羰基)-L-赖氨酸(AzK)。在一些实施方案中,所述至少一个非天然氨基酸的位置选自N82、N129、或Q132,其中所述残基位置对应于如SEQ ID NO:1中所示的位置82、129、132,并且所述至少一个非天然氨基酸包括N6-(炔丙基乙氧基)-L-赖氨酸(PraK)。在一些实施方案中,所述至少一个非天然氨基酸的位置选自N82、N129、或Q132,其中所述残基位置对应于如SEQ ID NO:1中所示的位置82、129、132,并且所述至少一个非天然氨基酸包括N6-(((2-叠氮基苄基)氧基)羰基)-L-赖氨酸。在一些实施方案中,所述至少一个非天然氨基酸的位置选自N82、N129、或Q132,其中所述残基位置对应于如SEQ ID NO:1中所示的位置82、129、132,并且所述至少一个非天然氨基酸包括N6-(((3-叠氮基苄基)氧基)羰基)-L-赖氨酸。在一些实施方案中,所述至少一个非天然氨基酸的位置选自N82、N129、或Q132,其中所述残基位置对应于如SEQ ID NO:1中所示的位置82、129、132,并且所述至少一个非天然氨基酸包括N6-(((4-叠氮基苄基)氧基)羰基)-L-赖氨酸。
在某些实施方案中,本文公开了所述至少一个非天然氨基酸的位置选自N82或N129,其中所述残基位置对应于如SEQ ID NO:1中所示的位置82和129,并且所述至少一个非天然氨基酸包括N6-((2-叠氮基乙氧基)-羰基)-L-赖氨酸(AzK)。在一些实施方案中,所述至少一个非天然氨基酸的位置选自N82或N129,其中所述残基位置对应于如SEQ ID NO:1中所示的位置82和129,并且所述至少一个非天然氨基酸包括N6-(炔丙基乙氧基)-L-赖氨酸(PraK)。在一些实施方案中,所述至少一个非天然氨基酸的位置选自N82或N129,其中所述残基位置对应于如SEQ ID NO:1中所示的位置82和129,并且所述至少一个非天然氨基酸包括N6-(((2-叠氮基苄基)氧基)羰基)-L-赖氨酸。在一些实施方案中,所述至少一个非天然氨基酸的位置选自N82或N129,其中所述残基位置对应于如SEQ ID NO:1中所示的位置82和129,并且所述至少一个非天然氨基酸包括N6-(((3-叠氮基苄基)氧基)羰基)-L-赖氨酸。在一些实施方案中,所述至少一个非天然氨基酸的位置选自N82或N129,其中所述残基位置对应于如SEQ ID NO:1中所示的位置82和129,并且所述至少一个非天然氨基酸包括N6-(((4-叠氮基苄基)氧基)羰基)-L-赖氨酸。
在某些实施方案中,本文公开了所述至少一个非天然氨基酸的位置选自N82,其中所述残基位置对应于如SEQ ID NO:1中所示的位置82,并且所述至少一个非天然氨基酸包括N6-((2-叠氮基乙氧基)-羰基)-L-赖氨酸(AzK)。在一些实施方案中,所述至少一个非天然氨基酸的位置选自N82,其中所述残基位置对应于如SEQ ID NO:1中所示的位置82,并且所述至少一个非天然氨基酸包括N6-(炔丙基乙氧基)-L-赖氨酸(PraK)。在一些实施方案中,所述至少一个非天然氨基酸的位置选自N82,其中所述残基位置对应于如SEQ ID NO:1中所示的位置82,并且所述至少一个非天然氨基酸包括N6-(((2-叠氮基苄基)氧基)羰基)-L-赖氨酸。在一些实施方案中,所述至少一个非天然氨基酸的位置选自N82,其中所述残基位置对应于如SEQ ID NO:1中所示的位置82,并且所述至少一个非天然氨基酸包括N6-(((3-叠氮基苄基)氧基)羰基)-L-赖氨酸。在一些实施方案中,所述至少一个非天然氨基酸的位置选自N82,其中所述残基位置对应于如SEQ ID NO:1中所示的位置82,并且所述至少一个非天然氨基酸包括N6-(((4-叠氮基苄基)氧基)羰基)-L-赖氨酸。
在某些实施方案中,本文公开了至少一个非天然氨基酸的位置选自N129,其中所述残基位置对应于如SEQ ID NO:1中所示的位置129,并且所述至少一个非天然氨基酸包括N6-((2-叠氮基乙氧基)-羰基)-L-赖氨酸(AzK)。在一些实施方案中,所述至少一个非天然氨基酸的位置选自N129,其中所述残基位置对应于如SEQ ID NO:1中所示的位置129,并且所述至少一个非天然氨基酸包括N6-(炔丙基乙氧基)-L-赖氨酸(PraK)。在一些实施方案中,所述至少一个非天然氨基酸的位置选自N129,其中所述残基位置对应于如SEQ ID NO:1中所示的位置129,并且所述至少一个非天然氨基酸包括N6-(((2-叠氮基苄基)氧基)羰基)-L-赖氨酸。在一些实施方案中,所述至少一个非天然氨基酸的位置选自N129,其中所述残基位置对应于如SEQ ID NO:1中所示的位置129,并且所述至少一个非天然氨基酸包括N6-(((3-叠氮基苄基)氧基)羰基)-L-赖氨酸、或N6-(((4-叠氮基苄基)氧基)羰基)-L-赖氨酸。
在某些实施方案中,本文公开了所述经修饰的IL-10多肽通过至少一个非天然氨基酸共价附接至缀合部分。在一些实施方案中,所述缀合部分包括水溶性聚合物、脂质、蛋白质、或肽。在一些实施方案中,所述水溶性聚合物包含聚乙二醇(PEG)、聚(丙二醇)(PPG)、乙二醇和丙二醇的共聚物、聚(氧乙基化多元醇)、聚(烯烃醇)、聚(乙烯基吡咯烷酮)、聚(羟烷基甲基丙烯酰胺)、聚(甲基丙烯酸羟烷基酯)、聚(糖类)、聚(α-羟基酸)、聚(乙烯醇)、聚磷腈、聚噁唑啉(POZ)、聚(N-丙烯酰吗啉)或其组合。
在某些实施方案中,本文公开了所述经修饰的IL-10多肽通过至少一个非天然氨基酸共价附接至PEG分子。在一些实施方案中,所述PEG分子是线性PEG。在一些实施方案中,所述PEG分子是支化PEG。在一些实施方案中,所述PEG的重均分子量为约100道尔顿至约150,000道尔顿。示例性范围包括,例如,重均分子量在大于5,000道尔顿至约100,000道尔顿的范围内、约6,000道尔顿至约90,000道尔顿的范围内、约10,000道尔顿至约85,000道尔顿的范围内、大于10,000道尔顿至约85,000道尔顿的范围内、约20,000道尔顿至约85,000道尔顿的范围内、约53,000道尔顿至约85,000道尔顿的范围内、约25,000道尔顿至约120,000道尔顿的范围内、约29,000道尔顿至约120,000道尔顿的范围内、约35,000道尔顿至约120,000道尔顿的范围内,以及约40,000道尔顿至约120,000道尔顿的范围内。所述PEG的示例性重均分子量包括约100道尔顿、约200道尔顿、约300道尔顿、约400道尔顿、约500道尔顿、约600道尔顿、约700道尔顿、约750道尔顿、约800道尔顿、约900道尔顿、约1,000道尔顿、约1,500道尔顿、约2,000道尔顿、约2,200道尔顿、约2,500道尔顿、约3,000道尔顿、约4,000道尔顿、约4,400道尔顿、约4,500道尔顿、约5,000道尔顿、约5,500道尔顿、约6,000道尔顿、约7,000道尔顿、约7,500道尔顿、约8,000道尔顿、约9,000道尔顿、约10,000道尔顿、约11,000道尔顿、约12,000道尔顿、约13,000道尔顿、约14,000道尔顿、约15,000道尔顿、约20,000道尔顿、约22,500道尔顿、约25,000道尔顿、约30,000道尔顿、约35,000道尔顿、约40,000道尔顿、约45,000道尔顿、约50,000道尔顿、约55,000道尔顿、约60,000道尔顿、约65,000道尔顿、约70,000道尔顿和约75,000道尔顿。还可以使用总分子量为上述任何一种的支化形式的PEG(例如,由两个20,000道尔顿聚合物构成的支化40,000道尔顿PEG)。在一些实施方案中,所述PEG的分子量为约5,000道尔顿。在一些实施方案中,所述PEG的分子量为约7,500道尔顿。在一些实施方案中,所述PEG的分子量为约8,000道尔顿。在一些实施方案中,所述PEG的分子量为约9,000道尔顿。在一些实施方案中,所述PEG的分子量为约10,000道尔顿。在一些实施方案中,所述PEG的分子量为约11,000道尔顿。在一些实施方案中,所述PEG的分子量为约12,000道尔顿。在一些实施方案中,所述PEG的分子量为约13,000道尔顿。在一些实施方案中,所述PEG的分子量为约14,000道尔顿。在一些实施方案中,所述PEG的分子量为约15,000道尔顿。在一些实施方案中,所述PEG的分子量为约16,000道尔顿。在一些实施方案中,所述PEG的分子量为约17,000道尔顿。在一些实施方案中,所述PEG的分子量为约18,000道尔顿。在一些实施方案中,所述PEG的分子量为约19,000道尔顿。在一些实施方案中,所述PEG的分子量为约20,000道尔顿。在一些实施方案中,所述PEG的分子量为约21,000道尔顿。在一些实施方案中,所述PEG的分子量为约22,000道尔顿。在一些实施方案中,所述PEG的分子量为约23,000道尔顿。在一些实施方案中,所述PEG的分子量为约25,000道尔顿。在一些实施方案中,所述PEG的分子量为约30,000道尔顿。在一些实施方案中,所述PEG的分子量为约40,000道尔顿。在一些实施方案中,所述PEG的分子量为约50,000道尔顿。在一些实施方案中,所述PEG的分子量为约60,000道尔顿。在一些实施方案中,所述PEG的分子量为约70,000道尔顿。在一些实施方案中,所述PEG的分子量为约80,000道尔顿。在一些实施方案中,所述PEG的分子量为约90,000道尔顿。在一些实施方案中,所述PEG的分子量为约100,000道尔顿。在一些实施方案中,所述PEG的分子量为约120,000道尔顿。在一些实施方案中,所述PEG的分子量为约130,000道尔顿。在一些实施方案中,所述PEG的分子量为约140,000道尔顿。在一些实施方案中,所述PEG的分子量为约150,000道尔顿。在一些实施方案中,所述PEG的分子量为约175,000道尔顿。在一些实施方案中,所述PEG的分子量为约200,000道尔顿。
在某些实施方案中,本文公开了所述经修饰的IL-10多肽共价附接至单糖或多糖。在某些实施方案中,所述经修饰的IL-10多肽共价附接至单糖。在某些实施方案中,所述经修饰的IL-10多肽共价附接至多糖。在某些实施方案中,所述单糖或多糖通过多肽中的半胱氨酸或天冬酰胺残基通过接头与IL-10多肽结合。在某些实施方案中,所述单糖或多糖通过多肽中的半胱氨酸残基通过接头与IL-10多肽结合。在某些实施方案中,所述单糖或多糖通过多肽中的天冬酰胺残基通过接头与IL-10多肽结合。
在某些实施方案中,本文公开了所述经修饰的IL-10多肽通过至少一个非天然氨基酸共价附接至PEG分子,并且通过所述多肽中的另一个氨基酸共价附接至单糖或多糖。在一些实施方案中,所述PEG分子是线性PEG。在一些实施方案中,所述PEG分子是支化PEG。在某些实施方案中,所述经修饰的IL-10多肽通过至少一个非天然氨基酸共价附接至PEG分子,并且通过所述多肽中的另一个氨基酸共价附接至单糖。在某些实施方案中,所述经修饰的IL-10多肽通过至少一个非天然氨基酸共价附接至PEG分子,并且通过所述多肽中的另一个氨基酸共价附接至多糖。在某些实施方案中,所述单糖或多糖通过多肽中的半胱氨酸或天冬酰胺残基通过接头与IL-10多肽结合。在某些实施方案中,所述单糖或多糖通过多肽中的半胱氨酸残基通过接头与IL-10多肽结合。在某些实施方案中,所述单糖或多糖通过多肽中的天冬酰胺残基通过接头与IL-10多肽结合。
在某些实施方案中,本文公开了包含至少一个非天然氨基酸的经分离和修饰的白介素10(IL-10)多肽,其中所述经分离和修饰的IL-10多肽是与IL-10受体(IL-10R)结合以形成IL-10/IL-10R复合物的生物活性IL-10多肽。在一些实施方案中,与野生型IL-10蛋白的血浆半衰期相比,所述生物活性IL-10多肽具有实质上增强的血浆半衰期。在一些实施方案中,所述至少一个非天然氨基酸位于螺旋C、D、或E中。在一些实施方案中,所述至少一个非天然氨基酸位于螺旋C、D、或E中的表面暴露位置。在一些实施方案中,所述至少一个非天然氨基酸的位置选自E67、Q70、E74、E75、Q79、N82、K88、K125、N126、N129、K130、或Q132,其中所述残基位置对应于如SEQ ID NO:1中所示的位置67、70、74、75、79、82、88、125、126、129、130、和132。在一些实施方案中,所述至少一个非天然氨基酸的位置选自E67、Q70、E74、E75、Q79、或N82,其中所述残基位置对应于如SEQ ID NO:1中所示的位置67、70、74、75、79、和82。在一些实施方案中,所述至少一个非天然氨基酸的位置选自K88、K125、N126、N129、K130、或Q132,其中所述残基位置对应于如SEQ ID NO:1中所示的位置88、125、126、129、130、和132。在一些实施方案中,所述至少一个非天然氨基酸的位置选自K125、N126、N129、K130、或Q132,其中所述残基位置对应于如SEQ ID NO:1中所示的位置125、126、129、130、和132。在一些实施方案中,所述至少一个非天然氨基酸的位置选自Q70、E74、N82、K88、N126、K130、或Q132,其中所述残基位置对应于如SEQ ID NO:1中所示的位置70、74、82、88、126、130、和132。在一些实施方案中,所述氨基酸序列与SEQ ID NO:1的氨基酸33至158至少或约99.0%相同。在一些实施方案中,所述氨基酸序列包含至少1、2、3、4、5、6、7、8、9、10、11、12、或13个野生型赖氨酸。在一些实施方案中,所述氨基酸序列在K34、K40、K49、K57、K88、K99、K117、K119、K125、K130、K134、K138、和K157中的一个或多个处包含野生型赖氨酸。在一些实施方案中,所述氨基酸序列在K34、K40、K49、K57、K88、K99、K117、K119、K125、K130、K134、K138、和K157中的至少2、3、4、5、6、7、8、9、10、11、或12个处包含野生型赖氨酸。在一些实施方案中,所述氨基酸序列在K34、K40、K49、K57、K88、K99、K117、K119、K125、K130、K134、K138、和K157处包含野生型赖氨酸。在一些实施方案中,所述至少一个非天然氨基酸位于N-末端的近端。在一些实施方案中,所述至少一个非天然氨基酸位于从N-末端起的前10、20、30、40、或50个残基内。在一些实施方案中,所述至少一个非天然氨基酸位于C-末端的近端。在一些实施方案中,所述至少一个非天然氨基酸位于从C-末端起的前10、20、30、40或50个残基内。在一些实施方案中,所述至少一个非天然氨基酸:a)是赖氨酸类似物;b)包含芳族侧链;c)包含叠氮基团;d)包含炔基;或e)包含醛或酮基团。在一些实施方案中,所述至少一个非天然氨基酸不包含芳族侧链。在一些实施方案中,所述至少一个非天然氨基酸包括N6-((2-叠氮基乙氧基)-羰基)-L-赖氨酸(AzK)、N6-(炔丙基乙氧基)-L-赖氨酸(PraK)、BCN-L-赖氨酸、降冰片烯赖氨酸、TCO-赖氨酸、甲基四嗪赖氨酸、烯丙氧基羰基赖氨酸、2-氨基-8-氧代壬酸、2-氨基-8-氧代辛酸、对-乙酰基-L-苯丙氨酸、对-叠氮基甲基-L-苯丙氨酸(pAMF)、对-碘-L-苯丙氨酸、间-乙酰基苯丙氨酸、2-氨基-8-氧代壬酸、对-炔丙基氧基苯丙氨酸、对-炔丙基-苯丙氨酸、3-甲基-苯丙氨酸、L-多巴、氟化苯丙氨酸、异丙基-L-苯丙氨酸、对-叠氮基-L-苯丙氨酸、对-酰基-L-苯丙氨酸、对-苯甲酰基-L-苯丙氨酸、对-溴苯丙氨酸、对-氨基-L-苯丙氨酸、异丙基-L-苯丙氨酸、O-烯丙基酪氨酸、O-甲基-L-酪氨酸、O-4-烯丙基-L-酪氨酸、4-丙基-L-酪氨酸、磷酰酪氨酸、三-O-乙酰基-GlcNAcp-丝氨酸、L-磷酸丝氨酸、磷酰丝氨酸、L-3-(2-萘基)丙氨酸、2-氨基-3-((2-((3-(苄氧基)-3-氧丙基)氨基)乙基)硒基)丙酸、2-氨基-3-(苯基硒基)丙酸或硒代半胱氨酸。在一些实施方案中,所述至少一个非天然氨基酸通过正交tRNA合成酶/tRNA对掺入经修饰的IL-10多肽中。在一些实施方案中,所述正交合成酶/tRNA对的正交tRNA包含至少一个非天然核碱基。在一些实施方案中,将经修饰的IL-10多肽与第二经修饰的IL-10多肽二聚化,从而产生包含两个非天然氨基酸的IL-10二聚体。在一些实施方案中,所述经修饰的IL-10多肽的非天然氨基酸位于与第二经修饰的IL-10多肽的非天然氨基酸不同的残基位置。在一些实施方案中,这两个非天然氨基酸在各自的IL-10多肽中位于相同的残基位置。在一些实施方案中,将经修饰的IL-10多肽与不包含非天然氨基酸的IL-10多肽二聚化。在一些实施方案中,将经修饰的IL-10多肽与野生型IL-10多肽二聚化。在一些实施方案中,所述经修饰的IL-10多肽通过至少一个非天然氨基酸共价附接至缀合部分。在一些实施方案中,所述缀合部分包括水溶性聚合物、脂质、蛋白质、或肽。在一些实施方案中,所述水溶性聚合物包含聚乙二醇(PEG)、聚(丙二醇)(PPG)、乙二醇和丙二醇的共聚物、聚(氧乙基化多元醇)、聚(烯烃醇)、聚(乙烯基吡咯烷酮)、聚(羟烷基甲基丙烯酰胺)、聚(甲基丙烯酸羟烷基酯)、聚(糖类)、聚(α-羟基酸)、聚(乙烯醇)、聚磷腈、聚噁唑啉(POZ)、聚(N-丙烯酰吗啉)或其组合。在一些实施方案中,所述水溶性聚合物包含PEG分子。在一些实施方案中,所述PEG分子是线性PEG。在一些实施方案中,所述PEG分子是支化PEG。在一些实施方案中,所述水溶性聚合物包含多糖。在一些实施方案中,所述多糖包括葡聚糖、聚唾液酸(PSA)、透明质酸(HA)、直链淀粉、肝素、硫酸乙酰肝素(HS)、糊精或羟乙基淀粉(HES)。在一些实施方案中,所述脂质包括脂肪酸。在一些实施方案中,所述脂肪酸包含约6至约26个碳原子、约6至约24个碳原子、约6至约22个碳原子、约6至约20个碳原子、约6至约18个碳原子、约20至约26个碳原子、约12至约26个碳原子、约12至约24个碳原子、约12至约22个碳原子、约12至约20个碳原子或约12至约18个碳原子。在一些实施方案中,所述脂肪酸是饱和脂肪酸。在一些实施方案中,所述蛋白质包括白蛋白、转铁蛋白或运甲状腺素蛋白。在一些实施方案中,所述蛋白质包括抗体或其结合片段。在一些实施方案中,所述抗体或其结合片段包括抗体的Fc部分。在一些实施方案中,所述肽包括XTEN肽、富含甘氨酸的高氨基酸聚合物(HAP)、PAS多肽、弹性蛋白样多肽(ELP)、CTP肽或明胶样蛋白(GLK)聚合物。在一些实施方案中,所述缀合部分通过接头与所述经修饰的IL-10的至少一个非天然氨基酸间接结合。在一些实施方案中,所述接头包括同双官能接头、异双官能接头、零长度接头、可切割或不可切割二肽接头、马来酰亚胺基团、间隔基或其组合。在一些实施方案中,所述经修饰的IL-10多肽是:a)全长IL-10多肽的功能活性片段;b)重组IL-10多肽;或c)重组人IL-10多肽。在一些实施方案中,所述经修饰的IL-10多肽包含N-末端缺失、C-末端缺失或其组合。在一些实施方案中,所述N-末端缺失包括从所述N-末端起缺失前1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、20、25或30个残基,其中所述残基位置参考SEQ ID NO:1中的位置。在一些实施方案中,所述C-末端缺失包括从所述C-末端起缺失最后1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、20或更多个残基,其中所述残基位置参考SEQ ID NO:1中的位置。在一些实施方案中,所述经修饰的IL-10多肽包括与SEQ ID NO:1约80%、85%、90%、95%、96%、97%、98%、或99%的序列同一性。在一些实施方案中,所述IL-10二聚体与IL-10R结合以形成IL-10/IL-10R复合物。在一些实施方案中,所述IL-10二聚体的增强的血浆半衰期是至少90分钟、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、18小时、24小时、36小时、48小时、3天、4天、5天、6天、7天、10天、12天、14天、21天、28天、30天、或长于野生型IL-10二聚体的血浆半衰期。在一些实施方案中,所述IL-10二聚体的增强的血浆半衰期是约90分钟、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、18小时、24小时、36小时、48小时、3天、4天、5天、6天、7天、10天、12天、14天、21天、28天、或30天。在一些实施方案中,所述至少一个非天然氨基酸的位置基本上不干扰IL-10多肽的二聚化。在一些实施方案中,所述至少一个非天然氨基酸的位置不显著干扰IL-10二聚体与IL-10R的结合。在一些实施方案中,所述至少一个非天然氨基酸的位置对IL-10R的信号传导的损害少于90%、80%、70%、60%、50%、40%、30%、20%、10%、5%、4%、3%、2%、1%、或更少。在一些实施方案中,所述至少一个非天然氨基酸的位置不显著损害IL-10R的信号传导。
在某些实施方案中,本文公开了经分离和修饰的白介素10(IL-10)多肽,其在所述多肽上的使多个肿瘤细胞向肿瘤浸润免疫细胞的暴露增强的位置处包含至少一个非天然氨基酸,其中所述多个肿瘤细胞的增强的暴露是与在野生型IL-10蛋白的存在下多个肿瘤细胞的暴露相比的。在一些实施方案中,本文还描述了经分离和修饰的白介素10(IL-10)多肽,其在所述多肽上的增强和/或维持肿瘤浸润免疫细胞的细胞毒性和/或克隆性扩增的位置处包含至少一个非天然氨基酸,其中所述增强的细胞毒性和克隆性扩增是与由等剂量的野生型IL-10蛋白导致的肿瘤浸润免疫细胞的暴露相比的。在一些实施方案中,所述至少一个非天然氨基酸位于螺旋C、D、或E中。在一些实施方案中,所述至少一个非天然氨基酸位于螺旋C、D、或E中的表面暴露位置。在一些实施方案中,所述至少一个非天然氨基酸的位置选自E67、Q70、E74、E75、Q79、N82、K88、K125、N126、N129、K130、或Q132,其中所述残基位置对应于如SEQ ID NO:1中所示的位置67、70、74、75、79、82、88、125、126、129、130、和132。在一些实施方案中,所述至少一个非天然氨基酸的位置选自E67、Q70、E74、E75、Q79、或N82,其中所述残基位置对应于如SEQ ID NO:1中所示的位置67、70、74、75、79、和82。在一些实施方案中,所述至少一个非天然氨基酸的位置选自K88、K125、N126、N129、K130、或Q132,其中所述残基位置对应于如SEQ ID NO:1中所示的位置88、125、126、129、130、和132。在一些实施方案中,所述至少一个非天然氨基酸的位置选自K125、N126、N129、K130、或Q132,其中所述残基位置对应于如SEQ ID NO:1中所示的位置125、126、129、130、和132。在一些实施方案中,所述至少一个非天然氨基酸的位置选自Q70、E74、N82、K88、N126、K130、或Q132,其中所述残基位置对应于如SEQ ID NO:1中所示的位置70、74、82、88、126、130、和132。在一些实施方案中,所述氨基酸序列与SEQ ID NO:1的氨基酸33至158至少或约99.0%相同。在一些实施方案中,所述氨基酸序列包含至少1、2、3、4、5、6、7、8、9、10、11、12、或13个野生型赖氨酸。在一些实施方案中,所述氨基酸序列在K34、K40、K49、K57、K88、K99、K117、K119、K125、K130、K134、K138、和K157中的一个或多个处包含野生型赖氨酸。在一些实施方案中,所述氨基酸序列在K34、K40、K49、K57、K88、K99、K117、K119、K125、K130、K134、K138、和K157中的至少2、3、4、5、6、7、8、9、10、11、或12个处包含野生型赖氨酸。在一些实施方案中,所述氨基酸序列在K34、K40、K49、K57、K88、K99、K117、K119、K125、K130、K134、K138、和K157处包含野生型赖氨酸。在一些实施方案中,所述至少一个非天然氨基酸的位置位于N-末端的近端。在一些实施方案中,所述至少一个非天然氨基酸位于从N-末端起的前10、20、30、40、或50个残基内。在一些实施方案中,所述至少一个非天然氨基酸位于C-末端的近端。在一些实施方案中,所述至少一个非天然氨基酸位于从C-末端起的前10、20、30、40或50个残基内。在一些实施方案中,所述至少一个非天然氨基酸:a)是赖氨酸类似物;b)包含芳族侧链;c)包含叠氮基团;d)包含炔基;或e)包含醛或酮基团。在一些实施方案中,所述至少一个非天然氨基酸不包含芳族侧链。在一些实施方案中,所述至少一个非天然氨基酸包括N6-((2-叠氮基乙氧基)-羰基)-L-赖氨酸(AzK)、N6-(炔丙基乙氧基)-L-赖氨酸(PraK)、BCN-L-赖氨酸、降冰片烯赖氨酸、TCO-赖氨酸、甲基四嗪赖氨酸、烯丙氧基羰基赖氨酸、2-氨基-8-氧代壬酸、2-氨基-8-氧代辛酸、对-乙酰基-L-苯丙氨酸、对-叠氮基甲基-L-苯丙氨酸(pAMF)、对-碘-L-苯丙氨酸、间-乙酰基苯丙氨酸、2-氨基-8-氧代壬酸、对-炔丙基氧基苯丙氨酸、对-炔丙基-苯丙氨酸、3-甲基-苯丙氨酸、L-多巴、氟化苯丙氨酸、异丙基-L-苯丙氨酸、对-叠氮基-L-苯丙氨酸、对-酰基-L-苯丙氨酸、对-苯甲酰基-L-苯丙氨酸、对-溴苯丙氨酸、对-氨基-L-苯丙氨酸、异丙基-L-苯丙氨酸、O-烯丙基酪氨酸、O-甲基-L-酪氨酸、O-4-烯丙基-L-酪氨酸、4-丙基-L-酪氨酸、磷酰酪氨酸、三-O-乙酰基-GlcNAcp-丝氨酸、L-磷酸丝氨酸、磷酰丝氨酸、L-3-(2-萘基)丙氨酸、2-氨基-3-((2-((3-(苄氧基)-3-氧丙基)氨基)乙基)硒基)丙酸、2-氨基-3-(苯基硒基)丙酸或硒代半胱氨酸。在一些实施方案中,所述至少一个非天然氨基酸通过正交tRNA合成酶/tRNA对掺入经修饰的IL-10多肽中。在一些实施方案中,所述正交合成酶/tRNA对的正交tRNA包含至少一个非天然核碱基。在一些实施方案中,将经修饰的IL-10多肽与第二经修饰的IL-10多肽二聚化,从而产生包含两个非天然氨基酸的IL-10二聚体。在一些实施方案中,所述经修饰的IL-10多肽的非天然氨基酸位于与第二经修饰的IL-10多肽的非天然氨基酸不同的残基位置。在一些实施方案中,这两个非天然氨基酸在各自的IL-10多肽中位于相同的残基位置。在一些实施方案中,将经修饰的IL-10多肽与不包含非天然氨基酸的IL-10多肽二聚化。在一些实施方案中,将经修饰的IL-10多肽与野生型IL-10多肽二聚化。在一些实施方案中,所述经修饰的IL-10多肽通过至少一个非天然氨基酸共价附接至缀合部分。在一些实施方案中,所述缀合部分包括水溶性聚合物、脂质、蛋白质、或肽。在一些实施方案中,所述水溶性聚合物包含聚乙二醇(PEG)、聚(丙二醇)(PPG)、乙二醇和丙二醇的共聚物、聚(氧乙基化多元醇)、聚(烯烃醇)、聚(乙烯基吡咯烷酮)、聚(羟烷基甲基丙烯酰胺)、聚(甲基丙烯酸羟烷基酯)、聚(糖类)、聚(α-羟基酸)、聚(乙烯醇)、聚磷腈、聚噁唑啉(POZ)、聚(N-丙烯酰吗啉)或其组合。在一些实施方案中,所述水溶性聚合物包含PEG分子。在一些实施方案中,所述PEG分子是线性PEG。在一些实施方案中,所述PEG分子是支化PEG。在一些实施方案中,所述水溶性聚合物包含多糖。在一些实施方案中,所述多糖包括葡聚糖、聚唾液酸(PSA)、透明质酸(HA)、直链淀粉、肝素、硫酸乙酰肝素(HS)、糊精或羟乙基淀粉(HES)。在一些实施方案中,所述脂质包括脂肪酸。在一些实施方案中,所述脂肪酸包含约6至约26个碳原子、约6至约24个碳原子、约6至约22个碳原子、约6至约20个碳原子、约6至约18个碳原子、约20至约26个碳原子、约12至约26个碳原子、约12至约24个碳原子、约12至约22个碳原子、约12至约20个碳原子或约12至约18个碳原子。在一些实施方案中,所述脂肪酸是饱和脂肪酸。在一些实施方案中,所述蛋白质包括白蛋白、转铁蛋白或运甲状腺素蛋白。在一些实施方案中,所述蛋白质包括抗体或其结合片段。在一些实施方案中,所述抗体或其结合片段包括抗体的Fc部分。在一些实施方案中,所述肽包括XTEN肽、富含甘氨酸的高氨基酸聚合物(HAP)、PAS多肽、弹性蛋白样多肽(ELP)、CTP肽或明胶样蛋白(GLK)聚合物。在一些实施方案中,所述缀合部分通过接头与所述经修饰的IL-10的至少一个非天然氨基酸间接结合。在一些实施方案中,所述接头包括同双官能接头、异双官能接头、零长度接头、可切割或不可切割二肽接头、马来酰亚胺基团、间隔基或其组合。在一些实施方案中,所述经修饰的IL-10多肽是:a)全长IL-10多肽的功能活性片段;b)重组IL-10多肽;或c)重组人IL-10多肽。在一些实施方案中,所述经修饰的IL-10多肽包含N-末端缺失、C-末端缺失或其组合。在一些实施方案中,所述N-末端缺失包括从所述N-末端起缺失前1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、20、25或30个残基,其中所述残基位置参考SEQ ID NO:1中的位置。在一些实施方案中,所述C-末端缺失包括从所述C-末端起缺失最后1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、20或更多个残基,其中所述残基位置参考SEQ ID NO:1中的位置。在一些实施方案中,所述经修饰的IL-10多肽包括与SEQ ID NO:1约80%、85%、90%、95%、96%、97%、98%、或99%的序列同一性。在一些实施方案中,所述IL-10二聚体与IL-10R结合以形成IL-10/IL-10R复合物。在一些实施方案中,所述IL-10二聚体的增强的血浆半衰期是至少90分钟、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、18小时、24小时、36小时、48小时、3天、4天、5天、6天、7天、10天、12天、14天、21天、28天、30天、或长于野生型IL-10二聚体的血浆半衰期。在一些实施方案中,所述IL-10二聚体的增强的血浆半衰期是约90分钟、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、18小时、24小时、36小时、48小时、3天、4天、5天、6天、7天、10天、12天、14天、21天、28天、或30天。在一些实施方案中,所述至少一个非天然氨基酸的位置基本上不干扰IL-10多肽的二聚化。在一些实施方案中,所述至少一个非天然氨基酸的位置不显著干扰IL-10二聚体与IL-10R的结合。在一些实施方案中,所述至少一个非天然氨基酸的位置对IL-10R的信号传导的损害少于90%、80%、70%、60%、50%、40%、30%、20%、10%、5%、4%、3%、2%、1%、或更少。在一些实施方案中,所述至少一个非天然氨基酸的位置不显著损害IL-10R的信号传导。在一些实施方案中,所述至少一个非天然氨基酸的位置不损害如通过Stat3的磷酸化和/或通过IL-10R信号传导的激活所测量的IL-10R的信号传导。
在某些实施方案中,本文公开了编码本文所述的经修饰的IL-10多肽的多核酸聚合物。
在某些实施方案中,本文公开了包含本文所述的多核酸聚合物的载体。
在某些实施方案中,本文公开了白介素10(IL-10)缀合物,所述缀合物包含含有至少一个非天然氨基酸的IL-10多肽和与所述至少一个非天然氨基酸结合的缀合部分。在一些实施方案中,所述缀合部分与所述至少一个非天然氨基酸直接结合。在一些实施方案中,所述缀合部分与所述至少一个非天然氨基酸经由接头间接结合。在一些实施方案中,所述至少一个非天然氨基酸位于螺旋C、D、或E中。在一些实施方案中,所述至少一个非天然氨基酸位于螺旋C、D、或E中的表面暴露位置。在一些实施方案中,所述至少一个非天然氨基酸的位置选自E67、Q70、E74、E75、Q79、N82、K88、K125、N126、N129、K130、或Q132,其中所述残基位置对应于如SEQ ID NO:1中所示的位置67、70、74、75、79、82、88、125、126、129、130、和132。在一些实施方案中,所述至少一个非天然氨基酸的位置选自E67、Q70、E74、E75、Q79、或N82,其中所述残基位置对应于如SEQ ID NO:1中所示的位置67、70、74、75、79、和82。在一些实施方案中,所述至少一个非天然氨基酸的位置选自K88、K125、N126、N129、K130、或Q132,其中所述残基位置对应于如SEQ ID NO:1中所示的位置88、125、126、129、130、和132。
在一些实施方案中,所述至少一个非天然氨基酸的位置选自K125、N126、N129、K130、或Q132,其中所述残基位置对应于如SEQ ID NO:1中所示的位置125、126、129、130、和132。在一些实施方案中,所述至少一个非天然氨基酸的位置选自Q70、E74、N82、K88、N126、K130、或Q132,其中所述残基位置对应于如SEQ ID NO:1中所示的位置70、74、82、88、126、130、和132。在一些实施方案中,所述氨基酸序列与SEQ ID NO:1的氨基酸33至158至少或约99.0%相同。在一些实施方案中,所述氨基酸序列包含至少1、2、3、4、5、6、7、8、9、10、11、12、或13个野生型赖氨酸。在一些实施方案中,所述氨基酸序列在K34、K40、K49、K57、K88、K99、K117、K119、K125、K130、K134、K138、和K157中的一个或多个处包含野生型赖氨酸。在一些实施方案中,所述氨基酸序列在K34、K40、K49、K57、K88、K99、K117、K119、K125、K130、K134、K138、和K157中的至少2、3、4、5、6、7、8、9、10、11、或12个处包含野生型赖氨酸。在一些实施方案中,所述氨基酸序列在K34、K40、K49、K57、K88、K99、K117、K119、K125、K130、K134、K138、和K157处包含野生型赖氨酸。在一些实施方案中,所述至少一个非天然氨基酸位于N-末端的近端。在一些实施方案中,所述至少一个非天然氨基酸位于从N-末端起的前10、20、30、40、或50个残基内。在一些实施方案中,所述至少一个非天然氨基酸位于C-末端的近端。在一些实施方案中,所述至少一个非天然氨基酸位于从C-末端起的前10、20、30、40或50个残基内。在一些实施方案中,IL-10多肽包含两个或更多个非天然氨基酸。在一些实施方案中,将IL-10多肽与包含至少一个非天然氨基酸的第二IL-10多肽二聚化。在一些实施方案中,将IL-10多肽与不包含非天然氨基酸的IL-10多肽二聚化。在一些实施方案中,将IL-10多肽与野生型IL-10多肽二聚化。在一些实施方案中,IL-10二聚体包含两个或更多个缀合部分,其中所述两个或更多个缀合部分中的每一个均与在各自的IL-10单体中位于相同的残基位置处的非天然氨基酸结合。在一些实施方案中,IL-10二聚体包含两个或更多个缀合部分,其中所述两个或更多个缀合部分中的每一个均与在IL-10二聚体中位于不同的残基位置的非天然氨基酸结合。在一些实施方案中,IL-10多肽包含增强的血浆半衰期,其中所述增强的血浆半衰期是与野生型IL-10蛋白的血浆半衰期相比的。在一些实施方案中,IL-10多肽是生物活性IL-10多肽,其与IL-10受体(IL-10R)结合以形成IL-10/IL-10R复合物并且激活IL-10R信号传导通路。
在某些实施方案中,本文公开了IL-10/IL-10R复合物,所述复合物包含含有至少一个非天然氨基酸的经修饰的IL-10二聚体和IL-10R,其中与野生型IL-10二聚体的血浆半衰期相比,所述经修饰的IL-10二聚体具有增强的血浆半衰期。在一些实施方案中,所述经修饰的IL-10二聚体进一步包含共价附接至至少一个非天然氨基酸的缀合部分。
在某些实施方案中,本文公开了一种药物组合物,其包含:本文所述的经分离和修饰的IL-10多肽或本文所述的IL-10缀合物;以及药学上可接受的赋形剂。在一些实施方案中,所述药物组合物被配制用于全身递送。在一些实施方案中,所述药物组合物被配制用于肠胃外施用。
在某些实施方案中,本文公开了一种治疗有需要的受试者的增殖性疾病或病症的方法,所述方法包括:向所述受试者施用治疗有效量的本文所述的经分离和修饰的IL-10多肽、本文所述的IL-10缀合物;或本文所述的药物组合物。在一些实施方案中,所述增殖性疾病或病症是癌症。在一些实施方案中,所述癌症是实体瘤癌症。在一些实施方案中,所述实体瘤癌症是膀胱癌、骨癌、脑癌、乳腺癌、结直肠癌、食道癌、眼癌、头颈癌、肾癌、肺癌、黑色素瘤、卵巢癌、胰腺癌或前列腺癌。在一些实施方案中,所述癌症是恶性血液病。在一些实施方案中,所述恶性血液病是慢性淋巴细胞性白血病(CLL)、小淋巴细胞性淋巴瘤(SLL)、滤泡性淋巴瘤(FL)、弥漫性大B细胞淋巴瘤(DLBCL)、套细胞淋巴瘤(MCL)、华氏巨球蛋白血症(Waldenstrom’s macroglobulinemia)、多发性骨髓瘤、结外边缘区B细胞淋巴瘤、结边缘区B细胞淋巴瘤、伯基特淋巴瘤、非伯基特高级B细胞淋巴瘤、原发性纵隔B细胞淋巴瘤(PMBL)、免疫母细胞性大细胞淋巴瘤、前体B淋巴母细胞淋巴瘤、B细胞前淋巴细胞性白血病、淋巴浆细胞性淋巴瘤、脾边缘区淋巴瘤、浆细胞骨髓瘤、浆细胞瘤、纵隔(胸腺)大B细胞淋巴瘤、血管内大B细胞淋巴瘤、原发性渗出性淋巴瘤或淋巴瘤样肉芽肿病。在一些实施方案中,所述方法进一步包括施用另外的治疗剂。在一些实施方案中,将本文所述的经分离和修饰的IL-10多肽、本文所述的IL-10缀合物;或本文所述的药物组合物和另外的治疗剂同时施用或共同配制。在一些实施方案中,将本文所述的经分离和修饰的IL-10多肽、本文所述的IL-10缀合物;或本文所述的药物组合物和另外的治疗剂顺序施用。在一些实施方案中,将本文所述的经分离和修饰的IL-10多肽、本文所述的IL-10缀合物;或本文所述的药物组合物在另外的治疗剂之前施用。在一些实施方案中,将本文所述的经分离和修饰的IL-10多肽、本文所述的IL-10缀合物;或本文所述的药物组合物在施用另外的治疗剂之后施用。
在某些实施方案中,本文公开了一种试剂盒,其包含本文所述的经分离和修饰的IL-10多肽、本文所述的IL-10缀合物;或本文所述的药物组合物。
附图说明
本公开文本的不同方面在随附权利要求书中具体阐述。将通过参考阐述了利用本公开文本的原理的说明性实施方案的以下具体实施方式和附图获得对本公开文本的特征和优点的更好的理解,在所述附图中:
图1示出了示例性的非天然氨基酸。此图改编自Young等人,“Beyond thecanonical 20amino acids:expanding the genetic lexicon,”J.of BiologicalChemistry 285(15):11039-11044(2010)的图2。
图2A-图2B展示了示例性的非天然氨基酸。图2A展示了示例性的赖氨酸衍生物。图2B展示了示例性的苯丙氨酸衍生物。
图3A-图3D展示了示例性的非天然氨基酸。这些非天然氨基酸(UAA)已经基因编码在蛋白质中(图3A-UAA#1-42;图3B-UAA#43-89;图3C-UAA#90-128;图3D-UAA#129-167)。图3A-3D改编自Dumas等人,Chemical Science 2015,6,50-69的表1。
具体实施方式
细胞因子包括一族细胞信号传导蛋白,诸如趋化因子、干扰素、白介素、淋巴因子、肿瘤坏死因子、和在先天和适应性免疫细胞稳态中起作用的其他生长因子。细胞因子是由免疫细胞(诸如巨噬细胞、B淋巴细胞、T淋巴细胞和肥大细胞、内皮细胞、成纤维细胞和不同的基质细胞)产生的。在一些情况下,细胞因子调节体液与基于细胞的免疫应答之间的平衡。
白介素是信号传导蛋白,其调节T和B淋巴细胞、单核细胞谱系的细胞、嗜中性粒细胞、嗜碱性粒细胞、嗜酸性粒细胞、巨核细胞和造血细胞的发育和分化。白介素是由辅助CD4T和B淋巴细胞、单核细胞、巨噬细胞、内皮细胞、和其他组织驻留物产生的。在一些情况下,存在约15种白介素:白介素1-13、白介素15和白介素17。
IL-10通过肿瘤浸润的CD8+T细胞的激活、CD8+T细胞的细胞增殖、IFN-γ的诱导(其增加肿瘤细胞上的MHC I类和巨噬细胞上的MHC II类)以及介导靶细胞裂解的细胞毒性蛋白的诱导来产生肿瘤免疫。在CD8+T细胞上增加的T细胞受体刺激提供了抗凋亡和增殖信号。IL-10在肿瘤微环境(TME)中的出乎意料的作用是抑制促炎性Th17细胞和负责肿瘤相关炎症的细胞因子,从而导致抑制抗肿瘤效应细胞反应。临床前研究已显示,IL-10的缺乏会增加肿瘤发生率并且减少免疫监视。此外,用聚乙二醇化的IL-10治疗Her2转基因小鼠已经导致肿瘤排斥,但是需要表达IFN-γ和颗粒酶的CD8+T细胞的表达,其中在肿瘤中CD8a/b+T细胞显著增加。
IL-10在体内具有相对短的血清半衰期。确实,如通过体外生物测定或在败血性休克模型系统中通过功效测量的小鼠的半衰期[参见Smith等人,Cellular Immunology 173:207–214(1996)]为约2至6小时。
在某些实施方案中,本文公开了具有增强的血浆半衰期的经修饰的IL-10多肽。在一些实施方案中,本文还描述了经修饰的IL-10多肽,其在二聚化后增强多个肿瘤细胞向肿瘤浸润免疫细胞的暴露。在其他实施方案中,本文进一步描述了形成生物活性IL-10二聚体的经修饰的IL-10多肽。
另外描述的包括IL-10多肽缀合物、包含一种或多种经修饰的IL-10多肽的药物组合物、和治疗疾病或适应症的方法。
经修饰的IL-10多肽
在一些实施方案中,本文描述了在氨基酸位置处经修饰的IL-10多肽。在一些情况下,所述修饰是针对天然氨基酸的。在一些情况下,所述修饰是针对非天然氨基酸的。在一些情况下,本文描述了包含至少一个非天然氨基酸的经分离和修饰的IL-10多肽。在一些情况下,IL-10多肽是经分离和纯化的哺乳动物IL-10,例如啮齿动物IL-10蛋白或人IL-10蛋白。在一些情况下,IL-10多肽是人IL-10蛋白。在一些情况下,IL-10多肽包含与SEQ ID NO:1具有约80%、85%、90%、95%、96%、97%、98%、或99%的序列同一性。在一些情况下,IL-10多肽包含SEQ ID NO:1的序列。在一些情况下,IL-10多肽由SEQ ID NO:1的序列组成。在另外的情况下,IL-10多肽包含与SEQ ID NO:2具有约80%、85%、90%、95%、96%、97%、98%、或99%的序列同一性。在另外的情况下,IL-10多肽包含SEQ ID NO:2的序列。在另外的情况下,IL-10多肽由SEQ ID NO:2的序列组成。
在一些情况下,IL-10多肽是截短的变体。在一些情况下,所述截短是N-末端缺失。在其他情况下,所述截短是C-末端缺失。在另外的情况下,所述截短包括N-末端和C-末端缺失两者。例如,所述截短可以是从N-末端或C-末端或两个末端起缺失至少或约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、20或更多个残基。在一些情况下,IL-10多肽包含至少或约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、20或更多个残基的N-末端缺失。在一些情况下,IL-10多肽包含至少或约1、2、3、4、5、6、7、8、9或10个残基的N-末端缺失。在一些情况下,IL-10多肽包含至少或约2个残基的N-末端缺失。在一些情况下,IL-10多肽包含至少或约3个残基的N-末端缺失。在一些情况下,IL-10多肽包含至少或约4个残基的N-末端缺失。在一些情况下,IL-10多肽包含至少或约5个残基的N-末端缺失。在一些情况下,IL-10多肽包含至少或约6个残基的N-末端缺失。在一些情况下,IL-10多肽包含至少或约7个残基的N-末端缺失。在一些情况下,IL-10多肽包含至少或约8个残基的N-末端缺失。在一些情况下,IL-10多肽包含至少或约9个残基的N-末端缺失。在一些情况下,IL-10多肽包含至少或约10个残基的N-末端缺失。
在一些实施方案中,IL-10多肽是功能活性片段。在一些情况下,功能活性片段包含IL-10区域5-160、10-160、15-160、20-160、1-155、5-155、10-155、15-155、20-155、1-150、5-150、10-150、15-150、或20-150,其中残基位置参考SEQ ID NO:1中的位置。在一些情况下,功能活性片段包含IL-10区域5-160,其中残基位置参考SEQ ID NO:1中的位置。在一些情况下,功能活性片段包含IL-10区域10-160,其中残基位置参考SEQ ID NO:1中的位置。在一些情况下,功能活性片段包含IL-10区域15-160,其中残基位置参考SEQ ID NO:1中的位置。在一些情况下,功能活性片段包含IL-10区域20-160,其中残基位置参考SEQ ID NO:1中的位置。在一些情况下,功能活性片段包含IL-10区域1-155,其中残基位置参考SEQ ID NO:1中的位置。在一些情况下,功能活性片段包含IL-10区域5-155,其中残基位置参考SEQ IDNO:1中的位置。在一些情况下,功能活性片段包含IL-10区域10-155,其中残基位置参考SEQID NO:1中的位置。在一些情况下,功能活性片段包含IL-10区域15-155,其中残基位置参考SEQ ID NO:1中的位置。在一些情况下,功能活性片段包含IL-10区域20-155,其中残基位置参考SEQ ID NO:1中的位置。在一些情况下,功能活性片段包含IL-10区域1-150,其中残基位置参考SEQ ID NO:1中的位置。在一些情况下,功能活性片段包含IL-10区域5-150,其中残基位置参考SEQ ID NO:1中的位置。在一些情况下,功能活性片段包含IL-10区域10-150,其中残基位置参考SEQ ID NO:1中的位置。在一些情况下,功能活性片段包含IL-10区域15-150,其中残基位置参考SEQ ID NO:1中的位置。在一些情况下,功能活性片段包含IL-10区域20-150,其中残基位置参考SEQ ID NO:1中的位置。
在一些实施方案中,本文描述了包含至少一个非天然氨基酸的IL-10多肽。在一些情况下,所述至少一个非天然氨基酸位于螺旋C、D、或E中。在一些情况下,螺旋C包含残基L60-N82,其中所述位置参考SEQ ID NO:1中的位置。在一些情况下,螺旋D包含残基I87-C108,其中所述位置参考SEQ ID NO:1中的位置。在一些情况下,螺旋E包含残基S118-L131,其中所述位置参考SEQ ID NO:1中的位置。在一些情况下,所述至少一个非天然氨基酸位于螺旋C、D、或E中的表面暴露位置。
在一些实施方案中,本文描述了IL-10多肽,其在选自E67、Q70、E74、E75、Q79、N82、K88、K125、N126、N129、K130、或Q132的位置处包含至少一个非天然氨基酸,其中所述残基位置对应于如SEQ ID NO:1中所示的位置67、70、74、75、79、82、88、125、126、129、130、和132。在一些情况下,所述至少一个非天然氨基酸的位置选自E67、Q70、E74、E75、Q79、或N82,其中所述残基位置对应于如SEQ ID NO:1中所示的位置67、70、74、75、79、和82。在一些情况下,所述至少一个非天然氨基酸的位置选自K88、K125、N126、N129、K130、或Q132,其中所述残基位置对应于如SEQ ID NO:1中所示的位置88、125、126、129、130、和132。在一些情况下,所述至少一个非天然氨基酸的位置选自K125、N126、N129、K130、或Q132,其中所述残基位置对应于如SEQ ID NO:1中所示的位置125、126、129、130、和132。在一些情况下,所述至少一个非天然氨基酸的位置选自Q70、E74、N82、K88、N126、K130、或Q132,其中所述残基位置对应于如SEQ ID NO:1中所示的位置70、74、82、88、126、130、和132。在一些情况下,所述至少一个非天然氨基酸的位置选自E67。在一些情况下,所述至少一个非天然氨基酸的位置选自Q70。在一些情况下,所述至少一个非天然氨基酸的位置选自E74。在一些情况下,所述至少一个非天然氨基酸的位置选自E75。在一些情况下,所述至少一个非天然氨基酸的位置选自Q79。在一些情况下,所述至少一个非天然氨基酸的位置选自N82。在一些情况下,所述至少一个非天然氨基酸的位置选自K88。在一些情况下,所述至少一个非天然氨基酸的位置选自K125。在一些情况下,所述至少一个非天然氨基酸的位置选自N126。在一些情况下,所述至少一个非天然氨基酸的位置选自N129。在一些情况下,所述至少一个非天然氨基酸的位置选自K130。在一些情况下,所述至少一个非天然氨基酸的位置选自Q132。
在一些情况下,所述至少一个非天然氨基酸位于N-末端的近端。如本文所用,近端是指位于距N-末端残基至少1个残基且直到距N-末端残基约50个残基处的残基。在一些情况下,所述至少一个非天然氨基酸位于从N-末端残基起的前10、20、30、40或50个残基内。在一些情况下,所述至少一个非天然氨基酸位于从N-末端残基起的前10个残基内。在一些情况下,所述至少一个非天然氨基酸位于从N-末端残基起的前20个残基内。在一些情况下,所述至少一个非天然氨基酸位于从N-末端残基起的前30个残基内。在一些情况下,所述至少一个非天然氨基酸位于从N-末端残基起的前40个残基内。在一些情况下,所述至少一个非天然氨基酸位于从N-末端残基起的前50个残基内。
在一些情况下,所述至少一个非天然氨基酸是N-末端残基。
在一些情况下,所述至少一个非天然氨基酸位于C-末端的近端。如本文所用,近端是指位于距C-末端残基至少1个残基且直到距C-末端残基约50个残基处的残基。在一些情况下,所述至少一个非天然氨基酸位于从C-末端残基起的前10、20、30、40或50个残基内。在一些情况下,所述至少一个非天然氨基酸位于从C-末端残基起的前10个残基内。在一些情况下,所述至少一个非天然氨基酸位于从C-末端残基起的前20个残基内。在一些情况下,所述至少一个非天然氨基酸位于从C-末端残基起的前30个残基内。在一些情况下,所述至少一个非天然氨基酸位于从C-末端残基起的前40个残基内。在一些情况下,所述至少一个非天然氨基酸位于从C-末端残基起的前50个残基内。
在一些情况下,所述至少一个非天然氨基酸是C-末端残基。
在一些实施方案中,IL-10多肽是能够与IL-10R结合并且激活信号传导通路的功能活性单体。在一些情况下,功能活性IL-10单体具有增强的血浆半衰期。在一些情况下,所述增强的血浆半衰期是与野生型IL-10二聚体的血浆半衰期相比的。在一些情况下,IL-10多肽的增强的血浆半衰期是至少90分钟、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、18小时、24小时、36小时、48小时、3天、4天、5天、6天、7天、10天、12天、14天、21天、28天、30天、或长于野生型IL-10蛋白的血浆半衰期。在一些情况下,与野生型IL-10蛋白的血浆半衰期相比,IL-10多肽的增强的血浆半衰期是约90分钟、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、18小时、24小时、36小时、48小时、3天、4天、5天、6天、7天、10天、12天、14天、21天、28天、或30天。
在一些实施方案中,IL-10多肽形成IL-10二聚体,例如生物活性二聚体。在一些情况下,IL-10二聚体(例如,生物活性IL-10二聚体)包含至少一个非天然氨基酸。在其他情况下,IL-10二聚体(例如,生物活性IL-10二聚体)包含至少两个或更多个非天然氨基酸。在另外的情况下,IL-10二聚体(例如,生物活性IL-10二聚体)包含至少三个、四个、五个、六个、七个、八个、或更多个非天然氨基酸。
在一些实施方案中,IL-10二聚体(例如,生物活性IL-10二聚体)包含两个非天然氨基酸。在一些情况下,这两个非天然氨基酸均位于相同的IL-10多肽上。在其他情况下,每个IL-10多肽均包含一个非天然氨基酸。在这种情况下,每个非天然氨基酸位于IL-10多肽中不同的残基位置处(即,一个非天然氨基酸位于一个IL-10多肽中的第一残基位置处并且第二非天然氨基酸位于另一个IL-10多肽中的第二残基位置处并且第二残基位置不同于第一残基位置)。在另外的情况下,每个非天然氨基酸位于各自的IL-10多肽中相同的残基位置处。
在一些实施方案中,IL-10二聚体(例如,生物活性IL-10二聚体)包含一个非天然氨基酸。在这种情况下,将经修饰的IL-10多肽与不包含非天然氨基酸的IL-10多肽二聚化。在一些情况下,不包含非天然氨基酸的IL-10多肽包含用天然氨基酸的突变。在其他情况下,不包含非天然氨基酸的IL-10多肽是IL-10变体,例如,截短的IL-10蛋白。在一些情况下,将经修饰的IL-10多肽与野生型IL-10多肽二聚化。
在一些情况下,所述至少一个非天然氨基酸的位置基本上不干扰IL-10多肽的二聚化。
在一些情况下,所述至少一个非天然氨基酸的位置进一步不显著干扰IL-10二聚体与IL-10R的结合。
在一些实施方案中,所述至少一个非天然氨基酸的位置对IL-10R的信号传导的损害少于90%、80%、70%、60%、50%、40%、30%、20%、10%、5%、4%、3%、2%、1%、或更少。在一些情况下,所述至少一个非天然氨基酸的位置对IL-10R的信号传导的损害少于80%。在一些情况下,所述至少一个非天然氨基酸的位置对IL-10R的信号传导的损害少于70%。在一些情况下,所述至少一个非天然氨基酸的位置对IL-10R的信号传导的损害少于60%。在一些情况下,所述至少一个非天然氨基酸的位置对IL-10R的信号传导的损害少于50%。在一些情况下,所述至少一个非天然氨基酸的位置对IL-10R的信号传导的损害少于40%。在一些情况下,所述至少一个非天然氨基酸的位置对IL-10R的信号传导的损害少于30%。在一些情况下,所述至少一个非天然氨基酸的位置对IL-10R的信号传导的损害少于20%。在一些情况下,所述至少一个非天然氨基酸的位置对IL-10R的信号传导的损害少于10%。在一些情况下,所述至少一个非天然氨基酸的位置对IL-10R的信号传导的损害少于5%。在一些情况下,所述至少一个非天然氨基酸的位置对IL-10R的信号传导的损害少于2%。在一些情况下,所述至少一个非天然氨基酸的位置对IL-10R的信号传导的损害少于1%。在一些情况下,所述至少一个非天然氨基酸的位置不显著损害IL-10R的信号传导。在另外的情况下,所述至少一个非天然氨基酸的位置不损害IL-10R的信号传导。
在一些情况下,生物活性IL-10二聚体具有增强的血浆半衰期。在一些情况下,所述增强的血浆半衰期是与野生型IL-10二聚体的血浆半衰期相比的。在一些情况下,IL-10二聚体的增强的血浆半衰期是至少90分钟、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、18小时、24小时、36小时、48小时、3天、4天、5天、6天、7天、10天、12天、14天、21天、28天、30天、或长于野生型IL-10二聚体的血浆半衰期。在一些情况下,IL-10二聚体的增强的血浆半衰期是至少90分钟或长于野生型IL-10二聚体的血浆半衰期。在一些情况下,IL-10二聚体的增强的血浆半衰期是至少2小时或长于野生型IL-10二聚体的血浆半衰期。在一些情况下,IL-10二聚体的增强的血浆半衰期是至少3小时或长于野生型IL-10二聚体的血浆半衰期。在一些情况下,IL-10二聚体的增强的血浆半衰期是至少4小时或长于野生型IL-10二聚体的血浆半衰期。在一些情况下,IL-10二聚体的增强的血浆半衰期是至少5小时或长于野生型IL-10二聚体的血浆半衰期。在一些情况下,IL-10二聚体的增强的血浆半衰期是至少6小时或长于野生型IL-10二聚体的血浆半衰期。在一些情况下,IL-10二聚体的增强的血浆半衰期是至少10小时或长于野生型IL-10二聚体的血浆半衰期。在一些情况下,IL-10二聚体的增强的血浆半衰期是至少12小时或长于野生型IL-10二聚体的血浆半衰期。在一些情况下,IL-10二聚体的增强的血浆半衰期是至少18小时或长于野生型IL-10二聚体的血浆半衰期。在一些情况下,IL-10二聚体的增强的血浆半衰期是至少24小时或长于野生型IL-10二聚体的血浆半衰期。在一些情况下,IL-10二聚体的增强的血浆半衰期是至少36小时或长于野生型IL-10二聚体的血浆半衰期。在一些情况下,IL-10二聚体的增强的血浆半衰期是至少48小时或长于野生型IL-10二聚体的血浆半衰期。在一些情况下,IL-10二聚体的增强的血浆半衰期是至少3天或长于野生型IL-10二聚体的血浆半衰期。在一些情况下,IL-10二聚体的增强的血浆半衰期是至少4天或长于野生型IL-10二聚体的血浆半衰期。在一些情况下,IL-10二聚体的增强的血浆半衰期是至少5天或长于野生型IL-10二聚体的血浆半衰期。在一些情况下,IL-10二聚体的增强的血浆半衰期是至少6天或长于野生型IL-10二聚体的血浆半衰期。在一些情况下,IL-10二聚体的增强的血浆半衰期是至少7天或长于野生型IL-10二聚体的血浆半衰期。在一些情况下,IL-10二聚体的增强的血浆半衰期是至少10天或长于野生型IL-10二聚体的血浆半衰期。在一些情况下,IL-10二聚体的增强的血浆半衰期是至少12天或长于野生型IL-10二聚体的血浆半衰期。在一些情况下,IL-10二聚体的增强的血浆半衰期是至少14天或长于野生型IL-10二聚体的血浆半衰期。在一些情况下,IL-10二聚体的增强的血浆半衰期是至少21天或长于野生型IL-10二聚体的血浆半衰期。在一些情况下,IL-10二聚体的增强的血浆半衰期是至少28天或长于野生型IL-10二聚体的血浆半衰期。在一些情况下,IL-10二聚体的增强的血浆半衰期是至少30天或长于野生型IL-10二聚体的血浆半衰期。
在一些情况下,生物活性IL-10二聚体具有约90分钟、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、18小时、24小时、36小时、48小时、3天、4天、5天、6天、7天、10天、12天、14天、21天、28天、或30天的增强的血浆半衰期。在一些情况下,生物活性IL-10二聚体具有约90分钟的增强的血浆半衰期。在一些情况下,生物活性IL-10二聚体具有约2小时的增强的血浆半衰期。在一些情况下,生物活性IL-10二聚体具有约3小时的增强的血浆半衰期。在一些情况下,生物活性IL-10二聚体具有约4小时的增强的血浆半衰期。在一些情况下,生物活性IL-10二聚体具有约5小时的增强的血浆半衰期。在一些情况下,生物活性IL-10二聚体具有约6小时的增强的血浆半衰期。在一些情况下,生物活性IL-10二聚体具有约7小时的增强的血浆半衰期。在一些情况下,生物活性IL-10二聚体具有约8小时的增强的血浆半衰期。在一些情况下,生物活性IL-10二聚体具有约9小时的增强的血浆半衰期。在一些情况下,生物活性IL-10二聚体具有约10小时的增强的血浆半衰期。在一些情况下,生物活性IL-10二聚体具有约11小时的增强的血浆半衰期。在一些情况下,生物活性IL-10二聚体具有约12小时的增强的血浆半衰期。在一些情况下,生物活性IL-10二聚体具有约18小时的增强的血浆半衰期。在一些情况下,生物活性IL-10二聚体具有约24小时的增强的血浆半衰期。在一些情况下,生物活性IL-10二聚体具有约36小时的增强的血浆半衰期。在一些情况下,生物活性IL-10二聚体具有约48小时的增强的血浆半衰期。在一些情况下,生物活性IL-10二聚体具有约3天的增强的血浆半衰期。在一些情况下,生物活性IL-10二聚体具有约4天的增强的血浆半衰期。在一些情况下,生物活性IL-10二聚体具有约5天的增强的血浆半衰期。在一些情况下,生物活性IL-10二聚体具有约6天的增强的血浆半衰期。在一些情况下,生物活性IL-10二聚体具有约7天的增强的血浆半衰期。在一些情况下,生物活性IL-10二聚体具有约10天的增强的血浆半衰期。在一些情况下,生物活性IL-10二聚体具有约12天的增强的血浆半衰期。在一些情况下,生物活性IL-10二聚体具有约14天的增强的血浆半衰期。在一些情况下,生物活性IL-10二聚体具有约21天的增强的血浆半衰期。在一些情况下,生物活性IL-10二聚体具有约28天的增强的血浆半衰期。在一些情况下,生物活性IL-10二聚体具有约30天的增强的血浆半衰期。
IL-10缀合物
在某些实施方案中,本文描述了IL-10缀合物。在一些实施方案中,IL-10缀合物包含含有至少一个非天然氨基酸的IL-10多肽和与至少一个非天然氨基酸结合的缀合部分。在一些情况下,缀合部分与至少一个非天然氨基酸直接结合。在其他情况下,缀合部分经由下文描述的接头与至少一个非天然氨基酸或末端残基间接结合。
同上所述,所述至少一个非天然氨基酸任选地位于螺旋C、D、或E(例如,表面可及的残基)中。在一些情况下,残基包括E67、Q70、E74、E75、Q79、N82、K88、K125、N126、N129、K130、或Q132,其中所述残基位置对应于如SEQ ID NO:1中所示的位置67、70、74、75、79、82、88、125、126、129、130、和132。在一些情况下,残基包括E67、Q70、E74、E75、Q79、或N82,其中所述残基位置对应于如SEQ ID NO:1中所示的位置67、70、74、75、79、和82。在一些情况下,残基包括K88、K125、N126、N129、K130、或Q132,其中所述残基位置对应于如SEQ ID NO:1中所示的位置88、125、126、129、130、和132。在一些情况下,残基包括K125、N126、N129、K130、或Q132,其中所述残基位置对应于如SEQ ID NO:1中所示的位置125、126、129、130、和132。在一些情况下,残基包括Q70、E74、N82、K88、N126、K130、或Q132,其中所述残基位置对应于如SEQ ID NO:1中所示的位置70、74、82、88、126、130、和132。
在一些实施方案中,所述至少一个非天然氨基酸位于N-末端的近端(例如,N-末端残基的近端)。例如,所述至少一个非天然氨基酸任选地位于从N-末端起的前10、20、30、40、或50个残基内。在一些情况下,所述至少一个非天然氨基酸位于N-末端(即,所述至少一个非天然氨基酸是IL-10多肽的N-末端残基)。
在其他实施方案中,所述至少一个非天然氨基酸位于C-末端的近端(例如,C-末端残基的近端)。例如,所述至少一个非天然氨基酸任选地位于从C-末端起的前10、20、30、40、或50个残基内。在一些情况下,所述至少一个非天然氨基酸位于C-末端(即,所述至少一个非天然氨基酸是IL-10多肽的C-末端残基)。
在一些情况下,IL-10缀合物包含与非天然氨基酸结合的一个缀合部分。
在一些情况下,IL-10缀合物包含能够激活IL-10R信号传导通路的IL-10单体。在其他情况下,IL-10缀合物包含功能活性IL-10二聚体。
在一些情况下,IL-10缀合物包含两个或更多个缀合部分,其中所述两个或更多个缀合部分中的每一个与不同的非天然氨基酸结合。在一些情况下,所述两个或更多个缀合部分与相同的IL-10多肽缀合(例如,在功能活性IL-10单体中或在功能活性IL-10二聚体中)。在其他情况下,所述两个或更多个缀合部分各自与IL-10二聚体中的不同的IL-10多肽缀合。在另外的情况下,IL-10缀合物包含三个、四个、五个、六个、或更多个缀合部分,其中每个缀合部分与不同的非天然氨基酸结合。在这种情况下,二聚体中的两个IL-10多肽具有不均等分布的缀合部分,例如一个IL-10多肽具有一个缀合部分而另一个IL-10多肽具有两个或更多个缀合部分。
在一些情况下,IL-10缀合物包含两个或更多个缀合部分。在一些情况下,所述两个或更多个缀合部分中的每一个均与在各自的IL-10单体中相同的残基位置处的非天然氨基酸结合。在其他情况下,所述两个或更多个缀合部分中的每一个均与在IL-10二聚体中位于不同的残基位置处的非天然氨基酸结合。
在一些情况下,缀合部分的位置基本上不干扰IL-10多肽的二聚化。
在一些情况下,缀合部分的位置进一步不显著干扰IL-10二聚体与IL-10R的结合。
在一些实施方案中,缀合部分的位置对IL-10R的信号传导的损害少于90%、80%、70%、60%、50%、40%、30%、20%、10%、5%、4%、3%、2%、1%、或更少。在一些情况下,缀合部分的位置对IL-10R的信号传导的损害少于80%。在一些情况下,缀合部分的位置对IL-10R的信号传导的损害少于70%。在一些情况下,缀合部分的位置对IL-10R的信号传导的损害少于60%。在一些情况下,缀合部分的位置对IL-10R的信号传导的损害少于50%。在一些情况下,缀合部分的位置对IL-10R的信号传导的损害少于40%。在一些情况下,缀合部分的位置对IL-10R的信号传导的损害少于30%。在一些情况下,缀合部分的位置对IL-10R的信号传导的损害少于20%。在一些情况下,缀合部分的位置对IL-10R的信号传导的损害少于10%。在一些情况下,缀合部分的位置对IL-10R的信号传导的损害少于5%。在一些情况下,缀合部分的位置对IL-10R的信号传导的损害少于2%。在一些情况下,缀合部分的位置对IL-10R的信号传导的损害少于1%。在一些情况下,缀合部分的位置不显著损害IL-10R的信号传导。在另外的情况下,缀合部分的位置不损害IL-10R的信号传导。
在一些情况下,IL-10缀合物具有增强的血浆半衰期。在一些情况下,所述增强的血浆半衰期是与野生型IL-10缀合物的血浆半衰期相比的。在一些情况下,IL-10缀合物的增强的血浆半衰期是至少90分钟、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、18小时、24小时、36小时、48小时、3天、4天、5天、6天、7天、10天、12天、14天、21天、28天、30天、或长于野生型IL-10缀合物的血浆半衰期。在一些情况下,IL-10缀合物的增强的血浆半衰期是至少90分钟或长于野生型IL-10缀合物的血浆半衰期。在一些情况下,IL-10缀合物的增强的血浆半衰期是至少2小时或长于野生型IL-10缀合物的血浆半衰期。在一些情况下,IL-10缀合物的增强的血浆半衰期是至少3小时或长于野生型IL-10缀合物的血浆半衰期。在一些情况下,IL-10缀合物的增强的血浆半衰期是至少4小时或长于野生型IL-10缀合物的血浆半衰期。在一些情况下,IL-10缀合物的增强的血浆半衰期是至少5小时或长于野生型IL-10缀合物的血浆半衰期。在一些情况下,IL-10缀合物的增强的血浆半衰期是至少6小时或长于野生型IL-10缀合物的血浆半衰期。在一些情况下,IL-10缀合物的增强的血浆半衰期是至少10小时或长于野生型IL-10缀合物的血浆半衰期。在一些情况下,IL-10缀合物的增强的血浆半衰期是至少12小时或长于野生型IL-10缀合物的血浆半衰期。在一些情况下,IL-10缀合物的增强的血浆半衰期是至少18小时或长于野生型IL-10缀合物的血浆半衰期。在一些情况下,IL-10缀合物的增强的血浆半衰期是至少24小时或长于野生型IL-10缀合物的血浆半衰期。在一些情况下,IL-10缀合物的增强的血浆半衰期是至少36小时或长于野生型IL-10缀合物的血浆半衰期。在一些情况下,IL-10缀合物的增强的血浆半衰期是至少48小时或长于野生型IL-10缀合物的血浆半衰期。在一些情况下,IL-10缀合物的增强的血浆半衰期是至少3天或长于野生型IL-10缀合物的血浆半衰期。在一些情况下,IL-10缀合物的增强的血浆半衰期是至少4天或长于野生型IL-10缀合物的血浆半衰期。在一些情况下,IL-10缀合物的增强的血浆半衰期是至少5天或长于野生型IL-10缀合物的血浆半衰期。在一些情况下,IL-10缀合物的增强的血浆半衰期是至少6天或长于野生型IL-10缀合物的血浆半衰期。在一些情况下,IL-10缀合物的增强的血浆半衰期是至少7天或长于野生型IL-10缀合物的血浆半衰期。在一些情况下,IL-10缀合物的增强的血浆半衰期是至少10天或长于野生型IL-10缀合物的血浆半衰期。在一些情况下,IL-10缀合物的增强的血浆半衰期是至少12天或长于野生型IL-10缀合物的血浆半衰期。在一些情况下,IL-10缀合物的增强的血浆半衰期是至少14天或长于野生型IL-10缀合物的血浆半衰期。在一些情况下,IL-10缀合物的增强的血浆半衰期是至少21天或长于野生型IL-10缀合物的血浆半衰期。在一些情况下,IL-10缀合物的增强的血浆半衰期是至少28天或长于野生型IL-10缀合物的血浆半衰期。在一些情况下,IL-10缀合物的增强的血浆半衰期是至少30天或长于野生型IL-10缀合物的血浆半衰期。
在一些实施方案中,本文还描述了IL-10/IL-10R复合物,其包含含有至少一个非天然氨基酸的经修饰的IL-10二聚体和IL-10R,其中与野生型IL-10二聚体的血浆半衰期相比,所述经修饰的IL-10二聚体具有增强的血浆半衰期。在一些情况下,所述经修饰的IL-10二聚体进一步包含共价附接至至少一个非天然氨基酸的缀合部分。
IL-10缀合物前体
本文描述了IL-10缀合物前体,其包含经修饰的IL-10多肽,其中一个或多个氨基酸已经从野生型氨基酸突变。此类前体通常与本文所述的方法一起用于治疗疾病或病症。在一些实施方案中,IL-10前体不是缀合的。此类突变不同地包括添加、缺失或取代。
天然和非天然氨基酸
在一些实施方案中,在与缀合部分结合(或反应)之前,本文所述的氨基酸残基(例如,在IL-10多肽内)突变为赖氨酸、半胱氨酸、组氨酸、精氨酸、天冬氨酸、谷氨酸、丝氨酸、苏氨酸或酪氨酸。例如,赖氨酸、半胱氨酸、组氨酸、精氨酸、天冬氨酸、谷氨酸、丝氨酸、苏氨酸或酪氨酸的侧链可以与本文所述的缀合部分结合。在一些情况下,氨基酸残基突变为半胱氨酸、赖氨酸或组氨酸。在一些情况下,氨基酸残基突变为半胱氨酸。在一些情况下,氨基酸残基突变为赖氨酸。在一些情况下,氨基酸残基突变为组氨酸。在一些情况下,氨基酸残基突变为酪氨酸。在一些情况下,氨基酸残基突变为色氨酸。在一些情况下,氨基酸残基位于N-或C-末端的近端、在N-或C-末端处或在内部残基位置处。在一些情况下,氨基酸残基是N-末端或C-末端残基,并且突变是半胱氨酸或赖氨酸。在一些情况下,氨基酸残基位于N-末端或C-末端残基的近端(例如,从N-末端或C-末端残基起的50、40、30、20或10个残基内),并且突变为半胱氨酸或赖氨酸。
在一些情况下,将氨基酸残基添加至N-末端或C-末端残基,即IL-10多肽在N-末端或C-末端处包含另外的氨基酸残基,并且所述另外的氨基酸残基是半胱氨酸或赖氨酸。在一些情况下,所述另外的氨基酸残基是半胱氨酸。在一些情况下,所述另外的氨基酸与缀合部分缀合。
在一些实施方案中,本文所述的氨基酸残基(例如,在IL-10多肽内)突变为非天然氨基酸。在一些实施方案下,所述非天然氨基酸不与缀合部分缀合。在一些实施方案中,本文所述的IL-10多肽包含非天然氨基酸,其中IL-10与蛋白质缀合,其中附接点不是所述非天然氨基酸。
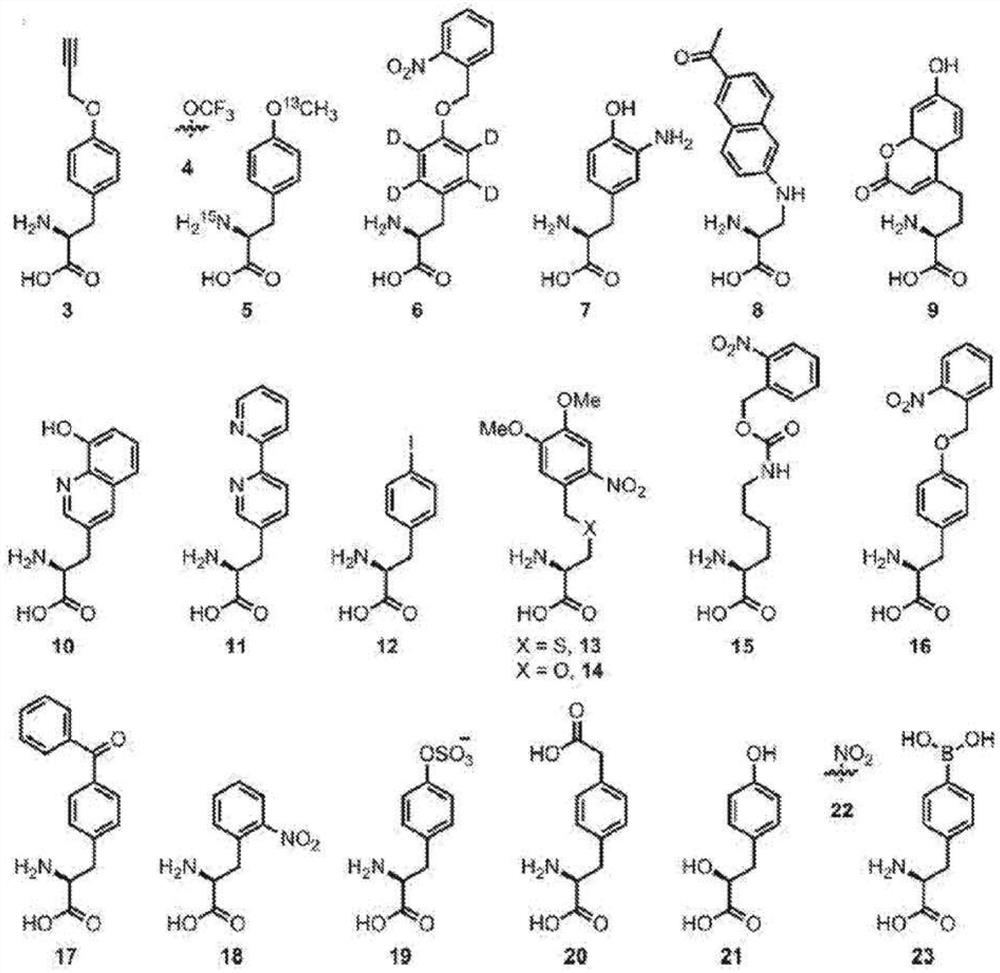
在一些实施方案中,在与缀合部分结合之前,本文所述的氨基酸残基(例如,在IL-10多肽内)突变为非天然氨基酸。在一些情况下,突变为非天然氨基酸防止或最小化免疫系统的自身抗原反应。如本文所用,术语“非天然氨基酸”是指除蛋白质中天然存在的20种氨基酸之外的氨基酸。非天然氨基酸的非限制性例子包括:对-乙酰基-L-苯丙氨酸、对-碘-L-苯丙氨酸、对-甲氧基苯丙氨酸、O-甲基-L-酪氨酸、对-炔丙基氧基苯丙氨酸、对-炔丙基-苯丙氨酸、L-3-(2-萘基)丙氨酸、3-甲基-苯丙氨酸、O-4-烯丙基-L-酪氨酸、4-丙基-L-酪氨酸、三-O-乙酰基-GlcNAcp-丝氨酸、L-多巴、氟化苯丙氨酸、异丙基-L-苯丙氨酸、对-叠氮基-L-苯丙氨酸、对-酰基-L-苯丙氨酸、对-苯甲酰基-L-苯丙氨酸、对-硼酸基苯丙氨酸、O-炔丙基酪氨酸、L-磷酸丝氨酸、膦酰丝氨酸、膦酰酪氨酸、对-溴苯丙氨酸、硒代半胱氨酸、对-氨基-L-苯丙氨酸、异丙基-L-苯丙氨酸、N6-((2-叠氮基乙氧基)羰基)-L-赖氨酸(AzK)、酪氨酸氨基酸的非天然类似物;谷氨酰胺氨基酸的非天然类似物;苯丙氨酸氨基酸的非天然类似物;丝氨酸氨基酸的非天然类似物;苏氨酸氨基酸的非天然类似物;烷基、芳基、酰基、叠氮基、氰基、卤素、肼、酰肼、羟基、烯基、炔基、醚、硫醇、磺酰基、硒代、酯、硫代酸、硼酸盐、硼酸酯、磷酸、膦酰、磷化氢、杂环、烯酮、亚胺、醛、羟胺、酮或氨基取代的氨基酸或其组合;具有可光活化的交联剂的氨基酸;自旋标记的氨基酸;荧光氨基酸;金属结合氨基酸;含金属的氨基酸;放射性氨基酸;光笼化和/或光异构化氨基酸;含有氨基酸的生物素或生物素类似物;含有氨基酸的酮;包含聚乙二醇或聚醚的氨基酸;重原子取代的氨基酸;化学可裂解或可光裂解的氨基酸;具有延长的侧链的氨基酸;含有毒性基团的氨基酸;糖取代的氨基酸;碳连接的含糖氨基酸;氧化还原活性氨基酸;含α-羟基的酸;氨基硫代酸;α,α二取代氨基酸;β-氨基酸;除脯氨酸或组氨酸之外的环状氨基酸,以及除苯丙氨酸、酪氨酸或色氨酸之外的芳族氨基酸。
非天然氨基酸的其他例子包括N6-((2-叠氮基乙氧基)-羰基)-L-赖氨酸(AzK)、N6-(炔丙基乙氧基)-L-赖氨酸(PraK)、N6-(((2-叠氮基苄基)氧基)羰基)-L-赖氨酸、N6-(((3-叠氮基苄基)氧基)羰基)-L-赖氨酸、和N6-(((4-叠氮基苄基)氧基)羰基)-L-赖氨酸。
在一些实施方案中,非天然氨基酸包含选择性反应性基团,或用于位点选择性标记靶多肽的反应性基团。在一些情况下,化学是双正交反应(例如,生物相容性和选择性反应)。在一些情况下,化学是Cu(I)催化或“无铜”炔-叠氮三唑形成反应、施陶丁格连接(Staudinger ligation)、反电子需求的迪尔斯-阿尔德(inverse-electron-demandDiels-Alder,IEDDA)反应、“光-点击”化学或金属介导的过程(如烯烃复分解和铃木-宫浦(Suzuki-Miyaura)或薗头(Sonogashira)交叉偶联)。
在一些实施方案中,非天然氨基酸包含光反应性基团,所述光反应性基团在用例如UV辐照时交联。
在一些实施方案中,非天然氨基酸包括光笼化氨基酸。
在一些情况下,非天然氨基酸是对位取代、间位取代或邻位取代的氨基酸衍生物。
在一些情况下,非天然氨基酸包括对-乙酰基-L-苯丙氨酸、对-叠氮甲基-L-苯丙氨酸(pAMF)、对-碘-L-苯丙氨酸、O-甲基-L-酪氨酸、对-甲氧基苯丙氨酸、对-炔丙氧基苯丙氨酸、对-炔丙基-苯丙氨酸、L-3-(2-萘基)丙氨酸、3-甲基-苯丙氨酸、O-4-烯丙基-L-酪氨酸、4-丙基-L-酪氨酸、三-O-乙酰基-GlcNAcp-丝氨酸、L-多巴、氟化苯丙氨酸、异丙基-L-苯丙氨酸、对-叠氮基-L-苯丙氨酸、对-酰基-L-苯丙氨酸、对-苯甲酰基-L-苯丙氨酸、L-磷酸丝氨酸、膦酰丝氨酸、膦酰酪氨酸、对-溴苯丙氨酸、对-氨基-L-苯丙氨酸或异丙基-L-苯丙氨酸。
在一些情况下,非天然氨基酸是3-氨基酪氨酸、3-硝基酪氨酸、3,4-二羟基-苯丙氨酸或3-碘酪氨酸。
在一些情况下,非天然氨基酸是苯基硒代半胱氨酸。
在一些情况下,非天然氨基酸是含二苯甲酮、酮、碘化物、甲氧基、乙酰基、苯甲酰基或叠氮化物的苯丙氨酸衍生物。
在一些情况下,非天然氨基酸是含二苯甲酮、酮、碘化物、甲氧基、乙酰基、苯甲酰基或叠氮化物的赖氨酸衍生物。
在一些情况下,非天然氨基酸包含芳族侧链。
在一些情况下,非天然氨基酸不包含芳族侧链。
在一些情况下,非天然氨基酸包含叠氮基。
在一些实施方案中,所述至少一个非天然氨基酸包括N6-((2-叠氮基乙氧基)-羰基)-L-赖氨酸(AzK)、N6-(炔丙基乙氧基)-L-赖氨酸(PraK)、N6-(((2-叠氮基苄基)氧基)羰基)-L-赖氨酸、N6-(((3-叠氮基苄基)氧基)羰基)-L-赖氨酸、或N6-(((4-叠氮基苄基)氧基)羰基)-L-赖氨酸。在一些实施方案中,所述至少一个非天然氨基酸包括N6-((2-叠氮基乙氧基)-羰基)-L-赖氨酸(AzK)。在一些实施方案中,所述至少一个非天然氨基酸包括N6-(炔丙基乙氧基)-L-赖氨酸(PraK)。在一些实施方案中,所述至少一个非天然氨基酸包括N6-(((2-叠氮基苄基)氧基)羰基)-L-赖氨酸。在一些实施方案中,所述至少一个非天然氨基酸包括N6-(((3-叠氮基苄基)氧基)羰基)-L-赖氨酸。在一些实施方案中,所述至少一个非天然氨基酸包括N6-(((4-叠氮基苄基)氧基)羰基)-L-赖氨酸。
在一些情况下,非天然氨基酸包含迈克尔(Michael)受体基团。在一些情况下,受体基团包含能够通过1,2-加成反应形成共价键的不饱和部分。在一些情况下,受体基团包括缺电子的烯烃或炔烃。在一些情况下,受体基团包括但不限于α、β不饱和基团:酮、醛、亚砜、砜、腈、亚胺或芳族化合物。
在一些情况下,非天然氨基酸是脱氢丙氨酸。
在一些情况下,非天然氨基酸包含醛或酮基团。
在一些情况下,非天然氨基酸是包含醛或酮基团的赖氨酸衍生物。
在一些情况下,非天然氨基酸是在β、γ或δ位置处包含一个或多个O、N、Se或S原子的赖氨酸衍生物。在一些情况下,非天然氨基酸是在γ位置处包含O、N、Se或S原子的赖氨酸衍生物。
在一些情况下,非天然氨基酸是赖氨酸衍生物,其中εN原子被氧原子替代。
在一些情况下,非天然氨基酸是赖氨酸衍生物,其不是天然存在的经翻译后修饰的赖氨酸。
在一些情况下,非天然氨基酸是包含侧链的氨基酸,其中从α位置起的第六个原子包含羰基。在一些情况下,非天然氨基酸是包含侧链的氨基酸,其中从α位置起的第六个原子包含羰基,并且从α位置起的第五个原子是氮。在一些情况下,非天然氨基酸是包含侧链的氨基酸,其中从α位置起的第七个原子是氧原子。
在一些情况下,非天然氨基酸是包含硒的丝氨酸衍生物。在一些情况下,非天然氨基酸是硒代丝氨酸(2-氨基-3-氢硒代丙酸)。在一些情况下,非天然氨基酸是2-氨基-3-((2-((3-(苄氧基)-3-氧丙基)氨基)乙基)硒基)丙酸。在一些情况下,非天然氨基酸是2-氨基-3-(苯基硒基)丙酸。在一些情况下,非天然氨基酸包含硒,其中硒的氧化导致形成包含烯烃的非天然氨基酸。
在一些情况下,非天然氨基酸包含环辛炔基。
在一些情况下,非天然氨基酸包含反式环辛烯基。
在一些情况下,非天然氨基酸包含降冰片烯基。
在一些情况下,非天然氨基酸包含环丙烯基。
在一些情况下,非天然氨基酸包含二吖丙因基团。
在一些情况下,非天然氨基酸包含四嗪基团。
在一些情况下,非天然氨基酸是赖氨酸衍生物,其中侧链氮被氨甲酰化。在一些情况下,非天然氨基酸是赖氨酸衍生物,其中侧链氮被酰化。在一些情况下,非天然氨基酸是2-氨基-6-{[(叔丁氧基)羰基]氨基}己酸。在一些情况下,非天然氨基酸是2-氨基-6-{[(叔丁氧基)羰基]氨基}己酸。在一些情况下,非天然氨基酸是N6-Boc-N6-甲基赖氨酸。在一些情况下,非天然氨基酸是N6-乙酰基赖氨酸。在一些情况下,非天然氨基酸是吡咯赖氨酸。在一些情况下,非天然氨基酸是N6-三氟乙酰基赖氨酸。在一些情况下,非天然氨基酸是2-氨基-6-{[(苄氧基)羰基]氨基}己酸。在一些情况下,非天然氨基酸是2-氨基-6-{[(对-碘代苄氧基)羰基]氨基}己酸。在一些情况下,非天然氨基酸是2-氨基-6-{[(对-硝基苄氧基)羰基]氨基}己酸。在一些情况下,非天然氨基酸是N6-脯氨酰基赖氨酸。在一些情况下,非天然氨基酸是2-氨基-6-{[(环戊基氧基)羰基]氨基}己酸。在一些情况下,非天然氨基酸是N6-(环戊烷羰基)赖氨酸。在一些情况下,非天然氨基酸是N6-(四氢呋喃-2-羰基)赖氨酸。在一些情况下,非天然氨基酸是N6-(3-乙炔基四氢呋喃-2-羰基)赖氨酸。在一些情况下,非天然氨基酸是N6-((丙-2-炔-1-基氧基)羰基)赖氨酸。在一些情况下,非天然氨基酸是2-氨基-6-{[(2-叠氮基环戊基氧基)羰基]氨基}己酸。在一些情况下,非天然氨基酸是N6-((2-叠氮基乙氧基)-羰基)-L-赖氨酸。在一些情况下,非天然氨基酸是2-氨基-6-{[(2-硝基苄氧基)羰基]氨基}己酸。在一些情况下,非天然氨基酸是2-氨基-6-{[(2-环辛炔基氧基)羰基]氨基}己酸。在一些情况下,非天然氨基酸是N6-(2-氨基丁-3-炔酰基)赖氨酸。在一些情况下,非天然氨基酸是2-氨基-6-((2-氨基丁-3-炔酰基)氧基)己酸。在一些情况下,非天然氨基酸是N6-(烯丙氧基羰基)赖氨酸。在一些情况下,非天然氨基酸是N6-(丁烯基-4-氧羰基)赖氨酸。在一些情况下,非天然氨基酸是N6-(戊烯基-5-氧羰基)赖氨酸。在一些情况下,非天然氨基酸是N6-((丁-3-炔-1-基氧基)羰基)-赖氨酸。在一些情况下,非天然氨基酸是N6-((戊-4-炔-1-基氧基)羰基)-赖氨酸。在一些情况下,非天然氨基酸是N6-(噻唑烷-4-羰基)赖氨酸。在一些情况下,非天然氨基酸是2-氨基-8-氧代壬酸。在一些情况下,非天然氨基酸是2-氨基-8-氧代辛酸。在一些情况下,非天然氨基酸是N6-(2-氧代乙酰基)赖氨酸。
在一些情况下,非天然氨基酸是N6-丙酰基赖氨酸。在一些情况下,非天然氨基酸是N6-丁酰基赖氨酸。在一些情况下,非天然氨基酸是N6-(丁-2-烯酰基)赖氨酸。在一些情况下,非天然氨基酸是N6-((双环[2.2.1]庚-5-烯-2-基氧基)羰基)赖氨酸。在一些情况下,非天然氨基酸是N6-((螺[2.3]己-1-烯-5-基甲氧基)羰基)赖氨酸。在一些情况下,非天然氨基酸是N6-(((4-(1-(三氟甲基)环丙-2-烯-1-基)苄基)氧基)羰基)赖氨酸。在一些情况下,非天然氨基酸是N6-((双环[2.2.1]庚-5-烯-2-基甲氧基)羰基)赖氨酸。在一些情况下,非天然氨基酸是半胱氨酸赖氨酸。在一些情况下,非天然氨基酸是N6-((1-(6-硝基苯并[d][1,3]二氧杂环戊烯-5-基)乙氧基)羰基)赖氨酸。在一些情况下,非天然氨基酸是N6-((2-(3-甲基-3H-二吖丙因-3-基)乙氧基)羰基)赖氨酸。在一些情况下,非天然氨基酸是N6-((3-(3-甲基-3H-二吖丙因-3-基)丙氧基)羰基)赖氨酸。在一些情况下,非天然氨基酸是N6-((间硝基苄氧基)N6-甲基羰基)赖氨酸。在一些情况下,非天然氨基酸是N6-((双环[6.1.0]壬-4-炔-9-基甲氧基)羰基)-赖氨酸。在一些情况下,非天然氨基酸是N6-((环庚-3-烯-1-基氧基)羰基)-L-赖氨酸。
在一些情况下,非天然氨基酸是2-氨基-3-(((((苄氧基)羰基)氨基)甲基)硒基)丙酸。
在一些实施方案中,非天然氨基酸通过重构的琥珀、蛋白石或赭石终止密码子掺入IL-10多肽中。
在一些实施方案中,非天然氨基酸通过4-碱基密码子掺入IL-10多肽中。
在一些实施方案中,非天然氨基酸通过重构的稀有有义密码子掺入IL-10多肽中。
在一些实施方案中,非天然氨基酸通过包含非天然核酸的合成密码子掺入IL-10多肽中。
在一些情况下,非天然氨基酸通过正交的、经修饰的合成酶/tRNA对掺入IL-10中。此类正交对包含天然合成酶,所述天然合成酶能够将非天然氨基酸装载到非天然tRNA上,同时最小化a)其他内源性氨基酸装载到非天然tRNA上和b)非天然氨基酸装载到其他内源性tRNA上。此类正交对包含tRNA,所述tRNA能够通过非天然合成酶进行装载,同时避免通过内源性合成酶装载其他内源性氨基酸。在一些实施方案中,从各种生物体(诸如细菌、酵母、古细菌或人来源)鉴定出此类对。在一些实施方案中,正交合成酶/tRNA对包含来自单一生物体的组分。在一些实施方案中,正交合成酶/tRNA对包含来自两种不同的生物体的组分。在一些实施方案中,正交合成酶/tRNA对包含在修饰之前促进两个不同氨基酸翻译的组分。在一些实施方案中,正交合成酶是经修饰的丙氨酸合成酶。在一些实施方案中,正交合成酶是经修饰的精氨酸合成酶。在一些实施方案中,正交合成酶是经修饰的天冬酰胺合成酶。在一些实施方案中,正交合成酶是经修饰的天冬氨酸合成酶。在一些实施方案中,正交合成酶是经修饰的半胱氨酸合成酶。在一些实施方案中,正交合成酶是经修饰的谷氨酰胺合成酶。在一些实施方案中,正交合成酶是经修饰的谷氨酸合成酶。在一些实施方案中,正交合成酶是经修饰的丙氨酸甘氨酸。在一些实施方案中,正交合成酶是经修饰的组氨酸合成酶。在一些实施方案中,正交合成酶是经修饰的亮氨酸合成酶。在一些实施方案中,正交合成酶是经修饰的异亮氨酸合成酶。在一些实施方案中,正交合成酶是经修饰的赖氨酸合成酶。在一些实施方案中,正交合成酶是经修饰的甲硫氨酸合成酶。在一些实施方案中,正交合成酶是经修饰的苯丙氨酸合成酶。在一些实施方案中,正交合成酶是经修饰的脯氨酸合成酶。在一些实施方案中,正交合成酶是经修饰的丝氨酸合成酶。在一些实施方案中,正交合成酶是经修饰的苏氨酸合成酶。在一些实施方案中,正交合成酶是经修饰的色氨酸合成酶。在一些实施方案中,正交合成酶是经修饰的酪氨酸合成酶。在一些实施方案中,正交合成酶是经修饰的缬氨酸合成酶。在一些实施方案中,正交合成酶是经修饰的磷酸丝氨酸合成酶。在一些实施方案中,正交tRNA是经修饰的丙氨酸tRNA。在一些实施方案中,正交tRNA是经修饰的精氨酸tRNA。在一些实施方案中,正交tRNA是经修饰的天冬酰胺tRNA。在一些实施方案中,正交tRNA是经修饰的天冬氨酸tRNA。在一些实施方案中,正交tRNA是经修饰的半胱氨酸tRNA。在一些实施方案中,正交tRNA是经修饰的谷氨酰胺tRNA。在一些实施方案中,正交tRNA是经修饰的谷氨酸tRNA。在一些实施方案中,正交tRNA是经修饰的丙氨酸甘氨酸。在一些实施方案中,正交tRNA是经修饰的组氨酸tRNA。在一些实施方案中,正交tRNA是经修饰的亮氨酸tRNA。在一些实施方案中,正交tRNA是经修饰的异亮氨酸tRNA。在一些实施方案中,正交tRNA是经修饰的赖氨酸tRNA。在一些实施方案中,正交tRNA是经修饰的甲硫氨酸tRNA。在一些实施方案中,正交tRNA是经修饰的苯丙氨酸tRNA。在一些实施方案中,正交tRNA是经修饰的脯氨酸tRNA。在一些实施方案中,正交tRNA是经修饰的丝氨酸tRNA。在一些实施方案中,正交tRNA是经修饰的苏氨酸tRNA。在一些实施方案中,正交tRNA是经修饰的色氨酸tRNA。在一些实施方案中,正交tRNA是经修饰的酪氨酸tRNA。在一些实施方案中,正交tRNA是经修饰的缬氨酸tRNA。在一些实施方案中,正交tRNA是经修饰的磷酸丝氨酸tRNA。
在一些实施方案中,非天然氨基酸通过氨酰基(aaRS或RS)-tRNA合成酶-tRNA对掺入IL-10多肽中。示例性aaRS-tRNA对包括但不限于詹氏甲烷球菌(Methanococcusjannaschii)(Mj-Tyr)aaRS/tRNA对、大肠杆菌(E.coli)TyrRS(Ec-Tyr)/嗜热脂肪芽孢杆菌(B.stearothermophilus)tRNA
在一些情况下,非天然氨基酸通过Ec-Tyr/tRNA
在一些情况下,非天然氨基酸通过吡咯基-tRNA对掺入IL-10多肽中。在一些情况下,PylRS获自古细菌,例如获自产甲烷的古细菌。在一些情况下,PylRS获自巴氏甲烷八叠球菌(Methanosarcina barkeri)、马氏甲烷八叠球菌(Methanosarcina mazei)或乙酸甲烷八叠球菌(Methanosarcina acetivorans)。可以通过吡咯基-tRNA对掺入的示例性UAA包括但不限于酰胺和氨基甲酸酯取代的赖氨酸,如2-氨基-6-((R)-四氢呋喃-2-甲酰胺基)己酸、N-ε-
在一些情况下,非天然氨基酸通过US 9,988,619和US 9,938,516中披露的合成酶掺入IL-10多肽中。可以通过此类合成酶掺入的示例性UAA包括对-甲基叠氮基-L-苯丙氨酸、芳烷基、杂环基、杂芳烷基非天然氨基酸等。在一些实施方案中,此类UAA包含吡啶基、吡嗪基、吡唑基、三唑基、噁唑基、噻唑基、噻吩基或其他杂环。在一些实施方案中,此类氨基酸包含叠氮化物、四嗪或能够与偶联配偶体(诸如水溶性部分)缀合的其他化学基团。在一些实施方案中,此类合成酶被表达并用于将UAA在体内掺入细胞因子中。在一些实施方案中,使用无细胞翻译系统将此类合成酶用于将UAA掺入细胞因子中。
将引入了本文公开的构建体或载体的宿主细胞在合适的培养基中培养或维持,使得产生tRNA、tRNA合成酶和目的蛋白质。培养基还包含一种或多种非天然氨基酸,使得目的蛋白质掺入所述一种或多种非天然氨基酸中。在一些实施方案中,来自细菌、植物或藻类的核苷酸三磷酸转运蛋白(NTT)也存在于宿主细胞中。在一些实施方案中,本文公开的IL-10缀合物通过使用表达NTT的宿主细胞来制备。在一些实施方案中,在宿主细胞中使用的核苷酸核苷三磷酸转运蛋白可以选自TpNTT1、TpNTT2、TpNTT3、TpNTT4、TpNTT5、TpNTT6、TpNTT7、TpNTT8(假微型海链藻(T.pseudonana))、PtNTT1、PtNTT2、PtNTT3、PtNTT4、PtNTT5、PtNTT6(三角褐指藻)、GsNTT(Galdieria sulphuraria)、AtNTT1、AtNTT2(拟南芥)、CtNTT1、CtNTT2(沙眼衣原体(Chlamydia trachomatis))、PamNTT1、PamNTT2(Protochlamydiaamoebophila)、CcNTT(Caedibacter caryophilus)、RpNTT1(普氏立克次氏体(Rickettsiaprowazekii))。在一些实施方案中,NTT选自PtNTT1、PtNTT2、PtNTT3、PtNTT4、PtNTT5、和PtNTT6。在一些实施方案中,NTT是PtNTT1。在一些实施方案中,NTT是PtNTT2。在一些实施方案中,NTT是PtNTT3。在一些实施方案中,NTT是PtNTT4。在一些实施方案中,NTT是PtNTT5。在一些实施方案中,NTT是PtNTT6。可以使用的其他NTT公开于Zhang等人,Nature 2017,551(7682):644-647;Malyshev等人Nature 2014(509(7500),385-388;和Zhang等人Proc NatlAcad Sci USA,2017,114:1317–1322中。
在一些实施方案中提供了在表达NTT和tRNA合成酶的细胞系统中制备本文公开的IL-10缀合物的方法。在本文所述的一些实施方案中,NTT选自PtNTT1、PtNTT2、PtNTT3、PtNTT4、PtNTT5、和PtNTT6,并且tRNA合成酶选自詹氏甲烷球菌、大肠杆菌TyrRS(Ec-Tyr)/嗜热脂肪芽孢杆菌、和马氏甲烷八叠球菌。在一些实施方案中,NTT是PtNTT1并且tRNA合成酶衍生自詹氏甲烷球菌、大肠杆菌TyrRS(Ec-Tyr)/嗜热脂肪芽孢杆菌、或马氏甲烷八叠球菌。在一些实施方案中,NTT是PtNTT2并且tRNA合成酶衍生自詹氏甲烷球菌、大肠杆菌TyrRS(Ec-Tyr)/嗜热脂肪芽孢杆菌、或马氏甲烷八叠球菌。在一些实施方案中,NTT是PtNTT3并且tRNA合成酶衍生自詹氏甲烷球菌、大肠杆菌TyrRS(Ec-Tyr)/嗜热脂肪芽孢杆菌、或马氏甲烷八叠球菌。在一些实施方案中,NTT是PtNTT3并且tRNA合成酶衍生自詹氏甲烷球菌、大肠杆菌TyrRS(Ec-Tyr)/嗜热脂肪芽孢杆菌、或马氏甲烷八叠球菌。在一些实施方案中,NTT是PtNTT4并且tRNA合成酶衍生自詹氏甲烷球菌、大肠杆菌TyrRS(Ec-Tyr)/嗜热脂肪芽孢杆菌、或马氏甲烷八叠球菌。在一些实施方案中,NTT是PtNTT5并且tRNA合成酶衍生自詹氏甲烷球菌、大肠杆菌TyrRS(Ec-Tyr)/嗜热脂肪芽孢杆菌、或马氏甲烷八叠球菌。在一些实施方案中,NTT是PtNTT6并且tRNA合成酶衍生自詹氏甲烷球菌、大肠杆菌TyrRS(Ec-Tyr)/嗜热脂肪芽孢杆菌、或马氏甲烷八叠球菌。
在一些实施方案中,本文公开的IL-10缀合物可以在细胞(诸如大肠杆菌)中制备,所述细胞包含(a)核苷酸三磷酸转运蛋白PtNTT2(包括截短的变体,其中全长蛋白质的前65个氨基酸残基缺失),(b)包含双链寡核苷酸的质粒,其编码具有所希望的氨基酸序列的IL-10变体并且含有包含第一非天然核苷酸和第二非天然核苷酸的非天然碱基对以在所希望的位置处提供密码子,在所述所希望的位置处将掺入非天然氨基酸,诸如N6-((2-叠氮基乙氧基)-羰基)-L-赖氨酸(AzK)、N6-(炔丙基乙氧基)-L-赖氨酸(PraK)、N6-(((2-叠氮基苄基)氧基)羰基)-L-赖氨酸、N6-(((3-叠氮基苄基)氧基)羰基)-L-赖氨酸、或N6-(((4-叠氮基苄基)氧基)羰基)-L-赖氨酸,(c)编码衍生自马氏甲烷八叠球菌的tRNA的质粒,并且其包含非天然核苷酸以提供识别的反密码子(针对IL-10变体的密码子)替换其天然序列,以及(d)编码巴克红曲菌来源的吡咯赖氨酰基-tRNA合成酶(Mb PylRS)的质粒,所述质粒可以是编码tRNA的相同的质粒或不同的质粒。在一些实施方案中,所述细胞进一步补充有包含一个或多个非天然碱基的脱氧核糖三磷酸酯。在一些实施方案中,所述细胞进一步补充有包含一个或多个非天然碱基的核糖三磷酸酯。在一些实施方案中,所述细胞进一步补充有一个或多个非天然氨基酸,诸如N6-((2-叠氮基乙氧基)-羰基)-L-赖氨酸(AzK)、N6-(炔丙基乙氧基)-L-赖氨酸(PraK)、N6-(((2-叠氮基苄基)氧基)羰基)-L-赖氨酸、N6-(((3-叠氮基苄基)氧基)羰基)-L-赖氨酸、或N6-(((4-叠氮基苄基)氧基)羰基)-L-赖氨酸。在一些实施方案中,编码所希望的IL-10变体的氨基酸序列的双链寡核苷酸在编码具有SEQ ID NO:1的蛋白质的序列的例如位置67、70、74、75、79、82、88、125、126、129、130、或132处含有密码子AXC,其中X是非天然核苷酸,诸如本文公开的那些,诸如NaM。在一些实施方案中,所述细胞进一步包含质粒,所述质粒可以是蛋白质表达质粒或编码来自马氏甲烷八叠球菌的正交tRNA基因的另一种质粒,所述正交tRNA基因包含AXC匹配的反密码子GYT替代其天然序列,其中Y是如本文所公开的非天然核苷酸(诸如TPT3),所述非天然核苷酸是互补的并且可以与在密码子中的非天然核苷酸相同或不同。在一些实施方案中,密码子中的非天然核苷酸不同于并且互补于反密码子中的非天然核苷酸。在一些实施方案中,密码子中的非天然核苷酸与反密码子中的非天然核苷酸相同。在一些实施方案中,在双链寡核苷酸中的包含非天然碱基对的第一和第二非天然核苷酸可以衍生自
可以通过本领域普通技术人员已知的方法纯化所表达的包含一个或多个非天然氨基酸(例如AzK、N6-(炔丙基乙氧基)-L-赖氨酸(PraK)、N6-(((2-叠氮基苄基)氧基)羰基)-L-赖氨酸、N6-(((3-叠氮基苄基)氧基)羰基)-L-赖氨酸、或N6-(((4-叠氮基苄基)氧基)羰基)-L-赖氨酸)的所得的蛋白质,并且然后可以允许在本领域普通技术人员已知的条件下与炔烃(诸如包含具有如本文公开的所希望的平均分子量的PEG链的DBCO)反应以得到本文公开的IL-10缀合物。其他方法是本领域普通技术人员已知的,诸如公开于Zhang等人,Nature 2017,551(7682):644-647;WO 2015157555;WO 2015021432;WO 2016115168;WO2017106767;WO 2017223528;WO 2019014262;WO 2019014267;WO 2019028419;和WO 2019/028425中的那些。
可替代地,通过将本文所述的包含tRNA和氨酰基tRNA合成酶并且包含具有一个或多个框内正交(终止)密码子的目的核酸序列的核酸构建体引入宿主细胞中来制备包含一个或多个非天然氨基酸的细胞因子(例如,IL-10)多肽。将宿主细胞在含有适当的营养素的培养基中培养,补充有(a)包含一个或多个非天然碱基的脱氧核糖核苷的三磷酸酯,所述一个或多个非天然碱基对于一种或多种质粒的复制是必需的,所述一种或多种质粒编码包含新密码和反密码子的细胞因子基因;(b)核糖核苷的三磷酸酯,其对于对应于以下的mRNA的转录是必需的:(i)含有密码子的细胞因子序列,和(ii)含有反密码子的正交tRNA;以及(c)一个或多个非天然氨基酸。然后将宿主细胞维持在允许目的蛋白表达的条件下。响应于非天然密码子,将所述一个或多个非天然氨基酸掺入多肽链中。例如,将一个或多个非天然氨基酸掺入细胞因子(例如,IL-10)多肽中。可替代地,可以在蛋白质的两个或更多个位点处将两个或更多个非天然氨基酸掺入细胞因子(例如,IL-10)多肽中。
一旦在宿主细胞中产生了掺入非天然氨基酸的细胞因子(例如,IL-10)多肽,就可以通过本领域已知的多种技术(包括酶促、化学和/或渗透裂解和物理破坏)从其提取。可以通过本领域已知的标准技术(诸如制备型离子交换色谱法、疏水色谱法、亲和色谱法、或本领域普通技术人员已知的任何其他合适的技术)纯化细胞因子(例如,IL-10)多肽。
在一些情况下,非天然氨基酸通过天然存在的合成酶掺入IL-10多肽中。在一些实施方案中,非天然氨基酸通过对于一个或多个氨基酸是营养缺陷型的生物体掺入细胞因子中。在一些实施方案中,对应于营养缺陷型氨基酸的合成酶能够将非天然氨基酸装载在相应的tRNA上。在一些实施方案中,非天然氨基酸是硒代半胱氨酸或其衍生物。在一些实施方案中,非天然氨基酸是硒代甲硫氨酸或其衍生物。在一些实施方案中,非天然氨基酸是芳族氨基酸,其中芳族氨基酸包含芳基卤化物,诸如碘化物。在实施方案中,非天然氨基酸在结构上与营养缺陷型氨基酸相似。
在一些情况下,非天然氨基酸包括图1所展示的非天然氨基酸。
在一些情况下,非天然氨基酸包括赖氨酸或苯丙氨酸衍生物或类似物。在一些情况下,非天然氨基酸包括赖氨酸衍生物或赖氨酸类似物。在一些情况下,非天然氨基酸包括吡咯赖氨酸(Pyl)。在一些情况下,非天然氨基酸包括苯丙氨酸衍生物或苯丙氨酸类似物。在一些情况下,非天然氨基酸是Wan等人,“Pyrrolysyl-tRNA synthetase:an ordinaryenzyme but an outstanding genetic code expansion tool,”Biochim Biophys Acta1844(6):1059-4070(2014)中描述的非天然氨基酸。在一些情况下,非天然氨基酸包括图2(例如,图2A和图2B)所展示的非天然氨基酸。
在一些实施方案中,非天然氨基酸包括图3A-图3D所展示的非天然氨基酸(从Dumas等人,Chemical Science 2015,6,50-69的表1中采用的)。
在一些实施方案中,掺入IL-10多肽中的非天然氨基酸在US9,840,493;US 9,682,934;US 2017/0260137;US 9,938,516;或US 2018/0086734中公开。可以通过此类合成酶掺入的示例性UAA包括对-甲基叠氮基-L-苯丙氨酸、芳烷基、杂环基和杂芳烷基,以及赖氨酸衍生物非天然氨基酸。在一些实施方案中,此类UAA包含吡啶基、吡嗪基、吡唑基、三唑基、噁唑基、噻唑基、噻吩基或其他杂环。在一些实施方案中,此类氨基酸包含叠氮化物、四嗪或能够与偶联配偶体(诸如水溶性部分)缀合的其他化学基团。在一些实施方案中,UAA包含经由烷基接头附接至芳族部分的叠氮化物。在一些实施方案中,烷基接头是C
缀合部分
在某些实施方案中,本文公开了与上述IL-10多肽结合的缀合部分。在一些情况下,缀合部分是干扰IL-10与其受体的相互作用的分子。在一些情况下,缀合部分是当与IL-10结合时能够使IL-10缀合物调节免疫应答的任何分子。在一些情况下,缀合部分通过共价键与IL-10结合。在一些情况下,本文所述的IL-10附接至具有三唑基团的缀合部分。在一些情况下,本文所述的IL-10附接至具有二氢哒嗪或哒嗪基团的缀合部分。在一些情况下,缀合部分包括水溶性聚合物。在其他情况下,缀合部分包括蛋白质或其结合片段。在另外的情况下,缀合部分包括肽。在另外的情况下,缀合部分包括核酸。在另外的情况下,缀合部分包括小分子。在另外的情况下,缀合部分包括生物缀合物(例如,TLR激动剂,诸如TLR1、TLR2、TLR3、TLR4、TLR5、TLR6、TLR7、TLR8或TLR9激动剂;或合成配体,诸如Pam3Cys、CFA、MALP2、Pam2Cys、FSL-1、Hib-OMPC、聚肌苷酸:聚胞苷酸、聚腺苷酸:聚尿苷酸、AGP、MPL A、RC-529、MDF2β、CFA或鞭毛蛋白)。在一些情况下,缀合部分增加血清半衰期和/或改善稳定性。在一些情况下,缀合部分降低细胞因子与一个或多个细胞因子受体结构域或亚基的相互作用。在另外的情况下,缀合部分阻断IL-10与具有其一种或多种同源受体的一个或多个IL-10结构域或亚基的相互作用。在一些实施方案中,本文所述的IL-10缀合物包含多个缀合部分。在一些实施方案中,缀合部分附接至IL-10多肽中的非天然或天然氨基酸。在一些实施方案中,IL-10缀合物包含附接至天然氨基酸的缀合部分。在一些实施方案中,IL-10缀合物附接至细胞因子肽中的非天然氨基酸。在一些实施方案中,缀合部分附接至IL-10多肽的N或C末端氨基酸。本文公开了各种组合位点,例如,第一缀合部分附接至IL-10多肽中的非天然或天然氨基酸,并且第二缀合部分附接至IL-10多肽的N或C末端氨基酸。在一些实施方案中,单个缀合部分附接至IL-10多肽的多个残基(例如钉)。在一些实施方案中,缀合部分附接至IL-10多肽的N和C末端氨基酸两者。
水溶性聚合物
在一些实施方案中,本文所述的缀合部分是水溶性聚合物。在一些情况下,所述水溶性聚合物是非肽的、无毒的和生物相容的。如本文所用,如果与单独使用物质或与(例如,施用于患者)有关的另一种物质(例如,活性剂,诸如IL-10部分)一起使用相关的有益效果超过由临床医生(例如,医师、毒理学家、或临床发展专家)评估的任何有害效果,则所述物质被认为是生物相容的。在一些情况下,所述水溶性聚合物进一步是非免疫原性的。在一些情况下,如果物质在体内的预期用途未产生不希望的免疫应答(例如,抗体形成),或者如果产生了免疫应答,这种应答被临床医生(例如,医师、毒理学家或临床发展专家)评估为临床上不显著或不重要,则所述物质被认为是非免疫原性的。
在一些情况下,所述水溶性聚合物的特征在于具有约2至约300个末端。示例性水溶性聚合物包括但不限于聚(亚烷基二醇),诸如聚乙二醇(“PEG”)、聚(丙二醇)(“PPG”)、乙二醇和丙二醇的共聚物等、聚(氧乙基化多元醇)、聚(烯烃醇)、聚(乙烯基吡咯烷酮)、聚(羟烷基甲基丙烯酰胺)、聚(甲基丙烯酸羟烷基酯)、聚(糖类)、聚(α-羟基酸)、聚(乙烯醇)(PVA)、聚丙烯酰胺(PAAm)、聚(N-(2-羟丙基)甲基丙烯酰胺)(PHPMA)、聚二甲基丙烯酰胺(PDAAm)、聚磷腈、聚噁唑啉(“POZ”)(其描述于WO 2008/106186中)、聚(N-丙烯酰吗啉)以及前述任何一种的组合。
在一些情况下,所述水溶性聚合物不限于特定结构。在一些情况下,所述水溶性聚合物是线性的(例如,封端的,例如,烷氧基PEG或双官能PEG)、支化的或多臂的(例如,叉状的PEG或附接至多元醇核的PEG)、树状的或星形)架构,每个架构都带有或不带有一个或多个可降解的连接。此外,所述水溶性聚合物的内部结构可以以任何数量的不同重复图案来组织,并且可以选自均聚物、交替共聚物、无规共聚物、嵌段共聚物、交替三聚物、无规三聚物和嵌段三聚物。
在一些实施方案中,IL-10缀合物中的水溶性聚合物的重均分子量为约100道尔顿至约150,000道尔顿。示例性范围包括,例如,重均分子量在大于5,000道尔顿至约100,000道尔顿的范围内、约6,000道尔顿至约90,000道尔顿的范围内、约10,000道尔顿至约85,000道尔顿的范围内、大于10,000道尔顿至约85,000道尔顿的范围内、约20,000道尔顿至约85,000道尔顿的范围内、约53,000道尔顿至约85,000道尔顿的范围内、约25,000道尔顿至约120,000道尔顿的范围内、约29,000道尔顿至约120,000道尔顿的范围内、约35,000道尔顿至约120,000道尔顿的范围内,以及约40,000道尔顿至约120,000道尔顿的范围内。
所述水溶性聚合物的示例性重均分子量包括约100道尔顿、约200道尔顿、约300道尔顿、约400道尔顿、约500道尔顿、约600道尔顿、约700道尔顿、约750道尔顿、约800道尔顿、约900道尔顿、约1,000道尔顿、约1,500道尔顿、约2,000道尔顿、约2,200道尔顿、约2,500道尔顿、约3,000道尔顿、约4,000道尔顿、约4,400道尔顿、约4,500道尔顿、约5,000道尔顿、约5,500道尔顿、约6,000道尔顿、约7,000道尔顿、约7,500道尔顿、约8,000道尔顿、约9,000道尔顿、约10,000道尔顿、约11,000道尔顿、约12,000道尔顿、约13,000道尔顿、约14,000道尔顿、约15,000道尔顿、约20,000道尔顿、约22,500道尔顿、约25,000道尔顿、约30,000道尔顿、约35,000道尔顿、约40,000道尔顿、约45,000道尔顿、约50,000道尔顿、约55,000道尔顿、约60,000道尔顿、约65,000道尔顿、约70,000道尔顿和约75,000道尔顿。还可以使用总分子量为上述任何一种的支化形式的水溶性聚合物(例如,由两种20,000道尔顿聚合物构成的支化40,000道尔顿水溶性聚合物)。在一个或多个实施方案中,缀合物将不具有直接或间接附接有重均分子量小于约6,000道尔顿的PEG的任何PEG部分。
PEG典型地将包含许多(OCH
在一些情况下,所述水溶性聚合物是封端的聚合物,即具有被相对惰性的基团(诸如低级C
在一些实施方案中,示例性水溶性聚合物包括但不限于来自Quanta Biodesign,Ltd的线性或支化的离散PEG(dPEG);来自Nektar Therapeutics的线性、支化或叉状PEG;来自JenKem Technology的线性、支化或Y形PEG衍生物。
在一些实施方案中,本文所述的IL-10多肽与选自以下的水溶性聚合物缀合:聚(亚烷基二醇)(如聚乙二醇(“PEG”)、聚丙二醇(“PPG”)、乙二醇和丙二醇的共聚物等)、聚(氧乙基化多元醇)、聚(烯烃醇)、聚(乙烯基吡咯烷酮)、聚(羟烷基甲基丙烯酰胺)、聚(甲基丙烯酸羟烷基酯)、聚(糖类)、聚(α-羟基酸)、聚(乙烯醇)(PVA)、聚丙烯酰胺(PAAm)、聚二甲基丙烯酰胺(PDAAm)、聚(N-(2-羟丙基)甲基丙烯酰胺)(PHPMA)、聚磷腈、聚噁唑啉(“POZ”)、聚(N-丙烯酰吗啉)及其组合。在一些情况下,IL-10多肽与PEG缀合(例如,聚乙二醇化)。在一些情况下,IL-10多肽与PPG缀合。在一些情况下,IL-10多肽与POZ缀合。在一些情况下,IL-10多肽与PVP缀合。
在一些情况下,水溶性聚合物包含聚甘油(PG)。在一些情况下,聚甘油是超支化PG(HPG)(例如,如Imran等人“Influence of architecture of high molecular weightlinear and branched polyglycerols on their biocompatibility andbiodistribution,”Biomaterials 33:9135–9147(2012)所述)。在其他情况下,聚甘油是线性PG(LPG)。在另外的情况下,聚甘油是中功能性PG、线性-嵌段-超支化PG(例如,如Wurm等人,“Squaric acid mediated synthesis and biological activity of a library oflinear and hyperbranched poly(glycerol)-protein conjugates,”Biomacromolecules13:1161-1171(2012)所述)、或侧链功能性PG(例如,如Li等人,“Synthesis of linear polyether polyol derivatives as new materials forbioconjugation,”Bioconjugate Chem.20:780-789(2009)所述。
在一些情况下,本文所述的IL-10多肽与PG,例如HPG、LPG、中功能性PG、线性-嵌段-超支化PG或侧链功能性PG缀合。
在一些实施方案中,水溶性聚合物是可降解的合成PEG替代物。示例性可降解的合成PEG替代物包括但不限于聚[低聚(乙二醇)甲基丙烯酸甲酯](POEGMA);通过远螯或基于二末端官能化的PEG大分子单体的聚合反应生成的经骨架修饰的PEG衍生物;包含含有可降解连接的共聚单体的PEG衍生物,诸如聚[(环氧乙烷)-共-(亚甲基环氧乙烷)][P(EO-共-MEO)]、环烯酮缩醛,诸如与OEGMA共聚的5,6-苯并-2-亚甲基-1,3-二氧杂环庚烷(BMDO)、2-亚甲基-1,3-二氧杂环庚烷(MDO)和2-亚甲基-4-苯基-1,3-二氧戊环(MPDL);或聚(ε-己内酯)-接枝-聚(环氧乙烷)(PCL-g-PEO)。
在一些情况下,本文所述的IL-10多肽与可降解的合成PEG替代物(例如像POEGM;通过远螯或基于二末端官能化的PEG大分子单体的聚合反应生成的经骨架修饰的PEG衍生物;P(EO-共-MEO);与OEGMA共聚的环状烯酮缩醛,诸如BMDO、MDO和MPDL;或PCL-g-PEO)缀合。
在一些实施方案中,水溶性聚合物包含聚(两性离子)。示例性聚(两性离子)包括但不限于聚(甲基丙烯酸磺基甜菜碱)(PSBMA)、聚(甲基丙烯酸羧基甜菜碱)(PCBMA)和聚(2-甲基丙烯酰氧乙基磷酰胆碱)(PMPC)。在一些情况下,IL-10多肽与聚(两性离子)(诸如PSBMA、PCBMA或PMPC)缀合。
在一些实施方案中,水溶性聚合物包含聚碳酸酯。示例性聚碳酸酯包括但不限于5-甲基-2-氧代-1,3-二氧六环-5-甲酸五氟苯酯(MTC-OC
在一些实施方案中,水溶性聚合物包括聚合物杂化物,例如像聚碳酸酯/PEG聚合物杂化物、肽/蛋白质-聚合物缀合物或含羟基和/或两性离子衍生化聚合物(例如,含羟基和/或两性离子衍生化PEG聚合物)。在一些情况下,本文所述的IL-10多肽与聚合物杂化物(诸如聚碳酸酯/PEG聚合物杂化物、肽/蛋白质-聚合物缀合物或含羟基和/或两性离子衍生化聚合物(例如,含羟基和/或两性离子衍生化PEG聚合物))缀合。
在一些情况下,水溶性聚合物包含多糖。示例性多糖包括但不限于葡聚糖、聚唾液酸(PSA)、透明质酸(HA)、直链淀粉、肝素、硫酸乙酰肝素(HS)、糊精或羟乙基淀粉(HES)。在一些情况下,IL-10多肽与多糖缀合。在一些情况下,IL-10多肽与葡聚糖缀合。在一些情况下,IL-10多肽与PSA缀合。在一些情况下,IL-10多肽与HA缀合。在一些情况下,IL-10多肽与直链淀粉缀合。在一些情况下,IL-10多肽与肝素缀合。在一些情况下,IL-10多肽与HS缀合。在一些情况下,IL-10多肽与糊精缀合。在一些情况下,IL-10多肽与HES缀合。
在一些情况下,水溶性聚合物包含聚糖。聚糖的示例性类别包括N-连接的聚糖、O-连接的聚糖、糖脂、O-GlcNAc和糖胺聚糖。在一些情况下,IL-10多肽与聚糖缀合。在一些情况下,IL-10多肽与N-连接的聚糖缀合。在一些情况下,IL-10多肽与O-连接的聚糖缀合。在一些情况下,IL-10多肽与糖脂缀合。在一些情况下,IL-10多肽与O-GlcNAc缀合。在一些情况下,IL-10多肽与糖胺聚糖缀合。
在一些实施方案中,水溶性聚合物包含聚噁唑啉聚合物。聚噁唑啉聚合物是线性合成聚合物,并且与PEG相似,具有低多分散性。在一些情况下,聚噁唑啉聚合物是多分散的聚噁唑啉聚合物,其特征在于平均分子量。在一些情况下,聚噁唑啉聚合物的平均分子量包括例如1000、1500、2000、2500、3000、3500、4000、4500、5000、5500、6000、6500、7000、7500、8000、10,000、12,000、20,000、35,000、40,000、50,000、60,000、100,000、200,000、300,000、400,000或500,000Da。在一些情况下,聚噁唑啉聚合物包括聚(2-甲基2-噁唑啉)(PMOZ)、聚(2-乙基2-噁唑啉)(PEOZ)或聚(2-丙基2-噁唑啉)(PPOZ)。在一些情况下,IL-10多肽与聚噁唑啉聚合物缀合。在一些情况下,IL-10多肽与PMOZ缀合。在一些情况下,IL-10多肽与PEOZ缀合。在一些情况下,IL-10多肽与PPOZ缀合。
在一些情况下,水溶性聚合物包括聚丙烯酸聚合物。在一些情况下,IL-10多肽与聚丙烯酸聚合物缀合。
在一些情况下,水溶性聚合物包括多胺。多胺是包含两个或更多个伯氨基的有机聚合物。在一些实施方案中,多胺包括支化多胺、线性多胺或环状多胺。在一些情况下,多胺是低分子量线性多胺。示例性多胺包括腐胺、尸胺、亚精胺、精胺、乙二胺、1,3-二氨基丙烷、六亚甲基二胺、四乙基亚甲基二胺和哌嗪。在一些情况下,IL-10多肽与多胺缀合。在一些情况下,IL-10多肽与腐胺、尸胺、亚精胺、精胺、乙二胺、1,3-二氨基丙烷、六亚甲基二胺、四乙基亚甲基二胺或哌嗪缀合。
在一些情况下,水溶性聚合物描述于美国专利号7,744,861、8,273,833、和7,803,777中。在一些情况下,IL-10多肽与描述于美国专利号7,744,861、8,273,833、或7,803,777中的接头缀合。
脂质
在一些实施方案中,本文所述的缀合部分是脂质。在一些情况下,脂质是脂肪酸。在一些情况下,脂肪酸是饱和脂肪酸。在其他情况下,脂肪酸是不饱和脂肪酸。示例性脂肪酸包括但不限于包含约6至约26个碳原子、约6至约24个碳原子、约6至约22个碳原子、约6至约20个碳原子、约6至约18个碳原子、约20至约26个碳原子、约12至约26个碳原子、约12至约24个碳原子、约12至约22个碳原子、约12至约20个碳原子或约12至约18个碳原子的脂肪酸。在一些情况下,脂质与一种或多种血清蛋白结合,从而增加血清稳定性和/或血清半衰期。
在一些实施方案中,脂质与本文所述的IL-10多肽缀合。在一些情况下,脂质是脂肪酸,例如饱和脂肪酸或不饱和脂肪酸。在一些情况下,脂肪酸是约6至约26个碳原子、约6至约24个碳原子、约6至约22个碳原子、约6至约20个碳原子、约6至约18个碳原子、约20至约26个碳原子、约12至约26个碳原子、约12至约24个碳原子、约12至约22个碳原子、约12至约20个碳原子或约12至约18个碳原子的。在一些情况下,脂肪酸的长度包含约6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25或26个碳原子。在一些情况下,脂肪酸包括己酸(caproic acid)(己酸(hexanoic acid))、庚酸(enanthic acid)(庚酸(heptanoic acid))、辛酸(caprylic acid)(辛酸(octanoic acid))、壬酸(pelargonicacid)(壬酸(nonanoic acid))、癸酸(capric acid)(癸酸(decanoic acid))、十一酸(十一烷酸)、月桂酸(十二烷酸)、十三酸(十三烷酸)、肉豆蔻酸(十四烷酸)、十五酸(十五烷酸)、棕榈酸(十六烷酸)、十七酸(十七烷酸)、硬脂酸(十八烷酸)、十九酸(十九烷酸)、花生酸(二十烷酸)、二十一酸(二十一烷酸)、山萮酸(二十二烷酸)、二十三酸(二十三烷酸)、木酚酸(二十四烷酸)、二十五酸(二十五烷酸)或蜡酸(二十六烷酸)。
在一些实施方案中,IL-10脂质缀合物增加血清稳定性和/或血清半衰期。
蛋白质
在一些实施方案中,本文所述的缀合部分是蛋白质或其结合片段。示例性蛋白质包括白蛋白、转铁蛋白或运甲状腺素蛋白。在一些情况下,蛋白质或其结合片段包含抗体或其结合片段。在一些情况下,IL-10缀合物包含蛋白质或其结合片段。在一些情况下,包含蛋白质或其结合片段的IL-10缀合物具有增加的血清半衰期和/或稳定性。在一些情况下,包含蛋白质或其结合片段的IL-10缀合物与一个或多个IL-10R亚基的IL-10相互作用降低。在另外的情况下,蛋白质或其结合片段阻断IL-10与一个或多个IL-10R亚基的相互作用。
在一些实施方案中,缀合部分是白蛋白。白蛋白是水溶性球状蛋白家族。其通常在血浆中发现,占所有血浆蛋白的约55%-60%。人血清白蛋白(HSA)是一种585个氨基酸的多肽,其中三级结构分为三个结构域:结构域I(氨基酸残基1-195)、结构域II(氨基酸残基196-383)和结构域III(氨基酸残基384-585)。每个结构域进一步包含结合位点,其可以与内源性配体(诸如长链和中链脂肪酸、胆红素或血红素)或外源性化合物(诸如杂环或芳族化合物)可逆或不可逆地相互作用。
在一些情况下,IL-10多肽与白蛋白缀合。在一些情况下,IL-10多肽与人血清白蛋白(HSA)缀合。在另外的情况下,IL-10多肽与白蛋白的功能片段缀合。
在一些实施方案中,缀合部分是转铁蛋白。转铁蛋白是一种679个氨基酸的多肽,其大小为约80kDa,并且包含两个Fe
在一些情况下,IL-10多肽与转铁蛋白缀合。在一些情况下,IL-10多肽与人转铁蛋白缀合。在另外的情况下,IL-10多肽与转铁蛋白的功能片段缀合。
在一些实施方案中,缀合部分是运甲状腺素蛋白(TTR)。运甲状腺素蛋白是一种位于血清和脑脊液中的转运蛋白,其转运甲状腺激素甲状腺素(T
在一些情况下,IL-10多肽与运甲状腺素蛋白缀合(经由其末端之一或经由内部铰链区)。在一些情况下,IL-10多肽与运甲状腺素蛋白的功能片段缀合。
在一些实施方案中,缀合部分是抗体或其结合片段。在一些情况下,抗体或其结合片段包括人源化抗体或其结合片段、鼠抗体或其结合片段、嵌合抗体或其结合片段、单克隆抗体或其结合片段、单价Fab’、二价Fab
在一些情况下,缀合部分包含scFv、双scFv、(scFv)
在一些情况下,缀合部分包含抗体(例如IgG、IgA、IgM、IgE或IgD)的Fc部分。在一些情况下,所述部分包含IgG(例如,IgG
在一些情况下,IL-10多肽与抗体或其结合片段缀合。在一些情况下,IL-10多肽与人源化抗体或其结合片段、鼠抗体或其结合片段、嵌合抗体或其结合片段、单克隆抗体或其结合片段、单价Fab’、二价Fab
在一些实施方案中,IL-10多肽与水溶性聚合物(例如,PEG)和抗体或其结合片段缀合。在一些情况下,抗体或其结合片段包括人源化抗体或其结合片段、鼠抗体或其结合片段、嵌合抗体或其结合片段、单克隆抗体或其结合片段、单价Fab’、二价Fab
在一些情况下,一种或多种IL-10多肽-水溶性聚合物(例如,PEG)缀合物进一步与抗体或其结合片段结合。在一些情况下,IL-10缀合物与抗体的比率为约1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1、11:1或12:1。在一些情况下,IL-10缀合物与抗体的比率为约1:1。在其他情况下,IL-10缀合物与抗体的比率为约2:1、3:1或4:1。在另外的情况下,IL-10缀合物与抗体的比率为约6:1或更高。
在一些实施方案中,一种或多种IL-10多肽-水溶性聚合物(例如,PEG)缀合物与抗体或其结合片段直接结合。在其他情况下,IL-10缀合物通过接头与所述抗体或其结合片段间接结合。示例性接头包括同双官能接头、异双官能接头、基于马来酰亚胺的接头、零迹线接头、自消灭接头、间隔基等。
在一些实施方案中,抗体或其结合片段与IL-10多肽-水溶性聚合物(例如,PEG)缀合物的IL-10多肽部分直接或间接结合。在这种情况下,抗体与IL-10多肽的缀合位点是在不会阻碍IL-10多肽与IL-10R结合的位点处。在另外的情况下,抗体与IL-10多肽的缀合位点是在部分阻断IL-10多肽与IL-10R结合的位点处。在其他实施方案中,抗体或其结合片段与IL-10多肽-水溶性聚合物(例如,PEG)缀合物的水溶性聚合物部分直接或间接结合。
肽
在一些实施方案中,本文所述的缀合部分是肽。在一些情况下,肽是非结构化肽。在一些情况下,IL-10多肽与肽缀合。在一些情况下,包含肽的IL-10缀合物具有增加的血清半衰期和/或稳定性。在一些情况下,包含肽的IL-10缀合物与一个或多个IL-10R亚基的IL-10相互作用降低。在另外的情况下,肽阻断IL-10与一个或多个IL-10R亚基的相互作用。
在一些情况下,缀合部分是XTEN
在一些情况下,缀合部分是富含甘氨酸的均氨基酸聚合物(HAP),并且修饰被称为HAPylation。HAPylation是编码目的多肽的核酸与编码富含甘氨酸的均氨基酸聚合物(HAP)的核酸的基因融合。在一些情况下,HAP聚合物包含(Gly
在一些实施方案中,缀合部分是PAS多肽,并且修饰被称为PAS化。PAS化是编码目的多肽的核酸与编码PAS多肽的核酸的基因融合。PAS多肽是由Pro、Ala和Ser残基组成的亲水性不带电多肽。在一些情况下,PAS多肽的长度是至少约100、200、300、400、500、或600个氨基酸。在一些情况下,IL-10多肽与PAS多肽缀合。
在一些实施方案中,缀合部分是弹性蛋白样多肽(ELP),并且所述修饰被称为ELP化。ELP化是编码目的多肽的核酸与编码弹性蛋白样多肽(ELP)的核酸的基因融合。ELP包含VPGxG重复基序(SEQ ID NO:4),其中x是除脯氨酸之外的任何氨基酸。在一些情况下,IL-10多肽与ELP缀合。
在一些实施方案中,缀合部分是CTP肽。CTP肽包含31个氨基酸残基的肽FQSSSS*KAPPPS*LPSPS*RLPGPS*DTPILPQ(SEQ ID NO:5),其中S*表示O-糖基化位点(OPKO)。在一些情况下,CTP肽与IL-10多肽遗传融合)。在一些情况下,IL-10多肽与CTP肽缀合。
在一些实施方案中,IL-10多肽通过谷氨酰化被修饰。谷氨酰化(或聚谷氨酰化)是谷氨酸的可逆翻译后修饰,其中谷氨酸的γ-羧基与游离谷氨酸的氨基形成肽样键,其中α-羧基延伸到聚谷氨酸酯链中。
在一些实施方案中,IL-10多肽通过明胶样蛋白(GLK)聚合物被修饰。在一些情况下,GLK聚合物包含Gly-Xaa-Yaa的多个重复,其中Xaa和Yaa分别主要包含脯氨酸和4-羟基脯氨酸。在一些情况下,GLK聚合物还包含氨基酸残基Pro、Gly、Glu、Gln、Asn、Ser和Lys。在一些情况下,GLK聚合物的长度为约20、30、40、50、60、70、80、90、100、110、120、150个残基或更长。
另外的缀合部分
在一些情况下,缀合部分包含细胞外生物标记物。在一些情况下,细胞外生物标记物是肿瘤抗原。在一些情况下,示例性细胞外生物标记物包括CD19、PSMA、B7-H3、B7-H6、CD70、CEA、CSPG4、EGFRvIII、EphA3、EpCAM、EGFR、ErbB2(HER2)、FAP、FRα、GD2、GD3、Lewis-Y、间皮素、Muc1、Muc 16、ROR1、TAG72、VEGFR2、CD11、Gr-1、CD204、CD16、CD49b、CD3、CD4、CD8和B220。在一些情况下,缀合部分与IL-10键合或缀合。在一些情况下,缀合部分是遗传融合的,例如在IL-10的N-末端或C-末端处。
在一些情况下,缀合部分包含来自翻译后修饰的分子。在一些情况下,翻译后修饰的例子包括肉豆蔻酰化、棕榈酰化、异戊二烯化(或异戊烯化)(例如,法尼基化或香叶基香叶基化)、糖基磷脂酰肌醇化、酰化(例如,O-酰化、N-酰化、S-酰化)、烷基化(例如,烷基(如甲基或乙基)的添加)、酰胺化、糖基化、羟基化、碘化、核苷酸加成、氧化、磷酸化、琥珀酰化、硫酸化、糖化、氨甲酰化、谷氨酰化或脱酰胺化。在一些情况下,IL-10通过翻译后修饰(诸如肉豆蔻酰化、棕榈酰化、异戊二烯化(或异戊烯化)(例如,法尼基化或香叶基香叶基化)、糖基磷脂酰肌醇化、酰化(例如,O-酰化、N-酰化、S-酰化)、烷基化(例如,烷基(如甲基或乙基)的添加)、酰胺化、糖基化、羟基化、碘化、核苷酸加成、氧化、磷酸化、琥珀酰化、硫酸化、糖化、氨甲酰化、谷氨酰化或脱酰胺化)被修饰。
缀合
接头
在一些实施方案中,用于将缀合部分与本文所述的IL-10多肽缀合或结合的有用的功能性反应性基团包括例如零阶或更高阶的接头。在一些情况下,掺入本文所述白介素中的非天然氨基酸包含功能性反应性基团。在一些情况下,接头包含与掺入本文所述白介素中的非天然氨基酸反应的功能性反应性基团。在一些情况下,缀合部分包含与掺入本文所述白介素中的非天然氨基酸反应的功能性反应性基团。在一些情况下,缀合部分包含与本文所述接头(任选地预附接至细胞因子肽)反应的功能性反应性基团。在一些实施方案中,接头包含与本文所述IL-10多肽中的天然氨基酸反应的反应性基团。在一些情况下,更高阶接头包含双官能接头,诸如同双官能接头或异双官能接头。示例性同双官能接头包括但不限于Lomant试剂二硫代双(琥珀酰亚胺基丙酸酯)DSP、3'3'-二硫代双(磺基琥珀酰亚胺基丙酸酯)(DTSSP)、二琥珀酰亚胺辛二酸酯(DSS)、双(磺基琥珀酰亚胺基)辛二酸酯(BS)、酒石酸二琥珀酰亚胺酯(DST)、酒石酸二磺基琥珀酰亚胺酯(磺基DST)、乙二醇双(琥珀酰亚胺基琥珀酸酯)(EGS)、二琥珀酰亚胺戊二酸酯(DSG)、N,N'-二琥珀酰亚胺碳酸酯(DSC)、己二亚氨酸二甲酯(DMA)、庚二亚氨酸二甲酯(DMP)、辛二亚氨酸二甲酯(DMS)、3,3'-二硫代双丙亚氨酸二甲酯(DTBP)、1,4-二-3'-(2'-吡啶基二硫代)丙酰胺基)丁烷(DPDPB)、双马来酰亚胺基己烷(BMH)、含芳基卤化物的化合物(DFDNB),例如像1,5-二氟-2,4-二硝基苯或1,3-二氟-4,6-二硝基苯、4,4'-二氟-3,3'-二硝基苯砜(DFDNPS)、双-[β-(4-叠氮基水杨酰胺基)乙基]二硫化物(BASED)、甲醛、戊二醛、1,4-丁二醇二缩水甘油醚、己二酸二酰肼、碳酰肼、邻甲苯胺、3,3'-二甲基联苯胺、联苯胺、α,α'-对-二氨基二苯基、二碘-对-二甲苯磺酸、N,N'-亚乙基-双(碘乙酰胺)或N,N'-六亚甲基-双(碘乙酰胺)。
在一些实施方案中,双官能接头包括异双官能接头。示例性异双官能接头包括但不限于胺反应性和巯基交联接头,诸如N-琥珀酰亚胺基3-(2-吡啶基二硫)丙酸酯(sPDP)、长链N-琥珀酰亚胺基3-(2-吡啶基二硫)丙酸酯(LC-sPDP)、水溶性长链N-琥珀酰亚胺基3-(2-吡啶基二硫)丙酸酯(磺基-LC-sPDP)、琥珀酰亚胺基氧羰基-α-甲基-α-(2-吡啶基二硫)甲苯(sMPT)、磺基琥珀酰亚胺基-6-[α-甲基-α-(2-吡啶基二硫)甲苯酰胺]己酸酯(磺基-LC-sMPT)、琥珀酰亚胺基-4-(N-马来酰亚胺甲基)环己烷-1-羧酸酯(sMCC)、磺基琥珀酰亚胺基-4-(N-马来酰亚胺甲基)环己基-1-羧酸酯(磺基-sMCC)、间马来酰亚胺基苯甲酰基-N-羟基琥珀酰亚胺酯(MB)、间马来酰亚胺基苯甲酰基-N-羟基磺基琥珀酰亚胺酯(磺基-MB)、N-琥珀酰亚胺基(4-碘乙酰基)氨基苯甲酸酯(sIAB)、磺基琥珀酰亚胺基(4-碘乙酰基)氨基苯甲酸酯(磺基-sIAB)、琥珀酰亚胺基-4-(对-马来酰亚胺基苯基)丁酸酯(sMPB)、磺基琥珀酰亚胺基-4-(对-马来酰亚胺基苯基)丁酸酯(磺基-sMPB)、N-(γ-马来酰亚胺基丁酰氧基)琥珀酰亚胺酯(GMB)、N-(γ-马来酰亚胺基丁酰氧基)磺基琥珀酰亚胺酯(磺基-GMB)、琥珀酰亚胺基6-((碘乙酰基)氨基)己酸酯(sIAX)、琥珀酰亚胺基6-[6-(((碘乙酰基)氨基)己酰基)氨基]己酸酯(sIAXX)、琥珀酰亚胺基4-(((碘乙酰基)氨基)甲基)环己烷-1-羧酸酯(sIAC)、琥珀酰亚胺基6-((((4-碘乙酰基)氨基)甲基)环己烷-1-羰基)氨基)己酸酯(sIACX)、对-硝基苯基碘乙酸酯(NPIA)、羰基反应性和巯基反应性交联剂如4-(4-N-马来酰亚胺基苯基)丁酸酰肼(MPBH)、4-(N-马来酰亚胺基甲基)环己烷-1-羧基-酰肼8(M
在一些情况下,反应性官能团包含与存在于结合部分(例如,缀合部分或IL-10)上的亲电基团具有反应性的亲核基团。示例性亲电基团包括羰基,诸如醛、酮、羧酸、酯、酰胺、烯酮、酰基卤或酸酐。在一些实施方案中,反应性官能团是醛。示例性亲核基团包括酰肼、肟、氨基、肼、缩氨基硫脲、肼羧酸酯和芳基酰肼。在一些实施方案中,掺入本文所述白介素中的非天然氨基酸包含亲电基团。
在一些实施方案中,接头是可切割接头。在一些实施方案中,可切割接头是二肽接头。在一些实施方案中,二肽接头是缬氨酸-瓜氨酸(Val-Cit)、苯丙氨酸-赖氨酸(Phe-Lys)、缬氨酸-丙氨酸(Val-Ala)和缬氨酸-赖氨酸(Val-Lys)。在一些实施方案中,二肽接头是缬氨酸-瓜氨酸。
在一些实施方案中,接头是肽接头,其包含例如至少2、3、4、5、6、7、8、9、10、11、12、15、20、25、30、35、40、45、50或更多个氨基酸。在一些情况下,肽接头包含至多2、3、4、5、6、7、8、9、10、11、12、15、20、25、30、35、40、45、50个或更少的氨基酸。在另外的情况下,肽接头包含约2、3、4、5、6、7、8、9、10、11、12、15、20、25、30、35、40、45或50个氨基酸。
在一些实施方案中,接头包含自消灭接头部分。在一些实施方案中,自消灭接头部分包含对-氨基苄醇(PAB)、对-氨基苄氧基羰基(PABC)或其衍生物或类似物。在一些实施方案中,接头包含二肽接头部分和自消灭接头部分。在一些实施方案中,自消灭接头部分诸如美国专利号9089614和WIPO申请号WO 2015038426中所述。
在一些实施方案中,可切割接头是葡糖苷酸。在一些实施方案中,可切割接头是酸可切割接头。在一些实施方案中,酸可切割接头是肼。在一些实施方案中,可切割接头是可还原接头。
在一些实施方案中,接头包含马来酰亚胺基团。在一些情况下,马来酰亚胺基团也称为马来酰亚胺间隔基。在一些情况下,马来酰亚胺基团还包含己酸,从而形成马来酰亚胺基己酰基(mc)。在一些情况下,接头包含马来酰亚胺基己酰基(mc)。在一些情况下,接头是马来酰亚胺基己酰基(mc)。在其他情况下,马来酰亚胺基团包含马来酰亚胺基甲基,诸如上述琥珀酰亚胺基-4-(N-马来酰亚胺基甲基)环己烷-1-羧酸酯(sMCC)或磺基琥珀酰亚胺基-4-(N-马来酰亚胺基甲基)环己烷-1-羧酸酯(磺基-sMCC)。
在一些实施方案中,马来酰亚胺基团是自稳定马来酰亚胺。在一些情况下,自稳定马来酰亚胺利用二氨基丙酸(DPR)掺入碱性氨基,使之与马来酰亚胺相邻,以提供硫代琥珀酰亚胺环水解的分子内催化,从而通过逆迈克尔反应进行消除反应以消除马来酰亚胺。在一些情况下,自稳定马来酰亚胺是Lyon等人,“Self-hydrolyzing maleimides improvethe stability and pharmacological properties of antibody-drug conjugates,”Nat.Biotechnol.32(10):1059-1062(2014)中描述的马来酰亚胺基团。在一些情况下,接头包含自稳定马来酰亚胺。在一些情况下,接头是自稳定马来酰亚胺。
缀合化学
各种缀合反应用于缀合物接头、缀合部分和掺入本文所述IL-10多肽中的非天然氨基酸。此类缀合反应通常与水性条件相容,诸如“双正交”反应。在一些实施方案中,缀合反应由化学试剂(诸如催化剂)、光、或在接头、缀合部分或非天然氨基酸上发现的反应性化学基团介导。在一些实施方案中,缀合反应由酶介导。在一些实施方案中,本文使用的缀合反应描述于Gong,Y.,Pan,L.Tett.Lett.2015,56,2123中。在一些实施方案中,本文使用的缀合反应描述于Chen,X.;Wu.Y-W.Org.Biomol.Chem.2016,14,5417中。
在本文所述的一些实施方案中,缀合反应包括酮或醛与亲核试剂的反应。在一些实施方案中,缀合反应包括酮与氨氧基的反应以形成肟。在一些实施方案中,缀合反应包括酮与芳基或杂芳基胺基团的反应以形成亚胺。在一些实施方案中,缀合反应包括醛与芳基或杂芳基胺基团的反应以形成亚胺。在一些实施方案中,本文所述的缀合反应产生包含经由肟附接的接头或缀合部分的IL-10多肽。在一些实施方案中,缀合反应包括醛或酮与色胺亲核试剂的Pictet-Spengler反应。在一些实施方案中,缀合反应包括肼基-Pictet-Spengler反应。在一些实施方案中,缀合反应包括Pictet-Spengler连接。
在本文所述的一些实施方案中,本文所述的缀合反应包括叠氮化物和膦的反应(Staudinger连接)。在一些实施方案中,膦是芳基膦。在一些实施方案中,芳基膦包含原酸酯基团。在一些实施方案中,膦包含结构2-(二苯基膦酰基)苯甲酸甲酯。在一些实施方案中,本文所述的缀合反应产生包含经由芳基酰胺附接的接头或缀合部分的IL-10多肽。在一些实施方案中,本文所述的缀合反应产生包含经由酰胺附接的接头或缀合部分的IL-10多肽。
在本文所述的一些实施方案中,本文所述的缀合反应包括1,3-偶极环加成反应。在一些实施方案中,1,3-偶极环加成反应包括叠氮化物和膦的反应(“点击”反应)。在一些实施方案中,缀合反应由铜催化。在一些实施方案中,本文所述的缀合反应产生包含经由三唑附接的接头或缀合部分的IL-10多肽。在一些实施方案中,本文所述的缀合反应包括叠氮化物与应变烯烃的反应。在一些实施方案中,本文所述的缀合反应包括叠氮化物与应变炔烃的反应。在一些实施方案中,本文所述的缀合反应包括叠氮化物与环炔(例如OCT、DIFO、DIFBO、DIBO、BARAC、TMTH或其他应变环炔)的反应,其结构示于Gong,Y.,Pan,L.Tett.Lett.2015,56,2123中。在一些实施方案中,1,3-偶极环加成反应通过光催化(“光点击(photoclick)”)。在一些实施方案中,本文所述的缀合反应包括末端烯丙基与四唑和光的反应。在一些实施方案中,本文所述的缀合反应包括末端炔基与四唑和光的反应。在一些实施方案中,本文所述的缀合反应包括邻-烯丙基氨基酸与四嗪和光的反应。在一些实施方案中,本文所述的缀合反应包括邻-烯丙基酪氨酸与四嗪和光的反应。
在一些实施方案中,本文所述的缀合反应包括叠氮化物与环炔烃(例如DBCO)的反应。在本文所述的一些实施方案中,本文所述的缀合反应包括:
如本文所述的缀合反应(诸如点击反应)反应可以产生单个区域异构体、或区域异构体的混合物。在一些情况下,区域异构体的比率是约1:1。在一些情况下,区域异构体的比率是约2:1。在一些情况下,区域异构体的比率是约1.5:1。在一些情况下,区域异构体的比率是约1.2:1。在一些情况下,区域异构体的比率是约1.1:1。在一些情况下,区域异构体的比率大于1:1。
在本文所述的一些实施方案中,本文所述的缀合反应包括包含二烯和亲二烯体的逆电子需求环加成反应。在一些实施方案中,二烯包括四嗪。在一些实施方案中,亲二烯体包括烯烃。在一些实施方案中,亲二烯体包括炔烃。在一些实施方案中,炔烃是应变炔烃。在一些实施方案中,烯烃是应变二烯。在一些实施方案中,炔烃是反式环辛炔。在一些实施方案中,炔烃是环辛烯。在一些实施方案中,烯烃是环丙烯。在一些实施方案中,烯烃是氟环丙烯。在一些实施方案中,本文所述的缀合反应导致形成经由在环中包含两个氮原子的6元环杂环附接至接头或缀合部分的IL-10多肽。
在本文所述的一些实施方案中,本文所述的缀合反应包括烯烃复分解反应。在一些实施方案中,本文所述的缀合反应包括烯烃和炔烃与钌催化剂的反应。在一些实施方案中,本文所述的缀合反应包括两种炔烃与钌催化剂的反应。在一些实施方案中,本文所述的缀合反应包括两种炔烃与钌催化剂的反应。在一些实施方案中,本文所述的缀合反应包括烯烃或炔烃与钌催化剂和包含烯丙基的氨基酸的反应。在一些实施方案中,本文所述的缀合反应包括烯烃或炔烃与钌催化剂和包含烯丙基硫醚或硒醚的氨基酸的反应。在一些实施方案中,钌催化剂是Hoveda-Grubbs第2代催化剂。在一些实施方案中,烯烃复分解反应包括一种或多种应变烯烃或炔烃的反应。
在本文所述的一些实施方案中,本文所述的缀合反应包括交叉偶联反应。在一些实施方案中,交叉偶联反应包含过渡金属催化剂,诸如铱、金、钌、铑、钯、镍、铂或其他过渡金属催化剂和一种或多种配体。在一些实施方案中,过渡金属催化剂是水溶性的。在本文所述的一些实施方案中,本文所述的缀合反应包括铃木-宫浦交叉偶联反应。在本文所述的一些实施方案中,本文所述的缀合反应包括芳基卤化物(或三氟甲磺酸酯、或甲苯磺酸酯)、芳基或烯基硼酸和钯催化剂的反应。在本文所述的一些实施方案中,本文所述的缀合反应包括薗头交叉偶联反应。在本文所述的一些实施方案中,本文所述的缀合反应包括芳基卤化物(或三氟甲磺酸酯、或甲苯磺酸酯)、炔烃和钯催化剂的反应。在一些实施方案中,交叉偶联反应导致接头或缀合部分经由碳-碳键附接至IL-10多肽。
在本文所述的一些实施方案中,本文所述的缀合反应包括在缀合之前反应性基团的脱保护或“解笼”反应。在一些实施方案中,本文所述的缀合反应包括用光使反应性基团解笼,随后进行缀合反应。在一些实施方案中,反应性基团被包含一个或多个硝基的芳烷基部分保护。在一些实施方案中,反应性基团的解笼导致游离胺、硫化物或其他反应性基团。在一些实施方案中,本文所述的缀合反应包括用过渡金属催化剂使反应性基团解笼,随后进行缀合反应。在一些实施方案中,过渡金属催化剂包含钯和一种或多种配体。在一些实施方案中,反应性基团被烯丙基部分保护。在一些实施方案中,反应性基团被烯丙基氨基甲酸酯保护。在一些实施方案中,反应性基团被炔丙基部分保护。在一些实施方案中,反应性基团被炔丙基氨基甲酸酯保护。在一些实施方案中,反应性基团被亲二烯体保护,其中暴露于二烯(诸如四嗪)导致反应性基团的脱保护。
在本文所述的一些实施方案中,本文所述的缀合反应包括配体定向反应,其中配体(任选地)附接至反应性基团)促进了反应性基团与IL-10多肽之间的缀合位点。在一些实施方案中,配体在IL-10多肽与反应性基团反应期间或之后被切割。在一些实施方案中,IL-10多肽的缀合位点是天然氨基酸。在一些实施方案中,IL-10多肽的缀合位点是赖氨酸、半胱氨酸或丝氨酸。在一些实施方案中,IL-10多肽的缀合位点是本文所述的非天然氨基酸。在一些实施方案中,反应性基团包括离去基团,诸如贫电子的芳基或杂芳基。在一些实施方案中,反应性基团包括离去基团,诸如被IL-10多肽置换的贫电子的烷基。在一些实施方案中,本文所述的缀合反应包括自由基捕获剂与自由基物质的反应。在一些实施方案中,本文所述的缀合反应包括氧化自由基加成反应。在一些实施例中,自由基捕获剂是芳胺。在一些实施方案中,自由基物质是酪氨酰自由基。在一些实施方案中,自由基物质由钌催化剂(诸如[Ru(bpy)
酶促反应任选地用于本文所述的缀合反应。示例性酶缀合包括SortA介导的缀合、TGs介导的缀合或FGE介导的缀合。在一些实施方案中,本文所述的缀合反应包括末端1-氨基-2-硫基团与硫酯的天然蛋白连接(NPL),以形成酰胺键。
本文描述了用于使接头或缀合部分与IL-10多肽反应的各种缀合反应,其中所述反应与IL-10多肽中的天然(“规范”)氨基酸一起发生。在一些实施方案中,天然氨基酸在野生型序列中发现的缀合位置处被发现,或替代地,所述位置已被突变。在一些实施方案中,缀合反应包括在IL-10残基处二硫键的形成。在一些实施方案中,缀合反应包括半胱氨酸或赖氨酸的1,4迈克尔加成反应。在一些实施方案中,缀合反应包括IL-10的氰基苯并噻唑连接。在一些实施方案中,缀合反应包括与丙酮部分,诸如1,3-二氯-2-丙酮的交联。在一些实施方案中,缀合反应包括通过半胱氨酸与邻-均三甲苯磺酰基羟胺反应形成的脱氢丙氨酸的1,4迈克尔加成。在一些实施方案中,缀合反应包括酪氨酸与三唑啉二酮(TAD)或TAD衍生物的反应。在一些实施方案中,缀合反应包括色氨酸与铑类卡宾的反应。
使用方法
增殖性疾病或病症
在一些实施方案中,本文描述了治疗有需要的受试者的增殖性疾病或病症的方法,所述方法包括向受试者施用治疗有效量的本文所述的IL-10缀合物。在一些实施方案中,所述增殖性疾病或病症是癌症。在一些情况下,所述癌症是实体瘤。示例性实体瘤包括但不限于膀胱癌、骨癌、脑癌、乳腺癌、结直肠癌、食道癌、眼癌、头颈癌、肾癌、肺癌、黑色素瘤、卵巢癌、胰腺癌或前列腺癌。在一些情况下,所述实体瘤是转移性癌症。在一些情况下,所述实体瘤是从先前治疗的复发性或难治性癌症。
在一些情况下,将本文所述的IL-10缀合物施用于有需要的受试者,用于治疗实体瘤。在这种情况下,受试者患有膀胱癌、骨癌、脑癌、乳腺癌、结直肠癌、食道癌、眼癌、头颈癌、肾癌(或肾细胞癌)、肺癌、黑色素瘤、卵巢癌、胰腺癌或前列腺癌。在一些情况下,将IL-10缀合物施用于受试者以治疗膀胱癌。在一些情况下,将IL-10缀合物施用于受试者以治疗乳腺癌。在一些情况下,将IL-10缀合物施用于受试者以治疗肠直肠癌。在一些情况下,将IL-10缀合物施用于受试者以治疗食道癌。在一些情况下,将IL-10缀合物施用于受试者以治疗头颈癌。在一些情况下,将IL-10缀合物施用于受试者以治疗肾癌(或肾细胞癌或RCC)。在一些情况下,将IL-10缀合物施用于受试者以治疗肺癌。在一些情况下,将IL-10缀合物施用于受试者以治疗黑色素瘤。在一些情况下,将IL-10缀合物施用于受试者以治疗卵巢癌。在一些情况下,将IL-10缀合物施用于受试者以治疗胰腺癌。在一些情况下,将IL-10缀合物施用于受试者以治疗前列腺癌。在一些情况下,所述癌症是转移性癌症。在其他情况下,所述癌症是复发性癌症。在另外的情况下,所述癌症是难治性癌症。
在一些实施方案中,所述癌症是治疗幼稚癌症。在这种情况下,所述治疗幼稚癌症是尚未通过疗法治疗的癌症。在一些情况下,所述治疗幼稚癌症是实体瘤,诸如膀胱癌、骨癌、脑癌、乳腺癌、结直肠癌、食道癌、眼癌、头颈癌、肾癌(或RCC)、肺癌、黑色素瘤、卵巢癌、胰腺癌或前列腺癌。在一些实施方案中,本文描述了治疗有需要的受试者的治疗幼稚实体瘤的方法,所述方法包括向受试者施用本文所述的IL-10缀合物。
在一些实施方案中,所述癌症是恶性血液病。在一些情况下,将本文所述的IL-10缀合物施用于有需要的受试者,以治疗恶性血液病。在一些情况下,所述恶性血液病包含白血病、淋巴瘤、或骨髓瘤。在一些情况下,所述恶性血液病是T细胞恶性肿瘤。在其他情况下,所述恶性血液病是B细胞恶性肿瘤。在一些情况下,所述恶性血液病是转移性恶性血液病。在其他情况下,所述恶性血液病是复发性恶性血液病。在另外的情况下,所述恶性血液病是难治性恶性血液病。在一些情况下,所述受试者患有T细胞恶性肿瘤。在一些情况下,所述受试者患有B细胞恶性肿瘤。在一些情况下,所述受试者患有慢性淋巴细胞性白血病(CLL)、小淋巴细胞性淋巴瘤(SLL)、滤泡性淋巴瘤(FL)、弥漫性大B细胞淋巴瘤(DLBCL)、套细胞淋巴瘤(MCL)、华氏巨球蛋白血症、多发性骨髓瘤、结外边缘区B细胞淋巴瘤、结边缘区B细胞淋巴瘤、伯基特淋巴瘤、非伯基特高级B细胞淋巴瘤、原发性纵隔B细胞淋巴瘤(PMBL)、免疫母细胞性大细胞淋巴瘤、前体B淋巴母细胞淋巴瘤、B细胞前淋巴细胞性白血病、淋巴浆细胞性淋巴瘤、脾边缘区淋巴瘤、浆细胞骨髓瘤、浆细胞瘤、纵隔(胸腺)大B细胞淋巴瘤、血管内大B细胞淋巴瘤、原发性渗出性淋巴瘤或淋巴瘤样肉芽肿病。在一些情况下,将IL-10缀合物施用于受试者以治疗CLL。在一些情况下,将IL-10缀合物施用于受试者以治疗SLL。在一些情况下,将IL-10缀合物施用于受试者以治疗FL。在一些情况下,将IL-10缀合物施用于受试者以治疗DLBCL。在一些情况下,将IL-10缀合物施用于受试者以治疗MCL。在一些情况下,将IL-10缀合物施用于受试者以治疗华氏巨球蛋白血症。在一些情况下,将IL-10缀合物施用于受试者以治疗多发性骨髓瘤。在一些情况下,将IL-10缀合物施用于受试者以治疗伯基特淋巴瘤。
另外的治疗剂
在一些实施方案中,将另外的治疗剂进一步施用于受试者。在一些情况下,将另外的治疗剂与IL-10缀合物同时施用和/或共配制。在其他情况下,顺序施用另外的治疗剂和IL-10缀合物,例如,在另外的治疗剂之前施用IL-10缀合物,或者在施用另外的治疗剂之后施用IL-10缀合物。
在一些情况下,另外的治疗剂包括化学治疗剂、免疫治疗剂、靶向疗法、放射疗法或其组合。说明性另外的治疗剂包括但不限于烷基化剂,诸如奥曲胺、白消安、卡铂、卡莫司汀、苯丁酸氮芥、顺铂、环磷酰胺、达卡巴嗪、洛莫司汀、美法仑、奥沙利铂、替莫唑胺或噻替帕;抗代谢物,诸如5-氟尿嘧啶(5-FU)、6-巯基嘌呤(6-MP)、卡培他滨、阿糖胞苷、氟尿苷、氟达拉滨、吉西他滨、羟基脲、甲氨蝶呤或培美曲塞;蒽环类药物,诸如柔红霉素、阿霉素、表柔比星或伊达比星;拓扑异构酶I抑制剂,诸如拓扑替康或伊立替康(CPT-11);拓扑异构酶II抑制剂,诸如依托泊苷(VP-16)、替尼泊苷或米托蒽醌;有丝分裂抑制剂,诸如多西他赛、雌莫司汀、伊沙匹隆、紫杉醇、长春碱、长春新碱或长春瑞滨;或皮质类固醇,诸如泼尼松、甲基泼尼松龙或地塞米松。
在一些情况下,另外的治疗剂包括一线疗法。如本文所用,“一线疗法”包括对患有癌症的受试者的初级治疗。在一些情况下,癌症是原发性或局部性癌症。在其他情况下,癌症是转移性或复发性癌症。在一些情况下,一线疗法包括化学疗法。在其他情况下,一线治疗包括免疫疗法、靶向疗法或放射疗法。技术人员将容易理解,不同的一线治疗可以适用于不同类型的癌症。
在一些情况下,将IL-10缀合物与选自以下的另外的治疗剂一起施用:烷基化剂,诸如奥曲胺、白消安、卡铂、卡莫司汀、苯丁酸氮芥、顺铂、环磷酰胺、达卡巴嗪、洛莫司汀、美法仑、奥沙利铂、替莫唑胺或噻替帕;抗代谢物,诸如5-氟尿嘧啶(5-FU)、6-巯基嘌呤(6-MP)、卡培他滨、阿糖胞苷、氟尿苷、氟达拉滨、吉西他滨、羟基脲、甲氨蝶呤或培美曲塞;蒽环类药物,诸如柔红霉素、阿霉素、表柔比星或伊达比星;拓扑异构酶I抑制剂,诸如拓扑替康或伊立替康(CPT-11);拓扑异构酶II抑制剂,诸如依托泊苷(VP-16)、替尼泊苷或米托蒽醌;有丝分裂抑制剂,诸如多西他赛、雌莫司汀、伊沙匹隆、紫杉醇、长春碱、长春新碱或长春瑞滨;或皮质类固醇,诸如泼尼松、甲基泼尼松龙或地塞米松。
在一些情况下,将本文所述的IL-10缀合物与酶聚ADP核糖聚合酶(PARP)的抑制剂一起施用。示例性PARP抑制剂包括但不限于奥拉帕尼(AZD-2281,
在一些实施方案中,将本文所述的IL-10缀合物与酪氨酸激酶抑制剂(TKI)一起施用。示例性TKI包括但不限于阿法替尼、阿来替尼、阿昔替尼、博舒替尼、卡博替尼、塞利替尼、考比替尼、克唑替尼、达拉非尼、达沙替尼、厄洛替尼、吉非替尼、依鲁替尼、伊马替尼、拉帕替尼、仑伐替尼、尼罗替尼、宁特达尼、奥希替尼、帕唑帕尼、帕纳替尼、瑞拉非尼、卢利替尼、索拉非尼、舒尼替尼、托法替尼和万迪他尼。
在一些情况下,将本文所述的IL-10缀合物与免疫检查点抑制剂一起施用。示例性检查点抑制剂包括:
PD-L1抑制剂,诸如来自AstraZeneca的度伐鲁单抗(Imfinzi)、来自Genentech的阿特珠单抗(MPDL3280A)、来自EMD Serono/Pfizer的阿维鲁单抗、来自CytomXTherapeutics的CX-072、来自Novartis Pharmaceuticals的FAZ053、来自3D Medicine/Alphamab的KN035、来自Eli Lilly的LY3300054、或来自EMD Serono的M7824(抗PD-L1/TGFβtrap);
PD-L2抑制剂,诸如葛兰素史克(GlaxoSmithKline)的AMP-224(Amplimmune)和rHIgM12B7;
PD-1抑制剂,诸如来自Bristol-Myers Squibb的纳武单抗(Opd ivo)、来自Merck的派姆单抗(Keytruda)、来自Agenus的AGEN 2034、来自BeiGene的BGB-A317、来自Boehringer-Ingelheim Pharmaceuticals的Bl-754091、来自CBT Pharmaceuticals的CBT-501(杰诺单抗(genolimzumab))、来自Incyte的INCSHR1210、来自Janssen Research&Development的JNJ-63723283、来自MedImmune的MEDI0680、来自MacroGenics的MGA 012、来自Nov artis Pharmaceuticals的PDR001、来自Pfizer的PF-06801591、来自RegeneronPharmaceuticals/Sanofi的REGN2810(SAR439684)、或来自TESARO的TSR-042;
CTLA-4抑制剂,诸如来自Bristol Meyers Squibb的伊匹单抗(也称为
LAG3抑制剂,诸如来自Bristol-Myers Squibb的BMS-986016、来自NovartisPharmaceuticals的IMP701、来自Novartis Pharmaceuticals的LAG525、或来自RegeneronPharmaceuticals的REGN3767;
B7-H3抑制剂,诸如来自MacroGenics的依诺妥珠单抗(enoblituzumab)(MGA271);
KIR抑制剂,诸如来自Innate Pharma的利瑞鲁单抗(IPH2101;BMS-986015);
CD137抑制剂,诸如乌瑞鲁单抗(BMS-663513,Bristol-Myers Squibb)、PF-05082566(抗4-1BB,PF-2566,Pfizer)、或XmAb-5592(Xencor);
PS抑制剂,诸如巴韦妥昔单抗;
和抑制剂,诸如抗体或其片段(例如,单克隆抗体,人、人源化或嵌合抗体)、RNAi分子或针对TIM3、CD52、CD30、CD20、CD33、CD27、OX40、GITR、ICOS、BTLA(CD272)、CD160、2B4、LAIR1、TIGHT、LIGHT、DR3、CD226、CD2、或SLAM的小分子。
在一些情况下,将IL-10缀合物与派姆单抗、纳武单抗、曲美目单抗或伊匹单抗组合施用。
在一些情况下,将本文所述的IL-10缀合物与抗体(诸如阿仑单抗、曲妥珠单抗、替伊莫单抗、本妥昔单抗、ado-曲妥珠单抗emtansine或博纳吐单抗)一起施用。
在一些情况下,将IL-10缀合物与选自另外的细胞因子的另外的治疗剂一起施用。在一些情况下,另外的细胞因子增强和/或协同T效应细胞扩增和/或增殖。在一些情况下,另外的细胞因子包括IL-1β、IL-2、IL-6、IL-7、IL-12、IL-15、IL-18、IL-21或TNFα。在一些情况下,另外的细胞因子是IL-7。在一些情况下,另外的细胞因子是IL-15。在一些情况下,另外的细胞因子是IL-21。在一些情况下,另外的细胞因子是TNFα。
在一些情况下,将IL-10缀合物与选自受体激动剂的另外的治疗剂一起施用。在一些情况下,受体激动剂包括Toll样受体(TLR)配体。在一些情况下,所述TLR配体包括TLR1、TLR2、TLR3、TLR4、TLR5、TLR6、TLR7、TLR8或TLR9。在一些情况下,所述TLR配体包括合成配体,例如像Pam3Cys、CFA、MALP2、Pam2Cys、FSL-1、Hib-OMPC、聚肌苷酸:聚胞苷酸、聚腺苷酸:聚尿苷酸、AGP、MPL A、RC-529、MDF2β、CFA或鞭毛蛋白。在一些情况下,将IL-10缀合物与选自TLR1、TLR2、TLR3、TLR4、TLR5、TLR6、TLR7、TLR8和TLR9的一种或多种TLR激动剂一起施用。在一些情况下,将IL-10缀合物与选自Pam3Cys、CFA、MALP2、Pam2Cys、FSL-1、Hib-OMPC、聚肌苷酸:聚胞苷酸、聚腺苷酸:聚尿苷酸、AGP、MPL A、RC-529、MDF2β、CFA和鞭毛蛋白的一种或多种TLR激动剂一起施用。
在一些实施方案中,将IL-10缀合物与过继性T细胞转移(ACT)疗法结合使用。在一个实施方案中,ACT涉及在受试者中鉴定具有例如抗肿瘤活性的自体T淋巴细胞、在体外扩增自体T淋巴细胞、以及随后将经扩增的T淋巴细胞再输注到受试者中。在另一个实施方案中,ACT包括使用具有例如抗肿瘤活性的同种异体T淋巴细胞、在体外扩增T淋巴细胞、以及随后将经扩增的同种异体T淋巴细胞输注到有需要的受试者中。在一些情况下,将本文所述的IL-10缀合物作为ACT疗法的一部分与自体T淋巴细胞结合使用。在其他情况下,将本文所述的IL-10缀合物作为ACT疗法的一部分与同种异体T淋巴细胞结合使用。在一些情况下,将IL-10缀合物与ACT疗法同时施用有需要的受试者。在其他情况下,将IL-10缀合物与ACT疗法顺序地施用于有需要的受试者。
在一些实施方案中,IL-10缀合物用于自体和/或同种异体T细胞转移物的离体激活和/或扩增。在这种情况下,IL-10缀合物用于激活和/或扩增包含自体和/或同种异体T细胞的样品,并且在将所述样品施用于有需要的受试者之前,任选地从所述样品中去除IL-10缀合物。
在一些实施方案中,将IL-10缀合物与疫苗一起施用。在一些情况下,将IL-10缀合物与溶瘤病毒组合使用。在这种情况下,IL-10缀合物充当刺激剂来调节免疫应答。在一些情况下,将IL-10缀合物作为辅助疗法的一部分与溶瘤病毒一起使用。示例性溶瘤病毒包括T-Vec(Amgen)、G47Δ(Todo等人)、JX-594(Sillajen)、CG0070(Cold Genesys)和Reolysin(Oncolytics Biotech)。在一些情况下,将IL-10缀合物与溶瘤病毒(诸如T-Vec、G47Δ、JX-594、CG0070或Reolysin)组合使用。
在一些实施方案中,将IL-10缀合物与放射疗法组合施用。
IL-10多肽产生
在一些情况下,重组产生或化学合成本文所述的IL-10多肽,其含有天然氨基酸突变或非天然氨基酸突变。在一些情况下,例如通过宿主细胞系统或在无细胞系统中重组产生本文所述的IL-10多肽。
在一些情况下,通过宿主细胞系统重组产生IL-10多肽。在一些情况下,宿主细胞是真核细胞(例如,哺乳动物细胞、昆虫细胞、酵母细胞或植物细胞)、原核细胞(例如,革兰氏阳性细菌或革兰氏阴性细菌)或古细菌细胞。在一些情况下,真核宿主细胞是哺乳动物宿主细胞。在一些情况下,哺乳动物宿主细胞是稳定的细胞系,或者是将目的遗传物质掺入其自身基因组中并且具有在多代细胞分裂后表达所述遗传物质产物的能力的细胞系。在其他情况下,哺乳动物宿主细胞是瞬时细胞系,或者是未将目的遗传物质掺入其自身基因组中并且不具有在多代细胞分裂后表达所述遗传物质产物的能力的细胞系。
示例性哺乳动物宿主细胞包括293T细胞系、293A细胞系、293FT细胞系、293F细胞、293H细胞、A549细胞、MDCK细胞、CHO DG44细胞、CHO-S细胞、CHO-K1细胞、Expi293F
在一些实施方案中,真核宿主细胞是昆虫宿主细胞。示例性昆虫宿主细胞包括果蝇(Drosophila)S2细胞、Sf9细胞、Sf21细胞、High Five
在一些实施方案中,真核宿主细胞是酵母宿主细胞。示例性酵母宿主细胞包括毕赤酵母(Pichia pastoris)酵母菌株,诸如GS115、KM71H、SMD1168、SMD1168H和X-33,以及酿酒酵母(Saccharomyces cerevisiae)酵母菌株,诸如INVSc1。
在一些实施方案中,真核宿主细胞是植物宿主细胞。在一些情况下,植物细胞包括来自藻类的细胞。示例性植物细胞系包括来自莱茵衣藻(Chlamydomonas reinhardtii)137c或细长聚球藻(Synechococcus elongatus)PPC 7942的菌株。
在一些实施方案中,宿主细胞是原核宿主细胞。示例性原核宿主细胞包括BL21、Mach1
在一些情况下,用于产生本文所述IL-10多肽的合适的多核酸分子或载体包括源自真核或原核来源的任何合适的载体。示例性多核酸分子或载体包括来自细菌(例如大肠杆菌)、昆虫、酵母(例如毕赤酵母)、藻类或哺乳动物来源的载体。细菌载体包括例如,pACYC177、pASK75、pBAD载体系列、pBADM载体系列、pET载体系列、pETM载体系列、pGEX载体系列、pHAT、pHAT2、pMal-c2、pMal-p2、pQE载体系列、pRSET A、pRSET B、pRSET C、pTrcHis2系列、pZA31-Luc、pZE21-MCS-1、pFLAG ATS、pFLAG CTS、pFLAG MAC、pFLAG Shift-12c、pTAC-MAT-1、pFLAG CTC或pTAC-MAT-2。
昆虫载体包括例如,pFastBac1、pFastBac DUAL、pFastBac ET、pFastBac HTa、pFastBac HTb、pFastBac HTc、pFastBac M30a、pFastBact M30b、pFastBac、M30c、pVL1392、pVL1393、pVL1393 M10、pVL1393 M11、pVL1393M12、FLAG载体(如pPolh-FLAG1或pPolh-MAT2)或MAT载体(如pPolh-MAT1或pPolh-MAT2)。
酵母载体包括例如,
藻类载体包括例如,pChlamy-4载体或MCS载体。
哺乳动物载体包括例如,瞬时表达载体或稳定表达载体。示例性哺乳动物瞬时表达载体包括p3xFLAG-CMV 8、pFLAG-Myc-CMV 19、pFLAG-Myc-CMV 23、pFLAG-CMV 2、pFLAG-CMV 6a,b,c、pFLAG-CMV5.1、pFLAG-CMV 5a,b,c、p3xFLAG-CMV 7.1、pFLAG-CMV 20、p3xFLAG-Myc-CMV 24、pCMV-FLAG-MAT1、pCMV-FLAG-MAT2、pBICEP-CMV 3、或pBICEP-CMV 4。示例性哺乳动物稳定表达载体包括pFLAG-CMV 3、p3xFLAG-CMV 9、p3xFLAG-CMV 13、pFLAG-Myc-CMV 21、p3xFLAG-Myc-CMV 25、pFLAG-CMV 4、p3xFLAG-CMV 10、p3xFLAG-CMV 14、pFLAG-Myc-CMV 22、p3xFLAG-Myc-CMV 26、pBICEP-CMV 1或pBICEP-CMV 2。
在一些情况下,将无细胞系统用于产生本文所述的IL-10多肽。在一些情况下,无细胞系统包含来自细胞的细胞质和/或核组分的混合物(例如,由完全纯化的重组组分或部分纯化的组分构成),并且适用于体外核酸合成。在一些情况下,无细胞系统利用原核细胞组分。在其他情况下,无细胞系统利用真核细胞组分。核酸合成是在基于例如果蝇细胞、非洲爪蟾卵、古细菌或HeLa细胞的无细胞系统中获得的。示例性无细胞系统包括大肠杆菌S30提取系统、大肠杆菌T7 S30系统或
无细胞翻译系统不同地包含组分,诸如质粒、mRNA、DNA、tRNA、合成酶、释放因子、核糖体、伴侣蛋白、翻译起始和延伸因子、天然和/或非天然氨基酸和/或用于蛋白质表达的其他组分。任选地修饰此类组分以提高产率、增加合成速率、增加蛋白质产物保真度或掺入非天然氨基酸。在一些实施方案中,本文所述的细胞因子是使用描述于US 8,778,631;US2017/0283469;US 2018/0051065;US 2014/0315245;或US 8,778,631中的无细胞翻译系统合成的。在一些实施方案中,无细胞翻译系统包含经修饰的释放因子,或甚至从所述系统中去除一种或多种释放因子。在一些实施方案中,无细胞翻译系统包含降低的蛋白酶浓度。在一些实施方案中,无细胞翻译系统包含具有重新分配的密码子的经修饰的tRNA,所述密码子用于编码非天然氨基酸。在一些实施方案中,将本文所述的用于掺入非天然氨基酸的合成酶用于无细胞翻译系统。在一些实施方案中,在将tRNA添加到无细胞翻译系统之前,使用酶促或化学方法将其用非天然氨基酸预加载。在一些实施方案中,用于无细胞翻译系统的组分获自经修饰的生物体,诸如经修饰的细菌、酵母或其他生物体。
在一些实施方案中,经由表达宿主系统或通过无细胞系统以循环排列的形式产生IL-10多肽。
包含非天然氨基酸的IL-10多肽的产生
可以在本公开中使用正交或扩增的遗传密码,其中将存在于IL-10多肽的核酸序列中的一个或多个特定密码子分配以编码非天然氨基酸,使得可以通过使用正交tRNA合成酶/tRNA对将其遗传掺入IL-10中。正交tRNA合成酶/tRNA对能够将非天然氨基酸装载在tRNA,并且能够响应于所述密码子将所述非天然氨基酸掺入多肽链中。
在一些情况下,密码子是密码子琥珀、赭色、蛋白石或四联体密码子。在一些情况下,密码子对应于将用于携带非天然氨基酸的正交tRNA。在一些情况下,密码子是琥珀。在其他情况下,密码子是正交密码子。
在一些情况下,密码子是四联体密码子,其可以由正交核糖体ribo-Q1解码。在一些情况下,四联体密码子如Neumann等人,“Encoding m ultiple unnatural amino acidsvia evolution of a quadruplet-decoding riboso me,”Nature,464(7287):441-444(2010)中所述。
在一些情况下,在本公开中使用的密码子是重新编码的密码子,例如,被可替代密码子替代的同义密码子或稀有密码子。在一些情况下,重新编码的密码子如Napolitano等人,“Emergent rules for codon choice elucidated by editing rare argininecodons in Escherichia coli,”PNAS,113(38):E5588-5597(2016)中所述。在一些情况下,重新编码的密码子如Ostrov等人,“Design,synthesis,and testing toward a 57-codongenome,”Science 353(6301):819-822(2016)中所述。
在一些情况下,利用非天然核酸,导致一种或多种非天然氨基酸掺入IL-10中。示例性非天然核酸包括但不限于尿嘧啶-5-基、次黄嘌呤-9-基(I)、2-氨基腺嘌呤-9-基、5-甲基胞嘧啶(5-me-C)、5-羟甲基胞嘧啶、黄嘌呤、次黄嘌呤、2-氨基腺嘌呤、腺嘌呤和鸟嘌呤的6-甲基衍生物和其他烷基衍生物、腺嘌呤和鸟嘌呤的2-丙基衍生物和其他烷基衍生物、2-硫尿嘧啶、2-硫胸腺嘧啶和2-硫胞嘧啶、5-卤代尿嘧啶和胞嘧啶、5-丙炔基尿嘧啶和胞嘧啶、6-偶氮基尿嘧啶、胞嘧啶和胸腺嘧啶、5-尿嘧啶(假尿嘧啶)、4-硫尿嘧啶、8-卤代、8-氨基、8-巯基、8-硫烷基、8-羟基和其他8-取代的腺嘌呤和鸟嘌呤、5-卤代(具体地5-溴)、5-三氟甲基和其他5-取代的尿嘧啶和胞嘧啶、7-甲基鸟嘌呤和7-甲基腺嘌呤、8-氮杂鸟嘌呤和8-氮杂腺嘌呤、7-脱氮鸟嘌呤和7-脱氮腺嘌呤以及3-脱氮鸟嘌呤和3-脱氮腺嘌呤。某些非天然核酸,诸如5-取代的嘧啶、6-氮杂嘧啶和N-2取代的嘌呤、N-6取代的嘌呤、O-6取代的嘌呤、2-氨基丙基腺嘌呤、5-丙炔基尿嘧啶、5-丙炔基胞嘧啶、5-甲基胞嘧啶、增加双链体形成稳定性的那些分子、通用核酸、疏水性核酸、混杂核酸、尺寸扩大的核酸、氟化核酸、5-取代的嘧啶、6-氮杂嘧啶以及N-2、N-6和0-6取代的嘌呤,包括2-氨基丙基腺嘌呤、5-丙炔基尿嘧啶和5-丙炔基胞嘧啶。5-甲基胞嘧啶(5-me-C)、5-羟甲基胞嘧啶、黄嘌呤、次黄嘌呤、2-氨基腺嘌呤、腺嘌呤和鸟嘌呤的6-甲基衍生物和其他烷基衍生物、腺嘌呤和鸟嘌呤的2-丙基衍生物和其他烷基衍生物、2-硫尿嘧啶、2-硫胸腺嘧啶和2-硫胞嘧啶、5-卤代尿嘧啶、5-卤代胞嘧啶、5-丙炔基(-C≡C-CH
包含各种杂环碱基和各种糖部分(和糖类似物)的非天然核酸是本领域可获得的,并且在一些情况下,核酸包括一种或几种除天然存在的核酸的主要五种碱基组分之外的杂环碱基。例如,在一些情况下,杂环碱基包括尿嘧啶-5-基、胞嘧啶-5-基、腺嘌呤-7-基、腺嘌呤-8-基、鸟嘌呤-7-基、鸟嘌呤-8-基、4-氨基吡咯并[2.3-d]嘧啶-5-基、2-氨基-4-氧代吡咯并[2,3-d]嘧啶5-基、2-氨基-4-氧代吡咯并[2.3-d]嘧啶-3-基,其中所述嘌呤经由9-位置、所述嘧啶经由1-位置、所述吡咯并嘧啶经由7-位置并且所述吡唑并嘧啶经由1-位置附接至核酸的糖部分。
在一些实施方案中,核苷酸类似物也在磷酸酯部分处被修饰。经修饰的磷酸酯部分包括但不限于在两个核苷酸之间的连接处被修饰的那些,并且含有例如,硫代磷酸酯、手性硫代磷酸酯、二硫代磷酸酯、磷酸三酯、氨基烷基磷酸三酯、甲基和其他烷基膦酸酯(包括3'-亚烷基膦酸酯和手性膦酸酯)、次膦酸酯、氨基磷酸酯(包括3'-氨基氨基磷酸酯和氨基烷基膦酰胺酯)、硫代磷酰胺酯、硫代烷基膦酸酯、硫代烷基磷酸三酯和硼烷磷酸酯。应理解,两个核苷酸之间的这些磷酸酯或经修饰的磷酸酯连接是通过3'-5'连接或2'-5'连接,并且所述连接含有相反的极性,如3'-5'至5'-3'或2'-5'至5'-2'。还包括各种盐、混合盐和游离酸形式。许多美国专利教导了如何制备和使用含有经修饰的磷酸酯的核苷酸,并且包括但不限于3,687,808;4,469,863;4,476,301;5,023,243;5,177,196;5,188,897;5,264,423;5,276,019;5,278,302;5,286,717;5,321,131;5,399,676;5,405,939;5,453,496;5,455,233;5,466,677;5,476,925;5,519,126;5,536,821;5,541,306;5,550,111;5,563,253;5,571,799;5,587,361;和5,625,050。
在一些实施方案中,非天然核酸包括2’,3’-二脱氧-2’,3’-二脱氢-核苷(PCT/US2002/006460)、5'-取代的DNA和RNA衍生物(PCT/US2011/033961;Saha等人,J.OrgChem.,1995,60,788-789;Wang等人,Bioorgani c&Medicinal Chemistry Letters,1999,9,885-890;和Mikhailov等人,Nuc leosides&Nucleotides,1991,10(1-3),339-343;Leonid等人,1995,14(3-5),901-905;以及Eppacher等人,Helvetica Chimica Acta,2004,87,3004-3020;PCT/JP2000/004720;PCT/JP2003/002342;PCT/JP2004/013216;PCT/JP2005/020435;PCT/JP2006/315479;PCT/JP2006/324484;PCT/JP2009/056718;PCT/JP2010/067560)或制成具有经修饰碱基的单磷酸酯的5'-取代的单体(W ang等人,Nucleosides Nucleotides&Nucleic Acids,2004,23(1&2),317-337)。
在一些实施方案中,非天然核酸包括在糖环的5'-位置和2'-位置处的修饰(PCT/US94/02993),诸如5’-CH
在一些实施方案中,非天然核酸还包括糖部分的修饰。在一些情况下,核酸含有其中糖基团已被修饰的一种或多种核苷。此类糖修饰的核苷可以赋予增强的核酸酶稳定性、增加的结合亲和力或一些其他有益的生物学特性。在某些实施方案中,核酸包含经化学修饰的呋喃核糖环部分。经化学修饰的呋喃核糖环的例子包括但不限于添加取代基(包括5'和/或2'取代基;两个环原子桥接形成双环核酸(BNA);用S、N(R)或C(R
在一些情况下,经修饰的核酸包含经修饰的糖或糖类似物。因此,除核糖和脱氧核糖之外,所述糖部分可以是戊糖、脱氧戊糖、己糖、脱氧己糖、葡萄糖、阿拉伯糖、木糖、来苏糖或糖“类似物”环戊基。所述糖可以呈吡喃糖基或呋喃糖基形式。所述糖部分可以是核糖、脱氧核糖、阿拉伯糖或2'-O-烷基核糖的呋喃糖苷,并且所述糖可以以[α]或[β]异头构型附接至相应的杂环碱基。糖修饰包括但不限于2'-烷氧基-RNA类似物、2'-氨基-RNA类似物、2'-氟-DNA和2'-烷氧基-或氨基-RNA/DNA嵌合体。例如,糖修饰可以包括2'-O-甲基-尿苷或2'-O-甲基-胞苷。糖修饰包括2'-O-烷基-取代的脱氧核糖核苷和2'-O-乙二醇样核糖核苷。这些糖或糖类似物以及其中此类糖或类似物附接至杂环碱基(核酸碱基)的相应“核苷”的制备是已知的。还可以进行糖修饰并且将其与其他修饰组合。
糖部分的修饰包括核糖和脱氧核糖的天然修饰以及非天然修饰。糖修饰包括但不限于在2'位置处的以下修饰:OH;F;O-、S-或N-烷基;O-、S-或N-烯基;O-、S-或N-炔基;或O-烷基-O-烷基,其中烷基、烯基和炔基可以是取代或未取代的C
2'位置处的其他修饰包括但不限于:C
具有经修饰的糖部分的核酸的例子包括但不限于包含5'-乙烯基、5'-甲基(R或S)、4'-S、2'-F、2’-OCH
在某些实施方案中,本文所述的核酸包括一种或多种二环核酸。在某些此类实施方案中,双环核酸包含4'与2'核糖基环原子之间的桥。在某些实施方案中,本文提供的核酸包括一种或多种双环核酸,其中所述桥包含4'至2'双环核酸。此类4'至2'双环核酸的例子包括但不限于下式之一:4’-(CH
在某些实施方案中,核酸包含连接的核酸。核酸可以使用任何核酸间连接而连接在一起。核酸间连接基团的两个主要类别是通过磷原子的存在或不存在来定义的。代表性的含磷的核酸间连接包括但不限于磷酸二酯、磷酸三酯、甲基膦酸酯、氨基磷酸酯和硫代磷酸酯(P=S)。代表性的不含磷的核酸间连接基团包括但不限于亚甲基甲基亚氨基(-CH
对核酸的骨架磷酸酯修饰包括但不限于甲基膦酸酯、硫代磷酸酯、氨基磷酸酯(桥连或非桥连)、磷酸三酯、二硫代磷酸酯、硫代磷酸酯和硼烷磷酸酯,并且可以以任何组合使用。还可以使用其他非磷酸酯连接。
在一些实施方案中,骨架修饰(例如,甲基膦酸酯、硫代磷酸酯、氨基磷酸酯和二硫代磷酸酯核苷酸间连接)可以赋予经修饰的核酸免疫调节活性和/或增强其体内稳定性。
在一些情况下,磷衍生物(或经修饰的磷酸酯基团)附接至糖或糖类似物部分,并且可以是单磷酸酯、二磷酸酯、三磷酸酯、烷基膦酸酯、硫代磷酸酯、二硫代磷酸酯、氨基磷酸酯等。含有经修饰的磷酸酯连接酶或非磷酸酯连接酶的示例性多核苷酸可以在以下文献中找到:Peyrottes等人,1996,Nucleic Acids Res.24:1841-1848;Chaturvedi等人,1996,Nucleic Acids Res.24:2318-2323;和Schultz等人,(1996)Nucleic Acids Res.24:2966-2973;Matteucci,1997,“Oligonucleotide Analogs:an Overview”in Oligonucleotidesas Therapeutic Agents,(Chadwick和Cardew,编辑)John Wiley和Sons,纽约州纽约;Zon,1993,“Oligonucleoside Phosphorothioates”,在Protocols for Oligonucleotides andAnalogs,Synthesis and Properties中,Humana Press,第165-190页;Miller等人,1971,JACS 93:6657-6665;Jager等人,1988,Biochem.27:7247-7246;Nelson等人,1997,JOC 62:7278-7287;美国专利号5,453,496;和Micklefield,2001,Curr.Med.Chem.8:1157-1179。
在一些情况下,骨架修饰包括用可替代部分(诸如阴离子、中性或阳离子基团)替代磷酸二酯连接。此类修饰的例子包括:阴离子核苷间连接;N3’至P5’氨基磷酸酯修饰;硼烷磷酸酯DNA;前寡核苷酸;中性核苷间连接,诸如甲基膦酸酯;酰胺连接的DNA;亚甲基(甲基亚氨基)连接;甲缩醛和硫代甲缩醛连接;含有磺酰基的骨架;吗啉代寡核苷酸;肽核酸(PNA);以及带正电荷的脱氧核糖核酸胍(DNG)寡聚物(Micklefield,2001,CurrentMedicinal Chemistry 8:1157-1179)。经修饰的核酸可以包含嵌合或混合的骨架,所述嵌合的或混合的骨架包含一种或多种修饰(例如,磷酸酯连接的组合,诸如磷酸二酯和硫代磷酸酯连接的组合)。
磷酸酯的取代基包括,例如,短链烷基或环烷基核苷间连接、混合的杂原子和烷基或环烷基核苷间连接,或一个或多个短链杂原子或杂环核苷间连接。这些包括具有以下的那些:吗啉代连接(部分地由核苷的糖部分形成);硅氧烷骨架;硫化物、亚砜和砜骨架;甲酰乙酰基和硫代甲酰乙酰基骨架;亚甲基甲酰乙酰基和硫代甲酰乙酰基骨架;含烯烃的骨架;氨基磺酸酯骨架;亚甲基亚胺基和亚甲基肼基骨架;磺酸酯和磺酰胺骨架;酰胺骨架;以及具有混合N、O、S和CH
在一些情况下,非天然核酸进一步形成非天然碱基对。能够在体内条件下形成非天然DNA或RNA碱基对(UBP)的示例性非天然核苷酸包括但不限于5SICS、d5SICS、NAM、dNaM、及其组合。在一些实施方案中,非天然核苷酸包括:
在一些情况下,非天然核酸进一步形成非天然碱基对。能够在体内条件下形成非天然DNA或RNA碱基对(UBP)的示例性非天然核苷酸包括但不限于TPT3、dTPT3、5SICS、d5SICS、NaM、dNaM、CNMO、dCNMO、及其组合。可用于制备本文所公开的IL-10缀合物的能够形成非天然UBP的非天然核苷酸的其他例子可以在Dien等人,J Am Chem Soc.,2018,140:16115–16123;Feldman等人,J Am Chem Soc,2017,139:11427–11433;Ledbetter等人,J AmChem Soc.,2018,140:758-765;Dhami等人,Nucleic Acids Res.2014,42:10235-10244;Malyshev等人,Nature,2014,509:385-388;Betz等人,J Am Chem Soc.,2013,135:18637-18643;Lavergne等人,J Am Chem Soc.2013,135:5408-5419;和Malyshev等人Proc NatlAcad Sci USA,2012,109:12005-12010中找到。
在一些实施方案中,可用于制备本文所公开的IL-10缀合物的非天然核苷酸可以衍生自下式的化合物:
其中R
波浪线指示与核糖基或2’-脱氧核糖基的键,其中核糖基的5’-羟基或2’-脱氧核糖基部分是游离形式的,或任选地与单磷酸酯、二磷酸酯、或三磷酸酯基团结合。
在一些实施方案中,可用于制备本文所公开的IL-10缀合物的非天然核苷酸可以衍生自
在一些实施方案中,非天然氨基酸通过包括以下所列出的那些的合成密码子/反密码子对而掺入IL-10多肽中:
其中X和Y包含如本文公开的非天然碱基。例如,X可以是衍生自
在一些实施方案中,非天然碱基对产生在Dumas等人,“Designing logical codonreassignment-Expanding the chemistry in biology,”Chemical Science,6:50-69(2015)中所述的非天然氨基酸。
将引入了本文公开的构建体或载体的宿主细胞在合适的培养基中培养或维持,使得产生tRNA、tRNA合成酶和目的蛋白质。培养基还包含一种或多种非天然氨基酸,使得目的蛋白质掺入所述一种或多种非天然氨基酸中。
正交tRNA合成酶/tRNA对将非天然氨基酸装载在tRNA上,并且响应于所述密码子将所述非天然氨基酸掺入多肽链中。示例性aaRS-tRNA对包括但不限于詹氏甲烷球菌(Methanococcus jannaschii)(Mj-Tyr)aaRS/tRNA对、大肠杆菌(E.coli)TyrRS(Ec-Tyr)/嗜热脂肪芽孢杆菌(B.stearothermophilus)tRNA
通过将本文所述的包含tRNA和tRNA合成酶并包含具有一个或多个框内正交(终止)密码子的目的核酸序列的核酸构建体引入宿主细胞中,来制备包含一种或多种非天然氨基酸的IL-10多肽。使宿主细胞暴露于包含所述一种或多种非天然氨基酸的生理溶液,然后将宿主细胞维持在允许表达目的蛋白质编码序列的条件下。响应于所述密码子,将所述一种或多种非天然氨基酸掺入多肽链中。例如,将一种或多种非天然氨基酸掺入IL-10多肽中。可替代地,可以在蛋白质的两个或更多个位点处将两个或更多个非天然氨基酸掺入IL-10多肽中。
当将多个非天然氨基酸掺入IL-10多肽中时,应理解,需要将多个密码子在所希望位置处掺入编码核酸序列中,使得tRNA合成酶/tRNA对可以响应于密码子引导非天然氨基酸的掺入。可以将至少1、2、3、4或更多个编码密码子的核酸掺入目的核酸序列中。
当希望将多于一种类型的非天然氨基酸掺入目的蛋白质成为单个蛋白质时,可以使用第二或另外的正交tRNA-tRNA合成酶对来掺入所述第二或另外的非天然氨基酸;合适地,所述第二或另外的正交tRNA-tRNA合成酶对识别编码所述目的蛋白质的核酸中的不同密码子,使得可以在单个制造步骤中将所述两个或更多个非天然氨基酸特异性地掺入蛋白质中的不同定义位点中。在某些实施方案中,因此可以使用两个或更多个正交tRNA-tRNA合成酶对。
一旦在宿主细胞中产生了掺入非天然氨基酸的IL-10多肽,就可以通过本领域已知的多种技术(包括酶促、化学和/或渗透裂解和物理破坏)从其提取。IL-10多肽可以通过本领域已知的标准技术(诸如制备色谱法、亲和纯化或任何其他合适的技术)纯化。
合适的宿主细胞可以包括细菌细胞(例如,大肠杆菌),但最合适的宿主细胞是真核细胞,例如昆虫细胞(例如果蝇,如黑腹果蝇(Drosophila melanogaster))、酵母细胞、线虫(例如秀丽隐杆线虫(Caenorhabditis elegans))、小鼠(例如小家鼠(Mus musculus))或哺乳动物细胞(如中国仓鼠卵巢细胞(CHO)或COS细胞、人293T细胞、HeLa细胞、NIH 3T3细胞和小鼠红白血病(MEL)细胞)或人细胞或其他真核细胞。其他合适的宿主细胞是本领域技术人员已知的。合适地,宿主细胞是哺乳动物细胞,诸如人细胞或昆虫细胞。
合适的宿主细胞可以包括细菌细胞(例如,大肠杆菌,BL21(DE3)),但最合适的宿主细胞是真核细胞,例如昆虫细胞(例如果蝇,如黑腹果蝇)、酵母细胞、线虫(例如秀丽隐杆线虫(C.elegans))、小鼠(例如小家鼠)或哺乳动物细胞(如中国仓鼠卵巢细胞(CHO)或COS细胞、人293T细胞、HeLa细胞、NIH 3T3细胞和小鼠红白血病(MEL)细胞)或人细胞或其他真核细胞。其他合适的宿主细胞是本领域技术人员已知的。合适地,宿主细胞是哺乳动物细胞,诸如人细胞或昆虫细胞。在一些实施方案中,合适的宿主细胞包括大肠杆菌。
通常可以在本发明的实施方案中使用的其他合适的宿主细胞是在实施例部分中提到的那些。可以经由常规转化或转染技术将载体DNA引入宿主细胞中。如本文所用,术语“转化”和“转染”旨在指用于将外来核酸分子(例如,DNA)引入宿主细胞中的多种公认的技术,包括磷酸钙或氯化钙共沉淀、DEAE-葡聚糖介导的转染、脂质转染或电穿孔。用于转化或转染宿主细胞的合适方法是本领域熟知的。
当创建细胞系时,通常优选制备稳定的细胞系。例如,对于哺乳动物细胞的稳定转染,已知根据所使用的表达载体和转染技术,只有一小部分细胞可以将外来DNA整合到其基因组中。为了鉴定和选择这些组成部分,通常将编码可选择标记物(例如,对抗生素的抗性)的基因与目的基因一起引入宿主细胞中。优选的可选择标记物包括赋予对药物(诸如G418、潮霉素或甲氨蝶呤)的抗性的那些可选择标记物。可以将编码可选择标记物的核酸分子在相同载体上引入宿主细胞中,或者可以引入单独的载体上。可以通过药物选择来鉴定被引入的核酸分子稳定转染的细胞(例如,已掺入可选择标记基因的细胞将存活,而其他细胞死亡)。
在一个实施方案中,将本文所述的构建体整合到宿主细胞的基因组中。稳定整合的优点是实现了各个细胞或克隆之间的均匀性。其他优点是可以进行最佳产生者的选择。因此,希望创建稳定的细胞系。在另一个实施方案中,将本文所述的构建体转染到宿主细胞中。将构建体转染到宿主细胞中的优点是可以使蛋白质产量最大化。在一个方面,描述了包含本文所述的核酸构建体或载体的细胞。
药物组合物和配制品
在一些实施方案中,通过多种施用途径(包括但不限于肠胃外、口服或透皮施用途径)将本文所述的药物组合物和配制品施用受试者。在一些情况下,肠胃外施用包括静脉内、皮下、肌内、脑内、鼻内、动脉内、关节内、皮内、玻璃体内、骨内输注、腹膜内或鞘内施用。在一些情况下,将药物组合物配制成用于局部施用。在其他情况下,将药物组合物配制成用于全身施用。
在一些实施方案中,药物配制品包括但不限于水性液体分散体、自乳化分散体、脂质体分散体、气雾剂、速释配制品、控释配制品、延迟释放配制品、延长释放配制品、脉冲式释放配制品以及混合的速释和控释配制品。
在一些实施方案中,药物配制品包括基于与本文公开的组合物的相容性和所希望剂型的释放特性而选择的一种或多种载体材料。参见例如,Remington:The Science andPractice of Pharmacy,第十九版(Easton,Pa.:Mack Publishing Company,1995),Hoover,John E.,Remington’s Phar maceutical Sciences,Mack Publishing Co.,Easton,Pennsylvania 1975,Libe rman,H.A.和Lachman,L.,编辑,PharmaceuticalDosage Forms,Marcel De cker,纽约,纽约州,1980,以及Pharmaceutical Dosage Formsand Drug Del ivery Systems,第七版(Lippincott Williams&Wilkins1999)。
在一些情况下,将药物组合物配制成免疫脂质体,其包含与脂质体的脂质双层直接或间接结合的多个IL-10缀合物。示例性脂质包括但不限于脂肪酸;磷脂;甾醇类,诸如胆固醇;鞘脂,诸如鞘磷脂;糖鞘脂,诸如神经节苷脂、红细胞糖苷脂和脑苷脂;表面活性剂胺,诸如硬脂酰胺、油酰胺和亚油酰胺。在一些情况下,脂质包括阳离子脂质。在一些情况下,脂质包括磷脂。示例性磷脂包括但不限于磷脂酸(“PA”)、磷脂酰胆碱(“PC”)、磷脂酰甘油(“PG”)、磷脂酰乙醇胺(“PE”)、磷脂酰肌醇(“PI”)和磷脂酰丝氨酸(“PS”)、鞘磷脂(包括脑鞘磷脂)、卵磷脂、溶血卵磷脂、溶血磷脂酰乙醇胺、脑苷脂、二花生酰基磷脂酰胆碱(“DAPC”)、二癸酰基-L-α-磷脂酰胆碱(“DDPC”)、二反油酰基磷脂酰胆碱(“DEPC”)、二月桂酰基磷脂酰胆碱(DLPC)、二亚油酰基磷脂酰胆碱、二肉豆蔻酰基磷脂酰胆碱(“DMPC”)、二油酰基磷脂酰胆碱(“DOPC”)、二棕榈酰基磷脂酰胆碱(“DPPC”)、二硬脂酰基磷脂酰胆碱(“DSPC”)、1-棕榈酰基-2-油酰基-磷脂酰胆碱(“POPC”)、二花生酰基磷脂酰甘油(“DAPG”)、二癸酰基-L-α-磷脂酰甘油(“DDPG”)、二反油酰基磷脂酰甘油(“DEPG”)、二月桂酰基磷脂酰甘油(“DLPG”)、二亚油酰基磷脂酰甘油、二肉豆蔻酰基磷脂酰甘油(“DMPG”)、二油酰基磷脂酰甘油(“DOPG”)、二棕榈酰基磷脂酰甘油(“DPPG”)、二硬脂酰基磷脂酰甘油(“DSPG”)、1-棕榈酰基-2-油酰基-磷脂酰甘油(“POPG”)、二花生酰基磷脂酰乙醇胺(“DAPE”)、二癸酰基-L-α-磷脂酰乙醇胺(“DDPE”)、二反油酰基磷脂酰乙醇胺(“DEPE”)、二月桂酰基磷脂酰乙醇胺(“DLPE”)、二亚油酰基磷脂酰乙醇胺、二肉豆蔻酰基磷脂酰乙醇胺(“DMPE”)、二油酰基磷脂酰乙醇胺(“DOPE”)、二棕榈酰基磷脂酰乙醇胺(“DPPE”)、二硬脂酰基磷脂酰乙醇胺(“DSPE”)、1-棕榈酰基-2-油酰基-磷脂酰乙醇胺(“POPE”)、二花生酰基磷脂酰肌醇(“DAPI”)、二癸酰基-L-α-磷脂酰肌醇(“DDPI”)、二反油酰基磷脂酰肌醇(“DEPI”)、二月桂酰基磷脂酰肌醇(“DLPI”)、二亚油酰基磷脂酰肌醇、二肉豆蔻酰基磷脂酰肌醇(“DMPI”)、二油酰基磷脂酰肌醇(“DOPI”)、二棕榈酰基磷脂酰肌醇(“DPPI”)、二硬脂酰基磷脂酰肌醇(“DSPI”)、1-棕榈酰基-2-油酰基-磷脂酰肌醇(“POPI”)、二花生酰基磷脂酰丝氨酸(“DAPS”)、二癸酰基-L-α-磷脂酰丝氨酸(“DDPS”)、二反油酰基磷脂酰丝氨酸(“DEPS”)、二月桂酰基磷脂酰丝氨酸(“DLPS”)、二亚油酰基磷脂酰丝氨酸(“DMPS”)、二油酰基磷脂酰丝氨酸(“DOPS”)、二棕榈酰基磷脂酰丝氨酸(“DPPS”)、二硬脂酰基磷脂酰丝氨酸(“DSPS”)、1-棕榈酰基-2-油酰基-磷脂酰丝氨酸(“POPS”)、二花生酰基鞘磷脂、二癸酰基鞘磷脂、二反油酰基鞘磷脂、二月桂酰基鞘磷脂、二亚油酰基鞘磷脂、二肉豆蔻酰基鞘磷脂、鞘磷脂、二油酰基鞘磷脂、二棕榈酰基鞘磷脂、二硬脂酰基鞘磷脂以及1-棕榈酰基-2-油酰基-鞘磷脂。
在一些情况下,药物配制品进一步包含pH调节剂或缓冲剂,其包括酸,诸如乙酸、硼酸、柠檬酸、乳酸、磷酸和盐酸;碱,诸如氢氧化钠、磷酸钠、硼酸钠、柠檬酸钠、乙酸钠、乳酸钠和三羟甲基氨基甲烷;以及缓冲液,诸如柠檬酸盐/葡萄糖、碳酸氢钠和氯化铵。以使组合物的pH维持在可接受范围内所需的量包括此类酸、碱和缓冲液。
在一些情况下,药物配制品包含一种或多种盐,其量需要使组合物的渗透度达到可接受的范围。此类盐包括具有钠、钾或铵阳离子和氯离子、柠檬酸根、抗坏血酸根、硼酸根、磷酸根、碳酸氢根、硫酸根、硫代硫酸根或亚硫酸氢根阴离子的那些盐,合适的盐包括氯化钠、氯化钾、硫代硫酸钠、亚硫酸氢钠和硫酸铵。
在一些实施方案中,药物配制品包括但不限于糖(诸如海藻糖、蔗糖、甘露醇、山梨糖醇、麦芽糖、葡萄糖)、或盐(诸如磷酸钾、柠檬酸钠、硫酸铵)和/或其他药剂(诸如肝素),以增加多肽的溶解度和体内稳定性。
在一些情况下,药物配制品进一步包含用于稳定化合物的稀释剂,因为它们可以提供更稳定的环境。溶解在缓冲溶液中的盐(其也可以提供pH控制或维持)在本领域中用作稀释剂,包括但不限于磷酸盐缓冲盐溶液。
稳定剂包括诸如任何抗氧化剂、缓冲剂、酸、防腐剂等化合物。示例性稳定剂包括L-精氨酸盐酸盐、氨基丁三醇、白蛋白(人)、柠檬酸、苯甲醇、苯酚、磷酸二氢二钠脱水、丙二醇、间甲酚或间甲酚(m-cresol)、乙酸锌、聚山梨酯-20或
表面活性剂包括诸如月桂基硫酸钠、多库酯钠、吐温60或80、三醋精、维生素ETPGS、脱水山梨糖醇单油酸酯、聚氧乙烯山梨醇酐单油酸酯、聚山梨酸酯、聚山梨醇酯、胆汁盐、单硬脂酸甘油酯、环氧乙烷和环氧丙烷的共聚物(例如
治疗方案
在一些实施方案中,施用本文所述的药物组合物用于治疗应用。在一些实施方案中,将药物组合物每日施用、每天施用、每隔一天施用、每周施用五天、每周施用一次、每隔一周施用、每月施用两周、每月施用三周、每月施用一次、每月施用两次、每月施用三次或更多次。施用所述药物组合物至少1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、12个月、18个月、2年、3年或更久。
在患者状况确实有所改善的情况下,根据医生的判断,连续施用所述组合物,可替代地,将施用的组合物的剂量暂时减少或暂时中止一定时间(即“药物假期”)。在一些情况下,药物假期的长度在2天至1年之间变化,仅作为示例,所述药物假期的长度包括2天、3天、4天、5天、6天、7天、10天、12天、15天、20天、28天、35天、50天、70天、100天、120天、150天、180天、200天、250天、280天、300天、320天、350天或365天。药物假期期间的剂量减少为10%-100%,仅作为示例,包括10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%。
一旦患者病症得到改善,必要时施用维持剂量。随后,可以根据症状将剂量或施用频率或两者降低至保留改善的疾病、障碍或病症的水平。
在一些实施方案中,对应于这样的量的给定药剂的量取决于多种因素而变化,所述多种因素是例如特定的化合物、疾病的严重程度、需要治疗的受试者或宿主的特性(例如,体重),然而以本领域已知的方式根据围绕病例的特定情况(包括例如所施用的特定药剂、施用途径和所治疗的受试者或宿主)常规地确定。在一些情况下,希望的剂量方便地以单剂量或以分开的剂量同时(或在短时间段内)或以适当的间隔(例如每天两个、三个、四个或更多个亚剂量)提供。
前述范围仅仅是提示性的,因为关于单个治疗方案的变量数目很大,并且与这些推荐值的相当大的偏差并不罕见。此类剂量根据许多变量而改变,不限于所使用化合物的活性、待治疗的疾病或病症、施用方式、个体受试者的需求、所治疗的疾病或病症的严重程度以及医师的判断。
在一些实施方案中,此类治疗方案的毒性和治疗功效通过细胞培养物或实验动物中的标准制药学程序来确定,所述标准制药学程序包括但不限于LD50(对50%的群体致死的剂量)和ED50(对50%的群体具有治疗效果的剂量)的确定。毒性与治疗效果之间的剂量比是治疗指数,并且其表示为LD50与ED50之间的比率。展现出高治疗指数的化合物是优选的。将从细胞培养测定和动物研究获得的数据用于制定用于人的剂量范围。此类化合物的剂量优选地在循环浓度的范围内,所述循环浓度包括具有最小毒性的ED50。所述剂量取决于所采用的剂型和所利用的施用途径而在这个范围内变化。
试剂盒/制品
在某些实施方案中,本文公开了与本文所述的一种或多种方法和组合物一起使用的试剂盒和制品。此类试剂盒包含载体、包装或容器,其被分隔以容纳一个或多个容器,诸如小瓶、管等,每个容器包含待用于本文所述方法的单独元素中的一种。合适的容器包括例如,瓶、小瓶、注射器、和试管。在一个实施方案中,容器由各种材料(诸如玻璃或塑料)形成。
本文提供的制品含有包装材料。药物包装材料的例子包括但不限于泡罩包装、瓶、管、袋、容器、瓶、以及适用于所选配制品以及预期施用方式和治疗的任何包装材料。
例如,一个或多个容器包含本文公开的一种或多种IL-10多肽或缀合物,以及任选地本文所述的一种或多种药物赋形剂,以促进IL-10多肽或缀合物的递送。此类试剂盒进一步任选地包含与其在本文所述的方法中的使用有关的识别描述或标签或说明。
试剂盒典型地包含列出内容物和/或使用说明的标签、以及包含使用说明的包装说明书。典型地还将包括一组说明书。
在一个实施方案中,标签在容器上或与容器相关。在一个实施方案中,当形成标签的字母、数字或其他字符被贴附、模制或蚀刻到容器本身中时,标签在容器上;当标签存在于容纳容器的器皿或载体内时,标签与容器相关,例如作为包装说明书。在一个实施方案中,标签用于指示内容物将用于特定治疗应用。标签还指示使用内容物的指示,诸如在本文所述的方法中。
在某些实施方案中,药物组合物存在于包装或分配器装置中,所述装置含有一种或多种含有本文提供的化合物的单位剂型。包装例如含有金属或塑料箔,诸如泡罩包装。在一个实施方案中,包装或分配器装置附有施用说明。在一个实施方案中,包装或分配器还附有与容器相关的通知,所述通知的形式由规范药物制造、使用或销售的政府机构规定,所述通知反映了所述机构对用于人或兽医施用的药物形式的批准。例如,此类通知是由美国食品和药物管理局批准的药物标签,或批准的产品插页。在一个实施方案中,还制备了在相容的药物载体中配制的含有本文提供的化合物的组合物,将其放置在适当的容器中,并且标记用于治疗指定病症。
某些术语
除非另外定义,否则本文中使用的所有技术术语和科学术语具有与要求保护的主题所属领域的技术人员通常所理解的相同的含义。应理解,详细描述仅是示例性和解释性的,并不是对所要求保护的任何主题的限制。在本申请中,除非另外明确陈述,否则使用单数包括复数。必须指出,如在说明书中所使用,单数形式“一个/一种(a/an)”和“所述(the)”包括复数指示物,除非上下文另外清楚地规定。在本申请中,除非另外陈述,否则“或”的使用意指“和/或”。此外,术语“包括(including)”以及其他形式如“包括(include)”、“包括(includes)”和“包括(included)”的使用是非限制性的。
尽管本发明的各种特征可以在单个实施方案的上下文中描述,但所述特征也可以单独提供或以任何合适的组合提供。相反,尽管为了清楚起见,本文可在单独的实施方案的上下文中描述本发明,但本发明也可在单个实施方案中实施。
在说明书中对“一些实施方案”、“实施方案”、“一个实施方案”或“其他实施方案”的提及意指结合实施方案描述的特定特征、结构或特性包括在本公开文本的至少一些实施方案中,但不必包括在本发明的所有实施方案中。
如本文所用,范围和数量可以表示为“约”特定值或范围。约也包括确切的量。因此,“约5μL”意指“约5μL”并且也意指“5μL”。通常,术语“约”包括将预期在实验误差内的量,例如像在15%、10%、或5%内。
本文使用的章节标题仅用于组织目的,而不应解释为限制所描述的主题。
如本文所用,术语“一个或多个个体”、“一名或多名受试者”和“一名或多名患者”意指任何哺乳动物。在一些实施方案中,所述哺乳动物是人。在一些实施方案中,所述哺乳动物是非人。所述术语均不要求或不限于以卫生保健工作者(例如医生、注册护士、执业护士、医师助理、护理员或临终关怀工作者)进行监督(例如持续或间断)为特征的情况。
如本文所用,关于受体结合的术语“显著”和“显著地”意指足以影响IL-10多肽与靶受体结合的变化。在一些情况下,所述术语是指至少10%、20%、30%、40%、50%、60%、70%、80%、90%、95%或更大的变化。在一些情况下,所述术语意指至少2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、50倍、100倍、500倍、1000倍或更大的变化。
在一些情况下,涉及二聚化的术语“基本上”意指足以防止IL-10二聚体形成的变化。
如本文所用,术语“一种或多种肿瘤浸润性免疫细胞”是指已经浸入包含肿瘤细胞的区域中(例如,在肿瘤微环境中)的免疫细胞。在一些情况下,肿瘤浸润性免疫细胞与肿瘤细胞破坏、肿瘤细胞增殖减少、肿瘤负荷降低或其组合相关。在一些情况下,肿瘤浸润性免疫细胞包括肿瘤浸润淋巴细胞(TIL)。在一些情况下,肿瘤浸润性免疫细胞包括T细胞、B细胞、自然杀伤细胞、巨噬细胞、嗜中性粒细胞、树突细胞、肥大细胞、嗜酸性粒细胞或嗜碱性粒细胞。在一些情况下,肿瘤浸润性免疫细胞包括CD4+或CD8+T细胞。
实施例
这些实施例仅仅出于说明性目的提供,并且不限制本文提供的权利要求的范围。
实施例1
聚乙二醇化的IL-10与人IL-10受体的生物化学相互作用
使用Biosensor Tools LLC的表面等离子体共振(SPR)测量聚乙二醇化的IL-10化合物与人IL-10受体相互作用的动力学和平衡解离常数。对于这些研究,在蛋白质A包被的CM4生物传感器芯片的表面上捕获人IgG1Fc融合的IL-10R细胞外结构域。使用Biacore2000或类似的SPR仪器,以2μM的天然IL-10或IL-10突变蛋白用两=倍稀释系列,一式两份地探测所述表面。注射测试样品持续60s或更长时间以允许测量缔合,直到达到稳定水平,然后用仅缓冲液(洗涤)持续30s或更长时间以测量解离。绘制响应单位(RU,Y轴)与时间(s,X轴)的关系。
原代人白细胞减少系统(LRS)来源的PBMC样品中IL-10突变蛋白的离体免疫响应谱分析
为了确定IL-10突变蛋白的差异受体特异性如何影响原代免疫细胞亚群的激活,使用多色流式细胞术进行人LRS来源的外周血单核细胞(PBMC)样品中淋巴细胞激活的浓度-响应谱分析。这些研究是在PrimityBio LLC(加利福尼亚州费利蒙)进行的。用天然IL-10或IL-10突变蛋白以5倍稀释系列(以30μg/mL的最高浓度开始)处理新鲜的LRS来源的样品。孵育45min后,将样品固定并且用抗体染色以检测转录因子STAT3的磷酸化形式(pSTAT3)(IL-10受体信号传导复合物的上游接合和激活的标记物)和一组表面标记物的磷酸化形式(表1),以跟踪在特定T细胞和自然杀伤(NK)细胞亚群中pSTAT3的形成。
表1:LRS来源的PBMC样品的流式细胞术研究的染色组
实施例2
表2:本文所述的IL-10序列。
虽然本文已显示并描述本公开文本的优选实施方案,但对于本领域技术人员将显而易见,此类实施方案仅以举例方式来提供。在不背离本公开文本的情况下,本领域技术人员现将想到多种修改、改变和取代。应理解,在本公开文本的实践中可以采用本文所述本公开文本的实施方案的多种备选方案。以下权利要求旨在界定本公开文本的范围,并且由此涵盖这些权利要求和其等效内容的范围内的方法和结构。
序列表
<110> 新索思股份有限公司
<120> 白介素10缀合物及其用途
<130> 46085-727.601
<140>
<141>
<150> 62/911,036
<151> 2019-10-04
<150> 62/757,690
<151> 2018-11-08
<160> 5
<170> PatentIn 3.5版
<210> 1
<211> 160
<212> PRT
<213> 智人
<400> 1
Ser Pro Gly Gln Gly Thr Gln Ser Glu Asn Ser Cys Thr His Phe Pro
1 5 10 15
Gly Asn Leu Pro Asn Met Leu Arg Asp Leu Arg Asp Ala Phe Ser Arg
20 25 30
Val Lys Thr Phe Phe Gln Met Lys Asp Gln Leu Asp Asn Leu Leu Leu
35 40 45
Lys Glu Ser Leu Leu Glu Asp Phe Lys Gly Tyr Leu Gly Cys Gln Ala
50 55 60
Leu Ser Glu Met Ile Gln Phe Tyr Leu Glu Glu Val Met Pro Gln Ala
65 70 75 80
Glu Asn Gln Asp Pro Asp Ile Lys Ala His Val Asn Ser Leu Gly Glu
85 90 95
Asn Leu Lys Thr Leu Arg Leu Arg Leu Arg Arg Cys His Arg Phe Leu
100 105 110
Pro Cys Glu Asn Lys Ser Lys Ala Val Glu Gln Val Lys Asn Ala Phe
115 120 125
Asn Lys Leu Gln Glu Lys Gly Ile Tyr Lys Ala Met Ser Glu Phe Asp
130 135 140
Ile Phe Ile Asn Tyr Ile Glu Ala Tyr Met Thr Met Lys Ile Arg Asn
145 150 155 160
<210> 2
<211> 178
<212> PRT
<213> 智人
<400> 2
Met His Ser Ser Ala Leu Leu Cys Cys Leu Val Leu Leu Thr Gly Val
1 5 10 15
Arg Ala Ser Pro Gly Gln Gly Thr Gln Ser Glu Asn Ser Cys Thr His
20 25 30
Phe Pro Gly Asn Leu Pro Asn Met Leu Arg Asp Leu Arg Asp Ala Phe
35 40 45
Ser Arg Val Lys Thr Phe Phe Gln Met Lys Asp Gln Leu Asp Asn Leu
50 55 60
Leu Leu Lys Glu Ser Leu Leu Glu Asp Phe Lys Gly Tyr Leu Gly Cys
65 70 75 80
Gln Ala Leu Ser Glu Met Ile Gln Phe Tyr Leu Glu Glu Val Met Pro
85 90 95
Gln Ala Glu Asn Gln Asp Pro Asp Ile Lys Ala His Val Asn Ser Leu
100 105 110
Gly Glu Asn Leu Lys Thr Leu Arg Leu Arg Leu Arg Arg Cys His Arg
115 120 125
Phe Leu Pro Cys Glu Asn Lys Ser Lys Ala Val Glu Gln Val Lys Asn
130 135 140
Ala Phe Asn Lys Leu Gln Glu Lys Gly Ile Tyr Lys Ala Met Ser Glu
145 150 155 160
Phe Asp Ile Phe Ile Asn Tyr Ile Glu Ala Tyr Met Thr Met Lys Ile
165 170 175
Arg Asn
<210> 3
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 3
Gly Gly Gly Gly Ser
1 5
<210> 4
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<220>
<221> MOD_RES
<222> (4)..(4)
<223> 除脯氨酸外的任何氨基酸
<400> 4
Val Pro Gly Xaa Gly
1 5
<210> 5
<211> 30
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成多肽
<400> 5
Phe Gln Ser Ser Ser Ser Lys Ala Pro Pro Pro Ser Leu Pro Ser Pro
1 5 10 15
Ser Arg Leu Pro Gly Pro Ser Asp Thr Pro Ile Leu Pro Gln
20 25 30
