包含化学修饰siRNA和裂褶菌多糖形成的复合体的医药组合物
文献发布时间:2023-06-19 09:29:07
技术领域
本发明涉及包含化学修饰siRNA和裂褶菌多糖(Schizophyllan)形成的复合体的医药组合物。更具体而言,涉及包含化学修饰siRNA和裂褶菌多糖形成的复合体的医药组合物,所述医药组合物对RNase的抗性较高并且有效地表示出RNAi活性,所述化学修饰siRNA在有义链的5’末端上添加有聚脱氧腺苷酸。
背景技术
1998年发现的RNA干扰(RNAi),其效果的大小、持续性显著地优于以往的反义法(Antisense method),其是划时代性的基因表达抑制方法,因此可期待医药应用。然而,表示出RNAi活性的双链RNA(即siRNA)通常在从施用开始至被靶细胞吸收的过程中或在细胞内被分解,而难以在细胞内形成作为其活性主体的RISC复合体。
通过适宜的算法设计的未修饰的siRNA,为了实现期待的RNAi活性而具有生物体内、细胞内的脆弱性,因此极易被例如血中等中存在的RNase分解,极少在靶细胞中发挥RNAi效果。因此,以往提出了对siRNA实施各种化学修饰以使其具有RNase抗性(非专利文献1~3)。然而,就作为核酸药物开发的siRNA而言,他们大多数对所有碱基实施了化学修饰,而导致无法在序列设计最初的未修饰的siRNA的情况下实现期待的RNAi活性。即,目前尚未发现通过少量的化学修饰而具有优异的RNase抗性并且如本来期待的那样诱导RNAi活性的化学修饰siRNA(非专利文献4)。
另一方面,作为siRNA的传递技术(Delivery technology),提出了裂褶菌多糖(SPG)和添加有聚脱氧腺苷酸的siRNA形成的siRNA/SPG复合体(参照专利文献1)。该siRNA/SPG复合体可选择性地将siRNA递送至树状细胞等De ctin-1表达细胞,并且当递送至细胞内时,可有效地发挥RNAi效果,因此期待作为核酸药物投入实际使用。就该siRNA/SPG复合体而言,由于siRNA处于被SPG包埋的状态,因此可期待一定程度的RNase抗性,但是在存在许多RNase的血中,会不可避免地被RNase分解,在开发该siRNA/SPG复合体作为核酸药物的情况下,希望开发在保持RNAi活性的同时提高对RNase的抗性的技术。
现有技术文献
非专利文献
非专利文献1:Development of Therapeutic-Grade Small Interfering RNAsby Chemical Engineering,Jesper B.Bramsen and Jorgen Kjems,Front Genet.2012;3:154.
非专利文献2:Oligonucleotide Therapies:The Past and the Present,KarinE.Lundin,Olof Gissberg,and C.I.Edvard Smith,Hum Gene Ther.2015Aug 1;26(8):475-485.
非专利文献3:siRNAmod:A database of experimentally validatedchemically modified siRNAs,Showkat Ahmad Dar,Anamika Thakur,Abid Qureshi&Manoj Kumar,Sci Rep.2016;6:20031.
非专利文献4:Preclinical and clinical development of siRNA-based therapeutics,Gulnihal Ozcan,Bulent Ozpolat,Robert L.Coleman,Anil K.Sood,andGabriel Lopez-Berestein,Adv Drug Deliv Rev.2015June 29;87:108-119.
专利文献
专利文献1:WO2009/078470公报
发明内容
发明所解决的技术问题
本发明的目的是,提供对RNase的抗性较高并且有效地表示出RNAi活性的医药组合物,所述医药组合物包含化学修饰siRNA和裂褶菌多糖形成的复合体,所述化学修饰siRNA是在有义链的5’末端上添加有聚脱氧腺苷酸(除非特别说明,否则下文中也包括硫代磷酸化(Phosphorothioated)聚脱氧腺苷酸)的化学修饰siRNA。
解决问题的技术手段
在对在有义链的5’末端上添加有聚脱氧腺苷酸的siRNA进行化学修饰以提高对RNase的抗性的情况下,对于本领域技术人员而言,通常认为在下述两个位点进行化学修饰来强化对RNase的抗性是不可或缺的,但本发明人等确认了即使在这两个位点实施化学修饰也无法充分提高对RNase的抗性,所述两个位点为:(1)反义链的5’末端侧,其与有义链的接合力特别弱;(2)siRNA与聚脱氧腺苷酸的连接处附近。并且,对公知文献中报告的siRNA的化学修饰法进行了研究。
这样的情况下,本发明人等通过深入研究而发现,与通常的未添加聚脱氧腺苷酸的siRNA相比,对于在有义链的5’末端上添加有聚脱氧腺苷酸的siRNA通过对特定的碱基实施特定的化学修饰的情况下,即使是较少的化学修饰,也可显著地提高在有义链的5’末端上添加有聚脱氧腺苷酸的siRNA与裂褶菌多糖复合时对RNase的抗性,有效地表现出RNAi活性。基于这样的发现,通过进一步研究而完成了本发明。
即,本发明提供下述方案的发明。下述项1的条件(i)~(ix)表示的本发明的修饰法在本说明书中也称为A-3修饰。
项1.一种医药组合物,其包含裂褶菌多糖/化学修饰siRNA复合体,所述复合体由化学修饰siRNA与裂褶菌多糖复合而得到,
所述化学修饰siRNA在有义链的5’末端上添加有聚脱氧腺苷酸,
所述化学修饰siRNA的有义链的碱基序列包含选自CA、UA和UG中的至少1种二核苷酸序列,
从所述化学修饰siRNA的反义链的5’末端侧起算的第8个碱基以后的碱基序列包含选自CA、UA和UG中的至少1种二核苷酸序列,并且
所述化学修饰siRNA满足下述条件(i)~(ix):
(i)在有义链的碱基序列中含有包含CA的二核苷酸序列的情况下,该二核苷酸序列中的胞苷酸残基的2’位羟基被氟基所取代,该二核苷酸序列中的腺苷酸残基的2’位羟基被甲氧基所取代;
(ii)在有义链的碱基序列中含有包含UA的二核苷酸序列的情况下,该二核苷酸序列中的尿苷酸残基的2’位羟基被氟基所取代,该二核苷酸序列中的腺苷酸残基的2’位羟基被甲氧基所取代;
(iii)在有义链的碱基序列中含有包含UG的二核苷酸序列的情况下,该二核苷酸序列中的尿苷酸残基的2’位羟基被氟基所取代,该二核苷酸序列中的鸟苷酸残基的2’位羟基被甲氧基所取代;
(iv)在从反义链的5’末端侧起算的第8个碱基以后的碱基序列中含有包含CA的二核苷酸序列的情况下,该二核苷酸序列中的胞苷酸残基的2’位羟基被氟基所取代,该二核苷酸序列中的腺苷酸残基的2’位羟基被甲氧基所取代;
(v)在从反义链的5’末端侧起算的第8个碱基以后的碱基序列中含有包含UA的二核苷酸序列的情况下,该二核苷酸序列中的尿苷酸残基的2’位羟基被氟基所取代,该二核苷酸序列中的腺苷酸残基的2’位羟基被甲氧基所取代;
(vi)在从反义链的5’末端侧起算的第8个碱基以后的碱基序列中含有包含UG的二核苷酸序列的情况下,该二核苷酸序列中的尿苷酸残基的2’位羟基被氟基所取代,该二核苷酸序列中的鸟苷酸残基的2’位羟基被甲氧基所取代;
(vii)从反义链的5’末端侧起算的第1~7个核糖核苷酸残基未被实施化学修饰;
(viii)当根据所述(i)~(vi)实施化学修饰时,在从有义链的5’末端侧起算的第1个核糖核苷酸残基和从反义链5’末端侧起算的第19个核糖核苷酸残基都未被化学修饰的情况下,如果从有义链的5’末端侧起算的第1个核糖核苷酸残基为胞苷酸残基或尿苷酸残基,则2’位羟基被氟基所取代,如果该核糖核苷酸残基为腺苷酸残基或鸟苷酸残基,则2’位羟基被甲氧基所取代;
(ix)当根据所述(i)~(vi)实施化学修饰时,在从有义链的5’末端侧起算的第1个核糖核苷酸残基和从反义链5’末端侧起算的第19个核糖核苷酸残基都被化学修饰的情况下,从反义链5’末端侧起算的第19个核糖核苷酸残基不实施化学修饰。
项2.根据项1所述的医药组合物,其中,
所述化学修饰siRNA的有义链的5’末端上添加的聚脱氧腺苷酸的长度为10~100碱基。
项3.根据项1或2所述的医药组合物,其中,
siRNA是针对CD40的siRNA。
项4.根据项1~3中任一项所述的医药组合物,其中,
所述化学修饰siRNA包含以下有义链和反义链,
有义链:5’-C(F)A(M)GGAGACCU(F)G(M)GC(F)A(M)CU(F)G(M)GAdtdt-3’
反义链:5’-UCCAGUGCC(F)A(M)GGUCUCCU(F)Gdtdt-3’
在所述有义链和反义链中,“dt”是指脱氧胸苷酸残基、“U(F)”是指2’位羟基被氟基所修饰的尿苷酸残基、“G(M)”是指2’位羟基被甲氧基所取代的鸟苷酸残基、“C(F)”是指2’位羟基被氟基所修饰的胞苷酸残基,并且“A(M)”是指2’位羟基被甲氧基所取代的腺苷酸残基。
项5.根据项4所述的医药组合物,其中,
有义链的5’末端上添加的聚脱氧腺苷酸的长度为40碱基。
项6.根据项1~3中任一项所述的医药组合物,其中,
所述化学修饰siRNA包含以下有义链和反义链,
有义链:5’-G(M)A(M)C(F)A(M)GAAACU(F)G(M)GU(F)G(M)AGU(F)G(M)Adtdt-3’
反义链:5’-UCACUCACC(F)A(M)GUUUCU(F)G(M)UCdtdt-3’
在所述有义链和反义链中,“dt”是指脱氧胸苷酸残基、“U(F)”是指2’位羟基被氟基所修饰的尿苷酸残基、“G(M)”是指2’位羟基被甲氧基所取代的鸟苷酸残基、“C(F)”是指2’位羟基被氟基所修饰的胞苷酸残基,并且“A(M)”是指2’位羟基被甲氧基所取代的腺苷酸残基。
项7.根据项6所述的医药组合物,其中,
有义链的5’末端上添加的聚脱氧腺苷酸的长度为40碱基。
项8.根据项1~3中任一项所述的医药组合物,其中,
所述化学修饰siRNA包含以下有义链和反义链,
有义链:5’-A(M)GU(F)G(M)U(F)G(M)GCC(F)A(M)CGU(F)G(M)GGC(F)A(M)Adtdt-3’
反义链:5’-UUGCCCACGU(F)G(M)GCC(F)A(M)C(F)A(M)CUdtdt-3’
在所述有义链和反义链中,“dt”是指脱氧胸苷酸残基、“U(F)”是指2’位羟基被氟基所修饰的尿苷酸残基、“G(M)”是指2’位羟基被甲氧基所取代的鸟苷酸残基、“C(F)”是指2’位羟基被氟基所修饰的胞苷酸残基,并且“A(M)”是指2’位羟基被甲氧基所取代的腺苷酸残基。
项9.根据项8所述的医药组合物,其中,
有义链的5’末端上添加的聚脱氧腺苷酸的长度为40碱基。
项10.根据项1~3中任一项所述的医药组合物,其中,
所述化学修饰siRNA包含以下有义链和反义链,
有义链:5’-C(F)AGA(M)AAC(F)A(M)GUUC(F)A(M)CCUU(F)G(M)Adtdt-3’
反义链:5’-UCAAGGU(F)G(M)AACU(F)G(M)UUUCU(F)Gdtdt-3’
在所述有义链和反义链中,“dt”是指脱氧胸苷酸残基、“U(F)”是指2’位羟基被氟基所修饰的尿苷酸残基、“G(M)”是指2’位羟基被甲氧基所取代的鸟苷酸残基、“C(F)”是指2’位羟基被氟基所修饰的胞苷酸残基,并且“A(M)”是指2’位羟基被甲氧基所取代的腺苷酸残基。
项11.根据项10所述的医药组合物,其中,
有义链的5’末端上添加的聚脱氧腺苷酸的长度为40碱基。
项12.根据项1~11中任一项所述的医药组合物,其是进一步包含氯化钠、磷酸二氢钾和磷酸氢二钠的液态制剂。
项13.根据项3~12中任一项所述的医药组合物,其用于治疗或预防对于移植内脏器官、移植组织或移植细胞的抵抗或排斥。
项14.根据项3~12中任一项所述的医药组合物,其用于治疗或预防移植物抗宿主病。
项15.一种治疗或预防对于移植内脏器官、移植组织或移植细胞的抵抗或排斥的方法,其中,
在接受内脏器官、组织或细胞的移植治疗的患者中,在该移植治疗的之前和/或之后,施用项3~12中任一项所述的医药组合物。
项16.一种治疗或预防移植物抗宿主病的方法,其中,
在接受同种异体造血干细胞移植治疗的患者中,在该移植治疗的之前和/或之后,施用项3~12中任一项所述的医药组合物。
项17.一种将项3~12中任一项所述的医药组合物用于制造药剂的用途,所述药剂用于治疗或预防对于移植内脏器官、移植组织或移植细胞的抵抗或排斥。
项18.一种将项3~12中任一项所述的医药组合物用于制造药剂的用途,所述药剂用于治疗或预防移植物抗宿主病。
发明效果
本发明的医药组合物可通过包含特定的化学修饰siRNA和裂褶菌多糖形成的复合体,而对RNase的抗性较高并且有效地表示出RNAi活性,所述化学修饰siRNA是在有义链的5’末端上添加有聚脱氧腺苷酸的化学修饰siRN A。
特别是,在包含裂褶菌多糖与针对CD40实施给定的化学修饰的siRNA形成的复合体的医药组合物的情况下,对RNase的抗性和制剂稳定性较高,可用于治疗或预防对于移植内脏器官、移植组织或移植细胞的抵抗或排斥、移植物抗宿主病等。
附图说明
[图1]是表示在参考试验例1中,各种化学修饰siRNA和使用了化学修饰siRNA的SPG/化学修饰siRNA复合体的基因表达抑制效果的评价结果的图。
[图2]是表示在参考试验例2中,各种化学修饰siRNA和使用了化学修饰siRNA的SPG/化学修饰siRNA复合体在血清中的稳定性的评价结果的图。
[图3]是表示在参考试验例3中,使用了各种化学修饰siRNA的SPG/化学修饰siRNA复合体的基因表达抑制效果的评价结果的图。
[图4]是表示在参考试验例4中,使用了各种化学修饰siRNA的SPG/化学修饰siRNA复合体在血清中的稳定性的评价结果的图。
[图5]是表示在试验例1中,各种化学修饰siRNA和使用了化学修饰siRNA的SPG/化学修饰siRNA复合体的基因表达抑制效果的评价结果的图。
[图6]是表示在试验例2中,使用了各种修饰siRNA的SPG/化学修饰siRNA复合体在血清中的稳定性的评价结果的图。
[图7]是表示在试验例3中,使用了各种修饰siRNA的SPG/化学修饰siRNA复合体的通过离体MLR(淋巴细胞混合培养)测定而评价的细胞增殖抑制效果的结果的图。
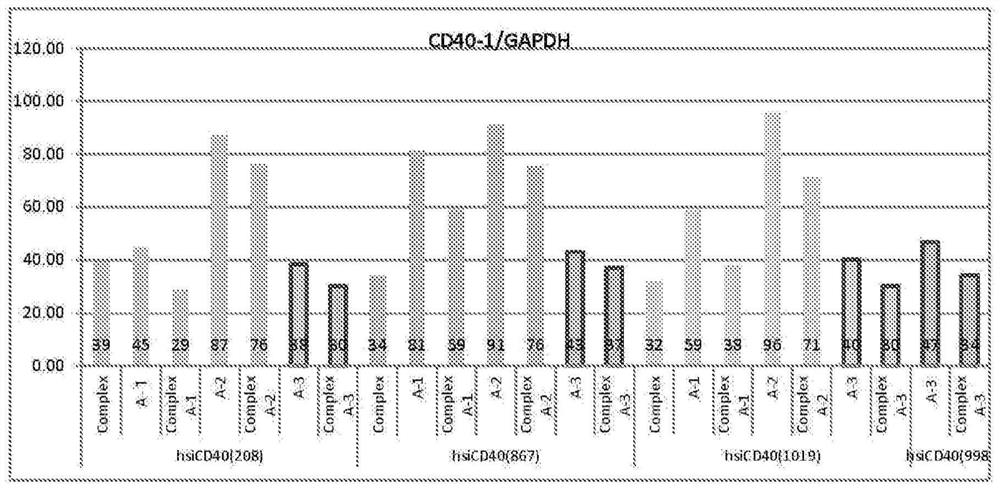
[图8]是表示在试验例4中,各种化学修饰siRNA和使用了化学修饰siRNA的SPG/化学修饰siRNA复合体的基因表达抑制效果的评价结果的图。
[图9]是表示在试验例7中,在使用了aGVHD模型小鼠的骨髓细胞移植中,使用针对CD40的化学修饰siRNA而制备的SPG/化学修饰siRNA复合体的施用带来的延长寿命效果的评价结果的图。
具体实施方式
在本发明中,在表示包含2个以上碱基的碱基序列的情况下,碱基序列的左端是5’末端,右端是3’末端。
本发明的医药组合物的特征在于,包含裂褶菌多糖/化学修饰siRNA复合体,所述复合体通过特定的化学修饰siRNA与裂褶菌多糖复合而得到。以下,对本发明的医药组合物进行说明。
在本发明中,作为化学修饰siRNA,使用以下化学修饰siRNA:在有义链的5’末端上添加有聚脱氧腺苷酸,有义链和反义链包含特定的二核苷酸序列,并且对该二核苷酸序列实施了特定的化学修饰的化学修饰siRNA。
在化学修饰siRNA中,对于有义链和反义链的碱基序列,根据靶基因中的靶序列来进行设定。靶基因中的靶序列可根据IDT公司(Integrated DNA T echnologies,INC)的手册(Dicer Substrate RNAi Design)等通过公知的手法来设定。siRNA通常设计为包含:与该靶序列100%一致的序列,或者,从该靶序列取代·添加了1个或多个碱基的序列,只要得到期望的RNA干扰效果即可。此外报告了,通过设计为反义链的5’末端是A/U对,有义链的5’末端是G/C对,反义链的5’末端侧约有5个A/U对,并且双链中没有9个以上G/C对的双链RNA,能够设计具有优异的RNA干扰效果的siRNA(Ui-Tei et.al,Nucleic Acids Res.,32,936-948(2004))。例如,作为针对CD40的siRNA,可举出:含有包含SEQ ID NO.1表示的碱基序列的有义链和包含SEQ ID N O.2表示的碱基序列的反义链的siRNA、含有包含SEQ ID NO.3表示的碱基序列的有义链和包含SEQ ID NO.4表示的碱基序列的反义链的siRNA、含有包含SEQ ID NO.5表示的碱基序列的有义链和包含SEQ ID NO.6表示的碱基序列的反义链的siRNA、含有包含SEQ ID NO.7表示的碱基序列的有义链和包含SEQ ID NO.8表示的碱基序列的反义链的siRNA、含有包含SEQ ID NO.9表示的碱基序列的有义链和包含SEQ ID NO.10表示的碱基序列的反义链的siRNA等。
在化学修饰siRNA中,有义链的碱基序列包含选自CA、UA和UG中的至少1种二核苷酸序列,并且从反义链的5’末端侧起算的第8个碱基以后的碱基序列包含选自CA、UA和UG中的至少1种二核苷酸序列。可通过对这样的二核苷酸序列实施后述的特定化学修饰,来在与SPG复合时保持RNAi活性的同时提高对RNase的抗性。
对于化学修饰siRNA的靶基因,没有特别限制,根据该化学修饰siRNA的用途来适宜选择即可,但是从用于药物用途这样的观点出发,与病况有关并且希望其表达被抑制的基因是适宜。
作为化学修饰siRNA的靶基因的适宜的一个方式,可举出:在Dectin-1表达细胞中被表达并且影响该细胞承担的生物体内功能的基因。Dectin-1是细胞膜上存在的具有C型凝聚素类型的糖链识别域的受体(Pattern Recognition Receptor)。Dectin-1具有在细胞外特异性地识别SPG的区域,并且具有在细胞内传达被称为免疫受体酪氨酸激活基序(ITAM,immunoreceptor tyrosinase-based activation motif-1)的活化信号的基序。当Dectin-1识别SPG时,会促进NF-κB、炎性细胞因子的产生,引起生物防御反应。作为Dectin-1表达细胞,具体而言,可举出巨噬细胞、树状细胞、嗜中性粒细胞等。已知SPG具有β-1,3-葡聚糖骨架,通过与Dectin-1表达细胞的细胞膜上存在的Dctin-1结合,来通过胞吞作用递送至Dectin-1表达细胞内。当化学修饰siRNA与SPG复合时,可通过SPG被Dectin-1识别,来将化学修饰siRNA选择性地递送至Dectin-1表达细胞内。此外,作为化学修饰siRNA的靶基因,可通过选择影响Dectin-1表达细胞承担的生物体内功能的基因,来诱导生物体内的免疫抑制并调节免疫。
将在Dectin-1表达细胞中被表达并且影响该细胞承担的生物体内功能的基因设为化学修饰siRNA的靶基因的情况下,该基因的种类没有特别限定,但是从生物体内的免疫调节,尤其是更有效地诱导免疫抑制的观点出发,作为适宜的靶基因,可举出与抗原呈递相关的基因等,包括编码CD40等共刺激因子(也称为共刺激分子)的基因。
在化学修饰siRNA中,对于有义链和反义链的碱基长度,没有特别限定,可优选举出为21碱基。
此外,在化学修饰siRNA中,可以使有义链和反义链杂交而形成双链,并使其具有两个3’末端的包含约2~5个核糖核苷酸或脱氧核糖核苷酸的Dang ling-end。
作为化学修饰siRNA适宜的方式的一个实例,可举出:有义链和反义链的长度同时为21碱基,并且在有义链的5’末端和反义链的3’末端形成包含两个核糖核苷酸或脱氧核糖核苷酸的Dangling-end。即,在这样的siRNA的情况下,从反义链的3’末端侧起算的第3~21个核糖核苷酸序列与从有义链的5’末端侧起算的第1~19个核糖核苷酸序列成为互补的。
在化学修饰siRNA中,在有义链的5’末端上添加有聚脱氧腺苷酸。
该聚脱氧腺苷酸与两个SPG形成三重螺旋结构,发挥使化学修饰siRNA与SPG复合的作用。
作为构成聚脱氧腺苷酸的脱氧腺苷酸残基的数目,只要可与SPG形成复合体,就没有特别限制,例如可举出为10~100个,优选为20~100个,更优选为20~80个,进一步优选为30~50个,特别优选为40个。
在化学修饰siRNA中,优选聚脱氧腺苷酸通过磷酸二酯键与有义链的5’末端直接结合,也可以经由接头(间隔物)与有义链的5’末端结合。
此外,化学修饰siRNA中,有义链、反义链和聚脱氧腺苷酸的磷酸二酯键可以部分或全部被硫代磷酸化(S化)。对于化学修饰siRNA的聚脱氧腺苷酸部分,优选被S化。S化的磷酸二酯键是磷酸二酯键部分的磷酸残基的一个氧原子被硫原子取代而成的键合结构。
本发明中使用的化学修饰siRNA根据后述的条件(i)~(ix)对有义链和反义链实施了化学修饰(A-3修饰)。需要说明的是,在化学修饰siRNA中,有义链和反义链需要不进行后述的条件(i)~(ix)以外的化学修饰。
<有义链的化学修饰>
对化学修饰siRNA的有义链实施化学修饰以使其满足以下条件(i)~(iii):
(i)在有义链的碱基序列中含有包含CA的二核苷酸序列的情况下,该二核苷酸序列中的胞苷酸残基的2’位羟基被氟基所取代,该二核苷酸序列中的腺苷酸残基的2’位羟基被甲氧基所取代;
(ii)在有义链的碱基序列中含有包含UA的二核苷酸序列的情况下,该二核苷酸序列中的尿苷酸残基的2’位羟基被氟基所取代,该二核苷酸序列中的腺苷酸残基的2’位羟基被甲氧基所取代;
(iii)在有义链的碱基序列中含有包含UG的二核苷酸序列的情况下,该二核苷酸序列中的尿苷酸残基的2’位羟基被氟基所取代,该二核苷酸序列中的鸟苷酸残基的2’位羟基被甲氧基所取代。
即,例如,在siRNA的有义链为表1的(A)表示的长度为21碱基的碱基序列的情况下,作为根据条件(i)~(iii)实施了化学修饰的有义链,可举出表1的(B)表示的方式。
[表1]
表中,“dt”是指脱氧胸苷酸残基、“U(F)”是指2’位的羚基被氟基所修饰的尿苷酸残基、“G(M)”是指2’位的羟基被甲氧基所取代的鸟苷酸残基、“C(F)”是指2’位的羟基被氟基所修饰的胞苷酸残基、“A(M)”是2’位的羟基被甲氧基所取代的腺苷酸残基。
<反义链的化学修饰>
对化学修饰siRNA的反义链实施化学修饰以使其满足以下条件(iv)~(vii):
(iv)在从反义链的5’末端侧起算的第8个碱基以后的碱基序列中含有包含CA的二核苷酸序列的情况下,该二核苷酸序列中的胞苷酸残基的2’位羟基被氟基所取代,该二核苷酸序列中的腺苷酸残基的2’位羟基被甲氧基所取代;
(v)在从反义链的5’末端侧起算的第8个碱基以后的碱基序列中含有包含UA的二核苷酸序列的情况下,该二核苷酸序列中的尿苷酸残基的2’位羟基被氟基所取代,该二核苷酸序列中的腺苷酸残基的2’位羟基被甲氧基所取代;
(vi)在从反义链的5’末端侧起算的第8个碱基以后的碱基序列中含有包含UG的二核苷酸序列的情况下,该二核苷酸序列中的尿苷酸残基的2’位羟基被氟基所取代,该二核苷酸序列中的鸟苷酸残基的2’位羟基被甲氧基所取代;
(vii)从反义链的5’末端侧起算的第1~7个核糖核苷酸残基未被实施化学修饰。
即,例如,在siRNA的反义链为表2的(A)表示的长度为21碱基的碱基序列的情况下,作为根据条件(iv)~(vii)实施了化学修饰的反义链,可举出表2的(B)表示的方式。
[表2]
表中,“dt”、“U(F)”、“G(M)”和”A(M)”如所述表1所示。
<聚脱氧腺苷酸附近的化学修饰>
在化学修饰siRNA中,从有义链的5’末端侧起算的第1个核糖核苷酸残基和从反义链5’末端侧起算的第19个核糖核苷酸残基位于最接近聚脱氧腺苷酸的位点。在化学修饰siRNA中,存在所述条件(i)~(vii)无法原样应用于这些核糖核苷酸残基的情况。
具体而言,在化学修饰siRNA中,根据所述条件(i)~(vii)对有义链和反义链实施化学修饰,但在根据这样的条件实施化学修饰时,在从有义链的5’末端侧起算的第1个核糖核苷酸残基和从反义链5’末端侧起算的第19个核糖核苷酸残基都未被化学修饰或都被化学修饰的情况下,需要根据下述条件(viii)和(ix)进行化学修饰。
(viii)当根据所述(i)~(vi)实施化学修饰时,在从有义链的5’末端侧起算的第1个核糖核苷酸残基和从反义链5’末端侧起算的第19个核糖核苷酸残基都未被化学修饰的情况下,如果从有义链的5’末端侧起算的第1个核糖核苷酸残基为胞苷酸残基或尿苷酸残基,则2’位被氟基修饰,如果该核糖核苷酸残基为腺苷酸残基或鸟苷酸残基,则2’位被甲氧基修饰。
(ix)当根据所述(i)~(vi)实施化学修饰时,从有义链的5’末端侧起算的第1个核糖核苷酸残基和从反义链5’末端侧起算的第19个核糖核苷酸残基都被化学修饰的情况下,从反义链5’末端侧起算的第19个核糖核苷酸残基不实施化学修饰。
<化学修饰的方法>
用氟基取代(修饰)胞苷酸残基和尿苷酸残基的核糖部分的2’位羟基的方法、用甲氧基取代(修饰)腺苷酸残基和鸟苷酸残基的核糖部分的2’位羟基的方法是公知的,本发明中使用的化学修饰siRNA可通过公知的方法制造。
<化学修饰siRNA的适宜的实例>
在本发明中使用的化学修饰siRNA中,作为对针对人CD40的siRNA实施了化学修饰的化学修饰siRNA的适宜的具体实例,可举出以下(1)~(4)表示的实例。这些化学修饰siRNA特别适宜用于治疗或预防对于移植内脏器官、移植组织或移植细胞的抵抗或排斥、移植物抗宿主病等。
(1)具有以下有义链和反义链的化学修饰siRNA,有义链:5’-C(F)A(M)GGAGACCU(F)G(M)GC(F)A(M)CU(F)G(M)GAdtdt-3’和反义链:5’-UCCAGUGCC(F)A(M)GGUCUCCU(F)Gdtdt-3’
(2)有义链:5’-G(M)A(M)C(F)A(M)GAAACU(F)G(M)GU(F)G(M)AGU(F)G(M)Adtdt-3’和反义链:5’-UCACUCACC(F)A(M)GUUUCU(F)G(M)UCdtdt-3’
(3)有义链:5’-A(M)GU(F)G(M)U(F)G(M)GCC(F)A(M)CGU(F)G(M)GGC(F)A(M)Adtdt-3’和反义链:5’-UUGCCCACGU(F)G(M)GCC(F)A(M)C(F)A(M)CUdtdt-3’
(4)有义链:5’-C(F)AGA(M)AAC(F)A(M)GUUC(F)A(M)CCUU(F)G(M)Adtdt-3’和反义链:5’-UCAAGGU(F)G(M)AACU(F)G(M)UUUCU(F)Gdtdt-3’
在所述(1)~(4)的有义链和反义链中,“dt”是指脱氧胸苷酸残基、“U(F)”是指2’位羟基被氟基所修饰的尿苷酸残基、“G(M)”是指2’位羟基被甲氧基所取代的鸟苷酸残基、“C(F)”是指2’位羟基被氟基所修饰的胞苷酸残基,并且“A(M)”是指2’位羟基被甲氧基所取代的腺苷酸残基。
在本发明中,使化学修饰siRNA与SPG复合,在裂褶菌多糖/化学修饰siRNA复合体(SPG/化学修饰siRNA复合体)的状态下使用。SPG是具有β-1,3-葡聚糖骨架的多糖,SPG/化学修饰siRNA复合体通过SPG与所述细胞表面存在的受体Dctin-1结合,来通过胞吞作用递送至细胞内。
作为SPG/化学修饰siRNA复合体的构成成分的裂褶菌多糖(有时简称为SPG)可根据文献(A.C.S.38(1),253(1997);Carbohydrate Research,89,121-135(1981))记载的常规方法制造。由此得到的裂褶菌多糖可通过超声波处理而得到期望的分子量的裂褶菌多糖。
对于SPG/化学修饰siRNA复合体中使用的裂褶菌多糖的分子量,没有特别限制,根据化学修饰siRNA上添加的聚脱氧腺苷酸的链长等适宜设定即可。具体而言,作为裂褶菌多糖的分子量,通常可举出为25000~500000,优选为25000~250000。
SPG/化学修饰siRNA复合体可根据使SPG与聚脱氧腺苷酸复合的公知的方法来制备。具体而言,可举出通过以下(1)~(3)的工序制造的方法:(1)根据公知的方法制备包含聚脱氧腺苷酸的化学修饰siRNA;(2)此外,另行准备SPG;(3)接着,使用与化学修饰siRNA结合的聚脱氧腺苷酸和SPG形成复合体。
在所述方法(3)工序中,化学修饰siRNA与SPG的混合比可根据聚脱氧腺苷酸的链长、SPG的分子量来适宜选择。就SPG/化学修饰siRNA复合体而言,SPG的主链的1分子葡萄糖对应于聚脱氧腺苷酸的1个脱氧腺苷酸残基,1条聚脱氧腺苷酸与两条SPG形成三重螺旋结构。即,在SPG/化学修饰siRNA复合体中,将聚脱氧腺苷酸组入由两条SPG形成的二重螺旋结构的1个位点或两个位点以上以形成三重螺旋结构。例如,如果是包含长度为40碱基的聚脱氧腺苷酸的化学修饰siRNA和分子量150000的SPG,则可形成包含2分子的分子量150000的SPG和17分子的包含碱基长度的聚脱氧腺苷酸的化学修饰siRNA的三重螺旋结构。包含聚脱氧腺苷酸的化学修饰siRNA与SPG的优选的摩尔比为20:1~1:5,优选以10:1~1:1的比例混合,优选使SPG和与化学修饰siRNA结合的单链聚脱氧腺苷酸区域进行复合。可通过以这样的摩尔比使包含聚脱氧腺苷酸的化学修饰siRNA和SPG暴露于复合体形成条件下,来使两者高效地相互作用,并且能够使SPG/化学修饰siRNA复合体的制造效率提高。
SPG/化学修饰siRNA复合体中的聚脱氧腺苷酸和SPG的三重链螺旋结构的形成,具体而言可根据以下方法实施。SPG在天然或在水中的情况下为三重螺旋结构。将该SPG溶解于DMSO(二甲基亚砜)等极性溶剂、氢氧化钠水溶液等碱性水溶液中以使其改性为单链后,添加包含聚脱氧腺苷酸的化学修饰siRNA,将溶剂返回为水或中和碱性水溶液(再生过程),从而形成三重螺旋型复合结构(缔合结构),所述复合结构包含与化学修饰siRNA连接的聚脱氧腺苷酸的单链部分和两条SPG。认为这样的聚脱氧腺苷酸和多糖的复合化主要通过氢键和疏水性相互作用而形成。
本发明的医药组合物包含SPG/化学修饰siRNA复合体。SPG/化学修饰siRNA复合体通过被导入细胞内,而能够抑制细胞内的靶基因的表达,因此本发明的医药组合物可用于抑制靶基因的表达。
本发明的医药组合物可通过含有治疗有效量的SPG/化学修饰siRNA复合体作为有效成分并进一步与药学上允许的载体适宜组合来制备。作为这样的载体,可举出:纯化水、含糖水溶液、缓冲液、生理盐水、无核酸酶水等水性载体;赋形剂等。
作为本发明的医药组合物用作注射剂等液态制剂的情况的一个方式,可举出包含SPG/化学修饰siRNA复合体并且包含接近中性的磷酸缓冲液的生理盐水。在该水性液剂中,对于各含有成分的浓度,只要大致与体液等渗就没有特别限定,例如,SPG/化学修饰siRNA复合体以化学修饰siRNA量计为0.001~7mg/mL,优选为0.01~5mg/mL,磷酸缓冲液为2~10mM,优选为约5mM的缓冲液,pH接近中性,优选为pH7.0~pH7.5,用食盐调整至大致与体液等渗。该注射剂可以原样通过静脉等施用,也可以与林格氏液等进行静脉滴注。
本发明的医药组合物的施用路径可举出:口服、非口服(包含静脉内、腹腔内、肌肉内、皮下、直肠内、阴道内施用)、吸入、全身施用、局部施用(包含对皮肤、颊面龋洞的外用;对眼、耳、鼻等的基本上不进入血流的部位的滴注)等,可基于患者的症状、病况、疾病的种类等根据以往利用的方法来适宜选择。
在本发明的医药组合物中包含的化学修饰siRNA的靶基因是CD40的情况下,该医药组合物可在内脏器官、组织或细胞的移植治疗中适当地用于治疗或预防对于移植内脏器官、移植组织、移植细胞(例如,肾脏、心脏、肺、骨髓、皮肤、角膜、骨髓细胞等)的抵抗或排斥。在将该医药组合物用于治疗或预防对于移植内脏器官、移植组织或移植细胞的抵抗或排斥的情况下,对于接受内脏器官、组织或细胞的移植治疗的患者,在该移植治疗之前和/或之后施用该医药组合物即可。此外,在本发明的医药组合物中包含的化学修饰siRNA的靶基因是CD40的情况下,该医药组合物还可适宜用于治疗或预防移植物抗宿主病(GVHD)。在将该医药组合物用于治疗或预防移植物抗宿主病(GVHD)的情况下,对于接受同种异体造血干细胞移植治疗的患者,在该移植治疗之前和/或之后施用该医药组合物即可。
在本发明的医药组合物中包含的化学修饰siRNA的靶基因是CD40的情况下,对于该医药组合物的施用量,是对目标治疗或预防有效并且非毒性的量即可,对于本领域技术人员而言,该施用量可通过通常性实验来决定,没有特别限定,每天每1kg体重的SPG/化学修饰siRNA复合体的施用量以化学修饰siRNA量计从下述范围中适宜选择即可,例如在约0.01μg~10mg的范围内,优选在约0.5μg~1mg的范围。
实施例
以下,将基于实施例对本发明更详细地进行说明,但本发明不限于此。
在以下试验中使用的SPG/化学修饰siRNA复合体中,所有化学修饰siRNA均使用下述化学修饰siRNA构成:在被实施了给定的化学修饰的有义链5’末端上添加有S化的聚脱氧腺苷酸(40mer)的化学修饰siRNA。
以下试验例中使用的SPG/化学修饰siRNA复合体通过下述方式形成。在0.25N氢氧化钠水溶液中制备分子量约15万的SPG并使其最终浓度为15mg/ml后,进行1小时振动搅拌并在4℃下静置1天使其改性。使其溶解在330mM的磷酸二氢钠中,将添加了S化的聚脱氧腺苷酸的给定序列的化学修饰siRNA的溶液添加至该改性SPG溶液中进行中和并在4℃下静置24小时以上。此时,使得SPG相对于1摩尔的化学修饰siRNA为0.27摩尔。需要说明的是,就添加了S化的聚脱氧腺苷酸的化学修饰siRNA而言,40个脱氧腺苷酸通过磷酸酯键而连接至siRNA的有义链5’末端。
使用经过化学修饰的针对CD40的化学修饰siRNA(表3所示的NJ050.11和NJ050.13),制备SPG/化学修饰siRNA复合体。此外,作为未添加聚脱氧腺苷酸的化学修饰siRNA,准备表3所示的NJ050.12和NJ050.13。该化学修饰siRNA的有义链和反义链的碱基序列分别对应于SEQ ID NO.1和SEQ ID NO.2。
在NJ050.11的情况下,在有义链中,所有腺苷酸和鸟苷酸残基的2’位羟基都被甲氧基所取代,所有胞苷酸和尿苷酸残基的2’位羟基都被氟基所取代,在反义链中,从5’末端侧起算的第8个以后的腺苷酸残基和鸟苷酸残基的2’位羟基被甲氧基所取代,从5’末端侧起算的第8个以后的胞苷酸和尿苷酸残基的2’位羟基被氟基所取代。
在NJ050.12的情况下,在有义链和反义链这两者中,包含CA、UA和UG的二核苷酸序列中的胞苷酸残基和尿苷酸残基的2’位羟基被氟基所取代,并且,该二核苷酸序列中的腺苷酸残基和鸟苷酸残基的2’位羟基被甲氧基所取代。
在NJ050.13的情况下,在有义链中,包含CA、UA和UG的二核苷酸序列中的胞苷酸残基和尿苷酸残基的2’位羟基被氟基所取代,并且,该二核苷酸序列中的腺苷酸残基和鸟苷酸残基的2’位羟基被甲氧基所取代,在反义链中,从5’末端侧起算的第8个以后的腺苷酸残基和鸟苷酸残基的2’位羟基被甲氧基所取代,从5’末端侧起算的第8个以后的胞苷酸残基和尿苷酸残基的2’位的甲氧基被氟基所取代。
[表3]
NJ050.11
NJ050.12
NJ050.13
表中,“dt”、“U(F)”、“G(M)”和”A(M)”如所述表1所示。
通过电穿孔法将各SPG/化学修饰siRNA复合体和化学修饰siRNA导入20万个c-wrt-7LR细胞(源自大鼠骨髓单核细胞性白血病的细胞)中。在导入后,将各细胞接种至48孔板中并使其为2×10
将得到的结果示于图1。在图1中,“LPS(-)”表示阴性对照,“LPS(+)”表示阳性对照,“21bp of NJ050.12”表示NJ050.12的化学修饰siRNA(长度为21碱基),“21bp ofNJ050.13”表示NJ050.13的化学修饰siRNA(长度为21碱基),“NJ050.11(dA40-dsRNA)”表示使用了NJ050.11的化学修饰siRNA的SPG/化学修饰siRNA复合体,“NJ050.13(dA40-dsRNA)”表示使用了NJ050.13的化学修饰siRNA的SPG/化学修饰siRNA复合体。
该结果,确认了NJ050.13的化学修饰siRNA的情况下CD40的mRNA量低于NJ050.12的化学修饰siRNA,从反义链中5’末端侧起算至第7个为止的核糖核苷酸残基未被实施化学修饰的情况下,基因表达抑制效果更高。另一方面,在使用了NJ050.13的化学修饰siRNA的SPG/化学修饰siRNA复合体的情况下,未观察到基因表达抑制效果。
在使用了NJ050.13的化学修饰siRNA的SPG/化学修饰siRNA复合体的情况下,作为未观察到基因表达抑制效果的主要原因,考虑可能是碱基序列的脆弱性导致的对RLC的组入不足,因此在本试验中,对化学修饰siRNA和SPG/化学修饰siRNA复合体在血清中的稳定性进行评价。
将在有义链5’末端连接有S化的聚脱氧腺苷酸(40mer)的NJ050.13的化学修饰siRNA(Naked)添加至包含10容量%牛胎血清(FBS)的RPMI1640培养基(Gibco)中并使得其为1μM,在37℃下进行16小时孵化。接着,添加与样品等量的TE饱和酚/氯仿,通过涡旋进行剧烈搅拌后,以12000×g进行15分钟离心分离。接着,回收上清液,通过分光光度计对上清液中的核酸浓度进行测定,对相当于200ng核酸的量进行使用了15%聚丙烯酰胺凝胶的电泳。此外,作为对照,使用通过磷酸酯键将40个S化的聚脱氧腺苷酸连接在有义链5’末端的NJ003.2的dsRNA。已知NJ003.2的dsRNA的碱基序列如表4所示,在血清中比较稳定。
此外,对于使用了NJ050.13的化学修饰siRNA的SPG/化学修饰siRNA复合体和使用了NJ003.2的dsRNA的SPG/siRNA复合体,除了将进行电泳的核酸量设定为400ng之外,以与所述同样的方式进行试验。
将得到的结果示于图2。图2的(A)表示NJ050.13的化学修饰siRNA(Naked)和NJ050.13的化学修饰siRNA(Naked)的结果。在图2的(A)中,“Naked”是指未在FBS存在下进行孵化的情况,“Naked in FBS”是指在FBS存在下进行了孵化的情况。图2的(B)表示使用了NJ050.13的化学修饰siRNA的SPG/化学修饰siRNA复合体和使用了NJ003.2的dsRNA的SPG/siRNA复合体的结果。在图2的(B)中,“Naked”是指未在FBS存在下对NJ050.13的化学修饰siRNA或NJ003.2的dsRNA进行孵化的情况,“Complex”是指在FBS存在下对SPG/化学修饰siRNA复合体或SPG/siRNA复合体进行了孵化的情况,“Complex in FBS”是指在FBS存在下对SPG/化学修饰siRNA复合体或SPG/siRNA复合体进行了孵化的情况。
该结果暗示以下可能性:在有义链的5’末端上添加了S化的聚脱氧腺苷酸的NJ050.13的化学修饰siRNA在聚脱氧腺苷酸与有义链的结合部位附近断裂。
参考试验例2的结果暗示需要提高S化的聚脱氧腺苷酸与siRNA的有义链的结合部位附近的稳定性,因此决定在有义链的接合部位添加化学修饰。此外,根据参考试验例1的结果,由于在NJ050.11中采用的有义链修饰的情况下存在丧失活性的风险,因此实施了表4所示的NJ050.14的化学修饰来制备siRNA。
[表4]
NJ050.14
表中,“dt”、“U(F)”、“G(M)”和”A(M)”如所述表1所示。
将dRAW细胞(小鼠巨噬细胞;过表达Dectin-1的RAW264细胞)接种至48孔板中并使其为2×10
将得到的结果示于图3。在图3中,“NT”表示阴性对照,“IFNγ(+)”表示阳性对照,“NJ050.13 SPG complex”表示使用了NJ050.13的化学修饰siRNA的SPG/化学修饰siRNA复合体,“NJ050.14 SPG complex”表示使用了NJ050.14的化学修饰siRNA的SPG/化学修饰siRNA复合体。由该结果确认了,使用了NJ050.14的化学修饰siRNA的SPG/化学修饰siRNA复合体,具有与使用了NJ050.13的化学修饰siRNA的复合体的情况同程度的良好的基因表达抑制效果。
将使用了NJ050.14的化学修饰siRNA的SPG/化学修饰siRNA复合体200ng添加至血清(小鼠血清、人血清和FBS),在37℃下进行1分钟或30分钟孵化。接着,添加与样品等量的TE饱和酚/氯仿,通过涡旋进行剧烈搅拌后,以12000×g进行15分钟离心分离。接着,回收上清液,通过分光光度计对上清液中的核酸浓度进行测定,对相当于200ng核酸的量进行使用了15%聚丙烯酰胺凝胶的电泳。
将得到的结果示于图4。在图4中,泳道1的“Naked”是指未在血清存在下对添加有S化的聚脱氧腺苷酸的NJ050.13的化学修饰siRNA进行孵化的情况,泳道2的“Complex”是指未在血清存在下对使用了NJ050.14的化学修饰siRNA的SPG/化学修饰siRNA复合体进行孵化的情况,泳道3~5和9~11的“NJ050.14 complex”是指使用了NJ050.14的化学修饰siRNA的SPG/化学修饰siRNA复合体,泳道12的“21mer”是NJ003.2的化学修饰siRNA部分的有义链序列并用作尺寸标记。由该结果确认了,使用了NJ050.14的化学修饰siRNA的SPG/化学修饰siRNA复合体在血清存在下比较稳定。
NJ050.14的化学修饰siRNA具有许多腺苷酸残基和鸟苷酸残基的2’位羟基被甲氧基所取代的位点,在制造上存在收率降低的风险。此外,认为虽然NJ050.14的化学修饰siRNA在血清存在下比较稳定,但是在血清存在下的稳定性比NJ050.13的化学修饰siRNA差,不能在体内使用。因此,对于S化的聚脱氧腺苷酸与siRNA的有义链的结合位点的化学修饰是不可或缺的,即使牺牲稳定性,也需要尽可能减少化学修饰的次数,开发具备适当的基因表达抑制效果的化学修饰siRNA。
因此,制备实施了表5所示的NJ050.15的化学修饰的siRNA。实施了NJ050.15的化学修饰的siRNA满足本发明中规定的条件(i)~(ix)。
[表5]
NJ050.15(A-3修饰)
表中,“dt”、“U(F)”、“G(M)”和”A(M)”如所述表1所示。
将dRAW细胞(小鼠巨噬细胞;过表达Dectin-1的RAW264细胞)接种至48孔板中并使其为5×10
将得到的结果示于图5。在图5中,“NT”是阴性对照,“IFNγ(+)”是阳性对照,“NJ050.14 naked”是通过磷酸酯键将40个脱氧腺嘌呤连接至有义链5’末端的NJ050.14的化学修饰siRNA,“NJ050.14complex”是使用了NJ050.14的化学修饰siRNA的SPG/化学修饰siRNA复合体,“NJ050.15naked”是通过磷酸酯键将40个脱氧腺苷酸连接至有义链5’末端的NJ050.15的化学修饰的siRNA,“NJ050.15complex”是使用了NJ050.15的化学修饰的siRNA的SPG/化学修饰siRNA复合体。该结果确认了,与使用了NJ050.14的化学修饰siRNA的SPG/化学修饰siRNA复合体相比,使用了NJ050.15的化学修饰的siRNA的SPG/化学修饰siRNA复合体具有同等或更好的基因表达抑制效果。
对于使用了NJ050.14或NJ050.15的化学修饰siRNA的SPG/化学修饰siRNA复合体和使用了表6所示的化学修饰siRNA的SPG/化学修饰siRNA复合体,对它们在血清中的稳定性进行评价。具体而言,将各SPG/化学修饰siRNA复合体添加至血清(人血清和FBS)中并使其为1μM,在37℃下进行16小时孵化。接着,添加与样品等量的TE饱和酚/氯仿,通过涡旋进行剧烈搅拌后,以12000×g进行15分钟离心分离。接着,回收上清液,通过分光光度计对上清液中的核酸浓度进行测定,对相当于20ng核酸的量进行使用了15%聚丙烯酰胺凝胶的电泳。对于未分解的化学修饰siRNA,使用Image J解析软件进行定量,求出残存率(%)。
[表6]
NJ070.13
NJ070.13t
NJ070.14(A.3修饰)
NJ151A3(A-3修饰)
NJ003.2
NJ003.21(A-3修饰)
表中,“dt”、“U(F)”、“G(M)”和”A(M)”如所述表1所示。
将得到的结果示于图6。图6的(A)表示使用了人血清的结果,(B)表示使用了FBS的结果。意外的是,与使用了NJA050.14的情况相比,尽管使用了NJA050.15的化学修饰的siRNA的SPG/化学修饰siRNA复合体的化学修饰次数较少,但其具备与NJA050.14的情况同等或更好的稳定性。
使用使用了NJ050.14或NJ050.15的化学修饰的siRNA的SPG/化学修饰siRNA复合体,进行离体MLR(淋巴细胞混合培养)测定,对细胞增殖抑制效果进行评价。具体而言,将使用了NJ050.14或NJ050.15的化学修饰的siRNA的SPG/化学修饰siRNA复合体以成为0.2μg/head或2μg/head的方式通过尾静脉施用至BALB/c小鼠(雄,9周龄)。经过20小时后,从BALB/c小鼠中取出脾,根据常规方法制备脾细胞(5×10
将得到的结果示于图7。由该结果确认了,使用了NJ050.15的化学修饰siRNA的SPG/化学修饰siRNA复合体可通过较少的化学修饰来提高稳定性,并且可诱导较高的敲低(Knock-Down)活性。
在特定规则下,使用实施了化学修饰的siRNA(针对CD40的siRNA,用于人序列)来制备SPG/化学修饰siRNA复合体。具体而言,准备表7中所示的有义链5’末端通过磷酸酯键连接有40个S化的脱氧腺苷酸的各种化学修饰siRNA,通过所述方法制备各种SPG/化学修饰siRNA复合体。需要说明的是,表7中所示的hsiCD40(208)的有义链和反义链的碱基序列分别对应于SEQ ID NO.3和4,hsiCD40(867)的有义链和反义链的碱基序列分别对应于SEQ IDNO.5和6,hsiCD40(1019)的有义链和反义链的碱基序列分别对应于SEQ ID NO.7和8,hsiCD40(998)的有义链和反义链的碱基序列分别对应于SEQ ID NO.9和10。
表7中所示的化学修饰方式(Modification pattern)A-1是具有较高相对稳定性和较强的活性的修饰方式,其是添加了预先S化的聚脱氧腺嘌呤的siRNA和SPG形成的复合体的稳定化研究所发现的结果。就该化学修饰方式A-1而言,在有义链中,从5’末端侧起算的第1、2、3、4、5、7、8、9、10、11、13、16、17和18个核糖核苷酸残基的2’位羟基被氟基所取代,从5’末端侧起算的第6、12、14、15和19个核糖核苷酸残基的2’位羟基被甲氧基所取代。此外,就该化学修饰方式A-1而言,在反义链中,包含CA、UA和UG的二核苷酸序列中的胞苷酸残基和尿苷酸残基的2’位羟基被氟基所取代,并且,该二核苷酸序列中的腺苷酸残基和鸟苷酸残基的2’位羟基被甲氧基所取代。
就表7中所示的化学修饰方式A-2而言,在有义链中,所有胞苷酸残基和尿苷酸残基的2’位羟基被氟基所取代,所有腺苷酸残基和鸟苷酸残基的2’位羟基被甲氧基所取代。此外,就该化学修饰方式A-2而言,在反义链中,包含CA、UA和UG的二核苷酸序列中的胞苷酸残基和尿苷酸残基的2’位羟基被氟基所取代,并且,该二核苷酸序列中的腺苷酸残基和鸟苷酸残基的2’位羟基被甲氧基所取代。然而,未对从反义链的5’末端侧起算的第1~7个核糖核苷酸残基进行修饰。
表7中所示的化学修饰方式A-3满足本发明中规定的条件(i)~(ix)。
[表7]
表中,“dt”、“U(F)”、“G(M)”和”A(M)”如所述表1所示。
通过电穿孔法将各SPG/化学修饰siRNA复合体400nM导入50万个人外周血单个核细胞(PBMC)中。在导入后,将各细胞接种至48孔板中并使其为2×10
将得到的结果示于图8。在图8中,“Complex”是指使用了未实施化学修饰的siRNA的SPG/siRNA复合体,“A-1”是指实施了化学修饰方式A-1的化学修饰siRNA的有义链5’末端通过磷酸酯键连接有S化的40个脱氧腺苷酸的化学修饰siRNA,“Complex A-1”是指使用了实施了化学修饰方式A-1的化学修饰siRNA的SPG/化学修饰siRNA复合体,“A-2”是指实施了化学修饰方式A-2的化学修饰siRNA的有义链5’末端通过磷酸酯键连接有S化的40个脱氧腺苷酸的化学修饰siRNA,“Complex A-2”是指使用了实施了化学修饰方式A-2的化学修饰siRNA的SPG/化学修饰siRNA复合体,“A-3”是指实施了化学修饰方式A-3的化学修饰siRNA的有义链5’末端通过磷酸酯键连接有S化的40个脱氧腺苷酸的化学修饰siRNA,“ComplexA-3”是指使用了实施了化学修饰方式A-3的化学修饰siRNA的SPG/化学修饰siRNA复合体。其结果,在使用了SPG/化学修饰siRNA复合体的情况下,基因表达抑制效果最高,所述SPG/化学修饰siRNA复合体使用了实施了化学修饰方式A-3的化学修饰siRNA。
由以上试验例1~4的结果可知,可通过使用了实施了满足本发明中规定的条件(i)~(ix)的化学修饰的化学修饰siRNA的SPG/化学修饰siRNA复合体,来同时提高对RNase的抗性和RNAi活性,即使在体内使用也可实现充分的基因表达抑制效果。
使用使用表7中所示的hsiCD40(998)的A-3化学修饰方式的化学修饰siRNA而进行了调整的SPG/化学修饰siRNA复合体(SPG/化学修饰hsiCD40(998)A-3复合体),制成表8中所示的组成的液态制剂。将得到的液态制剂密封在小瓶中,进行稳定性试验。稳定性试验通过以下方式实施:在长期保存试验中,在5℃、黑暗的条件下,保存6个月和13个月,在加速试验中,在25℃、相对湿度60%、黑暗的条件下,保存1个月、3个月和6个月,对保存后的液态制剂的特性和SPG/化学修饰hsiCD40(998)A-3复合体的含量等进行测定。
其结果,在长期保存试验和加速试验中,保存后的SPG/化学修饰hsiCD40(998)A-3复合体的含量均没有变化,并且保存后的液态制剂的特性等也没有变化,证明其为稳定的。
[表8]
使用表6中所示的SPG/化学修饰siRNA复合体NJ003.21(A-3修饰),通过使用了小鼠急性移植物抗宿主病(aGVHD,acute-graft-versus-host-disease)模型(受体,Recipient:9周龄,雌,BALB/C(H2k-d);供体,Donor:9周龄,雌,C57BL/6N(H2k-b))的动物模型进行评价。在该动物模型中,对受体小鼠(Recipient mouse)照射X线照射(8.5Gray),破坏免疫系统。通过将供体小鼠(Donor mouse)的骨髓细胞移植至免疫系统被破坏的受体小鼠,来重构免疫系统并成功进行骨髓移植。aGVHD是因供体小鼠的骨髓细胞以外的细胞的移入而引起的。
具体而言,分为BMs:WSCs=5:1(NJ003.21 i.v.)组(n=6)、放射对照组(n=4)、BM对照组(n=4)和BMs:WSCs=5:1(PBS i.v.)组(n=6),在以下条件下进行试验。
首先,在细胞移植的3天前和1天前,对受体小鼠尾静脉注射(i.v.)SPG/化学修饰siRNA复合体,并使其以化学修饰siRNA量计为2μg/head(days-3and-1)。第2次的SPG/化学修饰siRNA复合体的施用日起1天后,对受体小鼠进行X线照射(8.5Gray)以破坏免疫系统,然后,将从供体小鼠中收集的骨髓细胞(5×10
不施用SPG/化学修饰siRNA复合体,并且不进行细胞移植,除此之外,以与所述BMs:WSCs=5:1(NJ003.21 i.v.)组同样的条件进行试验。
<放射对照组>
不施用SPG/化学修饰siRNA复合体,并且仅将移植细胞变更为骨髓细胞(5×10
施用等量的PBS来代替SPG/化学修饰siRNA复合体,除此之外,以与所述BMs:WSCs=5:1(NJ003.21 i.v.)组同样的条件进行试验。
将得到的结果示于图9。其结果,与BMs:WSCs=5:1(PBS i.v.)组相比,在BMs:WSCs=5:1(NJ003.21 i.v.)组的情况下,生存率更高并且能够延长寿命。因此,确认了NJ003.21(hsiCD40(998)的小鼠直系同源物(Mouse Ortholog))对小鼠的aGVHD的预防或治疗是有效的。
序列表
<110> 日商那帕洁制药股份有限公司
<120> 包含化学修饰siRNA和裂皱菌多糖形成的复合体的医药组合物
<130> 19029WO
<150> JP2018-103933
<151> 2017-05-30
<160> 10
<170> PatentIn version 3.5
<210> 1
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> 针对CD40的siRNA的有义链
<400> 1
cgugcaguga caaacaguat t 21
<210> 2
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> 针对CD40的siRNA的反义链
<400> 2
uacuguuugu cacugcacgt t 21
<210> 3
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> hsiCD40(208)的有义链
<400> 3
gacagaaacu ggugagugat t 21
<210> 4
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> hsiCD40(208)的反义链
<400> 4
ucacucacca guuucuguct t 21
<210> 5
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> hsiCD40(867)的有义链
<400> 5
aguguggcca cgugggcaat t 21
<210> 6
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> hsiCD40(867)的反义链
<400> 6
uugcccacgu ggccacacut t 21
<210> 7
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> hsiCD40(1019)的有义链
<400> 7
cagaaacagu ucaccuugat t 21
<210> 8
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> hsiCD40(1019)的反义链
<400> 8
ucaaggugaa cuguuucugt t 21
<210> 9
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> hsiCD40(998)的有义链
<400> 9
caggagaccu ggcacuggat t 21
<210> 10
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> hsiCD40(998)的反义链
<400> 10
uccagugcca ggucuccugt t 21
- 包含化学修饰siRNA和裂褶菌多糖形成的复合体的医药组合物
- 一种调控裂褶菌发酵产物裂褶多糖分子量的方法
