一种透析液中神经递质的检测方法
文献发布时间:2023-06-19 13:29:16
技术领域
本发明涉及分析化学技术领域,具体涉及一种透析液中神经递质的检测方法。
背景技术
神经递质是指由突触前神经元合成并在末梢处释放,能特异性作用于突触后神经元或效应器细胞上的受体,并能起到信息传递作用的一类化学物质。神经递质主要包括γ-氨基丁酸、谷氨酸和甘氨酸等氨基酸类,5-羟色胺、肾上腺素和去甲肾上腺素等单胺类,乙酰胆碱和胆碱等胆碱类,腺苷及其衍生物单磷酸腺苷、二磷酸腺苷和三磷酸腺苷等嘌呤类及肽类等。
氨基酸类神经递质分为兴奋性(EAAs)和抑制性(IAAs)两大类,它们是调节机体生理活动的重要物质。其中,兴奋性氨基酸包括谷氨酸和天冬氨酸等,它们在维持神经元正常信号传递过程中起重要作用,而抑制性氨基酸包括γ-氨基丁酸和甘氨酸等,主要作为抑制性神经递质介导脊髓及脑干的快抑制性突触传递。单胺类神经递质包括儿茶酚胺类(多巴胺、去甲肾上腺素和肾上腺素)和吲哚类(5-羟色胺),两类神经元存储于突触前膜囊泡内,在人体的神经、心血管等系统中有着重要的调节作用。胆碱类神经递质主要指乙酰胆碱,它是许多外周神经的神经递质,胆碱类的改变与神经系统的肌肉疾病、癫痫、脑外伤及脑炎等多种疾病有关。嘌呤类神经递质主要包括腺嘌呤、腺苷及其衍生物,嘌呤类在机体代谢内占有重要地位,可以保护神经系统,调制痛觉,并在脑血管、胃肠道活动、神经系统免疫反应、癌变和神经再生过程中起到重要作用。
肌肉外周神经系统内存在大量的神经递质,其含量的变化对生物体有着重要的影响,并与多种疾病密切相关,包括肌肉强直、类风湿性关节炎、骨关节炎等。有研究表明,靶向周围神经中的谷氨酸能信号是促进再生和修复以及疼痛控制的重要途径;5-羟色胺参与了肌肉收缩、血压调控、血小板聚集等众多生理调节过程;肌强直病人的肌组织中乙酰胆碱的含量增高(正常肌肉中含量很少)。因此,对组织匀浆液等生物样本进行含量测定,并监测肌肉组织内神经递质含量的变化,对于神经学研究具有重要的意义。但是,由于大部分递质在生物样品中含量低、基质复杂、内源性成分干扰大。因而,其含量的测定对于样品的前处理、仪器的灵敏度等均有着较高的要求。
目前,关于生物样品中神经递质的检测方法已经有了很多报道。其中,单胺类神经递质较为常用的有电化学、荧光法、毛细管电泳法及液质联用法(LC-MS/MS);氨基酸类神经递质多采用柱前衍生化后的荧光法检测以及液质联用法;胆碱类主要采用电化学检测;腺苷类多采用毛细管电泳法和液质联用法检测。不同类型神经递质的检测大都采用高效液相系统进行分离,只是在检测器的选择上有所差异。对于样品中神经递质的检测所面临的问题,主要包括以下几个方面:1、神经递质的含量很低,且属于内源性物质,其他物质对其干扰较大;2、单胺类成分的化学性质不稳定,在光照和碱性条件下易发生氧化分解;3、氨基酸类递质采用HPLC-荧光法需要对检测样本进行衍生化以使其产生荧光,加大了分析检测及方法学建立上的难度。
相较于其他检测手段,LC-MS/MS法无需衍生化,操作简单、灵敏度高、分析时间短、选择性高,是分析复杂生物样本中痕量成分的有力工具,通过适当优化样品的前处理条件及色谱、质谱条件可以满足生物样本的分析要求。而在采用质谱方法进行测定时,单胺类、氨基酸类和胆碱大多采用正模式的质谱检测方法以得到更高的仪器响应,而嘌呤类中的单磷酸腺苷、二磷酸腺苷、三磷酸腺苷由于存在带负电的磷酸根基团,所以更合适采用碱性流动相条件下的负离子模式检测,虽然有文献报道采用离子对试剂(N,N-二甲基己胺、二丁胺乙酸等)作为流动相后能用正离子模式进行检测,但前期研究发现重复性较差。因此,需要找到更合适的色谱条件和质谱条件,使单磷酸腺苷类神经递质与其他类神经递质同时检测,达到减少检测成本和时间的目的。
发明内容
有鉴于此,本发明的目的在于提供一种透析液中神经递质的检测方法。本发明提供的检测方法能够实现嘌呤类神经递质中的单磷酸腺苷类神经递质和胆碱类神经递质、氨基酸类神经递质和单胺类神经递质同时检测。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了一种透析液中神经递质的检测方法,包括以下步骤:
将待测透析液进行富集,得到富集样品;
对所述富集样品进行超高效液相色谱-质谱检测;
所述超高效液相色谱-质谱检测包括超高效液相色谱检测和质谱检测;
所述超高效液相色谱检测的参数包括:
色谱柱:Waters ACQUITY UPLC BEH C
流动相A:甲酸铵水溶液;
流动相B:乙腈;
梯度洗脱程序:
(1)体积比例为2~5%乙腈等度洗脱11.5~12.5min;
(2)乙腈的体积比例匀速升至65~75%梯度洗脱2.5~3.5min;
(3)体积比例为65~75%乙腈等度洗脱1.0~2.0min;
(4)体积比例为65~75%乙腈瞬时切换为体积比例为2~5%乙腈后等度洗脱1.0~2.0min;
流动相的流速:0.2~0.3mL/min;
柱温:30~45℃;
所述质谱检测的参数包括:
离子源为电喷雾离子源,扫描模式为正或负离子模式;离子源喷雾电压:4.0~4.5kV;离子源气帘气:193.0~275.8kPa;碰撞气:41.4~55.1kPa;离子源温度:400~600℃;雾化气:344.7~413.7kPa;辅助气:344.7~413.7kPa;分析时间:8.0~10min;多反应监测模式。
优选地,所述富集为定量环富集;所述定量环的规格为5μL~20μL。
优选地,所述定量环为具有十通阀的定量环。
优选地,所述富集的时间为2.5min~20min。
优选地,当神经递质为谷氨酸时,监测离子对为148.1/84.1;当神经递质为天冬氨酸时,监测离子对为134.1/74.0;当神经递质为5-羟色胺时,监测离子对为177.2/160.3;当神经递质为组胺时,监测离子对为112.0/95.1;当神经递质为乙酰胆碱时,监测离子对为146.3/87.0;当神经递质为甘氨酸时,监测离子对为76.2/30.0;当神经递质为5-羟吲哚乙酸时,监测离子对为192.1/146.1;当神经递质为谷氨酰胺时,监测离子对为147.1/130.1;当神经递质为γ-氨基丁酸时,监测离子对为104.1/87.2;当神经递质为腺苷时,监测离子对为268.4/136.5;以上10种神经递质采用正离子模式监测;
当神经递质为单磷酸腺苷时,监测离子对为268.4/136.5;当神经递质为二磷酸腺苷时,监测离子对为426.2/133.8;当神经递质为三磷酸腺苷时,监测离子对为505.9/158.9;以上3种神经递质采用负离子模式监测。
优选地,所述待测透析液的稀释剂为林格氏液。
优选地,所述超高效液相色谱-质谱检测包括定量检测;所述定量检测采用标准曲线法;所述标准曲线法中的标准曲线为神经递质浓度和色谱峰面积的标准曲线。
本发明提供了一种透析液中神经递质的检测方法,包括以下步骤:将待测透析液进行富集,得到富集样品;对所述富集样品进行超高效液相色谱-质谱检测;所述超高效液相色谱-质谱检测包括超高效液相色谱检测和质谱检测;所述超高效液相色谱检测的参数包括:色谱柱:WatersACQUITY UPLC BEH C
本发明以乙腈为流动相B、甲酸铵水溶液作为流动相A,正、负离子同时扫描的质谱检测模式,首次完成了4类共13个神经递质(乙酰胆碱、甘氨酸、谷氨酸、谷氨酰胺、γ-氨基丁酸、天冬氨酸、组胺、5-羟色胺、5-羟吲哚乙酸、腺苷、单磷酸腺苷、二磷酸腺苷和三磷酸腺苷)的同时定性和定量检测,分析时间短,定性和定量检测结果准确、可靠,无需将待测透析液分别采用不同的检测仪器或不同的流动相条件进行分析,节省了样本量、样本的检测时间,也为在线检测提供了必要的前提,具有可期的临床应用前景。本发明在进行超高效液相色谱-质谱检测前,对待测透析液进行富集,实现了对低含量神经递质的透析液的检测。
进一步地,透析液经过定量环富集后,再经超高效液相色谱-质谱检测直接进行检测,避免了复杂的前处理带来的样品损失。
进一步地,定量环上的可切换的十通阀能将富集后的透析液直接进样分析,避免了样品在转移、储存过程中造成的损失和污染。
进一步地,用林格氏液稀释透析液,得到待测透析液,可起到改善峰形、减少基质效应的作用。
附图说明
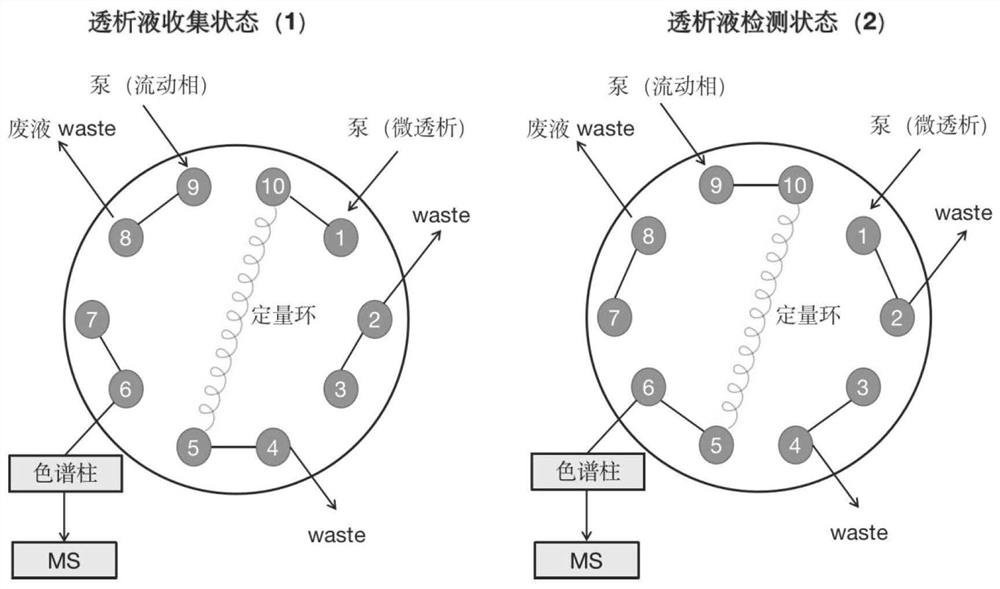
图1为具有十通阀的定量环的工作原理图;
图2为在线微透析-超高效液相色谱-质谱检测分析平台流程示意图;
图3为实施例1中Glu(谷氨酸)标准品的多反应离子监测色谱图;
图4为实施例1中Asp(天冬氨酸)标准品的多反应离子监测色谱图;
图5为实施例1中5-HT(5-羟色胺)标准品的多反应离子监测色谱图;
图6为实施例1中HA(组胺)标准品的多反应离子监测色谱图;
图7为实施例1中ACh(乙酰胆碱)标准品的多反应离子监测色谱图;
图8为实施例1中Gly(甘氨酸)标准品的多反应离子监测色谱图;
图9为实施例1中5-HIAA(5-羟吲哚乙酸)标准品的多反应离子监测色谱图;
图10为实施例1中Gln(谷氨酰胺)标准品的多反应离子监测色谱图;
图11为实施例1中γ-GABA(γ-氨基丁酸)标准品的多反应离子监测色谱图;
图12为实施例1中ADO(腺苷)标准品的多反应离子监测色谱图;
图13为实施例1中AMP(单磷酸腺苷)标准品的多反应离子监测色谱图;
图14为实施例1中ADP(二磷酸腺苷)标准品的多反应离子监测色谱图;
图15为实施例1中ATP(三磷酸腺苷)标准品的多反应离子监测色谱图;
图16为实施例2中13个神经递质的体外回收率-浓度趋势图;
图17~18为实施例3中大鼠肌肉透析液中13个神经递质浓度水平柱状图。
具体实施方式
本发明提供了一种透析液中神经递质的检测方法,包括以下步骤:
将待测透析液进行富集,得到富集样品;
对所述富集样品进行超高效液相色谱-质谱检测。
在本发明中,如无特殊说明,本发明所用原料均优选为市售产品。
在本发明中,所述待测透析液优选市售购买或自制。
在本发明中,当所述检测方法针对实时检测时,所述待测透析液的制备方法优选包括以下步骤:
待实时检测的动物体经灌流后,含有神经递质的透析液被带出体外,得到待测透析液。
在本发明中,所述灌流的试剂优选包括林格氏液(Ringer's Solution)。
在本发明中,所述灌流的设备优选包括微透析泵。
在本发明中,所述灌流优选包括以下步骤:
对待实时检测的动物体麻醉后,先将线性探针埋入待实时检测的动物体的组织内,通过微透析泵将林格氏液(Ringer's Solution)泵入到已插入探针的一端进行灌流,此时透析液从探针另一端流出;灌流平衡30min后,采集探针另一端的流出液,作为待测透析液。
在本发明中,所述灌流的流速优选为1μL/min~2μL/min,具体优选为1μL/min。
在本发明中,所述富集优选为定量环富集;所述定量环的规格优选为5μL~20μL,进一步优选为10μL。本发明的待测透析液经定量环富集后,再经超高效液相色谱-质谱检测直接进行检测,避免了复杂的前处理带来的样品损失。
在本发明中,所述定量环优选为具有十通阀的定量环。本发明的定量环上的可切换的十通阀能将富集后的透析液直接进样分析,避免了样品在转移、储存过程中造成的损失和污染。
图1为具有十通阀的定量环的工作原理示意图。
在本发明中,所述富集的时间优选为2.5min~20min,进一步优选为10min。
在本发明中,在进行超高效液相色谱-质谱检测前,对所述含有13种神经递质的透析进行富集,实现了对低含量神经递质的透析液的检测。
得到富集样品后,本发明对所述富集样品进行超高效液相色谱-质谱检测。
在本发明中,所述超高效液相色谱-质谱检测包括超高效液相色谱检测和质谱检测。
在本发明中,所述超高效液相色谱检测的参数包括:
色谱柱:Waters ACQUITY UPLC BEH C
流动相A:甲酸铵水溶液;所述甲酸铵水溶液的浓度优选为1mmol/L~5mmol/L,进一步优选为2mmol/L;所述甲酸铵水溶液的pH值优选为9.8~10.0,具体优选为9.8;
流动相B:乙腈;
梯度洗脱程序:
(1)体积比例为2~5%乙腈等度洗脱11.5~12.5min;
(2)乙腈的体积比例匀速升至65~75%梯度洗脱2.5~3.5min;
(3)体积比例为65~75%乙腈等度洗脱1.0~2.0min;
(4)体积比例为65~75%乙腈瞬时切换为体积比例为2~5%乙腈后等度洗脱1.0~2.0min;
所述梯度洗脱程序优选为:
0→12.0min:98%流动相A;
12.0→15.0min:98%→30%流动相A;
15.0→16.0min:30%流动相A;
16.0→18.0min:98%流动相A;
流动相的流速:0.2~0.3mL/min,优选为0.25mL/min;
柱温:30~45℃,优选为35℃。
在本发明中,所述质谱检测的参数包括:
离子源为电喷雾离子源,扫描模式为正或负离子模式;
离子源喷雾电压:4.0~4.5kV,具体优选为4.5kV;
离子源气帘气:193.0~275.8kPa,优选为241.3kPa;
碰撞气:41.4~55.1kPa,优选为48.3kPa;
离子源温度:400~600℃,优选为500℃;
雾化气:344.7~413.7kPa,优选为413.7kPa;
辅助气:344.7~413.7kPa,优选为413.7kPa;
分析时间:8.0~10min,优选为8.0min;
多反应监测模式(MRM)。
在本发明中,当神经递质为谷氨酸时,监测离子对为148.1/84.1;当神经递质为天冬氨酸时,监测离子对为134.1/74.0;当神经递质为5-羟色胺时,监测离子对为177.2/160.3;当神经递质为组胺时,监测离子对为112.0/95.1;当神经递质为乙酰胆碱时,监测离子对为146.3/87.0;当神经递质为甘氨酸时,监测离子对为76.2/30.0;当神经递质为5-羟吲哚乙酸时,监测离子对为192.1/146.1;当神经递质为谷氨酰胺时,监测离子对为147.1/130.1;当神经递质为γ-氨基丁酸时,监测离子对为104.1/87.2;当神经递质为腺苷时,监测离子对为268.4/136.5;以上10种神经递质采用正离子模式监测。
在本发明中,当神经递质为单磷酸腺苷时,监测离子对为268.4/136.5;当神经递质为二磷酸腺苷时,监测离子对为426.2/133.8;当神经递质为三磷酸腺苷时,监测离子对为505.9/158.9;以上3种神经递质采用负离子模式监测。
在本发明中,所述超高效液相色谱-质谱检测优选包括定量检测;所述定量检测优选采用标准曲线法。在本发明中,所述标准曲线法中的标准曲线为神经递质浓度和峰面积的标准曲线。
在本发明中,所述标准曲线法优选包括以下步骤:
配制溶有神经递质标准品的混合标准溶液;
对所述溶有神经递质标准品的混合标准溶液进行超高效液相色谱-质谱检测,得到神经递质标准品的色谱峰面积;
基于神经递质标准品的色谱峰面积和浓度,绘制各神经递质的色谱峰面积-浓度标准曲线;
将测得的待测透析液的各神经递质的色谱峰面积代入相应的神经递质的色谱峰面积-浓度标准曲线中,得到待测透析液中各神经递质的浓度。
本发明配制溶有神经递质标准品的混合标准溶液。
在本发明中,所述配制溶有神经递质标准品的混合标准溶液的方法优选包括以下步骤:
配制神经递质标准单个标准液或配制溶有多种神经递质标准品的混合标准溶液;
采用林格氏液稀释,得到溶有神经递质标准品的混合标准溶液。
在本发明中,所述配制神经递质标准单个标准液或配制溶有多种神经递质标准品的混合标准溶液的溶剂优选包括甲醇、乙腈或水;具体为:谷氨酸、天冬氨酸、单磷酸腺苷、二磷酸腺苷及三磷酸腺苷用超纯水溶解;其余的神经递质采用甲醇溶解。
得到溶有神经递质标准品的混合标准溶液后,本发明对所述溶有神经递质标准品的混合标准溶液进行超高效液相色谱-质谱检测,得到神经递质标准品的色谱峰面积。
在本发明中,所述超高效液相色谱-质谱检测的参数优选与上述技术方案一致,在此不再赘述。
得到神经递质标准品的色谱峰面积后,本发明基于神经递质标准品的色谱峰面积和浓度,绘制各神经递质的色谱峰面积-浓度标准曲线。
本发明对所述绘制的方式不做具体限定,采用本领域技术人员熟知的绘制操作即可。
得到各神经递质的色谱峰-浓度标准曲线后,本发明将测得的待测透析液的各神经递质的色谱峰面积代入相应的神经递质的色谱峰面积-浓度标准曲线中,得到待测透析液中各神经递质的浓度。
本发明对所述代入的操作不做具体限定,采用本领域技术人员熟知的代入操作即可。
图2为在线微透析-超高效液相色谱-质谱检测分析平台流程示意图。
下面结合实施例对本发明提供的透析液中神经递质的检测方法进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
实施例1
本实施例的目的是建立一种基于在线微透析-液质联用测定肌肉微透析样品中13个神经递质的检测方法。13种神经递质包括:胆碱类神经递质包括乙酰胆碱;氨基酸类包括:甘氨酸、谷氨酸、谷氨酰胺、γ-氨基丁酸、天冬氨酸、组胺;单胺类包括:5-羟色胺、5-羟吲哚乙酸;嘌呤类包括:腺苷、单磷酸腺苷、二磷酸腺苷、三磷酸腺苷。
标准品溶液配制:精密称取13种对照品,谷氨酸、天冬氨酸、单磷酸腺苷、二磷酸腺苷及三磷酸腺苷以超纯水溶解,其余神经递质对照品以甲醇溶解,分别配制成5.0mg/mL的单标储备液,存于-20℃。采用甲醇配制以上13种对照品的混合标准母液,浓度为200μg/mL。临用前以林格氏液稀释混合标准溶液母液,配制混合标准溶液中各神经递质呈不同浓度分布的一系列混合标准溶液。
样本采集:采用异氟烷对大鼠麻醉后,将线性探针埋入大鼠的前肢(外周)肌肉组织里,林格氏液灌流以1μL/min平衡30min后,立即采集透析液,透析液富集在体积为10μL的定量环,每个透析液的检测时间设为18min,其中富集时间为10min,质谱分析时间为8min。18min后继续下一个透析液的富集和分析。往复运行,从而达到实时进样分析的目的。具有十通阀的定量环的工作原理图及在线微透析-超高效液相色谱-质谱检测分析平台流程示意图分别如图1和图2所示。
液相色谱条件:WatersAcuity超高效液相色谱仪(美国Waters公司),WatersACQUITY UPLC BEH C
梯度洗脱程序:
0→12.0min:98%流动相A;12.0→15.0min:98%→30%流动相A;15.0→16.0min:30%流动相A;16.0→18.0min:98%流动相A;
柱温为35℃,流动相的流速为0.25mL/min。
质谱条件:API6500+三重四极杆串联质谱仪(美国AB Sciex公司);电喷雾离子源(ESI),正、负离子扫描模式;离子源喷雾电压:4.5kV;离子源气帘气:241.3kPa;碰撞气:48.3kPa;离子源温度:500℃;雾化气:413.7kPa;辅助气:413.7kPa;分析时间(duration):8.0min;多反应监测模式(MRM),仪器参数及监测离子对如表1。所得神经递质标准品的多反应离子监测色谱图,如图3~图15。
表1仪器参数及监测离子对
绘制标准曲线:取“标准品溶液配制”项下的一系列标准工作液,采用外标法定量,以待测物峰面积为纵坐标(Y值),以待测物浓度为横坐标(X值),用加权(W=1/X)最小二乘法进行回归计算,得到相应的回归方程,见表2。S/N≥3确定检出限,S/N≥10确定定量限,其中S代表信号值,N代表噪声值。
表2神经递质的标准曲线
由表2可知,各神经递质的标准曲线在相应的线性范围内,待测物峰面积与待测物浓度线性关系良好。
精密度与准确度:取“标准品溶液配制”项下浓度为5、50、400ng/mL的低、中、高浓度分布的一系列标准工作液,每个浓度平行制备5份,进样分析;连续测定3天,代入当日的标准曲线方程,计算得到批间、批内精密度及准确度,结果见表3。
表3批间、批内精密度及准确度测试结果
由表3可知,生物样品中各个神经递质成分的低、中、高浓度的批内及批间精密度和准确度良好,待测样本的批内及批间精密度范围为0.06%~9.25%,待测样本的准确度范围为-8.80%~9.60%,均满足生物分析方法的要求。
基质效应:取“标准品溶液配制”项下浓度分别为5、50、400ng/mL的低、中、高三个浓度水平的溶剂标样,进样分析,记录峰面积A。
取适量的健康大鼠空白肌肉透析液稀释混合标准溶液母液,配制成含有5、50、400ng/mL的低、中、高三个浓度水平的基质标样,进样分析,记录峰面积B。
取收集到的健康大鼠空白肌肉透析液直接进样分析,记录峰面积C。
以上3种制备方法,每个浓度平行5份,计算得到13个神经递质的基质效应。基质效应(ME)的计算公式如下:
ME(%)=(B-C)/A×100%;
式中,B为基质标样的峰面积,C为空白样的峰面积,A为溶剂标样的峰面积。
所得基质效应结果如表4所示。
表4基质效应
从表4可以看出:13个神经递质的基质效应范围为75.62%~112.5%之间,RSD范围均小于15%,说明透析液对待测物没有明显干扰。
实施例2
本实施例的目的是利用建立的检测方法研究13个神经递质的体外探针回收率与神经递质浓度水平之间的关系。
采用林格氏液作为灌流液,选择1.0μL/min的灌流速度考察当浓度水平为5μg/mL、10μg/mL、20μg/mL时体外探针回收率(n=3),每30min收集一份样品。以上三种浓度水平的溶液样本由林格氏液直接稀释混标溶液获得。根据公式R=C
表5 13个神经递质的体外回收率
由表5和图16可以发现:不同浓度的神经递质的体外探针回收率基本一致,探针回收率与递质浓度没有明显相关性;除嘌呤类神经递质的回收率较低,ADO为(7.39±0.97)%,AMP为(4.24±0.66)%,ADP为(5.50±2.20)%,ATP为(5.97±0.88)%,其余类神经递质不同浓度的回收率均高于8.5%。
实施例3
本实施例3的目的是利用建立的检测方法研究针刺对大鼠外周肌肉内13种神经递质含量的影响。
针刺及肌肉组织透析取样:健康雄性大鼠5只,每只分别透析孔最穴,针刺天府、尺泽穴。以1.0μL/min的流速灌流林格氏液,灌流平衡60min后,分别取得针刺时、针刺后的肌肉组织透析液。
大鼠肌肉组织透析液两组间的含量结果见图17和图18。由图17和图18可知:与针刺时组相比,针刺后组中Glu、Asp、HA、ACh、Gly、γ-GABA、ADO、ADP、AMP及ATP的含量降低,但没有统计学差异;5-HIAA、Gln含量升高,且Gln具有统计学差异(P<0.05)。结果表明,肌肉外周神经系统中包括Gln、AMP、ADP等神经递质浓度水平要高于其他神经递质;大鼠针刺时与针刺后肌肉组织中的大部分神经递质发生了改变。
实施例4
采用林格氏液自制含有13种神经递质的透析液,其中,透析液中谷氨酸的浓度为14.71μg/mL;天冬氨酸的浓度为13.31μg/mL;5-羟色胺的浓度为17.62μg/mL;组胺的浓度为11.11μg/mL;乙酰胆碱的浓度为16.32μg/mL;甘氨酸的浓度为15.0μg/mL;5-羟吲哚乙酸的浓度为19.12μg/mL;谷氨酰胺的浓度为14.61μg/mL;γ-氨基丁酸的浓度为10.31μg/mL;腺苷的浓度为26.72μg/mL;单磷酸腺苷的浓度为34.72μg/mL;二磷酸腺苷的浓度为42.72μg/mL;三磷酸腺苷的浓度为50.72μg/mL。
将上述透析液样本富集在体积为10μL的定量环,每个样本的检测时间设为18min,其中富集时间为10min,质谱分析时间为8min。
所述超高液相色谱和质谱检测的参数同实施例1。
测得透析液中谷氨酸的浓度为15.12μg/mL,天冬氨酸的浓度为12.75μg/mL,5-羟色胺的浓度为18.01μg/mL;组胺的浓度为10.94μg/mL;乙酰胆碱的浓度为15.18μg/mL;甘氨酸的浓度为15.78μg/mL;5-羟吲哚乙酸的浓度为19.96μg/mL;谷氨酰胺的浓度为13.70μg/mL;γ-氨基丁酸的浓度为9.91μg/mL;腺苷的浓度为28.88μg/mL;单磷酸腺苷的浓度为35.97μg/mL;二磷酸腺苷的浓度为43.87μg/mL;三磷酸腺苷的浓度为48.79μg/mL。结果表明:本发明提供的检测方法的结果准确可靠。
应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
