一种病理分析前处理试剂及其制备方法和应用
文献发布时间:2024-05-31 01:29:11
技术领域
本发明涉及生物技术领域,具体的,涉及一种病理分析前处理试剂及其制备方法和应用。
背景技术
细胞样本是疾病诊断检测分析的重要来源,在从人体血液中捕获靶细胞样本时,目前可采用相关器械进行靶细胞的捕获,但是,捕获时除了靶细胞还会非特异性结合其他杂质,如血液中的蛋白、其他血液细胞等,在采用相关器械捕获靶细胞时,捕获高纯度的靶细胞是后续进行病理分析的前提,也对后续进行其他研究具有重要意义,目前的病理分析前处理剂还存在采用相关器械捕获靶细胞时清洗效果不理想的问题,这对细胞样本后续的病理分析结果将产生不良影响,因此,获得一种对细胞样本清洗效果好的病理分析前处理剂将对后续检测分析的灵敏度、准确性和重复性具有重要意义。
发明内容
本发明提出一种病理分析前处理试剂及其制备方法和应用,解决了相关技术中在捕获细胞样本时病理分析前处理剂存在清洗效果较差的问题。
本发明的技术方案如下:
本发明提出一种病理分析前处理试剂,包括以下组分:酰亚胺基聚合物、聚乙二醇单甲醚聚己内酯两嵌段共聚物、半胱氨酸、L-丙氨酸。
作为进一步的技术方案,每1L病理分析前处理试剂中包括酰亚胺基聚合物2~4g、聚乙二醇单甲醚聚己内酯两嵌段共聚物1~2.5g、半胱氨酸1~1.5g、L-丙氨酸0.5~1g。
作为进一步的技术方案,所述病理分析前处理试剂的pH值为7~9。
作为进一步的技术方案,所述pH值采用磷酸盐缓冲液、HEPES缓冲液中的一种进行调节。
作为进一步的技术方案,所述酰亚胺基聚合物包括聚琥珀酰亚胺和/或聚马来酰亚胺。
作为进一步的技术方案,所述每1L病理分析前处理试剂中还包括棕榈酰五肽1~2g。
作为进一步的技术方案,所述聚乙二醇单甲醚聚己内酯两嵌段共聚物包括第一共聚物和/或第二共聚物;所述第一共聚物为分子量800~1000的聚乙二醇单甲醚聚己内酯两嵌段共聚物;所述第二共聚物为分子量1500~3000的聚乙二醇单甲醚聚己内酯两嵌段共聚物。
作为进一步的技术方案,当所述聚乙二醇单甲醚聚己内酯两嵌段共聚物的组分包括第一共聚物和第二共聚物时,所述第一共聚物和第二共聚物的质量比为3:2~4:1。
本发明还提出所述的病理分析前处理试剂的制备方法,包括以下步骤:将病理分析前处理试剂的组分进行混合,调节pH至7~9,得到病理分析前处理试剂。
本发明还提出所述的病理分析前处理试剂或所述的制备方法制得的病理分析前处理试剂在捕获靶细胞样本上的应用。
本发明的工作原理及有益效果为:
1、本发明中,通过在病理分析前处理试剂中采用酰亚胺基聚合物和聚乙二醇单甲醚聚己内酯两嵌段共聚物,二者协同作用,在溶液中形成氢键减低细胞样本中非特异性杂质的吸附,显著提高了病理分析前处理试剂对细胞样本清洗效果。
2、本发明中,病理分析前处理试剂中还引入了棕榈酰五肽,形成水合层,与酰亚胺基聚合物和聚乙二醇单甲醚聚己内酯两嵌段共聚物共同作用来降低非特异性杂质的吸附,进一步提高了病理分析前处理试剂对细胞样本清洗效果。
3、本发明中,通过采用不同分子量的聚乙二醇单甲醚聚己内酯两嵌段共聚物,进一步提高了病理分析前处理试剂对细胞样本清洗效果。
4、本发明中,制得的病理分析前处理试剂还可用于肾移植后细胞样本的处理,后续进行C4和AMACR蛋白的检测。
附图说明
下面结合附图和具体实施方式对本发明作进一步详细的说明。
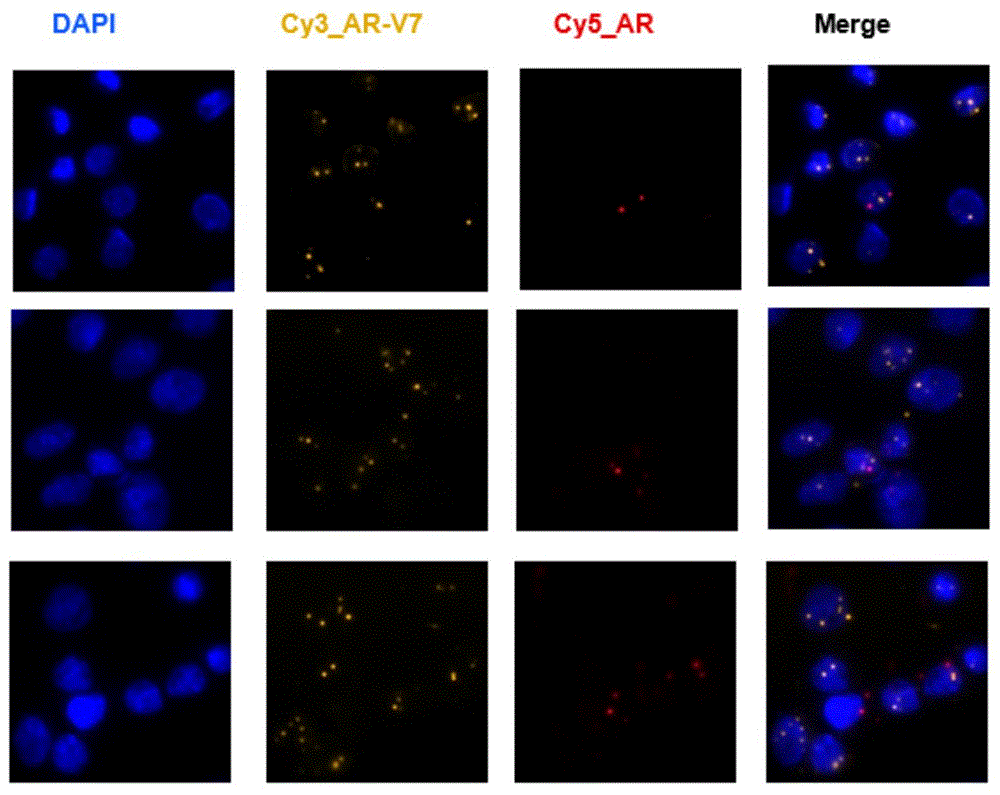
图1为经本发明实施例2制得的病理分析前处理试剂处理后的细胞在荧光显微镜下的AR-V7基因表达阳性细胞检测图;
图2为经本发明实施例2制得的病理分析前处理试剂处理后的细胞在荧光显微镜下的AR-V7基因表达阴性细胞检测图;
图3为经本发明实施例2制得的病理分析前处理试剂处理后的PSMA阳性细胞染色效果图;
图4为经本发明实施例2制得的病理分析前处理试剂处理后的PSMA阴性细胞染色效果图;
图5为经本发明实施例2制得的病理分析前处理试剂处理后的PSA阳性细胞染色效果图;
图6为经本发明实施例2制得的病理分析前处理试剂处理后的PSA阴性细胞染色效果图。
具体实施方式
下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都涉及本发明保护的范围。
下列实施例和对比例中,聚琥珀酰亚胺和聚马来酰亚胺的纯度均为99%,分子量均为3000;分子量为750、5000、1000、2000的聚乙二醇单甲醚聚己内酯两嵌段共聚物的货号分别对应JP0051-750、JP0051-5k、JP0051-1k、JP0051-2k;L-丙氨酸、半胱氨酸的纯度均为99%。
实施例1
病理分析前处理试剂,1L病理分析前处理试剂中含聚马来酰亚胺2g、分子量为750的聚乙二醇单甲醚聚己内酯两嵌段共聚物1g、半胱氨酸1g、L-丙氨酸0.5g、其余为水和磷酸盐缓冲液;
病理分析前处理试剂的制备方法,包括以下步骤:
将病理分析前处理试剂的组分进行混合,加入磷酸盐缓冲液调节pH至7,得到病理分析前处理试剂。
实施例2
病理分析前处理试剂,1L病理分析前处理试剂中含聚琥珀酰亚胺3g、分子量为750的聚乙二醇单甲醚聚己内酯两嵌段共聚物2g、半胱氨酸1g、L-丙氨酸0.8g、其余为水和HEPES缓冲液;
病理分析前处理试剂的制备方法,包括以下步骤:
将病理分析前处理试剂的组分进行混合,加入HEPES缓冲液调节pH至8,得到病理分析前处理试剂。
实施例3
病理分析前处理试剂,1L病理分析前处理试剂中含聚琥珀酰亚胺2g、聚马来酰亚胺2g、分子量为750的聚乙二醇单甲醚聚己内酯两嵌段共聚物2.5g、半胱氨酸1.5g、L-丙氨酸1g、其余为水和HEPES缓冲液;
病理分析前处理试剂的制备方法,包括以下步骤:
将病理分析前处理试剂的组分进行混合,加入HEPES缓冲液调节pH至9,得到病理分析前处理试剂。
实施例4
本实施例和实施例2的区别仅在于1L病理分析前处理试剂中还加入了棕榈酰五肽0.5g。
实施例5
本实施例和实施例2的区别仅在于1L病理分析前处理试剂中还加入了棕榈酰五肽3g。
实施例6
本实施例和实施例2的区别仅在于1L病理分析前处理试剂中还加入了棕榈酰五肽1g。
实施例7
本实施例和实施例2的区别仅在于1L病理分析前处理试剂中还加入了棕榈酰五肽2g。
实施例8
本实施例和实施例7的区别仅在于将分子量为750的聚乙二醇单甲醚聚己内酯两嵌段共聚物换为分子量为5000的聚乙二醇单甲醚聚己内酯两嵌段共聚物。
实施例9
本实施例和实施例7的区别仅在于将分子量为750的聚乙二醇单甲醚聚己内酯两嵌段共聚物换为分子量为1000的聚乙二醇单甲醚聚己内酯两嵌段共聚物。
实施例10
本实施例和实施例7的区别仅在于将分子量为750的聚乙二醇单甲醚聚己内酯两嵌段共聚物换为分子量为2000的聚乙二醇单甲醚聚己内酯两嵌段共聚物。
实施例11
本实施例和实施例10的区别仅在于1L病理分析前处理试剂中含聚琥珀酰亚胺3g、分子量为1000的聚乙二醇单甲醚聚己内酯两嵌段共聚物1g、分子量为2000的聚乙二醇单甲醚聚己内酯两嵌段共聚物1g、半胱氨酸1g、L-丙氨酸0.8g、其余为水和HEPES缓冲液。
实施例12
本实施例和实施例10的区别仅在于1L病理分析前处理试剂中含聚琥珀酰亚胺3g、分子量为1000的聚乙二醇单甲醚聚己内酯两嵌段共聚物1.8g、分子量为2000的聚乙二醇单甲醚聚己内酯两嵌段共聚物0.2g、半胱氨酸1g、L-丙氨酸0.8g、其余为水和HEPES缓冲液。
实施例13
本实施例和实施例10的区别仅在于1L病理分析前处理试剂中含聚琥珀酰亚胺3g、分子量为1000的聚乙二醇单甲醚聚己内酯两嵌段共聚物1.2g、分子量为2000的聚乙二醇单甲醚聚己内酯两嵌段共聚物0.8g、半胱氨酸1g、L-丙氨酸0.8g、其余为水和HEPES缓冲液。
实施例14
本实施例和实施例10的区别仅在于1L病理分析前处理试剂中含聚琥珀酰亚胺3g、分子量为1000的聚乙二醇单甲醚聚己内酯两嵌段共聚物1.6g、分子量为2000的聚乙二醇单甲醚聚己内酯两嵌段共聚物0.4g、半胱氨酸1g、L-丙氨酸0.8g、其余为水和HEPES缓冲液。
对比例1
本对比例和实施例2的区别仅在于1L病理分析前处理试剂中不加入聚琥珀酰亚胺,加入分子量为750的聚乙二醇单甲醚聚己内酯两嵌段共聚物5g。
对比例2
本对比例和实施例2的区别仅在于1L病理分析前处理试剂中不加入分子量为750的聚乙二醇单甲醚聚己内酯两嵌段共聚物,加入聚琥珀酰亚胺5g。
将捕获靶细胞样本的细胞采集器功能区分别浸于实施例1~14和对比例1~2所制得的病理分析前处理试剂中,左右及上下旋转5s,重复三次,按照GB2019《细胞纯度测定方法-流式细胞测定法》检测目标靶细胞的纯度后,计算目标靶细胞的纯度提升率,计算结果如下表所示;其中,目标靶细胞的纯度提升率=[(经病理分析前处理试剂处理的目标靶细胞纯度-经HEPES缓冲液处理的目标靶细胞纯度)/经HEPES缓冲液处理的目标靶细胞纯度]×100%。
通过对比实施例1~14和对比例1~2的数据发现,与对比例1~2相比,经实施例1~14所制得的病理分析前处理试剂处理的目标靶细胞的纯度提升率更高,说明通过在病理分析前处理试剂中采用酰亚胺基聚合物和聚乙二醇单甲醚聚己内酯两嵌段共聚物,二者协同作用,能显著提高病理分析前处理试剂对细胞样本清洗效果。
通过对比实施例2和实施例4~7的数据发现,与实施例2和实施例4~5相比,经实施例6~7所制得的病理分析前处理试剂处理的目标靶细胞的纯度提升率更高,说明病理分析前处理试剂中还引入1~2份的棕榈酰五肽,可进一步提高病理分析前处理试剂对细胞样本清洗效果。
通过对比实施例2和实施例8~10的数据发现,与实施例2和实施例8相比,经实施例9~10所制得的病理分析前处理试剂处理的目标靶细胞的纯度提升率更高,说明加入分子量800~1000的聚乙二醇单甲醚聚己内酯两嵌段共聚物或分子量1500~3000的聚乙二醇单甲醚聚己内酯两嵌段共聚物,可以进一步提高病理分析前处理试剂对细胞样本清洗效果。
通过对比实施例9~14的数据发现,与实施例9~12相比,经实施例13~14所制得的病理分析前处理试剂处理的目标靶细胞的纯度提升率更高,说明加入分子量800~1000的聚乙二醇单甲醚聚己内酯两嵌段共聚物和分子量1500~3000的聚乙二醇单甲醚聚己内酯两嵌段共聚物,可以进一步提高病理分析前处理试剂对细胞样本清洗效果;与实施例11~12相比,经实施例13~14所制得的病理分析前处理试剂处理的目标靶细胞的纯度提升率更高,说明当分子量800~1000的聚乙二醇单甲醚聚己内酯两嵌段共聚物和分子量1500~3000的聚乙二醇单甲醚聚己内酯两嵌段共聚物的质量比为3:2~4:1时,能进一步提高病理分析前处理试剂对细胞样本清洗效果。
将病理分析前处理试剂处理后的细胞用于AR-V7基因检测
检测方法步骤如下:
1、将前列腺癌细胞经实施例2制得的病理分析前处理试剂处理10分钟;
2、固定:采样针置于质量分数为3.7%的多聚甲醛中室温固定15min;
3、清洗:PBST中室温清洗5min;
4、透化:0.1M HCl-DEPC-H
5、清洗:PBST中室温清洗2次,5min/次;
6、反转录:将样本置于反转录体系中,45℃反应3h;
7、Padlock探针连接:将样本置于Padlock探针连接体系中,恒温孵育箱中37℃孵育30min,45℃孵育45min;
8、滚环扩增:将样本置于滚环扩增体系中,室温过夜;
9、检测探针杂交:将样本置于检测探针杂交体系中,恒温孵育箱中37℃孵育30min;
10、在荧光显微镜下观察AR-V7基因表达情况如图1~2所示,其中,图1为AR-V7基因表达阳性细胞检测结果,图2为AR-V7基因表达阴性细胞检测结果。
从图1和图2可以看出,经实施例2制得的病理分析前处理试剂处理后的细胞样本,在进行后续AR-V7基因过程中,可实现对靶基因高灵敏度、高特异性的检出,并且可明显区分AR-V7基因阳性细胞和阴性细胞。
将病理分析前处理试剂处理后的细胞用于细胞蛋白的免疫荧光染色
细胞PSMA蛋白的免疫荧光染色,检测方法步骤如下:
1、将前列腺癌细胞经实施例2制得的病理分析前处理试剂处理10分钟;
2、用磷酸盐缓冲液清洗5分钟;
3、向细胞样本中加入质量分数为3%的BSA溶液封闭30分钟;
4、向细胞样本中加入荧光标记抗体溶液,室温孵育60分钟;
5、用磷酸盐缓冲液清洗5分钟;
6、向细胞样本中加入Hoechst核染液,室温孵育10分钟;
7、在荧光显微镜下观察染色情况如图3~4所示,其中,图3为PSMA阳性细胞染色效果图,图4为PSMA阴性细胞染色效果图。
从图3和图4可以看出,经过病理分析前处理试剂处理后的细胞样本,在进行后续蛋白染色过程中,细胞蛋白染色效果好,可明显区分PSMA阳性细胞和阴性细胞,且不存在非特异性吸附。
细胞PSA蛋白的免疫荧光染色,检测方法步骤如下:
1、将前列腺癌细胞经病理分析前处理试剂处理10分钟;
2、用磷酸盐缓冲液清洗5分钟;
3、向细胞样本中加入质量分数为3%的BSA溶液封闭30分钟;
4、向细胞样本中加入荧光标记抗体溶液,室温孵育60分钟;
5、用磷酸盐缓冲液清洗5分钟;
6、向细胞样本中加入Hoechst核染液,室温孵育10分钟;
7、在荧光显微镜下观察染色情况如图5~6所示,其中,图5为PSA阳性细胞染色效果图,图6为PSA阴性细胞染色效果图。
从图5和图6可以看出,经过病理分析前处理试剂处理后的细胞样本,在进行后续蛋白染色过程中,细胞蛋白染色效果好,可明显区分PSA阳性细胞和阴性细胞,且不存在非特异性吸附。
以上仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 一种改良的QuChERS方法茶叶前处理试剂盒及前处理工艺
- 一种有机试剂中微量水分析荧光试纸条的制备方法与应用
- 一种病理分析前的生物组织复合脱水处理试剂
- 一种前处理试剂的制备方法、前处理试剂及前处理方法
