评估气道上皮细胞中的多信号传导途径活性评分以预测气道上皮异常和气道癌风险
文献发布时间:2023-06-19 13:46:35
技术领域
本文所描述的主题主要涉及生物信息学、基因组处理领域、蛋白质组处理领域和相关领域。更特别地,本发明涉及一种用于确定对象是否具有异常气道上皮的计算机实施的方法,并且涉及一种用于确定指示具有异常气道上皮的对象将形成气道癌的风险的风险评分的计算机实施的方法。本发明还涉及一种装置、非瞬态存储介质和计算机程序,用于确定指示对象是否具有异常气道上皮的气道异常因子或指示具有异常气道上皮的对象将形成气道癌的风险的风险评分。本发明还涉及一种用于确定指示对象是否具有异常气道上皮的气道异常因子或用于确定指示具有异常气道上皮的对象将形成气道癌的风险的风险评分的试剂盒以及一种在对应诊断或预测方法中使用的试剂盒。气道异常因子和风险评分是基于信号传导途径活性的组合来确定的。
背景技术
肺癌是一种具有不良预后的致命疾病,并且是世界范围内癌症死亡的主要原因。大多数患者在晚期被诊断,并且5年生存率仅为18.6%。因此,早期检测和及时诊断、分期和处置在肺癌护理中必不可少。筛查程序针对肺癌的早期检测,有时针对高危人群,旨在通过在早期阶段安置治疗来改进临床结果。正在实施对高危群体的低剂量CT(LDCT)筛查,其中,筛查资格主要基于吸烟史。然而,LDCT筛查的缺点之一是相对高的假阳性率(NLSTResearch Team.N Engl J Med;368:1980-1991(2013)),以及在重复筛查流程的情况下暴露于累积辐射剂量。阳性CT发现需要额外的后续,使用潜在不必要的活检流程来获得病理学确认-关于针对手头患者的相关联的健康风险。取决于肿瘤的位置,获得用于诊断/亚型分型目的的肿瘤样本可能是困难的。因此,需要具有更高灵敏度/特异性且无辐射暴露的肺癌的早期检测的测试。还需要为后续下一步成像分析识别高危群体的微创测试,以减少不必要的CT扫描和随之发生的假阳性的数量。而且,如果在例如CT扫描上发现结节,则需要做出关于需要进行活检以使能病理诊断的决定。这是侵入性和危险的流程。因此,需要通过提供关于所识别的结节的可能原因(即良性或恶性)的补充证据来帮助做出该决定的方法。
最常见的类型的肺癌是非小细胞肺癌(NSCLC),其中最常见的亚型是腺癌(40%)和鳞状细胞癌(30%)。吸烟占所有肺癌的大约85%。粗略在5%与15%之间的吸烟者将形成肺癌。与(重度)吸烟相关联的COPD患者会以增加的风险形成肺癌(Oncotarget.2017Sep29;8(44):78044–78056;Lung Cancer.2015 Nov;90(2):121–127;Respiration.2011;81(4):265-84)。
烟草暴露是引起恶变前变化的重要因子。绝大多数肺癌与吸烟相关联,尽管15%发生在从不吸烟者中。特别是大量吸烟与肺癌风险增加相关联,特别是鳞状细胞和小细胞类型的肺癌,但也有其他组织病理学癌症类型。
在从不吸烟者中,腺癌是主要亚型,并且从不吸烟者中的鳞状细胞癌很少见。腺癌常常具有外周或支气管内起源,而鳞状细胞癌通常发生在气管或近端气道中。
烟草暴露引起对气道上皮细胞的应激,并且可能导致吸烟引起的损伤,其需要上皮再生和修复。吸烟干扰在这些过程中涉及的信号传导途径,这可能促进致瘤性。
通常,恶变前病变(例如结肠腺瘤,但也有在气道上皮中)特征在于增加增殖,反映在诸如PI3K途径的某些信号转导途径的异常活性中(Clin Cancer Res.2018 Jul 1;24(13):2984-2992;Sci Transl Med.2010 Apr 7;2(26):26ra25。异常增殖可以通过一个或多个生长因子途径的活性来实现,如PI3K途径或MAPK-AP1或JAK-STAT途径,例如与正常细胞中抑制/控制细胞增殖的途径活性的丧失相关联,如TGF-β或Notch途径。在向癌症演变期间,由于增加数量的基因组突变和/或染色体畸变,能够动员其他致癌信号转导途径或失去更多控制途径。因此,恶变前病变可能与最终的癌症共享一些通路活性特征,但不一定全部。也许出于该原因,关于信号转导途径在(肺)癌形成中的角色和吸烟对途径活性的干扰知之甚少。
从大或小气道获得上皮样本以用于分析:对来自气道的上皮衬里的样本进行分析可能提供关于恶变前变化的信息,或者在例如CT扫描上看到可疑结节的情况下提供额外的诊断信息。
肺癌形成在较大气道(从气管分支出来的支气管)或小气道上皮中。使用如气道刷洗或支气管肺泡灌洗的技术,可以以相对非侵入性的方式从上气道和下气道获得上皮细胞以用于分子分析。这提供了一种潜在手段来识别个体,即吸烟者,其在他们的气道上皮中具有异常的致癌信号传导途径活性,这指示气道上皮的早期增殖变化,并且可能处于形成肺癌的增加的风险中。COPD患者通常是慢性重度吸烟者并且构成形成肺癌的高危人群。
异常信号转导途径活性当被识别时原则上可以通过靶向特定信号传导途径的靶向药物进行调节,例如由PI3K途径抑制剂阻断(W Verhaegh等人的Cancer research,2014年;74(11):2936-45;A van de Stolpe等人的Scientific Reports,2019;9(1603);vanOoijen,Am J Pathol,2018,188(9):1956-1972)。这开启了一个选择,即恶变前气道上皮病变在临床上是可行动的,并且在气道上皮的局部处置后可以逆转或消除异常。
因此,高度需要一种检测气道上皮中指示异常上皮的早期变化并且依据畸变信号传导途径活性表征异常的方法。该方法被预期用于识别肺癌的高危个体,并且为识别的肺结节的恶性与良性特征提供额外的证据,并且指示哪种治疗可以有用于处置所识别的病变或相关联的肺癌。
发明内容
根据本发明的第一方面,上述问题通过由数字处理设备执行的用于确定对象是否具有异常气道上皮的计算机实施的方法来解决,其中,所述确定包括:基于从所述对象的气道导出的上皮细胞样本中的细胞信号传导途径的活性的组合来确定指示所述对象是否具有异常气道上皮的气道异常因子,其中,所述细胞信号传导途径包括选自包括以下各项的组的两个或更多个细胞信号传导途径:TGF-β途径、PI3K-FOXO途径和Notch途径,其中,对所述信号传导途径异常因子的所述确定还基于相应细胞信号传导途径的参考活性,其中,所述参考活性反映在健康对象的气道上皮中发现的所述相应细胞信号传导途径的活性。额外的细胞信号传导途径可以任选地包括在本发明的方法中。在一个实施例中,该方法还包括出于本文所公开的各种用途中的任何一个的目的提供气道异常因子,诸如确定指示具有异常气道上皮的对象将形成气道癌的风险的风险评分,定义在其之后应重复该方法的间隔,推荐要执行的补充诊断,推荐处置等。
根据本发明的第二方面,该问题通过一种用于确定风险评分的计算机实施的方法来解决,所述风险评分指示具有异常气道上皮的对象将形成气道癌的风险,所述计算机实施的方法由数字处理设备执行,其中,所述确定包括:基于从所述对象的气道导出的上皮细胞样本中的细胞信号传导途径的活性的组合来确定所述风险评分,其中,所述细胞信号传导途径分析包括选自包括以下各项的组的两个或更多个细胞信号传导途径:TGF-β途径、PI3K-FOXO途径和Notch途径,其中,对所述风险评分的所述确定还基于所述细胞信号传导途径的参考活性的组合,并且其中,所述风险评分被定义为使得所指示的风险随着所述TGF-β途径相对于所述细胞信号传导途径的所述参考活性的降低的活性和以下各项中的一项或多项而增加:所述PI3K途径相对于所述细胞信号传导途径的所述参考活性的增加的活性和/或所述Notch途径相对于所述细胞信号传导途径的所述参考活性的降低的活性。在一个实施例中,该方法还包括出于本文所公开的各种用途中的任何一个的目的提供风险评分,诸如定义在其之后应重复该方法的间隔,推荐要执行的补充诊断方法、推荐处置等。
本发明基于发明人的创新,即信号转导途径活性的分析可以被用于表征甚至在向恶性气道癌发展中发挥作用的气道上皮的恶变前机会。发明人发现,可以通过测量某些信号传导途径的活性并组合评价测量的活性来评估恶性和恶变前机会的存在或缺失。发明人首次提供了在确定气道上皮是否异常和/或异常气道上皮是否表征处于形成气道癌的风险中的对象中相关途径活性如何彼此相关的见解。
本发明已经通过集中研究属于包括健康非吸烟者、轻度吸烟者和重度吸烟者的不同组的对象的气道上皮细胞中的信号传导途径(特别是TGF-β、PI3K-FOXO、Notch途径)的活性来完成。随后,计算模型已经被开发用于解释测量的途径活性,以便确定可以通过信号传导途径异常因子来指示的与正常途径活性的异常偏差,并且提供具有气道上皮的未知特征的对象的气道异常因子和/或风险评分。在该模型中,信号传导途径的组合活性被用作表征对象具有异常气道上皮和/或处于形成气道癌的风险中的可能性的指示器(生物标记)。
作为优点,本发明促进在疾病的早期阶段识别处于形成癌症的风险中的对象,并且因此启用比现有方法更好的处理选择。应预期,使用该方法将减少不必要的CT扫描的数量,从而减少不必要的侵入性诊断流程和暴露于有害辐射的数量。肺癌发展是多步骤过程,其中,正常肺上皮细胞积累遗传异常并变换为恶性表型。本发明的方法具有帮助检测早期(恶变前)变化的巨大潜力,该变化最终将在后期转变为恶性机会,并且在此背景下可以适用于各种临床情形。在气道癌可检测之前,本发明的方法可以被用于对可以受益于筛查或初级化学预防或局部处置以阻止进展或逆转病变至正常的群体的风险评估和识别。此外,如所提及的,本发明的方法可以被用于在进展为侵入性肺癌之前检测恶变前或早期阶段的肺癌。本发明的方法可以帮助选择用于密切CT监测和次级化学预防的个体。此外,本发明的方法对于在CT图像上发现的良性和恶性结节之间进行区分和帮助预测可能具有价值。最后,一些活检流程可能具有有限的灵敏度,并且因此并不总是导致诊断的建立。例如,支气管镜检查能够常常是非诊断性的,这要求额外的侵入性测试。预期这样的已知的诊断测试与本发明的方法的组合显著改进它们的诊断性能。在例如在CT扫描上发现非诊断性结节的情况下,该方法将有助于将结节分类为恶性或良性。
如本文所使用的,术语“对象”是指任何生物。在一些实施例中,所述对象是动物,优选地哺乳动物。在某些实施例中,所述对象是人类,诸如医学对象。尽管本发明的方法的适用性不限于特定的对象组,但是将显而易见,属于高风险组(诸如吸烟者或COPD)的对象受益于本发明的大部分。因此,优选的是,要诊断的对象是吸烟者,特别是烟民,或经常暴露于或已经经常暴露于烟雾的对象,例如与吸烟者住在同一家庭的对象。优选定义要诊断的对象的其他风险因子包括暴露于氡、石棉、砷、柴油机尾气、二氧化硅和铬。本发明的方法可以有利地重复应用,特别是以规律的间隔重复应用,使得可以尽可能早检测到气道上皮的恶变前变化。
根据本发明的要使用的上皮细胞样本可以是提取的样本,即已经从所述对象提取的样本。所述样本的范例包括但不限于上皮细胞、包含来自所述对象的气道的上皮细胞的组织和/或体液。所述上皮细胞样本也可以是包括上皮细胞的祖细胞和/或干细胞的样本,诸如构成受损上皮再生所需的干细胞/祖细胞的基底细胞(BC)。相应样本可以例如通过支气管肺泡灌洗、刷洗、活检等从所述对象的上气道或下气道获得。如本文所使用的,术语“样本”还涵盖以下情况:例如,其中,细胞、组织和/或体液已经从所述对象获取,并且例如已经被置于显微镜载玻片或固定剂上,并且其中,为了执行请求保护的方法,例如借助于激光捕获显微切割(LCM)或通过冲压或通过从载玻片上刮下感兴趣细胞或通过荧光激活细胞分类技术提取了该样本的部分。此外,如本文所使用的,术语“样本”还涵盖以下情况:其中,例如,细胞、组织和/或体液已经从所述对象取得并且已经置于显微镜载玻片上,并且在所述载玻片上执行要求保护的方法。
如本文所使用的,术语“上气道”包括鼻腔、咽(包括鼻咽、口咽和咽喉)和喉。如本文所使用的,术语“下气道”包括气管和肺(包括初级支气管和细支气管)。
术语“途径”、“信号转导途径”、“信号传导途径”和“细胞信号传导途径”在本文中可交换地使用。
“信号传导途径的活性”可以是指样本中的信号传导途径相关联转录因子(TF)元素的活性,TF元素在驱动靶基因表达时控制靶基因的转录,即,靶基因被转录的速度,例如在高活性(即,高速度)或低活性(即,低速度)方面,或者与这样的活性(例如,速度)有关的其他维度,诸如水平、值等。因此,出于本发明的目的,如本文所使用的,术语“活性”还意指在如本文所描述的“途径分析”期间可以作为中间结果获得的活性水平。
如本文所使用的,术语“转录因子元素”(TF元素)优选地指代有效转录因子的中间或前体蛋白质或蛋白质复合物,或者控制指定靶基因表达的有效转录因子蛋白质或蛋白质复合物。例如,蛋白质复合物可以至少包含相应信号传导途径蛋白质之一的细胞内域,以及一个或多个辅助因子,从而控制靶基因的转录。优选地,术语指代由导致细胞内域的相应信号传导途径蛋白质之一的分裂触发的蛋白质或蛋白质复合物转录因子。
如本文所使用的,术语“靶基因”意指其转录由相应转录因子元素直接或间接控制的基因。所述“靶基因”可以是“直接靶基因”和/或“间接靶基因”(如本文所描述的)。
如本文所使用的,术语“异常”和“异常性”指代分配给对象、细胞或细胞样本的特性,其被认为是罕见的、功能失调的、功能失常的或恶性的,并且特别表征对象、细胞或细胞样本的“恶变前”变化。异常(恶变前)特性的诊断可能指示对象处于朝向恶性气道癌演变的风险中。出于本发明的目的,如果已经基于如本文所公开的相应途径活性确定对象、细胞或细胞样本偏离相应参考途径活性,则对象、细胞或细胞样本特别地被认为是异常的。所述参考途径活性特别是可以在健康(即正常)对象、来自健康对象的细胞或包括来自健康对象的细胞的样本中发现的那些途径活性。如果尚未知道,参考途径活性可以通过如本文所公开的途径分析使用一个或多个健康对象的上皮细胞样本凭经验确定。优选地,评估来自多个健康对象的样本以考虑自然途径活性变化。
据此,本发明的实施例是,气道异常因子和/或风险评分的确定还基于信号传导途径的参考活性的相应组合。类似地,信号传导途径异常因子的确定还可以基于相应信号传导途径的参考活性。参考活性反映在健康对象的气道上皮中发现的相应信号传导途径的活性。
通过将参考途径活性中每个与要诊断的对象中的相应途径活性中每个进行比较,可以确定用于相应途径中每个的信号传导途径异常因子。所述信号传导途径异常因子指示相应途径的活性是否偏离(异常)于相应途径的参考活性。然后可以将所述信号传导途径异常因子转变为气道异常因子。所述气道异常因子也可以直接从途径活性的组合计算。所述气道异常因子可以被认为是多途径评分MPS,并且指代对象具有异常气道上皮的可能性。相应地,“气道异常因子”,本文也称为“气道途径异常评分”(APAS)或具体称为“小气道途径异常评分”(SAPAS)或“大气道途径异常评分”(LAPAS),是指将途径活性的组合与对象具有异常(例如小或大)气道上皮的可能性相关的尺度,例如水平或值。
如本文所使用的,术语“气道癌”是指气道的恶性肿瘤,在本文背景下尤其是指在你吸烟时风险增加的癌症类型。所述方法可广泛适用于这些癌症类型,特别是当它们源自上皮细胞时。本发明集中于源自所述气道的上皮细胞的癌症。这样的癌症的非限制性范例包括气管癌、支气管癌、上气道癌(包括鼻癌、口腔癌、喉癌等)、肺癌、肺癌亚型,包括非小细胞肺癌(NSCLC)和小细胞肺癌,组织学亚型,诸如鳞状肺癌、腺鳞癌、大细胞癌、肉瘤样癌和肺腺癌。可以通过将参考途径活性中每个与要诊断的对象的上皮细胞样本中的相应途径活性中每个进行比较来确定所述风险评分。所述风险评分可以被认为是多途径评分MPS,并且指代对象将形成气道癌的可能性。因此,“风险评分”是指将途径活性的组合与所述对象将形成气道癌的可能性相关的维度,例如水平或值。
所述气道异常因子和/或风险因子基于“细胞信号传导途径的活性的组合”。这意指所述气道异常因子和/或风险因子受两个或更多个细胞信号传导途径的活性影响。可以通过如本文所描述的数学模型推断和/或组合两个或更多个细胞信号传导途径的活性。在优选的实施例中,所述气道异常因子和/或风险评分基于信号传导途径活性的组合,包括超过2个细胞信号传导途径的活性。信号传导途径活性的这样的组合可以包括3或4个、或甚至多于4个(诸如5、6、7或8个)或甚至更多个不同信号传导途径的活性。
通常,可以设计许多不同的公式来确定基于对象中的两个或更多个细胞信号传导途径的活性的组合的气道异常因子和/或风险评分,即:
MPS=F(Pi)+X,其中,i=1...N,
其中,MPS指代气道异常因子和/或风险评分(术语“MPS”在本文中用作“多途径评分”的缩写,以便指代风险评分受两个或更多个细胞信号传导途径的活性影响),Pi指代细胞信号传导途径i的活性,N指代用于计算气道异常因子和/或风险评分的细胞信号传导途径的总数,并且X是可能进入等式的可能其他因子和/或参数的占位符。这样的公式可以更特别地是给定变量中的某个次数的多项式,或者变量的线性组合。这样的多项式中的加权系数和幂可以基于专家知识来设定,但通常使用具有已知标准数据的训练数据集(例如,生存数据)来获得对上述公式的加权系数和幂的估计。所述活性可以使用上述公式组合,并且将随后生成MPS。接下来,可以优化评分函数的加权系数和幂,使得高MPS与所述患者将具有异常气道上皮和/或将形成气道癌的更高概率相关,反之亦然。可以使用多种分析技术来做出优化所述评分函数与已知数据的相关性,例如Cox比例风险测试(如本文优选使用的)、对数秩测试、与标准优化技术结合的Kaplan-Meier估计器,诸如梯度下降或手动适应等。
根据本发明的优选实施例,所述气道异常因子和所述风险评分分别基于评价经校准的数学模型来确定,该数学模型将所述上皮细胞样本中的信号传导途径的活性与所述气道异常因子和所述风险评分相关。可以对该模型进行编程以解释途径活性的组合,以便确定要诊断的对象的气道异常因子和/或风险评分。特别地,所述气道异常因子和/或所述风险评分的确定包括(i)接收要诊断的对象的上皮细胞样本中的相应信号传导途径的活性,(ii)确定所述对象的气道异常因子和/或风险评分,所述确定基于评价将相应信号传导途径的活性与气道异常因子和/或风险评分相关的经校准的数学模型。
经校准的数学途径模型优选地是质心或线性模型、或基于条件概率的贝叶斯网络模型。例如,经校准的数学途径模型可以是概率模型,优选地基于与气道异常因子和/或风险评分和信号传导途径的活性相关的条件概率的贝叶斯网络模型,或经校准的数学途径模型可以基于信号传导途径的活性的一个或多个线性组合。
根据所述数学模型,所述信号传导途径的活性被解释为提供所述气道异常因子,其还可以转变为风险评分,或被解释为直接提供风险评分。所述气道异常因子和风险评分预测或提供对象具有异常气道上皮和/或对象处于形成气道癌的风险中的概率。
因此,所述风险评分的确定可以包括基于所述上皮细胞样本中的细胞信号传导途径的活性的组合确定气道异常因子并且将所述气道异常因子转变为风险评分。所述气道异常因子的确定可以包括基于所述上皮细胞样本中的相应细胞信号传导途径的活性来确定相应细胞信号传导途径中的每个的信号传导途径异常因子和基于所确定的信号传导途径异常因子的组合来确定所述气道异常因子。
根据本发明的优选实施例,通过如本文所描述的途径分析确定或可确定相应信号传导途径的活性。
基于推断来自与相应信号传导途径相关联的转录因子的良好验证的直接靶基因的mRNA水平的测量结果的信号转导途径的活性,途径分析使能上皮细胞中的信号转导途径活性的定量测量(参见例如W Verhaegh等人,2014,上述;W Verhaegh、A van de Stolpe、Oncotarget、2014,5(14):5196)。
优选地,确定所述信号传导途径的活性、多种途径活性的组合及其应用例如在以下文件中描述被执行,其中每个出于确定相应信号传导途径的活性的目的以其整体并入本文:公布的国际专利申请WO2013011479(题为“ASSESSMENT OF CELLULAR SIGNALINGPATHWAY ACTIVITY USING PROBABILISTIC MODELING OF TARGET GENE EXPRESSION”)、WO2014102668(题为“ASSESSMENT OF CELLULAR SIGNALING PATHWAY ACTIVITY USINGLINEAR COMBINATION(S)OF TARGET GENE EXPRESSION”)、WO2015101635(“题为ASSESSMENTOF THE PI3K CELLULAR SIGNALING PATHWAY ACTIVITY USING MATHEMATICAL MODELLINGOF TARGET GENE EXPRESSION”)、WO2016062891(题为“ASSESSMENT OF TGF-βCELLULARSIGNALING PATHWAY ACTIVITY USING MATHEMATICAL MODELLING OF TARGET GENEEXPRESSION”)、WO2017029215(题为“ASSESSMENT OF NFKB CELLULAR SIGNALING PATHWAYACTIVITY USING MATHEMATICAL MODELLING OF TARGET GENE EXPRESSION”)、WO2014174003(题为“MEDICAL PROGNOSIS AND PREDICTION OF TREATMENT RESPONSEUSING MULTIPLE CELLULAR SIGNALLING PATHWAY ACTIVITIES”)、WO2016062892(题为“MEDICAL PROGNOSIS AND PREDICTION OF TREATMENT RESPONSE USING MULTIPLECELLULAR SIGNALING PATHWAY ACTIVITIES”)、WO2016062893(题为“MEDICAL PROGNOSISAND PREDICTION OF TREATMENT RESPONSE USING MULTIPLE CELLULAR SIGNALINGPATHWAY ACTIVITIES”),WO2018096076(题为“Method to distinguish tumorsuppressive FOXO activity from oxidative stress”),以及在以下专利申请中:EP16200697.7(于2016年11月25日提交;题为“Method to distinguish tumorsuppressive FOXO activity from oxidative stress”)、EP17194288.1(于2017年10月2日提交;题为“Assessment of Notch cellular signaling pathway activity usingmathematical modelling of target gene expression”)、EP17194291.5(于2017年10月2日提交;题为“Assessment of JAK-STAT1/2cellular signaling pathway activityusing mathematical modelling of target gene expression”)、EP17194293.1(于2017年10月2日提交;题为“Assessment of JAK-STAT3 cellular signaling pathwayactivity using mathematical modelling of target gene expression”)和EP17209053.2(于2017年12月20日提交,题为“Assessment of MAPK-AP1 cellularsignaling pathway activity using mathematical modelling of target geneexpression”),PCT/EP2018/076232(于2018年9月27日提交,题为“Assessment of JAK-STAT3 cellular signaling pathway activity using mathematical modelling oftarget gene expression”),PCT/EP2018/076334(于2018年9月27日提交,题为“Assessment of JAK-STAT1/2 cellular signaling pathway activity usingmathematical modelling of target gene expression”),PCT/EP2018/076488(于2018年9月28日提交,题为“Assessment of Notch cellular signaling pathway activityusing mathematical modelling of target gene expression”),PCT/EP2018/076513(于2018年9月28日提交,题为“Assessment of MAPK-AP-1 cellular signaling pathwayactivity using mathematical modelling of target gene expression”),PCT/EP2018/076614(于2018年10月1日提交,题为“Determining functional status of immune cellstypes and immune response”)。
模型已经针对若干细胞类型上的ER、AR、PI3K-FOXO、HH、Notch、TGF-β、Wnt、NFkB、JAK-STAT1/2、JAK-STAT3和MAPK-AP1途径在生物学上验证。应注意,尚未公布的专利申请中采集的数学模型以及这些申请中的这些模型的校准和用途通常对应于已经公布的专利申请中公开的模型、校准和使用。
已经识别了优选分析其表达水平的独特的细胞信号传导途径靶基因集。为了在数学模型中使用,可以分析来自每个评估的细胞信号传导途径的三个或更多个,例如三、四、五、六、七、八、九、十、十一、十二或更多个靶基因以确定途径活性。
与用于确定如本文所公开的不同信号传导途径的活性的途径分析方法共有的是优选地在本文中出于本发明的目的应用的概念,其中,存在于样本中的细胞(诸如上皮细胞)中的信号传导途径的活性是通过接收信号传导途径的一个或多个(优选地三个或更多个)靶基因的表达水平,确定样本中的信号传导途径相关联转录因子(TF)元素的活性水平而可确定的,TF元素控制三个或更多个靶基因的转录,确定基于评价将一个或多个(优选地三个或更多个)靶基因的表达水平与信号传导途径的活性水平相关的经校准的数学途径模型,并且任选地基于信号传导途径相关联TF元素的所确定的活性水平来推断上皮细胞中的信号传导途径的活性。如本文所描述的,所述活性水平可以直接用作确定气道异常因子和/或风险评分的输入,这也是由本发明预期的。
如本文所使用的,术语TF元素的“活性水平”指代关于其靶基因的转录的TF元素的活性的水平。
经校准的数学途径模型可以是基于涉及信号传导途径相关联TF元素的活性水平和三个或更多个靶基因的表达水平的条件概率的概率模型,优选地贝叶斯网络模型,或者经校准的数学途径模型可以基于三个或更多个靶基因的表达水平的一个或多个线性组合。出于本发明的目的,经校准的数学途径模型优选地是质心或线性模型或者基于条件概率的贝叶斯网络模型。
特别地,所述表达水平的确定并且任选地所述对象中的信号传导途径的活性的推断可以例如通过尤其以下各项执行:(i)评价经校准的概率途径模型的部分,优选地贝叶斯网络,其表示用于一组输入的细胞信号传导途径,包括在所述对象的样本中测量的细胞信号传导途径的三个或更多个靶基因的表达水平;(ii)估计信号传导途径相关联转录因子(TF)元素的对象中的活性水平,所述信号传导途径相关联TF元素控制细胞信号传导途径的三个或更多个靶基因的转录,所述估计基于涉及信号传导途径相关联TF元素的活性水平和在所述对象的样本中测量的细胞信号传导途径的三个或更多个靶基因的表达水平的条件概率;以及任选地(iii)基于所述对象的样本中的信号传导途径相关联TF元素的估计活性水平来推断所述细胞信号传导途径的活性。这在公布的国际专利申请WO 2013/011479 A2(“Assessment of cellular signaling pathway activity using probabilisticmodeling of target gene expression”)中详细描述,通过引用将其内容整体并入本文。
在示范性备选方案中,表达水平的确定并且任选地所述对象中的细胞信号传导途径的活性的推断可以通过尤其以下各项执行:(i)确定所述对象的样本中的信号传导途径相关联转录因子(TF)元素的活性水平,所述信号传导途径相关联TF元素控制所述细胞信号传导途径的三个或更多个靶基因的转录,所述确定基于评价涉及所述细胞信号传导途径的三个或更多个靶基因的表达水平和所述信号传导途径相关联TF元素的活性水平的经校准的数学途径模型,所述数学途径模型基于所述三个或更多个靶基因的表达水平的一个或多个线性组合;以及任选地(ii)基于所述对象的样本中的信号传导途径相关联TF元素的所确定的活性水平来推断所述对象中的细胞信号传导途径的活性。这在公布的国际专利申请WO2014/102668 A2(“Assessment of cellular signaling pathway activity usinglinear combination(s)of target gene expressions”)中详细描述。
关于使用靶基因表达的数学建模推断细胞信号传导途径活性的另外的细节可以在W Verhaegh等人(2014,上述)中找到。
在实施例中,信号传导途径测量使用qPCR、多个qPCR、复用qPCR、ddPCR、RNAseq、RNA表达阵列或质谱分析执行。例如,可以使用基因表达微阵列数据,例如,Affymetrix微阵列或RNA测序方法,如Illumina定序器。
本发明集中于TGF-β途径、PI3K-FOXO途径、Notch途径和/或HH途径。根据本发明的优选实施例,信号传导途径包括所述TGF-β途径和PI3K-FOXO途径和Notch途径中的一个或多个,优选地TGF-β途径和至少PI3K-FOXO途径。
根据本发明的优选实施例,所述风险评分被定义为使得所指示的风险随着TGF-β途径的降低的活性和PI3K途径的增加的活性、Notch途径的降低活性而增加。类似地,所述气道异常因子优选地被定义为使得所指示的因子反映随着TGF-β途径的降低的活性和PI3K途径的增加的活性和/或Notch途径的降低的活性而与法线的增加的偏差。增加和/或降低优选地是单调增加和/或单调降低。TGF-β途径的降低的活性和PI3K途径的增加活性、Notch途径的降低的活性中的一项或多项优选地相对于参考细胞信号传导途径活性。
根据本发明的优选实施例及其各种实施例,三个或更多个TGF-β靶基因选自包括以下各项的组:ANGPTL4、CDC42EP3、CDKN1A、CTGF、GADD45A、GADD45B、HMGA2、ID1、IL11、JUNB、PDGFB、PTHLH、SERPINE1、SGK1、SKIL、SMAD4、SMAD5、SMAD6、SMAD7、SNAI2、VEGFA,更优选地选自包括以下各项的组:ANGPTL4、CDC42EP3、CDKN1A、CTGF、GADD45B、ID1、IL11、JUNB、SERPINE1、PDGFB、SKIL、SMAD7、SNAI2和VEGFA,最优选地选自包括以下各项的组:ANGPTL4、CDC42EP3、ID1、IL11、JUNB、SERPINE1、SKIL和SMAD7。
根据本发明的优选实施例及其各种实施例,三个或更多个PI3K-FOXO靶基因选自包括以下各项的组:AGRP、BCL2L11、BCL6、BNIP3、BTG1、CAT、CAV1、CCND1、CCND2、CCNG2、CDKN1A、CDKN1B、ESR1、FASLG、FBXO32、GADD45A、INSR、MXI1、NOS3、PCK1、POMC、PPARGC1A、PRDX3、RBL2、SOD2、TNFSF10,优选地选自包括以下各项的组:FBXO32、BCL2L11、SOD2、TNFSF10、BCL6、BTG1、CCNG2、CDKN1B、BNIP3、GADD45A、INSR和MXI1。
根据本发明的优选实施例及其各种实施例,三个或更多个Notch靶基因选自包括以下各项的组:CD28、CD44、DLGAP5、DTX1、EPHB3、FABP7、GFAP、GIMAP5、HES1、HES4、HES5、HES7、HEY1、HEY2、HEYL、KLF5、MYC、NFKB2、NOX1、NRARP、PBX1、PIN1、PLXND1、PTCRA、SOX9和TNC,优选地,其中,两个或更多个Notch靶基因选自包括以下各项的组:DTX1、HES1、HES4、HES5、HEY2、MYC、NRARP和PTCRA,并且一个或多个Notch靶基因选自包括以下各项的组:CD28、CD44、DLGAP5、EPHB3、FABP7、GFAP、GIMAP5、HES7、HEY1、HEYL、KLF5、NFKB2、NOX1、PBX1、PIN1、PLXND1、SOX9和TNC。
在该方面中,特别地对提供有上文所提到的参考的靶基因的序列表进行参考如下∶
TGF-β:ANGPTL4、CDC42EP3、CDKNIA、CDKN2B、CTGF、GADD45A、GADD45B、HMGA2,ID1、IL11、SERPINE1、INPP5D、JUNB、MMP2、MMP9、NKX2-5、OVOL1、PDGFB、PTHLH、SGK1、SKIL、SMAD4、SMAD5、SMAD6、SMAD7、SNAI1、SNAI2、TIMP1和VEGFA(WO 2016/062891、WO 2016/062893);
PI3K-FOXO:AGRP、BCL2L11、BCL6、BNIP3、BTG1、CAT、CAV1、CCND1、CCND2、CCNG2、CDK1A、CDK 1B、ESRl、FASLG、FBX032、GADD45A、INSR、MXIl、NOS3、PCKl、POMC、PPARGCIA、PRDX3、RBL2、SOD2和TNFSF10(WO 2015/101635);ATP8A1、BCL2L11、BNIP3、BTGl、ClOorflO、CAT、CBLB、CCNDl、CCND2、CDKNIB、DDB1、DYRK2、ERBB3、EREG、ESRl、EXT1、FASLG、FGFR2、GADD45A、IGF1R、IGFBP1、IGFBP3、INSR、LGMN、MXI1、PPM1D、SEMA3C、SEPP1、SESN1、SLC5A3、SMAD4、SOD2、TLE4、和TNFSF10(WO 2016/062892、WO 2016/062893);SOD2、BNIP3、MXI1、PCK1、PPARGC1A和CAT(EP16200697.7,上述);
Notch:CD28、CD44、DLGAP5、DTX1、EPHB3、FABP7、GFAP、GIMAP5、HES1、HES4、HES5、HES7、HEY1、HEY2、HEYL、KLF5、MYC、NFKB2、NOX1、NRARP、PBX1、PIN1、PLXND1、PTCRA、SOX9和TNC(EP 17194288.1,上述);
基于使用例如贝叶斯模型或(伪)线性模型的基于微阵列/RNA测序的研究,被发现最好指示相应细胞信号传导途径活性的该组靶基因可以被转变成例如要对对象的样本执行的多重定量PCR分析或专用微阵列生物芯片。如本文所描述的基因序列的选择可以被用于选择例如用于RT-PCR的引物-探针集或用于微阵列开发的寡核苷酸。为了开发用于途径活性和风险评分确定的这样的FDA批准的测试,要求开发标准化测试试剂盒,其需要在临床试验中进行临床验证以获得监管批准。
根据第三方面,本发明涉及一种用于确定指示对象是否具有异常气道上皮的气道异常因子或指示具有异常气道上皮的对象将形成气道癌的风险的风险评分的装置,其包括数字处理器,其被配置为执行本发明的第一和/或第二方面及其各种实施例的方法。因此,本发明涉及一种包括数字处理器的装置癌症,该数字处理器被配置为执行本发明的第一和/或第二方面及其各种实施例的方法。
根据第四方面,本发明涉及一种用于确定指示对象是否具有异常气道上皮的气道异常因子或指示具有异常气道上皮的对象将形成气道癌的风险的风险评分的非瞬态存储介质,其存储指令,所述指令可由数字处理设备执行以执行本发明的第一和/或第二方面及其各种实施例的方法。非瞬态存储介质可以是计算机可读存储介质,诸如硬盘驱动器或其他磁性存储介质、光盘或其他光学存储介质、随机存取存储器(RAM)、只读存储器(ROM)、闪存、或其他电子存储介质、网络服务器等。数字处理设备可以是手持式设备(例如,个人数据助理或智能电话)、笔记本计算机、台式计算机、平板计算机或设备、远程网络服务器等。因此,本发明涉及一种存储指令的非瞬态存储介质,该指令可由数字处理设备执行以执行本发明的第一和/或第二方面及其各种实施例的方法。
根据第五方面,本发明涉及一种用于确定指示对象是否具有异常气道上皮的气道异常因子或指示具有异常气道上皮的对象将形成气道癌的风险的风险评分的计算机程序,其包括程序代码模块,所述程序代码模块用于当所述计算机程序在所述数字处理设备上运行时使数字处理设备执行根据本发明的第一和/或第二方面及其各种实施例的方法。计算机程序可以被存储/被分布在适合的介质上,诸如与其他硬件一起或作为其部分提供的光学存储介质或固态介质上,但是计算机程序也可以以其他形式分布,诸如经由因特网或其他有线或无线电信系统分布。因此,本发明涉及一种包括程序代码模块的计算机程序,所述程序代码模块用于当所述计算机程序在所述数字处理设备上运行时使数字处理设备执行根据本发明的第一和/或第二方面及其各种实施例的方法。
根据第六方面,本发明涉及一种用于确定指示对象是否具有异常气道上皮的气道异常因子或指示具有异常气道上皮的对象将形成气道癌的风险的风险评分的试剂盒,所述试剂盒包括用于确定TGF-β细胞信号传导途径的至少三个靶基因、PI3K-FOXO细胞信号传导途径的至少三个靶基因、Notch细胞信号传导途径的至少三个靶基因和/或HH细胞信号传导途径的至少三个靶基因的表达水平的部件。优选地,所述试剂盒包括用于确定TGF-β细胞信号传导途径的至少三个靶基因、PI3K-FOXO细胞信号传导途径的至少三个靶基因和/或Notch细胞信号传导途径的至少三个靶基因的表达水平的部件。在根据本发明的试剂盒的优选实施例中,所述三个或更多个TGF-β靶基因选自包括以下各项的组:ANGPTL4、CDC42EP3、CDKN1A、CTGF、GADD45A、GADD45B、HMGA2、ID1、IL11、JUNB、PDGFB、PTHLH、SERPINE1、SGK1、SKIL、SMAD4、SMAD5、SMAD6、SMAD7、SNAI2、VEGFA,更优选地选自包括以下各项的组:ANGPTL4、CDC42EP3、CDKN1A、CTGF、GADD45B、ID1、IL11、JUNB、SERPINE1、PDGFB、SKIL、SMAD7、SNAI2和VEGFA,最优选地选自包括以下各项的组:ANGPTL4、CDC42EP3、ID1、IL11、JUNB、SERPINE1、SKIL和SMAD7,或者其中,所述三个或更多个TGF-β靶基因选自包括以下各项的组:CDC42EP3、GADD45B、HMGA2、ID1、JUNB、OVAL1、VEGFA、SGK1,并且
所述三个或更多个PI3K-FOXO靶基因选自包括以下各项的组:AGRP、BCL2L11、BCL6、BNIP3、BTG1、CAT、CAV1、CCND1、CCND2、CCNG2、CDKN1A、CDKN1B、ESR1、FASLG、FBXO32、GADD45A、INSR、MXI1、NOS3、PCK1、POMC、PPARGC1A、PRDX3、RBL2、SOD2、TNFSF10,优选地选自包括以下各项的组:FBXO32、BCL2L11、SOD2、TNFSF10、BCL6、BTG1、CCNG2、CDKN1B、BNIP3、GADD45A、INSR和MXI1,并且
所述三个或更多个Notch靶基因选自包括以下各项的组:CD28、CD44、DLGAP5、DTX1、EPHB3、FABP7、GFAP、GIMAP5、HES1、HES4、HES5、HES7、HEY1、HEY2、HEYL、KLF5、MYC、NFKB2、NOX1、NRARP、PBX1、PIN1、PLXND1、PTCRA、SOX9和TNC,优选地,其中,两个或更多个Notch靶基因选自包括以下各项的组:DTX1、HES1、HES4、HES5、HEY2、MYC、NRARP和PTCRA,并且一个或多个Notch靶基因选自包括以下各项的组:CD28、CD44、DLGAP5、EPHB3、FABP7、GFAP、GIMAP5、HES7、HEY1、HEYL、KLF5、NFKB2、NOX1、PBX1、PIN1、PLXND1、SOX9和TN。
本发明的另一方面涉及一种用于确定TGF-β细胞信号传导途径的至少三个靶基因、PI3K-FOXO细胞信号传导途径的至少三个靶基因、Notch细胞信号传导途径和/或HH细胞信号传导途径的至少三个靶基因的表达水平的部件的用途,其用于制造试剂盒以用于确定指示对象是否具有异常气道上皮的气道异常因子或指示具有异常气道上皮的对象将形成气道癌的风险的风险评分。
所述试剂盒特别是定量试剂盒,即允许对表达水平的量化。
所述试剂盒可以包括用于测量(特别地定量)选自包括以下各项的组的靶基因的表达水平的一个或多个部件或模块:DNA阵列芯片、寡核苷酸阵列芯片、蛋白质阵列芯片、抗体、多个探针,例如标记探针、一组RNA逆转录酶测序成分和/或RNA或DNA,包括cDNA、扩增引物。在优选实施例中,所述试剂盒选自包括以下各项的组:qPCR、多个qPCR、复用qPCR、ddPCR、RNAseq、RNA表达阵列和质谱分析。在实施例中,试剂盒包括针对靶基因的mRNA或cDNA序列的部分的一组标记探针,如本文所描述的。在实施例中,试剂盒包括针对靶基因的mRNA或cDNA序列的部分的一组引物和探针。在实施例中,标记的探针被包含在标准化96孔板中。在实施例中,试剂盒还包括针对一组参考基因的引物或探针。这样的参考基因可以是例如在归一化或者标准化本文所描述的靶基因表达水平的表达水平中有用的构成表达基因。
因此,在实施例中,本发明涉及一种试剂盒,所述试剂盒包括:
用于确定TGF-β细胞信号传导途径的至少三个靶基因、PI3K-FOXO细胞信号传导途径的至少三个靶基因和/或Notch细胞信号传导途径的至少三个靶基因的表达水平的部件,其中:
所述三个或更多个TGF-β靶基因,例如3、4、5、6、7、8、9、10、11、12个或更多个基因,选自包括以下各项的组:ANGPTL4、CDC42EP3、CDKN1A、CTGF、GADD45A、GADD45B、HMGA2、ID1、IL11、JUNB、PDGFB、PTHLH、SERPINE1、SGK1、SKIL、SMAD4、SMAD5、SMAD6、SMAD7、SNAI2、VEGFA,更优选地,所述三个或更多个TGF-β靶基因,例如3、4、5、6、7、8、9、10、11、12、13或14个基因,选自包括以下各项的组:ANGPTL4、CDC42EP3、CDKN1A、CTGF、GADD45B、ID1、IL11、JUNB、SERPINE1、PDGFB、SKIL、SMAD7、SNAI2和VEGFA,最优选地,所述三个或更多个TGF-β靶基因,例如3、4、5、6、7或8个基因,选自包括以下各项的组:ANGPTL4、CDC42EP3、ID1、IL11、JUNB、SERPINE1、SKIL和SMAD7,备选地,其中,所述三个或更多个TGF-β靶基因,例如3、4、5、6、7或8个基因,选自包括以下各项的组:CDC42EP3、GADD45B、HMGA2、ID1、JUNB、OVAL1、VEGFA、SGK1
和/或
所述三个或更多个PI3K-FOXO靶基因,例如3、4、5、6、7、8、9、10、11、12或更多个基因,选自包括以下各项的组:AGRP、BCL2L11、BCL6、BNIP3、BTG1、CAT、CAV1、CCND1、CCND2、CCNG2、CDKN1A、CDKN1B、ESR1、FASLG、FBXO32、GADD45A、INSR、MXI1、NOS3、PCK1、POMC、PPARGC1A、PRDX3、RBL2、SOD2、TNFSF10,优选地,所述三个或更多个PI3K-FOXO靶基因,例如3、4、5、6、7、8、9、10、11、12或13个基因,选自包括以下各项的组:FBXO32、BCL2L11、SOD2、TNFSF10、BCL6、BTG1、CCNG2、CDKN1B、BNIP3、GADD45A、INSR和MXI1,
和/或
所述三个或更多个Notch靶基因,例如3、4、5、6、7、8、9、10、11、12或更多个基因选自包括以下各项的组:CD28、CD44、DLGAP5、DTX1、EPHB3、FABP7、GFAP、GIMAP5、HES1、HES4、HES5、HES7、HEY1、HEY2、HEYL、KLF5、MYC、NFKB2、NOX1、NRARP、PBX1、PIN1、PLXND1、PTCRA、SOX9和TNC,优选地,其中,两个或更多个Notch靶基因,例如2、3、4、5、6、7或8个基因,选自包括以下各项的组:DTX1、HES1、HES4、HES5、HEY2、MYC、NRARP和PTCRA,并且一个或多个Notch靶基因,例如1、2、3、4、5、6、7、8、9、10、11、12或更多个基因选自包括以下各项的组:CD28、CD44、DLGAP5、EPHB3、FABP7、GFAP、GIMAP5、HES7、HEY1、HEYL、KLF5、NFKB2、NOX1、PBX1、PIN1、PLXND1、SOX9和TNC。优选地,所述试剂盒用于或适于确定指示对象是否具有异常气道上皮的气道异常因子或指示具有异常气道上皮的对象将形成气道癌的风险的风险评分。
在一些实施例中,所述试剂盒不是用于确定数千个靶基因的表达水平的微阵列。例如,除了本文所公开的特定靶基因要求的部件之外,本发明的试剂盒可以包括用于确定不超过1000个靶基因、不超过700个靶基因、不超过500个靶基因、不超过200个靶基因、不超过100个靶基因的表达水平的部件。
所述试剂盒还可以包括第三方面的装置、第四方面的非瞬态存储介质或第五方面的计算机程序。
根据第七方面,本发明涉及一种在诊断或预测对象是否具有异常气道上皮或具有异常气道上皮的对象是否将形成气道癌的方法中使用的试剂盒,所述试剂盒包括用于确定TGF-β细胞信号传导途径的至少三个靶基因、PI3K-FOXO细胞信号传导途径的至少三个靶基因、Notch细胞信号传导途径的至少三个靶基因和/或HH细胞信号传导途径的至少三个靶基因的表达水平的部件。根据优选实施例,诊断或预测的方法包括从所述对象的气道提取上皮细胞样本,并且使提取的上皮细胞样本经受根据本发明的第一和/或第二方面的方法。
本发明的另一方面是诊断或预测对象是否具有异常气道上皮或具有异常气道上皮的对象是否将形成气道癌的方法,所述方法包括提供对象的气道的上皮细胞样本或从所述对象的气道提取上皮细胞样本,并且使所提供或提取的上皮细胞样本经受根据本发明的第一和/或第二方面的方法。
因此,本发明还涉及使用试剂盒在体内或体外诊断或预测对象是否具有异常气道上皮或具有异常气道上皮的对象是否将形成气道癌的方法,所述试剂盒包括用于确定TGF-β细胞信号传导途径的至少三个靶基因、PI3K-FOXO细胞信号传导途径的至少三个靶基因、Notch细胞信号传导途径的至少三个靶基因的表达水平的部件。优选地,在所述用于在体内或体外诊断或预测对象的气道的上皮细胞样本的方法中,提供从所述对象的气道提取的上皮细胞样本,并且使所提供或提取的上皮细胞样本经受根据本发明的第一和/或第二方面的方法。优选地,所述方法还包括提供所述对象的气道的上皮细胞样本或从所述对象的气道提取上皮细胞样本。
优选地,在所述用于在体内或体外诊断或预测的方法中,所述用于确定TGF-β细胞信号传导途径的至少三个靶基因、PI3K-FOXO细胞信号传导途径的至少三个靶基因、Notch细胞信号传导途径的至少三个靶基因的表达水平的部件,包括:所述三个或更多个TGF-β靶基因,例如3、4、5、6、7、8、9、10、11、12个或更多个基因,选自包括以下各项的组:ANGPTL4、CDC42EP3、CDKN1A、CTGF、GADD45A、GADD45B、HMGA2、ID1、IL11、JUNB、PDGFB、PTHLH、SERPINE1、SGK1、SKIL、SMAD4、SMAD5、SMAD6、SMAD7、SNAI2、VEGFA,更优选地,所述三个或更多个TGF-β靶基因,例如3、4、5、6、7、8、9、10、11、12、13或14个基因,选自包括以下各项的组:ANGPTL4、CDC42EP3、CDKN1A、CTGF、GADD45B、ID1、IL11、JUNB、SERPINE1、PDGFB、SKIL、SMAD7、SNAI2和VEGFA,最优选地,所述三个或更多个TGF-β靶基因,例如3、4、5、6、7或8个基因,选自包括以下各项的组:ANGPTL4、CDC42EP3、ID1、IL11、JUNB、SERPINE1、SKIL和SMAD7,备选地,其中,所述三个或更多个TGF-β靶基因,例如3、4、5、6、7或8个基因,选自包括以下各项的组:CDC42EP3、GADD45B、HMGA2、ID1、JUNB、OVAL1、VEGFA、SGK1,以及所述三个或更多个PI3K-FOXO靶基因,例如3、4、5、6、7、8、9、10、11、12或更多个基因,选自包括以下各项的组:AGRP、BCL2L11、BCL6、BNIP3、BTG1、CAT、CAV1、CCND1、CCND2、CCNG2、CDKN1A、CDKN1B、ESR1、FASLG、FBXO32、GADD45A、INSR、MXI1、NOS3、PCK1、POMC、PPARGC1A、PRDX3、RBL2、SOD2、TNFSF10,优选地,所述三个或更多个PI3K-FOXO靶基因,例如3、4、5、6、7、8、9、10、11、12或13个基因,选自包括以下各项的组:FBXO32、BCL2L11、SOD2、TNFSF10、BCL6、BTG1、CCNG2、CDKN1B、BNIP3、GADD45A、INSR和MXI1,并且所述三个或更多个Notch靶基因,例如3、4、5、6、7、8、9、10、11、12或更多个基因选自包括以下各项的组:CD28、CD44、DLGAP5、DTX1、EPHB3、FABP7、GFAP、GIMAP5、HES1、HES4、HES5、HES7、HEY1、HEY2、HEYL、KLF5、MYC、NFKB2、NOX1、NRARP、PBX1、PIN1、PLXND1、PTCRA、SOX9和TNC,优选地,其中,两个或更多个Notch靶基因,例如2、3、4、5、6、7或8个基因,选自包括以下各项的组:DTX1、HES1、HES4、HES5、HEY2、MYC、NRARP和PTCRA,并且一个或多个Notch靶基因,例如1、2、3、4、5、6、7、8、9、10、11、12或更多个基因选自包括以下各项的组:CD28、CD44、DLGAP5、EPHB3、FABP7、GFAP、GIMAP5、HES7、HEY1、HEYL、KLF5、NFKB2、NOX1、PBX1、PIN1、PLXND1、SOX9和TNC。优选地,所述试剂盒是如根据本发明的第六方面的试剂盒中所描述的试剂盒。
在另一实施例中,根据本发明的用于在体内或体外诊断或预测对象是否具有异常气道上皮或具有异常气道上皮的对象是否将形成气道癌的方法还包括:基于从所述对象的气道导出的上皮细胞样本中的细胞信号传导途径的活性的组合来确定指示对象是否具有异常气道上皮的气道异常因子,其中,所述细胞信号传导途径包括选自包括以下各项的组的两个或更多个细胞信号传导途径:TGF-β途径、PI3K-FOXO途径和Notch途径,其中,所述信号传导途径异常因子的确定还基于相应细胞信号传导途径的参考活性,其中,所述参考活性反映在健康对象的气道上皮中发现的相应细胞信号传导途径的活性。
根据第八方面,本发明涉及一种试剂盒,其包括用于确定TGF-β细胞信号传导途径的至少三个靶基因、PI3K-FOXO细胞信号传导途径的至少三个靶基因、Notch细胞信号传导途径的至少三个靶基因的表达水平的部件。优选地,所述试剂盒用于或适于确定指示对象具有异常气道上皮或具有异常气道上皮的对象是否将形成气道癌的风险评分。
在另一优选实施例中,本发明涉及根据本发明的第六或第八方面的试剂盒在确定气道异常评分或用于确定指示对象具有异常气道上皮或具有异常气道上皮的对象是否将形成气道癌的风险评分中的用途。
本发明的一个优点在于一种临床决策支持(CDS)系统,其适于提供临床推荐,例如,通过基于如本文所描述的途径活性的组合决定对对象的处置,如由或基于途径活性的组合确定的气道异常因子和/风险评分所指示的。
另一优点在于一种CDS系统,其适于将对象分配到与所述对象将形成气道癌的不同风险相关联的多个风险组中的至少一个,如由基于如本文所描述的两个或更多个细胞信号传导途径的活性的组合确定的气道异常因子和/或风险评分所指示的。
另一优点在于将指示对象将形成气道癌的风险和基于如本文所描述的两个或更多个细胞信号传导途径的活性的组合确定的风险评分与从一个或多个额外的预测测试获得的一个或多个额外的风险评分组合。
如本文所描述的本发明也可以例如有利地结合以下各项使用:
对气道上皮是否是恶变前的预测,和/或
对人是否具有形成气道癌(如本文所定义的)的高风险的预测,和/或
对人是否具有形成肺癌的高风险的预测,和/或
对人是否具有形成鳞状肺癌的高风险的预测,和/或
对人是否具有形成肺腺癌的高风险的预测,和/或
对人是否能够从局部治疗受益以预防癌症的形成的预测,和/或
对患者是否具有肺癌的预测,和/或
基于两个或更多个细胞信号传导途径的活性的组合的预后和/或预测,和/或
基于两个或更多个细胞信号传导途径的活性组合对药物功效的预测,例如对化学治疗和激素处置的药物功效的预测,和/或
基于两个或更多个细胞信号传导途径的活性组合对药物功效的监测,和/或
基于两个或更多个细胞信号传导途径的活性组合来决定监测的频率,或者更特别地决定治疗响应监测的频率,和/或
基于两个或更多个细胞信号传导途径的活性的组合的药物开发,和/或
基于两个或更多个细胞信号传导途径的活性的组合的试验开发,和/或
对人是否处于形成侵入性气道癌的风险的预测,和/或
对人是否处于疾病进展的风险的预测,和/或
对人在处置(例如化学预防)之后是否具有降低的风险的预测或诊断,和/或
对利用成像模态(诸如CT扫描)检测到的结节或异常更可能是恶性还是良性的预测,和/或
基于两个或更多个细胞信号传导途径的活性的组合的癌症分期,
其中,在每种情况下,所述细胞信号传导途径包括TGF-β途径、PI3K-FOXO途径和/或Notch途径。
在阅读和理解了附图、以下描述,并且特别是阅读了下文提供的详细范例之后,其他优点对于本领域普通技术人员将是显而易见的。
本申请描述若干优选实施例。在阅读和理解了前述详细描述之后可以想到修改和变更。本申请旨在被理解为包括所有这样的修改和变型,只要其落入权利要求书或其等价方案的范围之内。
通过研究附图、说明书和随附的权利要求书,本领域的技术人员在实践请求保护的本发明时可以理解和实现所公开的实施例的其他变型。
应当理解,第一和第二方面的方法、第三方面的装置、第四方面的非瞬态存储介质、第五方面的计算机程序、第六、第七和第八方面的试剂盒具有相似和/或相同的优选实施例,特别是如从属权利要求中所定义的。
在权利要求中,词语“包括”不排除其他元件或者步骤,并且词语“一”或“一个”不排除多个。
单个单元或设备可以实现权利要求中记载的若干项的功能。尽管在互不相同的从属权利要求中记载了特定措施,但是这并不指示不能有利地使用这些措施的组合。
可以通过任何其他数目的单元或设备执行由一个或若干单元或设备所执行的计算,如风险评分的确定。
应当理解,本发明的优选的实施例还可以是从属权利要求或以上实施例与相应的独立权利要求的任何组合。
本发明的这些和其他方面将参考在下文中所描述的实施例而显而易见并且得到阐述。
附图说明
在以下附图中:
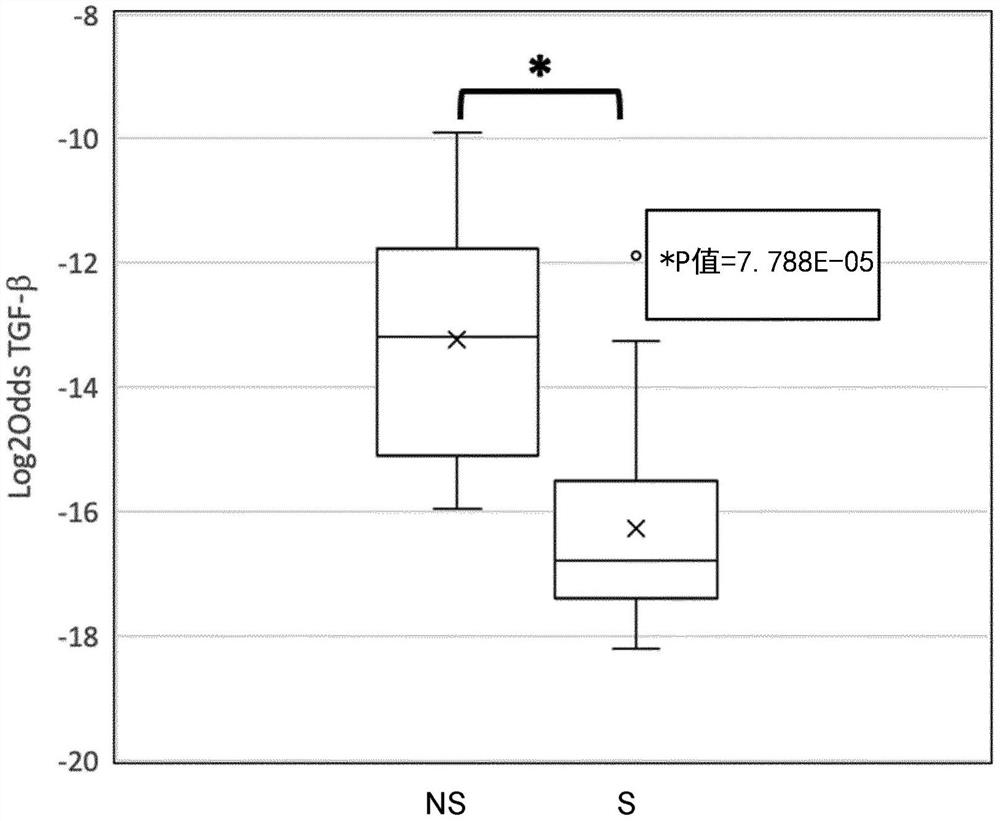
图1示范性地示出了在通过从非吸烟者(n=13)(左框,标记为“NS”)刷洗获得的正常小气道上皮细胞和从重度吸烟者(n=18)(右框,标记为“S”)获得的正常小气道上皮细胞中测量的信号传导途径活性的确定的结果(图1A.TGF-b;图1B.Notch;图1C:PI3K-FOXO)。示出了Log2odds途径评分。
图2示范性地示出了使用数据集GSE10006使用TGF-β途径活性计算气道上皮细胞中的异常途径活性的阈值。此处描绘的是数据集中的每个样本的途径活性评分,分别针对“非吸烟者”和“吸烟者”。对于这两组,计算途径活性评分的平均值(在图2中示出为小矩形)以及标准偏差(SD)。将异常低TGF-β活性的阈值设置为正常小气道的健康非吸烟者的TGF-β途径评分的平均途径活性评分减去1SD,或备选地平均值减去2SD,如图2中分别示出为标记有“1SD”和“2SD”的水平虚线。如果1SD被当作阈值,则低于该水平的TGF-β途径评分仅在15.8%的健康非吸烟者中发生,并且如果在较低阈值处获取2SD,则仅在2.2%的该群体中发生。低于该阈值的值被认为与从异常气道上皮导出的增加风险(取决于1SD或2SD阈值)相关联。对于此处描述的质心计算方法的开发,低于定义的2SD阈值的样本途径分析结果被认为是异常的。在这种情况下,异常途径活性特征在于肿瘤抑制性TGF-β活性的丧失。在该数据集的吸烟者组中,预期不是所有吸烟者,而是仅吸烟者的子组将具有异常气道上皮。该子组可以通过将正常上皮的TGF-β途径活性阈值应用于该组来识别。实际上,相对大量的样本具有低于相应1SD和2SD阈值的TGF-β途径活性(图2B)。对于质心计算模型的后续校准,具有低于正常的2SD的TGF-β途径评分的样本被认为是针对异常样本的校准集。另一方面,具有高于2SD阈值的TGF-β途径评分的非吸烟者样本构成了针对正常样本的校准集。对于线性模型,作为范例,1SD阈值被当作阈值,低于其,途径活性评分被认为异常低。对于其他信号传导途径,这可以以对应的方式完成。图2B额外地以四边形指示校准数据。左四边形指示针对正常样本“NS”的校准集。右四边形指示针对异常样本“AS”的校准集。
图3图解地示出了临床决策支持(CDS)系统,其被配置为确定指示对象将形成气道癌的风险的风险评分,如本文所公开的。
具体实施方式
以下实施例仅仅图示了特别优选的方法和与之连接的选定的方面。其中提供的教导可以被用于构建若干测试和/或试剂盒。以下范例要被解释为限制本发明的范围。
本发明涉及一种方法,其可以识别在气道上皮中具有异常/恶变前变化和/或处于形成肺癌的增加风险的个体,尤其是吸烟者。信号转导途径活性的测量可以识别指示异常气道上皮的异常信号转导途径活性,以及恶变前变化的增加的可能性。根据本发明,两个或更多个途径的活性被确定并且被转变成气道异常因子,在下文中也指代为(小/大)气道途径异常评分,(S/L)APAS,其识别具有形成肺癌的潜在增加风险的具有异常气道上皮的个体。
本发明基于PI3K-FOXO途径、Notch、HH和/或TGF-β途径的组合活性提供了风险评分和/或气道上皮异常因子/评分,其指示从气道导出的上皮细胞中的恶变前变化的存在;并且提供了使用提供风险评分和/或气道上皮异常因子的计算模型解释途径结果。分析从大或小气道导出的上皮细胞可以被用于早期检测可能指示形成肺癌的较高风险的异常。风险评分和/或气道上皮异常因子也可以被用于对患者进行分层以进行密切监测或帮助选择旨在将这些途径恢复到其非病理状态以逆转恶变前变化的处置。
肺癌形成在较大气道(从气管分支出来的支气管)或小气道上皮中。使用如气道刷洗、鼻细胞收集(鼻拭子)或支气管肺泡灌洗的技术,可以以相对非侵入性的方式从上气道和下气道获得上皮细胞以用于分子分析。这提供了识别个体,特别是吸烟者的潜在手段,其在他们的气道上皮中具有这些早期增殖性变化,并且处于形成肺癌的增加的风险中。
信号转导途径分析使得能够定量测量从上气道或下气道获得的上皮细胞中的信号转导途径活性(例如通过支气管肺泡灌洗、刷洗或活检),并且基于推断来自与相应信号信号传导途径相关联的转录因子的验证的直接靶基因的mRNA水平的测量结果的信号转导途径的活性(参见例如W Verhaegh等人,2014,上述;W Verhaegh、A van de Stolpe,2014,上述)。一个或多个途径的活性的确定、多个途径活性的组合及其应用可以如上文所描述被执行。模型已经针对若干细胞类型(包括上皮细胞)上的ER、AR、PI3K-FOXO、HH、Notch、TGF-β、Wnt、NFkB和STAT1/2和STAT3途径进行生物学验证。
本发明集中于TGF-β途径、PI3K-FOXO途径、Notch途径和/或HH途径。
TGF-β参与调节细胞增殖、分化、免疫细胞活性、细胞微环境和其他细胞过程。在正常和恶变前细胞中,TGF-β发挥肿瘤抑制功能。然而,在向癌细胞的进展中,通过受体失活突变或途径抑制臂的选择性丧失,可能失去肿瘤抑制效应(Massague等人,Cell,2008,134(2):215–230)。烟草暴露可以减少TGF-β介导的生长抑制和细胞凋亡,这指示吸烟促进致瘤性(Samanta等人,Cancer Prev Res,2012,5(3):453–63)。
PI3K-FOXO途径通常在各种类型的癌症中过度激活。肿瘤潜在地对PI3K-FOXO途径抑制剂敏感,但缺乏评估功能性PI3K-FOXO活性的可靠诊断测试。由于PI3K-FOXO途径负向调节肿瘤抑制性FOXO转录因子,FOXO靶基因表达与PI3K活性负相关(前提是没有氧化应激(van Ooijen,2018,上述)。已经示出,FOXO3缺乏导致对香烟烟雾引起的炎症、空气空间扩大和COPD的增加的易感性(Hwang等人,J Immunol,2011,187(2):987–998)。FOXO3的水平在吸烟者和具有慢性阻塞性肺病(COPD)的患者的肺部中显著降低。
Notch信号参与细胞增殖、分化和细胞凋亡的调节。Notch的不同亚型的肿瘤抑制性与肿瘤促进功能取决于细胞和环境背景。例如,在一个肿瘤中,已描述Notch1在促进肿瘤起始中具有致癌作用,而Notch2具有肿瘤抑制作用(Zou等人,Oncology Letters,2018,15:3415-3421)。然而,这在不同的肿瘤类型中可能不同,例如在恶性癌症中,NOTCH1和NOTCH2是肿瘤抑制性的(Cancer Discov,2014,4(11):1252)。不同亚型的表达水平在肺癌的各种组织学亚型之间不同(Chen等人,Journal of Cancer,2017,8(7):1292-1300)。在一种类型的肺癌SCLC中,Notch途径的肿瘤抑制功能丧失,并且这甚至提供了治疗靶,药物被开发以增加具有SCLC的患者的Notch途径活性(Nat Rev Clin Oncol,2017,14(9):549–561)。Notch途径在健康吸烟者和具有慢性阻塞性肺病的吸烟者的气道上皮中下调,从而隐含该途径可能对修复吸烟引起的损伤很重要(Tilley等人,Am J Respir Crit Care Med,2009,179(6):457-66)。
利用来自吸烟者和非吸烟者的数据对Affymetrix U133 Plus 2.0表达微阵列数据集(GEO,公共数据集)进行信号传导途径分析
在GEO数据集数据库(https://www.ncbi.nlm.nih.gov/gds/)中,识别了Affymetrix Plus2.0公开可用临床研究,其包含来自非吸烟者和轻度和重度吸烟者的上皮气道细胞的Affymetrix数据。
数据集GSE10006。调查组是:吸烟者的大气道(n=9);非吸烟者的大气道(n=20);吸烟者的小气道(n=13);非吸烟者的小气道(n=18),并且作为出于验证目的的独立数据集,COPD患者数据。非吸烟者和吸烟者的正常小气道上皮的TGFbeta、NOTCH途径和FOXO转录因子活性的分析结果示出在图1A至1C中。本文公开的靶基因的表达水平是从TGF-β、PI3K-FOXO和Notch途径中的每个的数据集收集的。随后地,信号传导途径活性如本文所描述被确定,并且在非吸烟者与吸烟者之间进行比较。途径活性以log2 odds标度指示,并且指示显著差异(Rank Wilcoxon测试)。
使用该方法,发现TGF-β和Notch途径活性在重度吸烟者亚群中丧失(参见图1A和1B),而FOXO转录因子的活性可能在吸烟者子组中丧失,其中,PI3K生长因子途径已被激活(参见图1C)。这意指与非吸烟者相比较,在来自重度吸烟者子组的气道上皮细胞中,存在特性途径活性轮廓:与增殖PI3K途径的增加的活性相关联的TGF-β途径和Notch途径活性的肿瘤抑制效应丧失。这指示在重度吸烟者群体的子组中的Notch和TGF-β途径的肿瘤抑制活性的异常增殖和丧失。该子组的对象可能处于形成肺癌形式的高风险中。当这些异常在从上气道导出的细胞中找到时,它们很可能处于形成通常此处出现的癌症的风险中,如鳞状肺癌;并且当存在于下气道上皮细胞中时,对象很可能处于形成腺癌的更高风险中,这通常发生在下气道中。
还确认来自气管(上气道)的上皮细胞示出与下气道上皮细胞中发现的相似的途径活性异常,并且因此能够可能用作替代样本以提供上皮异常评分和癌症风险评分(数据未示出)。来自气管的上皮细胞更容易获得,并且采样是更少侵入性的。
使用数据集GSE19722,还发现本发明适用于上皮细胞的干/祖细胞(数据集GSE19722.REF:Shaykhiev R、Wang R、Zwick RK、Hackett NR等人Airway basal cells ofhealthy smokers express an embryonic stem cell signature relevant to lungcancer.(Stem Cells 2013;sep;31(9):1992-2002)。特别地,构成受损上皮的再生所需的干细胞/祖细胞的培养的基底细胞(BC)因此可以用作原代、非培养的上皮细胞样本的替代样本。与非吸烟者相比较,来自吸烟者的基底细胞中的降低的FOXO转录因子活性指示增加的PI3K途径活性(参见表1)。
表1:使用数据集GSE19722对上皮细胞的干/祖细胞的分析。小气道上皮细胞经由柔性支气管镜收集并且培养;一周后提取RNA以用于Affymetrix微阵列分析。指示针对FOXO活性的Log2odds值。
与吸烟相关联的气道上皮的最早损伤反映在BC的增生中,这由PI3K途径的增加的活性引起,如本文所描述的飞利浦途径分析所识别的。在这种情况下,BC通过支气管镜检查从非吸烟者和吸烟者获得,并且在分析之前在胶原蛋白上培养一周。在这些条件下,来自吸烟者的培养的BC中的PI3K-FOXO活性增加(不显著),指示PI3K-FOXO途径活性的增加(降低的FOXO活性)(参见表1)。该细胞类型中的异常PI3K途径活性与上皮细胞类型中的异常途径活性相关,从而提出在上皮细胞中看到的PI3K通路活性起源于基底细胞。该实验示出,来自BC的样本原则上也可以被用于测量上皮细胞的异常。
正常途径活性的定义
基于健康非吸烟对象中的途径活性(GSE10006),为正常小气道上皮定义了参考途径活性。当测量的途径活性超过1个标准偏差(>1SD)或备选地超过2个标准偏差(>2SD),低于Notch、TGF-β途径和FOXO转录因子活性的正常途径活性的平均值时,在患者样本中测量的途径活性被认为是异常的。表2示出了针对相应途径的确定的平均值和标准偏差。
表2、TGF-α、NOTCH途径和FOXO转录因子的活性的平均值和标准偏差。
基于这些值,计算了途径活性的较低阈值,低于其,途径活性在气道上皮细胞中被认为是异常的:
针对较低阈值TGF-β活性的-15.17(1SD)和-17.12(2SD);
针对较低阈值NOTCH活性的8.79(1SD)和6.57(2SD);
针对较低阈值PI3K-FOXO活性的-0.14(1SD)和-2.40(2SD)。
因此计算的TGF-β途径活性的阈值在图2A和2B中指示为水平虚线。
计算模型的开发和校准
由于个体途径活性示出患者样本之间的变异性的事实,有利地采用计算模型来解释多个途径活性并提供所分析的上皮细胞样本不正常并且假定呈现恶变前状态的指标的概率。为了校准模型,使用来自数据集GSE10006的健康吸烟者和非吸烟者的小气道上皮的Affymetrix U133Plus2.0数据;出于来自相同数据集的验证目的,使用来自患有COPD的吸烟者的样本的独立数据。
该模型可以是线性、质心、贝叶斯模型或另一模型,如本文所描述的。可以分别为下气道上皮细胞和上气道上皮细胞开发模型,这可以提供指示形成不同肺癌类型的风险的异常评分。
在该范例中,使用质心模型和线性模型。然而,如技术人员将理解的,同样可以使用贝叶斯模型等。
质心模型
开发了示范性计算模型,其使用在使用刷洗从下(小)气道获得的上皮细胞中测量的PI3K、TGF-β和Notch的途径活性作为输入来计算质心模型(小/大)气道途径异常评分。
用于校准质心计算模型的样本的选择如下(参见图2B):
基于高于非吸烟者数据的2 x SD阈值的健康/正常小气道(非吸烟者)的“正常样本”的选择,
“异常样本”的选择基于低于非吸烟者数据的2 x SD阈值的健康/正常小气道(吸烟者)。
使用组合TGF-β和FOXO活性(参见表3)或组合TGF-β和FOXO和Notch活性(参见表4)校准模型。在使用微阵列数据之前,对来自每个个体样本的Affymetrix数据执行广泛的质量控制(QC),如别处描述的(Avan de Stolpe等人,2019,上述)。仅通过QC的样本被用于进一步分析。
表3、使用GSE10006数据集基于组合TGF-β、NOTCH和FOXO活性的模型的校准数据。每条线表示个体样本。样本“NS”指代来自非吸烟者的样本(校准正常样本)。样本“AS”指代吸烟者的样本(校准异常样本)。所有样本通过质量控制。
表4、使用GSE10006数据集基于组合TGF-β和FOXO活性的模型的校准数据。每条线表示个体样本。样本“NS”指代来自非吸烟者的样本(校准正常样本)。样本“AS”指代吸烟者的样本(校准异常样本)。所有样本通过质量控制。
来自相同数据集的患有COPD的吸烟者被用于验证模型。结果在下表5至7中进一步示出。
线性模型
开发了提供线性(小/大)气道途径异常评分的另一计算模型。在该范例中,1分的评分被分配给每个异常途径活性。如果测量的TGF-β或Notch途径或FOXO活性低于正常非吸烟者平均值-1SD或-2SD(针对这些阈值的计算,参见以上表2和图2A),则途径活性被认为是异常的。否则,“0”的评分被分配给相应途径。分被求和以指示气道上皮异常并且患者潜在处于形成肺癌的高风险中的可能性。评分越高,上皮异常并且处于形成肺癌的风险中越可能。该评分被称为APAS评分(气道途径活性评分)。0的评分正常(低风险),3的评分最大并且指示异常上皮,并且被假定为授予形成肺癌的最高风险。
计算模型的验证
随后,出于验证目的,来自吸烟者的GSE10006数据集的小气道上皮的独立数据,无论是具有早期慢性阻塞性肺病(COPD)还是具有长期COPD,都被用于对吸烟者中的异常上皮状态进行评分。
使用线性计算模型对气道上皮途径异常评分(APAS)的计算
在该实验中,基于在健康非吸烟者的小气道的上皮细胞(“正常”气道上皮)中测量的相应途径活性的平均值和方差来计算阈值。更特别地,正常上皮细胞中的TGF-β、Notch和FOXO活性的平均值和标准偏差通过如本文所描述的途径分析确定。值连同得到的1SD和2SD阈值一起汇总在表2和该表之后的段落中,并且在图2A中描绘。
如使用数据集GSE10006(参见图2A和2B)针对TGF-β途径示范性示出的,阈值被定义为平均途径活性减去2SD。阈值指示从正常到异常低TGF-β活性的转变。描绘了针对小气道上皮的2SD阈值。如果途径活性被确定为低于定义的阈值/水平线,则样本被认为具有异常途径活性。可以看到,吸烟者的子组具有异常TGF-β途径活性,特别是在小气道中(参见图2B)。在这种情况下,异常途径活性特征在于肿瘤抑制性TGF-β途径活性的丧失。假设来自该组的对象处于形成气道癌的增加的风险中。
对于线性模型,基于这些阈值,为评估的途径活性中每个分配途径异常因子。当途径活性被确定为异常时分配“1”的因子,否则“0”。例如,当TGF-β途径的活性被确定为低于该阈值时,1分的评分被分配给相应途径。对应的评论相对于FOXO活性适用。途径异常因子然后求和以产生APAS评分。
出于验证目的使用线性模型评价与小气道上皮中的正常途径活性的偏差,并且APAS评分基于组合TGF-β途径活性和FOXO转录因子活性来确定。“0”的APAS评分指代正常气道上皮(低风险)。评分越高,气道上皮异常的概率越高。用于验证的所有样本通过QC,如本文所描述的。验证结果连同校准数据一起在表5中示出。
表5、基于组合TGF-β和FOXO活性的线性模型的校准和验证结果。校准结果对应于表4中所示的那些。使用来自GSE10006数据集的患有早期(样本“eCOPD”)和建立的COPD(样本“COPD”)的吸烟者的样本执行验证。所有样本通过QC,如本文所描述的。
使用线性模型,具有异常气道上皮的个体的发生在具有建立的COPD的吸烟者组中最高,并且在具有早期COPD的组中较低。这与COPD患者中的肺癌的预期总体风险一致。因此,该模型按预期执行。
质心模型的验证
来自相同数据集(GSE10006)的患有早期和建立的COPD的吸烟者被用于验证该模型。该模型计算样本中发现的途径活性与正常/健康途径活性的集群以及异常上皮途径活性的距离评分;基于模型的校准,该评分定义分析的样本是被认为是正常的小气道上皮还是异常的。该模型可以与组合TGF-β和FOXO活性(参见表6)或组合TGF-β、FOXO和Notch活性(参见表7)一起使用。
表6、使用来自GSE10006数据集的患有早期和建立的COPD吸烟者的样本基于组合FOXO和TGF-活性的质心模型的验证数据。所有样本通过QC,如本文所描述的。
表7、使用来自GSE10006数据集的患有早期和建立的COPD的吸烟者的样本基于组合TGF-β、NOTCH和FOXO活性的质心模型的验证数据。所有样本通过QC,如本文所描述的。
可以看到,模型将一些早期COPD样本评分为正常,但是对于建立/长期存在的COPD样本,总是评分为异常,其与这两组中的肺癌的预期风险一致。
方法的临床用途
显然,并非所有(重度)吸烟者将形成肺癌,这是为什么气道异常因子和/或风险评分仅在吸烟者的子组中被检测到的原因。吸烟者中间的该变化也指示需要本发明的手段和方法,其允许识别具有异常气道上皮的对象,特别是吸烟者。
本发明预期减少重度吸烟者中的不必要的侵入性诊断流程,并且可以使能高风险患者的早期微创处置。
此外,气道上皮细胞上的途径分析可能是肺癌的额外诊断测试,使能选择全身(靶向)治疗。
1、吸烟者可以被筛查具有形成肺癌的高风险的恶变前变化,使用所描述的方法并且避免重复暴露于与如CT扫描的成像模态相关的辐射以进行筛查。可以从气道上皮获得上皮细胞,并且可以执行确定组合TGF-β/Notch/PI3K-FOXO途径活性或这些途径活性中的至少一种,优选地Notch和TGF-β。结果可以在筛查模型中解释以预测存在恶变前变化的风险,这指示吸烟相关联的肺癌的形成的高风险。
2、如果吸烟者存在有不适(例如咳嗽或呼吸急促)或异常成像发现,使用例如BAL上皮细胞可以从气道上皮获得,并且可以执行组合TGF-β/Notch/PI3K-FOXO途径活性的确定,并且在筛选模型中解释结果以预测存在恶变前变化的风险,这指示形成吸烟相关联的肺癌的高风险。
3、如果在如胸片或CT的图像上的肺部中检测到病变,并且不知道这是否是恶性病变,则对BAL细胞执行途径分析提供关于病变的特征的补充信息,这关于其潜在的恶性肿瘤,特别地针对吸烟者。
4、基于途径活性的分类器可以集成在诊断流程的读出中,例如支气管镜检查,以改进评估肺癌的概率的技术的灵敏度/特异性。
5、在以上情形中的任何中,计算的风险评分可以被用于对患者进行分层以进行密切监测和/或化学预防。
6、吸烟者可以被筛查具有形成肺癌的高风险的恶变前变化者,使用所描述的方法并且避免重复暴露于与如CT扫描的成像模态相关联的辐射以进行筛查。使用BAL或其他手段,可以从气道上皮获得上皮细胞,并且可以执行组合TGF-β/PI3K-FOXO途径活性的确定,并且在计算模型中解释结果以提供气道上皮异常评分,这指示存在恶变前变化的概率,这指示形成(鳞状)肺癌的风险。
7、如果吸烟者存在有不适,如持续咳嗽,使用BAL或气管刷洗技术,可以从气道上皮获得上皮细胞,并且在从该细胞样本中隔离的RNA上,执行定义的mRNA测量以确定组合TGF-β/HH/PI3K-FOXO途径活性,并且在计算模型中解释结果以提供气道上皮异常评分,这指示存在恶变前变化的概率,这指示形成(鳞状)肺癌的风险。
8、如果在如胸片或CT的图像上的肺部中检测到病变,并且不知道这是否是恶性病变,则对BAL/刷洗获得的气道上皮细胞执行所描述的测试提供关于病变的特征的补充信息,这关于其潜在的恶性肿瘤,特别地也针对吸烟者。
CDS应用
参考图3(图解地示出了临床决策支持(CDS)系统,其被配置为确定指示对象将形成气道癌的风险的风险评分,如本文所公开的),临床决策支持(CDS)系统10被实施为适合配置的计算机12。计算机12可以被配置为通过执行存储在非瞬态存储介质(未示出)上的适合的软件、固件或其他指令操作为CDS系统10,诸如硬盘驱动器或其他磁存储介质、光盘或另一光存储介质、随机存取存储器(RAM)、只读存储器(ROM)、闪存或另一电子存储介质、网络服务器等。尽管说明性CDS系统10由说明性计算机12实现,但是更一般地,CDS系统可以由数字处理设备或包括被配置为执行如本文所阐述的临床决策支持方法的数字处理器的装置实现。例如,数字处理设备可以是手持式设备(例如,个人数据助理或者运行CDS应用的智能电话)、笔记本计算机、台式计算机、平板计算机或设备、远程网络服务器等。计算机12或其他数字处理设备通常包括显示设备14或与显示设备14操作地连接,经由该显示设备14向医学人员显示包括临床决策支持推荐的信息。计算机12或其他数字处理设备通常还包括一个或多个用户输入设备或与其操作地连接,诸如说明性键盘16,或鼠标、轨迹球、触控板、触敏屏幕(可能与显示设备14集成),或另一基于指针的用户输入设备,医学人员可以经由该设备输入信息,诸如用于控制CDS系统10的操作命令、供CDS系统10使用的数据等。
CDS系统10接收关于对象(例如,住院患者,或由肿瘤学家、内科医师或其他医学人员处置的门诊患者,或接受癌症筛查或已知或怀疑具有某种类型的气道癌或用于形成气道癌的倾向的一些其他医学诊断的人)的信息作为输入。CDS系统10对该输入信息应用各种数据分析算法以便生成临床决策支持推荐,该推荐经由显示设备14(或经由语音合成器或其他提供人类可感知输出的设备)呈现给医学人员。在一些实施例中,这些算法可以包括对患者应用临床指南。临床指南是一组存储的标准或“规范”处置推荐,通常基于医学专家小组的推荐来构建,并且任选地以临床“流程图”的形式格式化以促进导航通过临床指南。在各种实施例中,CDS 10的数据处理算法可以额外地或备选地包括对输入信息执行以提取临床决策推荐的各种诊断或临床测试算法,诸如本文所公开的机器学习方法。
在本文所公开的说明性CDS系统(例如,CDS系统10)中,CDS数据分析算法包括一个或多个诊断或临床测试算法,其在由一个或多个医学实验室18采集的输入基因组和/或蛋白质组信息上执行。这些实验室可以不同地位于“现场”,即,在医院或对象正在经受医学检查和/或处置的其他位置,或“异地”,例如,接收(经由邮件或另一递送服务)从对象提取的对象的样本的专业或集中实验室。
样本由实验室处理以生成基因组或蛋白质组信息。例如,可以使用微阵列(在本领域中也不同地称为基因芯片、DNA芯片、生物芯片等)或通过定量聚合酶链反应(qPCR)处理来处理样本以测量证明基因组或蛋白质组信息,诸如感兴趣基因的表达水平,例如以从基因转录的信使核糖核酸(mRNA)的水平,或从根据基因转录的mRNA翻译的蛋白质的水平的形式。作为另一范例,样本可以由基因测序实验室处理以生成脱氧核糖核酸(DNA)的序列,或生成RNA序列、拷贝数变异、甲基化等。其他预期的测量方法包括在病理载玻片上执行的免疫组织化学(IHC)、细胞学、荧光原位杂交(FISH)、邻近连接试验等。可以通过微阵列处理、质谱分析、基因测序或其他实验室技术生成的其他信息包括甲基化信息。也可以执行这样的基因组和/或蛋白质组测量的各种组合。
在一些实施例中,医学实验室18对对象的样本执行多次标准化数据采集,以便生成大量基因组和/或蛋白质组数据。例如,标准化数据采集技术可以为一个或多个染色体或染色体部分或为整个基因组生成(任选地对齐的)DNA序列。应用标准微阵列可以生成数千或数万个数据项,诸如大量基因的表达水平、各种甲基化数据等。类似地,基于PCR的测量可以被用于测量基因的选择的表达水平。该过多的基因组和/或蛋白质组数据或其选定的部分被输入到CDS系统10以进行处理,以便开发用于制定临床决策支持推荐的临床有用信息。
所公开的CDS系统和相关方法涉及处理基因组和/或蛋白质组数据以评估各种细胞信号传导途径的活性并且确定指示对象将形成气道癌的风险的风险评分。然而,应理解,所公开的CDS系统(例如,CDS系统10)可以任选地还包括各种额外能力,诸如基于各种患者数据根据存储的临床指南生成临床决策支持推荐,诸如生命体征监测数据、患者历史数据、患者人口统计数据(例如性别、年龄等)、患者医学成像数据等。备选地,在一些实施例中,CDS系统10的能力可以限于仅执行基因组和/或蛋白质组数据分析以评估细胞信号传导途径的活性并且确定指示对象是否具有异常气道上皮和/或处于形成气道癌的风险中的风险评分,如本文所公开的。
继续参考示范性图3,CDS系统10推断选自包括对象中的TGF-β途径、PI3K-FOXO途径和Notch途径(P
对诸如作为形成细胞信号传导途径的蛋白质级联的部分的中间蛋白的编码细胞信号传导途径的调节蛋白的基因的mRNA表达水平的测量是调节蛋白表达水平的间接量度,并且可能或可能不与实际的调节蛋白表达水平强烈相关(与细胞信号传导途径的总体活性关系不大)。细胞信号传导途径直接调节靶基因的转录—因此,从靶基因转录的mRNA的表达水平是该调节活性的直接结果。因此,CDS系统10基于细胞信号传导途径的一个或多个靶基因的表达水平(mRNA或蛋白质水平作为替代测量)来推断两个或更多个细胞信号传导途径的活性。这确保CDS系统10基于由测量的(一个或多个)靶基因的表达水平提供的直接信息推断途径的活性。
推断的活性然后被用于确定24风险评分,其指示对象将形成气道癌的风险,如本文中详细描述的。风险评分基于推断活性的组合。例如,风险评分可以是如本文和以下参考文献中详细描述的计算的“多途径评分”(MPS),其中每个通过引用以其整体并入本文以用于计算多途径评分(MPS)分别地风险评分的目的:WO2014174003、WO2016062892和WO2016062893。
基于所确定的MPS,在该范例中,CDS系统10将对象分配26给与对象将形成气道癌的不同指示风险相关联的多个风险组中的至少一个,和/或基于所指示的风险决定28为对象推荐的处置。
还可能的是,CDS系统10被配置为将风险评分与从一个或多个额外预后测试获得的一个或多个额外风险评分组合以获得组合风险评分,其中,组合风险评分指示对象将形成气道癌的风险。
