复合材料、用于生产复合材料的工艺和基于复合材料的医疗器械
文献发布时间:2023-06-19 18:27:32
技术领域
本发明涉及复合材料,特别是金属复合材料,用于生产复合材料的工艺和基于该复合材料的医疗器械。医疗器械,特别是植入物,可以适用于骨折(以及腱或韧带等部分的)的固定和/或矫正,并且能够表现出代表骨折等治疗中的完全范式转变(completeparadigm shift)的有针对性的失效(targeted failure)。
背景技术
目前用于承重骨植入物(load-bearing orthopedic implant)(通常基于钛及其合金或不锈钢)的技术忽视了患者对理想的骨恢复的需求,并坚持稳定的永久性骨折固定的传统概念。这就需要进行移除手术,以避免因应力遮挡(stress shielding)(由于大模量不匹配)、植入物相关感染或纳米碎片随时间积累而导致的骨质疏松和再次骨折,这可能会削弱组织或导致慢性炎症(K.T.Kim et al.,Int.J Implant Dent.5(2019)10;A.Mombelliet al.,Clin.Oral Implants Res.29(2018)37-53)。
理想的植入物方案应该是(i)最初是承重的,以使患者能够早期活动;(ii)动态地自适应其特性(与愈合骨的特性相适应)的,直到发生可调整的和有针对性的预设失效,这对于完全的骨恢复是必要的;(iii)可生物降解的(因此不需要移除手术,并且不产生废物);(iv)对身体无害(无论局部还是全身、短期还是长期)的。
目前使用的永久性植入物或可降解植入物(如基于镁(Mg)、锌(Zn)或聚合物)的概念都没有全面反映这种重要的需求组合。虽然可降解植入物至少涵盖了其中的一些方面,但它们在承重情况下的应用迄今有限:基于纯Mg、Zn或聚合物的植入物太软。虽然镁可以通过与稀土元素(REE)合金化而得到强化,但REE的使用是有风险的:REE是非生理性的或可能有毒的、不可生物降解的,并且据报告在骨和器官中积累,至今后果不明(A.Drynda etal.,J.Biomed.Mater.Res.A 91A(2009)360-369;A.Myrissa et al.,Acta Biomater.48(2017)521-529)。此外,镁基材料或锌基材料通常降解过快,导致腐蚀产物(特别是氢气(H
事实上,Mg或Zn和Fe合金的组合受到各种物理和技术限制的阻碍:Mg或Zn和Fe的宏观组合是不可行的,因为它们的电化学电势有很大的差异。宏观复合材料的形成将产生某种“电池”,其中镁或锌将充当牺牲阳极(sacrificial anode),因此这将极大地提高降解率,达到不可接受的水平。然而,本发明人发现,如果在微观甚至亚微观尺度上实现Mg-Fe或Zn-Fe复合材料,则可以防止极其快速的电化学腐蚀。然而,鉴于其巨大的性能差异(例如,因为镁和锌的沸点低于铁的熔点,所以镁和锌在铁熔化之前会沸腾;镁和铁基本上不相溶,并表现出不同的变形行为),微观或亚微观复合材料的形成具有挑战性。
鉴于上述情况,接近上述理想植入物的医疗器械仍有改进空间。
发明内容
本发明的目的
因此,本发明的目的是提供一种医疗器械,例如适用于固定骨折(以及腱或韧带等的部分)和/或矫正的植入物,其最初具有足够的的强度和刚度,以便在愈合期间承重,动态地自适应其特性(强度和刚度与愈合的骨的特性相适应),直到发生可调整的和有针对性的预设失效,是可生物降解的/可吸收的(因此不需要进行移除手术),并且对身体无害或甚至可以表现出有利的生理作用。另一个目的是提供一种复合材料,在该复合材料的基础上可以形成这种医疗器械。
本发明人为了解决这些目的进行了勤奋的研究,并且发现基于Fe和Mg或Zn的特定精细结构的复合材料可以为能够在愈合期间承重的植入物提供足够的强度和刚度。植入后,复合材料的强度和刚度逐渐降低,从而促进骨再生的过程,当骨必须承受越来越多的负载(load)时,它可以长成理想的形状,以满足其自然的承重能力。强度特别是刚度的逐渐丧失导致材料在愈合期后表现出越来越大的弹性,并可能最终导致有针对性的植入物失效(特别是植入物的有针对性的疲劳失效),这代表骨折等治疗中的完全范式转变。不希望受限于任何理论,本发明人假设由于包含Mg相或Zn相和Fe相的复合材料的特定精细结构,其中Mg相或Zn相在至少一个维度(优选至少两个维度或所有三个维度)上的平均尺寸小于20μm,特别是小于10μm,由于几何原因,Mg或Zn的阳极溶解会减慢,因为镁或锌降解时产生的反应产物不能从腐蚀过程中形成的洞穴中快速去除,因此这种去除将成为限制速度的过程步骤。这意味着由于所形成的电化学元件的微米或纳米尺度的尺寸(至少在一个维度上),通过医疗器械的流体流动将由于电流的原因而极其有限。实验和流体动力学都可以证实,在一个维度上减小电化学元件的尺寸就足以大幅降低反应产物的去除速率。因此,可以通过适当调整复合材料的金属相的精细结构来控制和调整Mg或Zn的释放,并且随着Mg或Zn含量的逐渐减少,剩余的富铁医疗器械变得越来越柔韧,并可能最终导致植入物的疲劳失效。此外,由于在骨愈合期间,镁的持续降解,因此产生的镁离子(其为骨诱导性的(osteoinductive))可能会刺激并进一步促进骨的愈合。
根据本发明可以实现的有针对性的植入物失效(特别是植入物的有针对性的疲劳失效)代表了骨折等治疗中的完全范式转变,这一点怎么强调都不为过。这种有针对性的失效不仅偏离(或甚至违背)迄今为止用于治疗骨折等的植入物的持久高承重能力的传统方法,而且几乎不能通过目前可获得的基于例如Fe或Mg或Zn或它们的合金的生物可吸收材料来实现。与已知的生物可吸收材料相比,根据本发明的复合材料可以通过相应的相排列(以及进一步的组成,例如Fe:Mg或Fe:Zn的比例)在非常广泛的范围内(几个数量级)适当地调整降解速率,从而可以如所期望并且适合于个体情况来针对植入物的刻意(intentional)失效。
因此,本发明涉及复合材料,特别是金属复合材料,其包含至少5体积%的Fe和至少1体积%的Mg或Zn,其中复合材料包含Mg相或Zn相和铁相,其中Mg相或Zn相在至少一个维度(优选至少两个维度或所有三个维度)上的平均尺寸小于20μm,特别是小于10μm(例如10nm至10μm)。
本发明进一步涉及一种用于生产复合材料的工艺,该工艺包括使含Fe粉末和含Mg或Zn的粉末的混合物(或共混物)进行大塑性变形(severe plastic deformation,SPD)工艺。
更进一步,本发明涉及基于或包含本文所述复合材料的医疗器械(特别是植入物)。
通过参照以下实施方案的详细描述和附图,将更容易并能更好地理解本发明的实施方案的其他目的和许多附带优点。
附图说明
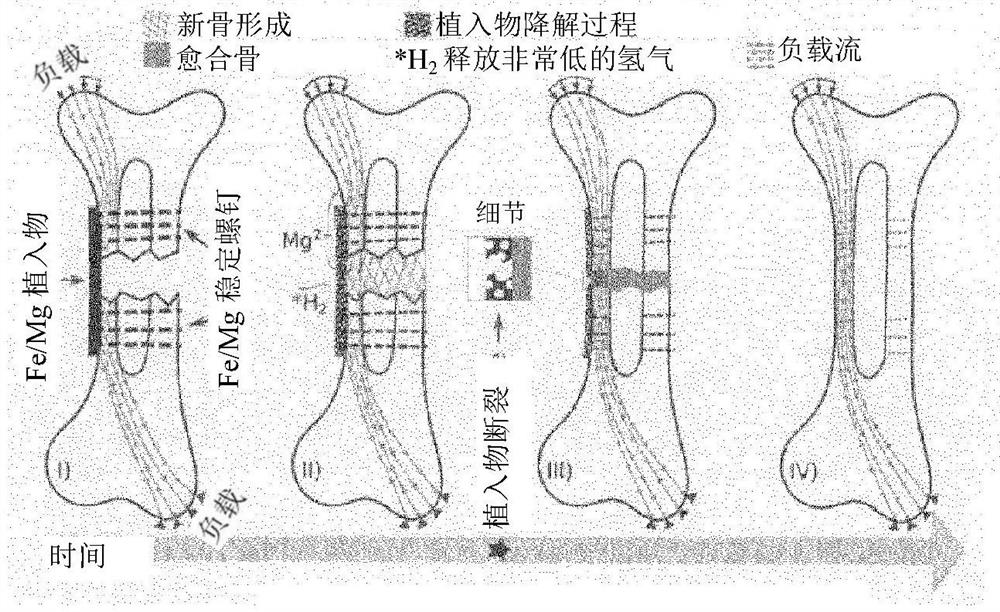
图1示意性地示出了骨折的愈合过程,该愈合过程遵循借助于根据本发明示例性实施方案的植入物的动态骨合(dynamic osteosynthesis)的概念。
图2示出了在Mg50%Fe上进行经a)低应变和b)巨大应变的概念性高压扭转(HPT)试验的代表性复合微结构,以及降解时相应的氢(H
具体实施方式
在下文中,将描述本发明的细节及本发明的其他特征和优点。然而,本发明不限于以下具体描述,并且它们仅出于说明目的。
应当指出,除非另有特别说明,否则与一个示例性实施方案或示例性方面有关描述的特征可以与任何其他示例性实施方案或示例性方面结合,特别是与复合材料的任何示例性实施方案有关的描述的特征可以与用于生产复合材料的工艺的任何示例性实施方案和医疗器械的任何示例性实施方案相结合,反之亦然。
除非另有特别说明,否则当提及单数术语,例如“一个(a)”、“一种(an)”或“该(the)”时,如果使用了不定冠词或定冠词,那么也包括该术语的复数形式,反之亦然,而本文使用的单词“一(one)”或数字“1”通常意指“仅仅一个”或“恰好一个”。
本文所用的表达“包括(comprising)”不仅包括“包括(comprising)”、“包含(including)”或“含有(containing)”的意思,还可以包括“基本上由……组成(consistingessentially of)”和“由……组成(consisting of)”。
在第一方面,本发明涉及复合材料,特别是金属复合材料,包括至少5体积%的Fe和至少1体积%的Mg或Zn。
本文所用的术语“复合材料”尤其可以指由两种或多种具有不同物理或化学性质的组成材料制成的材料,当这些材料组合成复合材料时,产生的材料具有不同于各个组分的特性。与合金或固溶体相比,成品结构中的各个组分保持独立和不同。特别地,复合材料可以包含单独的相,更具体地说,是Mg相或Zn相和Fe相,这将在下文中进一步详细说明。
复合材料包含至少5体积%的Fe和至少1体积%的Mg或Zn。
在一个实施方案中,复合材料包含至少10体积%的Fe,特别是至少20体积%的Fe,特别是至少30体积%的Fe,特别是至少40体积%的Fe,特别是至少50体积%的Fe,特别是至少60体积%的Fe,以及至多99体积%的Fe,特别是至多95体积%的Fe,特别是至多90体积%的Fe,特别是至多80体积%的Fe。
在一个实施方案中,复合材料包含至少5体积%的Mg或Zn,至少10体积%的Mg或Zn,特别是至少20体积%的Mg或Zn,特别是至少30体积%的Mg或Zn,特别是至少40体积%的Mg或Zn,特别是至少50体积%的Mg或Zn,特别是至少60体积%的Mg或Zn,以及至多95体积%的Mg或Zn,特别是至多90体积%的Mg或Zn,特别是至多80体积%的Mg或Zn。
在一个实施方案中,Fe和Mg或Zn的总量为至少80体积%,特别是至少90体积%,特别是至少95体积%,特别是至少99体积%。
在一个实施方案中,Fe与Mg或Zn的体积比为20:80至80:20(20%:80%至80%:20%),特别是30:70至70:30,特别是40:60至60:40。通过采取这种措施,可以获得特别合适的材料特性。
在一个实施方案中,除了基本组分Mg或Zn和Fe之外,复合材料可以进一步包含选自以下的至少一种元素:Ca(例如至多5重量%,特别是至多2重量%)、Mn(例如至多30重量%,特别是至多20重量%)、Zr(例如至多2重量%)、Y(例如至多5重量%)、Nd(例如至多5重量%)、Gd(例如至多10重量%)、Sn(例如至多5重量%)和Al(例如至多5重量%)。此外,如果是Fe-Mg复合材料,该复合材料可以进一步包含Zn(例如至多5重量%,特别是至多2重量%)。如果是Fe-Zn复合材料,该复合材料可以进一步包含Mg(例如至多5重量%,特别是至多2重量%)。当使用Mg-Ca-Zn合金作为用于生产复合材料的Mg源时,特别可以包含Mg、Ca和Zn,并且Mg、Ca和Zn因此可以特别存在于复合材料的Mg相中。当使用非磁性Fe-Mn合金作为用于生产复合材料的Fe源时,特别可以包含Mn,因此Mn可以特别存在于复合材料的Fe相中。此外,复合材料可以进一步包含不可避免的杂质,特别是总量至多1重量%,优选至多0.5重量%,更优选至多0.1重量%,和/或其中每种杂质的含量不超过0.1重量%,优选不超过0.05重量%,更优选不超过0.01重量%。
复合材料包含镁相或锌相和铁相。特别地,复合材料可以包含结晶Mg相或Zn相和结晶Fe相。本文所用的术语“Mg相或Zn相”可以特别表示复合材料的一个独特部分,其中复合材料的镁或锌主导性地存在,特别是以结晶的形式存在。例如,复合材料中超过80%,特别是超过90%,甚至基本上全部的镁或锌都可以以Mg相或Zn相存在。因此,Mg相或Zn相也可称为富镁的或富锌的或富镁相或富锌相。同样,本文所用的术语“Fe相”可以特别表示复合材料的一个独特部分,其中复合材料的铁主导性地存在,特别是以结晶形式存在。例如,复合材料中超过80%,特别是超过90%,甚至基本上所有的铁可以存在于Fe相中。因此,Fe相也可以称为富铁的或富铁相。如本领域技术人员容易理解的,复合材料可以包括多个Mg相或Zn相和Fe相。
在一个实施方案中,Fe相与Mg相或Zn相的体积比为20:80至80:20(20%:80%至80%:20%),特别是30:70至70:30,特别是40:60至60:40。
该复合材料的特征尤其在于Mg相或Zn相在至少一个维度(优选至少两个维度或甚至所有三个维度)上的平均尺寸小于20μm,特别是小于10μm(例如10nm至10μm)。事实证明,在一个维度上减小Mg相或Zn相的尺寸已经足以大幅降低Mg或Zn的降解速率。本发明人假设,由于包含Mg相或Zn相和Fe相的复合材料的特定精细结构,其中Mg相或Zn相在至少一个维度上的平均尺寸小于20μm,特别是小于10μm,Mg或Zn的阳极溶解由于几何原因而减慢,因为Mg或Zn降解时产生的反应产物不能从腐蚀过程中形成的洞穴中快速去除,因此这种去除将成为限制速度的过程步骤。因此,可以通过适当调整复合材料金属相的精细结构来控制和调整镁或锌的释放,并且随着Mg或Zn含量的减少,剩余的富Fe医疗器械变得越来越柔韧(有弹性),并可能最终导致植入物失效(特别是植入物的疲劳失效)。
如本文所用,术语“Mg相或Zn相的平均尺寸”可特别表示复合材料中多个Mg相或Zn相尺寸的平均值(特别是算术平均值)。如本文所用,术语“至少一个维度”可具体表示三维Mg相或Zn相(即复合材料中镁或锌主要存在的复合材料的不同部分)的三个空间维度(长度、宽度和高度)中的至少一个。因此,如本文所用,术语“至少两个维度”可具体表示三维Mg相或Zn相的三个空间维度(长度、宽度和高度)中的至少两个。
在一个实施方案中,Mg相或Zn相在至少一个维度(优选至少两个维度或所有三个维度)上的平均尺寸小于5μm(例如200nm至5μm),特别是小于3μm(例如500nm至3μm)。Mg相或Zn相在至少一个维度上的平均尺寸可以特别地小于10μm,特别地小于5μm,特别地小于3μm,并且可以特别地为至少10nm,特别地至少25nm,特别地至少50nm,特别地至少100nm,特别地至少200nm,特别地至少500nm。通过适当调整复合材料金属相的精细结构,可以根据需要调整Mg或Zn的释放。
Mg相或Zn相的平均尺寸可以例如通过用适当放大倍数的目视显微镜观察来确定,例如通过使用光学显微镜、电子显微镜(例如透射电子显微镜(TEM)或高分辨率扫描电子显微镜(SEM))并通过随机选择适当数量的Mg相或Zn相并计算各自尺寸的平均值(例如算术平均值)。
在一个实施方案中,Fe相中和/或Mg相或Zn相中的平均晶粒尺寸小于5μm,特别是小于1μm。特别地,如果Fe相中的平均晶粒尺寸小于5μm,特别是小于1μm,则可能是有利的。通过采取这种措施,复合材料的强度可以显著提高,并且因此可以使基于该材料的医疗器械,特别是植入物具有高承载能力(high load bearing capability)。
与确定Mg相或Zn相的平均尺寸类似,平均晶粒尺寸的确定是本领域技术人员已知的,并且可以例如通过具有适当放大倍数的目视显微镜观察来进行,例如通过使用光学显微镜、电子显微镜(例如透射电子显微镜(TEM)或高分辨率扫描电子显微镜(SEM))并且通过随机选择适当数量的晶粒并计算各自晶粒尺寸的平均值来进行。
在一个实施方案中,复合材料通过大塑性变形(SPD)工艺可得(获得)。本文使用的术语“大塑性变形(severe plastic deformation)”可以特别指一组允许施加巨大应变的金属成型技术。通常,它们涉及复杂的应力状态或高剪切应变,这在材料内产生巨大的缺陷密度,导致远低于一微米的显著晶粒细化。SPD工艺进一步提供了将细金属粉末固结成大块复合材料的可能性。SPD工艺、不同SPD工艺的组合或放电等离子烧结(spark plasmasintering,SPS)或类似工艺的组合可适用于制备本文所述的复合材料,所述工艺允许将金属粉末预固结成大块,并随后通过SPD工艺或允许施加大应变的传统金属成型工艺(例如轧制(rolling)、拉丝或锻造(swaging))使其变形。
在一个实施方案中,大塑性变形工艺包括高压扭转(HPT)工艺。本文使用的术语“高压扭转(high pressure torsion)”可以特别表示SPD工艺,其中样品受到巨大的流体静压力(hydrostatic pressures),随后施加大的剪切应变。在粉末前体的情况下,这确保致密化成块体材料(bulk material)或复合材料。更具体地说,粉末混合物可以被固结和精炼成致密的块体(纳米)复合材料。事实证明,HPT工艺特别适合于以多种方式改变Mg相或Zn相和Fe相的结构尺寸以及它们的几何排列。此外,与例如结合多重锻造或拉拔的放电等离子烧结相比,HPT可以允许更容易地调整复合材料的结构。
在一个实施方案中,复合材料的屈服强度大于200MPa,特别是大于300MPa。因此,基于复合材料的医疗器械,特别是植入物,在用于固定骨折时,可以表现出足够的强度以在愈合期间承载(load-bearing)。屈服强度尤其可以根据DIN EN ISO 6892-1标准(拉伸试验)或DIN 50106:2016-11(压缩试验)来确定。
在一个实施方案中,复合材料的杨氏模量小于200GPa,特别是小于150GPa。因此,基于复合材料的医疗器械,特别是植入物,可以表现出足够的刚度以在愈合期间承重。杨氏模量尤其可以根据DIN EN ISO 6892-1(拉伸试验)或DIN 50106:2016-11(压缩试验)来确定。可选地,杨氏模量也可以根据DIN EN ISO 14577-1:2015-11标准测定。
在第二方面,本发明涉及一种用于生产复合材料(特别是根据第一方面的复合材料)的工艺,包括对含Fe粉末和含Mg或Zn的粉末的混合物(或共混物)进行大塑性变形工艺。
在一个实施方案中,含Fe粉末包括纯铁或铁合金,例如(非铁磁性)Fe-Mn合金。
在一个实施方案中,含Mg粉末包括纯Mg或Mg合金,例如Mg-Ca-Zn合金、Mg-Zr合金、Mg-Y合金、Mg-Gd合金、Mg-Sn合金、Mg-Al合金以及这些合金元素的组合。
在一个实施方案中,含Zn粉末包括纯Zn或Zn合金,例如Zn-Mg合金、Zn-Al合金、Zn-Ca合金、Zn-Sn合金以及这些合金元素的组合。
在一个实施方案中,含Fe粉末和/或含Mg或Zn的粉末的平均粒度小于40μm,特别是小于20μm。原料的平均粒度越小,在随后的大塑性变形中需要的功夫(effort)就越少。此外,通过采取这种措施,在给定的Mg或Zn和Fe的相分数和相同的施加应变下,可以获得复合材料的降低的降解速率。
在一个实施方案中,大塑性变形工艺包括高压扭转工艺。关于大塑性变形(SPD)以及高压扭转(HPT)工艺的进一步细节已经在第一方面的上下文中给出。
在一个实施方案中,大塑性变形工艺,特别是高压扭转,在至少2GPa,特别是至少3GPa,并且至多15GPa,特别是至多12GPa的压力下进行。
在一个实施方案中,大塑性变形工艺,特别是高压扭转,在高温下进行,例如在至少200℃,特别是至少300℃的温度下进行。通过采取这种措施,在给定的Mg或Zn和Fe的相分数和相同的施加应变下,可以获得复合材料的降低的降解速率。
在第三方面,本发明涉及基于或包含本文所述复合材料的医疗器械。特别地,医疗器械可以是植入物。
本文所用的术语“植入物(implant)”特别是指可至少部分植入人体或动物体内的医疗器械。植入物可以具有各种二维或三维形状,例如销(pin)、杆、螺钉、线(wire)、板、盘、圆顶或半球。特别地,植入物可以选自板、钉子、螺钉和外科封缝钉(surgical staple);即植入物可以成形为板、钉、螺钉和/或外科封缝钉。植入物一旦植入人体或动物体内,则尤其可以至少部分地被人体或动物体吸收(生物可降解)。植入物可以特别地被配置用于骨、腱或韧带断裂的固定和/或矫正,特别是用于骨、腱或韧带断裂的内部固定和/或矫正。
本文所用的表达“基于复合材料的医疗器械/植入物”特别是指医疗器械或植入物包含复合材料,特别是作为其基本组成成分的复合材料。它甚至可能意味着植入物(基本上)由这种复合材料组成或由这种复合材料制成。
在一个实施方案中,医疗器械,例如植入物,具有大于200MPa的屈服强度和/或小于200GPa的杨氏模量。在该实施方案中,医疗器械可以优选地被配置为使得在三倍(threefold,three times)愈合期之后,特别是在两倍(twofold,twice,double)愈合期之后,屈服强度和/或杨氏模量中的至少一个的值小于各自初始值的50%。为此,可以通过适当调整复合材料金属相的精细结构来调整Mg或Zn的释放,并且随着Mg或Zn含量的逐渐减少,医疗器械的强度和刚度可能会下降,即构成医疗器械的材料的屈服强度和杨氏模量可能下降。
如本文所用,术语“愈合期(healing period)”尤其可以指愈合过程,特别是对于骨、肌腱或韧带的断裂的愈合的有意义的持续时间,并且因此可以有相应的差异。
在一个实施方案中,医疗器械,特别是植入物,被配置成使得医疗器械的失效(例如断裂)发生在愈合期之后,但优选在三倍(threefold)(three times)愈合期之前。为此,可通过适当调整复合材料金属相的精细结构来调整镁或锌的释放,并且随着镁或锌含量的减少,剩余的富铁医疗器械变得越来越柔韧,最终可能导致植入物的疲劳失效。
通过参照附图进一步描述本发明,这些附图仅用于说明具体的实施方案的目的,而不应被解释为以任何方式限制本发明的范围。
在参照附图进一步详细描述示例性实施方案之前,将基于已经开发的本发明的示例性实施方案总结一些基本考虑因素。
迄今为止,承载和可吸收的植入物保持其完整性的时间远远长于所要求的。由于在前四周需要高强度,降解速率被调整到低水平,因此,对骨的支持功能存在的时间远远长于对最佳骨再生的有用的时间。
根据本发明的实施方案的具有松散刚度和期望失效的自适应植入物的实施被精心设计为以最佳方式刺激骨的再生,因此是全新的和创新的。
从植入物到骨的负载转移和期望的失效可以通过随着时间的推移充分降低强度和弹性模量来调整。而如果材料的强度降低,从医疗器械(MD)到骨的负载转移是不言自明的,但也有证据表明,降低植入物的弹性模量可以用于实现期望的负载转移,从而优化愈合条件。考虑到与需要被支撑的对象(object)相比,支撑结构的刚度降低10倍,这就变得合理了。在这种情况下,根本没有任何支撑,并且对象本身将承载负荷(carry the load)。在用于骨折骨的固定(fixations)的情况下,将会出现完全相同的效果,然而对于小得多的刚度降低,这种情况已经发生了。因此,骨的承载功能被不断地刺激到其自然状态。
根据本发明实施方案的可吸收植入物的提出的(proposed)功能可以相应地分为三个部分:
第1部分:当T 第2部分:将T1和T2之间的这些值降低到可调整的、对于骨再生最佳的刺激水平,如果需要,最终失效。 第3部分:在T2之后的时间段内,继续通常和已知的吸收过程(即,此残留物的最终吸收过程可能最终需要1-3年)。 应注意,T1比愈合期长,但T2比三倍愈合期短。在理想情况下,T2短于两倍愈合期或1.5倍愈合期。 为了达到这个目标,已经研究了几种可吸收的和生物相容的材料。据观察,有机材料通常适合于适当地调整降解速率。然而,由于它们的强度水平和初始降解期,单一材料的多用途使用是完全不可能的。 考虑到金属,对于镁、锌及它们的合金来说,预测植入物的预期失效是极其困难的。这是因为最初放出大量氢气(H 原则上,可以考虑Mg或Zn和Fe的复合材料,这将结合两种材料的优点。然而,Mg或Zn和Fe的宏观组合是不可行的,因为它们的电化学电势相差很大。宏观复合物的形成将产生“电池”,其中镁或锌将用作牺牲阳极,因此这将极大地提高降解速率,达到不可接受的水平。因此,如上所述,Mg-Fe或Zn-Fe复合材料需要在微观或甚至亚微观尺度上实现,以防止出现上述极快的电化学腐蚀。 由于Mg或Zn和Fe的熔点极为不同,所以不能通过常规方法合成Mg或Zn和Fe的复合材料。因此,需要有针对性地采用其他加工技术,而HPT工艺为制造这种复合材料提供了完美的解决方案。 HPT工艺不仅可以生成Mg或Zn和Fe的复合物,而且还可以通过改变工艺参数,确保两相的几何排列和尺寸在很大范围内变化。因此,改变相间距及其几何排列可以在很大的范围内调整复合材料的降解速率和强度。 此外,简单的方法(例如,具有不同结构尺寸和/或直径的区域等)可以另外调整(加速或延缓)降解速率,从而调节初始氢气(H 提出的将Mg或Zn和Fe组合成用于MD的复合材料提供了一系列进一步的可能性: 1)SPD工艺,不同SPD工艺的组合或放电等离子烧结(SPS)或类似工艺的组合,其允许将金属粉末预固结成大块,并随后通过SPD工艺或允许施加大应变的常规金属成型工艺(例如轧制、拉丝或锻造)使其变形,从而将Mg或Zn和Fe粉末合成为完全致密的大块化合物。特别是HPT工艺适合于改变镁或锌和铁相的结构尺寸以及它们的几何排列形式。 2)如果Mg或Zn和Fe两种成分是完全结合的(例如可能通过HPT工艺可以实现的),则复合物的弹性模量高,其值在纯Mg或纯Zn和纯Fe的弹性模量之间。如果在复合材料降解过程中,Mg或Zn优先溶解,则剩余Fe骨架的刚度显著下降。承载能力(强度)仍然保持在相当高的水平,因为Fe的强度比Mg或Zn高得多。 3)如果Mg或Zn与Fe的相间距较小,则由于几何原因,Mg或Zn的阳极溶解变慢。Mg或Zn降解产生的反应产物不能从腐蚀过程中形成的洞穴中快速去除,这种去除将成为限制速度过程。这意味着由于所形成的电化学元件的微米或纳米级尺寸(至少在一个维度上),由于电流定律的原因,通过MD的流体流动将受到极大的限制。实验和流体动力学都证实,在一个维度上电化学元件尺寸的减小就可以大大降低反应产物的去除速率。 利用本发明提出的方案,与宏观但相同的电化学系统相比,MD的Mg相或Zn相的降解可以被延迟20%,优选被延迟50%。 由于Mg或Zn的间距至少在一个维度上远低于20μm,因此实现了降解速率的大幅降低。其他实验已经证明,50nm至10μm,优选200nm至5μm,理想地500nm至3μm的Mg或Zn间距完全适合于在MD中的应用。应再次指出,这些尺寸仅需要沿着一个主轴,而沿着其他方向,Mg或Zn相的尺寸仍然可以从几微米到一毫米。 4)如果Mg或Zn和Fe形成块体(bulk)且完全致密的复合材料,则在植入后弹性模量相当高。然而,由于Mg或Zn的腐蚀,剩余的铁骨架由于其相对较低的刚度而变得非常柔韧。 本发明的这一特性可以优先应用于MD。开始时,整个MD的刚度高于骨折后要支撑的骨结构(健康状态)的刚度。MD将承载负荷,骨受到保护,由MD支撑,愈合过程可以开始。 在骨折骨的愈合期间,Mg或Zn溶解,因此MD变得比所支撑的骨结构更不坚硬和更柔韧。骨需要持续承载更多的负荷,这有利于愈合过程和健康骨结构的形成。 通过改变Mg相或Zn相和Fe相的结构尺寸以及它们在MD上的结构排列,可以在很大的范围内调整Mg相或Zn相的降解速率。改变Mg或Zn和Fe的体积分数以及HPT中的工艺参数能够将组分的结构规模改变超过四个数量级(100μm-10nm)。 此外,Mg相或Zn相和Fe相可以以不同的方式进行几何排列。例如,相同组成和结构规模的复合材料可以由Mg或Zn和Fe的层状交替排列组成,但也可以由精细分散和单独的Mg相或Zn相或Fe相组成。这样,与初始刚度相比,在愈合期之后和三倍愈合期之前,MD的流动应力和/或刚度可以降低10%,优选降低大于20%,理想地降低大于30%。 5)如果Mg或Zn被溶解,剩余的铁骨架变得柔韧,硬度降低。这伴随着铁骨架内变形的增强和较高的应力水平急剧缩短了疲劳寿命。因此,尽管铁降解尚未明显开始或需要更多时间,但最终可能会发生断裂。这考虑到了这样一个概念,涉及到一旦骨愈合完成,Fe骨架刻意(deliberately)选择的失效。因此可以排除从医学观点来看并不优选的MD的长期支持功能。 6)由于在骨愈合期间Mg或Zn的持续降解,释放的Mg离子是骨传导性的,是刺激和支持骨愈合的因素。 7)由于Mg相或Zn相的尺寸减小以及相应的降解速率降低(对比3),可以显著减少氢气泡的释放问题,这从医学角度来看是优选的。 8)HPT工艺和SPD工艺通常会强化Mg相或Zn相和Fe相。当晶粒尺寸小于5μm,优选小于1μm时,Fe的强度通常从100MPa提高到大于1000MPa。Fe相的这种巨大强化使得MD具有大于300MPa的巨大承载能力。 9)由于Mg相或Zn相的降解比Fe相的降解进行得更快,与体液接触的铁Fe表面得到增强,这加速了通常较低的铁降解速率。 图1示意性地示出了骨折的愈合过程,该愈合过程遵循借助于根据本发明示例性实施方案的植入物的动态骨合的概念。 图1I)示出了根据本发明的实施方案,借助于基于Fe/Mg复合材料的植入物对骨折的初始稳定作用。在愈合过程的初始阶段,植入物表现出足够的强度和刚度,能够取代骨的自然承重功能。 随着愈合过程的进行,Fe/Mg复合材料由于镁的溶解而逐渐降解,如图1II)所示。由于这种逐渐溶解的结果,剩余的富Fe的植入物的强度和刚度降低,从而促进骨再生(由释放的镁离子的骨传导效应支持),并且当骨必须承载越来越多的负荷时,它可以生长成理想的形状,以实现其自然的承重能力。 如图1III)所示,在骨折愈合完成后,植入物可能降解到其自身断裂的程度,并且如图1IV)所示,最终可能随着时间的推移而被完全吸收。 图2示出了在Mg50%Fe上进行经a)低应变和b)巨大应变的概念性高压扭转(HPT)试验的代表性复合微结构,以及降解时相应的氢(H 在图2的左侧,示出了由等量的Mg和Fe制成的复合材料经a)低应变和b)巨大应变的扫描电子显微镜图像。从这些显微图像中可以明显看出,通过施加高应变可以获得Fe和Mg的特殊精细结构的复合材料。在图2的右侧,示意性地示出了它们对腐蚀速率的影响。从该图可以明显看出,通过结构限制可以实现Mg溶解的显著减少(如氢气(H 虽然已经通过具体实施方案和实施例详细描述了本发明,但是本发明并不局限于此,并且在不脱离本发明的范围的情况下,各种改变和修改是可以的。
