人参皂苷Rb1在制备抗抑郁药物中的应用
文献发布时间:2023-06-19 09:55:50
技术领域
本发明属于生物医药领域,具体涉及人参皂苷Rb1在制备抗抑郁药物中的应用。
背景技术
抑郁症是由各种原因引起的以抑郁为主要症状的一组心境障碍或情感性障碍。由于成瘾、耐受性和多种副作用等问题,临床上约40-60%的抑郁症患者对一线药物无敏感反应(Gerhard DM,Wohleb ES,Duman RS.Emerging treatment mechanisms fordepression:focus on glutamate and 690synaptic plasticity.Drug Discov Today,2016,21:454 464.),给家庭和社会造成严重的负担,该如何控制抑郁症患者病情的发展是一个亟待解决的问题。
抑郁症的发生受众多因素的影响,且各因素间通过不同的信号通路、病理生理等过程可导致突触结构和功能的改变,损害突触可塑性,诱导抑郁症的发生(LedfordH.Psychopharmacology drugmakers target fog of depression.Nature,2016,530(7588):17)。而突触结构和功能的恢复对抑郁症的治疗及预后可产生重要的作用。经典的抗抑郁药如选择性5-羟色胺(5-hydroxytryptamine,5-HT)再摄取抑制剂(Selectiveserotonin reuptake inhibitors,SSRIs)和三环类药物(Tricyclic antidepressants,TCA)的抗抑郁作用均与突触可塑性的改善有关(Castren E,Hen R.Neuronal plasticityand antidepressant actions.Trends Neurosci,2013,36(5):259-267)。因此,突触可塑性可以作为治疗抑郁症的一个切入点,研究突触可塑性的分子机制将为抑郁症病理生理机制的阐明和抗抑郁药物的开发提供良好的思路和支持。
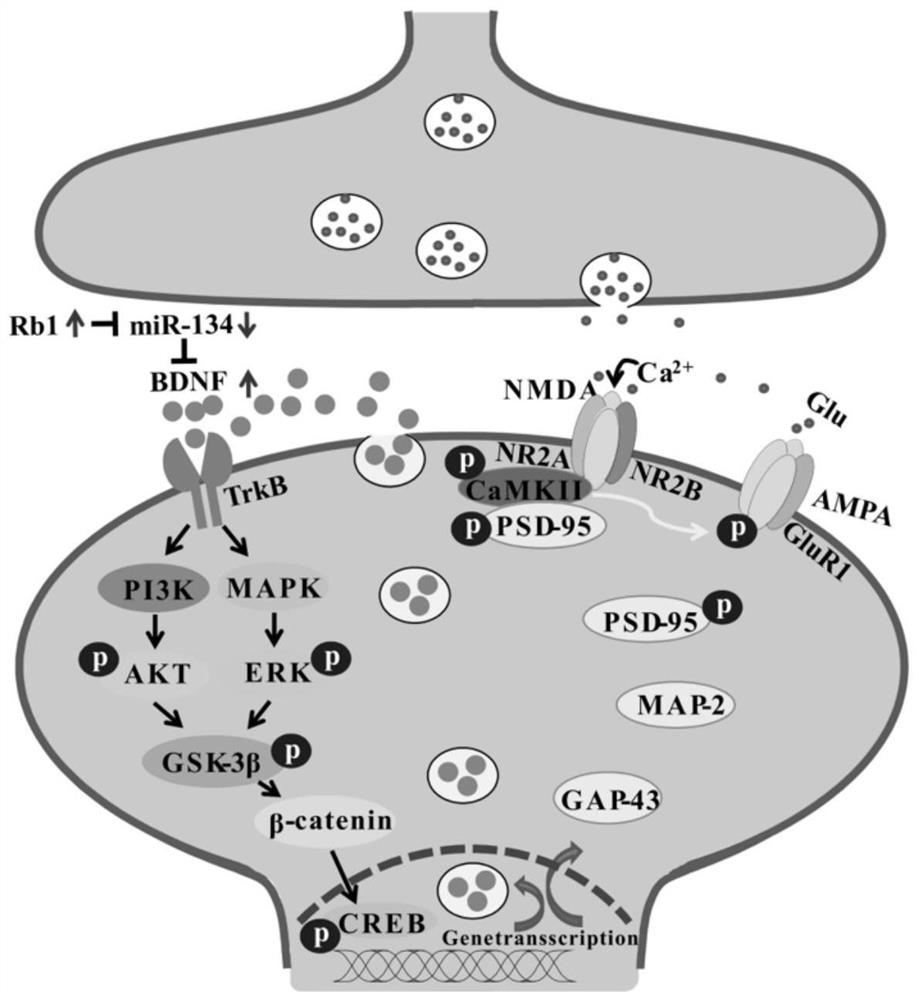
脑源性神经营养因子(Brain-derived neurotrophic factor,BDNF)是评价神经可塑性的关键指标(Autry AE,Monteggia LM.Brain-derived neurotrophic factor andneuropsychiatric disorders.Pharmacological Reviews,2012,64(2):238.)。BDNF属神经营养家族,广泛分布于大脑组织,其不仅可在活性突触处或其附近大量表达,调节神经元的存活和分化,还是大多数临床一线药物和电惊厥等疗法的主要靶点。原肌球蛋白相关激酶B(Tropomyosin-related kinase B,TrkB)是BDNF的功能性受体,广泛分布在突触前膜和突触后膜上,并被BDNF激活以调节神经递质的释放及突触后反应。BDNF通过TrkB可启动至少两个细胞内信号转导途径在调节突触结构重塑和增强突触传递效能中起关键作用,如丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)/细胞外调节蛋白激酶(Extracellular regulatory protein kinase,ERK)和磷脂酰肌醇3-激酶(Phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(Protein kinase B,AKT)途径,这些不同的信号通路最终通过激活核转录因子环磷腺苷效应元件结合蛋白(cAMP-responseelement binding protein,CREB)来调控多种基因的转录和表达,其中包括突触相关蛋白因子及BDNF本身。
MicroRNAs(miRNAs)是一类具备内源调控功能的非编码小RNA,不仅对突触的发生和功能起调节作用,而且对病理生理过程中涉及重塑的应激性疾病也有重要影响(Hu Z,LiZ.miRNAs in synapse development and synaptic plasticity.Curr Opin Neurobiol,2017,45:24-31.)。
人参(Panax ginseng C.A.Meyer)为我国五加科多年生草本植物。传统上人参对中枢神经系统疾病的治疗已有几千年的历史,主要是学习和记忆障碍、情绪障碍等。有关人参制剂对抑郁症的治疗可追溯到两千多年前的东汉时期由张仲景(150-219A.D.)撰写的《伤寒论》,人参为小柴胡汤传统配方中的重要组分,并且该方剂已在临床上用于抑郁症的治疗。2003年Kennedy和Scholey报道称,人参的临床适应症之一是抗抑郁(Kennedy DO,Scholey AB.Ginseng:potential for the enhancement of cognitive performance andmood.Pharmacology Biochemistry&Behavior,2003,75(3):687-700)。人参皂苷为人参的主要药效成分,目前人们已从人参总皂苷中分离出40余种单体,主要分为原人参二醇和原人参三醇两种类型,其中人参皂苷Rb1为原人参二醇型代表性成分。
发明内容
为了克服现有技术中存在的缺点与不足,本发明的目的在于提供人参皂苷Rb1在制备抗抑郁药物中的应用。
本发明的目的通过如下技术方案实现:
人参皂苷Rb1在制备抗抑郁药物中的应用。
人参皂苷Rb1在制备改善海马突触可塑性药物中的应用。
人参皂苷Rb1在制备miR-134靶向介导的BDNF信号通路调节剂中的应用。长期慢性不可预测的温和应激会增加小鼠海马中miR-134的表达。高表达的miR-134通过靶向结合BDNF基因3’UTR抑制其活性,进而抑制其受体TrkB及其下游PI3K-AKT和MAPK-ERK的表达。这两个途径的抑制均可降低糖原合成酶激酶(Glycogen synthase kinase-3β,GSK-3β)Ser9位点的磷酸化,促使GSK-3β活化。活化后的GSK-3β可降低β-catenin的稳定性,影响其与核内CREB结合及调控基因转录和表达,例如BDNF、突触后致密蛋白-95(Postsynapticdensity protein-95,PSD-95)、生长相关蛋白-43(Growth associated protein-43,GAP-43)、微管相关蛋白-2(Microtubule-associated protein-2,MAP-2)等。在所述的应用中,人参皂苷Rb1可以挽救慢性应激过程中miR-134对BDNF级联信号通路的负面调控,继而促进与突触可塑性相关的基因转录和表达,增加海马突触可塑性,发挥抗抑郁作用。
所述的miR-134的核苷酸序列如下所示:
5’-AGGGTGTGTGACTGGTTGACCAGAGGGGCGTGCACTCTGTTCACCCTGTGGGCCACCTAGTCACCAACCCT-3’。
人参皂苷Rb1在制备促进海马突触可塑性相关蛋白PSD-95、GAP-43、MAP-2、N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor,NMDAR)亚基NR2A和NR2B、α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体(α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid receptor,AMPAR)亚基GluR1、钙/钙调素依赖性蛋白激酶II(Ca
人参皂苷Rb1联合miR-134抑制剂在制备抗抑郁药物中的应用。
所述的应用是在使用人参皂苷Rb1时使用miR-134抑制剂。
一种抗抑郁药物,包括人参皂苷Rb1和miR-134抑制剂。
本发明具有如下的有益效果:
本发明首次发现人参皂苷Rb1通过miR-134介导的BDNF信号通路调控海马突触可塑性,发挥抗抑郁作用,首次阐明了人参皂苷Rb1调控海马突触可塑性发挥抗抑郁样作用的分子机制。
附图说明
图1是双荧光素酶报告基因系统验证miR-134与BDNF的结合试验结果图;其中,A为二者的结合位点预测图;B为各组荧光素酶相对活性变化图。
图2是人参皂苷Rb1及miR-134干预对慢性不可预测性温和应激(Chronicunpredictable mild stress,CUMS)小鼠行为学的影响试验结果图;其中,A和B为旷场试验(Open-field test,OFT)结果图;C为悬尾试验(Tail suspension test,TST)结果图;D为强迫游泳试验(Forced swim test,FST)结果图;E为糖水偏爱试验(Sucrose preferencetest,SPT)结果图。
图3是人参皂苷Rb1及miR-134干预对小鼠海马区神经元特异性的DNA结合核蛋白(Neuronal Nuclei,NeuN)的影响试验结果图;其中,A为免疫组化观察结果拍照图;B为试验结果统计图。
图4是人参皂苷Rb1及miR-134干预对小鼠海马CA1、CA3和DG区树突棘密度的影响试验结果图;其中,A为CA1区的试验结果图;B为CA3区的试验结果图;C为DG区的试验结果图。
图5是人参皂苷Rb1及miR-134干预对小鼠海马CA1和CA3区椎体细胞突触超微结构的影响试验结果图;其中,A为CA1区的试验结果图;B为CA3区的试验结果图。
图6是人参皂苷Rb1及miR-134干预对小鼠海马CA3区Schaffer collateral-CA1通路上长时程增强(Long-term potentiation,LTP)诱导的影响试验结果图。
图7是人参皂苷Rb1及miR-134干预对小鼠海马突触相关蛋白表达的影响试验结果图;其中,A为突触素(Synaptophysin,Syn);B为PSD-95;C为GAP-43;D为MAP-2;E为NR2A;F为NR2B;G为GluR1;H为CaMKII。
图8是人参皂苷Rb1及miR-134干预对BDNF级联信号通路的影响试验结果图;其中A为BNDF;B为TrkB;C为AKT;D为ERK1/2;E为GSK-3β;F为β-catenin;G为CREB。
图9是人参皂苷Rb1通过miR-134介导的BDNF信号通路调控海马突触可塑性的抗抑郁作用机制示意图。
具体实施方式
下面结合实施例和附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。下列实施例中未注明具体实验条件的试验方法,通常按照常规实验条件或按照制造厂所建议的实验条件。除非特别说明,本发明所用试剂和原材料均可通过市售获得。
实施例中涉及的抗体如下:BDNF(批号ab226843)、p-TrkB(批号ab228507)、p-NR2B(批号ab81271)购买于Abcam公司;TrkB(批号4603)、AKT(批号4691)、p-AKT(批号9275)、ERK1/2(批号4695)、p-ERK1/2(批号9102)、CREB(批号9197)、Syn(批号36406)、PSD-95(批号3450)、p-PSD-95(批号45737)、GAP-43(批号8945)、β-catenin(批号8480)、GSK-3β(批号9315)、p-GSK-3β(批号9323)、NR2A(批号4205)购买于Cell Sig naling Technology公司;p-CREB(批号YP0075)、CaMKII(批号YT0623)、p-CaMKII(批号YP0279)、NR2B(批号YN1212)、GluR1(批号YM3492)购买于Immunoway公司。AA V-vehicle、AAV-miR-134-up和AAV-miR-134-down合成于上海吉凯基因科技有限公司(miR-134的核苷酸序列为:5’-AGGGTGTGTGACTGGTTGACCAGAGGGGCGTGCACTCTGTTCA CCCTGTGGGCCACCTAGTCACCAACCCT-3’);FD RapidGolgi StainTM Kit购买于北京博蕾德生物科技有限公司;
实施例1:双荧光素酶报告基因系统验证miR-134与BDNF的结合
1、设计并合成BDNF-3’UTR-WT和BDNF-3’UTR-Mut引物,引物序列如下:
F-BDNF-3’UTR-WT:5’-TGTTTCCTCATGACTGCCCC-3’(SEQ ID NO.1);
R-BDNF-3’UTR-WT:5’-CGATCCGGGTTTCCGTGTTA-3’(SEQ ID NO.2);
F-BDNF-3’UTR-Mut:5’-GCTTCGGCAGCACATATACTAAAAT-3’(SEQ ID NO.3);
R-BDNF-3’UTR-Mut:5’-CGCTTCACGAATTTGCGTGTCAT-3’(SEQ ID NO.4);
2、委托上海宇玫博生物科技有限公司合成BDNF-3’UTR-WT和BDNF-3’UTR-Mut序列,并在片段两端分别加上酶切位点Sac I和Xho I和保护碱基(划线部分为酶切位点),两者序列如下:
BDNF-3’UTR-WT:
C
BDNF-3’UTR-Mut:
C
3、构建目的基因3’UTR双荧光素酶报告载体
(1)利用限制性内切酶Sac I和Xho I对BDNF-3’UTR-WT和BDNF-3’UTR-Mut两个片段(将合成的片段稀释为500ng/μL)以及载体pmirGLO(市售,稀释为100ng/μL)进行酶切,酶切体系如下:10×Cutsmart buffer,1μL;Xho I,0.5μL;Sac I,0.5μL;目的片段,4μL(pmirGLO载体,1μL);RNAse free water 4(载体酶切体系中加7)μL。
(2)酶切体系置于37℃水浴锅中酶切1h,然后进行胶回收。
(3)将回收的基因片段和载体按一下体系进行同源重组:5×CE II Buffer,2μL;回收的目的片段,4μL;回收的pmirGLO载体,1μL;Exnase II,1μL;RNAse free water,2μL。
(4)37℃水浴30min,然后取3.5μL转化大肠杆菌感受态DH5α,涂板并过夜培养。
(5)挑取单克隆进行PCR鉴定,将阳性菌落送测序。
(6)对测序正确的菌落摇菌,提取质粒,获得靶基因野生型、突变型两种重组载体,分别命名为pmirGLO-BDNF-3’UTR-WT和pmirGLO-BDNF-3’UTR-Mut。
4、细胞转染
使用转染试剂Fu Gene HD将miR-134mimics(委托上海宇玫博生物科技有限公司合成)(mmu-miR-134-5p)或miR-134阴性对照(mimics NC)与pmirGLO-BDNF-3’UTR-WT、pmirGLO-BDNF-3’UTR-Mut两种重组载体共转染至离体培养的293T工具细胞中,24-48h后荧光显微镜下观察转染情况。①观察96孔板中细胞形态,当融合度达到60%左右时开始进行转染,PBS清洗细胞1次。②将BDNF-3’UTR 4μg加入200μL添加B-27的神经元无血清培养基中稀释,使其终浓度为2μg/μL。
5、Luciferase荧光检测
(1)初次使用
(2)裂解细胞前,将Passive Lysis Buffer 5使用D-Hanks稀释配制成PassiveLysis Buffer1×;吸去24孔板中培养基,加入300μL的Passive Lysis Buffer 1×,放至4℃冰箱反应20min左右以待细胞充分裂解,吹打混匀,放至-80℃超低温冰箱过夜使其裂解更加彻底。
(3)上机检测前,提前将Stop&
(4)常温下溶解步骤(2)中的细胞裂解液,吸取20μL于Lockwell maxisorp检测板中,加入40uL Luciferase Assay Reagent,震荡混匀后立即使用酶标仪检测Fireflyluminescence(萤火虫荧光酶荧光值),注意该步骤时间不宜超过20min。
(5)检测Firefly luminescence后,再在每孔中加入40μL Stop&
(6)数据收集和分析。
以上实验结果如图1所示,mmu-miR-134-5p与BDNF的3'UTR存在结合位点;与BDNF-3'UTR-WT+miR-control组相比,BDNF-3'UTR-WT+mmu-miR-134-5p组的荧光素酶活性明显下降,提示miR-134可靶向结合BDNF基因的3’UTR。
实施例2:抑郁CUMS模型的建立及给药
1、抑郁CUMS模型的建立
小鼠适应环境7d后进行CUMS模型的建立:持续照明36h;禁食12h;禁水12h;笼子倾斜45°12h;4℃冷水游泳5min;潮湿垫料24h;悬尾2min;足底电刺激10min;白噪音12h;LED频闪刺激2h。除空白对照组外,小鼠连续接受慢性应激刺激35d,每种应激刺激源不连续且不规律。
2、动物分组及给药
小鼠适应环境7d后,随机分成8组,分别为(1)Control组,(2)CUMS-vehicle组,(3)人参皂苷Rb1组,(4)AAV-vehicle组,(5)AAV-miR-134-down组,(6)AAV-miR-134-up组,(7)Rb1+AAV-miR-134-down组,(8)Rb1+AAV-miR-134-up组,每组16只。
人参皂苷Rb1提前用0.5%羧甲基纤维素钠(Carboxy methyl cellulose-Na,CMC-Na)配置成混悬液。于慢性应激第7d,对人参皂苷Rb1单干预组(3)组,复合干预组(7)组、(8)组进行灌胃给予20mg/kg的人参皂苷Rb1,其他组灌胃给予相同体积的0.5%CMC-Na,持续35d。此外,第7d给予人参皂苷Rb1 60min后,对腺相关病毒(Adeno-associatedvirus,AAV)单干预组(4)组、(5)组、(6)组,复合干预组(7)组、(8)组分别进行单次双侧海马区微量注射AAV-vehicle、AAV-miR-134-up和AAV-miR-134-down。行为学于末次给药60min后进行检测。
3、立体定位注射AAV病毒
用5%异氟烷与30%O
实施例3:行为学检测
1、旷场试验(OFT)
为了排除小鼠的活动异常,小鼠在行为学考察前需进行自主活动的筛选,小鼠OFT装置由一个木制方盒(40cm×60cm×50cm)组成,底部分为12个相等的方格。将小鼠放在装置的一角,计算小鼠在6min内所有爪子通过方格的数量。
2、悬尾试验(TST)
各组小鼠末次给药60min后,将胶条粘在小鼠尾端1cm处,胶条长10cm,悬挂在高于地面50cm的架子上,使小鼠呈倒悬体位,每两只小鼠间用挡板隔开,防止相互干扰。每只小鼠观察6min,用秒表记录后4min的累计悬尾不动时间。不动状态以小鼠停止挣扎,身体呈静止垂直倒悬状态为准。为了避免主观意识,给药和行为学实验分别由两个人完成。
3、强迫游泳试验(FST)
正式实验前24h对各组小鼠进行预游泳实验,将小鼠放入高25cm,直径25cm,水深10cm的圆形容器中,水温23-25℃,游泳15min。实验当天,在给药30min后,将小鼠放入圆形容器中(与预游泳环境相同),强迫游泳6min,记录后4min内累计不动时间。判定不动的标准是小鼠在水中停止挣扎,呈漂浮状态或仅有细小的肢体运动以保持头部浮在水面。
4、糖水偏爱试验(SPT)
通过糖水消耗实验模拟小鼠的兴趣缺失,以考察人参皂苷Rb1对兴趣缺失小鼠的改善作用。第一个48h给予小鼠两瓶相同体积的1%蔗糖溶液,之后紧接着禁食禁水24h,小鼠同时接触相同重量的自来水和1%蔗糖溶液,统计1h内小鼠摄入的蔗糖水和饮用水量,计算出蔗糖消耗百分比。蔗糖消耗(%)=蔗糖溶液摄入量/(蔗糖溶液摄入量+饮用水摄入量)×100%。
以上实验结果如图2所示,各组小鼠在OFT中的自主活动无明显差异,提示小鼠在进行TST、FST和SPT前不存在活动异常等现象。与CUMS模型组相比,人参皂苷Rb1给药组、miR-134低表达组以及人参皂苷Rb1+miR-134低表达组不仅显著降低了小鼠在TST和FST中的不动时间,还显著增加了小鼠的糖水偏爱程度。但与人参皂苷Rb1给药组相比,过表达的miR-134可以显著逆转人参皂苷Rb1在TST、FST和SPT中的这种积极作用。
实施例4:免疫组化观察小鼠海马区神经元特异性NeuN的表达
小鼠通过2.5%戊巴比妥钠腹腔麻醉后(0.1mL/10g),打开腹腔,划开胸膜,充分暴漏出心脏。左手持镊子固定住心脏,并将20mL注射器(1mL注射器针头)经心尖处穿入,进入左心室,立即剪开右心耳,快速灌注生理盐水冲洗体循环血液(约20mL)。待右心耳流出的液体透明且肝脏组织变白后灌注4%多聚甲醛约40mL。随后持剪刀掀开颅骨,取出端脑,小心分离出海马区即刻放入4%多聚甲醛中,固定24h。经过脱水,透明,渗透后进行石蜡包埋。石蜡切片厚度为5μm,进行染色步骤。切片于78℃烘箱烘烤4h,待蜡完全融化后加入到二甲苯中,进行水化、染色,具体步骤:(1)二甲苯脱蜡洗30min,2次;(2)酒精梯度100%、95%、80%各5min;(3)蒸馏水洗3min,2次;(4)组织切片放入修复盒,加入适量0.01M枸橼酸缓冲液(PH6.0),微波中档修复10min;(5)室温冷却,1%PBS洗3min,3次,擦干;(6)滴加3%过氧化氢,室温孵育10min;(7)1%PBS洗3min,3次,擦干;(8)滴加5%BSA(PBS配制),37℃封闭30min;(9)1%PBS洗3min,3次,擦干;(10)滴加1%PBS稀释的NeuN抗体(1:100),4℃过夜;(11)1%PBS洗3min,3次,擦干;(12)滴加辣根过氧化物酶标记的二抗(1:200),37℃孵育30min;(13)1%PBS洗3min,3次,擦干;(14)滴加新鲜配制的DAB显色液,显微镜下观察,阳性信号为棕黄色或棕褐色,约1min,放入PBS盒内终止显色;(15)Harris苏木素复染约5min;(16)水洗2次,1%盐酸酒精分化10-30s(显微镜下观察);(17)流动水冲洗15min反蓝;(18)酒精梯度80%、95%、100%各5min;(19)二甲苯透明10min,两次;(20)中性树胶封片,显微镜下观察海马CA1、CA3和DG区的神经元变化并拍照。
以上实验结果如图3所示,与CUMS模型组相比,人参皂苷Rb1给药组、miR-134低表达组以及人参皂苷Rb1+miR-134低表达组海马CA1区、CA3区和DG区NeuN阳性表达明显增加;与人参皂苷Rb1给药组相比,过表达的miR-134可以显著抑制人参皂苷Rb1对抑郁CUMS小鼠海马CA1区、CA3区和DG区NeuN表达的增加。
实施例5:Golgi染色观察小鼠海马CA1、CA3和DG区树突棘密度
小鼠腹腔注射2.5%戊巴比妥钠麻醉后,快速取出端脑(新鲜脑组织、不灌注),冰上分离出海马,按照FD Rapid Golgi Stain Kit进行染色。将试剂盒中溶液A和溶液B等体积混合,海马组织即刻放入混合液中,室温避光固定;两周后将组织移入溶液C中,室温避光3-7天后,OCT包埋,冰冻切片120μm进行染色。(1)dH
以上实验结果如图4所示,与CUMS模型组相比,人参皂苷Rb1给药组、miR-134低表达组以及人参皂苷Rb1+miR-134低表达组海马CA1区、CA3区和DG区的树突棘密度明显增加;与人参皂苷Rb1给药组相比,过表达的miR-134可以显著拮抗人参皂苷Rb1对抑郁CUMS小鼠海马CA1区、CA3区和DG区树突棘密度的这种积极作用。
实施例6:透射电镜观察小鼠海马CA1和CA3区椎体细胞突触超微结构
小鼠腹腔注射2.5%戊巴比妥钠麻醉后,快速取出端脑(新鲜脑组织、不灌注),冰上分离出海马,2.5%戊二醇固定10h左右,PBS冲洗,0.1M柠檬酸缓冲液冲洗3次(15min;7次),1%锇酸处理2h,0.1M柠檬酸缓冲液冲洗2次(15min;7次)。脱水:依次用50%乙醇处理15min,70%乙醇处理15min,90%乙醇处理15min,90%乙醇与90%丙酮等体积混合液处理15min,90%丙酮处理15min,100%丙酮处理15min。用环氧树脂Epon812包埋。LKB超薄切片机切片80nm,切片置于铜网上进行醋酸铀和枸橼酸铅双染色(4%醋酸铀20min;0.5%枸橼酸铅5min),在透射电镜下观察海马CA1、CA3和DG区的突触超微结构变化。
以上实验结果如图5所示,与CUMS模型组相比,人参皂苷Rb1给药组、miR-134低表达组以及人参皂苷Rb1+miR-134低表达组海马CA1区和CA3区锥体细胞的突触PSD长度、PSD厚度明显增加,突触间隙的宽度明显减少;与人参皂苷Rb1给药组相比,过表达的miR-134可以显著降低人参皂苷Rb1对抑郁CUMS小鼠海马CA1区和CA3区突触超微结构的这种积极作用。
实施例7:脑片电生理观察小鼠海马CA3区Schaffer collateral-CA1通路上长时程增强诱导的影响
小鼠麻醉(2.5%戊巴比妥钠)后断头处死,剪开头皮、头骨,迅速取出全脑,淹没至饱和的冰冻人工脑脊液(Artificial cerebrospinal fluid,ACSF)(0℃)中,ACSF中提前半小时通入混合气体(95%O
脑片孵育结束后,选取淡黄色的健康活性好的脑片转移至灌流槽的载玻片上,用盖网固定,以1-2mL/min持续灌流脑片,并持续给予混合气体(95%O
以上实验结果如图6所示,与CUMS模型组相比,人参皂苷Rb1给药组、miR-134低表达组以及人参皂苷Rb1+miR-134低表达组海马CA1区的fEPSP斜率百分比明显上升;与人参皂苷Rb1给药组相比,过表达的miR-134可以显著抑制人参皂苷Rb1对抑郁CUMS小鼠海马CA1区fEPSP斜率百分比的增加。
实施例8:Western blot技术检测小鼠海马突触相关蛋白及BDNF级联信号通路中蛋白的表达
1、组织总蛋白提取
取出-80℃冻存的海马组织,按20mg组织加入1mL冰冷裂解液混合物:RIPA裂解液(强):磷酸酶抑制剂混合物(50×):PMSF=100:1:1,匀浆机研磨1min,4℃12000转离心15min。取上清,弃沉淀。取适量上清按BCA法测定蛋白浓度后按5:1的比例加入loadingbuffer,100℃煮沸7min,用于Western blot或-80℃冰箱储存备用。
2、SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)
(1)清洗玻璃板
(2)灌胶和上样
按照配方配置10%分离胶,最后加入TEMED后轻轻混匀,避免产生气泡。将10%分离胶加至距梳齿下1cm处即可,用75%酒精或水封层。当水和胶之间有一条明显分界面时说明胶已凝,倒去胶面上层水,并用滤纸吸干多余水分。加入4%浓缩胶灌满剩余空间后立即插入上样梳子,约30min胶凝固。将凝固好的胶夹好放入电泳槽内,加入适量电泳缓冲液(1×)。上样时,垂直拔出梳子,marker加两侧,样品上样量为20μL。
(3)电泳
通电后将电压设定为80V,当电泳至浓缩胶与分离胶交界面时,将电压改为120V,电泳至溴酚蓝刚跑出分离胶下缘时终止电泳,时长约为120min。
3、Western blot反应
(1)转膜
撬开电泳玻璃板,取出凝固好的凝胶,切除浓缩胶部分及不要的分离胶后放入电转液中平衡10min。在装有电转液盘中将阳极电转夹上依次整齐叠放1层海绵垫,2层滤纸,PVDF膜(4.5cm×8.0cm),凝胶,2层滤纸和1层海绵垫。期间要时刻赶走膜和凝胶之间的气泡。将电转夹放入电转槽内,正负极切要对应,槽外周围要放满冰及冰袋,做好及时降温准备。倒入足够多的转膜液后将电流调至300mA,电转1-1.5h。
(2)封闭
将电转好的PVDF膜取出,正面朝上(面向胶面为正面),放入内含5%脱脂奶粉中进行封闭,室温摇床90min。
(3)一抗孵育
将封闭好的膜取出,用TBST洗3次,每次10min至无泡沫。放入预先TBST稀释好的一抗兔源的抗体。摇床上摇1h后4℃孵育过夜。
(4)二抗孵育
取出过夜的孵有一抗的PVDF膜,TBST洗3次,每次10min。加入预先5%脱脂奶粉稀释好的辣根过氧化物酶(HRP)偶联的二抗,在室温摇床上孵育1h后,TBST洗3次,每次10min,进行显影。
(5)曝光
曝光液A液:B液为1:1。将膜正面朝上,滴加配好的曝光液进行曝光。
(6)凝胶图像分析
对胶片进行扫描仪拍照,采用凝胶图像处理系统分析目标条带的分子量和净光密度值。
以上实验结果如图7所示,Syn蛋白在各组小鼠海马组织中的表达并无显著性差异。此外,与CUMS模型组相比,人参皂苷Rb1给药组、miR-134低表达组以及人参皂苷Rb1+miR-134低表达组的海马突触相关蛋白如PSD-95、GAP-43和MAP-2,以及突触功能蛋白NR2A、NR2B、GluR1和CaMKII的表达含量明显增加;与人参皂苷Rb1给药组相比,过表达的miR-134可以显著抑制人参皂苷Rb1对这些突触相关蛋白的积极调控作用。人参皂苷Rb1的抗抑郁样作用及其分子机制研究,可能通过图8所示机制,即miR-134可以靶向结合并负调控BDNF的表达,且人参皂苷Rb1通过miR-134介导的BDNF信号通路调控海马突触可塑性的抗抑郁作用:与CUMS模型组相比,人参皂苷Rb1给药组、miR-134低表达组以及人参皂苷Rb1+miR-134低表达组的海马组织BDNF、TrkB、AKT、ERK1/2、GSK-3β、β-catenin和CREB的表达水平明显升高;与人参皂苷Rb1给药组相比,过表达的miR-134可显著抑制人参皂苷Rb1对BDNF信号通路的积极调控作用。
海马靶向性miR-134的过度表达显著阻断了人参皂苷Rb1对小鼠行为学、海马突触超微结构、LTP诱导、突触相关蛋白表达以及BDNF-TrkB信号传导的抗抑郁样作用。这些影响表现为:增加TST和FST中的不动时间,降低SPT中的蔗糖偏好程度,降低海马树突棘密度和PSD长度、PSD厚度,增加突触间隙宽度,此外,抑制LTP的诱导,抑制突触相关蛋白包括PSD-95、GAP-43、MAP-2、NR2A、NR2B、GluR1、CaMKII,以及BDNF及其下游蛋白,包括TrkB、AKT、ERK1/2、GSK-3β,β-catenin和CREB的表达。而人参皂苷Rb1可以挽救慢性应激过程中miR-134对BDNF级联信号通路的负面调控,继而促进与突触可塑性相关的基因转录和表达,增加海马突触可塑性。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
序列表
<110> 暨南大学
<120> 人参皂苷Rb1在制备抗抑郁药物中的应用
<160> 7
<170> SIPOSequenceListing 1.0
<210> 1
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> F-BDNF-3’UTR-WT
<400> 1
tgtttcctca tgactgcccc 20
<210> 2
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> R-BDNF-3’UTR-WT
<400> 2
cgatccgggt ttccgtgtta 20
<210> 3
<211> 25
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> F-BDNF-3’UTR-Mut
<400> 3
gcttcggcag cacatatact aaaat 25
<210> 4
<211> 23
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> R-BDNF-3’UTR-Mut
<400> 4
cgcttcacga atttgcgtgt cat 23
<210> 5
<211> 375
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> BDNF-3’UTR-WT核苷酸序列
<400> 5
cgagctccca cccggagtag ggatggagaa aatttcttca ctatccattc tggttgataa 60
agcgttacat ttgtatgttg taaagatgtt tgcaaaatcc aatcagatga ctggaaaaca 120
aataaaaatt aaggcaactg aataaaatgc tcacactcca ctgcccatga tgtatctccc 180
tggtccccct cagctcactc ttctggcatg ggtcagggaa aattgctttt attggaaaga 240
ccagcatttg ttcaaagcat actctttccc tccctcctcc cattttggtc ccttcttttt 300
gttttgtttt aagaaagaaa attaagttgc gcgctttaaa atattttact actgctacaa 360
acagatgctc gaggg 375
<210> 6
<211> 375
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> BDNF-3’UTR-Mut核苷酸序列
<400> 6
cgagctccca cccggagtag ggatggagaa aatttcttca ctatccattc tggttgataa 60
agcgttacat ttgtatgttg taaagatgtt tgcaaaatcc aatcagatga ctggaaaaca 120
aataaaaatt aaggcaactg aataaaatgc tcacactcca ctgcccatga tgtatgtggg 180
tggtgcccct gtgctgtgtc ttctggcatg ggtcagggaa aattgctttt attggaaaga 240
ccagcatttg ttcaaagcat actctttccc tccctcctcc cattttggtc ccttcttttt 300
gttttgtttt aagaaagaaa attaagttgc gcgctttaaa atattttact actgctacaa 360
acagatgctc gaggg 375
<210> 7
<211> 71
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> miR-134核苷酸序列
<400> 7
agggtgtgtg actggttgac cagaggggcg tgcactctgt tcaccctgtg ggccacctag 60
tcaccaaccc t 71
- 人参皂苷Rb1在制备抗抑郁药物中的应用
- 人参皂苷Rb1在制备细胞甲基乙二醛损伤抑制剂中的应用
