在棒状细菌中提供丙二酰辅酶A以及通过棒状细菌制备多酚和聚酮的方法
文献发布时间:2023-06-19 11:26:00
本发明涉及在棒状细菌中提供丙二酰辅酶A的系统。本发明还涉及通过棒状细菌制备次级代谢物,例如多酚和聚酮的方法。
来自多酚(茋类、黄酮类)和聚酮的大量不同分子是经济上令人感兴趣的具有巨大药理学应用潜力的次级代谢物。例如,茋类白藜芦醇被预测具有抗肿瘤、抗细菌、抗炎和抗老作用(Pangeni等2014; https://doi.org/10.1517/17425247.2014.919253)。还讨论了预防心血管疾病的作用。对于黄酮类,例如柚皮素或其衍生物描述了包括抗诱变、抗氧化、抗恶性细胞增生和抗动脉粥样化作用的类似效果 (Erlund, 2004; https://doi.org/10.1016/j.nutres.2004.07.005, Harbone, 2013; https://doi.org/10.1007/978-1-4899-2915-0)。
然而,这些物质的天然生产者(植物、真菌、细菌)形成和积累仅非常少量的产物或者难以培养或根本无法培养。特别地,从植物中提取是经济上不令人感兴趣的。因此,希望工业大规模地微生物生产药理学和/或生物技术上令人感兴趣的多酚和/或聚酮。
已描述了通过细菌大肠杆菌和酵母酿酒酵母制备次级代谢物 (Xu等; 2011,https://doi.org/10.1016/j.ymben.2011.06.008; Li等; 2016, https://doi.org/10.1038/srep36827)。然而,在使用大肠杆菌来生产这样复杂的次级代谢物以及特别是其在医学中的使用时的安全性的很大疑虑是已知的。因此非常希望使用GRAS微生物(公认为安全),它已经是工业上被证实的细胞工厂。因此,本发明的目的是提供通过棒状细菌(其被分类为GRAS)微生物工业大规模制备选自多酚(茋类、黄酮类)和聚酮的分子的系统和方法。本发明的另一目的是通过定向菌株构造来提供确切表征的细菌菌株,其克服已知的缺点。
用于合成多酚或聚酮的决定性基础单元是丙二酰辅酶A。选自黄酮类和茋类的代表需要3摩尔丙二酰辅酶A/摩尔产物,而聚酮几乎仅基于丙二酰辅酶A单元来形成。丙二酰辅酶A是细菌代谢中的核心中间体,其不能被运输通过细胞膜,以使得在微生物制备过程中不能进行细胞外补料。虽然丙二酰辅酶A是通过乙酰辅酶A,即糖酵解的最终产物的羧化在细菌细胞中形成的,但是微生物几乎仅将丙二酰辅酶A转化以合成脂肪酸,这阻碍了增强提供。此外,脂肪酸合成是细胞的非常昂贵的合成,因此丙二酰辅酶A的合成是被严格调节的。
提高丙二酰辅酶A在微生物中的细胞内浓度的间接方式是例如加入脂肪酸合成的抑制剂,例如浅蓝菌素。通过谷氨酸棒杆菌制备白藜芦醇也被Kallscheuer等(2016,https://doi.org/10.1016/j.ymben.2016.06.003)描述。在此也使用浅蓝菌素来抑制脂肪酸合成,以便实现白藜芦醇的形成。然而,加入浅蓝菌素的主要缺点是,在加入浅蓝菌素后的细胞在其生长方面完全停止。这又对于在细胞中提供丙二酰辅酶A(这仅在生长时发生)是不利的。
浅蓝菌素是抗生素,其选择性地不可逆地抑制脂肪酸合成(Omura等; 1976; PMID791237)。由于该抑制,丙二酰辅酶A不再被消耗用于脂肪酸的内源性合成,并且可用于其它转化,例如合成次级代谢物。然而,浅蓝菌素非常昂贵,因此不太适合用于工业大规模或工业上令人感兴趣的微生物制备方法。此外,浅蓝菌素的非常重要的缺点是,细胞由于脂肪酸合成的抑制而在其生长方面受到极端抑制,并且通常在短时间(细胞分裂)后最终根本不能再生长。因此,鉴于高成本和由于细胞死亡引起的不可进一步优化的产率,在微生物或生物技术制备方法中使用浅蓝菌素不是有意义的经济替代方案。因此,本发明的另一目的是提供用于增加棒状细菌中的核心代谢物丙二酰辅酶A的浓度的系统和方法,所述浓度不依赖于浅蓝菌素的加入。
本发明的另一目的是提供经济上令人感兴趣的系统,其适合于在棒状细菌中生物技术提供丙二酰辅酶A,且其中细胞的生长保持不受影响或不受负面影响或甚至停止。
此外,本发明的目的是避免对棒状细菌细胞系统的代谢的干扰,所述干扰可能具有广泛未定义的生理影响,这例如是一个或多个核心作用(zentral-agierend)的调节子(例如调节蛋白FasR)失活时的情况,该生理影响对细胞中的多种基因或蛋白产生影响。因此,本发明的另一目的是提供定向建立和精确定义的细胞系统和一种或多种经定义的同源结构元素,其使得能够通过非重组棒状细菌(non-GVO)微生物制备丙二酰辅酶A并同时克服已知的缺点。
本发明的另一目的是提供在棒状细菌中微生物制备经济上令人感兴趣的次级代谢物,例如选自多酚(茋类、黄酮类)和聚酮的分子的方法,其中克服了已知的缺点。
这些目的通过如下文所述的本发明以有利的方式实现。
下面首先是本发明的简要说明,而不由此对本发明的主题进行限制。
本发明的主题是与其原始型相比增强提供丙二酰辅酶A的棒状细菌细胞,其中对选自fasB、gltA、accBC和accD1的基因的调节和/或表达和/或由其编码的酶的功能进行了定向修饰。本发明的另一主题包括棒状细菌细胞,其具有一种或多种选自如下的定向修饰
a) 脂肪酸合酶FasB的减弱或失活的功能;
b) 编码脂肪酸合酶的基因fasB的突变或部分或完全缺失;
c) 与柠檬酸合酶基因gtlA可操作连接的启动子的减弱的功能;
d) 编码柠檬酸合酶CS的基因gltA的减弱的表达;
e) 编码乙酰辅酶A羧化酶亚单元的基因accBC和accD1的启动子区域中用于调节子FasR的操纵子结合位点(fasO)的减弱或失活的功能;
f) 编码乙酰辅酶A羧化酶亚单元的基因accBC和accD1的去阻遏的表达;
g) a)-f)的一种或多种组合。
因此,根据本发明还包括棒状细菌细胞,其中脂肪酸合酶FasB的功能减弱或失活,和/或编码脂肪酸合酶的基因fasB定向突变,优选通过一个或多个核苷酸取代而定向突变,或部分或完全缺失。
根据本发明,还包括棒状细菌细胞,其中编码柠檬酸合酶的基因gltA的表达由于可操作连接的启动子的突变,优选多个核苷酸取代而减弱。
本发明的主题还是棒状细菌细胞,其中在编码乙酰辅酶A羧化酶亚单元的基因accBC和accD1的启动子区域中用于调节子FasR的操纵子结合位点(fasO)的功能减弱或失活,优选地由于一个或多个核苷酸取代而减弱或失活,并且编码乙酰辅酶A羧化酶亚单元的基因accBC和accD1的表达去阻遏,优选增强。
本发明的另一主题还是棒状细菌细胞,其具有柠檬酸合酶(CS)的减弱的表达和/或活性和乙酰辅酶A羧化酶亚单元(AccBC和AccD1)的解调节的增强的表达和/或活性的组合。
根据本发明还包括棒状细菌细胞,其具有柠檬酸合酶(CS)的减弱的表达和/或活性和乙酰辅酶A羧化酶亚单元(AccBC和AccD1)的解调节的增强的表达和/或活性和脂肪酸合酶FasB的减弱或失活的功能的组合。
本发明的主题还是用于制备多酚或聚酮的棒状细菌细胞,其具有上述类型的修饰,并且其中另外地,芳族组分,优选选自苯丙素类(Phenylpropanoide)和苯甲酸衍生物的芳族组分的分解代谢途径失活。
根据本发明还包括棒状细菌细胞,其另外地具有编码抗反馈3-脱氧-D-阿拉伯庚糖酮酸-7-磷酸合酶(aroH),优选来自大肠杆菌的抗反馈3-脱氧-D-阿拉伯庚糖酮酸-7-磷酸合酶(aroH)和编码酪氨酸解氨酶(tal),优选来自约氏黄杆菌(Flavobacteriumjohnsoniae)的酪氨酸解氨酶(tal)的基因。
本发明的主题还是上述类型的棒状细菌细胞,其另外地具有用于多酚或聚酮合成的衍生自植物的酶或编码其的基因。
根据本发明,棒状细菌细胞是选自棒杆菌和短杆菌,优选谷氨酸棒杆菌,特别优选谷氨酸棒杆菌ATCC13032或其定向基因工程改变的变体的类型。
本发明的主题还是通过上述棒状细菌在棒状细菌中增强提供丙二酰辅酶A的方法,以及在棒状细菌中微生物制备多酚或聚酮的方法。根据本发明,这些方法不依赖于浅蓝菌素的加入。
本发明的主题还是本发明的棒状细菌细胞用于在棒状细菌中增强提供丙二酰辅酶A的用途,以及本发明的棒状细菌细胞用于通过棒状细菌制备多酚或聚酮的用途。
根据本发明还包括组合物,其包含选自多酚和聚酮,优选茋类、黄酮类和聚酮,特别优选白藜芦醇、柚皮素和去甲丁香色原酮的次级代谢物,其通过本发明的棒状或本发明的方法制备。本发明的主题还是上述本发明组合物用于制备药物、食品、饲料和/或用于植物生理学的用途。
以下通过实施例并借助附图更详细地解释本发明的主题,而不由此限制本发明的主题。
在描述这些实施例之前,给出了一些对于理解本发明而言重要的定义。
本发明的主题是与其原始型相比增强提供丙二酰辅酶A的棒状细菌细胞,其中对选自fasB、gltA、accBC和accD1的基因的调节和/或表达和/或由其编码的酶的功能进行了定向修饰。
因此,根据本发明包括棒状细菌细胞,其具有一种或多种选自如下的定向修饰
a) 脂肪酸合酶FasB的减弱或失活的功能;
b) 编码脂肪酸合酶的基因fasB的突变或部分或完全缺失;
c) 与柠檬酸合酶基因gtlA可操作连接的启动子的减弱的功能;
d) 编码柠檬酸合酶CS的基因gltA的减弱的表达;
e) 编码乙酰辅酶A羧化酶亚单元的基因accBC和accD1的启动子区域中用于调节子FasR的操纵子结合位点(fasO)的减弱或失活的功能;
f) 编码乙酰辅酶A羧化酶亚单元的基因accBC和accD1的去阻遏的表达;
g) a)-f)的一种或多种组合。
根据本发明还包括棒状细菌细胞,其中脂肪酸合酶FasB的功能减弱或失活,和/或编码脂肪酸合酶的基因fasB定向突变,优选通过一个或多个核苷酸取代而定向突变,或部分或完全缺失。
根据本发明还包括棒状细菌细胞,其中编码柠檬酸合酶的基因gltA的表达由于可操作连接的启动子的突变,优选多个核苷酸取代而减弱。
本发明的主题还是棒状细菌细胞,其中编码乙酰辅酶A羧化酶亚单元的基因accBC和accD1的启动子区域中用于调节子FasR的操纵子结合位点(fasO)的功能减弱或失活,优选由于一个或多个核苷酸取代而减弱或失活,并且编码乙酰辅酶A羧化酶亚单元的基因accBC和accD1的表达去阻遏,优选增强。
已知在accBC和accD1之前的fasO结合位点的突变(Nickel等, 2010; https://doi.org/10.1111/j.1365-2958.2010.07337.x)。在此描述了fasO结合位点突变,其导致脂肪酸合成调节子FasR的结合的丧失。在accBC的情况下,fasO结合位点位于accBC基因的上游,从而可以进行(Nickel等, 2010)的突变。在accD1的情况下,阅读框架和fasO结合位点重叠(图23;在灰色突出显示的左框中的ATG是accD1的起始密码子)。因此,在该区域中的突变是不可能的,因为否则在此的起始密码子会突变。因为由于突变也不形成替代的起始密码子(GTG或TTG),因此不可能转译,这导致不存在AccD1亚单元和因此不存在有效的乙酰辅酶A羧化酶活性。这进一步导致不能形成丙二酰辅酶A,并且细胞可能致命或严重地畸形。因此,根据Nickel等的突变不适合于本发明。
根据本发明,提供在棒状细菌的accD1基因之前以5'可操作连接的形式的新fasO结合位点。其特性有利地在于,考虑到棒状细菌中的氨基酸序列和可能最佳的密码子使用,其具有与天然fasO序列:MTISSPX的最大偏差(图23)。在此,在accBC之前的fasO结合位点中在位置11-13 (tga->gtc)和20-22 (cct->aag)存在核苷酸取代。在accD1之前的fasO结合位点中,在位置20-24 (cctca->gtacg)存在核苷酸取代。在本发明的一个变体中,在accBD和accD1基因之前的本发明的fasO结合位点分别具有SEQ ID NO: 13和15的核酸序列。
本发明的另一主题也是棒状细菌细胞,其具有柠檬酸合酶(CS)的减弱的表达和/或活性和乙酰辅酶A羧化酶亚单元(AccBC和AccD1)的解调节的增强的表达和/或活性的组合。
根据本发明还包括棒状细菌细胞,其具有柠檬酸合酶(CS)的减弱的表达和/或活性和乙酰辅酶A羧化酶亚单元(AccBC和AccD1)的解调节的增强的表达和/或活性和脂肪酸合酶FasB的减弱或失活的功能的组合。
在此,本发明的棒状细菌细胞的特征尤其在于,定向增强丙二酰辅酶A的合成代谢并且同时不影响细胞的生长。这种棒状细菌细胞迄今没有被描述。通常,为了增加细胞中的丙二酰辅酶A浓度,丙二酰辅酶A的分解代谢失活,然而这带来细胞不再能够生长的负面效果。这以多种方式,例如通过加入浅蓝菌素被描述。然而,不足的生长对严格受控的丙二酰辅酶A提供产生负面影响,即提供较少的丙二酰辅酶A,这因此被证实为适得其反。本发明有利地克服了这样的缺点。
术语“原始型”在本发明的意义上既理解为例如提供基因未改变的起始基因或起始酶的棒状细菌细胞“野生型”,也理解为其直接衍生物。优选是棒杆菌或短杆菌属的棒状野生型细胞;特别优选是谷氨酸棒杆菌野生型的棒状细菌细胞;非常特别优选是谷氨酸棒杆菌ATCC 13032野生型的棒状细菌细胞。因此,根据本发明,术语“原始型”除了“野生型”之外还包括野生型的定向衍生、精确定义且确切表征的“衍生物”。“衍生物”在此具有借助分子生物学方法而定向、靶向和受控实现并且其中涉及同源、非重组的改变,例如核苷酸取代或缺失或异源核酸序列与野生型密码子使用(密码子使用)的匹配。所得衍生物在生理学上是确切表征的并且不携带异源核酸序列;既不是染色体编码的,也不是质粒编码的。作为本发明意义上的“原始型”的实例,可提及这样的野生型棒状细菌细胞,其中负责分解芳族组分的基因从基因组中缺失。除了缺失之外,还可以设想在基因组中的定向核苷酸取代,由此使野生型在基因方面保持同源的非重组生物体。该实例不应被解释为限制本发明。因为根据本发明其涉及相同同源宿主生物体的定向核苷酸替换,因此所得的生物体根据本发明是非重组改变的。在本发明的意义上,“同源”理解为本发明的酶和编码其的本发明核酸序列和本发明的与其可调节连接的非编码核酸序列相关地源自于棒状细菌细胞的共同起始菌株。根据本发明,“同源”与术语“非异源”同义使用。本发明的“原始型”是基因上和生理上精确表征、同源、非重组的,并且可以等同于“野生型”。根据本发明,术语“野生型”、“衍生物”和“原始型”同义使用。
在本发明的意义上,“减弱或失活的功能”例如既涉及本发明的脂肪酸合酶FasB在蛋白水平上的功能,也涉及编码其的本发明核酸序列。因此,“功能”通常包括蛋白或编码其的核酸序列的功能,其可以例如由于核苷酸取代或缺失而减弱或失活。因此,“功能”也包括蛋白的活性,其可以被改变,例如减弱或失活。在此,根据本发明,蛋白的改变的活性既可以包括活性催化中心的改变,也可以包括调节中心的改变。根据本发明同样包括这些变体。
在本发明的一个变体中包括棒状细菌细胞,其特征在于其具有酶和/或编码核酸序列和/或可操作连接、调节的非编码核酸序列的经修饰的功能。本发明的棒状细菌细胞的另一变体的特征在于,所述修饰归因于选自如下的改变:a)用于基因表达的调节或信号结构的改变,b)编码核酸序列的转录活性的改变,或c)编码核酸序列的改变。根据本发明,在此例如包括基因表达的信号结构的改变,例如通过抑制因子基因、激活因子基因、操纵子(Operator)、启动子;弱化子、核糖体结合位点、起始密码子、终止子的改变。还包括在本发明棒状细菌细胞的基因组中引入更强或更弱的启动子或诱导型启动子、或在编码或非编码区域中的缺失或核苷酸取代,其中分子生物学方法是本领域技术人员已知的。本发明的主题是棒状细菌细胞,其中所述改变以染色体编码的形式存在于基因组中或以染色体外,即载体编码或质粒编码的形式存在。根据本发明,适合作为质粒的是那些在棒状细菌中复制的质粒。许多已知的质粒载体,例如pZ1 (Menkel等, Applied and EnvironmentalMicrobiology (1989) 64: 549-554)、pEKEx1 (Eikmanns等, Gene 102:93-98 (1991))或pHS2-1 (Sonnen等, Gene 107:69-74 (1991))基于隐蔽性质粒pHM1519、pBL1或pGA1。其它质粒载体,例如基于pCG4 (US-A 4,489,160)或pNG2 (Serwold-Davis等, FEMSMicrobiology Letters 66, 119-124 (1990))或pAG1 (US-A 5,158,891)的那些可以以相同的方式使用(O. Kirchner 2003, J. Biotechnol. 104:287-99)。同样,可以使用具有可调节的表达的载体,例如pEKEx2 (B. Eikmanns, 1991 Gene 102:93-8; O. Kirchner2003, J. Biotechnol. 104:287-99)或pEKEx3 (Gande, R. ; Dover, L.G. ; Krumbach,K. ; Besra, G.S. ; Sahm, H. ; Oikawa, T. ; Eggeling, L., 2007. “The twocarboxylases of Corynebacterium glutamicum essential for fatty acid andmycolic acid synthesis.” Journal of Bacteriology, 189 (14), 5257–5264.https://doi.org/10.1128/JB.00254-07)。此外,所述基因可以通过整合到染色体中以单拷贝(P. Vasicova 1999, J. Bacteriol. 181:6188-91)或多拷贝(D. Reinscheid 1994Appl. Environ Microbiol 60:126-132)的形式来表达。所需菌株用载体的转化是通过例如谷氨酸棒杆菌的所需菌株的缀合或电穿孔来进行的。缀合方法例如由Schäfer等(Applied and Environmental Microbiology (1994) 60:756-759)描述。用于转化的方法例如由Tauch等(FEMS Microbiological Letters (1994)123:343-347)描述。
除了根据本发明优选的编码核酸序列和/或调节结构的部分或完全缺失之外,根据本发明还包括改变,例如转换、颠换或插入,以及定向进化方法。产生这种改变的指导可从已知的教科书(R. Knippers "Molekulare Genetik", 第8版, 2001, Georg ThiemeVerlag, Stuttgart, Deutschland)中获得。优选的是根据本发明的核酸取代或缺失。
在本发明的意义上,“减弱或失活的功能”不仅指基因或蛋白的功能,而且指调节子结合位点(例如通常与例如核心作用的调节蛋白如fasR结合的操纵子结合位点fasO)的改变的功能,并由此使编码核酸序列的表达被阻遏。因此,在本发明的意义上,“减弱”或“失活”还意味着与在本发明意义上的野生型或原始型宿主细胞中的情况相比,编码核酸序列的表达更差地进行或不再处于调节子的表达控制下。在本发明的意义上,“减弱”或“失活”被理解为对于“解调节”或“去阻遏”同义。因此,在本发明的意义上,调节子结合位点的“去阻遏的功能”也可以导致所涉的后续基因的表达增强。
在本发明的意义上,“减弱或失活的功能”也是指在编码基因之前的5'调节区域中的启动子区域的改变的功能。“功能”的改变可以增强、或也可以减弱启动子的活性。在本发明的一个变体中,例如在编码柠檬酸合酶的基因gtlA之前的启动子的功能和因此活性被减弱。这导致由该启动子编码的基因更弱地表达。本领域技术人员熟悉所有变体中的调节机理及其在改变时的影响。
本发明用术语“修饰”表示“改变”,例如还有“基因改变”,其中根据本发明是指,虽然应用了基因工程方法,但不产生核酸分子的插入。在本发明的意义上,“修饰”或“改变”是指取代和/或缺失,优选取代。在本发明的意义上,“修饰”、“改变”或“基因改变”也在本发明核酸的调节的非编码区域中产生。在本发明的意义上,这是指并包括编码基因或基因簇的调节区域中的所有可设想的位置,其改变对fasO结合位点和fasR结合的功能具有“减弱”或“失活”意义上的可测量的影响。
本发明的主题还是从棒状细菌分离的编码脂肪酸合酶FasB的蛋白,所述脂肪酸合酶FasB的功能减弱或失活并通过其使得能够在棒状细菌中增强提供丙二酰辅酶A,其中氨基酸序列与选自SEQ ID NO. 2、4、6、8和10的氨基酸序列或其片段或等位基因具有至少70%的同一性。根据本发明还包括具有选自SEQ ID NO. 2、4、6、8和10的氨基酸序列或其片段或等位基因的脂肪酸合酶FasB。此外,根据本发明包括由与选自SEQ ID NO. 1、3、5、7和9的核酸序列或其片段具有至少70%同一性的核酸序列编码的脂肪酸合酶。本发明还包括由选自SEQ ID NO. 1、3、5、7和9的核酸序列或其片段编码的脂肪酸合酶。
根据本发明还包括编码与根据SEQ ID NO. 2、4、6、8和10的氨基酸序列或其片段或等位基因具有至少75或80%,优选至少81、82、83、84、85或86%的同一性,特别优选87、88、89、90%的同一性,非常特别优选至少91、92、93、94、95%的同一性或最优选96、97、98、99或100%的同一性的氨基酸序列的蛋白。此外,本发明涉及含有根据SEQ ID NO. 2、4、6、8和10的氨基酸序列或其片段或等位基因的脂肪酸合酶FasB。
本发明的主题还包括用于在棒状细菌中增强提供丙二酰辅酶A的编码来自棒状细菌的功能减弱或失活的脂肪酸合酶FasB的核酸序列,其选自:
a) 与选自SEQ ID NO. 1、3、5、7和9的核酸序列或其片段具有至少70%的同一性的核酸序列,
b) 核酸序列,其在严格条件下与选自SEQ ID NO. 1、3、5、7和9的核酸序列或其片段的互补序列杂交,
c) 选自SEQ ID NO. 1、3、5、7和9的核酸序列或其片段,或
d) 对应于根据a)-c)的核酸中每一种的编码脂肪酸合酶FasB的核酸序列,但其与根据a)-c)的这些核酸序列的区别在于遗传密码的简并性或功能中性的突变。
本发明的主题还是由与根据SEQ ID NO. 1、3、5、7和9的核酸序列或其片段具有至少70%的同一性的核酸序列编码的脂肪酸合酶FasB。根据本发明还包括核酸序列,其与根据SEQ ID NO. 1、3、5、7和9的核酸序列或其片段具有至少75%或80%,优选至少81、82、83、84、85或86%的同一性,更优选87、88、89、90%的同一性,非常特别优选至少91、92、93、94、95%的同一性或最优选96、97、98、99或100%的同一性。此外,本发明涉及由根据SEQ ID NO. 1、3、5、7和9的核酸序列或其片段编码的脂肪酸合酶FasB。
根据本发明还包括棒状细菌细胞,其具有编码具有减弱或失活的功能的脂肪酸合酶FasB的蛋白或编码具有上述改变的功能的脂肪酸合酶FasB的核酸序列。
在本发明的一个变体中还包括棒状细菌细胞,其具有一种或多种选自如下的定向修饰:
a) 与选自SEQ ID NO. 2、4、6、8和10的氨基酸序列或其片段或等位基因具有至少70%的同一性的脂肪酸合酶FasB的减弱或失活的功能;
b) 编码脂肪酸合酶的基因fasB的突变或部分或完全缺失,该基因fasB的核酸序列与选自SEQ ID NO. 1、3、5、7和9的核酸序列或其片段具有至少70%的同一性;
c) 根据SEQ ID NO. 11的与柠檬酸合酶基因gltA可操作连接的启动子的减弱的功能;
d) 编码柠檬酸合酶(CS)的基因gltA的减弱的表达;
e) 根据SEQ ID NO. 13和15的编码乙酰辅酶A羧化酶亚单元的基因accBC和accD1的启动子区域中用于调节子FasR的操纵子结合位点(fasO)的减弱或失活的功能;
f) 编码乙酰辅酶A羧化酶亚单元的基因accBC和accD1的去阻遏的表达;
g) a)-f)的一种或多种组合。
在本发明的变体中还包括来自棒状细菌的脂肪酸合酶FasB的蛋白和/或编码来自棒状细菌的脂肪酸合酶FasB的核酸序列,其中存在核苷酸取代和对应相应的氨基酸替换。在实施例中阐述这样的变体,但是其不对本发明产生限制作用。
在本发明的变体中,与柠檬酸合酶基因gltA可操作连接的启动子的功能也减弱。根据本发明,为此核苷酸取代可以在负责聚合酶结合的结合位点上进行,或用天然存在的启动子序列替换较弱启动子的整个启动子序列,或两者的组合,其中较弱启动子另外由于核苷酸取代而进一步减弱。由于根据本发明涉及相同的同源宿主生物体的定向核苷酸替换,因此所得的生物体根据本发明是非重组改变的。
在本发明的意义上,“同源”被理解为是指本发明的酶和编码其的本发明核酸序列和本发明的与其可调节连接的非编码核酸序列相关地源自于棒状细菌细胞的共同起始菌株。根据本发明,“同源”与术语“非异源”同义使用。
在本发明的意义上,术语“核酸序列”是指传输基因信息的各种同源分子单元。这相应地涉及同源基因,优选天然存在的和/或非重组的同源基因、同源转基因或密码子优化的同源基因。根据本发明,术语“核酸序列”是指编码或表达特定蛋白的核酸序列或其片段或等位基因。优选地,术语“核酸序列”是指包含调节序列的核酸序列,所述调节序列在编码序列之前(上游,上游,5'非编码序列)和之后(下游,下游,3'非编码序列)。术语“天然存在的”基因是指天然存在的基因,其例如来自棒状细菌细胞的野生型菌株,其具有自身的调节序列。
在本发明的意义上,术语“可操作连接的区域”是指核酸序列在单个核酸片段上的缔合,以使得所述一个核酸序列的功能受另一个核酸序列的功能影响。在启动子或调节蛋白的结合位点的上下文中,术语“可操作连接”在本发明的意义上是指编码序列处于调节编码序列的表达的调节区域(特别是启动子或调节子结合位点的调节区域)的控制下。
根据本发明,还提供在棒状细菌的accD1基因之前以5'可操作连接的形式的新fasO结合位点。在本发明的变体中,还包括在编码乙酰辅酶A羧化酶亚单元的基因accBC和accD1的启动子区域中用于调节子FasR的操纵子结合位点(fasO)的减弱或失活的功能。其特征有利地在于,考虑到棒状细菌中氨基酸序列和可能最佳的密码子使用,其具有与天然fasO序列:MTISSPX的最大偏差(图23)。在此,在accBC前的fasO结合位点中,在位置11-13(tga->gtc)和位置20-22 (cct->aag)存在核苷酸取代。在accD1之前的fasO结合位点中,在位置20-24 (cctca->gtacg)存在核苷酸取代。
因此,本发明的主题还是在棒状细菌的accD1基因之前的5'调节非编码区域中的可操作连接的fasO结合位点的核酸序列,其具有根据SEQ ID NO. 15的核苷酸取代。由于功能改变的fasO结合位点,不再可能结合FasR调节蛋白,并导致对accD1基因的表达的解调节,这导致亚单元accD1的表达的增强。与本发明的解调节的,即增强的亚单元accBC的表达组合,这根据本发明导致在棒状细菌中增强提供丙二酰辅酶A。
本发明的主题也是棒状细菌细胞,其中本发明的修饰有利地以染色体编码的形式存在。根据本发明,还包括非重组(no-GVO)的棒状细菌细胞。
在本发明的上下文中,术语“非重组”应理解为是指本发明的棒状细菌细胞的基因材料仅以天然方式改变,如例如可通过天然重组或天然突变所产生那样。因此,本发明的棒状细菌细胞的特征在于非基因工程改变的有机体(non-GVO)。
这也开辟了进一步优化工业上令人感兴趣的棒状细菌生产菌株的可能性,而不必将重组或异源基因材料引入细胞。因此,本发明提供了系统,使用该系统可以明显更简单、更稳定、更廉价和更经济地进行丙二酰辅酶A的微生物生产。因为所有迄今已知的具有丙二酰辅酶A合成能力的细菌菌株都需要复合培养基来生长,因此培养变得明显更复杂、更昂贵并因此更不经济。这里,尤其可提及加入脂肪酸合成的抑制剂,例如浅蓝菌素,其非常昂贵,因此不适用于工业大规模制备方法中。此外,所有迄今描述的丙二酰辅酶A生产者不是GRAS有机体。由此,由于昂贵的批准过程而产生了在特定工业领域(例如食品和制药工业)中应用的缺点。
本发明的棒状细菌细胞提供了许多优点,其中一个选择将在下面描述。棒状细菌,优选棒杆菌属,是可以用于所有工业领域的“公认为安全”(GRAS)生物体。棒状细菌在特定培养基上实现高的生长速率和生物质产量(Grünberger等,2012),并且在棒状细菌的工业应用中存在广泛的经验(Becker等,2012)。
根据本发明包括棒杆菌或短杆菌属的棒状细菌。本发明的棒状细菌的变体选自棒杆菌和短杆菌,优选谷氨酸棒杆菌,特别优选谷氨酸棒杆菌ATCC13032、醋谷棒杆菌、热产氨棒杆菌、黄色短杆菌、乳糖发酵短杆菌或双歧短杆菌。根据本发明还包括选自谷氨酸棒杆菌ATCC13032或定向修饰的衍生物或原始型、醋谷棒杆菌ATCC15806、嗜乙酰乙酸棒杆菌ATCC13870、热产氨棒杆菌FERM BP-1539、黄色短杆菌ATCC14067、乳糖发酵短杆菌ATCC13869、双歧短杆菌ATCC14020的棒状细菌细胞。
根据本发明还包括具有一个或多个上述本发明修饰的棒状细菌细胞,所述修饰起始于棒杆菌,优选谷氨酸棒杆菌ATCC13032,其中此外还另外使芳族组分,优选选自苯丙素类和苯甲酸衍生物的芳族组分的分解代谢途径失活。
本发明的棒状细菌细胞的其它变体的特征在于,由于基因簇cg0344-47(phdBCDE-操纵子)、cg2625-40 (cat、ben和pca)、cg1226 (pobA)和cg0502 (qsuB)的缺失,参与芳族组分的分解代谢途径的酶的功能和/或活性或编码其的基因的表达失活。本发明的这些细胞被定向改变,并且不通过非定向的突变而产生。它们的特征有利地在于,它们在基因学方面确切表征,并且所述修饰通过缺失来实现。这些缺失根据本发明以染色体编码的形式存在。因此,这些细胞仅具有同源DNA,并且它们被非重组地改变。除了算上GRAS有机体的性质之外,其特征还有利地在于诸如次级植物代谢物之类的产物的微生物制备。因为本发明的棒状细菌细胞的特征还有利地在于,其为了增强提供丙二酰辅酶A而不需要染色体外的DNA,例如质粒或载体。首先,具有大于2个质粒或每质粒大于2个基因的细菌菌株通常不是稳定的,其次需要注意的是,根据本发明包括的复杂次级代谢物在细菌中的微生物制备需要相应植物基因的异源表达以制备多酚和/或聚酮,第三,这些所需产物或它们的前体不应由于细胞自身的活性,例如芳族组分的酶促降解而重新分解。因此,非常有利地通过本发明的棒状细菌细胞实现本发明的另一个非常复杂的目的,即提供在棒状细菌中增强提供丙二酰辅酶A的系统而无需进行质粒编码的改变并在此同时防止所需含芳族化合物的产物及其前体在棒状细菌中的分解。棒状细菌细胞的这种根据本发明非常有利的系统允许实现将植物或其它异源基因以染色体外的形式引入该系统中的巨大自由度,以便因此能够稳定地微生物制备植物次级代谢物。
本发明的主题还是棒状细菌细胞,其特征在于,其独立于脂肪酸合成抑制剂的加入而提供了增加的细胞内丙二酰辅酶A浓度。根据本发明,增强提供作为核心中间体的丙二酰辅酶A可以用于制备其合成需要增加浓度的丙二酰辅酶A的这种产物,例如脂肪酸合成或合成植物次级代谢物,如多酚或聚酮。
本发明的主题还是用于制备多酚或聚酮的棒状细菌细胞,其具有上述类型的本发明的修饰,并且其中另外地,芳族组分,优选选自苯丙素类和苯甲酸衍生物的芳族组分的分解代谢途径失活。棒状细菌具有用于分解苯丙素类或苯甲酸衍生物的自身代谢途径(Kallscheuer等, 2016; https://doi.org/10.1007/s00253-015-7165-1)。对于用棒状细菌制备聚酮或多酚,这是适得其反的。根据本发明,为此提供棒状细菌细胞,其能够增强提供丙二酰辅酶A,并且其特征另外在于,由于基因簇cg0344-47 (phdBCDE-操纵子)、cg2625-40 (cat、ben和pca)、cg1226 (pobA)和cg0502 (qsuB)的缺失,参与芳族组分的分解代谢途径的酶的功能和/或活性或编码其的基因的表达失活。本发明的这些细胞被定向改变,并且不通过非定向的突变而产生。它们的特征有利地在于它们在基因学上是确切表征的,并且所述修饰通过缺失来实现。这些缺失根据本发明以染色体编码的形式存在。因此,这些细胞仅具有同源DNA,并且它们被非重组地改变。除了算上GRAS有机体的性质之外,其特征还有利地在于诸如次级植物代谢物之类的产物的微生物制备。因为本发明的棒状细菌细胞的特征还有利地在于,其为了增强提供丙二酰辅酶A和为了避免芳族组分的分解而不需要染色体外的DNA,例如质粒或载体。
本发明的主题还是棒状细菌细胞,其除了上述类型的本发明修饰之外还包含用于合成多酚或聚酮的衍生自植物的酶或编码其的基因。在本发明的一个变体中还包括具有衍生自植物的用于生产多酚或聚酮的基因的棒状细菌细胞,所述基因选自基因4cl、sts、chs、chi和pcs。
具有以前述方式根据本发明规定的性质的本发明棒状细菌细胞的特征有利地在于,其可以由5个丙二酰辅酶A单元合成聚酮。多酚的合成同样可以通过上述类型的本发明棒状细菌细胞进行,其中用多酚前体例如对香豆酸补充相应的培养基有利于丙二酰辅酶A转化成茋类或黄酮类。从葡萄糖作为碳源出发,本发明棒状细菌细胞需要分别由基因aroH和tal编码的酶3-脱氧-D-阿拉伯庚糖酮酸-7-磷酸合酶和酪氨酸解氨酶。
在本发明的一个变体中还包括棒状细菌细胞,其具有编码抗反馈3-脱氧-D-阿拉伯庚糖酮酸-7-磷酸合酶(aroH),优选来自大肠杆菌的抗反馈3-脱氧-D-阿拉伯庚糖酮酸-7-磷酸合酶(aroH)和编码酪氨酸解氨酶(tal),优选来自约氏黄杆菌的酪氨酸解氨酶(tal)的基因。
酶5,7-二羟基-2-甲基色酮合酶活性(PCS)是III类型的聚酮合酶(EC 2.3.1.216,UniProt Q58VP7, (Abe等, 2005; https://doi.org/10.1021/ja043120)。来自木立芦荟的PSC由pcs基因编码并被命名为EC 2.3.1.216, UniProt Q58VP7。作为假定功能,描述了由五分子的丙二酰辅酶A合成去甲丁香色原酮的催化活性。根据本发明,来自木立芦荟的pcs基因借助谷氨酸棒杆菌的密码子使用来合成,并且用于本发明棒状细菌细胞的克隆和转化。然而,通过所得的棒状细菌细胞,只能检测到最小痕量的去甲丁香色原酮。这意味着,既定的来自木立芦荟的酶PCS和编码其的psc基因在其所标注的功能方面无法在棒状细菌细胞中被证实。因此,所标注的5,7-二羟基-2-甲基色酮合酶活性(PCS) (EC 2.3.1.216,UniProt Q58VP7)不适合于根据本发明用于棒状细菌细胞中。
通过分离和提供编码在棒状细菌中具有增强活性的5,7-二羟基-2-甲基色酮合酶(PCS
本发明的主题还是用于在棒状细菌中合成聚酮的在上述本发明棒状细菌细胞之一中具有增强的5,7-二羟基-2-甲基色酮合酶活性的蛋白(PCS
在本发明的另一个变体中包括编码在棒状细菌中具有增强的聚酮制备活性的5,7-二羟基-2-甲基色酮合酶的核酸序列(pcs
a) 与根据SEQ ID NO. 19的核酸序列或其片段具有至少70%的同一性的核酸序列,
b) 核酸序列,其在严格条件下与根据SEQ ID NO. 19的核酸序列或其片段的互补序列杂交,
c) 根据SEQ ID NO. 19的核酸序列或其片段,或
d) 对应于根据a)-c)的核酸中每一种的编码5,7-二羟基-2-甲基色酮合酶(PCS
e) 与根据a)-d)的这些核酸序列的区别在于遗传密码的简并性或功能中性的突变的那些。
本发明的主题还是上述类型的棒状细菌细胞,其包含具有增强的5,7-二羟基-2-甲基色酮合酶活性的蛋白(PCS
所有衍生自植物或其它异源系统的基因,例如aroH、tal和/或用于合成多酚,优选合成茋类和/或黄酮类的基因,特别应提及的基因sts、chs、chi或用于合成聚酮的基因,优选pcs
在本发明的一个变体中还包括上述类型的棒状细菌细胞,其中植物基因处于诱导型启动子的表达控制下。在另一个变体中,根据本发明存在IPTG诱导型启动子,优选启动子T7。
在本发明的一个变体中包括本发明的棒状细菌细胞,其中编码4-香豆酸辅酶A连接酶(4CL)的基因4cl处于诱导型启动子的表达控制下,其中所述诱导型启动子和与其可调节连接的基因整合到棒状细菌细胞的基因组中,即以染色体编码的形式存在。在本发明的另一变体中,使用IPTG诱导型启动子,优选启动子T7。
本发明的主题还是染色体外系统,如载体或质粒,其具有表达用于合成多酚或聚酮的所需基因的所需性质。在本发明的一个变体中,质粒或载体编码的基因受制于诱导型启动子,优选IPTG诱导型启动子,优选启动子T7。根据本发明,使用诱导型启动子具有这样的优点,即可以根据本发明棒状细菌细胞的生长或培养条件而定向控制,即激活用于次级代谢物的所需基因的表达。因此,可以首先培养上述类型的本发明棒状细菌细胞,以增强提供丙二酰辅酶A,其然后在定向诱导所需基因的表达后进一步转化成所需产物。
本发明的主题还是棒状细菌细胞,其具有选自如下的基因
a) 用于合成多酚,优选茋类,特别优选白藜芦醇的4cl和sts,或
b) 用于合成多酚,优选黄酮类,特别优选柚皮素的chs和chi,或
c) 用于合成聚酮,优选去甲丁香色原酮的pcs
其处于诱导型启动子,优选IPTG诱导型启动子,特别优选T7启动子的控制下。
如上所述,本发明的特征有利地在于,将基因或与其可调节连接的区域整合到本发明细胞的基因组中,即以染色体编码的形式存在,以增强提供丙二酰辅酶A。这提供了将进一步的异源基因以质粒编码的形式引入到该细胞中而不会过分要求该细胞的自由度。通过根据本发明非常有利的棒状细菌细胞的系统,克服了具有超过2个质粒的细菌细胞不能稳定增殖的已知缺点,或具有超过2个异源基因的质粒通常在稳定性或表达方面不产生令人满意的结果的巨大缺点。通过其结构,它提供了可以将植物或其它异源基因以染色体外的形式引入到该系统中的巨大自由度,以便因此能够从丙二酰辅酶A出发稳定、微生物地制备植物次级代谢物。
在本发明的一个变体中,存在棒状细菌细胞,其具有选自如下的基因:
a) fasB和/或gltA和/或accBCD1,其功能和/或表达被定向修饰以增强提供丙二酰辅酶A,和
b) cg0344-47 (phdBCDE-操纵子)、cg2625-40 (cat、ben和pca)、cg1226 (pobA)和cg0502 (qsuB),其用于芳族组分,优选选自苯丙素类或苯甲酸衍生物的芳族组分的分解的功能失活,和
c) 编码用于合成聚酮,优选去甲丁香色原酮的具有增强的5,7-二羟基-2-甲基色酮合酶活性的蛋白(PCS
d) 任选地,用于从葡萄糖出发合成多酚前体的aroH和tal,和
e) 用于合成多酚,优选茋类,特别优选白藜芦醇的4cl和sts,或
f) 用于合成多酚,优选黄酮类,特别优选柚皮素的 chs和chi。
在本发明细菌细胞的变体中,来自a)和b)的本发明基因或与其可操作连接的调节区域在基因组中以编码形式存在。来自c)-f的基因或与其可操作连接的调节区域以质粒编码的形式存在。根据本发明,为了制备聚酮,优选去甲丁香色原酮,在此可设想组合,其例如具有fasB的变体(取代突变体或缺失突变体)和Δcg0344-47 (phdBCDE-操纵子)和Δcg2625-40 (cat、ben和pca)和Δcg1226 (pobA)和Δcg0502 (qsuB)和pcs
为了制备多酚,优选茋类,更优选白藜芦醇,可设想组合,其例如具有fasB的变体(取代突变体或缺失突变体)和Δcg0344-47 (phdBCDE-操纵子)和Δcg2625-40 (cat、ben和pca)和Δcg1226 (pobA)和Δcg0502 (qsuB)和aroH和tal和4cl和sts;具有gtlA和Δcg0344-47 (phdBCDE-操纵子)和Δcg2625-40 (cat、ben和pca)和Δcg1226 (pobA)和Δcg0502 (qsuB)和aroH和tal和4cl和sts;具有gtlA和accBCD1和Δcg0344-47 (phdBCDE-操纵子)和Δcg2625-40 (cat、ben和pca)和Δcg1226 (pobA)和Δcg0502 (qsuB)和aroH和tal和4cl和sts;具有fasB的变体(取代突变体或缺失突变体)和gtlA和accBCD1和Δcg0344-47 (phdBCDE-操纵子)和Δcg2625-40 (cat、ben和pca)和Δcg1226 (pobA)和Δcg0502 (qsuB)和aroH和tal和4cl和sts。这些上述变体允许由于基因aroH和tal的表达而从葡萄糖出发制备多酚。然而,对于本发明棒状细菌细胞的补充对香豆酸前体的培养而言,基因aroH和tal不是必需的。本发明的上述棒状细菌细胞的变体此时不具有基因aroH和tal。
为了制备多酚,优选黄酮类,更优选柚皮素,可以设想组合,其例如具有fasB的变体(取代突变体或缺失突变体)和Δcg0344-47 (phdBCDE-操纵子)和Δcg2625-40 (cat、ben和pca)和Δcg1226 (pobA)和Δcg0502 (qsuB)和aroH和tal和chs和chi;具有gtlA和Δcg0344-47 (phdBCDE-操纵子)和Δcg2625-40 (cat、ben和pca)和Δcg1226 (pobA)和Δcg0502 (qsuB)和aroH和tal和chs和chi;具有gtlA和accBCD1和Δcg0344-47 (phdBCDE-操纵子)和Δcg2625-40 (cat、ben和pca)和Δcg1226 (pobA)和Δcg0502 (qsuB)和aroH和tal和chs和chi;具有fasB的变体(取代突变体或缺失突变体)和gtlA和accBCD1和Δcg0344-47 (phdBCDE-操纵子)和Δcg2625-40 (cat、ben和pca)和Δcg1226 (pobA)和Δcg0502 (qsuB)和aroH和tal和chs和chi。这些上述变体允许由于基因aroH和tal的表达而从葡萄糖出发制备多酚。然而,对于本发明棒状细菌细胞的补充对香豆酸前体的培养而言,基因aroH和tal不是必需的。本发明的上述棒状细菌细胞的变体此时任选不具有基因aroH和tal。
在本发明的其它变体中,存在具有上述基因组合变体的上述类型的棒状细菌细胞,该基因组合变体具有选自如下的基因
a) 根据选自SEQ ID NO. 1、3、5、7和9的核酸序列或其片段的fasB基因,其编码选自SEQ ID NO. 2、4、6、8和10的脂肪酸合酶FasB或其片段或等位基因,和/或根据SEQ IDNO. 11的具有可操作连接的启动子区域的gltA基因,和/或选自SEQ ID NO. 13和15的具有可操作连接的fasO结合位点的accBCD1基因簇,其功能和/或表达被定向修饰以增强提供丙二酰辅酶A,和
b) cg0344-47 (phdBCDE-操纵子)、cg2625-40 (cat、ben和pca)、cg1226 (pobA)和cg0502 (qsuB),其用于芳族组分,优选选自苯丙素类或苯甲酸衍生物的芳族组分的分解的功能失活,和
c) 编码用于合成聚酮,优选去甲丁香色原酮的根据SEQ ID NO. 20的具有增强的5,7-二羟基-2-甲基色酮合酶活性的蛋白(PCS
d) 任选地,用于从葡萄糖出发合成多酚前体的根据SEQ ID NO. 30的aroH或其片段或等位基因和根据SEQ ID NO. 32的tal或其片段或等位基因,和
e) 用于合成多酚,优选茋类,特别优选白藜芦醇的根据SEQ ID NO. 22的4cl或其片段或等位基因和根据SEQ ID NO. 24的sts或其片段或等位基因,或
f) 用于合成多酚,优选黄酮类,特别优选柚皮素的根据SEQ ID NO. 26的chs或其片段或等位基因和根据SEQ ID NO. 28的chi或其片段或等位基因。
这些所述变体是本发明的主题,但不由此限制本发明。所述描述用于更好地理解本发明。
本发明的主题还是在棒状细菌中增强提供丙二酰辅酶A的方法,其包括以下步骤:
a) 提供包含水和C6碳源的溶液;
b) 在本发明的棒状细菌细胞存在下将根据步骤a)的溶液中的C6碳源微生物转化成丙二酰辅酶A,其中选自fasB、gtlA、accBC和accD1的基因的调节和/或表达和/或由其编码的酶的功能被定向修饰。
根据本发明,“溶液”被理解为与“培养基”、“培养基”、“培养液”或“培养溶液”同义。在本发明的意义上,“微生物地”被理解为与“生物技术地”或“发酵地”同义。根据本发明,“转化”被理解为与“代谢”、“代谢”或“培养”同义。根据本发明,“处理”被理解为与“分离”、“浓缩”或“纯化”同义。
使用的培养基应当以合适的方式满足各自微生物的要求。各种微生物的培养基的描述包含在美国细菌学学会的手册“Manual of Methods for General Bacteriology(Washington D.C., USA, 1981)中。除了葡萄糖作为丙二酰辅酶A制备的起始底物外,作为碳源可以使用糖和碳水化合物,例如葡萄糖、蔗糖、乳糖、果糖、麦芽糖、糖蜜、淀粉和纤维素,油和脂肪,例如大豆油、葵花籽油、花生油和椰子脂,脂肪酸,例如棕榈酸、硬脂酸和亚油酸,醇,例如甘油和乙醇,和有机酸,例如乙酸。这些物质可以单独使用或作为混合物使用。作为氮源,可以使用有机含氮化合物,例如蛋白胨、酵母提取物、肉提取物、麦芽提取物、玉米源水、大豆粉和尿素,或无机化合物,例如硫酸铵、氯化铵、磷酸铵、碳酸铵和硝酸铵。氮源可以单独使用或作为混合物使用。作为磷源可以使用磷酸二氢钾或磷酸氢二钾或相应的含钠盐。培养基还应包含生长所需的金属盐,例如硫酸镁或硫酸铁。最后,除了上述物质之外,还可以使用必需生长物质,例如氨基酸和维生素。所述原料可以一次性批料的形式加入培养物中,或在培养期间以合适的方式加入。为了控制培养物的pH,以合适的方式使用碱性化合物,例如氢氧化钠、氢氧化钾、氨或酸性化合物,例如盐酸、磷酸或硫酸。为了控制泡沫形成,可以使用消泡剂,例如脂肪酸聚二醇酯。为了保持质粒的稳定性,可以向培养基中加入合适的选择性作用物质,例如抗生素。为了保持需氧条件,将氧气或含氧气体混合物例如空气引入培养物中。培养物的温度通常为20-45℃,优选25-40℃。
本发明涉及不连续或连续地,优选在分批、补料分批、重复补料分批或连续模式中进行培养的方法。
在用于增强提供丙二酰辅酶A的本发明方法的一个变体中,在包含根据本发明所述的fasB变体的本发明棒状细菌中进行C6碳源的微生物转化,在所述细菌中脂肪酸合酶FasB减弱或失活和/或编码脂肪酸合酶的基因fasB定向突变,优选通过一个或多个核苷酸取代而定向突变,或部分或完全缺失。
在用于增强提供丙二酰辅酶A的本发明方法的一个变体中,在包含根据本发明编码柠檬酸合酶的基因gltA的本发明棒状细菌细胞中进行C6碳源的微生物转化,所述基因gltA通过可操作连接的启动子的突变,优选多个核苷酸取代而减弱其表达。
在用于增强提供丙二酰辅酶A的本发明方法的一个变体中,在包含本发明基因accBC和accD1的本发明棒状细菌细胞中进行C6碳源的微生物转化,其中编码乙酰辅酶A羧化酶亚单元的基因accBC和accD1的启动子区域中用于调节子FasR的操纵子结合位点(fasO)的功能优选由于一个或多个核苷酸取代而减弱或失活,并且编码乙酰辅酶A羧化酶亚单元的基因accBC和accD1的表达去阻遏,优选增强。
在用于增强提供丙二酰辅酶A的本发明方法的另一个变体中,在本发明棒状细菌细胞中进行C6碳源的微生物转化,所述棒状细菌细胞具有柠檬酸合酶(CS)的减弱的表达和/或活性和乙酰辅酶A羧化酶亚单元(AccBC和AccD1)的解调节的增强的表达和/或活性的组合。
在用于增强提供丙二酰辅酶A的本发明方法的另一个变体中,在本发明棒状细菌细胞中进行C6碳源的微生物转化,所述棒状细菌细胞具有柠檬酸合酶(CS)的减弱的表达和/或活性和乙酰辅酶A羧化酶亚单元(AccBC和AccD1)的解调节的增强的表达和/或活性和脂肪酸合酶FasB的减弱或失活的功能的组合。
在用于增强提供丙二酰辅酶A的本发明方法的另一个变体中,在棒杆菌或短杆菌属的本发明棒状细菌细胞中进行C6碳源的微生物转化。在用于增强提供丙二酰辅酶A的本发明方法的另一个变体中,在本发明的棒状细菌细胞中进行C6碳源的微生物转化,所述棒状细菌细胞选自谷氨酸棒杆菌,特别优选谷氨酸棒杆菌ATCC13032、醋谷棒杆菌、热产氨棒杆菌、黄色短杆菌、乳糖发酵短杆菌或双歧短杆菌。根据本发明,还包括用于增强提供丙二酰辅酶A的本发明方法的一个变体,其中在本发明棒状细菌细胞例如谷氨酸棒杆菌ATCC13032或其定向改变的衍生物或原始型中,例如其中此外还另外地使芳族组分,优选选自苯丙素类或苯甲酸衍生物的芳族组分的分解代谢途径失活的谷氨酸棒杆菌ATCC13032中进行C6碳源的微生物转化。
本发明的主题还是在棒状细菌中微生物制备多酚或聚酮的方法,其包括以下步骤:
a) 提供包含水和C6碳源的溶液;
b) 在本发明的棒状细菌细胞存在下将根据步骤a)的溶液中的C6碳源微生物转化成多酚或聚酮,其中首先提供浓度提高的丙二酰辅酶A作为中间体,并进一步转化以微生物合成多酚或聚酮;
c) 通过在步骤b)中加入合适的诱导剂在诱导型启动子的控制下诱导异源或植物基因的表达,
d) 任选处理所需产物。
在本发明方法的一个变体中,使用棒状细菌细胞,其具有选自如下的基因:
a) fasB和/或gltA和/或accBCD1,其功能和/或表达被定向修饰以增强提供丙二酰辅酶A,和
b) cg0344-47 (phdBCDE-操纵子)、cg2625-40 (cat、ben和pca)、cg1226 (pobA)和cg0502 (qsuB),其用于芳族组分,优选选自苯丙素类或苯甲酸衍生物的芳族组分的分解的功能失活,和
c) 编码用于合成聚酮,优选去甲丁香色原酮的具有增强的5,7-二羟基-2-甲基色酮合酶活性的蛋白(PCS
d) 用于从葡萄糖出发合成多酚前体的aroH和tal,和
e) 用于合成多酚,优选茋类,特别优选白藜芦醇的4cl和sts,或
f) 用于合成多酚,优选黄酮类,特别优选柚皮素的 chs和chi。
根据本发明,为了制备聚酮,优选去甲丁香色原酮,在此可设想组合,其例如具有fasB的变体(取代突变体或缺失突变体)和Δcg0344-47 (phdBCDE-操纵子)和Δcg2625-40(cat、ben和pca)和Δcg1226 (pobA)和Δcg0502 (qsuB)和pcs
根据本发明,为了制备多酚,优选茋类,更优选白藜芦醇,可设想组合,其例如具有fasB的变体(取代突变体或缺失突变体)和Δcg0344-47 (phdBCDE-操纵子)和Δcg2625-40(cat、ben和pca)和Δcg1226 (pobA)和Δcg0502 (qsuB)和aroH和tal和4cl和sts;具有gtlA和Δcg0344-47 (phdBCDE-操纵子)和Δcg2625-40 (cat、ben和pca)和Δcg1226(pobA)和Δcg0502 (qsuB)和aroH和tal和4cl和sts;具有gtlA和accBCD1和Δcg0344-47(phdBCDE-操纵子)和Δcg2625-40 (cat、ben和pca)和Δcg1226 (pobA)和Δcg0502(qsuB)和aroH和tal和4cl和sts;具有fasB的变体(取代突变体或缺失突变体)和gtlA和accBCD1和Δcg0344-47 (phdBCDE-操纵子)和Δcg2625-40 (cat、ben和pca)和Δcg1226(pobA)和Δcg0502 (qsuB)和aroH和tal和4cl和sts。这些上述变体允许由于基因aroH和tal的表达而从葡萄糖出发制备多酚。然而,对于本发明棒状细菌细胞的补充对香豆酸前体的培养而言,基因aroH和tal不是必需的。本发明的上述棒状细菌细胞的变体此时不具有基因aroH和tal,或这些基因的表达不被诱导。
根据本发明,为了制备多酚,优选黄酮类,更优选柚皮素,可设想组合,其例如具有fasB的变体(取代突变体或缺失突变体)和Δcg0344-47 (phdBCDE-操纵子)和Δcg2625-40(cat、ben和pca)和Δcg1226 (pobA)和Δcg0502 (qsuB)和aroH和tal和4cl和sts;具有gtlA和Δcg0344-47 (phdBCDE-操纵子)和Δcg2625-40 (cat、ben和pca)和Δcg1226(pobA)和Δcg0502 (qsuB)和aroH和tal和4cl和sts;具有gtlA和accBCD1和Δcg0344-47(phdBCDE-操纵子)和Δcg2625-40 (cat、ben和pca)和Δcg1226 (pobA)和Δcg0502(qsuB)和aroH和tal和4cl和sts;具有fasB的变体(取代突变体或缺失突变体)和gtlA和accBCD1和Δcg0344-47 (phdBCDE-操纵子)和Δcg2625-40 (cat、ben和pca)和Δcg1226(pobA)和Δcg0502 (qsuB)和aroH和tal和4cl和sts。这些上述变体允许由于基因aroH和tal的表达而从葡萄糖出发制备多酚。然而,对于本发明棒状细菌细胞的补充对香豆酸前体的培养而言,基因aroH和tal不是必需的。本发明的上述棒状细菌细胞的变体此时任选不具有基因aroH和tal。
在用于制备多酚的本发明方法的一个变体中,将步骤b)中的溶液用多酚前体,优选对香豆酸补充。
在此,合适的是用1-10 mM,优选2-8 mM,特别优选3-7 mM,非常特别优选5-6 mM和特别是5 mM的浓度的对香豆酸以及所有可设想的中间体进行补充。
根据本发明,“处理”被理解为与“分离”、“提取”、“浓缩”或“纯化”同义。在用于制备聚酮和多酚的本发明方法中,产物处理是任选的,因为通过本发明棒状细菌的有利的定向菌株构造实现了生产仅一种次级代谢物,例如白藜芦醇或柚皮素或者去甲丁香色原酮。由此,有利地不需要从培养溶液中分离多种不同的产物,例如白藜芦醇和柚皮素。这是本发明的另一个优点。此外,本发明方法的特征有利地在于,其不依赖于脂肪酸合成的抑制剂,例如浅蓝菌素的加入。细胞、细胞提取物或细胞上清液的进一步提取、处理是本领域技术人员已知的并且可以以已知的方式进行。
在本发明方法的变体中,在不连续或连续地,优选分批、补料分批、重复补料分批或连续模式中进行培养。实施这种培养方法所需的程序是本领域技术人员已知的。
本发明的主题还是上述类型的本发明棒状细菌细胞和/或一种或多种本发明蛋白和/或一种或多种本发明核苷酸序列用于在棒状细菌中增强提供丙二酰辅酶A的用途。
本发明的主题还是本发明棒状细菌细胞和/或一种或多种本发明蛋白和/或一种或多种本发明核苷酸序列用于制备聚酮或多酚,优选用于制备去甲丁香色原酮或制备茋类,特别优选白藜芦醇,或用于制备黄酮类,特别优选柚皮素的用途。
本发明的主题还是组合物,其包含选自多酚和聚酮,优选茋类、黄酮类或聚酮,特别优选白藜芦醇、柚皮素和/或去甲丁香色原酮的次级代谢物,所述次级代谢物通过上述类型的本发明棒状细菌细胞和/或一种或多种本发明蛋白和/或一种或多种本发明核苷酸序列和/或本发明方法来制备。
本发明的主题还是通过本发明棒状细菌细胞和/或根据本发明方法制备的白藜芦醇、柚皮素和/或去甲丁香色原酮的用途,和/或上述类型的组合物用于制备药物、食品、饲料和/或用于植物生理学的用途。本发明的组合物可以包含在制备所需产物中有利的其它物质。本领域技术人员从现有技术中已知选项。
表1显示了本发明细菌菌株的概况;
表2显示了本发明质粒的概况;
表3显示了本发明的SEQ ID NO的概况;
图1显示了在编码具有减弱功能的脂肪酸合酶FasB的fasB基因(cg2743)中氨基酸取代E622K的质粒pK19mobsacB-fasB-E622;
图2在编码具有减弱功能的脂肪酸合酶FasB的fasB基因(cg2743)中氨基酸取代G1361D 的质粒pK19mobsacB-fasB-G1361D;
图3显示了在编码具有减弱功能的脂肪酸合酶FasB的fasB基因(cg2743)中氨基酸取代G2153D的质粒pK19mobsacB-fasB-G2153D;
图4显示了在编码具有减弱功能的脂肪酸合酶FasB的fasB基因(cg2743)中氨基酸取代G2668S的质粒K19mobsacB-fasB-G2668S;
图5显示了用于功能失活的脂肪酸合酶FasB的fasB (cg2743)的框内缺失的质粒pK19mobsacB-ΔfasB;
图6显示了在缺失基因座Δcg0344-47 (Δcg0344-47::P
图7显示了在编码乙酰辅酶A羧化酶亚单元的基因accBC (cg0802)之前的fasO键合位点突变的质粒pK19mobsacB-mufasO-accBC;
图8显示了在编码乙酰辅酶A羧化酶亚单元的基因accD1 (cg0812)之前的fasO键合位点突变的质粒pK19mobsacB-mufasO-accD1,其中考虑了accD1的ATG起始密码子和氨基酸序列;
图9显示了在IPTG诱导型T7启动子的控制下来自落花生(Arachis hypogea)的茋类合酶(sts)和来自欧芹的4-香豆酸辅酶A连接酶(4cl)的对于谷氨酸棒杆菌密码子优化的基因的表达的质粒pMKEx2-sts
图10显示了在IPTG诱导型T7启动子的控制下来自矮牵牛(Petunia x hybrida)的查耳酮合酶(chs)和来自矮牵牛的查耳酮异构酶(chi)的对于谷氨酸棒杆菌密码子优化的基因的表达的质粒pMKEx2-chs
图11显示了来自木立芦荟(Aloe arborescens)的聚五酮色酮合酶的对于谷氨酸棒杆菌密码子优化的基因(pcs)的缩短变体的表达的质粒pMKEx2-pcs
图12显示了质粒pK19mobsacB-cg0344-47-del,通过其使编码参与苯丙素类例如对香豆酸的分解代谢的基因phdBCDE-操纵子(cg0344-47)从基因组中缺失;
图13显示了质粒pK19mobsacB-cg2625-40-del,通过其使对于分解4-羟基苯甲酸、儿茶酚、苯甲酸和原儿茶酸而言必要的基因cat、ben和pca (cg2625-40)从基因组中缺失;
图14显示了在缺失基因座Δcg0344-47上在T7启动子(P
图15显示了质粒pK19mobsacB-cg0502-del,通过其使对于原儿茶酸积累而言必要的基因qsuB (cg0502)从基因组中缺失;
图16显示了质粒pK19mobsacB-cg1226-del,通过其使编码4-羟基苯甲酸-3-羟化酶且对于分解4-羟基苯甲酸、儿茶酚、苯甲酸和原儿茶酸而言必要的基因phobA (cg1226)从基因组中缺失;
图17显示了质粒pEKEx3-aroH
图18显示了在棒状细菌细胞中表达来自落花生的基因sts (sts
图19显示了在棒状细菌细胞中表达来自矮牵牛的基因chs和chi (chs
图20显示了表达与棒状细菌细胞的密码子使用相匹配的来自木立芦荟的pcs(pcs
图21显示了用于在棒状细菌细胞中表达来自木立芦荟的pcs基因变体(pcs
图22显示了谷氨酸棒杆菌野生型基因的天然启动子区域P
图23显示了具有本发明核苷酸取代的在基因accBC和accD1之前5'可操作连接的fasO结合位点的概况,所述核苷酸取代导致fasR调节子的结合丧失以及accBCD1基因的功能或表达增强。此外,显示了fasO-accD1序列的概况。accD1起始密码子:下划线(AS序列相应地从这里开始转译),灰色突出显示:fasO结合基序的保守区域,其必须突变,以防止FasR结合。红色:与天然序列的差异;
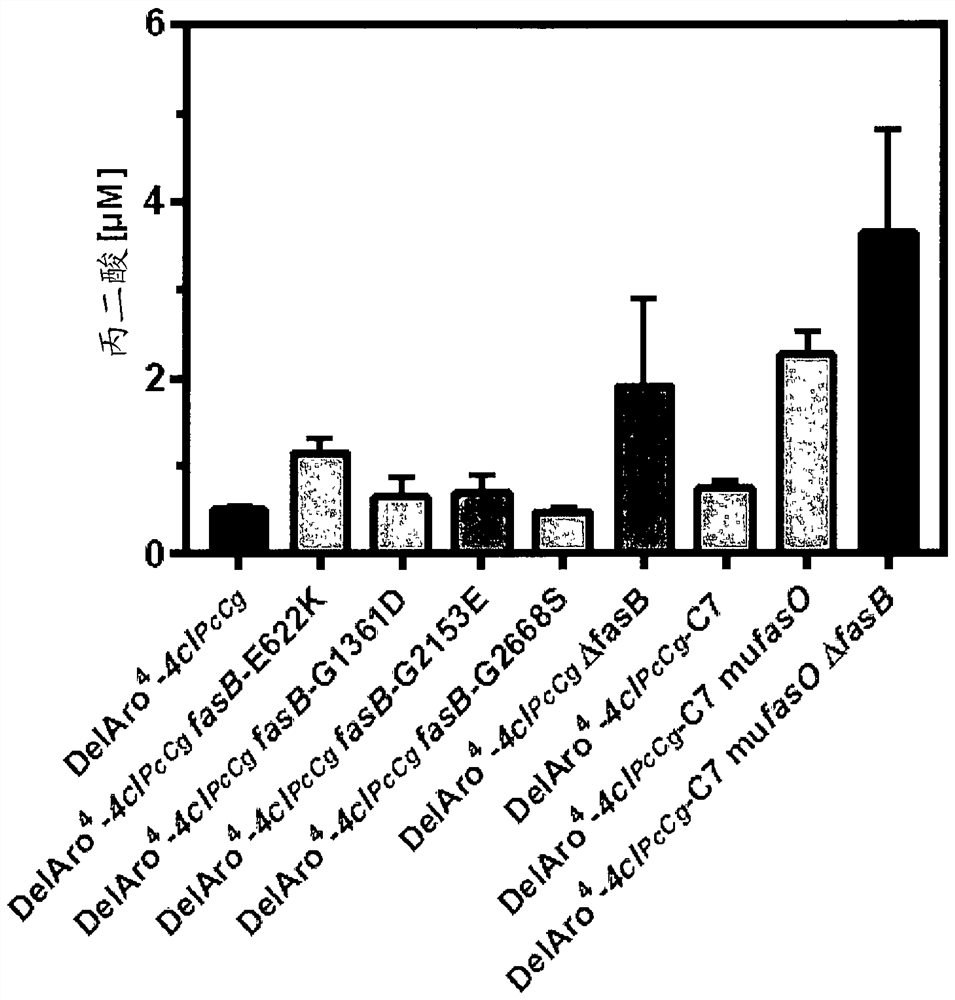
图24显示了在本发明棒状细菌细胞中的丙二酰辅酶A浓度(以μM丙二酸的形式测量)的图表。
通过以下实施例更详细地解释本发明,但这些实施例不是限制性的:
克隆pK19mobsacB-PgltA::PdapA-C7
为了构造质粒pK19mobsacB-PgltA::PdapA-C7 (图6),首先构造质粒pK19mobsacB-△540。这里,选择侧翼区域,以使得带有包含两个转录起始序列和操纵子序列的天然gltA启动子区域的大染色体片段的540个碱基对可以缺失。在上述两个上游和下游侧翼区之间,插入具有接口(Schnittstelle)NsiI和XhoI的大接头的20个碱基对。随后通过这些接口将dapA启动子的C7变体亚克隆。
对于pK19mobsacB-△540的克隆,上游片段“上游”用引物对PgltA-up-s / PgltA-up-as扩增,下游侧翼区用引物对PgltA-down-s / PgltA-down-as扩增。借助1%琼脂糖凝胶上的凝胶电泳分析,检验所生成的DNA片段的预期碱基对尺寸。在此,选择内引物(PgltA-up-as / PgltA-down-s)的核苷酸序列,以使得两个扩增的上游和下游片段含有彼此互补的突出端(包括所述NsiI/XhoI接头。在第二次PCR中(不添加DNA引物),纯化的片段通过互补序列附着(anlagern),并彼此既用作引物、也用作模板(重叠延伸PCR)。将如此生成的△540片段通过来自第一次PCR的两个外(背离基因)引物(PgltA-up-s / PgltA-down-as)在最终PCR中扩增。在1%TAE琼脂糖凝胶上的电泳分离后,根据所附方案从凝胶中通过NucleoSpin®凝胶和 PCR Clean-up试剂盒(Macherey-Nagel, Düren)分离出最终突变片段。为了构造pk19mobsacB-△540,通过限制酶 XbaI和SmaI的FastDigest变体(ThermoFisher Scientific)消化了所生成的△540片段以及pK19-mobsacB空载体。将所述片段的限制批料通过NucleoSpin凝胶和PCR Clean-up试剂盒(Macherey-Nagel, Düren)纯化。为了借助Rapid DNA Ligation试剂盒(Thermo Fisher Scientific)连接水解的DNA片段,以相对于线性化载体骨架pK19mobsacB而言三倍摩尔过量使用缺失片段。在片段连接完成后,将整个批料体积用于借助在42℃下热激90秒来转化化学感受态大肠杆菌DH5α-细胞。在热激之后,在冰上使这些细胞再生90秒,然后为它们提供800μL LB培养基,并且在900 rpm下在恒温混匀仪(Eppendorf, Hamburg)中在37℃下再生60分钟。随后将100μl的细胞悬浮液在包含卡那霉素(50μg/ml)的LB琼脂板上进行铺板(ausgestrichen)并在37℃下温育过夜。借助菌落PCR检查生长转化株中的pk19mobsacB-△540的正确组装。为此,使用2x DreamTaqGreen PCR Master Mix (ThermoFisher Scientific Inc., Waltham, MA, USA)。在此通过添加生长菌落的细胞,将DNA模板埋入PCR批料中。由于PCR方案在95℃下3分钟的初始变性步骤,细胞裂解,以使得DNA模板被释放并可用于DNA聚合酶。作为菌落PCR的DNA引物,使用引物对univ / rsp,其特异性地结合pK19mobsacB载体骨架,并且在所用片段的正确连接的情况下形成特定尺寸的PCR产物,其通过凝胶电泳来检查。其PCR产物表明pK19mobsacB-△540的正确组装的克隆(Klone)在包含卡那霉素(50μg/ml)的LB培养基中培养过夜,以分离质粒。然后将质粒与NucleoSpin Plasmid (NoLid)试剂盒(Macherey-Nagel, Düren)分离并且用所述扩增PCR引物和菌落PCR引物进行测序。
为了构造pk19mobsacB-PgltA::PdapA-C7,将dapA启动子的C7变体用引物对PPdapA-s / PdapA-as扩增,并借助1%琼脂糖凝胶上的凝胶电泳分析检测预期的碱基对尺寸。根据所附方案通过NucleoSpin®凝胶和 PCR Clean-up试剂盒(Macherey-Nagel, Düren)纯化所生成的片段。为了构造pk19mobsacB-PgltA::PdapA-C7,通过限制酶 XhoI和NsiI 的FastDigest变体(Thermo Fisher Scientific)消化了所生成的PdapA片段和目标载体pk19mobsacB-△540。将所述片段的限制批料通过NucleoSpin凝胶和PCR Clean-up试剂盒(Macherey-Nagel, Düren)纯化。为了借助Rapid DNA Ligation试剂盒(ThermoFisher Scientific)连接水解的DNA片段,以相对于线性化载体骨架pk19mobsacB-△540而言三倍摩尔过量使用PdapA片段。在片段连接完成后,将整个批料体积用于借助在42℃下热激90秒来转化化学感受态大肠杆菌DH5α-细胞。在热激之后,在冰上使这些细胞再生90秒,然后为它们提供800μL LB培养基,并且在900 rpm下在恒温混匀仪(Eppendorf, Hamburg)中在37℃下再生60分钟。随后将100μl的细胞悬浮液在包含卡那霉素(50μg/ml)的LB琼脂板上进行铺板并在37℃下温育过夜。借助菌落PCR检查生长转化株中的pk19mobsacB-PgltA::PdapA-C7的正确组装。为此,使用2x DreamTaq Green PCR Master Mix (ThermoFisherScientific Inc., Waltham, MA, USA)。在此通过添加生长菌落的细胞,将DNA模板埋入PCR批料中。由于PCR方案在95℃下3分钟的初始变性步骤,细胞裂解,以使得DNA模板被释放并可用于DNA聚合酶。作为菌落PCR的DNA引物,使用引物对univ / rsp,其特异性地结合pK19mobsacB载体骨架,并且在所用片段的正确连接的情况下形成特定尺寸的PCR产物,其通过凝胶电泳来检查。其PCR产物表明pk19mobsacB-PgltA::PdapA-C7的正确组装的克隆在包含卡那霉素(50μg/ml)的LB培养基中培养过夜,以分离质粒。然后将质粒通过NucleoSpinPlasmid (NoLid)试剂盒(Macherey-Nagel, Düren)分离并且用所述扩增PCR引物和菌落PCR引物进行测序。
通过所述方案用pk19mobsacB-PgltA::PdapA-C7转化电感受态谷氨酸棒杆菌细胞的等分试样,并在BHIS-Kan
pK19mobsacB 的切除在第二次重组事件中通过现在双重的DNA区域发生,其中来自染色体的要突变的密码子最终替换成引入的突变片段。为此,将显示出所述表型(卡那霉素抗性、蔗糖敏感性)的细胞在包含3ml BHI培养基(没有添加卡那霉素)的试管中在30℃和170rpm下温育3小时。然后将各100μl的1:10稀释物在BHI-Kan
本发明的启动子区域PgltA::PdapA-C7除了gtlA的启动子区域替换成dapA外还具有在起始密码子ATG之前在位置95 (a->t)和96 (g->a)的核苷酸取代(图22)。
通过整合到棒状细菌细胞基因组中的核苷酸取代对乙酰羧化酶AccBCD1的启动子区域中用于FasR调节蛋白的调节结合位点(操纵子;fasO)进行改变
构造pK19mobsacB-mufasO-accBC und pK19mobsacB-mufasO-accD1
为了构造在谷氨酸棒杆菌中的基因accBC 和accD1的各自fasO结合位点的突变的质粒pK19mobsacB-mufasO-accBC(图7)和pK19mobsacB-mufasO-accD1(图8),将同源重组事件所需的侧翼片段通过PCR从分离的基因组谷氨酸棒杆菌DNA出发进行扩增。
为了生成上游片段,使用引物对mu-accXX-up-s / mu-accXX-up-as,下游侧翼区使用引物对mu-accXX-down-s / mu-accXX-down-as进行扩增。代码XX在此分别表示两个acc基因变体(accBC或accD1)之一。在此选择内(朝向缺失基因)引物的核苷酸序列(fasB-(cg2743)-up-as / fasB-(cg2743)-down-s),以使得两个扩增的上游和下游片段含有彼此互补的突出端,其是后期gibson组装的前提条件。此外,通过这些引物在各自的fasO结合位点内引入所计划的突变。借助1%琼脂糖凝胶上的凝胶电泳分析检测所生成的DNA片段的预期碱基对尺寸,并且然后根据所附方案用NucleoSpin®凝胶和PCR Clean-up试剂盒(Macherey-Nagel, Düren)纯化。为了构造突变质粒,pK19-mobsacB空载体用限制酶EcoRI的FastDigest变体(Thermo Fisher Scientific)线性化。将限制批料用NucleoSpin凝胶和PCR Clean-up试剂盒(Macherey-Nagel, Düren)纯化。对于借助Gibson组装(Gibson等,2009a)来组装DNA片段,以相对于线性化载体骨架pK19mobsacB而言三倍摩尔过量使用扩增的片段。为DNA片段提供准备的Gibson组装母料混合物,其除了等温反应缓冲液之外还包含组装所需的酶(T5核酸外切酶、高保真DNA聚合酶和Taq DNA连接酶)。所述片段的组装在50℃下在热循环器中进行60分钟。在片段组装完成之后,将整个批料体积用于借助在42℃下热激90秒来转化化学感受态大肠杆菌DH5α细胞。在热激之后,在冰上使这些细胞再生90秒,然后为它们提供800μL LB培养基,并且在900 rpm下在恒温混匀仪(Eppendorf, Hamburg)中在37℃下再生60分钟。随后将100μl的细胞悬浮液在包含卡那霉素(50μg/ml)的LB琼脂板上进行铺板并在37℃下温育过夜。借助菌落PCR检查生长转化株中的突变质粒的正确组装。为此,使用2x DreamTaq Green PCR Master Mix (ThermoFisher Scientific Inc.,Waltham, MA, USA)。在此通过添加生长菌落的细胞,将DNA模板埋入PCR批料中。由于PCR方案在95℃下3分钟的初始变性步骤,细胞裂解,以使得DNA模板被释放并可用于DNA聚合酶。作为菌落PCR的DNA引物,使用引物对univ / rsp ,其特异性地结合pK19mobsacB载体骨架,并在所用片段的正确组装的情况下形成特定尺寸的PCR产物,其通过凝胶电泳来检查。其PCR产物表明突变质粒pK19mobsacB-mufasO-accBC或pK19mobsacB-mufasO-accD1的正确组装的克隆在包含卡那霉素50μg/ml)的LB培养基中培养过夜,以分离质粒。然后将质粒用NucleoSpin Plasmid (NoLid)试剂盒(Macherey-Nagel, Düren)分离并且用所述扩增PCR引物和菌落PCR引物进行测序。
通过所述方案用各自的突变质粒转化电感受态谷氨酸棒杆菌细胞的等分试样,并在BHIS-Kan
pK19mobsacB 的切除在第二次重组事件中通过现在双重的DNA区域发生,其中来自染色体的要突变的密码子最终替换成引入的突变片段。为此,将显示出所述表型(卡那霉素抗性、蔗糖敏感性)的细胞在包含3ml的BHI培养基(没有添加卡那霉素)的试管中在30℃和170 rpm下温育3小时。然后将各100μl的1:10稀释物在BHI-Kan
因此,根据本发明,在accBC 之前的fasO结合位点中在位置11-13 (tga -> gtc)和20-22 (cct -> aag)存在核苷酸取代。在accD1之前的fasO结合位点中,在位置20-24(cctca -> gtacg)存在核苷酸取代。在本发明一个变体中,在基因accBD和accD1之前的本发明fasO结合位点分别具有根据SEQ ID NO:13和15的核酸序列。
整合到棒状细菌细胞基因组中的用于使脂肪酸合酶FasB 的功能失活的基因fasB缺失
构造pK19mobsacB-△fasB
为了构造在谷氨酸棒杆菌中的基因fasB缺失的质粒pK19mobsacB-△fasB(图5),使同源重组事件所需的侧翼片段通过PCR从分离的基因组谷氨酸棒杆菌DNA出发进行扩增。
对于生成上游片段,使用引物对fasB-(cg2743)-up-s / fasB-(cg2743)-up-as,下游侧翼区用引物对fasB-(cg2743)-down-s / fasB-(cg2743)-down-as进行扩增。在此选择内(朝向缺失基因)引物的核苷酸序列(fasB-(cg2743)-up-as / fasB-(cg2743)-down-s),以使得两个扩增的上游和下游片段含有彼此互补的突出端,其是后期gibson组装的前提条件。借助1%琼脂糖凝胶上的凝胶电泳分析检测所生成的DNA片段的预期碱基对尺寸,并且然后根据所附方案用NucleoSpin®凝胶和PCR Clean-up试剂盒(Macherey-Nagel, Düren)纯化。为了构造缺失质粒,pK19-mobsacB空载体用限制酶EcoRI的FastDigest变体(Thermo Fisher Scientific)线性化。将限制批料用NucleoSpin凝胶和PCR Clean-up试剂盒(Macherey-Nagel, Düren)纯化。对于借助Gibson组装(Gibson等, 2009a)来组装DNA片段,以相对于线性化载体骨架pK19mobsacB而言三倍摩尔过量使用扩增的片段。为DNA片段提供准备的Gibson组装母料混合物,其除了等温反应缓冲液之外还包含组装所需的酶(T5核酸外切酶、高保真DNA聚合酶和Taq DNA连接酶)。所述片段的组装在50℃下在热循环器中进行60分钟。在片段组装完成之后,将整个批料体积用于借助在42℃下热激90秒来转化化学感受态大肠杆菌DH5α细胞。在热激之后,在冰上使这些细胞再生90秒,然后为它们提供800μL LB培养基,并且在900 rpm下在恒温混匀仪(Eppendorf, Hamburg)中在37℃下再生60分钟。随后将100μl的细胞悬浮液在包含卡那霉素(50μg/ml)的LB琼脂板上进行铺板并在37℃下温育过夜。借助菌落PCR检查生长转化株中的突变质粒的正确组装。为此,使用2xDreamTaq Green PCR Master Mix (ThermoFisher Scientific Inc., Waltham, MA,USA)。在此通过添加生长菌落的细胞,将DNA模板埋入PCR批料中。由于PCR方案在95℃下3分钟的初始变性步骤,细胞裂解,以使得DNA模板被释放并可用于DNA聚合酶。作为菌落PCR的DNA引物,使用引物对univ / rsp ,其特异性地结合pK19mobsacB载体骨架,并在所用片段的正确组装的情况下形成特定尺寸的PCR产物,其通过凝胶电泳来检查。其PCR产物表明缺失质粒pK19mobsacB-△fasB的正确组装的克隆在包含卡那霉素(50μg/ml)的LB培养基中培养过夜,以分离质粒。然后将质粒用NucleoSpin Plasmid (NoLid)试剂盒(Macherey-Nagel, Düren)分离并且用所述扩增PCR引物和菌落PCR引物进行测序。
通过所述方案用各自的突变质粒转化电感受态谷氨酸棒杆菌细胞的等分试样,并在BHIS-Kan
pK19mobsacB的切除在第二次重组事件中通过现在双重的DNA区域发生,其中来自染色体的要突变的密码子最终替换成引入的突变片段。为此,将显示出所述表型(卡那霉素抗性、蔗糖敏感性)的细胞在包含3ml的BHI培养基(没有添加卡那霉素)的试管中在30℃和170 rpm下温育3小时。然后将各100μl的1:10稀释物在BHI-Kan
谷氨酸棒杆菌 DelAro
构造质粒pK19mobsacB-fasB-E622K、pK19mobsacB-fasB-G1361D、pK19mobsacB-fasB-G2153D和pK19mobsacB-fasB-G2668S
为了构造将各自的氨基酸取代整合到在谷氨酸棒杆菌中由基因fasB编码的脂肪酸合酶B中的质粒pK19mobsacB-fasB-E622K (图1)、pK19mobsacB-fasB-G1361D (图2)、pK19mobsacB-fasB-G2153D (图3)和pK19mobsacB-fasB-G2668S (图4),同源重组事件所需的各自要突变的密码子的侧翼片段通过PCR从分离的基因组谷氨酸棒杆菌DNA出发进行扩增。
为了生成上游片段,使用引物对SbfI_XXX_s / OL_XXX_as,下游侧翼区用引物对OL_XXX_s / XbaI_XXX-as进行扩增。代码XXX在此各自表示引入在脂肪酸合酶B中特定位置的氨基酸取代。借助1%琼脂糖凝胶上的凝胶电泳分析,检查所生成的DNA片段的预期碱基对尺寸。在此选择内(朝向要突变的密码子)引物的核苷酸序列(OL_XXX_as / OL_XXX_s),以使得两个扩增的上游和下游片段包含彼此互补的突出端。在第二次PCR中(不添加DNA引物),纯化的片段通过互补序列附着,并彼此既用作引物、也用作模板(重叠延伸PCR)。由此生成的突变片段在最终PCR中用来自第一次PCR的两个外(背向基因)引物进行扩增(SbfI_XXX_s / XbaI_XXX-as)。在1%TAE琼脂糖凝胶上的电泳分离后,根据所附方案从凝胶中通过NucleoSpin®凝胶和 PCR Clean-up试剂盒(Macherey-Nagel, Düren)分离最终突变片段。为了构造突变质粒,将突变片段和pK19-mobsacB空载体用限制酶SbfI和XbaI的FastDigest变体(Thermo Fisher Scientific)线性化。将所述片段的限制批料通过NucleoSpin凝胶和PCR Clean-up试剂盒(Macherey-Nagel, Düren)纯化。为了借助RapidDNA Ligation试剂盒(Thermo Fisher Scientific)连接水解的DNA片段,分别以相对于线性化的载体骨架pK19mobsacB而言三倍摩尔过量使用突变片段。在片段连接完成后,将整个批料体积用于借助在42℃下热激90秒来转化化学感受态大肠杆菌DH5α-细胞。在热激之后,在冰上使这些细胞再生90秒,然后为它们提供800μL LB培养基,并且在900 rpm下在恒温混匀仪(Eppendorf, Hamburg)中在37℃下再生60分钟。随后将100μl的细胞悬浮液在包含卡那霉素(50μg/ml)的LB琼脂板上进行铺板并在37℃下温育过夜。借助菌落PCR检查生长转化株中的突变质粒的正确组装。为此,使用2x DreamTaq Green PCR Master Mix(ThermoFisher Scientific Inc., Waltham, MA, USA)。在此通过添加生长菌落的细胞,将DNA模板埋入PCR批料中。由于PCR方案在95℃下3分钟的初始变性步骤,细胞裂解,以使得DNA模板被释放并可用于DNA聚合酶。作为菌落PCR的DNA引物,使用引物对univ / rsp,其特异性地结合pK19mobsacB载体骨架,并且在所用片段的正确连接的情况下形成特定尺寸的PCR产物,其通过凝胶电泳来检查。将其PCR产物表明各自的突变质粒pK19mobsacB-fasB-XXX的正确组装的克隆在包含卡那霉素(50μg/mL)的LB培养基中培养过夜,以分离质粒。然后将质粒用NucleoSpin Plasmid (NoLid)试剂盒(Macherey-Nagel, Düren)分离并且用所述扩增PCR引物和菌落PCR引物进行测序。
通过所述方案用各自的突变质粒转化电感受态谷氨酸棒杆菌细胞的等分试样,并在BHIS-Kan
pK19mobsacB 的切除在第二次重组事件中通过现在双重的DNA区域发生,其中来自染色体的要突变的密码子最终替换成引入的突变片段。为此,将显示出所述表型(卡那霉素抗性、蔗糖敏感性)的细胞在包含3ml的BHI培养基(没有添加卡那霉素)的试管中在30℃和170 rpm下温育3小时。然后将各100μl的1:10稀释物在BHI-Kan
在本发明的变体中,还包括来自棒状细菌的脂肪酸合酶FasB的蛋白和/或编码来自棒状细菌的脂肪酸合酶FasB的核酸序列,其中存在核苷酸取代和相应对应的氨基酸替换。这样的变体例如描述在具有在位置1864 (g -> a)的核苷酸取代的SEQ ID NO.1中、具有在位置4082 (g -> a)的核苷酸取代的SEQ ID NO.3中、具有在位置6458 (g -> a)的核苷酸取代的SEQ ID NO.5中、具有在位置8002-8004 (ggt->tcc)的核苷酸取代的SEQ IDNO.7中和具有在位置25-8943的缺失的SEQ ID NO.9中。
对于缺失和整合/取代,以下步骤都是相同的。为了简单起见,仅提及缺失菌株或缺失质粒。
为了构造谷氨酸棒杆菌缺失菌株,克隆了基于pK19mobsacB的缺失质粒(Schäfer等, 1994; https://doi.org/10.1016/0378-1119(94)90324-7)。然后如所述(Niebisch &Bott, 2001; https://doi.org/10.1007/s002030100262)使目标基因缺失。为此所需的缺失片段在此借助交叉PCR (Link等, 1997; https://doi.org/10.1128/jb.179.20.6228-6237.1997)生成。为此,在第一步骤中在两个独立的反应中生成尺寸为约500 bp的侧翼片段,其在染色体中位于要缺失的基因上游和下游。在此选择内(朝向要缺失的基因)引物的核苷酸序列,以使得两个扩增的片段包含彼此互补的突出端。在第二次PCR中,纯化的片段通过互补序列附着,并且彼此既用作引物、也用作模板。由此生成的缺失片段在最终PCR中使用来自第一次PCR中的两个外(背向基因)引物进行扩增。在1%TAE琼脂糖凝胶上进行电泳分离(Sambrook等, 1989)后,根据所附方案使用NucleoSpin
对于缺失和插入,以下步骤都是相同的。为了简单起见,仅提及缺失质粒。
使用所述方案用各自的缺失质粒转化电感受态谷氨酸棒杆菌细胞的等分试样,并在BHIS-Kan
pK19mobsacB的切除在第二次重组事件中通过现在双重的DNA区域发生,其中来自染色体的要缺失的基因最终替换成引入的缺失片段。为此,将显示出所述表型(卡那霉素抗性、蔗糖敏感性)的细胞在包含3ml BHI培养基(没有添加卡那霉素)的试管中在30℃和170rpm下温育3小时。然后将各100μl的1:10稀释物在BHI-Kan
通过上述操作方式,从菌株谷氨酸棒杆菌ATCC 13032出发构造菌株,其在同源脂肪酸合酶基因fasB的编码区域中包含核苷酸取代(C.g.130232-fasB-E622K、C.g.130232-fasB-G1361D、C.g.130232-fasB-G2153E、C.g.130232-fasB-G2668S)或缺失区域(C.g13032-ΔfasB)、在基因簇accBCD1之前的同源fasO结合位点中包含改变(C.g.130232-mufasO)以及在编码柠檬酸合酶的基因gtlA之前包含具有减弱活性的同源启动子区域(C.g.13032-C7)。这些菌株的特征在于它们是非重组改变的,因此被标示为non-GVO。
下述方法用于构造谷氨酸棒杆菌DelAro
选择菌株谷氨酸棒杆菌MB001 (DE3)作为构造谷氨酸棒杆菌DelAro
从谷氨酸棒杆菌MB001 (DE3)出发,通过基因(簇)cg0344-47、cg2625-40和cg1226的缺失来构造菌株谷氨酸棒杆菌DelAro
cg0344-47是phdBCDE操纵子,其编码参与苯丙素类例如p-香豆酸的分解代谢的基因。
为了防止由酶催化的环羟基化或环裂解反应引起的苯丙素类的非特异性转化(各自的酶4-羟基苯甲酸-3-羟化酶PobA和原儿茶酸二加氧酶PcaGH的天然底物分别显示出与苯丙素类的高结构相似性),使对于分解4-羟基苯甲酸、儿茶酚、苯甲酸和原儿茶酸而言必要的相应基因(簇)cg1226 (pobA) 和cg2625-40 (cat、ben和pca 基因缺失。
在建立从葡萄糖出发(此外用质粒pEKEx3_aroH
通过在T7启动子控制下将来自欧芹的4cl
从谷氨酸棒杆菌DelAro
构造pK19mobsacB-cg0344-47-del和pK19mobsacB-cg2625-40-del
为了构造谷氨酸棒杆菌中的基因簇cg0344-47和cg2625-40缺失的质粒pK19mobsacB-cg0344-47-del (图12)和pK19mobsacB-cg2625-40-del(图13),将同源重组事件所需的各自要缺失的基因簇的侧翼片段通过PCR从分离的基因组谷氨酸棒杆菌DNA出发进行扩增。
为了生成上游片段,使用引物对cgXXXX-XX-up-s / cgXXXX-XX-up-as,下游侧翼区用引物对cgXXXX-XX-down-s / cgXXXX-XX-down-as进行扩增。代码XXXX-XX在此各自表示要缺失的基因的cg编号。例如,引物对cg0344-47-up-s/ cg0344-47-up-as用于基因簇cg0344-47的缺失,类似地,引物对cg2625-40-up-s/ cg2625-40-up-as用于基因簇cg2625-40的缺失。借助1%琼脂糖凝胶上的凝胶电泳分析,检验所生成的DNA片段的预期碱基对尺寸。在此选择内(朝向要缺失的基因)引物的核苷酸序列(cgXXXX-XX-up-as / cgXXXX-XX-down-s),以使得两个扩增的上游和下游片段包含彼此互补的突出端。对于基因簇cg0344-47,这是引物对cg0344-47-up-as/cg0344-47-down-s,类似地,对于基因簇cg2625-40,这是引物对cg2625-40-up-as/cg2625-40-down-s。在第二次PCR中(不添加DNA引物),纯化的片段通过互补序列附着,并彼此既用作引物、也用作模板(重叠延伸PCR)。以这种方式生成的缺失片段在最终的PCR中用来自第一次PCR的两个外(背向基因)引物进行扩增(cgXXXX-XX-up-s / cgXXXX-XX-down-as)。对于基因簇cg0344-47,这是引物对cg0344-47-up-s/cg0344-47-down-as,类似地,对于基因簇cg2625-40,这是引物对cg2625-40-up-s/cg2625-40-down-as。在1%TAE琼脂糖凝胶上的电泳分离后,根据所附方案从凝胶中通过NucleoSpin®凝胶和 PCR Clean-up试剂盒(Macherey-Nagel, Düren)分离出最终缺失片段。为了构造缺失质粒,通过限制酶XbaI和EcoRI的FastDigest变体(Thermo FisherScientific)使缺失片段和pK19-mobsacB空载体都线性化。将所述片段的限制批料通过NucleoSpin凝胶和PCR Clean-up试剂盒(Macherey-Nagel, Düren)纯化。为了通过RapidDNA Ligation试剂盒(Thermo Fisher Scientific)连接水解的DNA片段,以相对于线性化载体骨架pK19mobsacB而言三倍摩尔过量使用两种缺失片段中的各一种。在片段连接完成后,将整个批料体积用于借助在42℃下热激90秒来转化化学感受态的大肠杆菌DH5α-细胞。在热激之后,在冰上使这些细胞再生90秒,然后为它们提供800μL LB培养基,并且在900rpm下在恒温混匀仪(Eppendorf, Hamburg)中在37℃下再生60分钟。随后将100μl的细胞悬浮液在包含卡那霉素(50μg/ml)的LB琼脂板上进行铺板并在37℃下温育过夜。通过菌落PCR检查生长的转化株中的缺失质粒的正确组装。为此,使用2x DreamTaq Green PCR MasterMix (ThermoFisher Scientific Inc., Waltham, MA, USA)。在此通过添加生长菌落的细胞,将DNA模板埋入PCR批料中。由于PCR方案在95℃下3分钟的初始变性步骤,细胞裂解,以使得DNA模板被释放并可用于DNA聚合酶。作为菌落PCR的DNA引物,使用引物对univ / rsp,其特异性地结合pK19mobsacB载体骨架,并且在所用片段的正确连接的情况下形成特定尺寸的PCR产物,其通过凝胶电泳来检查。其PCR产物表明各自的缺失质粒pK19mobsacB-cg0344-47-del和pK19mobsacB-cg2625-40-del的正确组装的克隆,在包含卡那霉素(50μg/ml)的LB培养基中培养过夜,以分离质粒。然后将质粒用NucleoSpin Plasmid (NoLid)试剂盒(Macherey-Nagel, Düren)分离并且用所述扩增PCR引物和菌落PCR引物进行测序。
用所述方案将谷氨酸棒杆菌细胞的等分试样用各自的缺失质粒转化,并在BHIS-Kan
pK19mobsacB的切除在第二次重组事件中通过现在双重存在的DNA区域发生,其中来自染色体的要缺失的基因最终替换成引入的缺失片段。为此,将显示出所述表型(卡那霉素抗性、蔗糖敏感性)的细胞在包含3ml的BHI培养基(没有添加卡那霉素)的试管中在30℃和170 rpm下温育3小时。然后将各100μl的1:10稀释物在BHI-Kan
构造pK19mobsacB-△cg0344-47::P
为了构造在T7启动子(P
通过所述方案用插入质粒转化电感受态谷氨酸棒杆菌细胞的等分试样,并在BHIS-Kan
pK19mobsacB的切除在第二次重组事件中通过现在双重存在的DNA区域发生,其中所选择的来自染色体的整合基因座最终替换成引入的插入片段。为此,将显示出所述表型(卡那霉素抗性、蔗糖敏感性)的细胞在包含3ml的BHI培养基(没有添加卡那霉素)的试管中在30℃和170 rpm下温育3小时。然后将各100μl的1:10稀释物在BHI-Kan
构造pK19mobsacB-cg0502-del
为了构造谷氨酸棒杆菌中的基因cg0502缺失的质粒pK19mobsacB-cg0502-del(图15),同源重组事件所需的侧翼片段通过PCR从分离的基因组谷氨酸棒杆菌DNA出发进行扩增。
对于上游的片段的生成,使用引物对cg0502-up-s / cg0502-up-as,下游的侧翼区使用引物对cg0502-down-s / cg0502-down-as扩增。借助1%琼脂糖凝胶上的凝胶电泳分析,检验所生成的DNA片段的预期碱基对尺寸。选择内(朝向缺失基因)引物的核苷酸序列(cg0502-up-as / cg0502-down-s),以使得两个扩增的上游和下游片段包含彼此互补的突出端。在第二次PCR中(不添加DNA引物),纯化的片段通过互补序列附着,并彼此既用作引物、也用作模板(重叠延伸PCR)。将如此生成的缺失片段在最终PCR中通过来自第一次PCR的两个外(背离基因)引物扩增(cg0502-up-s / cg0502-down-as)。在1%TAE琼脂糖凝胶上的电泳分离后,根据所附方案从凝胶中通过NucleoSpin®凝胶和 PCR Clean-up试剂盒(Macherey-Nagel, Düren)分离出最终缺失片段。为了构造缺失质粒,通过限制酶HindIII和BamHI的FastDigest变体(Thermo Fisher Scientific)使缺失片段和pK19-mobsacB空载体都线性化。将所述片段的限制批料通过NucleoSpin凝胶和PCR Clean-up试剂盒(Macherey-Nagel, Düren)纯化。为了借助Rapid DNA Ligation试剂盒(Thermo FisherScientific)连接水解的DNA片段,以相对于线性化载体骨架pK19mobsacB而言三倍摩尔过量使用缺失片段。在片段连接完成后,将整个批料体积用于借助在42℃下热激90秒来转化化学感受态大肠杆菌DH5α-细胞。在热激之后,在冰上使这些细胞再生90秒,然后为它们提供800μL LB培养基,并且在900 rpm下在恒温混匀仪(Eppendorf, Hamburg)中在37℃下再生60分钟。随后将100μl的细胞悬浮液在包含卡那霉素(50μg/ml)的LB琼脂板上进行铺板并在37℃下温育过夜。通过菌落PCR检查生长的转化株中缺失质粒的正确组装。为此,使用2xDreamTaq Green PCR Master Mix (ThermoFisher Scientific Inc., Waltham, MA,USA)。在此通过添加生长菌落的细胞,将DNA模板埋入PCR批料中。由于PCR方案在95℃下3分钟的初始变性步骤,细胞裂解,以使得DNA模板被释放并可用于DNA聚合酶。作为菌落PCR的DNA引物,使用引物对univ / rsp,其特异性地结合pK19mobsacB载体骨架,并且在所用片段的正确连接的情况下形成特定尺寸的PCR产物,其通过凝胶电泳来检查。其PCR产物表明缺失质粒pK19mobsacB-cg0502-del的正确组装的克隆在包含卡那霉素(50μg/ml)的LB培养基中培养过夜,以分离质粒。然后将质粒用NucleoSpin Plasmid (NoLid)试剂盒(Macherey-Nagel, Düren)分离并且用所述扩增PCR引物和菌落PCR引物进行测序。
通过所述方案用各自的缺失质粒转化电感受态谷氨酸棒杆菌细胞的等分试样,并在BHIS-Kan
pK19mobsacB的切除在第二次重组事件中通过现在双重存在的DNA区域发生,其中来自染色体的要缺失的基因最终替换成引入的缺失片段。为此,将显示出所述表型(卡那霉素抗性、蔗糖敏感性)的细胞在包含3ml的BHI培养基(没有添加卡那霉素)的试管中在30℃和170 rpm下温育3小时。然后将各100μl的1:10稀释物在BHI-Kan
构造pK19mobsacB-cg1226-del
为了构造在谷氨酸棒杆菌中的基因cg1226缺失的质粒pK19mobsacB-cg1226-del(图16),同源重组事件所需的侧翼片段通过PCR从分离的基因组谷氨酸棒杆菌DNA出发进行扩增。
对于上游片段的生成,使用引物对cg1226-up-s / cg1226-up-as,下游的侧翼区使用引物对cg1226-down-s / cg1226-down-as 扩增。借助1%琼脂糖凝胶上的凝胶电泳分析,检验所生成的DNA片段的预期碱基对尺寸。在此选择内(朝向缺失基因)引物的核苷酸序列(cg1226-up-as / cg1226-down-s),以使得两个扩增的上游和下游片段包含彼此互补的突出端。在第二次PCR中(不添加DNA引物),纯化的片段通过互补序列附着,并彼此既用作引物、也用作模板(重叠延伸PCR)。将如此生成的缺失片段在最终PCR中通过来自第一次PCR的两个外(背离基因)引物扩增(cg1226-up-s / cg1226-down-as)。在1%TAE琼脂糖凝胶上的电泳分离后,根据所附方案从凝胶中通过NucleoSpin®凝胶和 PCR Clean-up试剂盒(Macherey-Nagel, Düren)分离出最终缺失片段。为了构造缺失质粒,通过限制酶HindIII和BamHI的FastDigest变体(Thermo Fisher Scientific)使缺失片段和pK19-mobsacB空载体都线性化。将所述片段的限制批料通过NucleoSpin凝胶和PCR Clean-up试剂盒(Macherey-Nagel, Düren)纯化。为了借助Rapid DNA Ligation试剂盒(Thermo FisherScientific)连接水解的DNA片段,以相对于线性化载体骨架pK19mobsacB而言三倍摩尔过量使用缺失片段。在片段连接完成后,将整个批料体积用于借助在42℃下热激90秒来转化化学感受态的大肠杆菌DH5α-细胞。在热激之后,在冰上使这些细胞再生90秒,然后为它们提供800μL LB培养基,并且在900 rpm下在恒温混匀仪(Eppendorf, Hamburg)中在37℃下再生60分钟。随后将100μl的细胞悬浮液在包含卡那霉素(50μg/ml)的LB琼脂板上进行铺板并在37℃下温育过夜。通过菌落PCR检查生长的转化株中缺失质粒的正确组装。为此,使用2x DreamTaq Green PCR Master Mix (ThermoFisher Scientific Inc., Waltham, MA,USA)。在此通过添加生长菌落的细胞,将DNA模板埋入PCR批料中。由于PCR方案在95℃下3分钟的初始变性步骤,细胞裂解,以使得DNA模板被释放并可用于DNA聚合酶。作为菌落PCR的DNA引物,使用引物对univ / rsp,其特异性地结合pK19mobsacB载体骨架,并且在所用片段的正确连接的情况下形成特定尺寸的PCR产物,其通过凝胶电泳来检查。其PCR产物表明缺失质粒pK19mobsacB-cg1226-del的正确组装的克隆在包含卡那霉素(50μg/ml)的LB培养基中培养过夜,以分离质粒。然后将质粒用NucleoSpin Plasmid (NoLid)试剂盒(Macherey-Nagel, Düren)分离并且用所述扩增PCR引物和菌落PCR引物进行测序。
通过所述方案用各自的缺失质粒转化电感受态谷氨酸棒杆菌细胞的等分试样,并在BHIS-Kan
pK19mobsacB的切除在第二次重组事件中通过现在双重存在的DNA区域发生,其中来自染色体的要缺失的基因最终替换成引入的缺失片段。为此,将显示出所述表型(卡那霉素抗性、蔗糖敏感性)的细胞在包含3ml的BHI培养基(没有添加卡那霉素)的试管中在30℃和170 rpm下温育3小时。然后将各100μl的1:10稀释物在BHI-Kan
在棒状细菌细胞中建立来自植物的合成生物合成途径,例如多酚或聚酮的合成需 要所需植物基因的异源表达。已知的是,不同物种使用具有不同频率的通用遗传密码的变 体,这最终归因于细胞内的不同tRNA浓度。在这种情况下,称为密码子使用(英语Codon Usage)。很少使用的密码子可以阻碍转译,而更常用的密码子可以加速转译。这导致通过特 异性用于目标生物体的密码子使用来合成异源基因。为此,通过特异性的密码子使用将感 兴趣的异源蛋白的氨基酸序列转录到DNA序列中。对于谷氨酸棒杆菌,关于密码子使用的数 据库可如下获得:http://www.kazusa.or.jp/codon/cgi-bin/showcodon.cgi
基因aroH和tal在棒状细菌细胞中的表达
构造质粒pEKEx3-aroH
为了能够在棒状细菌中合成植物多酚而无需补充多酚前体对香豆酸,即为了由葡萄糖合成植物多酚,需要另外两种基因(Kallscheuer等, 2016; https://doi.org/10.1016/j.ymben.2016.06.003)。这是编码抗反馈3-脱氧-D-阿拉伯庚糖酮酸-7-磷酸合酶(aroH),优选来自大肠杆菌的3-脱氧-D-阿拉伯庚糖酮酸-7-磷酸合酶(aroH
为了构造质粒pEKEx3-aroH
为了构造表达来自大肠杆菌的基因aroH (aroH
构造pMKEx2_sts
为了构造表达来自落花生的基因sts (sts
构造pMKEX2-chs
为了构造表达来自矮牵牛的基因chs和chi (chs
在棒状细菌细胞中根据本发明的聚酮合酶PCS的表达
构造pMKEx2-pcsAa和pMKEx2-pcsAa-short
为了构造表达来自木立芦荟的pcs的基因变体(pcs
借助1%琼脂糖凝胶上的凝胶电泳分析检测所生成的DNA片段的预期碱基对尺寸,并且然后根据所附方案用NucleoSpin®凝胶和PCR Clean-up试剂盒(Macherey-Nagel, Düren)纯化。为了构造所述表达质粒,通过限制酶NcoI和ScaI的FastDigest变体(ThermoFisher scientific)将质粒pMKEx2-sts
用于测量细胞内丙二酰辅酶A提供或柚皮素、去甲丁香色原酮和白藜芦醇合成的谷氨酸棒杆菌的所有培养是在50ml的包含4 %葡萄糖(w/v)的特定CGXII培养基中(Keilhauer等, 1993)在JRC-1-T振荡式培养器(Adolf Kühner AG, Birsfelden, 瑞士)中进行的(500ml带挡板的锥形瓶,30℃,130 rpm)。当适当时,添加所述浓度的选择抗生素:
为了在CGXII培养基中培养,将菌株首先在170 rpm下在试管中的5ml BHI培养基(脑心浸液,Difco Laboratories, Detroit, USA)中温育6-8小时(第一预培养物),然后用于接种500ml带挡板的锥形瓶(有两个彼此相对的挡板)中的50ml CGXII培养基。将该第二预培养物在30℃和130 rpm下温育过夜。CGXII主培养物(50ml在500mL带挡板的锥形瓶中)用生长的第二预培养物接种到OD
通过在接种后90分钟加入1mM异丙基-β-硫代半乳糖苷(IPTG),诱导染色体整合或基于质粒引入的异源基因的表达。在所示的时间点,取出1ml培养物并在-20℃下储存直至使用。如下所述进行产物测定(丙二酰辅酶A或多酚或聚酮)。在发酵结束时,将来自培养溶液的白藜芦醇或柚皮素或去甲丁香色原酮任选进一步处理,即分离、纯化和/或浓缩。
通过用Ultrospec 3300 pro UV/可见分光光度计(Amersham Biosciences,Freiburg)测量600nm波长下的光密度(OD
如前所述进行定量细胞内丙二酰辅酶A水平的样品准备(Kallscheuer等, 2016)。将5ml的培养物在15ml冰冷的60%MeOH/H
通过用Agilent 1260 Infinity HPLC系统(Agilent Technologies, Waldbronn,德国)在40 ℃下使用粒径为5 µm且具有20*2.1 mm预柱(Merck, Darmstadt, 德国)的150* 2.1 mm Sequant ZIC-pHILIC柱的LC-MS/MS分析,将所得样品(细胞提取物、培养物上清液和淬灭上清液)中的丙二酰辅酶A浓度进行定量。用10mM乙酸铵(pH 9.2)(缓冲液A)和乙腈(缓冲液B)进行分离。在每次注射之前,用90%缓冲液B将柱平衡15分钟。以下梯度用于分离(注射体积5μL):0 min: 90% B, 1 min: 90% B, 10 min: 70% B, 25 min: 65 % B, 35min: 10 % B, 45 min: 10% B, 55 min: 10% B。所述测量是通过具有IonDrive离子源的ESI-QqTOF-MS (TripleTOF 6600, AB Sciex, Darmstadt, 德国)进行的。对于数据分析,使用软件分析器TF 1.7 (AB Sciex, Concord, ON, 加拿大)。
作为参考,进行添加有
作为丙二酰辅酶A(852.1>79)和丙二酸(103>59)的最强转换的最佳碰撞能,分别使用-130eV和-11eV。这些借助代谢物标准来确定。在洗脱期间,将所提到的转换和内标(855.1>79和 106>61)用于在MS/MS高灵敏度模式下用最佳碰撞能进行测量。
为了定量这两种代谢物,使用
例如,用本发明棒状细菌细胞测定以下丙二酸(丙二酰辅酶A)滴度(图24)。野生型谷氨酸棒杆菌ATCC 13032和其原始型衍生物谷氨酸棒杆菌DelAro
如上所述进行了产物柚皮素、去甲丁香色原酮和白藜芦醇的提取(Kallscheuer等, 2016)。在培养过程中取出的样品被解冻并为其提供1ml乙酸乙酯,并在Eppendorf恒温混匀仪(Hamburg, 德国)中在1400 rpm下和20℃下温育10分钟。然后将悬浮液以16000g离心5分钟。在乙酸乙酯相中,将800μl转移到抗溶剂的2mL深孔板(Eppendorf, Hamburg, 德国)中。在过夜蒸发溶剂后,将干燥的提取物重悬浮在800μL乙腈中并直接用于LC-MS分析。
提取物中各自产品的LC-MS分析如所述通过耦合到6130四极杆LC-MS系统(Agilent, Waldbronn, 德国)的超高效液相色谱1290 Infinity系统来进行(Kallscheuer等, 2016)。对于色谱分离,在50℃下使用具有100Å孔径(50mm×2.1mm [内径];Phenomenex, Torrance, CA, USA)的Kinetex 1.7 µm C18 柱。作为移动相,在0.5ml/min的流速下使用0.1%乙酸(相A)和乙腈+ 0.1%乙酸(相B)。然后是梯度洗脱,其中相B的比例逐步增加:0-6分钟: 10-30 %, 6-7分钟: 30-50 %, 7-8分钟: 50-100 %, 8-8.5分钟:100-10 %。质谱仪在负电喷雾电离模式(ESI)中操作;数据采集是在选择性离子监测(SIM)中进行的。为了定量,配制乙腈中的各种浓度的纯产物标准。[M-H]—-质量信号(用于柚皮素的m/z 271,用于去甲丁香色原酮的m/z 191,用于白藜芦醇的m/z 227)的测量面积对于高达250 mg/l 的浓度而言是线性的。作为内标,使用苯甲酸(最终浓度100 mg/l,用于苯甲酸的m/z 121)。基于被分析物的测量面积与内标的比率计算校准曲线。
通过本发明的棒状细菌细胞分别在标准条件下在葡萄糖和补充有对香豆酸的葡萄糖上生长时测定以下多酚或聚酮滴度。野生型谷氨酸棒杆菌ATCC 13032和其原始型衍生物谷氨酸棒杆菌DelAro
关于柚皮素制备,本发明的棒状细菌细胞分别在标准条件下在葡萄糖和补充有对香豆酸的葡萄糖上生长时具有以下滴度。野生型谷氨酸棒杆菌ATCC 13032和其原始型衍生物谷氨酸棒杆菌DelAro
本发明棒状细菌细胞在标准条件下在葡萄糖上生长时具有以下去甲丁香色原酮滴度。对于野生型谷氨酸棒杆菌ATCC 13032 pMKEx2-pcs
表1:
表2
表3:
- 在棒状细菌中提供丙二酰辅酶A以及通过棒状细菌制备多酚和聚酮的方法
- 用于制备甲基丙二酰辅酶A或乙基丙二酰辅酶A的酶及其用途
