PCSK9抑制剂用于降低心血管风险的用途
文献发布时间:2023-06-19 11:32:36
相关申请的交叉引用
本申请要求2018年3月6日提交的美国临时专利申请号62/639,407;2018年3月8日提交的美国临时专利申请号62/640,361;2018年3月9日提交的美国临时专利申请号62/641,082;2018年3月12日提交的美国临时专利申请号62/641,918;2018年4月13日提交的美国临时专利申请号62/657,495;2018年6月12日提交的美国临时专利申请号62/683,695;2018年6月22日提交的美国临时专利申请号62/688,622;2018年8月10日提交的美国临时专利申请号62/717,530;2018年9月25日提交的美国临时专利申请号62/736,284;2018年10月10日提交的美国临时专利申请号62/744,008;2018年10月16日提交的美国临时专利申请号62/746,319;2018年11月21日提交的美国临时专利申请号62/770,530;2018年12月4日提交的美国临时专利申请号62/775,219;2019年1月28日提交的美国临时专利申请号62/797,680;2019年2月7日提交的美国临时专利申请号62/802,545;2019年2月15日提交的美国临时专利申请号62/806,313;以及2019年3月4日提交的欧洲专利申请号19305247.9的优先权,将所述专利申请的全部公开内容通过引用以其整体特此并入本文。
技术领域
本发明涉及与脂质和脂蛋白水平升高相关的疾病和障碍的治疗性治疗领域。更具体地,本发明涉及PCSK9抑制剂用于在急性冠状动脉综合征后尽管进行最大耐受他汀疗法仍有高心血管风险的患者中降低心血管风险(包括死亡)和减少致动脉粥样硬化脂蛋白的用途。
背景技术
尽管进行包括迅速冠状动脉血运重建、双重抗血小板疗法和强化他汀治疗的现代疗法,但是仍在急性冠状动脉综合征(ACS)后发生高频率的心血管事件。登记数据指示,5年时心血管死亡率高达13%,绝大多数发生在初次出院后。患有近期急性冠状动脉综合征(ACS)的患者短期内发生复发性冠状动脉事件的风险非常高。在大约10%的ACS患者中,在1年内发生心血管死亡、复发性心肌梗塞或中风。基于大型临床试验的结果,早期强化他汀疗法已经被正式认可为ACS患者的治疗建议。流行病学和药理学干预试验都证明,低密度脂蛋白胆固醇(LDL-C)水平和心血管(CV)事件之间存在强烈的线性关系。然而,许多高CV风险患者不能用当前可用的降脂药物达到这样的水平。此外,大量高风险患者甚至未能达到推荐的LDL-C目标水平,并且实际上没有预防大多数CV事件,为患者留下了相当大的“残留风险”。因此,需要另外的用于治疗高心血管风险患者(包括降低死亡率)的药物疗法。
发明内容
本发明提供了用于在高心血管风险患者中使用PCSK9抑制剂降低心血管风险和减少致动脉粥样硬化脂蛋白的方法。本发明的方法特别可用于降低心血管风险和/或事件。此类方法部分基于本文公开的临床试验结果,其首次证明在接受最大耐受他汀疗法的高心血管风险患者中用PCSK9抑制剂治疗与降低的死亡风险相关。
因此,在一方面,本发明提供了一种用于降低高心血管风险患者的死亡风险的方法,所述方法包括:
(a)选择有需要的高心血管风险患者;以及
(b)向所述患者给予前蛋白转化酶枯草杆菌蛋白酶/kexin 9型(PCSK9)抑制剂,从而降低所述患者的死亡风险。
在一个实施方案中,所述PCSK9抑制剂是PCSK9抗体或其抗原结合片段。在某些实施方案中,所述患者的LDL-C水平大于或等于70mg/dL,尽管用最大耐受他汀疗法进行治疗。在某些实施方案中,所述患者的死亡风险降低了约15%。在其他实施方案中,所述患者的LDL-C水平大于或等于100mg/dL,尽管用最大耐受他汀疗法进行治疗。在某些其他实施方案中,所述患者的死亡风险降低了约29%。在某些实施方案中,所述方法增加了所述患者的存活时间。在某些实施方案中,所述死亡是心血管疾病死亡(“CV死亡”)。在其他实施方案中,所述死亡是非心血管死亡(“非CV死亡”)。在某些实施方案中,所述非CV死亡归因于肺部感染、肺部恶性肿瘤、胃肠/肝胆/胰腺感染、胃肠/肝胆/胰腺恶性肿瘤、出血、非中风/出血的神经过程、自杀、非心血管手术或外科手术、意外或创伤、肾脏感染、肾脏恶性肿瘤、其他非心血管感染或其他非心血管恶性肿瘤。
在另一方面,本发明提供了一种用于降低高心血管风险患者的冠心病(CHD)死亡、非致命性心肌梗塞、需要住院治疗的不稳定型心绞痛或缺血性中风的风险的方法,所述方法包括:
(a)选择有需要的高心血管风险患者;以及
(b)向所述患者给予前蛋白转化酶枯草杆菌蛋白酶/kexin 9型(PCSK9)抑制剂,从而降低所述患者的CHD死亡、非致命性心肌梗塞、需要住院治疗的不稳定型心绞痛或缺血性中风的风险。
在一个实施方案中,所述PCSK9抑制剂是PCSK9抗体或其抗原结合片段。在某些实施方案中,所述患者的LDL-C水平大于或等于70mg/dL,尽管用最大耐受他汀疗法进行治疗。在某些实施方案中,所述患者的CHD死亡、非致命性心肌梗塞、需要住院治疗的不稳定型心绞痛或缺血性中风的风险降低了约15%。在其他实施方案中,所述患者的LDL-C水平大于或等于100mg/dL,尽管用最大耐受他汀疗法进行治疗。在某些其他实施方案中,所述患者的CHD死亡、非致命性心肌梗塞、需要住院治疗的不稳定型心绞痛或缺血性中风的风险降低了约24%。在某些实施方案中,所述方法增加了所述患者到首次发生CHD死亡、非致命性心肌梗塞、需要住院治疗的不稳定型心绞痛或缺血性中风的时间。在某些实施方案中,如通过自动乳胶增强浊度测定法所测量的,所述高心血管风险患者的Lp(a)水平大于或等于20mg/dL,尽管用最大耐受他汀疗法进行治疗。在一些实施方案中,所述高心血管风险患者患有外周动脉疾病(PAD)。在一些实施方案中,所述高心血管风险患者患有脑血管疾病(CeVD)。在一些实施方案中,所述患者患有多血管疾病。在一些实施方案中,所述高心血管风险患者曾进行既往冠状动脉旁路移植术(CABG)。
在某些实施方案中,所述高心血管风险患者患有糖尿病。在某些实施方案中,所述方法将所述糖尿病患者的冠心病(CHD)死亡、非致命性心肌梗塞、需要住院治疗的不稳定型心绞痛或缺血性中风的风险降低了约16%。
在另一方面,本发明提供了一种用于降低高心血管风险患者的冠心病(CHD)事件的风险的方法,所述方法包括:
(a)选择有需要的高心血管风险患者;以及
(b)向所述患者给予前蛋白转化酶枯草杆菌蛋白酶/kexin 9型(PCSK9)抑制剂,从而降低所述患者的CHD事件的风险。
在一个实施方案中,所述PCSK9抑制剂是PCSK9抗体或其抗原结合片段。在某些实施方案中,所述CHD事件包括CHD死亡、非致命性心肌梗塞、需要住院治疗的不稳定型心绞痛或缺血驱动的冠状动脉血运重建术。在某些实施方案中,所述患者的LDL-C水平大于或等于70mg/dL,尽管用最大耐受他汀疗法进行治疗。在某些实施方案中,所述患者的CHD事件的风险降低了约12%。在其他实施方案中,所述患者的LDL-C水平大于或等于100mg/dL,尽管用最大耐受他汀疗法进行治疗。在某些其他实施方案中,所述患者的CHD事件的风险降低了约22%。在某些实施方案中,所述方法增加了所述患者到首次发生CHD事件的时间。
在另一方面,本发明提供了一种用于降低高心血管风险患者的重大CHD事件的风险的方法,所述方法包括:
(a)选择有需要的高心血管风险患者;以及
(b)向所述患者给予前蛋白转化酶枯草杆菌蛋白酶/kexin 9型(PCSK9)抑制剂,从而降低所述患者的重大CHD事件的风险。
在一个实施方案中,所述PCSK9抑制剂是PCSK9抗体或其抗原结合片段。在某些实施方案中,所述重大CHD事件包括CHD死亡或非致命性心肌梗塞。在某些实施方案中,所述患者的LDL-C水平大于或等于70mg/dL,尽管用最大耐受他汀疗法进行治疗。在某些实施方案中,所述患者的重大CHD事件的风险降低了约12%。在其他实施方案中,所述患者的LDL-C水平大于或等于100mg/dL,尽管用最大耐受他汀疗法进行治疗。在某些其他实施方案中,所述患者的重大CHD事件的风险降低了约23%。在某些实施方案中,所述方法增加了所述患者到首次发生重大CHD事件的时间。
在另一方面,本发明提供了一种用于降低高心血管风险患者的CHD死亡的风险的方法,所述方法包括:
(a)选择有需要的高心血管风险患者;以及
(b)向所述患者给予PCSK9抑制剂,从而降低所述患者的CHD死亡的风险。
在一个实施方案中,所述PCSK9抑制剂是PCSK9抗体或其抗原结合片段。在某些实施方案中,所述患者的LDL-C水平大于或等于100mg/dL,尽管用最大耐受他汀疗法进行治疗。在某些实施方案中,所述患者的CHD死亡的风险降低了约28%。在某些实施方案中,所述方法增加了所述患者到首次发生CHD死亡的时间。
在另一方面,本发明提供了一种用于降低高心血管风险患者的心血管事件的风险的方法,所述方法包括:
(a)选择有需要的高心血管风险患者;以及
(b)向所述患者给予前蛋白转化酶枯草杆菌蛋白酶/kexin 9型(PCSK9)抑制剂,从而降低所述患者的心血管事件的风险。
在一个实施方案中,所述PCSK9抑制剂是PCSK9抗体或其抗原结合片段。在某些实施方案中,所述心血管事件包括非致命性CHD事件、心血管死亡或非致命性缺血性中风。在某些实施方案中,所述非致命性CHD事件包括非致命性心肌梗塞、需要住院治疗的不稳定型心绞痛或缺血驱动的冠状动脉血运重建术。在某些实施方案中,所述患者的LDL-C水平大于或等于70mg/dL,尽管用最大耐受他汀疗法进行治疗。在某些实施方案中,所述患者的心血管事件的风险降低了约13%。在其他实施方案中,所述患者的LDL-C水平大于或等于100mg/dL,尽管用最大耐受他汀疗法进行治疗。在某些其他实施方案中,所述患者的心血管事件的风险降低了约22%。在某些实施方案中,所述方法增加了所述患者到首次发生心血管事件的时间。
在另一方面,本发明提供了一种用于降低高心血管风险患者的心血管死亡的风险的方法,所述方法包括:
(a)选择有需要的高心血管风险;以及
(b)向所述患者给予PCSK9抑制剂,从而降低所述患者的心血管死亡的风险。
在一个实施方案中,所述PCSK9抑制剂是PCSK9抗体或其抗原结合片段。在某些实施方案中,所述患者的LDL-C水平大于或等于100mg/dL,尽管用最大耐受他汀疗法进行治疗。在某些实施方案中,所述患者的心血管事件的风险降低了约31%。在某些实施方案中,所述方法增加了所述患者到首次发生心血管死亡的时间。
在另一方面,本发明提供了一种用于降低高心血管风险患者的非致命性心血管事件的风险的方法,所述方法包括:
(a)选择有需要的高心血管风险;以及
(b)向所述患者给予PCSK9抑制剂,从而降低所述患者的非致命性心血管事件的风险。
在一个实施方案中,所述PCSK9抑制剂是PCSK9抗体或其抗原结合片段。在某些实施方案中,所述非致命性心血管事件包括心肌梗塞、中风、需要住院治疗的不稳定型心绞痛、需要住院治疗的心力衰竭或缺血驱动的冠状动脉血运重建术。在某些实施方案中,所述患者的LDL-C水平大于或等于70mg/dL,尽管用最大耐受他汀疗法进行治疗。在某些实施方案中,所述患者的非致命性心血管事件的风险降低了约15%。
在另一方面,本发明提供了一种用于降低高心血管风险患者的初始非致命性CV事件后的继发非致命性心血管(CV)事件或死亡的风险的方法,所述方法包括:
(a)选择有需要的高心血管风险患者,其中所述患者曾经历初始非致命性CV事件;以及
(b)向所述患者给予前蛋白转化酶枯草杆菌蛋白酶/kexin 9型(PCSK9)抑制剂,从而降低所述患者的继发非致命性CV事件的风险。
在一个实施方案中,所述PCSK9抑制剂是PCSK9抗体或其抗原结合片段。在某些实施方案中,所述非致命性CV事件包括心肌梗塞、中风、需要住院治疗的不稳定型心绞痛、需要住院治疗的心力衰竭或缺血驱动的冠状动脉血运重建术。在某些实施方案中,所述患者曾经历一例、两例、三例、四例或超过四例非致命性心血管事件。在一个实施方案中,所述初始非致命性CV事件是第一非致命性CV事件,并且所述继发非致命性CV事件是第二非致命性CV事件。在另一个实施方案中,所述初始非致命性CV事件是第二非致命性CV事件,并且所述继发非致命性CV事件是第三非致命性CV事件。在另一个实施方案中,所述初始非致命性CV事件是第三非致命性CV事件,并且所述继发非致命性CV事件是第四非致命性CV事件。在另一个实施方案中,所述初始非致命性CV事件是第四非致命性CV事件,并且所述继发非致命性CV事件是第五非致命性CV事件。在某些实施方案中,所述患者曾经历超过四例非致命性CV事件。
在另一方面,本发明提供了一种用于减少高心血管风险患者的非致命性心血管(CV)事件的总数的方法,所述方法包括:
(a)选择有需要的高心血管风险患者;以及
(b)向所述患者给予前蛋白转化酶枯草杆菌蛋白酶/kexin 9型(PCSK9)抑制剂,从而减少所述患者的非致命性CV事件的总数。
在一个实施方案中,所述PCSK9抑制剂是PCSK9抗体或其抗原结合片段。在某些实施方案中,所述非致命性心血管事件包括非致命性心肌梗塞、非致命性中风或非致命性不稳定型心绞痛。在某些实施方案中,所述患者的非致命性心血管事件的风险降低,从而导致所述患者的非心血管死亡的风险降低。在某些实施方案中,所述患者的非心血管死亡的风险降低了约19%。
在另一方面,本发明提供了一种用于降低高心血管风险患者的死亡、非致命性心肌梗塞或非致命性缺血性中风的风险的方法,所述方法包括:
(a)选择有需要的高心血管风险患者;以及
(b)向所述患者给予前蛋白转化酶枯草杆菌蛋白酶/kexin 9型(PCSK9)抑制剂,从而降低所述患者的死亡、非致命性心肌梗塞或非致命性缺血性中风的风险。
在一个实施方案中,所述PCSK9抑制剂是PCSK9抗体或其抗原结合片段。在某些实施方案中,所述患者的LDL-C水平大于或等于70mg/dL,尽管用最大耐受他汀疗法进行治疗。在某些实施方案中,所述患者的死亡、非致命性心肌梗塞或非致命性缺血性中风的风险降低了约14%。在其他实施方案中,所述患者的LDL-C水平大于或等于100mg/dL,尽管用最大耐受他汀疗法进行治疗。在某些其他实施方案中,所述患者的死亡、非致命性心肌梗塞或非致命性缺血性中风的风险降低了约23%。在某些实施方案中,所述方法增加了所述患者到首次发生死亡、非致命性心肌梗塞或非致命性缺血性中风的时间。在某些实施方案中,所述死亡是CV死亡。在其他实施方案中,所述死亡是非CV死亡。
在另一方面,本发明提供了一种用于降低高心血管风险患者的缺血性中风的风险的方法,所述方法包括:
(a)选择有需要的高心血管风险患者;以及
(b)向所述患者给予PCSK9抑制剂,从而降低所述患者的缺血性中风的风险。
在一个实施方案中,所述PCSK9抑制剂是PCSK9抗体或其抗原结合片段。在某些实施方案中,所述患者的LDL-C水平大于或等于70mg/dL,尽管用最大耐受他汀疗法进行治疗。在某些实施方案中,所述患者的缺血性中风的风险降低了约27%。在其他实施方案中,所述患者的LDL-C水平大于或等于100mg/dL,尽管用最大耐受他汀疗法进行治疗。在某些其他实施方案中,所述患者的缺血性中风的风险降低了约40%。在某些实施方案中,所述方法增加了所述患者到首次发生缺血性中风的时间。
在另一方面,本发明提供了一种用于降低高心血管风险患者的需要住院治疗的不稳定型心绞痛的风险的方法,所述方法包括:
(a)选择有需要的高心血管风险患者;以及
(b)向所述患者给予PCSK9抑制剂,从而降低所述患者的需要住院治疗的不稳定型心绞痛的风险。
在一个实施方案中,所述PCSK9抑制剂是PCSK9抗体或其抗原结合片段。在某些实施方案中,所述患者的LDL-C水平大于或等于70mg/dL,尽管用最大耐受他汀疗法进行治疗。在某些实施方案中,所述患者的需要住院治疗的不稳定型心绞痛的风险降低了约39%。在其他实施方案中,所述患者的LDL-C水平大于或等于100mg/dL,尽管用最大耐受他汀疗法进行治疗。在某些其他实施方案中,所述患者的需要住院治疗的不稳定型心绞痛的风险降低了约52%。在某些实施方案中,所述方法增加了所述患者到首次发生需要住院治疗的不稳定型心绞痛的时间。
在另一方面,本发明提供了一种用于降低高心血管风险患者的非致命性心肌梗塞的风险的方法,所述方法包括:
(a)选择有需要的高心血管风险患者;以及
(b)向所述患者给予前蛋白转化酶枯草杆菌蛋白酶/kexin 9型(PCSK9)抑制剂,从而降低所述患者的非致命性心肌梗塞的风险。
在一个实施方案中,所述PCSK9抑制剂是PCSK9抗体或其抗原结合片段。在某些实施方案中,所述患者的LDL-C水平大于或等于70mg/dL,尽管用最大耐受他汀疗法进行治疗。在某些实施方案中,所述患者的非致命性心肌梗塞的风险降低了约14%。
在一个实施方案中,所述心肌梗塞是1型心肌梗塞。在某些实施方案中,所述患者的1型心肌梗塞的风险降低了约13%。在另一个实施方案中,所述心肌梗塞是2型心肌梗塞。在某些实施方案中,所述患者的2型心肌梗塞的风险降低了约23%。在某些实施方案中,所述方法增加了所述患者到首次发生非致命性心肌梗塞的时间。
在另一方面,本发明提供了一种用于降低高心血管风险患者的进行缺血驱动的冠状动脉血运重建术的风险的方法,所述方法包括:
(a)选择有需要的高心血管风险患者;以及
(b)向所述患者给予前蛋白转化酶枯草杆菌蛋白酶/kexin 9型(PCSK9)抑制剂,从而降低所述患者的进行缺血驱动的冠状动脉血运重建术的风险。
在一个实施方案中,所述PCSK9抑制剂是PCSK9抗体或其抗原结合片段。在某些实施方案中,所述患者的LDL-C水平大于或等于70mg/dL,尽管用最大耐受他汀疗法进行治疗。在某些实施方案中,所述患者的进行缺血驱动的冠状动脉血运重建术的风险降低了约12%。在某些实施方案中,所述方法增加了高心血管风险患者的缺血驱动的冠状动脉血运重建术的发生率。在某些实施方案中,所述方法增加了所述患者到首次发生缺血驱动的冠状动脉血运重建术的时间。
在另一方面,本发明提供了一种用于降低具有非常高的未来动脉粥样硬化性心血管疾病(ASCVD)事件的风险的患者的冠心病(CHD)死亡、非致命性心肌梗塞、需要住院治疗的不稳定型心绞痛或缺血性中风的风险的方法,所述方法包括:
(a)选择有需要的具有非常高的未来ASCVD事件的风险的患者;以及
(b)向所述患者给予前蛋白转化酶枯草杆菌蛋白酶/kexin 9型(PCSK9)抑制剂,从而降低所述患者的CHD死亡、非致命性心肌梗塞、需要住院治疗的不稳定型心绞痛或缺血性中风的风险。
在一个实施方案中,所述PCSK9抑制剂是PCSK9抗体或其抗原结合片段。在某些实施方案中,通过具有多例重大ASCVD事件或一例重大ASCVD事件和多个高风险状况的历史来选择所述风险非常高的患者。在某些实施方案中,高风险状况包括杂合子家族性高胆固醇血症、既往冠状动脉搭桥手术或经皮冠状动脉介入治疗史、糖尿病、高血压、CKD(eGFR 15-59mL/min/1.73m
在另一方面,本发明提供了一种降低高心血管风险患者的心血管风险的方法,所述方法包括:
(a)选择有需要的高心血管风险患者;以及
(b)向所述患者给予前蛋白转化酶枯草杆菌蛋白酶/kexin 9型(PCSK9)抑制剂,其中所述患者的Lp(a)水平降低,从而降低所述患者的心血管风险。
在一个实施方案中,所述PCSK9抑制剂是PCSK9抗体或其抗原结合片段。在某些实施方案中,所述Lp(a)水平是通过自动乳胶增强浊度测定法来测量。
在任何一个前述方面的某些实施方案中,所述患者已确诊心血管疾病。在某些实施方案中,所述患者患有临床动脉粥样硬化性心血管疾病(ASCVD)。在某些实施方案中,所述患者曾具有急性冠状动脉综合征(ACS)事件。在某些实施方案中,所述患者在过去12个月内曾具有ACS事件。在某些实施方案中,所述ACS事件定义如下:(1)在归因于假定或得到证明的阻塞性冠状动脉疾病的计划外住院的72小时内在休息或极少用力时发生心肌缺血的不稳定症状;以及(2)以下至少之一:(i)与急性心肌梗塞一致的升高的心脏生物标志物;和(ii)与缺血或梗塞一致的静息ECG变化连同来自局部灌注成像或室壁运动异常的阻塞性冠状动脉疾病的另外证据、通过血管造影术得到的心外膜冠状动脉狭窄≥70%或对与所述事件相关的冠状动脉血运重建的需要。
在任何一个前述方面的某些实施方案中,向所述患者给予所述PCSK9抑制剂持续至少一年。在其他实施方案中,向所述患者给予所述PCSK9抑制剂持续至少三年。
在某些实施方案中,将所述PCSK9抑制剂与所述最大耐受他汀疗法组合给予所述患者。在某些实施方案中,所述最大耐受他汀疗法包括日剂量为约40mg至约80mg的阿托伐他汀。在某些实施方案中,所述最大耐受他汀疗法包括日剂量为约20mg至约40mg的罗苏伐他汀。在某些实施方案中,所述最大耐受他汀疗法是低剂量或中等剂量的阿托伐他汀或罗苏伐他汀。在某些实施方案中,所述最大耐受他汀疗法包括阿托伐他汀或罗苏伐他汀以外的他汀。在某些实施方案中,所述患者已经用所述最大耐受他汀疗法治疗至少两周。
在某些实施方案中,所述PCSK9抑制剂是特异性结合PCSK9的抗体或其抗原结合片段。在某些实施方案中,所述抗体或其抗原结合片段包含重链可变区(HCVR)和轻链可变区(LCVR)的互补决定区(CDR),所述重链可变区(HCVR)和所述轻链可变区(LCVR)分别包含SEQID NO:1和6所示的氨基酸序列。在某些实施方案中,所述抗体或其抗原结合片段包含具有SEQ ID NO:2、3、4、7、8和10的重链和轻链CDR氨基酸序列。在某些实施方案中,所述抗体或其抗原结合片段包含具有SEQ ID NO:1的氨基酸序列的HCVR和具有SEQ ID NO:6的氨基酸序列的LCVR。在某些实施方案中,所述抗体或其抗原结合片段与包含具有SEQ ID NO:2、3、4、7、8和10的重链和轻链CDR氨基酸序列的抗体结合PCSK9上的相同表位。在某些实施方案中,所述抗体或其抗原结合片段与包含具有SEQ ID NO:2、3、4、7、8和10的重链和轻链CDR氨基酸序列的抗体竞争结合PCSK9。在某些实施方案中,所述抗体或其抗原结合片段包含重链可变区(HCVR)和轻链可变区(LCVR)的互补决定区(CDR),所述重链可变区(HCVR)和所述轻链可变区(LCVR)分别包含SEQ ID NO:85和89所示的氨基酸序列。在某些实施方案中,所述抗体或其抗原结合片段包含具有SEQ ID NO:86、87、88、90、91和92的重链和轻链CDR氨基酸序列。在某些实施方案中,所述抗体或其抗原结合片段包含具有与SEQ ID NO:85所示的氨基酸序列至少90%、95%或99%相同的氨基酸序列的HCVR和具有与SEQ ID NO:89所示的氨基酸序列至少90%、95%或99%相同的氨基酸序列的LCVR。
在本文公开的方法的某些实施方案中,给予PCSK9抗体或其抗原结合片段的步骤(步骤(b))包括:
(i)约每两周向所述患者给予一个或多个初始剂量的75mg的所述抗体或其抗原结合片段;以及
(ii)如果步骤(i)后所述患者的LDL-C水平低于阈值水平,则约每两周向所述患者给予一个或多个随后剂量的75mg的所述抗体或其抗原结合片段,或者如果步骤(i)后所述患者的LDL-C水平大于或等于阈值水平,则约每两周向所述患者给予一个或多个随后剂量的150mg的所述抗体或其抗原结合片段。
在某些实施方案中,所述阈值水平为50mg/dL。在某些实施方案中,前述方法的步骤(b)包括约每两周向所述患者给予一个或多个剂量的150mg的所述抗体或其抗原结合片段。在其他实施方案中,前述方法的步骤(b)包括约每两周或约每四周向所述患者给予一个或多个剂量的300mg的所述抗体或其抗原结合片段。
在某些实施方案中,约每两周向所述患者给予所述抗体或其抗原结合片段持续至少一年或超过一年。
在另一方面,本发明提供了一种用于降低冠心病(CHD)死亡、非致命性心肌梗塞、需要住院治疗的不稳定型心绞痛或缺血性中风的风险的方法,所述方法包括:
(a)选择有需要的高心血管风险患者,其中所述患者当前没有接受他汀疗法;以及
(b)向所述有需要的患者给予前蛋白转化酶枯草杆菌蛋白酶/kexin 9型(PCSK9)抑制剂,从而降低所述患者的CHD死亡、非致命性心肌梗塞、需要住院治疗的不稳定型心绞痛或缺血性中风的风险。
在某些实施方案中,所述患者对他汀不耐受或有他汀疗法的不良反应史。在某些实施方案中,所述患者的冠心病(CHD)死亡、非致命性心肌梗塞、需要住院治疗的不稳定型心绞痛或缺血性中风的风险降低了约35%。
通过阅读随后的具体实施方式,本发明的其他实施方案将变得清楚。
附图说明
图1A-图1G以图形方式描绘了接受治疗群体的标志物水平。图1A描绘了接受安慰剂或阿利珠单抗(alirocumab)的患者在48个月内接受治疗群体的LDL-C值的图。图1B-图1G描绘了显示接受安慰剂或阿利珠单抗的患者的非HDL胆固醇(图1B)、ApoB(图1C)、甘油三酯(图1D)、HDL胆固醇(图1E)、脂蛋白(a)(图1F)和总胆固醇(图1G)水平的图。用虚线显示的意向治疗(ITT)水平包括所有值,包括在过早治疗中止、盲法阿利珠单抗剂量滴定或从阿利珠单抗到安慰剂的盲法转换后测量的那些。用实线显示的接受治疗水平排除了在过早治疗中止或从阿利珠单抗到安慰剂的盲法转换后获得的值(但是包括在盲法阿利珠单抗向下滴定后获得的值)。
图2描绘了用阿利珠单抗或安慰剂治疗的患者中主要功效终点MACE的图。阿利珠单抗将MACE风险降低了15%(HR=0.85,0.78至0.93,p<0.001)。插图在放大的y轴上显示相同的数据。使用按地理区域分层的对数秩检验计算P值。
图3描绘了用阿利珠单抗和安慰剂治疗的患者中全因死亡的图(包括危险比)。插图在放大的y轴上显示相同的数据。使用按地理区域分层的对数秩检验计算P值。
图4描绘了用于分析各预先指定的子组的结果,包括危险比,包括来自不同子组之间相互作用检验的P值。在涉及主要结果(首次发生冠心病死亡、非致命性心肌梗塞、缺血性中风或不稳定型心绞痛住院治疗)的子组的患者中进行预先指定的Cox比例危险回归分析。Apo,载脂蛋白;CI,置信区间;HR,危险比;hs-CRP,高敏C反应蛋白;NSTEMI,非ST段抬高心肌梗塞;LDL-C,低密度脂蛋白胆固醇;STEMI,ST段抬高心肌梗塞。
图5A-图5C描绘了按基线LDL-C水平分层的三个不同子组(<80mg/dL(图5A)、80-100mg/dL(图5B)和≥100mg/dL(图5C))的用阿利珠单抗和安慰剂治疗的患者中MACE的一组图(包括危险比)。
图6A-图6B描绘了按基线LDL-C水平分层的两个不同子组(<100mg/dL(图6A)和≥100mg/dL(图6B))的用阿利珠单抗和安慰剂治疗的患者中MACE的一组图(包括危险比)。
图7A-图7C显示了在根据基线LDL胆固醇水平<80mg/分升(图7A)、80至<100mg/分升(图7B)或≥100mg/分升(图7C)的子组中检查的LDL-C水平。
图8A-图8C是按基线LDL-C水平分层的三个不同子组(<80mg/dL(图8A)、80-100mg/dL(图8B)和≥100mg/dL(图8C))的用阿利珠单抗和安慰剂治疗的患者中全因死亡的一组图(包括危险比)。相对风险降低(RRR)相互作用p=0.12;绝对风险降低(ARR)相互作用p=0.005。
图9是显示基线Lp(a)水平分布的直方图。从mg/dL到nmol/L的近似转换可以计算为Lp(a)mg/dL*0.357。
图10是显示由安慰剂组的基线Lp(a)四分位数显示的MACE、非致命性心肌梗塞、缺血性中风、CHD死亡、CV死亡和全因死亡的发生率的图。
图11是显示基于自然三次和3节点的3次样条曲线(分段三次曲线)的图,位于总体第25百分位数(6.7mg/dL)、中位数(21.2mg/dL)和第75百分位数(59.6mg/dL)处。样条效应的P值基于计分检验。在总体基线中位数(21.2mg/dL)处,危险比设定为1.00。样条效应P<0.0001。
图12是描绘了与安慰剂相比在阿利珠单抗的情况下相对和绝对风险降低的森林图。显示了按基线Lp(a)四分位数分层的阿利珠单抗和安慰剂组以及总群体的MACE发生率。
图13是描绘了按基线Lp(a)和基线LDL-C分层的MACE绝对风险降低的图。基线LDL-C未针对Lp(a)校正。
图14描绘了在基线、第4个月和第12个月的阿利珠单抗和安慰剂组中Lp(a)的分布(中位数和四分位距),按Lp(a)的基线四分位数分层。
图15A-图15B描绘了在阿利珠单抗治疗组(图15A)和安慰剂组(图15B)中LDL-胆固醇、校正LDL-胆固醇和Lp(a)自基线到第4个月的绝对变化的中位数和四分位距,按Lp(a)四分位数分层。
图16A-图16B描绘了基线脂蛋白(a)对比脂蛋白(a)的绝对变化(图16A)和基线脂蛋白(a)对比LDL-C
图17A-图17B描绘了跨2至150mg/dl的基线Lp(a)分布显示的第4个月时Lp(a)绝对变化与MACE风险之间的关系。图17A显示了针对LDL-C
图18A是显示在研究过程中接受安慰剂或阿利珠单抗的患者中Lp(a)水平的第一四分位数(“1Q”)、中位数和第三四分位数(“3Q”)的图。图18B是显示在研究过程中接受安慰剂或阿利珠单抗的患者中Lp(a)水平的绝对变化的第一四分位数(“1Q”)、中位数和第三四分位数(“3Q”)的图。
图19A-图19C显示了关于以下的连续意向治疗第4个月LDL-C的全因死亡样条分析:所有患者(图19A;*HR是相对于第4个月中位LDL-C(1.68mmol/L[65mg/dL]),按区域分层。次数=3,3个节点位于第4个月LDL-C四分位数(0.80、1.68和2.38mmol/L[31、65和92mg/dL])处,模型的p值=0.0070。);安慰剂治疗的患者(图19B;HR是相对于第4个月中位LDL-C(2.25mmol/L[87mg/dL]),按区域分层。次数=3,3个节点位于第4个月LDL-C四分位数(1.86、2.25和2.64mmol/L[72、87和102mg/dL])处,模型的p值=0.0007。);以及阿利珠单抗治疗的患者(图19C;HR是相对于第4个月中位LDL-C(0.80mmol/L[31mg/dL]),按区域分层。次数=3,3个节点位于第4个月LDL-C四分位数(0.52、0.80和1.27mmol/L[20、31和49mg/dL])处,模型的p值=0.0083。LDL-C=低密度脂蛋白胆固醇;HR=危险比)。
图20A-图20D是总群体(图20A和图20C)和有资格进行≥三年随访的患者(图20B和图20D)中MACE(图20A和图20B)和全因死亡(图20C和图20D)的一组图(包括危险比)。
图21A-图21B以图形方式描绘了死亡数据。图21A是显示用阿利珠单抗或安慰剂治疗的患者的总群体中全因死亡、心血管(CV)死亡和非心血管(非CV)死亡的图。图21B显示了有资格进行≥3年随访的患者的死亡减少。
图22描绘了非致命性心血管(CV)事件的平均累积函数和Kaplan-Meier曲线。平均累积函数曲线描绘了在随机化后给定时间安慰剂和阿利珠单抗组中给定患者的非致命性心血管事件的预期总数。
图23A-图23B显示了不同患者组中非致命性CV事件的平均累积函数和Kaplan-Maier曲线。图23A展示了基线LDL-C≥100mg/dL的患者(n=5,629)中的非致命性CV事件。图23B展示了基线LDL-C<100mg/dL的患者(n=13,295)中的非致命性CV事件。
图24描绘了依据治疗组的第一、继发以及总CV事件和死亡。
图25描绘了根据基线LDL-C子组的联合脆弱模型。
图26描绘了显示随机化(意向治疗分析)后16周在血糖量正常、前驱糖尿病和糖尿病患者中的脂质水平的图。在每个条下方呈现了自基线的中位百分比变化。
图27描绘了显示在血糖量正常、前驱糖尿病和糖尿病患者中心血管事件发生率的图,其中位数(Q1、Q3)随访期为2.8(2.3、3.4)年。*具有糖尿病的人中的危险对比具有血糖量正常或前驱糖尿病的人中的危险的比较P<0.0001。
图28是显示依据基线糖代谢状况的随机化后A1c、空腹血糖和新发糖尿病的一系列图,对于A1c和空腹血糖使用重复测量混合效应模型。在分析中仅包括在开始糖尿病药物治疗之前的随机化后的值。*无糖尿病=前驱糖尿病或血糖量正常。
图29A和图29B显示了在用阿利珠单抗(ALI;粗线)或安慰剂(PBO)治疗后,在血管床1(冠状动脉疾病且无PAD或CeVD)、血管床2(冠状动脉疾病和PAD或CeVD)或血管床3(冠状动脉疾病和PAD与CeVD)中患有动脉疾病的患者中主要MACE终点(图29A)和全因死亡(图29B)的Kaplan-Meier曲线。ARR指示绝对风险降低。
图30描绘了患有单血管疾病(冠状动脉疾病而无已知的PAD或CeVD)、两个血管床中的多血管疾病(冠状动脉疾病和PAD或CeVD)以及三个血管床中的多血管疾病(冠状动脉疾病和PAD与CeVD两者)的患者中MACE和全因死亡的危险比以及对应的绝对风险降低(ARR)。
图31描绘了根据既往冠状动脉旁路移植术(CABG)状况的MACE发生的Kaplan-Meier曲线。曲线代表具有如下情况的患者:(1)无既往CABG(“无”);(2)索引(index)ACS后但随机化前进行CABG(“索引”);以及(3)索引ACS之前进行CABG(“既往”)。
图32描绘了根据既往冠状动脉旁路移植术(CABG)状况在患者中MACE(主要终点)和全因死亡的危险比以及对应的绝对风险降低(ARR)。
图33描绘了1型或2型心肌梗塞(MI)的发生以及阿利珠单抗对比安慰剂随时间的效果的Kaplan-Meier曲线。
图34描绘了随访期间1型或2型心肌梗塞(MI)的森林图,作为全因死亡的预测因子。模型中包括的预后因素:年龄组(<65岁、65岁至<75岁或≥75岁),地理区域,糖尿病史,COPD史,索引事件前MI史,PAD史,高血压史,GFR组(<60对比≥60mL/min/1.73m2,LDL-C组(<100对比≥100mg/dL)。
图35描绘了对1型或2型心肌梗塞(MI)之前和之后的全因死亡和特因死亡的治疗效果的危险比。
具体实施方式
在描述本发明方法之前,应理解本发明不限于所述的特定方法和实验条件,因为此类方法和条件可以变化。还应理解的是,因为本发明方法的范围将仅由所附权利要求限制,所以本文所用的术语仅是出于描述具体实施方案的目的,并不旨在是限制性的。本文提及的所有出版物均通过引用以其整体特此并入。
定义
除非另外定义,否则本文所用的所有技术术语和科学术语具有与本领域普通技术人员通常所理解的相同的含义。如本文所用,当用于提及具体列举的数值时,术语“约”意指所述值可以与所列举值相差不超过1%。例如,如本文所用,表述“约100”包括99和101以及之间的所有值(例如,99.1、99.2、99.3、99.4等)。
如本文所用,“高心血管风险患者”是指具有高胆固醇血症和/或升高水平的至少一种致动脉粥样硬化脂蛋白的患者。在某些实施方案中,高心血管风险患者具有未被脂质修饰疗法(LMT,包括例如最大耐受他汀疗法)充分控制的高胆固醇血症和/或升高水平的至少一种致动脉粥样硬化脂蛋白。在某些实施方案中,高心血管风险患者是患有临床动脉粥样硬化性心血管疾病(ASCVD)的患者。临床ASCVD患者涵盖ACS患者,有心肌梗塞、稳定型或不稳定型心绞痛或冠状动脉或其他动脉血运重建、中风、短暂性脑缺血发作(TIA)或外周动脉疾病(包括主动脉瘤)史的那些患者,均为动脉粥样硬化起源。
如本文所用,“急性冠状动脉综合征事件”或“ACS事件”是指在归因于假定或得到证明的阻塞性冠状动脉疾病的计划外住院的72小时内在休息或极少用力时发生心肌缺血的不稳定症状。在某些实施方案中,ACS事件需要满足以下标准中的至少一个:与急性心肌梗塞一致的升高的心脏生物标志物,或与缺血或梗塞一致的静息ECG变化连同来自局部灌注成像或室壁运动异常的阻塞性冠状动脉疾病的另外证据、通过血管造影术得到的心外膜冠状动脉狭窄≧70%或对与所述事件相关的冠状动脉血运重建的需要。
如本文所用,“重大不良心血管事件”或“MACE”是指以下中的一种或多种:冠心病死亡(CHD死亡)、非致命性心肌梗塞、需要住院治疗的不稳定型心绞痛以及致命性或非致命性缺血性中风。
如本文所用,“死亡(mortality)”、“全因死亡(all-cause mortality和all-causedeath)”可互换使用,是指由任何原因引起的死亡。
如本文所用,“冠心病事件”或“CHD事件”是指冠心病死亡、非致命性心肌梗塞、需要住院治疗的不稳定型心绞痛或缺血驱动的冠状动脉血运重建术。术语“重大冠心病事件”是指来自冠心病或非致命性心肌梗塞的死亡。
术语“缺血驱动的冠状动脉血运重建”是指经皮冠状动脉介入治疗(PCI)或冠状动脉旁路移植术(CABG)。对于本文公开的临床研究,仅针对先前PCI部位处的再狭窄进行的冠状动脉血运重建术被排除在此定义之外。在某些实施方案中,缺血驱动的冠状动脉血运重建必须由以下之一驱动:a)急性缺血,b)新的或进行性症状(心绞痛或等效的),或3)新的或进行性的功能测试异常(例如,压力测试或成像)。
如本文所用,“冠心病死亡”、“CHD死亡”和“归因于冠心病的死亡”可互换使用,是指心血管死亡的子集,其与潜在的冠心病有明显关系,包括继发于急性心肌梗塞(MI)、猝死、心力衰竭、针对症状进行的冠状动脉血运重建术的并发症、冠状动脉疾病进展或新的心肌缺血的死亡(其中死因明显与手术有关)、未观察到的和未预料到的死亡以及其他不能明确归因于非血管原因的死亡。
如本文所用,术语“心血管事件”或“CV事件”是指任何非致命性冠心病事件、任何心血管死亡和任何非致命性缺血性中风。示例性CV事件包括但不限于心肌梗塞、中风、需要住院治疗的不稳定型心绞痛、需要住院治疗的心力衰竭和缺血驱动的冠状动脉血运重建术。
如本文所用,术语“心血管死亡(cardiovascular death)”、“CV死亡”和“心血管死亡(cardiovascular mortality)”可互换使用,是指由急性心肌梗塞导致的死亡、心脏性猝死、归因于心力衰竭的死亡、归因于中风的死亡以及归因于其他心血管原因的死亡。在某些实施方案中,CV死亡是CHD死亡。在其他实施方案中,CV死亡选自心力衰竭或心源性休克、中风、缺血性心血管病因或除缺血之外的心血管病因。
如本文所用,术语“非致命性心血管事件”是指任何不会导致死亡的CV事件。在某些实施方案中,非致命性CV事件可以在时间上连续发生,其中初始(例如,第一)CV事件之后是继发(例如,第二、第三或第四)事件。
如本文所用,“非心血管死亡”和“非CV死亡”可互换使用,是指任何不被认为是心血管死亡的死亡。非心血管死亡的例子包括但不限于肺部感染、肺部恶性肿瘤、胃肠/肝胆/胰腺感染、胃肠/肝胆/胰腺恶性肿瘤、出血、非中风/出血的神经过程、自杀、非心血管手术或外科手术、意外或创伤、肾脏感染、肾脏恶性肿瘤、其他非心血管感染和其他非心血管恶性肿瘤。
如本文所用,“非致命性心肌梗塞”是根据心肌梗塞ACC/AHA/ESC通用定义进行定义和细分(参见Thygesen等人,2012.Third universal d efinition of myocardialinfarction.Journal of the American College of Card iology.60(16):1581-98,将其通过引用以其整体并入本文)。对于本文公开的临床研究,无症状心肌梗塞不被认为是主要终点的一部分。
如本文所用,“1型心肌梗塞”是指与动脉粥样硬化斑块破裂、溃疡、裂隙、糜烂或夹层相关的事件相关的自发性心肌梗塞,其导致一个或多个冠状动脉中的腔内血栓,导致心肌血流减少或远端血小板栓塞,接着发生肌细胞坏死(参见Thygesen等人,2012.JACC 60(16):1581-98)。在一些实施方案中,1型心肌梗塞被定义为检测到心肌肌钙蛋白(cTn)的上升和/或下降,伴随至少一个值超过第99百分位数参考上限(URL)并且伴随以下至少之一:急性心肌缺血的症状、新的缺血性ECG变化、病理性Q波的发展、与缺血病因学一致的模式的存活心肌新损失或新节段性室壁运动异常的成像证据或通过包括冠状动脉内成像的血管造影术或通过尸检鉴定为冠状动脉血栓。
如本文所用,“2型心肌梗塞”是指具有坏死的心肌损伤的情况,其中除冠状动脉疾病之外的病症导致心肌氧供应和/或需求之间的不平衡(参见Thygesen等人,2012.JACC 60(16):1581-98)。在一些实施方案中,2型心肌梗塞被定义为检测到cTn的上升和/或下降,伴随至少一个值超过第99百分位数URL以及与冠状动脉血栓形成无关的心肌氧供应与需求之间的不平衡的证据,需要以下至少之一:急性心肌缺血的症状、新的缺血性ECG变化、病理性Q波的发展或与缺血病因学一致的模式的存活心肌新损失或新节段性室壁运动异常的成像证据。
如本文所用,“3型心肌梗塞”是指遭受心脏死亡的患者,其症状暗示心肌缺血伴随假定的新缺血性心电图(ECG)变化或新的左束支传导阻滞-但是没有可用的生物标志物值(参见Thygesen等人,2012.JACC60(16):1581-98)。
如本文所用,“4a型心肌梗塞”是指与经皮冠状动脉介入治疗相关的心肌梗塞。如本文所用,“4b型心肌梗塞”是指与支架内血栓形成相关的心肌梗塞(参见Thygesen等人,2012.JACC 60(16):1581-98)。
如本文所用,“5型心肌梗塞”是指与冠状动脉旁路移植术(CABG)相关的心肌梗塞(参见Thygesen等人,2012.JACC 60(16):1581-98)。
如本文所用,“冠状动脉旁路移植术(CABG)”是指其中将自体动脉或静脉用作移植物以绕过被动脉粥样硬化斑块部分或完全阻塞的冠状动脉的手术(参见Alexander&Smith,2016,Coronary-Artery Bypass Grafting.NEJM 374:1954-64,将其通过引用以其整体并入本文)。
如本文所用,术语“需要住院治疗的不稳定型心绞痛”和“不稳定型心绞痛住院治疗”可互换使用,是指:因在先前48小时内与日俱增的心肌缺血症状和/或静息胸部不适≧20min而入院或急诊入院,此外还需要以下两者:a)新的或假定的新的缺血性ECG变化,由以下定义:2个连续导联的ST下降>0.5mm;2个连续导联的T波倒置>1mm,有明显的R波或R/S>1;男性V2或V3中>2个连续导联的ST段抬高>0.2mV,女性V2或V3中>0.15mV,或其他导联>0.1mV;或LBBB;以及b)因需要冠状动脉血运重建术或至少一次心外膜狭窄≧70%而得到的冠状动脉阻塞的明确现下证据。对于本文公开的临床试验,排除仅归因于先前PCI部位处的再狭窄的冠状动脉血运重建术或狭窄。
如本文所用,“缺血性中风”是指:1)由梗塞引起的局灶性脑、脊髓或视网膜功能障碍的急性发作,由以下至少之一定义:a)确定的血管分布中急性局灶性脑、脊髓或视网膜缺血性损伤的病理学、成像或其他客观证据;或b)持续24小时或直至死亡的急性脑、脊髓或视网膜缺血性损伤的症状,排除其他病因学;2)出血性梗塞,但是不是由脑内或蛛网膜下出血引起的中风;或3)没有另外细分的中风。
如本文所用,“糖尿病(diabetes和diabetic)”是指一组代谢疾病,其中人具有高血糖水平,是因为身体不会产生足够的胰岛素,或是因为细胞对产生的胰岛素没有反应。最常见的糖尿病类型是:(1)1型糖尿病,其中身体不能产生胰岛素;(2)2型糖尿病,其中身体不能适当使用胰岛素,与胰岛素缺乏随时间增加组合;以及(3)妊娠期糖尿病,其中女性因怀孕而发展糖尿病。在某些实施方案中,糖尿病被定义为1型或2型糖尿病的病史、血红蛋白A1c水平≥6.5%、空腹血清或血浆葡萄糖(FPG)的两个值≥126mg/dL或糖尿病药物治疗的使用。在某些实施方案中,根据美国糖尿病协会推荐的标准诊断糖尿病(参见Standards ofMedical Care in Diabetes-2012.Diabetes Care.2012年1月;35增刊1:S11-63,将其通过引用以其整体并入本文)。在一个具体实施方案中,在具有高血糖症或高血糖危象的典型症状的患者中糖尿病被诊断为FPG大于或等于126mg/dL;75克口服葡萄糖耐量测试(OGTT)中的两小时值大于或等于200mg/dL;血红蛋白A1c水平大于或等于6.5%;或随机血浆葡萄糖水平大于或等于200mg/dL。如本文所用,“前驱糖尿病”是指基线时A1c≥5.7%且<6.5%,或两个FPG值>100mg/dL,但是不超过一个≥126mg/dL。如本文所用,“血糖量正常”是指这些列出的糖尿病或前驱糖尿病参数中的任一个均不存在。如本文所用,“新发糖尿病”是指以下任一项:A1c的至少两个值≥6.5%、至少两次FPG测量≥126mg/dL、研究者报告的糖尿病相关不良事件或开始糖尿病药物治疗。
如本文所用,“外周动脉疾病”或“PAD”涵盖主要由改变主动脉、其内脏动脉分支和下肢动脉的正常结构和功能的动脉粥样硬化和血栓栓塞病理生理过程引起的血管疾病。PAD是指表示主动脉及其分支动脉(排除冠状动脉)的狭窄、闭塞和动脉瘤疾病(参见Hirsch等人,2006,ACC/AHA2005practice guidelines for the management of patients withperipheral artery disease,Circulation.113:1475-1547,将其通过引用以其整体并入本文)。
如本文所用,“脑血管疾病”或“CeVD”是指如下所有障碍的历史,其中脑区暂时或永久地受到缺血或出血的影响,并且一个或多个脑血管参与病理学过程。CeVD包括但不限于中风、颈动脉狭窄、椎管狭窄和颅内狭窄、动脉瘤和血管畸形(参见Advisory Councilfor the National Institute of Neurological and Communicative Disorders andStroke,1975,A Classification and Outline of Cerebrovascular Diseases II,Stroke.6:564-616.,将其通过引用以其整体并入本文)。
如本文所用,“多血管疾病”、“PoVD”或“PVD”是指在多个动脉领域或具有动脉粥样硬化受累的两个或更多个血管领域(床)中预先存在的疾病(Bhatt等人,2009.Eur.HeartJ.30:1195-1202,将其通过引用以其整体并入本文)。在某些实施方案中,多血管疾病患者患有冠状动脉疾病,并发外周动脉疾病(PAD)、脑血管疾病(CeVD)或两者。
如本文所用,“高强度他汀疗法”和“高剂量阿托伐他汀/罗苏伐他汀”可互换使用,是指每日给予40-80mg阿托伐他汀或每日给予20-40mg罗苏伐他汀。
如本文所用,“最大耐受他汀疗法”或“最大耐受剂量的他汀疗法”可互换使用,意指包括给予每日剂量的他汀的治疗方案(可向特定患者给予最高剂量的他汀而不会在患者中造成不可接受的不良副作用)。最大耐受他汀疗法包括但不限于高强度他汀疗法。
如本文所用,如果患者具有经历在接受每日他汀疗法方案开始或增加并且在他汀疗法中止时停止的一种或多种不良反应史,则所述患者被视为“他汀不耐受”或“对他汀不耐受”。在某些实施方案中,不良反应本质上是肌肉骨骼的,如骨骼肌疼痛、酸痛、虚弱或痉挛(例如,肌痛、肌病、横纹肌溶解等)。此类不良反应通常在运动或用力后加剧。他汀相关的不良反应还包括与他汀给予相关的肝脏、胃肠道和精神症状。根据某些实施方案,如果例如以下任一项适用于患者,则所述患者被认为是“他汀不耐受”或“对他汀不耐受”:(1)具有与至少两种不同和单独的每日他汀疗法方案相关的骨骼肌相关症状史;(2)对最低批准日剂量的一种或多种他汀展现出一种或多种他汀相关的不良反应;(3)不能耐受作为最低批准片剂大小的七倍的累积每周他汀剂量;(4)能够耐受低剂量他汀疗法但是在剂量增加时发展症状(例如,达到目标LDL-C水平);或(5)患者禁用他汀。
如本文所用,关于高胆固醇血症,“未充分控制”意指在接受包含稳定的每日剂量的他汀的治疗方案至少4周后,患者的血清低密度脂蛋白胆固醇(LDL-C)浓度、总胆固醇浓度和/或甘油三酯浓度未降低至公认的医学上可接受的水平(考虑到患者的相对冠心病风险)。例如,患有未被他汀充分控制的高胆固醇血症的患者包括如下一名或多名患者,在所述患者已经接受稳定的每日他汀方案至少4周后,其血清LDL-C浓度大于或等于约70mg/dL、80mg/dL、90mg/dL、100mg/dL、110mg/dL、120mg/dL、130mg/dL、140mg/dL或更高(取决于患者的潜在心脏病风险)。
如本文所用,关于致动脉粥样硬化脂蛋白,表述“未充分控制”意指在接受包含稳定的每日剂量的他汀的治疗方案至少4周后,患者的血清低密度脂蛋白胆固醇(LDL-C)浓度、非高密度脂蛋白胆固醇和/或载脂蛋白B浓度未降低至公认的医学上可接受的水平(考虑到患者的相对冠心病风险)。例如,具有未被他汀充分控制的升高水平的致动脉粥样硬化脂蛋白的患者包括如下一名或多名患者,在所述患者已经接受稳定的每日他汀方案至少4周后,其血清LDL-C浓度大于或等于约70mg/dL、80mg/dL、90mg/dL、100mg/dL、110mg/dL、120mg/dL、130mg/dL、140mg/dL或更高(取决于患者的潜在心脏病风险);非高密度脂蛋白胆固醇浓度大于或等于约100mg/dL;或者载脂蛋白B浓度大于或等于约80mg/dL。
未被最大耐受剂量他汀疗法充分控制的高胆固醇血症和其他致动脉粥样硬化脂蛋白
本发明总体上涉及用于治疗如下高心血管风险患者的方法和组合物,所述高心血管风险患者患有未被他汀充分控制的高胆固醇血症,即未被包含每日最大耐受剂量的他汀的治疗方案充分控制的高胆固醇血症。
根据某些实施方案,尽管服用稳定的每日剂量的他汀(伴随或不伴随其他脂质修饰疗法)至少4周、5周、6周或更长时间,可通过本发明的方法治疗的高心血管风险患者仍患有高胆固醇血症(例如,血清LDL-C浓度大于或等于70mg/dL)。在某些实施方案中,高心血管风险患者的高胆固醇血症未被最大耐受剂量他汀疗法充分控制。
本发明总体上还涉及用于治疗如下高心血管风险患者的方法和组合物,所述高心血管风险患者具有未被他汀充分控制的升高水平的致动脉粥样硬化脂蛋白,即未被包含每日最大耐受剂量的他汀的治疗方案充分控制的升高水平的致动脉粥样硬化脂蛋白。
根据某些实施方案,尽管服用稳定的每日剂量的他汀(伴随或不伴随其他脂质修饰疗法)至少4周、5周、6周或更长时间,可通过本发明的方法治疗的高心血管风险患者仍具有升高水平的致动脉粥样硬化脂蛋白(例如,血清LDL-C浓度大于或等于70mg/dL)。在某些实施方案中,高心血管风险患者的升高水平的致动脉粥样硬化脂蛋白未被最大耐受剂量的他汀疗法充分控制。
本发明还包括用于治疗具有未被最大耐受剂量的他汀疗法充分控制的高胆固醇血症和升高水平的致动脉粥样硬化脂蛋白的高心血管风险患者的方法。最大耐受剂量的他汀疗法包括每日给予他汀,如西立伐他汀、匹伐他汀、氟伐他汀、洛伐他汀和普伐他汀。
患者选择
本发明包括可用于治疗具有未被每日最大耐受他汀疗法充分控制的高胆固醇血症和升高水平的致动脉粥样硬化脂蛋白的高心血管风险患者的方法和组合物。
在本发明的某些实施方案中,抗体或其抗原结合片段作为饮食的辅助剂给予。
在一些实施方案中,给予抗体或其抗原结合片段以减少患有近期急性冠状动脉综合征(ACS)的患者的心血管事件(例如,ACS事件的过去1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17或18个月内的ACS事件)。在一些实施方案中,给予抗体或其抗原结合片段以降低患有近期ACS的患者的心血管风险。在某些实施方案中,ACS事件是心肌梗塞。在某些实施方案中,ACS事件是不稳定型心绞痛。
在一些实施方案中,将抗体或其抗原结合片段与他汀组合使用,或作为单一疗法使用,包括在他汀不耐受的患者中。
可通过本发明的方法治疗的高心血管风险患者包括住院治疗ACS的那些患者。
在某些实施方案中,可以基于尽管用阿托伐他汀40-80mg每日、罗苏伐他汀20-40mg每日或最大耐受剂量的这些药剂之一进行稳定状态(至少2周)的治疗仍展现未充分控制致动脉粥样硬化脂蛋白来选择高心血管风险患者。在一些实施方案中,患者的LDL-C水平大于或等于70、80、90、100、110、120、130或140mg/dL,尽管用高强度或最大耐受他汀疗法进行治疗。在一些实施方案中,患者的非HDL-C水平大于或等于100mg/dL,尽管用高强度或最大耐受他汀疗法进行治疗。在一些实施方案中,患者的载脂蛋白B水平大于或等于80mg/dL,尽管用高强度或最大耐受他汀疗法进行治疗。在一些实施方案中,如通过自动乳胶增强浊度测定法所测量的,患者的Lp(a)水平大于或等于15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50、55或60mg/dL,尽管用高强度或最大耐受他汀疗法进行治疗。在一个实施方案中,如通过自动乳胶增强浊度测定法所测量的,患者的Lp(a)水平大于或等于21.2mg/dL,尽管用高强度或最大耐受他汀疗法进行治疗。
根据某些实施方案,可以基于具有选自以下的附加风险因子来选择高心血管风险患者:年龄(例如,年龄大于40岁、45岁、50岁、55岁、60岁、65岁、70岁、75岁或80岁)、人种、国籍、性别(男性或女性)、运动习惯(例如,常规锻炼者、非锻炼者)、其他先前存在的医疗状况(例如,糖尿病、高血压等)以及当前的药物治疗状况(例如,当前服用β阻滞剂、尼克酸、依泽替米贝、贝特类、ω-3脂肪酸、胆汁酸树脂等)。在某些实施方案中,如下选择高心血管风险患者:基于先前存在的糖尿病(例如,I型糖尿病或II型糖尿病),单独或与基于近期ACS和/或未充分控制致动脉粥样硬化脂蛋白的前述选择标准组合。
在某些实施方案中,高心血管风险患者患有临床动脉粥样硬化性心血管疾病(ASCVD)。临床ASCVD涵盖ACS,有MI、稳定型或不稳定型心绞痛或冠状动脉或其他动脉血运重建、中风、TIA或PAD(包括主动脉瘤)史的那些,均为动脉粥样硬化起源。
根据本发明,可以基于一种或多种前述选择标准或治疗特征的组合来选择高心血管风险患者。还可以基于临床指南(包括例如美国心脏协会(AHA)和美国心脏病学会(ACC)临床实践指南(Clinical Practice Gu idelines))来选择高心血管风险或非常高心血管风险患者。参见例如,Stone等人2013 ACC/AHA Guideline on the Treatment of BloodCholesterol to Reduce Atherosclerotic Cardiovascular Risk in Adults:A Reportof the A merican College of Cardiology/American Heart Association Task Forceon Practice Guidelines.Circulation(2014)129:S1-45;Grundy SM等人2018 A HA/ACC/AACVPR/AAPA/ABC/ACPM/ADA/AGS/APhA/ASPC/NLA/PCNA Guideline on the Managementof Blood Cholesterol,Journal of the Americ an College of Cardiology(2018)(印刷中-2018年11月10日可在线获得),将其中的每个通过引用以其整体并入本文。
给予PCSK9抑制剂作为最大耐受剂量他汀疗法的附加疗法
提供了治疗方法,包括用PCSK9抑制剂(如特异性结合PCKS9的抗体或其抗原结合片段)治疗高心血管风险患者的方法,其中所述患者具有未被在不存在PCSK9抑制剂的情况下最大耐受剂量或高强度剂量的他汀疗法充分控制的高胆固醇血症和/或升高水平的其他致动脉粥样硬化脂蛋白。在一些实施方案中,PCSK9抑制剂可以作为患者预先存在的脂质修饰治疗(LMT)的附加给予(如果适用),如患者预先存在的每日治疗性他汀方案的附加。
例如,所述方法包括附加治疗方案,其中PCSK9抑制剂作为在接受PCSK9抑制剂之前患者所接受的相同的稳定每日治疗性他汀方案(即,相同给药量的他汀)的附加疗法给予。在其他实施方案中,PCSK9抑制剂作为治疗性他汀方案的附加疗法给予,其包含的他汀的量大于或小于在接受PCSK9抑制剂之前患者所接受的他汀的剂量。例如,在开始包含以特定给药频率和量给予的PCSK9抑制剂的治疗方案后,给予患者或开给患者的他汀的日剂量可以与患者在开始PCSK9抑制剂治疗方案之前服用的每日他汀剂量相比(a)保持相同,(b)增加,或(c)减少(例如,向上滴定或向下滴定),取决于患者的治疗需要。
治疗功效
本发明的方法导致选自LDL-C、ApoB100、非HDL-C、总胆固醇、VLDL-C、甘油三酯、Lp(a)和残粒胆固醇的一种或多种脂质组分的血清水平降低。例如,根据本发明的某些实施方案,向具有未被稳定的每日最大耐受剂量的他汀疗法充分控制的高胆固醇血症或升高水平的其他致动脉粥样硬化脂蛋白的高心血管风险患者给予包含PCSK9抑制剂的药物组合物(例如,在高心血管风险患者的最大耐受剂量的他汀疗法之上给予PCSK9抑制剂)将导致血清低密度脂蛋白胆固醇(LDL-C)自基线的平均百分比降低为至少约25%、约30%、约40%、约50%、约60%或更高;ApoB100自基线的平均百分比降低为至少约25%、约30%、约40%、约50%、约60%或更高;非HDL-C自基线的平均百分比降低为至少约25%、约30%、约40%、约50%、约60%或更高;总胆固醇自基线的平均百分比降低为至少约10%、约15%、约20%、约25%、约30%、约35%或更高;VLDL-C自基线的平均百分比降低为至少约5%、约10%、约15%、约20%、约25%、约30%或更高;甘油三酯自基线的平均百分比降低为至少约5%、约10%、约15%、约20%、约25%、约30%、约35%或更高;和/或Lp(a)自基线的平均百分比降低为至少约5%、约10%、约15%、约20%、约25%或更高(例如,如通过自动乳胶增强浊度测定法所测量的)。
在某些实施方案中,本发明的方法还降低心血管风险。在某些实施方案中,本发明的方法用于降低心血管风险。示例类型的心血管风险包括但不限于:冠心病(CHD)死亡、非致命性心肌梗塞、缺血性中风(致命性或非致命性)或需要住院治疗的不稳定型心绞痛的风险或发生率;任何CHD事件的风险;重大CHD事件的风险;任何心血管事件的风险;死亡(即全因死亡)、非致命性心肌梗塞或非致命性缺血性中风的风险;CHD死亡的风险;心血管死亡的风险;死亡(即,全因死亡)的风险;非致命性心肌梗塞的风险;致命性或非致命性缺血性中风的风险;需要住院治疗的不稳定型心绞痛的风险;缺血驱动的冠状动脉血运重建术的风险;需要住院治疗的充血性心力衰竭的风险;非致命性心血管事件的风险以及非致命性心肌梗塞、中风或不稳定型心绞痛的风险。
在一方面,本公开文本提供了PCSK9抑制剂,其用于降低高心血管风险患者的死亡风险。在某些实施方案中,基于对这种疗法的需要来选择患者。在某些实施方案中,根据本文公开的方法向高心血管风险患者给予PCSK9抑制剂降低了患者的死亡风险。在某些实施方案中,患者的死亡风险降低了约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约65%、约70%、约75%或约80%。在一个实施方案中,患者的LDL-C水平大于或等于70mg/dL,尽管用最大耐受他汀疗法进行治疗,并且患者的死亡风险降低了约15%。在另一个实施方案中,患者的LDL-C水平大于或等于100mg/dL,尽管用最大耐受他汀疗法进行治疗,并且风险降低了约29%。在某些实施方案中,患者的存活时间增加了例如约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约65%、约70%、约75%或约80%。
在某些实施方案中,根据本文公开的方法向患有另外的疾病的高心血管风险患者给予PCSK9抑制剂降低了患者的死亡风险。在一些实施方案中,患者患有外周动脉疾病(PAD),并且PAD患者的患者死亡风险降低了约29%。在某些实施方案中,PAD患者的绝对死亡风险降低了约2.8%。在其他实施方案中,高心血管风险患者患有脑血管疾病(CeVD)。在某些实施方案中,CeVD患者的死亡风险降低了约42%。在某些实施方案中,CeVD患者的绝对死亡风险降低了约4.9%。在某些实施方案中,被给予所公开的PCSK9抑制剂的患有PAD和CeVD两者的患者的死亡风险降低了约80%。在某些实施方案中,患有PAD和CeVD两者的患者的绝对风险降低了约16.2%。在一些实施方案中,患者曾进行既往冠状动脉旁路移植术(CABG)。在某些实施方案中,高心血管风险患者在CABG之前曾具有初始急性冠状动脉综合征(ACS)事件。在某些实施方案中,在CABG之前具有初始ACS事件的患者的死亡风险降低了约15%。在某些实施方案中,在CABG之前具有初始ACS事件的患者的绝对死亡风险降低了约0.5%。在某些实施方案中,高心血管风险患者在CABG之后曾具有ACS事件。在某些实施方案中,在CABG之后具有ACS事件的患者的死亡风险降低了约33%。在某些实施方案中,在CABG之后具有ACS事件的患者的绝对死亡风险降低了约3.6%。
在另一方面,本公开文本提供了PCSK9抑制剂,其用于降低高心血管风险患者的重大不良心血管事件(MACE)的风险。在某些实施方案中,基于对这种疗法的需要来选择患者。在某些实施方案中,根据本文公开的方法向高心血管风险患者给予PCSK9抑制剂降低了患者的MACE风险。在某些实施方案中,缺血性中风包括致命性缺血性中风和非致命性缺血性中风。在某些实施方案中,MACE的风险降低了约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约65%、约70%、约75%或约80%。在一个实施方案中,患者的LDL-C水平大于或等于70mg/dL,尽管用最大耐受剂量的他汀疗法进行治疗,并且MACE的风险降低了约15%。在另一个实施方案中,患者的LDL-C水平大于或等于100mg/dL,尽管用最大耐受剂量的他汀疗法进行治疗,并且MACE的风险降低了约24%。在另一个实施方案中,患者当前没有接受他汀疗法,并且MACE的风险降低了约35%。在另一个实施方案中,患者患有糖尿病,并且MACE的风险降低了约16%和/或绝对风险降低了约2.3%。在一个实施方案中,如通过自动乳胶增强浊度测定法所测量的,患者的Lp(a)水平大于或等于21.2mg/dL,尽管用高强度或最大耐受剂量的他汀疗法进行治疗。在某些实施方案中,患者到首次发生CHD死亡、非致命性心肌梗塞、需要住院治疗的不稳定型心绞痛或缺血性中风的时间增加了例如约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约65%、约70%、约75%或约80%。
在某些实施方案中,根据本文公开的方法向患有另外的疾病的高心血管风险患者给予PCSK9抑制剂降低了患者的MACE风险。在一些实施方案中,患者患有外周动脉疾病(PAD),并且PAD患者的MACE风险降低了约17%。在某些实施方案中,PAD患者的MACE绝对风险降低了约3.4%。在一些实施方案中,患者患有脑血管疾病(CeVD),并且CeVD患者的MACE风险降低了约19%。在某些实施方案中,CeVD患者的MACE绝对风险降低了约4.5%。在某些实施方案中,患有PAD和CeVD两者的患者的MACE风险降低了约46%。在某些实施方案中,患有PAD和CeVD两者的患者的MACE绝对风险降低了约13%。在一些实施方案中,患者曾进行既往冠状动脉旁路移植术(CABG)。在某些实施方案中,高心血管风险患者在CABG之前曾具有初始急性冠状动脉综合征(ACS)事件。在某些实施方案中,在CABG之前具有初始ACS事件的患者的MACE风险降低了约15%。在某些实施方案中,在CABG之前具有初始ACS事件的患者的MACE绝对风险降低了约0.9%。在某些实施方案中,高心血管风险患者在CABG之后曾具有ACS事件。在某些实施方案中,在CABG之后具有ACS事件的患者的MACE风险降低了约23%。在某些实施方案中,在CABG之后具有ACS事件的患者的MACE绝对风险降低了约6.4%。
在另一方面,本公开文本提供了PCSK9抑制剂,其用于降低高心血管风险患者的缺血性中风(致命性或非致命性)的风险。在某些实施方案中,基于对这种疗法的需要来选择患者。在某些实施方案中,根据本文公开的方法向高心血管风险患者给予PCSK9抑制剂降低了患者的缺血性中风(致命性或非致命性)的风险。在某些实施方案中,风险降低了约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约65%、约70%、约75%或约80%。在一个实施方案中,患者的LDL-C水平大于或等于70mg/dL,尽管用最大耐受剂量的他汀疗法进行治疗,并且风险降低了约27%。在另一个实施方案中,患者的LDL-C水平大于或等于100mg/dL,尽管用最大耐受剂量的他汀疗法进行治疗,并且风险降低了约40%。在某些实施方案中,患者到首次发生缺血性中风的时间增加了例如约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约65%、约70%、约75%或约80%。在某些实施方案中,缺血性中风是致命性的。在某些实施方案中,缺血性中风是非致命性的。
在另一方面,本公开文本提供了PCSK9抑制剂,其用于降低高心血管风险患者的需要住院治疗的不稳定型心绞痛的风险。在某些实施方案中,基于对这种疗法的需要来选择患者。在某些实施方案中,根据本文公开的方法向高心血管风险患者给予PCSK9抑制剂降低了患者的需要住院治疗的不稳定型心绞痛的风险。在某些实施方案中,风险降低了约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约65%、约70%、约75%或约80%。在一个实施方案中,患者的LDL-C水平大于或等于70mg/dL,尽管用最大耐受剂量的他汀疗法进行治疗,并且风险降低了约39%。在另一个实施方案中,患者的LDL-C水平大于或等于100mg/dL,尽管用最大耐受剂量的他汀疗法进行治疗,并且风险降低了约52%。在某些实施方案中,患者到首次发生需要住院治疗的不稳定型心绞痛的时间增加了例如约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约65%、约70%、约75%或约80%。
在另一方面,本公开文本提供了PCSK9抑制剂,其用于降低高心血管风险患者的CHD死亡的风险。在某些实施方案中,基于对这种疗法的需要来选择患者。在某些实施方案中,根据本文公开的方法向高心血管风险患者给予PCSK9抑制剂降低了患者的CHD死亡的风险。在某些实施方案中,风险降低了约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约65%、约70%、约75%或约80%。在另一个实施方案中,患者的LDL-C水平大于或等于100mg/dL,尽管用最大耐受剂量的他汀疗法进行治疗,并且风险降低了约28%。在某些实施方案中,患者到首次发生CHD死亡的时间增加了例如约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约65%、约70%、约75%或约80%。
在另一方面,本公开文本提供了PCSK9抑制剂,其用于降低高心血管风险患者的心血管死亡的风险。在某些实施方案中,基于对这种疗法的需要来选择患者。在某些实施方案中,根据本文公开的方法向高心血管风险患者给予PCSK9抑制剂降低了患者的心血管死亡的风险。如本文所用,“心血管死亡(cardiovascular death)”、“CV死亡”和“心血管死亡(cardiovascular mortality)”可互换使用。在某些实施方案中,风险降低了约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约65%、约70%、约75%或约80%。在另一个实施方案中,患者的LDL-C水平大于或等于100mg/dL,尽管用最大耐受他汀疗法进行治疗,并且风险降低了约31%。在某些实施方案中,患者到首次发生心血管死亡的时间增加了例如约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约65%、约70%、约75%或约80%。
在另一方面,本公开文本提供了PCSK9抑制剂,其用于降低高心血管风险患者的CHD事件的风险。在某些实施方案中,基于对这种疗法的需要来选择患者。在某些实施方案中,根据本文公开的方法向高心血管风险患者给予PCSK9抑制剂降低了患者的CHD事件的风险。在某些实施方案中,CHD事件被定义为CHD死亡、非致命性心肌梗塞、需要住院治疗的不稳定型心绞痛或缺血驱动的冠状动脉血运重建术。在某些实施方案中,风险降低了约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约65%、约70%、约75%或约80%。在一个实施方案中,患者的LDL-C水平大于或等于70mg/dL,尽管用最大耐受他汀疗法进行治疗,并且风险降低了约12%。在某些实施方案中,患者到首次发生CHD事件的时间增加了例如约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约65%、约70%、约75%或约80%。
在另一方面,本公开文本提供了PCSK9抑制剂,其用于降低高心血管风险患者的重大CHD事件的风险。在某些实施方案中,基于对这种疗法的需要来选择患者。在某些实施方案中,根据本文公开的方法向高心血管风险患者给予PCSK9抑制剂降低了患者的重大CHD事件的风险。在某些实施方案中,重大CHD事件被定义为CHD死亡和非致命性心肌梗塞。在某些实施方案中,风险降低了约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约65%、约70%、约75%或约80%。在一个实施方案中,患者的LDL-C水平大于或等于70mg/dL,尽管用最大耐受他汀疗法进行治疗,并且风险降低了约12%。在某些实施方案中,患者到首次发生重大CHD事件的时间增加了例如约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约65%、约70%、约75%或约80%。
在另一方面,本公开文本提供了PCSK9抑制剂,其用于降低高心血管风险患者的心血管事件的风险。在某些实施方案中,基于对这种疗法的需要来选择患者。在某些实施方案中,根据本文公开的方法向高心血管风险患者给予PCSK9抑制剂降低了患者的心血管事件的风险。在某些实施方案中,心血管事件被定义为非致命性CHD事件、心血管死亡和非致命性缺血性中风。在某些实施方案中,心血管事件被定义为非致命性心肌梗塞、需要住院治疗的不稳定型心绞痛、缺血驱动的冠状动脉血运重建术、心血管死亡和非致命性缺血性中风。在某些实施方案中,风险降低了约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约65%、约70%、约75%或约80%。在一个实施方案中,患者的LDL-C水平大于或等于70mg/dL,尽管用最大耐受他汀疗法进行治疗,并且风险降低了约13%。在某些实施方案中,患者到首次发生心血管事件的时间增加了例如约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约65%、约70%、约75%或约80%。
在另一方面,本公开文本提供了PCSK9抑制剂,其用于降低高心血管风险患者的死亡、非致命性心肌梗塞或非致命性缺血性中风的风险。在某些实施方案中,基于对这种疗法的需要来选择患者。在某些实施方案中,根据本文公开的方法向高心血管风险患者给予PCSK9抑制剂降低了患者的死亡、非致命性心肌梗塞或非致命性缺血性中风的风险。在某些实施方案中,风险降低了约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约65%、约70%、约75%或约80%。在一个实施方案中,患者的LDL-C水平大于或等于70mg/dL,尽管用最大耐受他汀疗法进行治疗,并且风险降低了约14%。在某些实施方案中,患者到首次发生全因死亡、非致命性心肌梗塞或非致命性缺血性中风的时间增加了例如约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约65%、约70%、约75%或约80%。
在另一方面,本公开文本提供了PCSK9抑制剂,其用于降低高心血管风险患者的非致命性心肌梗塞的风险。在某些实施方案中,基于对这种疗法的需要来选择患者。在某些实施方案中,根据本文公开的方法向高心血管风险患者给予PCSK9抑制剂降低了患者的非致命性心肌梗塞的风险。在某些实施方案中,风险降低了约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约65%、约70%、约75%或约80%。在一个实施方案中,患者的LDL-C水平大于或等于70mg/dL,尽管用最大耐受他汀疗法进行治疗,并且风险降低了约14%。在另一个实施方案中,患者的LDL-C水平大于或等于100mg/dL,尽管用最大耐受他汀疗法进行治疗,并且风险降低了约21%。在某些实施方案中,如通过自动乳胶增强浊度测定法所测量的,患者的Lp(a)水平大于或等于15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50、55或60mg/dL,尽管用高强度或最大耐受他汀疗法进行治疗。在一个实施方案中,如通过自动乳胶增强浊度测定法所测量的,患者的Lp(a)水平大于或等于21.2mg/dL,尽管用高强度或最大耐受他汀疗法进行治疗。在某些实施方案中,患者到首次发生非致命性心肌梗塞的时间增加了例如约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约65%、约70%、约75%或约80%。
在另一方面,本公开文本提供了PCSK9抑制剂,其用于降低高心血管风险患者的缺血驱动的冠状动脉血运重建术的发生率。在某些实施方案中,基于对这种疗法的需要来选择患者。在某些实施方案中,根据本文公开的方法向高心血管风险患者给予PCSK9抑制剂降低了患者的缺血驱动的冠状动脉血运重建术的发生率。在某些实施方案中,风险降低了约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约65%、约70%、约75%或约80%。在一个实施方案中,患者的LDL-C水平大于或等于70mg/dL,尽管用最大耐受他汀疗法进行治疗,并且风险降低了约12%。在某些实施方案中,患者到首次发生缺血驱动的冠状动脉血运重建术的时间增加了例如约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约65%、约70%、约75%或约80%。
在另一方面,本公开文本提供了PCSK9抑制剂,其用于降低高心血管风险患者的需要住院治疗的充血性心力衰竭的风险。在某些实施方案中,基于对这种疗法的需要来选择患者。在某些实施方案中,根据本文公开的方法向高心血管风险患者给予PCSK9抑制剂降低了患者的需要住院治疗的充血性心力衰竭风险。在某些实施方案中,风险降低了约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约65%、约70%、约75%或约80%。在某些实施方案中,患者到首次发生需要住院治疗的充血性心力衰竭的时间增加了例如约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约65%、约70%、约75%或约80%。
在另一方面,本公开文本提供了PCSK9抑制剂,其用于降低高心血管风险患者的非致命性心血管事件的风险。在某些实施方案中,基于对这种疗法的需要来选择患者。在某些实施方案中,根据本文公开的方法向高心血管风险患者给予PCSK9抑制剂降低了患者的非致命性心血管事件的风险。在某些实施方案中,风险降低了约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约65%、约70%、约75%或约80%。在某些实施方案中,患者的总非致命性心血管事件的发生率降低了例如约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约65%、约70%、约75%或约80%。
在另一方面,本公开文本提供了PCSK9抑制剂,其用于降低高心血管风险患者的非致命性心肌梗塞、中风或不稳定型心绞痛的风险。在某些实施方案中,基于对这种疗法的需要来选择患者。在某些实施方案中,根据本文公开的方法向高心血管风险患者给予PCSK9抑制剂降低了患者的非致命性心肌梗塞、中风或不稳定型心绞痛的风险。在某些实施方案中,风险降低了约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约65%、约70%、约75%或约80%。在某些实施方案中,患者的总非致命性心肌梗塞、中风或不稳定型心绞痛的发生率降低了例如约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约65%、约70%、约75%或约80%。
在另一方面,本公开文本提供了PCSK9抑制剂,其用于降低高心血管风险患者的1型或2型心肌梗塞的风险。在某些实施方案中,基于对这种疗法的需要来选择患者。在某些实施方案中,根据本文公开的方法向高心血管风险患者给予PCSK9抑制剂降低了患者的1型或2型心肌梗塞的风险。在某些实施方案中,1型心肌梗塞的风险降低了例如约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约65%、约70%、约75%或约80%。在某些实施方案中,1型心肌梗塞的风险降低了约13%。在某些实施方案中,2型心肌梗塞的风险降低了例如约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约65%、约70%、约75%或约80%。在某些实施方案中,2型心肌梗塞的风险降低了约23%。在某些实施方案中,患者的LDL-C水平大于或等于70mg/dL,尽管用最大耐受他汀疗法进行治疗。在某些实施方案中,患者的LDL-C水平大于或等于100mg/dL,尽管用最大耐受他汀疗法进行治疗。
PCSK9抑制剂
所述方法包括向患者给予包含PCSK9抑制剂的治疗组合物。如本文所用,“PCSK9抑制剂”是与人PCSK9结合或相互作用并且在体外或在体内抑制PCSK9的正常生物学功能的任何药剂。PCSK9抑制剂类别的非限制性例子包括小分子PCSK9拮抗剂、基于核酸的PCSK9表达或活性抑制剂(例如,siRNA或反义)、与PCSK9特异性相互作用的基于肽的分子(例如,肽体)、与PCSK9特异性相互作用的受体分子、包含LDL受体的配体结合部分的蛋白质、PCSK9结合支架分子(例如,DARPin、HEAT重复蛋白、ARM重复蛋白、三角形四肽(tetratricopeptide)重复蛋白、基于纤连蛋白的支架构建体和其他基于天然存在的重复蛋白的支架等)(参见例如,Boersma和Pluckthun,2011,Curr.Opin.Biotechnol.22:849-857,以及其中引用的参考文献,将其中的每个通过引用以其整体并入本文)以及抗PCSK9适配体或其部分。根据某些实施方案,可以在本发明方法的上下文中使用的PCSK9抑制剂是抗PCSK9抗体或特异性结合人PCSK9的抗体的抗原结合片段。
如本文所用,术语“人前蛋白转化酶枯草杆菌蛋白酶/kexin 9型”或“人PCSK9”或“hPCSK9”是指具有SEQ ID NO:197所示核酸序列和SEQ ID NO:198的氨基酸序列的PCSK9或其生物活性片段。
如本文所用,术语“抗体”旨在指代包含通过二硫键相互连接的四条多肽链(即两条重(H)链和两条轻(L)链)的免疫球蛋白分子以及其多聚体(例如,IgM)。每条重链包含重链可变区(本文缩写为HCVR或V
如本文所用,术语“抗体”还包括完整抗体分子的抗原结合片段。如本文所用,术语抗体的“抗原结合部分”、抗体的“抗原结合片段”等包括任何天然存在的、可酶促获得的、合成的或基因工程化的多肽或糖蛋白,其特异性结合抗原以形成复合物。抗体的抗原结合片段可以使用任何合适的标准技术(如蛋白水解消化或涉及操纵和表达编码抗体可变结构域和任选地恒定结构域的DNA的重组基因工程技术)例如从完整抗体分子衍生。这种DNA是已知的和/或容易从例如商业来源、DNA文库(包括例如噬菌体-抗体文库)获得,或者可以合成。DNA可以按化学方式或通过使用分子生物学技术进行测序和操纵,例如以将一个或多个可变结构域和/或恒定结构域排列成合适的构型,或者引入密码子,产生半胱氨酸残基,修饰、添加或缺失氨基酸等。
抗原结合片段的非限制性例子包括:(i)Fab片段;(ii)F(ab')2片段;(iii)Fd片段;(iv)Fv片段;(v)单链Fv(scFv)分子;(vi)dAb片段;以及(vii)由模拟抗体高变区(例如,分离的互补决定区(CDR),如CDR3肽)或受限FR3-CDR3-FR4肽的氨基酸残基组成的最小识别单位。其他工程化分子如结构域特异性抗体、单结构域抗体、结构域缺失抗体、嵌合抗体、CDR嫁接抗体、双抗体、三抗体、四抗体、微抗体、纳米抗体(例如单价纳米抗体、二价纳米抗体等)、小的模块化免疫药物(SMIP)和鲨鱼可变IgNAR结构域也涵盖在如本文所用的表述“抗原结合片段”内。
抗体的抗原结合片段将典型地包含至少一个可变结构域。可变结构域可以具有任何大小或氨基酸组成,并且将通常包含至少一个与一个或多个框架序列相邻或同在框内的CDR。在具有与V
在某些实施方案中,抗体的抗原结合片段可以含有与至少一个恒定结构域共价连接的至少一个可变结构域。可以在抗体的抗原结合片段内发现的可变结构域和恒定结构域的非限制性示例性构型包括:(i)V
与完整抗体分子一样,抗原结合片段可以是单特异性的或多特异性的(例如,双特异性的)。抗体的多特异性抗原结合片段将典型地包含至少两个不同的可变结构域,其中每个可变结构域能够特异性结合单独的抗原或同一抗原上的不同表位。使用本领域可获得的常规技术,任何多特异性抗体形式(包括本文公开的示例性双特异性抗体形式)可以适用于本发明方法的抗体的抗原结合片段的上下文中。
抗体的恒定区在抗体固定补体和介导细胞依赖性细胞毒性的能力上是重要的。因此,可以基于对于抗体来说介导细胞毒性是否是理想的来选择抗体的同种型。
如本文所用,术语“人抗体”旨在包括具有衍生自人种系免疫球蛋白序列的可变区和恒定区的抗体。尽管如此,人抗体可以包括不由人种系免疫球蛋白序列编码的氨基酸残基(例如,通过体外随机或位点特异性诱变或通过体内体细胞突变引入的突变),例如在CDR中,并且特别是在CDR3中。然而,如本文所用,术语“人抗体”不旨在包括其中衍生自另一种哺乳动物物种(如小鼠)的种系的CDR序列已经被嫁接到人框架序列上的抗体。
如本文所用,术语“重组人抗体”旨在包括通过重组方式制备、表达、产生或分离的所有人抗体,如使用转染到宿主细胞中的重组表达载体表达的抗体(下文进一步描述),从重组的组合人抗体文库分离的抗体(下文进一步描述),从对于人免疫球蛋白基因为转基因的动物(例如,小鼠)分离的抗体(参见例如,Taylor等人(1992)Nucl.Acids Res.20:6287-6295)或通过涉及将人免疫球蛋白基因序列剪接到其他DNA序列的任何其他方式制备、表达、产生或分离的抗体。此类重组人抗体具有衍生自人种系免疫球蛋白序列的可变区和恒定区。然而,在某些实施方案中,将此类重组人抗体进行体外诱变(或者,当使用对于人Ig序列为转基因的动物时,体内体细胞诱变)并且因此重组抗体的V
人抗体可以以与铰链异质性相关的两种形式存在。在一种形式中,免疫球蛋白分子包含大约150-160kDa的稳定四链构建体,其中二聚体通过链间重链二硫键保持在一起。在第二种形式中,二聚体不通过链间二硫键连接,并且形成约75-80kDa的分子,其由共价偶联的轻链和重链组成(半抗体)。即使在亲和纯化后,这些形式也极难分离。
在各完整IgG同种型中第二种形式出现的频率是归因于但不限于与抗体的铰链区同种型相关的结构差异。人IgG4铰链的铰链区中的单个氨基酸取代可以将第二种形式的出现(Angal等人(1993)Molecular Immunology 30:105)显著降低至典型地使用人IgG1铰链观察到的水平。本发明方法涵盖在铰链、C
如本文所用,“分离的抗体”是指已经从其天然环境的至少一种组分中鉴定和分离和/或回收的抗体。例如,出于本发明方法的目的,已经从生物体的至少一种组分或从其中天然存在或天然产生抗体的组织或细胞中分离或除去的抗体是“分离的抗体”。分离的抗体还包括重组细胞内的原位抗体。分离的抗体是已经经过至少一个纯化或分离步骤的抗体。根据某些实施方案,分离的抗体可以基本上不含其他细胞材料和/或化学物质。
术语“特异性结合”等意指抗体或其抗原结合片段与抗原形成在生理条件下相对稳定的复合物。用于确定抗体是否特异性结合抗原的方法是本领域公知的,并且包括例如平衡透析、表面等离子体共振等。例如,如在本发明方法的上下文中使用的,“特异性结合”PCSK9的抗体包括结合PCSK9的抗体或其部分,其K
与衍生出所述抗体的对应种系序列相比,可用于本发明方法的抗PCSK9抗体可以在重链和轻链可变结构域的框架和/或CDR区中包含一个或多个氨基酸取代、插入和/或缺失。通过将本文公开的氨基酸序列与可从例如公共抗体序列数据库获得的种系序列进行比较,可以容易地确定此类突变。所述方法包括使用衍生自本文公开的任何氨基酸序列的抗体及其抗原结合片段,其中一个或多个框架和/或CDR区内的一个或多个氨基酸突变为衍生出所述抗体的种系序列的一个或多个对应残基,或另一个人种系序列的一个或多个对应残基,或所述一个或多个对应种系残基的保守氨基酸取代(此类序列变化在本文中统称为“种系突变”)。从本文公开的重链和轻链可变区序列开始,本领域普通技术人员可以容易地产生许多抗体和抗原结合片段,其包含一个或多个单独种系突变或其组合。在某些实施方案中,V
所述方法包括使用包含具有一个或多个保守取代的本文公开的任何HCVR、LCVR和/或CDR氨基酸序列的变体的抗PCSK9抗体。例如,本发明方法包括使用具有HCVR、LCVR和/或CDR氨基酸序列的抗PCSK9抗体,其具有例如相对于本文公开的任何HCVR、LCVR和/或CDR氨基酸序列的10个或更少、8个或更少、6个或更少、4个或更少等保守氨基酸取代。
如本文所用,术语“表面等离子体共振”是指一种光学现象,它允许通过例如使用BIAcore
如本文所用,术语“K
术语“表位”是指与抗体分子的可变区中称为互补位的特异性抗原结合位点相互作用的抗原决定簇。单个抗原可以具有超过一个表位。因此,不同的抗体可以结合抗原上的不同区域并且可以具有不同的生物效应。表位可以是构象的或线性的。通过来自线性多肽链的不同区段的空间并列氨基酸产生构象表位。线性表位是由多肽链中的相邻氨基酸残基产生的表位。在某些情况下,表位可以包括抗原上的糖、磷酰基或磺酰基的部分。
根据某些实施方案,所述方法中使用的抗PCSK9抗体是具有pH依赖性结合特征的抗体。如本文所用,表述“pH依赖性结合”意指抗体或其抗原结合片段展现出“与中性pH相比在酸性pH下与PCSK9的结合降低”(出于本公开文本的目的,两种表述可以互换使用)。例如,“具有pH依赖性结合特征的抗体”包括在中性pH下以比在酸性pH下高的亲和力结合PCSK9的抗体及其抗原结合片段。在某些实施方案中,抗体和抗原结合片段在中性pH下以比在酸性pH下高至少3、5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100或更多倍的亲和力结合PCSK9。
根据此方面,具有pH依赖性结合特征的抗PCSK9抗体可以具有相对于亲本抗PCSK9抗体的一个或多个氨基酸变化。例如,具有pH依赖性结合特征的抗PCSK9抗体可以在例如亲本抗PCSK9抗体的一个或多个CDR中含有一个或多个组氨酸取代或插入。因此,根据某些实施方案,提供了包括给予抗PCSK9抗体的方法,所述抗PCSK9抗体包含与亲本抗PCSK9抗体的CDR氨基酸序列相同的CDR氨基酸序列(例如,重链和轻链CDR),除了用组氨酸残基取代亲本抗体的一个或多个CDR的一个或多个氨基酸之外。具有pH依赖性结合的抗PCSK9抗体可以具有例如1、2、3、4、5、6、7、8、9或更多个组氨酸取代,在亲本抗体的单个CDR内或分布遍及亲本抗PCSK9抗体的多个(例如,2、3、4、5或6个)CDR。例如,本发明方法包括使用具有pH依赖性结合的抗PCSK9抗体,其包含亲本抗PCSK9抗体的HCDR1中的一个或多个组氨酸取代、HCDR2中的一个或多个组氨酸取代、HCDR3中的一个或多个组氨酸取代、LCDR1中的一个或多个组氨酸取代、LCDR2中的一个或多个组氨酸取代和/或LCDR3中的一个或多个组氨酸取代。
如本文所用,表述“酸性pH”意指pH为6.0或更小(例如,小于约6.0、小于约5.5、小于约5.0等)。表述“酸性pH”包括约6.0、5.95、5.90、5.85、5.8、5.75、5.7、5.65、5.6、5.55、5.5、5.45、5.4、5.35、5.3、5.25、5.2、5.15、5.1、5.05、5.0或更小的pH值。如本文所用,表述“中性pH”意指pH为约7.0至约7.4。表述“中性pH”包括约7.0、7.05、7.1、7.15、7.2、7.25、7.3、7.35和7.4的pH值。
可以用于本发明方法的上下文中的抗PCSK9抗体的非限制性例子包括例如阿利珠单抗、依伏库单抗(具有以下氨基酸序列特征:包含SEQ ID NO:86的重链互补决定区1(HCDR1);包含SEQ ID NO:87的HCDR2;包含SEQ ID NO:88的HCDR3;包含SEQ ID NO:90的轻链互补决定区1(LCDR1);包含SEQ ID NO:91的LCDR2;和包含SEQ ID NO:92的LCDR3)、博克昔单抗(bococizumab)、洛德昔单抗(lodelcizumab)、拉潘昔单抗(ralpancizumab)、LY3015014或任何前述抗体的抗原结合部分。
人抗体的制备
用于在转基因小鼠中产生人抗体的方法是本领域已知的。可以在本发明方法的上下文中使用任何此类已知方法来制备特异性结合人PCSK9的人抗体。
使用VELOCIMMUNE
通常,用感兴趣的抗原激发
最初,分离具有人可变区和小鼠恒定区的高亲和力嵌合抗体。使用本领域技术人员已知的标准程序表征和选择抗体的理想特征,包括亲和力、选择性、表位等。用所需人恒定区替换小鼠恒定区以产生全人抗体,例如野生型或经修饰的IgG1或IgG4。虽然选择的恒定区可以根据具体用途而变化,但是可变区中存在高亲和力抗原结合和靶特异性特征。通常,当通过与固定在固相上或固定在溶液相中的抗原结合来测量时,可以使用的抗体具有高亲和力,如上所述。
可以在所述方法的上下文中使用的特异性结合PCSK9的人抗体或抗体的抗原结合片段的具体例子包括包含三个含在重链可变区(HCVR)内的重链CDR(HCDR1、HCDR2和HCDR3)的任何抗体或抗原结合片段,所述重链可变区(HCVR)具有选自SEQ ID NO:1和11的氨基酸序列或其具有至少90%、至少95%、至少98%或至少99%序列同一性的基本上相似的序列。可替代地,可以在所述方法的上下文中使用的特异性结合PCSK9的人抗体或抗体的抗原结合片段的具体例子包括包含三个含在重链可变区(HCVR)内的重链CDR(HCDR1、HCDR2和HCDR3)的任何抗体或抗原结合片段,所述重链可变区(HCVR)具有选自SEQ ID NO 37、45、53、61、69、77、85、93、101、109、117、125、133、141、149、157、165、173、181和189的氨基酸序列或其具有至少90%、至少95%、至少98%或至少99%序列同一性的基本上相似的序列。抗体或抗原结合片段可以包含三个含在轻链可变区(LCVR)内的轻链CDR(LCVR1、LCVR2、LCVR3),所述轻链可变区(LCVR)具有选自SEQ ID NO 6和15的氨基酸序列或其具有至少90%、至少95%、至少98%或至少99%序列同一性的基本上相似的序列。可替代地,抗体或抗原结合片段可以包含三个含在轻链可变区(LCVR)内的轻链CDR(LCVR1、LCVR2、LCVR3),所述轻链可变区(LCVR)具有选自SEQ ID NO 41、49、57、65、73、81、89、97、105、113、121、129、137、145、153、161、169、177、185和193的氨基酸序列或其具有至少90%、至少95%、至少98%或至少99%序列同一性的基本上相似的序列。
在参考氨基酸序列(即,用SEQ ID NO鉴定的氨基酸序列)的整个长度上使用最佳序列比对和/或在两个氨基酸序列之间的最佳序列比对区域确定两个氨基酸序列之间的序列同一性,其中最佳序列比对可以用本领域已知的工具(例如,Align)使用标准设置(优选地EMBOSS::needle,Matrix:Blosum62,Gap Open 10.0,Gap Extend 0.5)获得。
在某些实施方案中,抗体或抗原结合蛋白包含来自选自SEQ ID NO:1/6和11/15的重链和轻链可变区氨基酸序列对(HCVR/LCVR)的六个CDR(HCDR1、HCDR2、HCDR3、LCDR1、LCDR2和LCDR3)。可替代地,在某些实施方案中,抗体或抗原结合蛋白包含来自选自SEQ IDNO:37/41、45/49、53/57、61/65、69/73、77/81、85/89、93/97、101/105、109/113、117/121、125/129、133/137、141/145、149/153、157/161、165/169、173/177、181/185和189/193的重链和轻链可变区氨基酸序列对(HCVR/LCVR)的六个CDR(HCDR1、HCDR2、HCDR3、LCDR1、LCDR2和LCDR3)。
在某些实施方案中,可以用于所述方法中的抗PCSK9抗体或抗原结合蛋白具有选自SEQ ID NO:2/3/4/7/8/10(mAb316P[也称为“REGN727”或“阿利珠单抗”])、SEQ ID NO:12/13/14/16/17/18(mAb300N)(参见美国专利申请公开号2010/0166768,将其通过引用以其整体特此并入)和SEQ ID NO:12/13/14/16/17/18(其中SEQ ID NO:16包含氨基酸残基30处的组氨酸取代亮氨酸(L30H))和SEQ ID NO:86/87/88/90/91/92的HCDR1/HCDR2/HCDR3/LCDR1/LCDR2/LCDR3氨基酸序列。
在某些实施方案中,抗体或抗原结合蛋白包含选自SEQ ID NO:1/6和11/15的HCVR/LCVR氨基酸序列对。在某些示例性实施方案中,抗体或抗原结合蛋白包含SEQ ID NO:1的HCVR氨基酸序列和SEQ ID NO:6的LCVR氨基酸序列。在某些示例性实施方案中,抗体或抗原结合蛋白包含SEQ ID NO:11的HCVR氨基酸序列和SEQ ID NO:15的LCVR氨基酸序列。在某些示例性实施方案中,抗体或抗原结合蛋白包含SEQ ID NO:11的HCVR氨基酸序列和SEQID NO:15的LCVR氨基酸序列,SEQ ID NO:15包含氨基酸残基30处的组氨酸取代亮氨酸(L30H)。
药物组合物和给予方法
本发明方法包括向患者给予PCSK9抑制剂,其中PCSK9抑制剂含在药物组合物内。用合适的载体、赋形剂和其他提供合适的转移、递送、耐受等的试剂配制药物组合物。在所有药物化学家都已知的处方集中可以找到许多适当的配方:Remington’s PharmaceuticalSciences,Mack Publishing Company,Easton,PA。这些配方包括例如粉末、糊剂、软膏、凝胶、蜡、油、脂质、含有脂质(阳离子或阴离子)的囊泡(如LIPOFECTIN
可以在本发明方法的上下文中使用的包含抗PCSK9抗体的示例性药物配制品包括US 8,795,669(尤其描述了包含阿利珠单抗的示例性配制品)或如WO 2013/166448或WO2012/168491中列出的任何配制品,将其中的每个通过引用以其整体并入本文。
多种递送系统是已知的并且可以用于给予药物组合物,例如包封在脂质体、微粒、微胶囊中,能够表达突变型病毒的重组细胞,受体介导的内吞作用(参见例如,Wu等人,1987,J.Biol.Chem.262:4429-4432)。给予方法包括但不限于皮内、肌肉内、腹膜内、静脉内、皮下、鼻内、硬膜外和口服途径。组合物可以通过任何方便的途径给予,例如通过输注或团注,通过上皮或粘膜皮肤内层(例如,口腔粘膜、直肠和肠粘膜等)吸收,并且可以与其他生物活性剂一起给予。
药物组合物可以用标准针和注射筒皮下或静脉内递送。另外,就皮下递送而言,笔递送装置可容易地应用于递送药物组合物。这种笔递送装置可以是可重复使用的或一次性的。可重复使用的笔递送装置通常利用含有药物组合物的可更换药筒。一旦给予了药筒内的所有药物组合物并且药筒是空的,就可以容易地丢弃空药筒并用含有药物组合物的新药筒更换。然后可以重复使用笔递送装置。在一次性笔递送装置中,没有可更换药筒。相反,一次性笔递送装置预装有保持在装置内的贮存器中的药物组合物。一旦贮存器清空药物组合物,就丢弃整个装置。
许多可重复使用的笔和自动注射器递送装置可用于皮下递送药物组合物。例子包括但不限于AUTOPEN
在某些情况下,药物组合物可以在控释系统中递送。在一个实施方案中,可以使用泵(参见Langer,同上;Sefton,1987,CRC Crit.Ref.Biomed.Eng.14:201)。在另一个实施方案中,可以使用聚合物材料;参见Medical Applications of Controlled Release,Langer和Wise(编辑),1974,CRC Pres.,Boca Raton,Florida。在又另一个实施方案中,控释系统可以放置在组合物的靶标附近,因此仅需要全身剂量的一小部分(参见例如,Goodson,1984,Medical Applications of Controlled Release,同上,第2卷,第115-138页)。Langer,1990,Science 249:1527-1533的综述中讨论了其他控释系统。
可注射制剂可以包括用于静脉内、皮下、皮内和肌肉内注射、滴注等的剂型。这些可注射制剂可以通过已知方法制备。例如,可以通过例如将上述抗体或其盐溶解、悬浮或乳化在常规用于注射的无菌水性介质或油性介质中来制备可注射制剂。作为注射用水性介质,有例如生理盐水,一种含有葡萄糖和其他助剂等的等渗溶液,其可以与适当的增溶剂如醇(例如,乙醇)、多元醇(例如,丙二醇、聚乙二醇)、非离子表面活性剂[例如,聚山梨醇酯80、HCO-50(氢化蓖麻油的聚氧乙烯(50mol)加合物)]等组合使用。作为油性介质,采用例如芝麻油、大豆油等,其可以与增溶剂(如苯甲酸苄酯、苯甲醇等)组合使用。这样制备的注射剂优选地填充在适当的安瓿中。
有利地,将上述用于口服或肠胃外使用的药物组合物制备成适于配合一定剂量活性成分的单位剂量的剂型。单位剂量的此类剂型包括例如片剂、丸剂、胶囊剂、注射剂(安瓿剂)、栓剂等。
在一些实施方案中,使用一次性预填充笔或一次性预填充注射筒将抗体或其抗原结合片段作为皮下注射剂给予到大腿、腹部或上臂中。注射部位可以每次注射轮流进行。不应当将抗体或其抗原结合片段注射到活动性皮肤病或诸如晒伤、皮疹、炎症或皮肤感染等损伤的区域。
剂量
给予患者的PCSK9抑制剂(例如,抗PCSK9抗体)的量通常是治疗有效量。如本文所用,短语“治疗有效量”意指PCSK9抑制剂的如下剂量,其导致选自以下的一个或多个参数的可检测降低(例如,自基线至少约5%、约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%、约75%或更多):LDL-C、ApoB、ApoB100、非HDL-C、总胆固醇、VLDL-C、甘油三酯、ApoC3、TRL颗粒、Lp(a)和残粒胆固醇。
在抗PCSK9抗体的情况下,治疗有效量可以为约0.05mg至约600mg,例如约0.05mg、约0.1mg、约1.0mg、约1.5mg、约2.0mg、约10mg、约20mg、约30mg、约40mg、约50mg、约60mg、约70mg、约75mg、约80mg、约90mg、约100mg、约110mg、约120mg、约130mg、约140mg、约160mg、约170mg、约180mg、约190mg、约200mg、约210mg、约220mg、约230mg、约240mg、约250mg、约260mg、约270mg、约280mg、约290mg、约300mg、约310mg、约320mg、约330mg、约340mg、约350mg、约360mg、约370mg、约380mg、约390mg、约400mg、约410mg、约420mg、约430mg、约440mg、约450mg、约460mg、约470mg、约480mg、约490mg、约500mg、约510mg、约520mg、约530mg、约540mg、约550mg、约560mg、约570mg、约580mg、约590mg或约600mg的抗PCSK9抗体。根据某些示例性实施方案,抗PCSK9抗体的治疗有效量是30mg、40mg或75mg(例如,在阿利珠单抗的情况下,对于体重小于50kg和/或年龄小于或等于17岁的患者),50mg、75mg或150mg(例如,在阿利珠单抗的情况下,对于体重大于或等于50kg和/或年龄小于或等于17岁的患者),或者140mg或420mg(例如,在依伏库单抗的情况下)。PCSK9抑制剂的其他给药量对于本领域普通技术人员而言将是清楚的。
单独剂量内含有的抗PCSK9抗体的量可以按照每公斤患者体重的抗体毫克数(即,mg/kg)表示。例如,抗PCSK9抗体可以按约0.0001至约10mg/kg体重的剂量给予患者。
给予方案
根据某些实施方案,可以在确定的时间过程(例如,在每日治疗性他汀方案或其他背景LMT之上)向患者给予多个剂量的PCSK9抑制剂(即,包含PCSK9抑制剂的药物组合物)。根据此方面的方法包括向患者依次给予多个剂量的PCSK9抑制剂。如本文所用,“依次给予”意指将每个剂量的PCSK9抑制剂在不同时间点给予患者,例如在以预定间隔(例如,数小时、数天、数周或数月)隔开的不同日期。本发明方法包括向患者依次给予单个初始剂量的PCSK9抑制剂,之后给予一个或多个二级剂量的PCSK9抑制剂,并且任选地之后给予一个或多个三级剂量的PCSK9抑制剂。
术语“初始剂量”、“二级剂量”和“三级剂量”是指给予单独剂量的包含PCSK9抑制剂的药物组合物的时间顺序。因此,“初始剂量”是在治疗方案开始时给予的剂量(也称为“基线剂量”);“二级剂量”是初始剂量后给予的剂量;并且“三级剂量”是在二级剂量后给予的剂量。初始、二级和三级剂量可以全部都含有相同量的PCSK9抑制剂,但是通常在给予频率方面可以彼此不同。然而,在某些实施方案中,初始、二级和/或三级剂量中含有的PCSK9抑制剂的量在治疗过程期间彼此不同(例如,适当时向上或向下调整)。在某些实施方案中,在治疗方案开始时给予两个或更多个(例如,2、3、4或5个)剂量作为“负荷剂量”,之后给予在频率较小的基础上给予的后续剂量(例如,“维持剂量”)。
根据示例性实施方案,在紧接在前剂量后1至26(例如,1、1
根据此方面的方法可以包括向患者给予任何数量的二级和/或三级剂量的PCSK9抑制剂。例如,在某些实施方案中,仅向患者给予单个二级剂量。在其他实施方案中,向患者给予两个或更多个(例如,2、3、4、5、6、7、8或更多个)二级剂量。同样地,在某些实施方案中,仅向患者给予单个三级剂量。在其他实施方案中,向患者给予两个或更多个(例如,2、3、4、5、6、7、8或更多个)三级剂量。
在涉及多个二级剂量的实施方案中,每个二级剂量可以以与其他二级剂量相同的频率给予。例如,可以在紧接在前剂量后1至2、4、6、8或更多周向患者给予每个二级剂量。类似地,在涉及多个三级剂量的实施方案中,每个三级剂量可以以与其他三级剂量相同的频率给予。例如,可以在紧接在前剂量后1至2、4、6、8或更多周向患者给予每个三级剂量。可替代地,给予患者二级和/或三级剂量的频率可以在治疗方案的过程中变化。根据临床检查后个体患者的需要,医生在治疗过程期间也可以调整给予频率。
本发明方法包括包含向上滴定选项的给予方案(在本文中也称为“剂量修改”)。如本文所用,“向上滴定选项”意指在接受特定数量的PCSK9抑制剂剂量后,如果患者尚未达到一个或多个所定义治疗参数的规定降低,则此后增加PCSK9抑制剂的剂量。例如,在包括以每两周一次的频率向患者给予75mg剂量的抗PCSK9抗体的治疗方案的情况下,如果在4周后(即,2个剂量)或8周后(即,在第0周、第2周、第4周、第6周和第8周给予5个剂量),患者尚未达到小于50mg/dL的血清LDL-C浓度,则此后将抗PCSK9抗体的剂量增加至例如每两周一次给予150mg(例如,在第10周或第12周或更晚开始)。
在某些实施方案中,以约75mg的剂量以每两周一次的频率向患者给予特异性结合PCSK9的抗体或其抗原结合片段。在某些实施方案中,如果在一个或多个、两个或更多个、三个或更多个、四个或更多个或者五个或更多个剂量后测量的患者的LDL-C<70mg/dL,则维持约75mg剂量。在某些实施方案中,如果在一个或多个、两个或更多个、三个或更多个、四个或更多个或者五个或更多个剂量后测量的患者的LDL-C仍然≥70mg/dL,则中止约75mg剂量,并且随后以约150mg的剂量以每两周一次的频率向患者给予特异性结合PCSK9的抗体或其抗原结合片段。
在某些实施方案中,以约150mg的剂量以每两周一次的频率向患者给予特异性结合PCSK9的抗体或其抗原结合片段。在某些实施方案中,当以约150mg的剂量以每两周一次的频率向患者给予特异性结合PCSK9的抗体或其抗原结合片段时,如果在至少一个剂量或至少两个、三个、四个或五个连续剂量后测量的患者的LDL-C<10、15、20或25mg/dL,则中止约150mg剂量,并且随后以约75mg的剂量以每两周一次的频率向患者给予特异性结合PCSK9的抗体或其抗原结合片段。在某些实施方案中,将约150mg剂量以恒定剂量给予患者。在某些实施方案中,在如本文公开的剂量调整(例如,从每两周约75mg或从每四周约300mg)后向患者给予约150mg剂量。
在某些实施方案中,以约300mg的剂量以每四周一次的频率向患者给予特异性结合PCSK9的抗体或其抗原结合片段。在某些实施方案中,如果在一个或多个、两个或更多个、三个或更多个、四个或更多个或者五个或更多个剂量后测量的患者的LDL-C<70mg/dL,则维持约300mg剂量。在某些实施方案中,如果在一个或多个、两个或更多个、三个或更多个、四个或更多个或者五个或更多个剂量后测量的患者的LDL-C仍然≥70mg/dL,则中止约300mg剂量,并且随后以约150mg的剂量以每两周一次的频率向患者给予特异性结合PCSK9的抗体或其抗原结合片段。
在某些实施方案中,将抗PCSK9抗体以每两周约75mg的剂量给予患者,例如持续至少两个剂量。
在某些实施方案中,将抗PCSK9抗体以每两周约150mg的剂量给予患者,例如持续至少两个剂量。
在一些实施方案中,将抗体以每两周或每4周约300mg的剂量给予患者。
在另外的实施方案中,如果在150mg剂量的情况下在任何2次连续测量中患者的LDL-C<25mg/dL,则此后将剂量减少至75mg。
组合疗法
如本文其他地方所述,所述方法可以包括将PCSK9抑制剂与患者先前开处的脂质修饰疗法(LMT)组合(“在其之上”)给予患者。LMT包括但不限于他汀、贝特类、尼克酸(例如,烟酸及其衍生物)、胆汁酸螯合剂、依泽替米贝、洛美他派(lomitapide)、植物甾醇、奥利司他等。例如,可以将PCSK9抑制剂与稳定的每日治疗性他汀方案组合给予患者。在本发明方法的上下文中可以与PCSK9抑制剂组合给予的示例性每日治疗性他汀方案包括例如阿托伐他汀(每日10、20、40或80mg)、阿托伐他汀/依泽替米贝(每日10/10或40/10mg)、罗苏伐他汀(每日5、10或20mg)、西立伐他汀(每日0.4或0.8mg)、匹伐他汀(每日1、2或4mg)、氟伐他汀(每日20、40或80mg)、辛伐他汀(每日5、10、20、40或80mg)、辛伐他汀/依泽替米贝(每日10/10、20/10、40/10或80/10mg)、洛伐他汀(每日10、20、40或80mg)、普伐他汀(每日10、20、40或80mg)及其组合。在某些实施方案中,他汀疗法是对于患者而言最大耐受他汀疗法。在本发明方法的上下文中可以与PCSK9抑制剂组合给予的其他LMT包括例如(1)抑制胆固醇摄取和或胆汁酸再吸收的药剂(例如,依泽替米贝);(2)增加脂蛋白分解代谢的药剂(如尼克酸);和/或(3)LXR转录因子(其在胆固醇消除中起作用)的活化剂,如22-羟基胆固醇。
在所述方法的上下文中,可以在给予PCSK9抑制剂刚好之前、同时或不久之后给予一种或多种另外的治疗活性成分,例如上文列出的任何药剂或其衍生物;(出于本公开文本的目的,此类给予方案被认为是“与(另外的治疗活性组分)组合”给予PCSK9抑制剂)。本发明方法包括药物组合物及其使用方法,其中PCSK9抑制剂与如本文其他地方所述的一种或多种另外的治疗活性组分共同配制。
实施例
提出以下实施例以向本领域普通技术人员提供关于如何制备和使用本发明的方法和组合物的完整公开内容和描述,并且不旨在限制诸位发明人视为其发明的范围。已经努力确保关于所使用的数字(例如,量、温度等)的准确性,但是应当考虑一些实验误差和偏差。除非另外指示,否则“份数”是重量份,“分子量”是平均分子量,温度是按摄氏度计,并且压力是大气压或接近大气压。
实施例1.产生针对人PCSK9的人抗体
如美国专利号8,062,640中所述产生人抗PCSK9抗体,将其通过引用以其整体并入本文。用于以下实施例的示例性PCSK9抑制剂是指定为“mAb316P”的人抗PCSK9抗体,也称为“REGN727”或“阿利珠单抗”。mAb316P具有以下氨基酸序列特征:包含SEQ ID NO:5的重链和包含SEQ ID NO:9的轻链;包含SEQ ID NO:1的重链可变区(HCVR)和包含SEQ ID NO:6的轻链可变结构域(LCVR);包含SEQ ID NO:2的重链互补决定区1(HCDR1)、包含SEQ ID NO:3的HCDR2、包含SEQ ID NO:4的HCDR3;包含SEQ ID NO:7的轻链互补决定区1(LCDR1)、包含SEQID NO:8的LCDR2和包含SEQ ID NO:10的LCDR3。
实施例2:阿利珠单抗(针对PCSK9的一种单克隆抗体)对急性冠状动脉综合征后的长期心血管结果的影响:方案
引言
自1987年以来,他汀已经被批准用于临床。然而,自那时起,没有非他汀降脂疗法与任何原因造成的死亡减少相关。抑制PCSK9提供了机会来确定LDL-C和其他致动脉粥样硬化脂蛋白的实质性进一步减少是否能够提供超过他汀所提供的那些的进一步心血管结果改进,包括对死亡率降低的影响。
本研究询问阿利珠单抗(针对PCSK9的一种全人单克隆抗体)是否可以在添加到最佳他汀疗法中时降低心血管风险,包括死亡。选择患有近期急性冠状动脉综合征的患者作为研究群体,因为他们比患有稳定的心血管疾病的患者面临更高的复发性事件风险,并且因此可能从有效的新治疗中获得更大的绝对益处。通过致动脉粥样硬化脂蛋白的最低及格水平进一步定义研究群体,以靶向其残留心血管风险可能通过进一步减少这些脂蛋白而被修改的那些。本研究还提供了关于PCSK9抑制的安全性的实质信息。
研究目标
本研究是一项由研究者发起的国际性、多中心、随机、双盲、安慰剂对照的研究,在大约18,000名患有近期急性冠状动脉综合征(ACS)的患者中进行。主要目标是评价在索引ACS事件后1-12个月开始的阿利珠单抗(每2周皮下注射75-150mg)是否降低冠心病死亡、重大非致命性冠状动脉事件(急性心肌梗塞或不稳定型心绞痛住院治疗)或缺血性中风的复合结果的发生率。
研究群体
主要纳入标准是:1)ACS住院治疗,由以下定义:在归因于假定或得到证明的阻塞性冠状动脉疾病的计划外住院的72小时内在休息或极少用力时发生的不稳定模式的心肌缺血症状,以及以下至少之一:a)升高的心脏生物标志物;或b)与缺血或梗塞一致的静息ECG变化,加上来自节段性室壁运动或灌注异常的阻塞性冠状动脉疾病的另外证据、通过血管造影术得到的≥70%心外膜冠状动脉狭窄或对冠状动脉血运重建术的需要;以及2)未被每日阿托伐他汀40-80mg或罗苏伐他汀20-40mg或最大耐受剂量的这些药剂之一充分控制的脂质水平,由以下至少之一定义:a)LDL-C≥70mg/dl、b)非HDL-C≥100mg/dl或c)载脂蛋白B≥80mg/dl。
主要排除标准是:1)年龄<40岁;2)随机化前<4或>52周为及格索引ACS事件;3)在随机化前至少2周不进行稳定的脂质修饰疗法;4)未被控制的高血压(在随机化访视时>180mm Hg收缩压和/或>110mm Hg舒张压);5)尽管进行治疗,纽约心脏协会III类或IV类充血性心力衰竭仍持续存在,或者如果测量LVEF<25%;6)出血性中风史;7)在及格实验室访视时,空腹甘油三酯>400mg/dl(4.52mmol/L);8)随机化访视前2周内的复发性ACS事件;9)在随机化访视前2周内进行或随机化后计划的冠状动脉血运重建术;10)肝转氨酶>正常上限的3倍;当前乙型或丙型肝炎感染的实验室证据;肌酸激酶>正常上限的3倍;估计肾小球滤过率<30ml/min/1.73m2;尿液或血清妊娠测试阳性;11)甲状腺功能减退症的近期诊断,在及格实验室访视1个月内开始治疗;12)过去5年的癌症,除了充分治疗的基底细胞或鳞状细胞皮肤癌或原位宫颈癌之外;13)先前用任何PCSK9抗体进行了治疗;14)在磨合期期间使用非诺贝特或非诺贝酸以外的贝特类;以及15)无法提供知情同意或遵守研究要求;不使用有效避孕措施的怀孕、哺乳或生育潜能。
试验招募了已经因由以下定义的ACS住院治疗的至少40岁的男性和女性患者,即在归因于假定或得到证明的阻塞性冠状动脉疾病的计划外住院的72小时内在休息或极少用力时发生心肌缺血的不稳定症状。此外,及格ACS事件需要满足以下标准中的至少一个:与急性心肌梗塞一致的升高的心脏生物标志物,或与缺血或梗塞一致的静息ECG变化连同来自局部灌注成像或室壁运动异常的阻塞性冠状动脉疾病的另外证据、通过血管造影术得到的心外膜冠状动脉狭窄≥70%或对与所述事件相关的冠状动脉血运重建的需要。
及格患者必须曾展现尽管用阿托伐他汀40-80mg每日、罗苏伐他汀20-40mg每日或最大值耐受剂量的这些药剂之一进行稳定状态(至少2周)的治疗仍未充分控制致动脉粥样硬化脂蛋白。因此,试验中的背景他汀治疗与美国心脏协会和美国心脏病学会的关于降低血液胆固醇水平的二级预防指南一致(参见Stone等人,Circulation(2014)129:S1-45.)。未充分控制致动脉粥样硬化脂蛋白由以下至少之一定义:LDL-C≥70mg/dL(1.81mmol/L)、非高密度脂蛋白胆固醇(非HDL-C)≥100mg/dL(2.59mmol/L)或载脂蛋白B≥80mg/dL(0.8mmol/L)。
研究程序
患者进入持续2-16周的磨合期。在此期期间,指示患者使用研究自动注射器装置进行自我注射技术。根据需要开始和/或调整阿托伐他汀(每日40-80mg)或罗苏伐他汀(每日20-40mg)以确定最大耐受剂量。任凭研究者处理,其他未排除的脂质修饰疗法也可能在磨合期期间开始。在至少两周的稳态脂质修饰疗法后,获得空腹血样以确定是否满足至少一个及格脂蛋白标准。
在磨合期结束时满足所有纳入标准且无排除标准的患者被随机分配为进行用每2周皮下注射阿利珠单抗75mg(1ml注射量)或匹配安慰剂进行的初始治疗。在随机化后1、2、4、8、12、16、20和24个月进行随访,然后以6个月间隔进行,直至共同研究结束日期。在随机化时和随机化后的多个时间点,评估患者的研究终点和不良事件,并且收集血样和尿样,用于包括脂蛋白和载脂蛋白的测量;血液学和化学研究,包括肝脏、肌肉和肾功能测试;血红蛋白A1c;高敏C反应蛋白(hsCRP)、抗阿利珠单抗抗体;以及对有生育潜能的妇女进行的妊娠测试。使用Friedewald公式计算LDL-C,除了通过直接测量确认值<15mg/dl(以及当TG值超过400mg/dL(4.52mmol/L)时)。还收集样品用于测量PCSK9水平、脂蛋白亚级分以及炎症和心血管风险的其他介质。在随机化时和研究完成时记录心电图。在随机治疗期期间,患者和研究者对脂蛋白水平保持不知情,并且指示治疗医生不要进行常规的临床脂蛋白测试。
本研究旨在确定在生理范围的较低部分达到LDL-C水平是否能改进临床结果;试验并非设计用来探讨持续的亚生理性LDL-C水平的安全性。因此,盲法剂量调整和监测程序被并入方案中,如下。在分配为用阿利珠单抗进行治疗的患者中,如果随机化后1个月(即,2个剂量的每2周阿利珠单抗75mg后)测量的LDL-C仍然≥50mg/dl,则阿利珠单抗的剂量以盲法方式增加至每2周150mg。如果随机化后1个月测量的LDL-C<50mg/dl,则将阿利珠单抗的剂量维持在75mg。如果在接受阿利珠单抗150mg时在任何2次连续测量中LDL-C<25mg/dl,则将剂量减少至75mg。如果在接受阿利珠单抗75mg时在2次连续测量中LDL-C<25mg/dl但是≥15mg/dl,则继续该剂量,但是由独立安全医生监测患者的潜在相关不良事件,如果数据表明不良事件与治疗有因果关系,则医生向数据安全性监测委员会(DSMB)报告个体和合并发现并建议盲法中止治疗。如果在用阿利珠单抗75mg治疗期间在2次连续测量中LDL-C<15mg/dl,则在下次研究访视时中止活性治疗,并且在研究的剩余持续时间内以盲法方式取代安慰剂注射。综合而言,这些盲法剂量调整旨在最大化阿利珠单抗组中LDL-C<50mg/dl的患者的数量,同时使具有持续的LDL-C<15mg/dl水平的患者的数量最小化。
研究结果
主要功效量度是到首次发生冠心病死亡、重大非致命性冠状动脉事件(心肌梗塞或不稳定型心绞痛住院治疗)或缺血性中风的时间。
次要终点包括缺血驱动的冠状动脉血运重建术、充血性心力衰竭住院治疗和全因死亡。
主要功效量度是:到首次发生冠心病死亡、非致命性急性心肌梗塞、致命性或非致命性缺血性中风或需要住院治疗的不稳定型心绞痛的时间。
主要的次要功效量度是(按层级顺序):1)从随机化到首次发生重大冠心病事件(冠心病死亡或非致命性心肌梗塞)、需要住院治疗的不稳定型心绞痛或缺血驱动的冠状动脉血运重建术的时间;2)从随机化到首次发生重大冠心病事件的时间;3)从随机化到首次发生任何心血管事件(任何心血管死亡、任何非致命性冠心病事件或非致命性缺血性中风)的时间;4)从随机化到首次发生全因死亡、非致命性心肌梗塞或非致命性缺血性中风的时间;以及5)从随机化到死亡(全因死亡)的时间。
其他次要功效量度是:1)从随机化到冠心病死亡的时间;2)从随机化到首次发生非致命性心肌梗塞的时间;3)从随机化到首次发生缺血性中风的时间;4)从随机化到首次发生需要住院治疗的不稳定型心绞痛的时间;5)从随机化到首次发生缺血驱动的冠状动脉血运重建术的时间;以及6)从随机化到首次发生需要住院治疗的充血性心力衰竭的时间。
安全性量度是:所有不良事件;心率和血压;血液学;以及生物化学评估。
其他量度是:1)在整个研究中评估的抗阿利珠单抗抗体;以及2)LDL胆固醇、载脂蛋白B、非HDL胆固醇和高敏C反应蛋白的百分比变化。
实验室功效终点包括所计算的LDL-C、载脂蛋白B、非HDL-C和hsCRP自基线的变化。通过报告不良事件和实验室测试来评估阿利珠单抗治疗的安全性。在此试验中特别感兴趣的不良事件包括过敏事件、局部注射部位反应、肝酶增加和溶血性贫血。
统计考虑
安慰剂组的主要终点事件的推断的Kaplan-Meier发生率在12个月时为3.8%,在24个月时为6.4%,在36个月时为9.0%,并且在48个月时为11.4%。其他假设包括1%的患者未能随访到24个月、基线时中位LDL-C为90mg/dl和在阿利珠单抗治疗的情况下LDL-C自基线降低50%,导致15%危险降低。基于这些假设并指定单侧2.49%显著性水平的对数秩检验以解释两个期中分析,试验对1613例主要终点事件具有90%的效力,对应于40个月内随机化的18,000名患者的样本量。为了有足够的持续时间暴露于阿利珠单抗以全面评估安全性和功效,试验继续直到1613例主要终点事件发生,并且所有可评估的存活患者已经被跟踪至少2年。对于主要结果,跨根据性别、年龄、人种、地理区域和从ACS事件到随机化的时间分类的子组检查治疗效果。使用与主要终点相同的方法分析事件发生时间次要结果。对于主要的次要结果,总体1型误差是通过使用顺序推理方法来控制的。构建比例危险回归模型以包括LDL-C和其他脂质参数的变化或绝对值。根据预先指定的统计分析计划对由分类和连续变量定义的亚群进行分析。在没有正式推理测试的情况下,治疗组呈现了安全性结果。
独立的DSMB由3名心脏病学家、1名脂质学家和1名统计学家组成,以规律间隔审查期中数据,以评估安全性和功效。当大约50%的事件发生时,DSMB对无用性(对应于危险比>1.008的非约束边界)进行了期中分析。当大约75%的事件发生时,DSMB对无用性(对应于危险比>0.951的非约束边界)和压倒性功效(危险比<0.802,对应于p<0.0001,跨子组和区域的主要终点具有一致性,包括全因死亡的次要终点有正趋势,并且没有过多的非心血管死亡)进行了第二次期中分析。
实施例3:阿利珠单抗(针对PCSK9的一种单克隆抗体)对急性冠状动脉综合征后的长期心血管结果的影响:结果
本研究首次和唯一一次显示,非他汀降脂疗法与任何原因造成的死亡减少相关。
研究患者
在本研究中,在57个国家的1,315个地点招募了总计18,924名患者。及格急性冠状动脉综合征(ACS)在83.2%的患者中为心肌梗塞,并且在16.8%的患者中为不稳定型心绞痛。大多数患者(92.1%)以70mg/分升或更高的LDL胆固醇及格。另外4.2%仅满足非HDL-胆固醇标准,并且0.3%仅满足载脂蛋白B标准。从及格急性冠状动脉综合征到随机化的中位时间对于整个群体为2.6个月(四分位距,1.7至4.3),对于阿利珠单抗治疗组为2.6个月(四分位距,1.7至4.4),并且对于安慰剂治疗组为2.6个月(四分位距,1.7至4.3)。
在这些患者中,其中9,462名在阿利珠单抗治疗组中,并且其中9,462名在安慰剂治疗组中。在随机化时,两个治疗组的基线特征得到很好平衡(表1)。将大多数患者用指南推荐的二级预防药物治疗进行治疗,并且针对索引事件进行了冠状动脉血运重建。在随机化时,88.8%的患者用每日阿托伐他汀40至80mg或每日罗苏伐他汀20至40mg进行治疗。随访1年和3年后,阿利珠单抗组对应的百分比为84.7%和82.8%,并且安慰剂组为86.2%和86.6%。两组之间在基线特征上没有名义上的显著差异。
表1.患者的基线特征*
*以mg/分升的单位报告脂质水平。为了将胆固醇的值转换为毫摩尔/升,乘以0.02586。为了将甘油三酯的值转换为毫摩尔/升,乘以0.01129。HDL表示高密度脂蛋白,并且LDL表示低密度脂蛋白。数据是中位数(四分位距),除了指出为平均值(标准偏差)。
§用Friedewald公式计算LDL胆固醇;通过超速离心/β定量确认计算值<15mg/分升。
研究治疗
在随机化后的第一次评估时,用阿利珠单抗治疗的2615名(27.6%)患者的LDL-胆固醇水平为50mg/分升或更高,并且随后从75mg至150mg盲法向上滴定阿利珠单抗。在这2615名患者中,805名之后在两次连续LDL胆固醇测量低于25mg/分升后盲法向下滴定至75mg。在用阿利珠单抗治疗的所有患者中,730名(7.7%)在75mg剂量下两次连续LDL-胆固醇测量低于15mg/分升,导致自随机化起中位8.3个月后盲法转换为安慰剂注射。在盲法转换为安慰剂的患者中,中位基线LDL胆固醇为71(四分位距,58至83)mg/分升。在用阿利珠单抗治疗的总时间中,78%和22%分别处于75mg和150mg剂量下。
跟踪患者持续的时间中位数为2.8(四分位距,2.3至3.4)年。在阿利珠单抗治疗组的1,343名(14.2%)患者和安慰剂治疗组的1,496名(15.8%)患者中发生除死亡之外的原因导致的过早治疗中止。此外,阿利珠单抗和安慰剂治疗组中分别有14和9名患者失访(生命状况)。归因于具有低于15mg/dL的两个连续LDL值,阿利珠单抗治疗组中的730名(7.7%)患者以盲法方式转换为安慰剂治疗组。在阿利珠单抗和安慰剂组中,预期治疗暴露(包括从阿利珠单抗到安慰剂的盲法转换)占总随访时间的百分比分别为86%和91%。确定完成99.1%和99.8%的分别针对主要终点和死亡进行随访的潜在患者年。
将患者治疗平均(中位数)33个月。
治疗对脂蛋白的影响
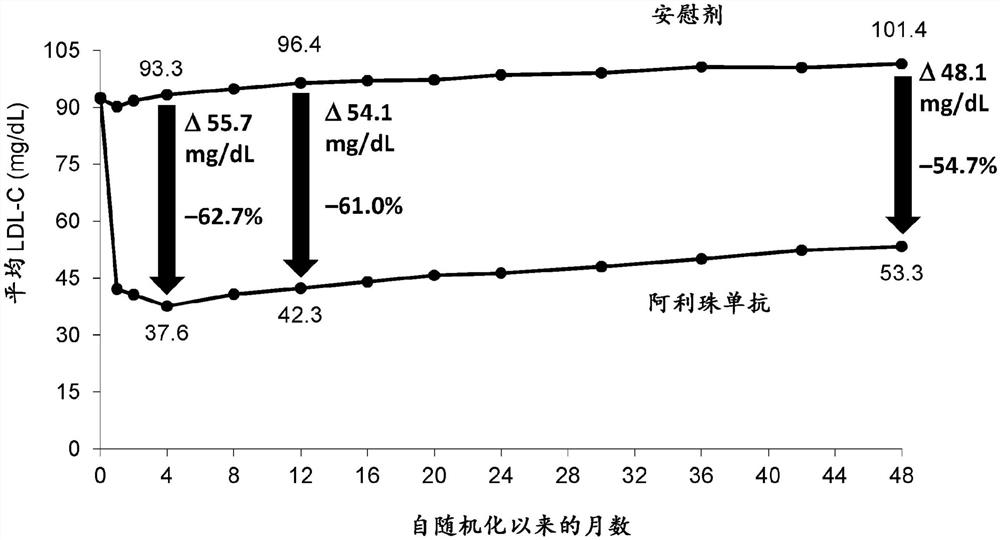
在基线时,LDL胆固醇为92±31mg/分升(2.39±0.80mmol/升),(平均值±标准偏差)。在阿利珠单抗组的意向治疗基础上,平均LDL胆固醇在4个月时达到40mg/分升(1.03mmol/升)的最低点,在12个月时升至48mg/分升(1.24mmol/升),并且在48个月时达到66mg/分升(1.72mmol/升)(图1A)。排除中止阿利珠单抗后收集的值,在4、12和48个月时的平均LDL-胆固醇水平分别为38、42和53mg/分升(0.97、1.09和1.38mmol/升),对应于62.7%、61.0%和54.7%平均安慰剂校正降低。阿利珠单抗组相对于安慰剂组的平均LDL-胆固醇水平的绝对降低在4、12和48个月时分别为55.7mg/dL、54.1mg/dL和48.1mg/dL。在安慰剂组中,在4、12和48个月时的平均LDL-胆固醇水平(意向治疗)分别为93、96和103mg/分升(2.42、2.50和2.67mmol/升)。图1B-1G中提供了其他脂质测量。
功效终点
主要终点发生在阿利珠单抗组的903名(9.5%)患者和安慰剂组的1052名(11.1%)(表2);阿利珠单抗和安慰剂组的4年Kaplan-Meier比率估计值分别为12.5%和14.5%(危险比0.85;95%置信区间,0.78至0.93;P<0.001)(图2)。因此,在此终点,阿利珠单抗将MACE的风险降低了15%。为了预防一例主要终点事件,需要将49名患者治疗4年。MACE是一个复合终点,其包括经历过以下的患者:(1)冠心病(CHD)死亡、(2)非致命性心肌梗塞、(3)致命性或非致命性缺血性中风或(4)需要住院治疗的不稳定型心绞痛。如表2所示,与安慰剂相比,在阿利珠单抗治疗的患者中,MACE终点的每个成分均较低,针对非致命性心肌梗塞、致命性或非致命性缺血性中风和需要住院治疗的不稳定型心绞痛显示出统计上的显著差异。
表2.主要终点和次要终点(意向治疗群体)。*
*冠心病死亡、非致命性心肌梗塞、需要住院治疗的不稳定型心绞痛或缺血驱动的冠状动脉血运重建术。
阿利珠单抗降低了任何冠心病事件、重大冠心病事件、任何心血管事件以及死亡、非致命性心肌梗塞和非致命性中风的复合体的风险(表2)。虽然在冠心病死亡或心血管死亡的减少上不是统计上显著的,但是阿利珠单抗组患者中的全因死亡发生频率较低(334对比392名患者;估计4年事件比率,5.3%对比6.4%;危险比,0.85;95%置信区间,0.73至0.98;P=0.026;图3)。由于在主要的次要终点的层级中全因死亡跟随冠心病和心血管死亡,因此全因死亡的P值被认为是名义上显著的。为了预防一例死亡,需要将87名患者治疗4年。阿利珠单抗还降低了非致命性心肌梗塞、非致命性缺血性中风、不稳定型心绞痛住院治疗和缺血驱动的冠状动脉血运重建的风险,但是未降低充血性心力衰竭住院治疗的风险。
阿利珠单抗对主要终点的跨预定义子组的影响是一致的(图4),包括三个预定义的基线LDL胆固醇子组(小于80mg/分升、80至100mg/分升以及100mg/分升或更高;相互作用的P值,0.09)(参见图5A、5B和5C)。然而,在这三个子组中,分配到安慰剂的患者中主要终点的累积发生率分别为9.5%、9.5%和14.9%。因此,与安慰剂相比,在具有最高基线LDL胆固醇和最大绝对风险的子组中,阿利珠单抗产生了最大的绝对风险降低(图5C)。
特别感兴趣的是,基线LDL胆固醇水平超过100mg/dL的这些患者中MACE显著降低了24%(HR=0.76(95%置信区间0.65-0.87)),这与基线LDL胆固醇水平低于100mg/dL的患者显著不同(p=0.05)(图6)。为了预防此子组中的一个主要终点,需要将16名患者治疗4年。在图7A、7B和7C中,在意向治疗(ITT)的基础上,针对三个预定义子组中的每一个示出了对应的LDL-C水平。
在跨基线LDL胆固醇的三个预定义子组的事后分析中,阿利珠单抗对死亡的影响没有显著的异质性(ARR相互作用的P值,0.12)(参见图8A、8B和8C)。与主要终点类似,安慰剂组的绝对死亡风险和阿利珠单抗与安慰剂组之间的死亡绝对差异在基线LDL胆固醇为至少100mg/分升的子组中最大。基线LDL-C水平等于或高于100mg/dL的患者的死亡风险显著降低了29%(HR=0.71(95%置信区间0.56-0.90))。(表3A)。
在按年龄(<65对比≥65)、性别(男性对比女性)、区域(东欧、西欧、北美、南美、亚洲和世界其他地区)或自随机化起的时间分析的患者中未看到风险降低的显著差异。
表3A和3B集中于基线LDL-C≥100mg/dL的患者。表3A显示了基线LDL-C水平等于或高于100mg/dL的患者亚群的进一步分析。在此患者子组中,阿利珠单抗将重大心血管事件的风险显著降低了24%,并且另外的事后分析也发现阿利珠单抗将冠心病(CHD)死亡减少了28%,并且将任何原因造成的死亡减少了29%。在CHD事件、重大CHD事件、死亡、非致命性心肌梗塞或非致命性缺血性中风和心血管死亡的次要终点中风险降低也是显著的。在根据<80mg/d、80至<100mg/dL或≥100mg/dL的基线LDL胆固醇水平(中位基线LDL-C:118mg/dL)的子组的预先指定的分析中观察到类似结果(表3B)。
表3A.功效:基线LDL-C≥100mg/dL(中位基线LDL-C:118mg/dL)的子组
表3B.功效:根据<80mg/dL、80至<100mg/dL或≥100mg/dL的基线LDL胆固醇水平(中位基线LDL-C:118mg/dL)的子组
安全性
a.不良事件
在用阿利珠单抗治疗的患者中,与用安慰剂治疗的那些患者相比,没有过量的不良事件或实验室异常(表4),除了注射部位反应之外(分别为3.8%对比2.1%)。分别地,神经认知事件发生在1.5%的接受阿利珠单抗的患者中和1.8%的接受安慰剂的患者中,新发糖尿病为9.6%对比10.1%,并且出血性中风(通过判定确认)为<0.1%对比0.2%。在0.5%的接受阿利珠单抗的患者中和在<0.1%的接受安慰剂的患者中检测到中和抗药物抗体。
b.非常低LDL-C
与来自安慰剂组的匹配患者相比,在达到非常低LDL-C的患者中分析了阿利珠单抗的安全性和功效。
在随机化到接受阿利珠单抗的9462名患者中,730名(7.7%)在两次连续测量中达到非常低LDL-C(<15mg/dL或0.39mmol/L),并且在随机化后的中位8.3个月取代安慰剂。使用倾向评分匹配,将它们与初始分配到安慰剂的2152名患者进行比较(3:1)。也使用倾向评分匹配来比较在基线时无糖尿病的525名患者(其具有两个连续的非常低LDL-C水平并且取代安慰剂)与安慰剂组中1675名匹配的患者的新发糖尿病。还关于非常低LDL-C评价神经认知事件和出血性中风。
与非常低LDL-C相关并用于倾向评分匹配的特征包括男性、糖尿病、较低基线LDL-C和脂蛋白(a)以及在亚洲的招募。尽管转换为安慰剂,但是接受阿利珠单抗的具有非常低LDL-C的患者的MACE发生率低于来自安慰剂组的匹配患者(6.4%对比8.5%,HR 0.71,95%CI 0.52-0.98,P=0.039)。与来自安慰剂组的匹配患者相比,在接受阿利珠单抗时非常低LDL-C与新发糖尿病的较高风险无关(15.1%对比13.0%,HR 1.10,95%CI 0.85-1.43,P=0.46)。也没有鉴定出非常低LDL-C与神经认知事件或出血性中风的关联。
表4.不良事件和实验室测试结果
*由以下中的一项或多项定义,由糖尿病学专家盲法外部审查确认诊断:不良事件报告、糖尿病药物治疗新处方、两次血红蛋白A1c至少6.5%(并且基线水平<6.5%)、两次空腹血糖至少126mg/分升(并且基线水平<126mg/分升)。
结论
总之,ODYSSEY OUTCOMES满足其主要终点的效力(重大CV事件/MACE的相对风险降低15%)。所有单独终点均实现了一致的益处(MI、缺血性中风、需要住院治疗的不稳定型心绞痛和缺血驱动的冠状动脉血运重建为显著,且CHD和CV死亡有正趋势)。这是第一项非他汀试验,以证明全因死亡的名义上显著的益处。对于LDL>100mg/dL的患者,所有MACE终点均被显著改进,包括针对CHD死亡、CV死亡和全因死亡的情况。随着长达5年的双盲随访期,在阿利珠单抗和安慰剂组之间在总体安全性和感兴趣的安全性事件(包括新发糖尿病、白内障、神经认知事件和出血性中风)上均未观察到不平衡。
与ACS后患者的安慰剂相比,靶向LDL-C水平25-50mg/dL并允许水平低至15mg/dL的阿利珠单抗75或150mg Q2W:(1)减少MACE、MI和缺血性中风;(2)与较低全因死亡率相关;并且(3)在试验持续时间内是安全且耐受良好的。具体而言,在这项接近19,000名患者的安慰剂对照试验中,包括治疗≥3年的超过6000名患者,在阿利珠单抗的情况下没有安全性信号。
在具有ACS且基线LDL-C≥100mg/dL的患者中,与安慰剂相比,阿利珠单抗将MACE降低了24%(ARR:3.4%),并且将全因死亡降低了29%(ARR:1.7%)。不旨在受科学理论的束缚,这些是可能从治疗中受益最多的患者。
实施例4:基线Lp(a)与MACE和死亡风险的关系
升高的脂蛋白(a)(Lp(a))水平是心血管疾病的独立风险因子。Lp(a)是动脉粥样硬化前和血栓形成前/抗纤维蛋白溶解脂质,并且不被他汀或依泽替米贝降低。关于显示降低Lp(a)的潜在益处的努力在过去30年中未获成功。此实施例证明了阿利珠单抗在ODYSSEYOUTCOMES临床研究中降低Lp(a)的特定益处。
a.方法
通过自动乳胶浊度法(Siemens Healthcare Diagnostics,伊利诺伊州迪尔菲尔德),在基线、从初始阿利珠单抗或安慰剂给予开始4个月、从初始阿利珠单抗或安慰剂给予开始12个月以及在研究结束时测量Lp(a)。载脂蛋白(a)的大小异质性对测定法中的Lp(a)恢复仅具有中等影响。根据Lp(a)浓度,测定间变异系数为3.1%至4.8%。在基线以及随机化后的第4个月和第12个月(±4周),评估总群体以及分别地阿利珠单抗和安慰剂组的Lp(a)和LDL-C水平的分布。如果患者在每个这些访视窗口内具有多个值,则分析窗口内的最后一个值。
计算或直接测量的LDL-C水平包括Lp(a)中含有的胆固醇,其对应于大约30%的Lp(a)质量。为了解释这一点并推导LDL颗粒中含有的胆固醇的估计值,LDL-C
根据基线Lp(a)的四分位数确定阿利珠单抗治疗对MACE的相对和绝对影响是否存在异质性。为了评估前者,构建了按地理区域分层的Cox比例危险模型,具有基线Lp(a)四分位数、治疗及其相互作用的项。为了评估后者,使用Gail-Simon检验,跨基线Lp(a)的四分位数比较在阿利珠单抗治疗的情况下的绝对风险降低,量化为两个治疗组中观察到的发生率的差异。根据Lp(a)(<中位数、≥中位数)和基线LDL-C(<100mg/dL、≥100mg/dL[<2.59mmolL、≥2.59mm/L])的类别评估治疗对MACE的绝对风险降低的影响。
b.基线特征
在18,924名患者中,基线Lp(a)水平的平均值(SD)为39.0(43.2)mg/dL。基线Lp(a)的分布高度偏斜,中位数为21.2mg/dL(四分位距为6.7至59.6mg/dL)(图9)。最低水平为1mg/dL,第90百分位数水平为101mg/dL,并且最高水平为361mg/dL。根据Lp(a)四分位数的基线特征通过卡方检验(分类变量)或基于秩的检验(连续变量)进行比较。按基线Lp(a)的人口统计学和临床特征分别显示在表5和6中。上Lp(a)四分位数中的参与者更可能是女性、黑人且来自北美,但是不太可能吸烟或患有糖尿病。LDL-C浓度和用高强度他汀治疗的患者的百分比在Lp(a)的最高四分位数中最大。相反,LDL-C
表5.按基线Lp(a)四分位数的人口统计学
表6.按基线Lp(a)四分位数的临床特征
c.安慰剂组中的基线Lp(a)、心血管事件和死亡
使用具有基线Lp(a)的Cox回归模型,跨根据四分位数划分的四个基线Lp(a)类别比较MACE、CHD死亡和非致命性心肌梗塞(MI)的发生率。针对年龄、性别、人种、地理区域、自索引事件以来的时间、BMI、吸烟史、糖尿病、基线LDL-C和/或治疗分配进行调整。在安慰剂组中基线Lp(a)四分位数与事件发生率之间的关系显示在图10中;并且这种关系的建模显示在下表7中。
表7.安慰剂组中的基线Lp(a)四分位数以及心血管事件和死亡
基线Lp(a)四分位数是参考四分位数。经调整的模型是针对基线校正LDL-胆固醇调整的。
如表8所示,随着基线Lp(a)水平渐增,观察到MACE、CHD死亡和非致命性MI的发生率显著更高。在未经调整的Cox模型中,与最低Lp(a)基线四分位数相比,最高四分位数中的个体经历MACE或非致命性心肌梗塞的可能性高46%-58%。在针对基线LDL-C
表8.按基线Lp(a)四分位数的心血管事件
d.按基线Lp(a)四分位数分层的阿利珠单抗对MACE的影响
跨四个基线Lp(a)四分位数比较阿利珠单抗治疗组中相对于安慰剂治疗组的MACE、非致命性MI、CHD死亡和全因死亡的相对发生率。针对年龄、性别、人种、地理区域、自索引事件以来的时间、BMI、吸烟史、糖尿病和基线LDL-C进行调整。按基线Lp(a)四分位数分层的MACE的相对和绝对治疗效果显示在图12中。如表9所示,随着基线Lp(a)水平渐增,观察到通过阿利珠单抗治疗得到MACE和非致命性MI发生率的更大降低。在基线Lp(a)四分位数与阿利珠单抗在降低CHD死亡或全因死亡发生率上的影响之间未观察到任何关系。
总体而言,MACE的危险比(阿利珠单抗/安慰剂)为0.85(95%置信区间[CI]0.78至0.93,P<0.001),绝对风险降低为1.6%。治疗和基线Lp(a)四分位数对MACE相对风险没有统计上显著的相互作用。相比之下,在阿利珠单抗情况下的绝对风险降低在基线Lp(a)的上四分位数(2.3%和2.1%)比下四分位数(0.4%和1.4%,相互作用P值0.0011)高几倍。需要用阿利珠单抗治疗的时间中位数为2.8年以预防一例MACE的患者数量在基线Lp(a)的四分位数1、2、3和4中分别为250、71、43和47。
基线LDL-C>100mg/dL(>2.59mmol/l)、基线Lp(a)>中位数(21.2mg/dl)或两者的患者被鉴定为从阿利珠单抗治疗中受益的患者(图13)。
表9.按基线Lp(a)四分位数的心血管事件
*针对年龄、性别、人种、地理区域、自索引事件以来的时间、BMI、吸烟史、糖尿病和基线LDL-C进行调整。
e.阿利珠单抗对Lp(a)水平的影响
还分析了在研究过程中患者的Lp(a)水平。图14显示了按Lp(a)的基线四分位数和治疗组的中位Lp(a)浓度。两个治疗组中Lp(a)的基线分布类似。如图18A和18B所示,阿利珠单抗显著降低了患者从初始治疗起4个月的Lp(a)水平,并且维持降低直至研究结束。此外,在根据四分位数划分的四个基线Lp(a)类别中,在阿利珠单抗组内比较LDL-C和Lp(a)在第4个月时自基线的绝对变化。图15显示了阿利珠单抗组(图15A)和安慰剂组(图15B)中Lp(a)、LDL-C和LDL-C
总体而言,阿利珠单抗组中自基线到第4个月的中位相对变化和绝对变化分别为-23%(IQR-47%,0%)和-5.0mg/dl(IQR-13.5,0)。虽然在阿利珠单抗治疗的情况下跨基线Lp(a)四分位数的Lp(a)相对变化是类似的,但是存在实质的中位绝对变化梯度,范围从四分位数1的0mg/dl到四分位数4的-20.2mg/dl。所有Lp(a)四分位数的LDL-C变化类似;相比之下,LDL-C
表10.跨Lp(a)四分位数的LDL-C和Lp(a)水平变化
*表中的值是中位数(四分位距);基线和第4个月之间的变化。
f.Lp(a)变化对结果的影响
为了确定通过阿利珠单抗治疗修改Lp(a)水平与终点事件之间的关联,在阿利珠单抗组患者中,用Cox比例危险回归模型描述了Lp(a)自基线到第4个月的变化与第4个月后MACE和次要终点风险之间的关系。针对每个感兴趣的结果开发了四个模型:没有协变量的模型(未经调整的模型;模型1);针对基线Lp(a)调整的模型(模型2);另外针对基线LDL C
模型2和3A的比较指示通过针对LDL C
表11.在阿利珠单抗治疗下Lp(a)与MACE风险的关系
表12显示了关于CHD死亡或非致命性心肌梗塞、CV死亡和全因死亡的建模。在未经调整的模型中,Lp(a)变化与MACE风险之间没有发现显著的关系(模型1)。在针对基线Lp(a)进行调整后,Lp(a)变化与MACE之间的显著关系是清楚的(模型2)。这是因为较高的基线Lp(a)与更高的心血管风险相关,并且在阿利珠单抗治疗时Lp(a)减少更多,并且因此,对前者的解释暴露了后者与MACE风险的关系。重要的是,针对基线和LDL-C
表12.阿利珠单抗组中Lp(a)和LDL-C自基线到第4个月的变化与第4个月后的结果的关系。
在阿利珠单抗治疗下Lp(a)变化的幅度随基线Lp(a)浓度而增加。例如,在基线Lp(a)分布的第25、第50和第75百分位数处的患者在阿利珠单抗治疗下Lp(a)的预期变化为-1.6、-4.8和-13.4mg/dl。图17A和B显示了针对基线Lp(a)调整的第4个月时Lp(a)的绝对变化与基线和LDL-C
因此,在阿利珠单抗治疗下Lp(a)的变化幅度及其对心血管风险降低的贡献随基线Lp(a)浓度而增加。例如,在基线Lp(a)的第25、第50和第75百分位数处,与Lp(a)的-1.6、-4.8和-13.4mg/dl的变化相关的MACE危险比分别为0.991、0.973和0.928,并且可归因于Lp(a)变化的MACE风险降低的比例为4%、10%和26%。因此,在具有较高基线Lp(a)的患者中,在阿利珠单抗的情况下Lp(a)减少成为MACE降低的突出贡献者。这些结果表明Lp(a)减少与MACE或非致命性MI之间的关系独立于LDL-C水平。绝对Lp(a)变化的时间加权移动平均值与缺血性中风、CHD死亡、CV死亡或全因死亡之间没有关系。
g.Lp(a)变化对总事件的影响
为了研究Lp(a)减少对在阿利珠单抗治疗的情况下观察到的总事件(非致命性CV事件和死亡)减少的贡献,将接受强化或最大耐受他汀疗法的具有ACS且LDL-C≥70mg/dL、非HDL-C≥100mg/dL或apoB≥80mg/dL的患者以1:1随机化到阿利珠单抗治疗或安慰剂。通过针对人口统计学和临床变量、基线Lp(a)和LDL-C以及LDL-C自基线到第4个月的变化调整的脆弱模型描述了阿利珠单抗组中Lp(a)自基线到第4个月的变化与继发事件之间的关系。按基线Lp(a)百分位数处的危险比总结影响(参见表13)。
在阿利珠单抗组中,有1,636例非致命性事件和299例死亡。在Lp(a)和LDL-C降低的组合影响中,可归因于Lp(a)变化的风险降低的比例在基线Lp(a)的第25、第50和第75百分位数处分别为5%、13%和30%。因此,通过阿利珠单抗降低Lp(a)有助于减少总事件,尤其在具有较高基线Lp(a)水平的患者中。即使在针对LDL-C变化进行调整后,阿利珠单抗诱导的Lp(a)减少与总事件风险降低相关。
表13.第4个月时Lp(a)的绝对变化与总事件风险的关系
结论
基线Lp(a)水平预测阿利珠单抗和安慰剂两组中的MACE、CHD死亡和非致命性MI,独立于基线LDL-C水平以及人口统计学和临床变量。基线Lp(a)不会预测死亡或缺血性中风。基线Lp(a)也与阿利珠单抗治疗对MACE和非致命性MI的益处相关。因此,基线Lp(a)水平是患有近期ACS的患者中MACE和非致命性MI的独立预测因子,独立于阿利珠单抗治疗和基线LDL-C。
此外,Lp(a)水平自基线的中位变化在阿利珠单抗的情况下为大约-5mg/dL,且在安慰剂的情况下为0mg/dL。在阿利珠单抗组中,Lp(a)减少预测在解释人口统计学和临床变量、基线LDL-C和LDL-C自基线变化的模型中MACE和非致命MI的减少。在Lp(a)减少和中风或死亡之间未观察到任何关系。在安慰剂组中,在自基线没有系统性变化的情况下,Lp(a)变化不会预测任何结果事件。在本研究中,Lp(a)水平等于或高于队列中位数(21mg/dL)或LDL-C水平等于或高于100mg/dL的患者从阿利珠单抗治疗中获益。因此,通过阿利珠单抗降低Lp(a)与MACE、非致命性MI风险降低和总事件减少相关,独立于基线LDL-C和同时LDL-C降低。
实施例5:二次分析:阿利珠单抗对治疗超过一年的患者的急性冠状动脉综合征后死亡和MACE的影响
根据二次(事后)分析,一组特别感兴趣的患者是治疗超过12个月的那些患者。如表14所示,基线LDL-C水平等于或高于100mg/dL的接受阿利珠单抗治疗不到十二个月的患者显示出MACE减少(HR=0.81(置信区间0.66-1.01))。当用阿利珠单抗治疗相同群体超过十二个月时,MACE事件的减少增加且显著(HR=0.71(置信区间0.58-0.87))。观察到全因死亡的类似趋势。基线LDL-C高于100mg/dL的接受阿利珠单抗治疗不到十二个月的患者显示出全因死亡减少(HR=0.79(置信区间0.51-1.22))。当用阿利珠单抗治疗相同群体超过十二个月时,全因死亡降低且显著(HR=0.67(置信区间0.50-0.89))。8242名有资格进行至少三年随访的患者的MACE和全因死亡的另外的预先指定的分析显示在图20中。将超过44%的意向治疗(ITT)群体治疗超过三年。如此处所示,与在总研究群体中的MACE事件(图20A;HR0.85)和全因死亡(图20C;HR 0.85)相比,在治疗至少三年的群体中观察到较低的MACE事件(图20B;HR 0.83)和全因死亡(图20D;HR 0.78)比率。
这些结果指示,在总群体中以及在基线LDL-C水平等于或高于100mg/dL的患者中,阿利珠单抗治疗的益处继续积累,在第一年后有较大风险降低。
表14.事后地标分析
实施例6:二次分析-阿利珠单抗对治疗超过一年的患者的全因死亡、心血管死亡和非心血管死亡的影响
a.对全因死亡的影响
共有726名(3.8%)患者在试验期间死亡。总患者队列、存活者和死亡患者的基线特征总结在表16中。阿利珠单抗组死亡情况比安慰剂组少(分别地,334[3.5%]对比392[4.1%];HR 0.85,95%CI 0.73至0.98;p=0.026;表15)。基于阿利珠单抗和安慰剂组中对4年时死亡的分别为5.3%和6.4%的4年Kaplan-Meier估计,绝对风险降低为1.1%,并且需要治疗4年以预防1例死亡的患者数量是87。
表15.全因死亡、心血管死亡和非心血管死亡终点的总结
与主要终点类似,允许对全因死亡的非恒定治疗危险比表明阿利珠单抗的治疗效果滞后;第一年期间没有治疗益处HR 1.01,95%CI 0.77至1.32;p=0.95),但是在第一年后明显(HR 0.79,95%CI 0.66至0.94;p=0.0073;模型拟合对比恒定危险模型的改进p=0.13[HR为0.85])。
鉴于许多他汀试验中脂质降低的延迟益处的先前证据,预先指定的分析检查了在阿利珠单抗的情况下死亡减少是否与潜在的治疗持续时间有关。在有资格进行≥3年随访的8242名患者(整个研究队列的44%)中检查死亡。表17中描述了此子集的基线特征和在共同研究结束日期之前<3年招募的患者的剩余子集。在有资格进行≥3年随访的患者中,阿利珠单抗对全因死亡的益处比总试验群体更明显,即阿利珠单抗使死亡减少了22%(HR0.78,95%CI 0.65至0.94;p=0.01;图20D)。对于有资格进行<3年随访的患者,全因死亡的治疗危险比为0.96(95%CI 0.76至1.21;p=0.71;相互作用p=0.19)。
表16.基线特征
ACE=血管紧张素转换酶;ACS=急性冠状动脉综合征;ARB=血管紧张素II受体阻滞剂;CABG=冠状动脉旁路移植术;CHD=冠心病;GFR=肾小球滤过率;HDL=高密度脂蛋白胆固醇;LDL-C=低密度脂蛋白胆固醇;PCI=经皮冠状动脉介入治疗;STEMI=ST段抬高心肌梗塞。
*为了将胆固醇的值转换为mmol/L,乘以0.02586。为了将甘油三酯的值转换为mmol/L,乘以0.01129。数据是中位数(四分位距),除了指出为平均值(标准偏差)。
§用Friedewald公式计算LDL-C;通过超速离心/β定量确认计算值<15mg/dL。
表17:根据潜在随访持续时间的基线特征
ACE=血管紧张素转换酶;ACS=急性冠状动脉综合征;ARB=血管紧张素II受体阻滞剂;CABG=冠状动脉旁路移植术;CHD=冠心病;GFR=肾小球滤过率;HDL=高密度脂蛋白;LDL=低密度脂蛋白;PCI=经皮冠状动脉介入治疗;STEMI=ST段抬高心肌梗塞。
*以mg/dL的单位报告脂质水平。为了将胆固醇的值转换为mmol/L,乘以0.02586。为了将甘油三酯的值转换为mmol/L,乘以0.01129。数据是中位数(四分位距),除了指出为平均值(标准偏差)。
§用Friedewald公式计算LDL胆固醇;通过超速离心/β定量确认计算值<15mg/dL。
b.对心血管死亡和非心血管死亡的影响
CHD死亡发生在阿利珠单抗组的205名(2.2%)患者和安慰剂组的222名(2.3%)患者中(HR 0.92,95%CI 0.76至1.11;p=0.38),并且代表726例总死亡中的427例(58.8%)。心血管死亡发生在阿利珠单抗组的240名(2.5%)患者和安慰剂组的271名(2.9%)患者中(HR 0.88,95%CI 0.74至1.05;p=0.15),并且代表全因死亡中的511例(70.4%)死亡。与安慰剂相比,在阿利珠单抗的情况下非CV死亡在数值上较低但非显著(94[1.0%]对比121[1.3%];HR 0.77,95%CI 0.59至1.01;p=0.06)(表15)。判定的CV和非CV死因总结在表18和19中。未确定的死因比例较低。在阿利珠单抗组比安慰剂组少的31例CV死亡中,组间最大的差异是因为致命性心肌梗塞(n=10)和心脏性猝死(n=8)。在阿利珠单抗组对比安慰剂组少的27例非CV死因中,最大的差异是因为归因于肺部(n=14)原因的死亡。
表18.判定的心血管死亡的原因
表19.判定的非心血管死亡的原因
c.非致命性心血管事件与非心血管死亡的关系
总体而言,阿利珠单抗组中的非致命性CV事件比安慰剂组中少206例(HR 0.83,95%CI 0.76至0.91;p<0.0001)。当非致命性CV事件和非CV死亡被描述为序数函数时(表20),作为第一事件、第二事件和第三或更多事件的两种类型的事件在阿利珠单抗的情况下在数值上都比在安慰剂的情况下小,表明两种类型的事件之间的联系。
此外,以非致命性CV事件为条件,继发非CV死亡的风险更高。在阿利珠单抗和安慰剂组中有第一事件风险的患者中,非CV死亡分别以0.8%和0.9%作为第一事件发生。在随机化后总体中位数为1.1(0.4,1.9)年发生的第一非致命性CV事件后,非CV死亡在阿利珠单抗和安慰剂组的患者中分别以1.8%和2.0%作为第二事件发生。类似地,在随机化后总体中位数为1.5(0.9,2.3)年发生的第二非致命性CV事件后,非CV死亡在阿利珠单抗和安慰剂组的患者中分别以3.7%和6.2%作为第三事件发生。定性地,这些数据指示,每例连续的既往非致命性CV事件均与非CV死亡的继发风险增加相关。
表20:根据序数事件编号的非心血管死亡和非致命性心肌梗塞、中风或需要住院治疗的不稳定型心绞痛的数量和计时
事件时间表示为自随机化以来的年数
为了定量地探讨这种可能性,用危险函数中的治疗分配和招募区域构建了联合半参数模型(表21)。所述模型指示阿利珠单抗是CV死亡率降低的预测因子(p=0.043),并且提供了2.15的关联参数(95%CI 1.61至2.69),指示有较高非致命性CV事件风险的患者也有较高CV死亡风险。因此,先前的非致命性CV事件与继发致命性CV事件之间的依赖性加上在阿利珠单抗的情况下前者的减少指示预防非致命性CV事件可以解释在阿利珠单抗的情况下较低的CV死亡数量。
表21:模型中的联合半参数模型结果:总非致命性心肌梗塞、中风或不稳定型心绞痛和非心血管死亡,治疗和地理区域*
*亚洲被用作地理区域分析的参考。
为了探讨非致命性CV事件和非CV死亡之间关系的强度是否受到对非致命性CV事件和/或非CV死亡的预后因素的调整的影响,将一系列单变量联合半参数模型用预期可预测这些事件的预测因子拟合。在单变量模型中包括与非致命性CV事件或非CV死亡显著相关的所有因素(其允许经调整模型的收敛)后,估计的关联参数仍然显著(1.82,95%CI:1.08至2.55;p<0.0001),指示非致命性CV事件与非CV死亡之间存在持久的强烈关系。
d.死亡与基线和达到的LDL-C水平的关系
在事后分析中,在基线LDL-C水平的三个预定义子组(<80mg/dL[2.07mmol/L]、80至<100mg/dL[2.07至<2.59mmol/L]和≥100mg/dL[2.59mmol/L];图8A-图8C)中检查死亡。在基线LDL-C≥100mg/dL的子组中死亡的HR在数值上最低(HR 0.71,95%CI 0.56至0.90),但是阿利珠单抗对跨基线LDL-C类别的相对死亡风险的影响没有显著异质性(p相互作用=0.12)。相比之下,安慰剂组中存在显著的绝对死亡风险梯度,并且在阿利珠单抗和安慰剂组之间存在跨基线LDL-C子组的绝对死亡差异,安慰剂组风险最大,并且观察到在基线LDL-C≥100mg/dL的子组中在阿利珠单抗的情况下风险降低最大(P相互作用<0.005)。使用基线LDL-C值≥100mg/dL的患者在4年时全因死亡的Kaplan-Meier估计(5.8%对比9.6%),绝对风险降低为3.8%,并且需要治疗4年以避免该患者子集中1例死亡的数量是26。
另外的分析探讨了随机化后4个月达到的LDL-C水平与此后发生的死亡之间的关系。在根据达到的LDL-C四分位数的线性模型中,在4个月时达到较低LDL-C值的患者中全因死亡的风险较低(p=0.005)(表22)。当将试验群体按治疗分配进行分层时,安慰剂组在4个月时达到的LDL-C值与继发死亡无关,其中在4个月时中位LDL-C值为87mg/dL(2.25mmol/L)(表23)。相比之下,在阿利珠单抗组中的强烈关系是明显的(表4),其中在4个月时达到的中位LDL-C值为31mg/dL(0.80mmol/L)。将达到的LDL-C连续值与全因死亡风险相关联的样条分析得到了类似的发现:在整个试验队列中在4个月时达到的LDL-C与继发死亡之间的关系几乎是单调函数(模型p值=0.007)(图19A),其在阿利珠单抗组中更明显(图19C)。相比之下,安慰剂组中的关系是U形的,在4个月时达到最低或最高LDL-C的患者的死亡率更高(图19B)。
表22:按ITT第4个月LDL-C四分位数的全因死亡、心血管死亡和非心血管死亡(所有患者)
*按区域分层;ITT=意向治疗;第4个月LDL-C四分位数:Q1=≤0.80mmol/L(≤31mg/dL);Q2=>0.80至1.68mmol/L(>31至≤65mg/dL);Q3=>1.68至2.38mmol/L(>65至≤92mg/dL);Q4=>2.38mmol/L(>92mg/dL)
表23.在安慰剂和阿利珠单抗组中按ITT第4个月LDL-C四分位数的全因死亡
*按区域分层;CI=置信区间;HR=危险比;ITT=意向治疗;LDL-C=低密度脂蛋白胆固醇。
结论
阿利珠单抗减少了接受强化他汀治疗的致动脉粥样硬化脂蛋白升高的患者的ACS后的死亡,对CV和非CV死亡具有一致的影响。在基线时LDL-C较高或随访≥3年的患者在阿利珠单抗的情况下死亡特别明显地减少。达到的较低LDL-C与较少的死亡相关,特别地,在用阿利珠单抗治疗4个月时达到较低LDL-C水平的患者经历死亡风险降低。联合半参数模型分析证明,非CV死亡的风险与非致命性CV事件(例如非致命性MI、需要住院治疗的不稳定型心绞痛和非致命性缺血性中风)的风险有关,并且阿利珠单抗对非致命性CV事件有强烈影响。因此,用阿利珠单抗预防非致命性CV事件与非CV死亡的减少相关。
实施例7:二次分析-阿利珠单抗对致命性和非致命性心血管事件的总数的影响
常规假定非CV死亡的风险独立于非致命性CV事件的风险,并且不可被LDL-C降低修改。此外,先前的试验(FOURIER,SPIRE)未能证明对非CV死亡的影响。因此,在进一步的二次分析中,使用联合脆弱模型分析了阿利珠单抗对总(第一和继发)非致命性心血管(CV)事件和全因死亡的影响,所述模型解释了非致命性和致命性事件之间的潜在关系。此分析包括全因死亡和总非致命性CV事件(MI、中风、UA或心力衰竭住院或缺血驱动的冠状动脉血运重建)。敏感性分析将非致命性事件限于MI、中风或UA。总非致命性和致命性事件危险函数由联合模型单独估计,通过解释患者间的风险异质性和相关的患者内非致命性事件的共享脆弱性联系起来。所述模型还确定了非致命性事件是否与死亡风险增加相关。如果非致命性事件与死亡风险增加相关,则所述模型提供了非致命性事件风险的准确相对估计。按HR总结治疗效果,并且与第一非致命性CV事件或死亡的常规分析进行比较。
有5425例总死亡或非致命性CV事件,比第一事件(3064)高77%。与安慰剂相比,阿利珠单抗在第一和总事件中产生了类似的相对减少。重要的是,在阿利珠单抗的情况下总非致命性心血管事件或死亡事件减少385例(针对安慰剂为2,905例事件,针对阿利珠单抗为2,520例事件),对比第一非致命性心血管事件或死亡事件减少190例(针对安慰剂为1,627例事件,针对阿利珠单抗为1,437例事件)(图23)。因此,第一事件的分析仅反映了与阿利珠单抗治疗的时间中位数为2.8年相关的总事件减少的约一半。
在4年时,在随机化后给定时间安慰剂和阿利珠单抗组中给定患者的非致命性心血管事件的预期总数的估计值分别为0.357和0.301。相比之下,在安慰剂和阿利珠单抗组中具有第一非致命性心血管事件的患者的预期比例分别为0.183和0.160。需要治疗(95%CI)4年以预防一例非致命性事件的数量基于总事件是18(11至53),并且基于第一事件是44(26至129)。
非致命性CV事件与显著较高的死亡风险相关,并且脆弱方差指示实质的患者间风险异质性(表24)。
表24.阿利珠单抗对总非致命性CV事件和全因死亡的影响的分析
基于在4年时的估计比例,需要治疗(95%CI)以预防1例非致命性事件的数量基于第一事件是44(26至129),并且基于总事件是18(11至53)。因此,解释总事件说明了研究群体中正在发生的疾病的高负担并且阿利珠单抗减轻了该负担(图22)。按基线LDL-C子组的对应(事后)图显示在图23A和23B中。在图23A中,安慰剂和阿利珠单抗组中在4年时基线LDL-C≥100mg/dL的给定患者的非致命性心血管事件的预期数量分别为0.489和0.380,而安慰剂和阿利珠单抗组中具有第一非致命性心血管事件的患者的预期比例分别为0.237和0.183。需要治疗(95%CI)4年以预防一例非致命性事件的数量基于第一事件是19(12至45),并且基于总事件是9(5至46)。在LDL-C≥100mg/dL子组中需要治疗以预防一例非致命性事件的数量基于总事件是9(5至46)。在图23B中,安慰剂和阿利珠单抗组中在4年时基线LDL-C<100mg/dL的给定患者的非致命性心血管事件的预期数量分别为0.160和0.151,而安慰剂和阿利珠单抗组中具有第一非致命性心血管事件的患者的预期比例分别为0.302和0.267。需要治疗(95%CI)4年以预防一例非致命性事件的数量基于第一事件是103(38至-140),并且基于总事件是29(14至-217)(CI的负值反映损害)。
随机化后判定的非致命性心血管事件的类型和计数总结在下表25中。心肌梗塞和冠状动脉血运重建是最常见的事件类型,并且治疗组内每种事件类型的比例类似。随机化到阿利珠单抗的患者的每种类型的非致命性心血管事件在数值上减少,除了需要住院治疗的心力衰竭之外。
表25.非致命性心血管事件的类别
总研究群体和以基线水平100mg/dL分层的LDL-C子组的总的非致命性心血管和死亡联合脆弱模型结果显示在图24中。基于相互作用p值(针对非致命性事件p=0.02,针对死亡p=0.03),有证据表明相对阿利珠单抗治疗对总非致命性心血管事件和死亡两者的影响的显著异质性,在随机化时子组≥100mg/dL获得更大的相对益处。此结果也与图23A和23B中的观察结果一致。
表26总结了按序数事件计的死亡和非致命性心血管事件的分布。有5,425例总死亡或非致命性心血管事件,比第一事件(n=3,064)高77%。虽然大多数患者在研究期间没有经历过事件,但是相当大的患者子集经历了超过1例事件(1,261名患者)。在阿利珠单抗和安慰剂组中有第一事件风险的患者中,死亡分别以2.2%和2.5%作为第一事件发生。值得注意的是,以第一非致命性心血管事件为条件,继发死亡的风险更高。在随机化后总体中位数为1.0(0.4,1.7)年发生的第一非致命性心血管事件后,死亡在阿利珠单抗和安慰剂组的患者中分别以5.7%和5.0%作为第二事件发生。类似地,在随机化后总体中位数为1.2(0.6,2.0)年发生的第二非致命性心血管事件后,死亡在阿利珠单抗和安慰剂组的患者中分别以6.2%和6.6%作为第三事件发生。定性地,这些数据指示,每例连续的既往非致命性心血管事件均与死亡的继发风险增加相关。联合脆弱模型确认了此观察结果,其关联参数(95%CI)为2.04(1.78至2.29),将非致命性心血管事件和死亡的风险联系起来。
表26:按事件编号的死亡和判定的非致命性心血管事件的分布
按由事件频率类别定义的组的基线特征总结在下表27中。有至少一例事件的患者年龄较大,基线LDL-C较高,并且更有可能发生合并症,相比于在研究期间未发生事件的患者,包括ACS索引事件之前的糖尿病、高血压和MI。将具有至少一例事件的组进行比较,具有多例事件或仅有死亡事件的患者相对于具有单例非致命性事件的患者具有更高的基线LDL-C,并且在合并症方面存在若干差异。
表27:按非致命性心血管事件和致命性事件数量的类别的患者的基线特征
联合脆弱模型也用于分析不同的基线LDL-C子组(参见图25)。相互作用p值指示对按基线LDL-C子组的总非致命性心血管事件和死亡的相对治疗效果的显著异质性。在5,629名基线LDL-C水平≥100mg/dL的患者中,阿利珠单抗将非致命性心血管事件和死亡减少了255例。相比之下,在13,295名基线LDL-C<100mg/dL的患者中,阿利珠单抗将非致命性心血管事件和死亡减少了130例。
结论
总之,在跟踪持续的时间中位数为28个月的ACS患者中,用阿利珠单抗预防的死亡和非致命性CV事件的总数量是预防的第一事件数量的两倍。在非致命性和致命性事件风险之间存在强烈关联的情况下,阿利珠单抗减少了非致命性CV事件和死亡。达到的较低LDL-C与较少的死亡相关。
实施例8:二次分析-阿利珠单抗在糖尿病和前驱糖尿病ACS患者中的效果
另一组特别感兴趣的ACS患者是患有糖尿病和前驱糖尿病的那些患者,因为大多数ACS患者具有糖代谢异常。与没有糖尿病的ACS患者相比,患有糖尿病的ACS患者有更高的复发性缺血性心血管事件风险,并且从高强度他汀疗法或依泽替米贝加他汀疗法获得更大的绝对益处。在此预先指定的分析中,比较了阿利珠单抗或安慰剂在具有糖尿病、前驱糖尿病或血糖量正常的人中的CV功效和糖代谢安全性。
a.基线特征
在随机化时,5444名(28.8%)患者患有糖尿病,8246名(43.6%)患者患有前驱糖尿病,并且5234名(27.7%)患者具有正常血糖量。在每个糖代谢类别中,基线特征在阿利珠单抗和安慰剂组之间得到良好平衡。血糖量正常、前驱糖尿病和糖尿病患者的基线特征在表28中提供,并且按治疗组跨血糖层的基线特征在表29中提供。大多数患者进行了针对索引ACS事件的冠状动脉血运重建,并且接受了双重抗血小板剂、β-阻滞剂和肾素-血管紧张素系统抑制剂的循证治疗。跨糖代谢层观察到体重指数、非HDL胆固醇和甘油三酯的更高基线值以及更低水平的HDL胆固醇。不存在跨糖代谢层的LDL胆固醇水平梯度。
表28.血糖量正常、前驱糖尿病和糖尿病患者的基线特征
NSTEMI:非ST段抬高心肌梗塞;STEMI:ST段抬高心肌梗塞;UA:不稳定型心绞痛。
表29.按治疗组跨血糖层的基线特征
b.安慰剂组中按糖代谢状况的心血管事件
治疗16周后(意向治疗群体),在阿利珠单抗组和安慰剂组两者中,在三个血糖量正常、前驱糖尿病和糖尿病患者子组之间LDL-C、非HDL-C、HDL-C和甘油三酯水平都类似。在安慰剂组中,对于在基线具有糖尿病、前驱糖尿病和血糖量正常的那些患者,主要终点的比率分别为6.5、3.4和3.1/100人年(图26)。在安慰剂组中,尽管具有类似的脂质参数,但是糖尿病患者的MACE发生率增加。具有糖尿病对比血糖量正常和前驱糖尿病对比血糖量正常的那些患者中,主要终点的对应未经调整危险比分别为2.09(95%CI,1.78至2.46)和1.10(95%CI,0.93至1.30)(图27)。主要终点的各成分的类似数据在表30中提供。
表30.安慰剂组中主要终点的各成分的危险比
c.阿利珠单抗对脂质的影响
图26显示了每个治疗组在第4个月的脂质参数的中位数变化,按基线糖代谢类别分层。在第4个月时LDL-C自基线的变化在每个糖代谢类别中类似(在阿利珠单抗的情况下中位数为-64%至-65%;在安慰剂的情况下为+1.0%至0%)。
在阿利珠单抗治疗的患者中,在具有糖尿病、前驱糖尿病和血糖量正常的患者中在第4个月的中位数(四分位数1,四分位数3)LDL-C值分别为31mg/dL(20,47)、31mg/dL(21,49)和31mg/dL(21,50),相比于分配到安慰剂的患者的87mg/dL(71,107)、87mg/dL(72,107)和88mg/dL(73,107)。
d.根据糖代谢状况的阿利珠单抗对终点事件的影响
表31显示了按分配治疗和基线糖代谢状况的MACE发生率的预先指定的分析。在具有糖尿病(HR,0.84;95%CI,0.74至0.97)、前驱糖尿病(HR,0.86;95%CI,0.74至1.00)和血糖量正常(HR,0.85;95%CI,0.70至1.03)的患者中阿利珠单抗产生类似的主要终点风险相对降低,糖代谢状态和治疗无明显相互作用。然而,在基线时患有糖尿病的患者中,尽管进行强化他汀治疗,但是ACS后复发性缺血事件风险仍然很高。因此,与具有前驱糖尿病(-1.2%)或血糖量正常(-1.2%;P
表31.糖尿病、前驱糖尿病和血糖量正常的患者的预先指定的分析
中位随访:34个月。ARR:绝对降低风险;NA:不适用。
e.阿利珠单抗的血糖安全性
图28显示了阿利珠单抗在基线时无糖尿病的患者中以及分别在具有前驱糖尿病或血糖量正常的患者中对HbA1c、空腹血糖和新发糖尿病发生率的影响。在基线时无糖尿病的患者中,阿利珠单抗治疗导致与安慰剂相比较低的平均HbA1c(5.78%对比5.80%,P=0.0008)、类似的平均空腹血糖(5.67对比5.68mmol/L,P=0.84)以及无过多新发糖尿病风险(HR,1.00;95%CI,0.89至1.11)。当考虑在基线时前驱糖尿病或血糖量正常的单独类别时,结果类似。因此,与安慰剂相比,在阿利珠单抗的情况下未观察到空腹血清葡萄糖或HbA1c增加的证据。此外,在本研究持续时间内,与安慰剂相比,在阿利珠单抗的情况下未观察到新发糖尿病(预先指定的安全性终点)的总体增加(参见图28和表4)。
结论
在患有近期ACS的糖尿病、前驱糖尿病和血糖量正常的患者的预先指定的分析中,在患有近期ACS和糖尿病的患者中获得了向最大耐受他汀添加阿利珠单抗的最大绝对益处。对于患有近期ACS和糖尿病的这些患者,靶向LDL-C水平25-50mg/dl的阿利珠单抗治疗提供了患有糖尿病的患者中的心血管事件对比具有前驱糖尿病或血糖量正常的患者的大约两倍绝对减少。对于中位随访为2.8年和2405例有资格进行3-5年随访的无糖尿病患者,阿利珠单抗不会不利地影响血糖(HbA1c,空腹血糖)量度或增加新发糖尿病的风险。
实施例9:二次分析-阿利珠单抗在患有外周动脉疾病、脑血管疾病或两者的患者中的效果
在超过一个血管床中具有明显的动脉粥样硬化的患者具有高的重大不良心血管事件(MACE)和死亡风险。ODYSSEY OUTCOMES试验的二次分析分析了阿利珠单抗的益处是否受到多血管疾病的影响,所述多血管疾病被定义为冠状动脉疾病并发外周动脉疾病(PAD)、脑血管疾病(CeVD)或两者。中位随访为2.8年。
a.基线特征
在此分析中,基于其他明显的血管疾病的分布来定义患有近期ACS的患者的三个子组:1)单血管疾病(冠状动脉疾病而无已知的PAD或CeVD);2)两个血管床中的多血管疾病(冠状动脉疾病和PAD或CeVD);以及3)三个血管床中的多血管疾病(冠状动脉疾病和PAD与CeVD两者)。用ACS患者的以下四个子组进行了另外的敏感性分析:1)既无PAD也无CeVD;2)PAD,有或无并发CeVD;3)CeVD,有或无并发PAD;以及4)PAD和CeVD两者。PAD包括四肢动脉疾病或腹主动脉瘤。CeVD被定义为颈动脉内膜切除术、颈动脉支架术、既往中风或短暂性脑缺血发作史。
表32总结了患有单血管(冠状动脉)疾病、两个床中的多血管疾病(通过仅PAD和仅CeVD分开)和三个床中的多血管疾病的患者的基线特征。在基线时,17,370名患者患有单血管疾病(91.8%),1,405名患者患有两个血管床中的多血管疾病(7.4%;3.2%仅PAD和4.2%仅CeVD),并且149名患者患有三个血管床中的多血管疾病(0.8%)。与患有单血管疾病的患者相比,患有冠状动脉疾病和PAD、冠状动脉疾病和CeVD以及三床多血管疾病的那些患者年龄较大(中位年龄为58岁、62岁、62岁和66岁,p<0.0001);患有冠状动脉疾病和PAD或冠状动脉疾病和CeVD的那些患者相比于患有单血管疾病的那些患者(24.7%,p<0.0001)在某种程度上更可能是女性(分别为26.7%和33.2%)。在所有CeVD患者中,526例(66.2%)有中风史。与患有单血管(冠状动脉)疾病的患者相比,患有三个床中的多血管疾病的患者合并症较多,包括高血压、心肌梗塞和冠状动脉旁路移植术史(所有p<0.0001)。此外,患有三个床中的多血管疾病的患者对比患有单血管疾病的患者的糖尿病患病率较高(43.6%对比27.7%;p<0.0001),并且更可能是当前或从前吸烟者(81.9%对比64.9%;p<0.0001)。患有三个床中的多血管疾病的患者对比患有单血管疾病的患者有更多具有<60ml/min/1.73m
表32.按PAD或CeVD类别史的基线特征
值是中位数(四分位数1,四分位数3)或n(%)。NS=p>0.05。CABG=冠状动脉旁路移植术;CeVD=脑血管疾病;COPD=慢性阻塞性肺病;CV=心血管;GFR=肾小球滤过率;LDL-C=低密度脂蛋白胆固醇;LLT=降脂疗法;NSTEMI=非ST段抬高心肌梗塞;PAD=外周动脉疾病;STEMI=ST段抬高心肌梗塞。
表33.按PAD或CeVD类别史的基线特征
值是中位数(四分位数1,四分位数3)或列百分比。CABG,冠状动脉旁路移植术;CeVD,脑血管疾病;COPD,慢性阻塞性肺病;GFR,肾小球滤过率;LDL-C,低密度脂蛋白胆固醇;LLT,降脂疗法;NSTEMI,非ST段抬高心肌梗塞;PAD,外周动脉疾病;STEMI,ST段抬高心肌梗塞。
b.LDL-C降低
在基线时,中位LDL-C(四分位数1,四分位数3)在患有多血管疾病的患者中更高,患有单血管(冠状动脉)疾病的患者的值为86(73,103),患有冠状动脉疾病和PAD疾病的患者的值为91(76,108),患有冠状动脉疾病和CeVD的患者的值为90(75,109),并且患有三个床中的多血管疾病的患者的值为95mg/dl(80,115)(p<0.0001)。在安慰剂组中,在4个月时中位LDL-C在患有单血管疾病的患者中为87(72,106);在仅患有PAD的患者中为90(73,108);在仅患有CeVD的患者中为90(73,115);并且在患有三个床中的多血管疾病的患者中为93mg/dl(78,118)。在用阿利珠单抗治疗的患者中,在4个月时中位LDL-C在相同的四个血管疾病类别中为30(20,47);34(23,50);34(21,52);和31(20,42)。
c.主要MACE终点和全因死亡
总体而言,在ODYSSEY OUTCOMES试验中,安慰剂和阿利珠单抗组的MACE发生率分别为11.1%和9.5%,对应的绝对风险降低(ARR)为1.6%(95%置信区间[CI],0.7%,2.4%;p=0.0003)(13)。图29A显示,对MACE的此总体功效反映了根据患病血管床数量的绝对风险和ARR梯度。对于安慰剂组中具有一个、两个或三个患病血管床的患者,MACE的发生率分别为10.0%、22.2%和39.7%。在阿利珠单抗的情况下对应的ARR为1.4%(0.6%,2.3%)、1.9%(-2.4%,6.2%)和13.0%(-2.0%,28.0%),3向相互作用p=0.0012。对于所有患者需要治疗以预防一例MACE的对应数量(NNT)是64,对于患有单血管(冠状动脉)疾病的患者是69,对于患有两个床中的多血管疾病的患者是53,并且对于患有三个床中的多血管疾病的患者是8。
安慰剂和阿利珠单抗组的全因死亡的总体发生率分别为4.1%和3.5%,对应的ARR为0.6%(95%CI 0.2%,1.2%)。与MACE类似,图29B显示,对全因死亡的总体功效反映了在阿利珠单抗的情况下根据患病血管床数量的绝对风险和ARR梯度。在安慰剂组中,在一个、两个或三个患病血管床的情况下的死亡发生率分别为3.5%、10.0%和21.8%。在阿利珠单抗的情况下,对应的ARR为0.4%(-0.1,1.0)、1.3%(-a1.8%,4.3%)和16.2%(5.5,26.8),3向相互作用p=0.0025。对于所有患者用以预防死亡的对应NNT是163,对于患有单血管(冠状动脉)疾病的患者是236,对于患有两个床中的多血管疾病的患者是78,并且对于患有三个床中的多血管疾病的患者是6。
主要MACE终点和全因死亡的细节显示在表34和图30中,包括阿利珠单抗对比安慰剂的患有单血管(冠状动脉)疾病、两个床中的多血管疾病(通过PAD或CeVD分开)和三个床中的多血管疾病的患者的主要终点和全因死亡的事件总数以及对应的HR和ARR。表35显示了基于PAD或CeVD的四个重叠血管组的这些细节。
表34.按PAD或CeVD类别史的主要MACE终点和全因死亡
HR反映了在具有治疗、既往PAD和既往CeVD之间相互作用的模型中通过地理区域进行的分层。*基于时间中位数为2.8年的随访的观察发生率。
ARR=绝对风险降低;CeVD=脑血管疾病;CI=置信区间;HR=危险比;MACE=重大不良心血管事件;NNT=需要治疗的数量;PAD=外周动脉疾病。
表35.按PAD或CeVD类别史的主要MACE终点和全因死亡
HR和p值反映了通过地理区域进行的分层。
ARR,绝对风险降低;CeVD,脑血管疾病;CI,置信区间;HR,危险比;NNT,需要治疗的数量;PAD,外周动脉疾病。
d.安全性结果
总体而言,在阿利珠单抗和安慰剂组之间不良事件或实验室异常的发生率没有差异,除了在阿利珠单抗组中更常发生局部注射部位反应。表36显示了患有单血管(冠状动脉)疾病、两个床中的多血管疾病(通过PAD或CeVD分开)和三个床中的多血管疾病的患者的阿利珠单抗对比安慰剂的所有安全性终点。各组之间未观察到重大差异。
表36.安全性终点
值为n/N(%)或n(%)。
*根据以下中的一项或多项的存在定义新发糖尿病,通过糖尿病领域专家的盲法外部审查确认诊断:不良事件报告、糖尿病药物治疗新处方、两次糖化血红蛋白水平≥6.5%(并且基线水平<6.5%)或两次空腹血清葡萄糖水平≥126mg/dl(7.0mmol/l)(并且基线水平<126mg/dl)。
结论
在患有ACS且尽管进行强化他汀疗法仍血脂异常的患者中,患有多血管疾病(包括并发PAD、CeVD或两者的历史)的患者与显著更高的MACE和死亡风险相关。在这些患者中,用阿利珠单抗治疗导致ARR比无并发PAD或CeVD的患者更大(图30)。因此,患有多血管疾病的患者应当被认为是ACS后阿利珠单抗治疗的优选候选者。
实施例10:二次分析-阿利珠单抗在有既往冠状动脉旁路移植术的患者中的效果
a.按既往CABG状况的基线特征
有既往冠状动脉旁路移植术(CABG)的患者患有广泛的先天性冠状动脉和旁路移植动脉粥样硬化,并且有增加的CV事件和死亡风险。在ODYSSEY OUTCOMES试验的二次分析中,将患者按CABG状况分类:(1)无CABG(n=16896);(2)索引ACS后但随机化前CABG,包括44名在索引ACS之前也曾进行既往CABG的患者(索引CABG;n=1025);或(3)索引ACS之前CABG(既往CABG;n=1003)(表37)。与无既往CABG或索引CABG的患者相比,有既往CABG的那些患者年龄较大,女性频率较少,具有既往MI、中风、PAD、糖尿病和高血压的频率较大。此外,有既往CABG的那些患者具有非ST段抬高MI(NSTEMI)作为其索引ACS的频率更大,更可能接受肾素-血管紧张素系统(RAS)抑制剂并且不太可能接受β-阻滞剂。既往CABG患者以较小频率接受高剂量他汀,并且以较大频率接受其他降脂疗法(包括依泽替米贝),具有更高的基线LDL-C、非HDL-C、apoB和脂蛋白(a)值。在每个CABG类别内,在分配到阿利珠单抗或安慰剂治疗的那些患者之间在基线特征上没有显著差异。在无既往CABG的接受阿利珠单抗的那些患者(27.2%)、正进行针对ACS的CABG的那些患者(28.3%)和有既往CABG的那些患者(34.5%)中,按照方案随机化后,剂量从75mg盲法增加到150mg(表37)。根据方案对阿利珠单抗剂量进行盲法调整的患者的数量在每个CABG类别中是类似的(表37)。
表37.按既往CABG状况的基线特征
值是中位数(四分位数1,四分位数3)或列百分比。n.s.:p>0.05
NSTEMI,非ST段抬高心肌梗塞;STEMI,ST段抬高心肌梗塞;LDL-C,低密度脂蛋白胆固醇;HDL-C,高密度脂蛋白胆固醇;GFR,肾小球滤过率;COPD,慢性阻塞性肺病;CABG,冠状动脉旁路移植术;PAD,外周动脉疾病;CeVD,脑血管疾病;SC,皮下;Q2W,每两周一次。
b.按既往CABG状况的终点
在每个类别中,确定在阿利珠单抗的情况下的相对危险比(HR)、绝对风险降低(ARR)和需要治疗2.8年以预防1个主要终点(MACE)或死亡的数量(NNT)。有既往CABG的患者(27.7%)的主要复合终点的累积发生率显著高于在索引ACS住院治疗期间进行CABG的患者(7.1%)或未进行CABG的那些患者(9.5%)(表38和图31)。有既往CABG的患者也具有较高的主要终点的各成分的比率和次要终点的各成分的比率(表38)。
表38.按既往CABG状况的主要和次要终点
*反映针对性别、年龄、地理区域、糖尿病状况、吸烟状况、基线LDL-C、基线HDL-C、基线BMI、肾功能(GFR<60对比>=60mL/min/1.73m
阿利珠单抗降低了总研究群体的主要终点(HR 0.85[0.78-0.93]),每个CABG类别的相对风险降低一致(表39和图31)。相比之下,分别与索引CABG(0.9%[-2.3%,4.0%])和无既往CABG患者(1.3%[0.5%,2.2%])相比,在有既往CABG的患者(6.4%[0.9%,12.0%],NNT
次要终点的发现类似。根据CABG类别,在阿利珠单抗的情况下的相对风险降低没有异质性,除了缺血驱动的冠状动脉血运重建之外。与其他两个CABG类别相比,有既往CABG的患者中的次要终点风险的绝对降低在数值上更大,包括CHD死亡(3.0%对比0.5%和0%)、非致命性MI(2.2%对比1.2%和0%)、缺血性中风(2.2%对比-0.3%和0.4%)、冠状动脉血运重建(4.6%对比3.7%和0.7%)、研究者报告的PAD事件(2.8%对比0.3%和0.3%)、CV死亡(3.6%对比1.0%和0.1%)以及全因死亡(3.6%对比0.5%和0.4%)。在有既往CABG的患者中,预防一例死亡的NNT
表39.按随机化治疗并根据既往CABG状况的主要和次要终点
HR和HR相互作用p值反映了通过地理区域进行的分层。
结论
在患有近期ACS且尽管进行强化他汀疗法致动脉粥样硬化脂蛋白仍升高的患者中,有既往CABG的那些患者在阿利珠单抗治疗的情况下得到了致命性和非致命性心血管事件的较大的绝对减少。
实施例11:二次分析-阿利珠单抗在1型和2型心肌梗塞患者中的效果
用他汀和PCSK9抑制剂降低LDL胆固醇(LDL-C)降低了心肌梗塞(MI)的风险,但是对特定类型MI的影响尚不清楚。在ODYSSEY OUTCOMES试验的预先指定的分析中,在患有近期急性冠状动脉综合征(ACS)和尽管进行强化他汀疗法LDL-C仍升高的随机化到接受PCSK9抑制剂阿利珠单抗或安慰剂并且针对心血管结果进行跟踪的患者中的各MI类型(根据第3通用定义)的发生率和结果。总体而言,随机化后MI发生在1383名(7.3%)患者中(总共1860例MI)。其中,991例(71.7%)患者共有1223例1型MI(42例被认为致命),287例(20.1%)共有386例2型MI(1例被认为致命),225例(16.3%)具有4型MI,并且其余7例(<0.01%)具有3型或5型MI。
1型和2型MI患者的基线特征显示在表40中。与2型MI患者相比,1型MI患者年龄较大,更可能是女性,更可能是黑人,来自北美或欧洲,并且具有高血压、充血性心力衰竭、肺部疾病、糖尿病和恶性疾病史。MI患者的LDL-C、Lp(a)和高敏C反应蛋白(hsCRP)水平高于无MI患者。LDL-C和hsCRP在患有1型或2型MI的那些患者之间无差异,但是2型MI患者的Lp(a)较高。
表40. 1型和2型心肌梗塞患者的基线特征
值是中位数(四分位数1,四分位数3)或列百分比。n.s.:p>0.05
ACE,血管紧张素转换酶;ARB,血管紧张素II受体阻滞剂;CABG,冠状动脉旁路移植术;CHF,充血性心力衰竭;COPD,慢性阻塞性肺病;CV,心血管;LDL-C=低密度脂蛋白胆固醇;LLT,降脂疗法;NSTEMI,非ST段抬高心肌梗塞;PAD,外周动脉疾病;PCI,经皮冠状动脉介入治疗;STEMI,ST段抬高心肌梗塞。
图33显示了用阿利珠单抗和安慰剂治疗的患者中1型和2型MI随时间的发生的Kaplan-Meier曲线。对于1型MI,最高风险是在前12个月,然后曲线发散,之后年风险降低。对于2型MI,存在随时间的相对一致的风险,分散开始于大约6个月。
阿利珠单抗对每种类型MI的影响显示在表41中。总体而言,与安慰剂相比,阿利珠单抗减少了所有MI的发生(7.9%安慰剂对比6.8%阿利珠单抗,HR 0.85,95%CI 0.77-0.95,p=0.003)。1型MI(HR 0.87,95%CI0.77-0.99,p=0.0317)和2型MI(HR 0.77,95%CI0.61-0.97,p=0.0251)均降低。未观察到阿利珠单抗治疗对MI类型3-5的影响。对于4型MI,HR为0.94(CI 0.72-1.22,p=0.62)。
大多数MI(82.7%)为非STEMI(ST段抬高心肌梗塞),并且阿利珠单抗显著降低了这些MI(HR 0.82(CI 0.72,0.93),p=0.0020)。对STEMI没有显著影响。Q波MI是具有可判断的ECG患者的少数(10.5%)。在Q波MI中未观察到阿利珠单抗的效果,而对于非Q波MI,在阿利珠单抗的情况下有所减少。(HR 0.86,CI 0.76,0.97),p=0.0130。表42显示了各心肌梗塞类型和阿利珠单抗影响的敏感性分析,其包括在第1天死亡的患者(阿利珠单抗n=7;安慰剂n=11)。
表41:心肌梗塞的类型和阿利珠单抗的影响
NSTEMI,非ST段抬高心肌梗塞;STEMI,ST段抬高心肌梗塞
表42.各心肌梗塞类型和阿利珠单抗影响的敏感性分析,包括死亡日期的事件
表43显示了在不同分界点阿利珠单抗对生物标志物水平(主要是心肌肌钙蛋白(92%))的影响。阿利珠单抗治疗与较小MI的无明显降低相关(峰值生物标志物水平<正常上限的3倍),但是与较大MI的大幅降低相关,如由峰值生物标志物值所定义的。
表43.按生物标志物升高水平的第一MI
CI,置信区间;HR,危险比;MI,心肌梗塞。
a.1型和2型心肌梗塞的预测因子
1型MI的候选预测因子是年龄类别、人种、区域、索引事件、在随机化时的降脂疗法、LDL-C、HDL-C、Lp(a)、BMI、GFR、糖尿病、高血压、心肌梗塞、中风、PCI、COPD、CABG、PAD、CHF、针对索引事件的血运重建和阿利珠单抗治疗(传统Cox模型中的显著预测因子(p<0.05))。
2型MI的候选预测因子是年龄类别、女性、人种、区域、索引事件、在随机化时的降脂疗法、LDL-C、HDL-C、Lp(a)、BMI、GFR、当前吸烟者、糖尿病、高血压、心肌梗塞、中风、恶性疾病、PCI、COPD、CABG、PAD、CHF、针对索引事件的血运重建和阿利珠单抗治疗(传统Cox模型中的显著预测因子(p<0.05))。表44和45分别显示了1型和2型MI的多变量预测模型。
表44. 1型MI的多变量预测模型
表45. 2型MI的多变量预测模型
两种MI类型的大多数显著因子类似。然而,LDL-C、在索引事件时的血运重建、当前吸烟、人种和先前中风对于1型MI是显著的,但是对于2型MI不是显著的。此外,年龄类别、慢性阻塞性肺病史和基线HDL-C水平对于2型MI是显著的,而对于1型MI不是显著的。
b.1型和2型心肌梗塞患者的死亡率
随机化后2型MI患者的死亡率(n=283,25.4%)是随机化后1型MI患者的死亡率(n=73,11.9%)的两倍。阿利珠单抗降低了2型MI的频率,但是并未降低2型MI后的死亡率(24.8%对比25.9%)。相比之下,阿利珠单抗与安慰剂相比降低了1型MI后的死亡率(10.2%对比13.4%)。
图34显示了随访期间1型MI或2型MI的森林图,作为全因死亡的预测因子。在针对治疗和预后因素进行调整后,对1型MI有显著影响,p=0.03,但是对2型MI没有显著影响,p=0.61。
图35显示了在1型或2型MI发生之前和之后全因死亡、心血管死亡和非心血管死亡的森林图。MI前全因死亡的发生率在1型和2型梗塞两者中类似,但是2型MI后高至1型MI后的大约两倍。在阿利珠单抗的情况下1型MI后全因死亡的减少为47/463(10.2%)对比安慰剂组的71/528(13.4%),HR 0.69(CI 0.48,1.00)。2型MI后,阿利珠单抗对死亡率没有明显影响,阿利珠单抗31/125(24.8%)对比42/162(25.9%)HR 0.98(CI 0.62,1.56)。
1型和2型MI两者的MI前心血管死亡率类似。2型MI后的心血管死亡率高于1型MI后的心血管死亡率。对于任何一种类型的MI,阿利珠单抗对心血管死亡率没有影响。对于非心血管死亡,1型和2型MI两者的MI前比率类似。MI后,2型MI患者的非心血管死亡率比1型MI患者高3-4倍。阿利珠单抗对1型或2型MI的非心血管死亡没有影响。
结论
在患有ACS且尽管进行强化他汀疗法LDL-C仍升高的患者中,阿利珠单抗降低了1型和2型MI两者的发生率,并且降低了1型MI的死亡率,指示LDL-C降低至他汀可达到的水平以下是两种类型的MI的有效预防策略。
实施例12:高风险患者对比非常高风险患者中急性冠状动脉综合征后阿利珠单抗的心血管功效
根据2018ACC/AHA指南,在被归类为对未来动脉粥样硬化性心血管疾病(ASCVD)事件具有“非常高风险”的ODYSSEY OUTCOMES患者中检查复合缺血事件的频率和用阿利珠单抗抑制PCSK9的功效。(Grundy SM等人JACC(2018)(印刷中-2018年11月10日可在线获得))。
基于2018ACC/AHA指南标准,共有11,935名(63%)患者被分类为非常高风险,并且6,989名(37%)患者没有非常高风险。“非常高风险”的标准包括既往(在索引ACS事件之前)缺血事件(其中19.2%的患者有既往心肌梗塞(MI),2.8%有既往缺血性中风,并且4.0%有既往PAD)或存在多种高风险临床状况(26.9%为≥65岁,28.8%患有糖尿病,13.4%患有慢性肾病,并且24.1%是当前吸烟者)。
阿利珠单抗治疗与具有高风险特征的患者对比没有非常高风险特征的患者中MACE事件风险的一致相对降低相关(表46)。然而,在阿利珠单抗的情况下MACE的绝对风险和MACE事件的绝对减少在被分类为非常高风险的患者中更高,在具有多例既往缺血事件的那些患者中的绝对益处与仅具有其他高风险临床状况的那些患者相比加重。
表46.到首次发生主要终点的时间
结论
应用“非常高风险”的2018ACC/AHA胆固醇指南标准准确地鉴定具有ACS和血脂异常的患者,其从阿利珠单抗治疗中获得较大的绝对益处。基于多例既往缺血事件分类为非常高风险的患者从此方法中获得特别大的益处。
实施例13.阿利珠单抗的根据背景他汀治疗的效果
在此分析中,在具有不同他汀疗法背景的ODYSSEY OUTCO MES患者中比较了阿利珠单抗或安慰剂的功效。在随机化时,将所有18,924名患者按背景他汀疗法分类:高强度(阿托伐他汀40-80mg/d或罗苏伐他汀20-40mg/d)(n=16,811,88.8%);低强度或中等强度(阿托伐他汀<40mg/d或罗苏伐他汀<20mg/d)(n=1653,8.7%);或不使用他汀(n=460,2.4%)。在所述研究中,在他汀不耐受的情况下不允许背景他汀,这是用有记录的对≥2种他汀的不耐受建立的。确定所有患者组的MACE的相对风险(危险比[HR])和绝对风险降低(ARR)。
跨他汀类别的危险比(HR)是一致的(表47)。基线LDL-C跨高强度、低强度/中等强度和无他汀类别增加。在安慰剂组中存在跨这些类别的MACE风险梯度(分别为10.8%、10.7%和26%)。在阿利珠单抗治疗的情况下,LDL-C自基线到第4个月的平均降低跨三个类别更高(分别为-1.37mmol/L、-1.47mmol/L和-2.27mmol/L),并且跨类别的MACE的ARR分别为1.3%、3.2%和8.0%(P
表47.按他汀疗法的强度分层的LDL-C值和MACE事件。
结论
在ODYSSEY OUTCOMES患者中,未接受他汀治疗的那些患者显示与接受他汀治疗的患者相比,在阿利珠单抗治疗的情况下的平均基线LDL-C更高(3.82mmol/L)且LDL-C平均绝对降低更大(-2.27mmol/L)。与接受高强度他汀治疗的那些患者(1.3%(0.3-2.2)P
序列表
<110> 赛诺菲生物技术公司
再生元制药公司
<120> PCSK9抑制剂用于降低心血管风险的用途
<130> 610348:SA9-234PC
<160> 198
<170> PatentIn version 3.5
<210> 1
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成多肽
<400> 1
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn Asn Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Asp Trp Val
35 40 45
Ser Thr Ile Ser Gly Ser Gly Gly Thr Thr Asn Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Ile Ile Ser Arg Asp Ser Ser Lys His Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Ser Asn Trp Gly Asn Phe Asp Leu Trp Gly Arg Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 2
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 2
Gly Phe Thr Phe Asn Asn Tyr Ala
1 5
<210> 3
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 3
Ile Ser Gly Ser Gly Gly Thr Thr
1 5
<210> 4
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 4
Ala Lys Asp Ser Asn Trp Gly Asn Phe Asp Leu
1 5 10
<210> 5
<211> 447
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的REGN727重链
多肽
<400> 5
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn Asn Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Asp Trp Val
35 40 45
Ser Thr Ile Ser Gly Ser Gly Gly Thr Thr Asn Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Ile Ile Ser Arg Asp Ser Ser Lys His Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Ser Asn Trp Gly Asn Phe Asp Leu Trp Gly Arg Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 6
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成多肽
<400> 6
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Val Leu Tyr Arg
20 25 30
Ser Asn Asn Arg Asn Phe Leu Gly Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Asn Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Thr Thr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 7
<211> 12
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 7
Gln Ser Val Leu Tyr Arg Ser Asn Asn Arg Asn Phe
1 5 10
<210> 8
<211> 3
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 8
Trp Ala Ser
1
<210> 9
<211> 220
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的REGN727轻链
多肽
<400> 9
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Val Leu Tyr Arg
20 25 30
Ser Asn Asn Arg Asn Phe Leu Gly Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Asn Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Thr Thr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile
100 105 110
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
115 120 125
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
130 135 140
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
145 150 155 160
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
165 170 175
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
180 185 190
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
195 200 205
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215 220
<210> 10
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 10
Gln Gln Tyr Tyr Thr Thr Pro Tyr Thr
1 5
<210> 11
<211> 127
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成多肽
<400> 11
Glu Met Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser His
20 25 30
Trp Met Lys Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asn Ile Asn Gln Asp Gly Ser Glu Lys Tyr Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Ile Val Leu Met Val Tyr Asp Met Asp Tyr Tyr Tyr Tyr
100 105 110
Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 12
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 12
Gly Phe Thr Phe Ser Ser His Trp
1 5
<210> 13
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 13
Ile Asn Gln Asp Gly Ser Glu Lys
1 5
<210> 14
<211> 20
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 14
Ala Arg Asp Ile Val Leu Met Val Tyr Asp Met Asp Tyr Tyr Tyr Tyr
1 5 10 15
Gly Met Asp Val
20
<210> 15
<211> 112
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成多肽
<400> 15
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Asn Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Thr
85 90 95
Leu Gln Thr Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 16
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 16
Gln Ser Leu Leu His Ser Asn Gly Asn Asn Tyr
1 5 10
<210> 17
<211> 3
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 17
Leu Gly Ser
1
<210> 18
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 18
Met Gln Thr Leu Gln Thr Pro Leu Thr
1 5
<210> 19
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 19
Gly Phe Thr Phe Ser Ser His Trp
1 5
<210> 20
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 20
Ile Asn Gln Asp Gly Ser Glu Lys
1 5
<210> 21
<211> 20
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 21
Ala Arg Asp Ile Val Leu Met Val Tyr Asp Met Asp Tyr Tyr Tyr Tyr
1 5 10 15
Gly Met Asp Val
20
<210> 22
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 22
Gln Ser Leu His His Ser Asn Gly Asn Asn Tyr
1 5 10
<210> 23
<211> 3
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 23
Leu Gly Ser
1
<210> 24
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 24
Met Gln Thr Leu Gln Thr Pro Leu Thr
1 5
<210> 25
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 25
Gly Phe Thr Phe Ser Ser His Trp
1 5
<210> 26
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 26
Ile Asn Gln Asp Gly Ser Glu Lys
1 5
<210> 27
<211> 20
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 27
Ala Arg Asp Ile Val Leu Met Val Tyr His Met Asp Tyr Tyr Tyr Tyr
1 5 10 15
Gly Met Asp Val
20
<210> 28
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 28
Gln Ser Leu Leu His Ser Asn Gly Asn Asn Tyr
1 5 10
<210> 29
<211> 3
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 29
Leu Gly Ser
1
<210> 30
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 30
Met Gln Thr Leu Gln Thr Pro Leu Thr
1 5
<210> 31
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 31
Gly Phe Thr Phe Ser Ser His Trp
1 5
<210> 32
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 32
Ile Asn Gln Asp Gly Ser Glu Lys
1 5
<210> 33
<211> 20
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 33
Ala Arg Asp Ile Val Leu Met Val Tyr His Met Asp Tyr Tyr Tyr Tyr
1 5 10 15
Gly Met Asp Val
20
<210> 34
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 34
Gln Ser Leu His His Ser Asn Gly Asn Asn Tyr
1 5 10
<210> 35
<211> 3
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 35
Leu Gly Ser
1
<210> 36
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 36
Met Gln Thr Leu Gln Thr Pro Leu Thr
1 5
<210> 37
<211> 131
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的VH;m2CX1D05
多肽
<400> 37
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Asn Ser His
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Asn Pro Ile Leu Gly Ile Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg His Tyr Glu Ile Gln Ile Gly Arg Tyr Gly Met Asn Val Tyr
100 105 110
Tyr Leu Met Tyr Arg Phe Ala Ser Trp Gly Gln Gly Thr Leu Val Thr
115 120 125
Val Ser Ser
130
<210> 38
<211> 10
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的VH CDR1;m2CX1D05
肽
<400> 38
Gly Gly Thr Phe Asn Ser His Ala Ile Ser
1 5 10
<210> 39
<211> 20
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的VH CDR2;m2CX1D05
肽
<400> 39
Trp Met Gly Gly Ile Asn Pro Ile Leu Gly Ile Ala Asn Tyr Ala Gln
1 5 10 15
Lys Phe Gln Gly
20
<210> 40
<211> 22
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的VH CDR3;m2CX1D05
肽
<400> 40
His Tyr Glu Ile Gln Ile Gly Arg Tyr Gly Met Asn Val Tyr Tyr Leu
1 5 10 15
Met Tyr Arg Phe Ala Ser
20
<210> 41
<211> 213
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的LC;m2CX1D05
多肽
<400> 41
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Ser Ala
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asn Gly Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Phe Asp Gly Asp Pro Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala Pro
100 105 110
Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr
115 120 125
Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys
130 135 140
Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu
145 150 155 160
Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser
165 170 175
Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala
180 185 190
Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe
195 200 205
Asn Arg Gly Glu Ala
210
<210> 42
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的VL CDR 1;m2CX1D05
肽
<400> 42
Arg Ala Ser Gln Gly Ile Arg Ser Ala Leu Asn
1 5 10
<210> 43
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的VL CDR2;m2CX1D05
肽
<400> 43
Leu Leu Ile Tyr Asn Gly Ser Thr Leu Gln Ser
1 5 10
<210> 44
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的VL CDR3;m2CX1D05
肽
<400> 44
Gln Gln Phe Asp Gly Asp Pro
1 5
<210> 45
<211> 119
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的VH;1B20
多肽
<400> 45
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Asn Tyr
20 25 30
Trp Ile Ser Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Tyr Pro Gly Asp Ser Tyr Thr Asn Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Asp Tyr Trp Tyr Lys Pro Leu Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 46
<211> 10
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的VH CDR1;1B20
肽
<400> 46
Gly Tyr Ser Phe Thr Asn Tyr Trp Ile Ser
1 5 10
<210> 47
<211> 20
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的VH CDR2;1B20
肽
<400> 47
Trp Met Gly Ile Ile Tyr Pro Gly Asp Ser Tyr Thr Asn Tyr Ser Pro
1 5 10 15
Ser Phe Gln Gly
20
<210> 48
<211> 10
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的VH CDR3;1B20
肽
<400> 48
Asp Tyr Trp Tyr Lys Pro Leu Phe Asp Ile
1 5 10
<210> 49
<211> 220
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的LC;1B20
多肽
<400> 49
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ser Asn Asn Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Ser Ser Phe Pro Ile Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
115 120 125
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
130 135 140
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
145 150 155 160
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
165 170 175
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
180 185 190
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
195 200 205
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Ala
210 215 220
<210> 50
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的VL CDR1;1B20
肽
<400> 50
Arg Ser Ser Gln Ser Val Leu Tyr Ser Ser Asn Asn Lys Asn Tyr Leu
1 5 10 15
Ala
<210> 51
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的VL CDR2;1B20
肽
<400> 51
Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser
1 5 10
<210> 52
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的VL CDR3;1B20
肽
<400> 52
Gln Gln Tyr Ser Ser Phe Pro Ile
1 5
<210> 53
<211> 120
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的可变重链
抗体区多肽
<400> 53
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Ser Tyr
20 25 30
Gly Met Tyr Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Asp Pro Gly Ser Gly Gly Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Arg Tyr Gly Tyr Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser
115 120
<210> 54
<211> 16
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的AX132重链
CDR1抗体区肽
<400> 54
Lys Ala Ser Gly Tyr Thr Phe Ser Ser Tyr Gly Met Tyr Trp Val Arg
1 5 10 15
<210> 55
<211> 23
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的AX132重链
CDR2抗体区肽
<400> 55
Trp Ile Gly Trp Ile Asp Pro Gly Ser Gly Gly Thr Lys Tyr Asn Glu
1 5 10 15
Lys Phe Lys Gly Lys Ala Thr
20
<210> 56
<211> 15
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的AX132重链
CDR3抗体区肽
<400> 56
Cys Ala Arg Glu Arg Tyr Gly Tyr Tyr Phe Asp Tyr Trp Gly Gln
1 5 10 15
<210> 57
<211> 108
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的可变轻链
抗体区多肽
<400> 57
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Ile Thr Cys Arg Ala Ser Gln Tyr Val Gly Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Val Trp Asp Ser Ser Pro Pro
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 58
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的AX213和AX132
轻链CDR1抗体区肽
<400> 58
Ile Thr Cys Arg Ala Ser Gln Tyr Val Gly Ser Tyr Leu Asn Trp Tyr
1 5 10 15
Gln
<210> 59
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的AX213和AX132
轻链CDR2抗体区肽
<400> 59
Leu Ile Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro
1 5 10
<210> 60
<211> 16
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的AX132和AX213轻
链CDR3抗体区肽
<400> 60
Tyr Tyr Cys Gln Val Trp Asp Ser Ser Pro Pro Val Val Phe Gly Gly
1 5 10 15
<210> 61
<211> 120
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的可变重链
抗体区多肽
<400> 61
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Arg Tyr
20 25 30
Gly Ile Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asp Pro Gly Asn Gly Gly Thr Arg Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Asn Asp Gly Tyr Ser Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser
115 120
<210> 62
<211> 16
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的AX213重链
CDR1抗体区肽
<400> 62
Lys Ala Ser Gly Tyr Thr Phe Ser Arg Tyr Gly Ile Asn Trp Val Arg
1 5 10 15
<210> 63
<211> 23
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的AX213重链
CDR2抗体区肽
<400> 63
Trp Ile Gly Arg Ile Asp Pro Gly Asn Gly Gly Thr Arg Tyr Asn Glu
1 5 10 15
Lys Phe Lys Gly Lys Ala Thr
20
<210> 64
<211> 15
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的AX213重链
CDR3抗体区肽
<400> 64
Cys Ala Arg Ala Asn Asp Gly Tyr Ser Phe Asp Tyr Trp Gly Gln
1 5 10 15
<210> 65
<211> 108
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的可变轻链
抗体区多肽
<400> 65
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Ile Thr Cys Arg Ala Ser Gln Tyr Val Gly Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Val Trp Asp Ser Ser Pro Pro
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 66
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的AX213和AX132
轻链CDR1抗体区肽
<400> 66
Ile Thr Cys Arg Ala Ser Gln Tyr Val Gly Ser Tyr Leu Asn Trp Tyr
1 5 10 15
Gln
<210> 67
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的AX213和AX132
轻链CDR2抗体区肽
<400> 67
Leu Ile Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro
1 5 10
<210> 68
<211> 16
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的AX132和AX213轻
链CDR3抗体区肽
<400> 68
Tyr Tyr Cys Gln Val Trp Asp Ser Ser Pro Pro Val Val Phe Gly Gly
1 5 10 15
<210> 69
<211> 119
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的AX1 VH抗体
序列多肽
<400> 69
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Lys Ala Ser Gly Phe Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asn Pro Asp Ser Gly Ser Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Ala Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Arg Leu Ser Trp Asp Phe Asp Val Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 70
<211> 16
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的AX1 VH CDR1
抗体序列肽
<400> 70
Lys Ala Ser Gly Phe Thr Phe Thr Ser Tyr Tyr Met His Trp Val Arg
1 5 10 15
<210> 71
<211> 23
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的AX1 VH CDR2
抗体序列肽
<400> 71
Trp Ile Gly Arg Ile Asn Pro Asp Ser Gly Ser Thr Lys Tyr Asn Glu
1 5 10 15
Lys Phe Lys Gly Arg Ala Thr
20
<210> 72
<211> 16
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的AX1 VH CDR3
抗体序列肽
<400> 72
Cys Ala Arg Gly Gly Arg Leu Ser Trp Asp Phe Asp Val Trp Gly Gln
1 5 10 15
<210> 73
<211> 109
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的AX1 VL抗体
序列多肽
<400> 73
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Arg Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Ala Ala Tyr Asp Tyr Ser Leu Gly
85 90 95
Gly Tyr Val Phe Gly Asp Gly Thr Lys Val Glu Ile Lys
100 105
<210> 74
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的AX1 VL CDR1
抗体序列肽
<400> 74
Arg Ala Ser Gln Asp Ile Ser Arg Tyr Leu Ala
1 5 10
<210> 75
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的AX1 AX9 AX189 VL
CDR2抗体序列肽
<400> 75
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 76
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的AX1 VL CDR3
抗体序列肽
<400> 76
Ala Ala Tyr Asp Tyr Ser Leu Gly Gly Tyr Val
1 5 10
<210> 77
<211> 121
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的AX9 AX189 VH
抗体序列多肽
<400> 77
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Ser Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asp Pro Tyr Asn Gly Gly Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Tyr Gly Tyr Tyr Leu Gly Ser Tyr Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 78
<211> 16
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的AX9 AX189 VH CDR1
抗体序列肽
<400> 78
Lys Ala Ser Gly Tyr Thr Phe Ser Ser Tyr Trp Met His Trp Val Arg
1 5 10 15
<210> 79
<211> 23
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的AX9 AX189 VH CDR2
抗体序列肽
<400> 79
Trp Ile Gly Arg Ile Asp Pro Tyr Asn Gly Gly Thr Lys Tyr Asn Glu
1 5 10 15
Lys Phe Lys Gly Lys Ala Thr
20
<210> 80
<211> 18
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的AX9 AX189 VH CDR3
抗体序列肽
<400> 80
Cys Ala Arg Tyr Gly Tyr Tyr Leu Gly Ser Tyr Ala Met Asp Tyr Trp
1 5 10 15
Gly Gln
<210> 81
<211> 109
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的AX189 VL抗体
序列多肽
<400> 81
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Arg Tyr
20 25 30
Leu Thr Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Ala Tyr Asp Tyr Ser Leu Ser
85 90 95
Gly Tyr Val Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 82
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的AX189 VL CDR1
抗体序列肽
<400> 82
Arg Ala Ser Gln Asp Val Ser Arg Tyr Leu Thr
1 5 10
<210> 83
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的AX1 AX9 AX189 VL
CDR2抗体序列肽
<400> 83
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 84
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的AX189 VL CDR3
抗体序列肽
<400> 84
Gln Ala Tyr Asp Tyr Ser Leu Ser Gly Tyr Val
1 5 10
<210> 85
<211> 115
<212> PRT
<213> 智人(Homo sapiens)
<400> 85
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Leu Thr Ser Tyr
20 25 30
Gly Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Val Ser Phe Tyr Asn Gly Asn Thr Asn Tyr Ala Gln Lys Leu
50 55 60
Gln Gly Arg Gly Thr Met Thr Thr Asp Pro Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Tyr Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 86
<211> 5
<212> PRT
<213> 智人(Homo sapiens)
<400> 86
Ser Tyr Gly Ile Ser
1 5
<210> 87
<211> 17
<212> PRT
<213> 智人(Homo sapiens)
<400> 87
Trp Val Ser Phe Tyr Asn Gly Asn Thr Asn Tyr Ala Gln Lys Leu Gln
1 5 10 15
Gly
<210> 88
<211> 6
<212> PRT
<213> 智人(Homo sapiens)
<400> 88
Gly Tyr Gly Met Asp Val
1 5
<210> 89
<211> 109
<212> PRT
<213> 智人(Homo sapiens)
<400> 89
Gln Ser Ala Leu Thr Gln Pro Ala Ser Val Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Ile Thr Ile Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Ser Val Ser Trp Tyr Gln Gln His Pro Gly Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Ser Asn Arg Pro Ser Gly Val Ser Asn Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Ile Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Asn Ser Tyr Thr Ser Thr
85 90 95
Ser Met Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 90
<211> 14
<212> PRT
<213> 智人(Homo sapiens)
<400> 90
Thr Gly Thr Ser Ser Asp Val Gly Gly Tyr Asn Ser Val Ser
1 5 10
<210> 91
<211> 7
<212> PRT
<213> 智人(Homo sapiens)
<400> 91
Glu Val Ser Asn Arg Pro Ser
1 5
<210> 92
<211> 9
<212> PRT
<213> 智人(Homo sapiens)
<400> 92
Asn Ser Tyr Thr Ser Thr Ser Met Val
1 5
<210> 93
<211> 123
<212> PRT
<213> 智人(Homo sapiens)
<400> 93
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ser Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Ser Ser Ser Ser Tyr Ile Ser Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Arg Asp Tyr Asp Phe Trp Ser Ala Tyr Tyr Asp Ala Phe Asp Val
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 94
<211> 10
<212> PRT
<213> 智人(Homo sapiens)
<400> 94
Gly Phe Thr Phe Ser Ser Tyr Ser Met Asn
1 5 10
<210> 95
<211> 17
<212> PRT
<213> 智人(Homo sapiens)
<400> 95
Ser Ile Ser Ser Ser Ser Ser Tyr Ile Ser Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 96
<211> 14
<212> PRT
<213> 智人(Homo sapiens)
<400> 96
Asp Tyr Asp Phe Trp Ser Ala Tyr Tyr Asp Ala Phe Asp Val
1 5 10
<210> 97
<211> 111
<212> PRT
<213> 智人(Homo sapiens)
<400> 97
Gln Ser Val Leu Thr Gln Pro Pro Ser Val Ser Gly Ala Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile Gly Ala Gly
20 25 30
Tyr Asp Val His Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu
35 40 45
Leu Ile Ser Gly Asn Ser Asn Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Ser Ser
85 90 95
Leu Ser Gly Ser Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 98
<211> 14
<212> PRT
<213> 智人(Homo sapiens)
<400> 98
Thr Gly Ser Ser Ser Asn Ile Gly Ala Gly Tyr Asp Val His
1 5 10
<210> 99
<211> 7
<212> PRT
<213> 智人(Homo sapiens)
<400> 99
Gly Asn Ser Asn Arg Pro Ser
1 5
<210> 100
<211> 11
<212> PRT
<213> 智人(Homo sapiens)
<400> 100
Gln Ser Tyr Asp Ser Ser Leu Ser Gly Ser Val
1 5 10
<210> 101
<211> 114
<212> PRT
<213> 智人(Homo sapiens)
<400> 101
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Ala Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Tyr Tyr Asp Gly Ile Asn Lys His Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Gly Leu Asp Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 102
<211> 10
<212> PRT
<213> 智人(Homo sapiens)
<400> 102
Gly Phe Thr Phe Ser Ser Tyr Gly Met His
1 5 10
<210> 103
<211> 17
<212> PRT
<213> 智人(Homo sapiens)
<400> 103
Val Ile Tyr Tyr Asp Gly Ile Asn Lys His Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 104
<211> 5
<212> PRT
<213> 智人(Homo sapiens)
<400> 104
Asp Arg Gly Leu Asp
1 5
<210> 105
<211> 113
<212> PRT
<213> 智人(Homo sapiens)
<400> 105
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ser Asn Ser Lys Asn Tyr Leu Val Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Ser Thr Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 106
<211> 17
<212> PRT
<213> 智人(Homo sapiens)
<400> 106
Lys Ser Ser Gln Ser Val Leu Tyr Ser Ser Asn Ser Lys Asn Tyr Leu
1 5 10 15
Val
<210> 107
<211> 7
<212> PRT
<213> 智人(Homo sapiens)
<400> 107
Trp Ala Ser Thr Arg Glu Ser
1 5
<210> 108
<211> 9
<212> PRT
<213> 智人(Homo sapiens)
<400> 108
Gln Gln Tyr Tyr Ser Thr Pro Trp Thr
1 5
<210> 109
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的抗PCSK9
单克隆抗体pJG04(克隆LGT-209和LGT-210)Vh重
链可变区(FR1-FR4)多肽
<400> 109
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Thr Met
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Ala Asn Glu His Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Thr Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Tyr Tyr Tyr Tyr Asn Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 110
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的抗PCSK9
单克隆抗体克隆LGT-209、LGT-210和LGT-211重
链CDR1肽
<400> 110
Thr Met Tyr Met Ser
1 5
<210> 111
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的抗PCSK9
单克隆抗体克隆LGT-209、LGT-210和LGT-211重
链CDR2肽
<400> 111
Arg Ile Asp Pro Ala Asn Glu His Thr Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 112
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的抗PCSK9
单克隆抗体pJG04(克隆LGT-209和LGT-210)Vh重
链互补决定区3(CDR3)肽
<400> 112
Ser Tyr Tyr Tyr Tyr Asn Met Asp Tyr
1 5
<210> 113
<211> 106
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的抗PCSK9
单克隆抗体pJG10(克隆LGT-209和LGT-211) Vk轻
链可变区(FR1-FR4)多肽
<400> 113
Gln Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr
35 40 45
Gly Val Phe Arg Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Gly Arg Leu Glu Pro Glu
65 70 75 80
Asp Phe Ala Val Tyr Tyr Cys Leu Gln Trp Ser Ser Asp Pro Pro Thr
85 90 95
Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 114
<211> 10
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的抗PCSK9
单克隆抗体克隆LGT-209、LGT-210和LGT-211轻
链CDR1肽
<400> 114
Arg Ala Ser Gln Ser Val Ser Tyr Met His
1 5 10
<210> 115
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的抗PCSK9
单克隆抗体克隆LGT-209、LGT-210和LGT-211轻
链CDR1肽
<400> 115
Gly Val Phe Arg Arg Ala Thr
1 5
<210> 116
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的小鼠抗PCSK9
单克隆抗体LFU720和抗PCSK9单克隆抗体
克隆LGT-209、LGT-210和LGT-211轻链CDR3肽
<400> 116
Leu Gln Trp Ser Ser Asp Pro Pro Thr
1 5
<210> 117
<211> 118
<212> PRT
<213> 智人(Homo sapiens)
<400> 117
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Ile Ser Pro Phe Gly Gly Arg Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Arg Pro Leu Tyr Ala Ser Asp Leu Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 118
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 118
Gly Tyr Thr Phe Thr Ser Tyr
1 5
<210> 119
<211> 6
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 119
Ser Pro Phe Gly Gly Arg
1 5
<210> 120
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的可变重
链CDR肽
<400> 120
Glu Arg Pro Leu Tyr Ala Ser Asp Leu
1 5
<210> 121
<211> 107
<212> PRT
<213> 智人(Homo sapiens)
<400> 121
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Ala
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Arg Tyr Ser Leu Trp Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 122
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的可变轻
链CDR肽
<400> 122
Arg Ala Ser Gln Gly Ile Ser Ser Ala Leu Ala
1 5 10
<210> 123
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的可变轻
链CDR肽
<400> 123
Ser Ala Ser Tyr Arg Tyr Thr
1 5
<210> 124
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的可变轻
链CDR肽
<400> 124
Gln Gln Arg Tyr Ser Leu Trp Arg Thr
1 5
<210> 125
<211> 118
<212> PRT
<213> 智人(Homo sapiens)
<400> 125
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Ile His Pro Ser Gly Gly Arg Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Arg Pro Leu Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 126
<211> 10
<212> PRT
<213> 智人(Homo sapiens)
<400> 126
Gly Tyr Thr Phe Thr Ser Tyr Tyr Met His
1 5 10
<210> 127
<211> 17
<212> PRT
<213> 智人(Homo sapiens)
<400> 127
Glu Ile His Pro Ser Gly Gly Arg Thr Asn Tyr Asn Glu Lys Phe Lys
1 5 10 15
Ser
<210> 128
<211> 9
<212> PRT
<213> 智人(Homo sapiens)
<400> 128
Glu Arg Pro Leu Tyr Ala Met Asp Tyr
1 5
<210> 129
<211> 107
<212> PRT
<213> 智人(Homo sapiens)
<400> 129
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val His Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr His Ala Ser Tyr Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Arg Tyr Ser Leu Trp Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 130
<211> 11
<212> PRT
<213> 智人(Homo sapiens)
<400> 130
Lys Ala Ser Gln Asp Val His Thr Ala Val Ala
1 5 10
<210> 131
<211> 7
<212> PRT
<213> 智人(Homo sapiens)
<400> 131
His Ala Ser Tyr Arg Tyr Thr
1 5
<210> 132
<211> 9
<212> PRT
<213> 智人(Homo sapiens)
<400> 132
Gln Gln Arg Tyr Ser Leu Trp Arg Thr
1 5
<210> 133
<211> 118
<212> PRT
<213> 智人(Homo sapiens)
<400> 133
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Ile His Pro Ser Gly Gly Arg Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Arg Pro Leu Tyr Ala Ser Asp Leu Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 134
<211> 10
<212> PRT
<213> 智人(Homo sapiens)
<400> 134
Gly Tyr Thr Phe Thr Ser Tyr Tyr Met His
1 5 10
<210> 135
<211> 17
<212> PRT
<213> 智人(Homo sapiens)
<400> 135
Glu Ile His Pro Ser Gly Gly Arg Thr Asn Tyr Asn Glu Lys Phe Lys
1 5 10 15
Ser
<210> 136
<211> 9
<212> PRT
<213> 智人(Homo sapiens)
<400> 136
Glu Arg Pro Leu Tyr Ala Ser Asp Leu
1 5
<210> 137
<211> 107
<212> PRT
<213> 智人(Homo sapiens)
<400> 137
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val His Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr His Ala Ser Tyr Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Arg Tyr Ser Leu Trp Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 138
<211> 11
<212> PRT
<213> 智人(Homo sapiens)
<400> 138
Lys Ala Ser Gln Asp Val His Thr Ala Val Ala
1 5 10
<210> 139
<211> 7
<212> PRT
<213> 智人(Homo sapiens)
<400> 139
His Ala Ser Tyr Arg Tyr Thr
1 5
<210> 140
<211> 9
<212> PRT
<213> 智人(Homo sapiens)
<400> 140
Gln Gln Arg Tyr Ser Leu Trp Arg Thr
1 5
<210> 141
<211> 118
<212> PRT
<213> 小家鼠(Mus musculus)
<400> 141
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asn Pro Ser Asn Gly Arg Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Arg Pro Leu Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser
115
<210> 142
<211> 7
<212> PRT
<213> 小家鼠(Mus musculus)
<400> 142
Gly Tyr Thr Phe Thr Ser Tyr
1 5
<210> 143
<211> 6
<212> PRT
<213> 小家鼠(Mus musculus)
<400> 143
Asn Pro Ser Asn Gly Arg
1 5
<210> 144
<211> 9
<212> PRT
<213> 小家鼠(Mus musculus)
<400> 144
Glu Arg Pro Leu Tyr Ala Met Asp Tyr
1 5
<210> 145
<211> 108
<212> PRT
<213> 小家鼠(Mus musculus)
<400> 145
Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Val Gln Ala
65 70 75 80
Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln Arg Tyr Ser Thr Pro Arg
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 146
<211> 11
<212> PRT
<213> 小家鼠(Mus musculus)
<400> 146
Lys Ala Ser Gln Asp Val Ser Thr Ala Val Ala
1 5 10
<210> 147
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的可变轻
链CDR肽
<400> 147
Ser Ala Ser Tyr Arg Tyr Thr
1 5
<210> 148
<211> 9
<212> PRT
<213> 小家鼠(Mus musculus)
<400> 148
Gln Gln Arg Tyr Ser Thr Pro Arg Thr
1 5
<210> 149
<211> 115
<212> PRT
<213> 小家鼠(Mus musculus)
<400> 149
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Asp Ile Asn Pro Asn Asn Gly Gly Thr Thr Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Tyr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Trp Leu Leu Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ala
115
<210> 150
<211> 7
<212> PRT
<213> 小家鼠(Mus musculus)
<400> 150
Gly Tyr Thr Phe Thr Asp Tyr
1 5
<210> 151
<211> 6
<212> PRT
<213> 小家鼠(Mus musculus)
<400> 151
Asn Pro Asn Asn Gly Gly
1 5
<210> 152
<211> 6
<212> PRT
<213> 小家鼠(Mus musculus)
<400> 152
Trp Leu Leu Phe Ala Tyr
1 5
<210> 153
<211> 108
<212> PRT
<213> 小家鼠(Mus musculus)
<400> 153
Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Val Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Ala Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Asn Val Leu Ser
65 70 75 80
Glu Asp Leu Ala Glu Tyr Phe Cys Gln Gln Phe Tyr Ser Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 154
<211> 11
<212> PRT
<213> 小家鼠(Mus musculus)
<400> 154
Lys Ala Ser Gln Asn Val Gly Thr Asn Val Ala
1 5 10
<210> 155
<211> 7
<212> PRT
<213> 小家鼠(Mus musculus)
<400> 155
Ser Ala Ser Tyr Arg Tyr Ser
1 5
<210> 156
<211> 9
<212> PRT
<213> 小家鼠(Mus musculus)
<400> 156
Gln Gln Phe Tyr Ser Tyr Pro Tyr Thr
1 5
<210> 157
<211> 123
<212> PRT
<213> 小家鼠(Mus musculus)
<400> 157
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Asp Ile Asn Pro Asn Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Gly Gly Gly Ile Tyr Tyr Arg Tyr Asp Arg Asn Tyr Phe Asp Tyr
100 105 110
Trp Gly Gln Gly Thr Thr Leu Thr Val Ser Ser
115 120
<210> 158
<211> 7
<212> PRT
<213> 小家鼠(Mus musculus)
<400> 158
Gly Tyr Thr Phe Thr Asp Tyr
1 5
<210> 159
<211> 6
<212> PRT
<213> 小家鼠(Mus musculus)
<400> 159
Asn Pro Asn Asn Gly Gly
1 5
<210> 160
<211> 14
<212> PRT
<213> 小家鼠(Mus musculus)
<400> 160
Gly Gly Ile Tyr Tyr Arg Tyr Asp Arg Asn Tyr Phe Asp Tyr
1 5 10
<210> 161
<211> 107
<212> PRT
<213> 小家鼠(Mus musculus)
<400> 161
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Ser Ala Ser Gln Gly Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Ser Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Lys Leu Pro Phe
85 90 95
Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 162
<211> 11
<212> PRT
<213> 小家鼠(Mus musculus)
<400> 162
Ser Ala Ser Gln Gly Ile Ser Asn Tyr Leu Asn
1 5 10
<210> 163
<211> 7
<212> PRT
<213> 小家鼠(Mus musculus)
<400> 163
Tyr Thr Ser Ser Leu His Ser
1 5
<210> 164
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 164
Gln Gln Tyr Ser Lys Leu Pro Phe Thr
1 5
<210> 165
<211> 117
<212> PRT
<213> 小家鼠(Mus musculus)
<400> 165
Glu Val Lys Leu Val Glu Ser Glu Gly Gly Leu Val Gln Pro Gly Ser
1 5 10 15
Ser Met Lys Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Tyr Met Ala Trp Val Arg Gln Val Pro Glu Lys Gly Leu Glu Trp Val
35 40 45
Ala Asn Ile Asn Tyr Asp Gly Ser Asn Thr Ser Tyr Leu Asp Ser Leu
50 55 60
Lys Ser Arg Phe Ile Ile Ser Arg Asp Asn Ala Lys Asn Ile Leu Tyr
65 70 75 80
Leu Gln Met Ser Ser Leu Lys Ser Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Arg Glu Lys Phe Ala Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser
100 105 110
Val Thr Val Ser Ser
115
<210> 166
<211> 7
<212> PRT
<213> 小家鼠(Mus musculus)
<400> 166
Gly Phe Thr Phe Ser Asp Tyr
1 5
<210> 167
<211> 6
<212> PRT
<213> 小家鼠(Mus musculus)
<400> 167
Asn Tyr Asp Gly Ser Asn
1 5
<210> 168
<211> 8
<212> PRT
<213> 小家鼠(Mus musculus)
<400> 168
Glu Lys Phe Ala Ala Met Asp Tyr
1 5
<210> 169
<211> 108
<212> PRT
<213> 小家鼠(Mus musculus)
<400> 169
Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser Thr Ser Phe Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asp Val Ser Asn Ala
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly His Ser Pro Lys Leu Leu Ile
35 40 45
Phe Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Val Gln Ala
65 70 75 80
Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln His Tyr Ser Thr Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 170
<211> 11
<212> PRT
<213> 小家鼠(Mus musculus)
<400> 170
Lys Ala Ser Gln Asp Val Ser Asn Ala Leu Ala
1 5 10
<210> 171
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的可变轻
链CDR肽
<400> 171
Ser Ala Ser Tyr Arg Tyr Thr
1 5
<210> 172
<211> 9
<212> PRT
<213> 小家鼠(Mus musculus)
<400> 172
Gln Gln His Tyr Ser Thr Pro Trp Thr
1 5
<210> 173
<211> 121
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成多肽
<400> 173
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Arg His
20 25 30
Thr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Ser Pro Ala Asn Gly Asn Thr Asn Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Trp Ile Gly Ser Arg Glu Leu Tyr Ile Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 174
<211> 10
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 174
Gly Phe Thr Phe Thr Arg His Thr Ile His
1 5 10
<210> 175
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 175
Arg Ile Ser Pro Ala Asn Gly Asn Thr Asn Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 176
<211> 12
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 176
Trp Ile Gly Ser Arg Glu Leu Tyr Ile Met Asp Tyr
1 5 10
<210> 177
<211> 108
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成多肽
<400> 177
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Arg Ile Gln Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 178
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 178
Arg Ala Ser Gln Asp Val Ser Thr Ala Val Ala
1 5 10
<210> 179
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 179
Ser Ala Ser Phe Leu Tyr Ser
1 5
<210> 180
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 180
Gln Gln Ser Tyr Arg Ile Gln Pro Thr
1 5
<210> 181
<211> 121
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成多肽
<400> 181
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Thr
20 25 30
Ala Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Ser Pro Ala Asn Gly Asn Thr Asn Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Trp Ile Gly Ser Arg Glu Leu Tyr Ile Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 182
<211> 10
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 182
Gly Phe Thr Phe Ser Ser Thr Ala Ile His
1 5 10
<210> 183
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 183
Arg Ile Ser Pro Ala Asn Gly Asn Thr Asn Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 184
<211> 12
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 184
Trp Ile Gly Ser Arg Glu Leu Tyr Ile Met Asp Tyr
1 5 10
<210> 185
<211> 108
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成多肽
<400> 185
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Pro Ala Leu His
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 186
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 186
Arg Ala Ser Gln Asp Val Ser Thr Ala Val Ala
1 5 10
<210> 187
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 187
Ser Ala Ser Phe Leu Tyr Ser
1 5
<210> 188
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 188
Gln Gln Ser Tyr Pro Ala Leu His Thr
1 5
<210> 189
<211> 125
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成多肽
<400> 189
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Pro Phe Ser Lys Leu
20 25 30
Gly Met Val Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Thr Ile Ser Ser Gly Gly Gly Tyr Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Ile Ser Phe Gln Gly Gly Thr Tyr Thr Tyr Val Met
100 105 110
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 190
<211> 10
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 190
Gly Phe Pro Phe Ser Lys Leu Gly Met Val
1 5 10
<210> 191
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 191
Thr Ile Ser Ser Gly Gly Gly Tyr Thr Tyr Tyr Pro Asp Ser Val Lys
1 5 10 15
Gly
<210> 192
<211> 16
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 192
Glu Gly Ile Ser Phe Gln Gly Gly Thr Tyr Thr Tyr Val Met Asp Tyr
1 5 10 15
<210> 193
<211> 112
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成多肽
<400> 193
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu His Arg
20 25 30
Asn Gly Ile Thr Tyr Ser Tyr Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Gln Leu Ser Asn Leu Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Tyr Gln Asn
85 90 95
Leu Glu Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 194
<211> 16
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 194
Arg Ser Ser Lys Ser Leu Leu His Arg Asn Gly Ile Thr Tyr Ser Tyr
1 5 10 15
<210> 195
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 195
Gln Leu Ser Asn Leu Ala Ser
1 5
<210> 196
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成肽
<400> 196
Tyr Gln Asn Leu Glu Leu Pro Leu Thr
1 5
<210> 197
<211> 2076
<212> DNA
<213> 智人(Homo sapiens)
<400> 197
atgggcaccg tcagctccag gcggtcctgg tggccgctgc cactgctgct gctgctgctg 60
ctgctcctgg gtcccgcggg cgcccgtgcg caggaggacg aggacggcga ctacgaggag 120
ctggtgctag ccttgcgttc cgaggaggac ggcctggccg aagcacccga gcacggaacc 180
acagccacct tccaccgctg cgccaaggat ccgtggaggt tgcctggcac ctacgtggtg 240
gtgctgaagg aggagaccca cctctcgcag tcagagcgca ctgcccgccg cctgcaggcc 300
caggctgccc gccggggata cctcaccaag atcctgcatg tcttccatgg ccttcttcct 360
ggcttcctgg tgaagatgag tggcgacctg ctggagctgg ccttgaagtt gccccatgtc 420
gactacatcg aggaggactc ctctgtcttt gcccagagca tcccgtggaa cctggagcgg 480
attacccctc cacggtaccg ggcggatgaa taccagcccc ccgacggagg cagcctggtg 540
gaggtgtatc tcctagacac cagcatacag agtgaccacc gggaaatcga gggcagggtc 600
atggtcaccg acttcgagaa tgtgcccgag gaggacggga cccgcttcca cagacaggcc 660
agcaagtgtg acagtcatgg cacccacctg gcaggggtgg tcagcggccg ggatgccggc 720
gtggccaagg gtgccagcat gcgcagcctg cgcgtgctca actgccaagg gaagggcacg 780
gttagcggca ccctcatagg cctggagttt attcggaaaa gccagctggt ccagcctgtg 840
gggccactgg tggtgctgct gcccctggcg ggtgggtaca gccgcgtcct caacgccgcc 900
tgccagcgcc tggcgagggc tggggtcgtg ctggtcaccg ctgccggcaa cttccgggac 960
gatgcctgcc tctactcccc agcctcagct cccgaggtca tcacagttgg ggccaccaat 1020
gcccaagacc agccggtgac cctggggact ttggggacca actttggccg ctgtgtggac 1080
ctctttgccc caggggagga catcattggt gcctccagcg actgcagcac ctgctttgtg 1140
tcacagagtg ggacatcaca ggctgctgcc cacgtggctg gcattgcagc catgatgctg 1200
tctgccgagc cggagctcac cctggccgag ttgaggcaga gactgatcca cttctctgcc 1260
aaagatgtca tcaatgaggc ctggttccct gaggaccagc gggtactgac ccccaacctg 1320
gtggccgccc tgccccccag cacccatggg gcaggttggc agctgttttg caggactgta 1380
tggtcagcac actcggggcc tacacggatg gccacagccg tcgcccgctg cgccccagat 1440
gaggagctgc tgagctgctc cagtttctcc aggagtggga agcggcgggg cgagcgcatg 1500
gaggcccaag ggggcaagct ggtctgccgg gcccacaacg cttttggggg tgagggtgtc 1560
tacgccattg ccaggtgctg cctgctaccc caggccaact gcagcgtcca cacagctcca 1620
ccagctgagg ccagcatggg gacccgtgtc cactgccacc aacagggcca cgtcctcaca 1680
ggctgcagct cccactggga ggtggaggac cttggcaccc acaagccgcc tgtgctgagg 1740
ccacgaggtc agcccaacca gtgcgtgggc cacagggagg ccagcatcca cgcttcctgc 1800
tgccatgccc caggtctgga atgcaaagtc aaggagcatg gaatcccggc ccctcaggag 1860
caggtgaccg tggcctgcga ggagggctgg accctgactg gctgcagtgc cctccctggg 1920
acctcccacg tcctgggggc ctacgccgta gacaacacgt gtgtagtcag gagccgggac 1980
gtcagcacta caggcagcac cagcgaaggg gccgtgacag ccgttgccat ctgctgccgg 2040
agccggcacc tggcgcaggc ctcccaggag ctccag 2076
<210> 198
<211> 692
<212> PRT
<213> 智人(Homo sapiens)
<400> 198
Met Gly Thr Val Ser Ser Arg Arg Ser Trp Trp Pro Leu Pro Leu Leu
1 5 10 15
Leu Leu Leu Leu Leu Leu Leu Gly Pro Ala Gly Ala Arg Ala Gln Glu
20 25 30
Asp Glu Asp Gly Asp Tyr Glu Glu Leu Val Leu Ala Leu Arg Ser Glu
35 40 45
Glu Asp Gly Leu Ala Glu Ala Pro Glu His Gly Thr Thr Ala Thr Phe
50 55 60
His Arg Cys Ala Lys Asp Pro Trp Arg Leu Pro Gly Thr Tyr Val Val
65 70 75 80
Val Leu Lys Glu Glu Thr His Leu Ser Gln Ser Glu Arg Thr Ala Arg
85 90 95
Arg Leu Gln Ala Gln Ala Ala Arg Arg Gly Tyr Leu Thr Lys Ile Leu
100 105 110
His Val Phe His Gly Leu Leu Pro Gly Phe Leu Val Lys Met Ser Gly
115 120 125
Asp Leu Leu Glu Leu Ala Leu Lys Leu Pro His Val Asp Tyr Ile Glu
130 135 140
Glu Asp Ser Ser Val Phe Ala Gln Ser Ile Pro Trp Asn Leu Glu Arg
145 150 155 160
Ile Thr Pro Pro Arg Tyr Arg Ala Asp Glu Tyr Gln Pro Pro Asp Gly
165 170 175
Gly Ser Leu Val Glu Val Tyr Leu Leu Asp Thr Ser Ile Gln Ser Asp
180 185 190
His Arg Glu Ile Glu Gly Arg Val Met Val Thr Asp Phe Glu Asn Val
195 200 205
Pro Glu Glu Asp Gly Thr Arg Phe His Arg Gln Ala Ser Lys Cys Asp
210 215 220
Ser His Gly Thr His Leu Ala Gly Val Val Ser Gly Arg Asp Ala Gly
225 230 235 240
Val Ala Lys Gly Ala Ser Met Arg Ser Leu Arg Val Leu Asn Cys Gln
245 250 255
Gly Lys Gly Thr Val Ser Gly Thr Leu Ile Gly Leu Glu Phe Ile Arg
260 265 270
Lys Ser Gln Leu Val Gln Pro Val Gly Pro Leu Val Val Leu Leu Pro
275 280 285
Leu Ala Gly Gly Tyr Ser Arg Val Leu Asn Ala Ala Cys Gln Arg Leu
290 295 300
Ala Arg Ala Gly Val Val Leu Val Thr Ala Ala Gly Asn Phe Arg Asp
305 310 315 320
Asp Ala Cys Leu Tyr Ser Pro Ala Ser Ala Pro Glu Val Ile Thr Val
325 330 335
Gly Ala Thr Asn Ala Gln Asp Gln Pro Val Thr Leu Gly Thr Leu Gly
340 345 350
Thr Asn Phe Gly Arg Cys Val Asp Leu Phe Ala Pro Gly Glu Asp Ile
355 360 365
Ile Gly Ala Ser Ser Asp Cys Ser Thr Cys Phe Val Ser Gln Ser Gly
370 375 380
Thr Ser Gln Ala Ala Ala His Val Ala Gly Ile Ala Ala Met Met Leu
385 390 395 400
Ser Ala Glu Pro Glu Leu Thr Leu Ala Glu Leu Arg Gln Arg Leu Ile
405 410 415
His Phe Ser Ala Lys Asp Val Ile Asn Glu Ala Trp Phe Pro Glu Asp
420 425 430
Gln Arg Val Leu Thr Pro Asn Leu Val Ala Ala Leu Pro Pro Ser Thr
435 440 445
His Gly Ala Gly Trp Gln Leu Phe Cys Arg Thr Val Trp Ser Ala His
450 455 460
Ser Gly Pro Thr Arg Met Ala Thr Ala Val Ala Arg Cys Ala Pro Asp
465 470 475 480
Glu Glu Leu Leu Ser Cys Ser Ser Phe Ser Arg Ser Gly Lys Arg Arg
485 490 495
Gly Glu Arg Met Glu Ala Gln Gly Gly Lys Leu Val Cys Arg Ala His
500 505 510
Asn Ala Phe Gly Gly Glu Gly Val Tyr Ala Ile Ala Arg Cys Cys Leu
515 520 525
Leu Pro Gln Ala Asn Cys Ser Val His Thr Ala Pro Pro Ala Glu Ala
530 535 540
Ser Met Gly Thr Arg Val His Cys His Gln Gln Gly His Val Leu Thr
545 550 555 560
Gly Cys Ser Ser His Trp Glu Val Glu Asp Leu Gly Thr His Lys Pro
565 570 575
Pro Val Leu Arg Pro Arg Gly Gln Pro Asn Gln Cys Val Gly His Arg
580 585 590
Glu Ala Ser Ile His Ala Ser Cys Cys His Ala Pro Gly Leu Glu Cys
595 600 605
Lys Val Lys Glu His Gly Ile Pro Ala Pro Gln Glu Gln Val Thr Val
610 615 620
Ala Cys Glu Glu Gly Trp Thr Leu Thr Gly Cys Ser Ala Leu Pro Gly
625 630 635 640
Thr Ser His Val Leu Gly Ala Tyr Ala Val Asp Asn Thr Cys Val Val
645 650 655
Arg Ser Arg Asp Val Ser Thr Thr Gly Ser Thr Ser Glu Gly Ala Val
660 665 670
Thr Ala Val Ala Ile Cys Cys Arg Ser Arg His Leu Ala Gln Ala Ser
675 680 685
Gln Glu Leu Gln
690
- PCSK9抑制剂用于降低心血管风险的用途
- Na,K‑ATP酶的α2亚型的选择性抑制剂和用于降低眼内压的用途
