一种基于宏量营养素成分改变和mTOR信号抑制剂的饥饿干预方法和应用
文献发布时间:2023-06-19 11:39:06
技术领域
本发明属于药理领域,具体涉及一种基于宏量营养素成分改变和mTOR信号抑制剂的饥饿干预方法和应用。
背景技术
肥胖症的全球患病率正在迅速增加。根据世界卫生组织数据,2014年全球估计有19亿成年人超重,其中至少6亿肥胖(世界卫生组织,2016年数据)。肥胖是多种非传染性疾病的高危因素,包括2型糖尿病(T2D),心血管疾病,高血压,血脂异常和动脉粥样硬化。目前,肥胖和超重是净能量平衡盈余导致的已被广泛接受,即机体摄入的卡路里超过机体消耗的卡路里。因此,减少卡路里摄入(节食)是目前最常用的减肥方法之一。但由于节食会激活大脑饥饿信号,使机体不得不中断限食从而导致体重反弹,最终导致减肥失败。
目前最为广泛使用的节食减肥方法,其最主要缺点是,节食过程会激活大脑饥饿感信号通路,因此一旦停止节食则会出现食欲亢进而暴饮暴食,最终导致减肥失败。
发明内容
面对上述问题,本发明提供一种方法,通过抑制饥饿信号通路来解决限食减肥的体重反弹问题。本技术方案将通过使用低蛋白食物或者抑制下丘脑mTOR信号通路的药物,达到抑制节食引发的饥饿感和食欲亢进的问题。
本发明一个方面提供了一种抑制食欲、降低饥饿感的方法,所述方法包括给予受试者有效量的mTOR信号通路抑制剂和或给予受试者低蛋白饮食作为能量来源,所述低蛋白饮食为其宏量营养素成分中蛋白质含量低于总能值的5%的食物。
在本发明的实施方案中,所述的抑制食欲、降低饥饿感的方法中所述的食欲、饥饿感为受试者由于节食导致的食欲亢进。
在本发明的实施方案中,所述的节食为受试者摄取的能量少于平时摄入能量。
在本发明的实施方案中,所述的抑制食欲、降低饥饿感或抑制食欲亢进的方法为非诊断或治疗目的的。
本发明第二个方面提供了一种降低体重或体脂的方法,所述方法包括给予受试者有效量的mTOR信号通路抑制剂和或给予受试者低蛋白饮食作为能量来源,所述低蛋白饮食为其宏量营养素成分中蛋白质含量低于总能值的5%的食物。
在本发明的实施方案中,所述的降低体重或体脂的方法为非诊断或治疗目的的。
本发明第三个方面提供了一种提高葡萄糖糖耐受性的方法,所述方法包括给予受试者有效量的mTOR信号通路抑制剂和或给予受试者低蛋白饮食作为能量来源,所述低蛋白饮食为其宏量营养素成分中蛋白质含量低于总能值的5%的食物。
在本发明的实施方案中,所述的提高葡萄糖糖耐受性的方法为非诊断或治疗目的的。
本发明第四个方面提供了mTOR信号通路抑制剂和或低蛋白饮食在制备降低体重、降低体脂、抑制食欲、降低饥饿感和或提高葡萄糖糖耐受性的药物或食品中的用途。
本发明第五个方面提供了一种降低节食后防止体重反弹的方法,所述方法包括给予受试者有效量的mTOR信号通路抑制剂和或给予受试者低蛋白饮食作为能量来源,所述低蛋白饮食为其宏量营养素成分中蛋白质含量低于总能值的5%的食物。
在本发明的实施方案中,mTOR信号通路抑制剂选自雷帕霉素、地磷莫司、依维莫司、坦罗莫司、唑罗莫司、RAD001、AP23573、比欧莫司A9、子囊霉素、CCI-779、ABT578、SAR543、AP23841、AZD08055或OSI027,但是不仅限于此类药物
在本发明的实施方案中,所述低蛋白饮食为其宏量营养素成分中蛋白质含量低于总能值的5%的食物,优选蛋白质含量低于总能值的3%的食物,例如0.1%-2.5%。
在本发明的实施方案中,所述低蛋白饮食为宏量营养素成分中脂肪含量为总能值的20%-60%。
在本发明的实施方案中,所述脂肪包含饱和脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸。
在本发明的实施方案中,所述低蛋白饮食中宏量营养素成分中还包含碳水化合物,碳水化合物的含量为35%-80%。
本发明第六个方面提供了mTOR信号通路抑制剂作为在节食过程中抑制饥饿感的辅助药物治疗靶点的用途。
本发明第七个方面提供了一种在节食过程中抑制饥饿感的辅助药物,所述药物为mTOR信号通路抑制剂。
在本发明的实施方案中,mTOR信号通路抑制剂经口、胃肠外、舌下、通过气雾化作用或吸入喷雾、直肠、或以含有所需的常规无毒可药用载体、佐剂及溶媒的剂量单位制剂形式施用。局部施用还可涉及经皮给药,例如经皮贴剂或离子电泳装置的使用。所述胃肠外包括皮下注射、静脉注射、肌内注射、胸骨内注射或输注。
本发明第八个方面提供一种抑制饥饿感或食欲、降低体重或体脂、提高葡萄糖耐受性的代餐,所述代餐为低蛋白饮食,所述低蛋白饮食为其宏量营养素成分中蛋白质含量低于总能值的5%的食物。
有益效果
本发明克服了技术偏见,意外地发现低蛋白饮食可以降低体重和体脂,改善代谢。进一步地,本发明发现低蛋白食物通过作用于下丘脑中mTOR信号通路从而抑制了限食引起的饥饿感,因此,本发明还发现了mTOR信号通路抑制剂可以作为在限食过程中抑制饥饿感的辅助药物治疗靶点。
附图说明
图1为本发明的设计技术路线。
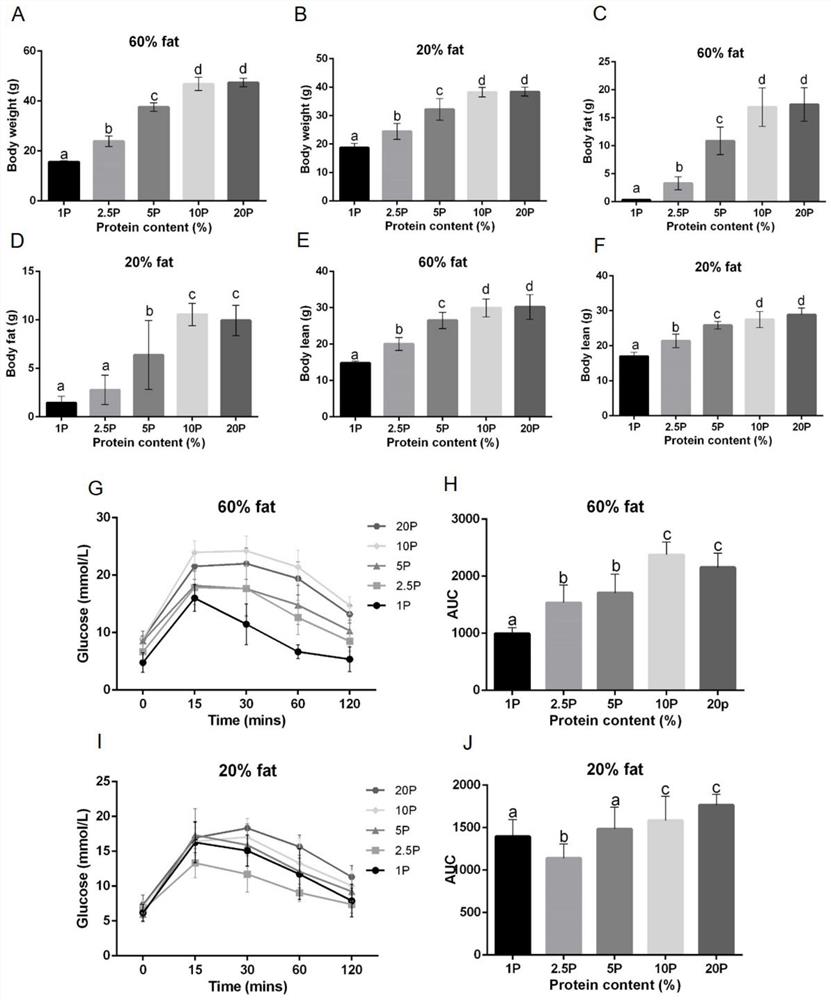
图2不同蛋白含量食物对小鼠身体成分和代谢健康的影响结果图;其中不同蛋白含量食物处理(A和B)最后十天的平均体重(n=13-17),(C和D)最后一周平均体脂含量和(E和F)平均非体脂成分重量(n=13-17),(G和I)小鼠注射葡萄糖的0、15、30、60和120分钟之后血糖水平(n=7-9)。(H和J)注射葡萄糖后的各个时间段血糖水平曲线下面积(n=7-9)。有相同字母的组间没有显著差异。数据显示平均值和标准差。
图3饥饿信号通路图和不同蛋白含量食物处理组的摄食量;其中A-D为实施例2结果,(A和B)不同蛋白含量食物处理组下丘脑中饥饿信号通路基因表达量。(C和D)处理最后十天的平均能量摄入量(KJ/天)(n=13-17),E-G为实施例3结果,(E和F)图中共三组小鼠分别用不同食物处理方式饲喂。一组小鼠用1%低蛋白食物处理,另一组是模拟1%低蛋白摄食的20%蛋白食物处理(相当于限食处理,给予的热量与1%低蛋白组相同,但是使用了20%蛋白食物,称之为20%对照饲喂组),最后一组使用20%正常蛋白处理,三组小鼠分别用不同食物处理方式喂养两周后用20%蛋白食物自由喂食方法处理24小时。期间,观测了体重和摄食的变化。(G三个处理组重新给予20%蛋白食物时24小时的平均摄食(n=7-9)。对于图C和D,有相同字母的组间没有显著差异。对于图A,B和G,*代表P<0.05,**代表P<0.01,***代表P<0.001,对于图A和B,对基因表达量与食物中的蛋白含量做了一般线性模型分析,数据显示平均值和标准差。
图4雷帕霉素处理能够抑制限食处理引起的过度饮食表型;(A)低蛋白和正常蛋白处理组下丘脑中显著差异的基因信号通路。(B和C)1%低蛋白和20%配对饲喂组(相当于卡路里限制组)小鼠下丘脑中p-S6K1蛋白的表达量(n=3)。(D和E)分别用1%低蛋白和模拟1%低蛋白组摄食的20%蛋白处理两周后的小鼠侧脑室插入释放DMSO和雷帕霉素的泵之后的体重摄食变化以及从手术中恢复之后三个不同处理组(DMSO注射的1%低蛋白处理,DMSO注射的20%对照饲喂组,雷帕霉素注射的20%对照饲喂组)重新喂20%蛋白食物时的体重和摄食的变化。(F和G)三个不同处理组分别用DMSO和雷帕霉素处理之后的下丘脑中p-S6K1蛋白的表达量(n=3)。(H)重新喂20%蛋白之后三个不同处理组24小时的平均摄食量(n=7-9)。*代表P<0.05,**代表P<0.01,***代表P<0.001,ns代表P>0.05。数据显示平均值和标准差。
具体实施方式
为了使本发明的上述目的、特征和优点能够更加明显易懂,下面对本发明的具体实施方式做详细的说明,但不能理解为对本发明的可实施范围的限定。
在本发明中,脂肪含量、碳水化合物含量或蛋白含量均为能量含量,即脂肪、碳水化合物或蛋白质提供的能量占总食物提供能量的百分比。
在本发明中,节食和限食具有相同含义,可以互换,其代表受试者摄取的能量少于平时摄入能量。
实施例1低蛋白饮食动物实验
以雄性小鼠C57BL/6N进行低蛋白饮食处理实验。在小鼠实验中共用到十种特殊设计的食物。在十种特殊设计的食物中,有五种食物是固定其中的脂肪含量为60%(能量的比值),蛋白含量从1%到20%,具体分别为1%、2.5%、5%、10%和20%,而剩下的能量由碳水化合物来补充,因此这五种食物碳水化合物含量分别为39%、37.5%、35%、30%以及20%。碳水化合物主要成分分别为玉米淀粉(Corn starch),麦芽糊精(Maltodextrin 10)和蔗糖(Sucrose),其中所有食物中蔗糖和纤维素的含量均分别固定在总食物能量的5%。而另外五种食物其脂肪含量为20%,蛋白含量与上述五种食物相同,分别为1%,2.5%、5%、10%和20%,同样的原理剩下的碳水化合物含量分别为79%、77.5%、75%、70%以及60%。食物中用到的蛋白质为酪蛋白(Casein),食物中的脂肪为可可油(Cocoa Butter)、椰子油(Coconut Oil)、鲱鱼油(Menhaden Oil)、棕榈油(Palm Oil)、葵花油(Sunflower Oil)。使用这些油是为了保证食物中饱和脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸三种脂肪酸的比例的平衡,其比例为47.5:36.8:15.8,这也是典型食物中用到的比例。所有的食物中都有加入标准含量的维他命和少量元素。
十二周大的小鼠适应环境两周后开始用标准食物(D12450B,Research Diets)处理两周,标准食物成分为20%蛋白质、10%脂肪和70%碳水化合物含量。标准食物处理之后小鼠分别用不同蛋白含量(1%、2.5%、5%、10%和20%)结合两种固定脂肪含量(20%和60%)的十种食物处理十二周。其中在十种食物处理十二周期间,每天称取小鼠体重和摄食量,身体成分体脂含量和非体脂成分重量由EchoMRI身体成分分析仪每周测量一次
由于低蛋白处理导致了较低的体脂,为了检测低蛋白是否会改善机体代谢,对所有处理组的小鼠进行了葡萄糖糖耐受性的检测。小鼠被禁食14小时后第二天早上先测试注射葡萄糖之前的基础血糖,之后称取每组小鼠体重,并根据小鼠体重腹腔注射2g/kg的葡萄糖,然后分别检测注射葡萄糖之后15、30、60和120分钟的血糖水平。本实验用的是强生ONETOUCH血糖仪,采血方法使用了尾巴采血法。
实验结果
低蛋白处理显著降低体重和体脂
小鼠喂了将近12周的10种不同食物之后所有低蛋白组1%、2.5%和5%蛋白处理组的平均体重均显著低于20%正常蛋白组(p<0.001),但是10%蛋白组和20%蛋白组之间的平均体重并没有显著差异(p>0.05)(图2A和B)。除了在20%低脂组中1%蛋白和2.5%蛋白组之间没有显著差异以外,体脂和非脂肪成分重量的变化趋势也与体重变化一样(图2C和D和2E和F)。尤其是1%低蛋白食物即使是与60%高脂肪含量结合的时候也导致了极低的体脂,小鼠经过喂12周的这种食物之后最后平均体脂含量只有0.319g。
低蛋白处理显著改善葡萄糖耐受性
在葡萄糖耐受性实验中各个时间血糖浓度曲线下面积是表示是否改善葡萄糖耐受性的重要指标,曲线面积越小说明葡萄糖耐受性越好,是因为曲线面积小说明回到原始血糖水平的时间越短也就是说恢复原始血糖的能力越强。而本发明的实验结果表明60%和20%脂肪含量条件下,低蛋白处理组(1%、2.5%和5%)的曲线下面积(Area Under Curve,AUC)均显著小于10%和20%对照蛋白处理组(p<0.05)(图2H和J)。在现有技术的经验中,通常认为血糖变化与碳水化合物摄入量有关,因为碳水化合物最容易转换为血糖,增加碳水化合物摄入比例会导致更高的血糖。而在本发明的实验中可以看出,在固定蔗糖和纤维素比例为5%的前提下,更低比例的蛋白质的摄入带来了更低的血糖水平,血糖峰值仅为不到20mmol/L,而且在达到峰值后显示出更快的下降趋势(图2G和I)。
因此可以总结出低蛋白食物即使是在与高脂结合的条件下也能够改善小鼠的葡萄糖耐受性。
实施例2低蛋白处理与下丘脑饥饿通路相关性研究
为了探究不同蛋白含量食物对小鼠下丘脑基因表达信号通路的影响,本发明进行了转录组测序以及分析。
本发明人对饥饿信号通路基因进行了一般线性模型分析,采用实施例1中所述的10中食物处理小鼠12周,以食物中的脂肪含量作为因子,蛋白含量作为协变量。结果表明,饥饿通路中四个基因Pomc,Cartpt,Agrp和Npy与食物中的蛋白含量显著相关(p=2.2×10
实施例3低蛋白处理小鼠摄食量显著降低
本发明人一项之前的研究发现限食处理小鼠在限食两周之后再喂回正常食物时会由于饥饿(检测发现下丘脑饥饿通路被激活)而比正常摄食(约3.5g/天)显著增高(约5g/天),因此为了探究1%低蛋白食物处理小鼠喂正常蛋白食物时是否也会有报复性的过度饮食行为,设计了以下实验:
正常饮食20%蛋白质10%脂肪70%碳水化合物的标准食物饲喂小鼠一周,然后小鼠分为3组,其中第一组用60%脂肪1%蛋白质39%碳水化合物的低蛋白食物处理(1P),第二组小鼠模拟1%低蛋白处理组的摄食量每天给予定量的与1%蛋白组摄食同样能量的60%脂肪20%蛋白质20%碳水化合物的食物(称之为20%配对饲喂组,20PF,类似限食处理)处理。第三组小鼠一直采用自由喂20%蛋白质60%脂肪20%碳水化合物的标准食物(20P-normal)的方法。三组小鼠用上述处理方法喂食两周之后,再用20%蛋白60%脂肪20%碳水化合物食物自由喂食的方法处理24小时,并观测小鼠的体重和摄食变化。其中自由喂指不限量投食。三组小鼠在开始用特殊食物处理(第7天)之前其体重没有显著差异(p>0.05)(图3E)。分别用特殊食物即1%低蛋白,20%配对饲喂和20%蛋白自由喂食处理两周之后,体重出现了显著差异。其中第三组体重显著高于第一组和第二组小鼠,而第二组体重显著高于第一组小鼠(图3E)。通过统计三个不同处理组在恢复自由喂食20%蛋白时的摄食量,实验结果与发明人之前实验结果一致的是,第二组进行限食的小鼠具有报复性的过度饮食的表型(大约为5.11g±0.44g/天)。第一组低蛋白组摄食量也有所反弹,但是仅与第三组正常20%蛋白组摄食量相当(大约为3.4g±0.07g/天)。换言之,即使1%低蛋白处理组饥饿通路显著激活,再换用自由喂食20%蛋白食物时,并没有像限食处理小鼠一样报复性的过度饮食,其摄食量只是恢复到了正常水平(图3G)。
虽然实施例2中结果显示,低蛋白饮食小鼠的饥饿通路被激活,但是通过对实施例3中低蛋白组摄食量的研究显示,虽然1%低蛋白处理组尤其是在60%高脂含量背景下下丘脑中饥饿通路被激活,但是这些小鼠并没有多吃食物,反而其摄食相比其他浓度蛋白处理组显著降低(图3C和D)。
实施例4过度饮食与mTOR通路的关系研究
实施例3的结果证实,虽然饥饿信号通路被打开,1%低蛋白喂养小鼠相比20%蛋白限食处理组缺乏报复性的过度饮食的表型。因此,本发明人认为限食导致的过度饮食表型可能与下丘脑中信号通路变化有关。下丘脑转录组测序信号通路分析结果揭示mTOR信号通路,饥饿信号通路以及eIF2a信号通路是与食物中蛋白含量显著相关的信号通路(图4A)。根据转录组测序和结合既往研究结果本发明人推测限食导致的过度饮食表型与mTOR信号通路有关,并对过度饮食与mTOR信号通路之间的关系进行了研究。
首先,检测了实施例3第一组(1P)和第二组(20P-PF)小鼠下丘脑中的p-S6K1(mTOR信号通路下游分子)蛋白含量,结果与预期一致的是p-S6K1蛋白含量在20%蛋白配对饲喂组中相比1%低蛋白组显著高表达(p=0.032)(图4B和C),说明mTOR信号通路有显著的变化。进一步,为了探究抑制20%蛋白配对饲喂组下丘脑中mTOR信号通路是否抑制复喂20%对照蛋白含量食物时过度摄食的表型,设计了以下实验:
小鼠共分三组,第一组喂1%低蛋白食物(即60%脂肪,1%蛋白质,39%碳水化合物),第二组和第三组都喂与第一组能量相同的20%蛋白质的食物(即60%脂肪,20%蛋白质,20%碳水化合物,且能量和第一组相同)(即20%蛋白配对饲喂组)。
用这些食物处理小鼠两周后在小鼠侧脑室(相对前囟(Bregma)前后-0.3mm,左右0.1mm,深度-0.23mm的位置)插入了携带渗透泵(Model 1004osmotic pump,Alzet)的脑输液装置(Brain Infusion Kit,Alzet)。通过渗透泵给予第一组和第二组小鼠每天释放2.4μL DMSO,第三组小鼠给与每天释放2.4μL雷帕霉素,渗透泵每天以0.11μL/小时的速率释放相应的药物直到整个实验的结束。在手术恢复期间各组饲喂饮食不变。
这样处理三周后三组小鼠下丘脑饥饿通路应均被激活,因此小鼠手术并给药一周后三组小鼠都再用20%含量蛋白食物处理五天观察三组小鼠喂20%蛋白含量食物时的摄食是否有差异。
实验结果见图4中的DEFGH。首先,D为本实施例三组小鼠的体重变化,E为三组小鼠的摄食量变化。主要观察第29天自由喂食20%正常蛋白后摄食量的变化,通过观察可知,雷帕霉素的使用并未影响在限食阶段的摄食量变化,而在恢复自由饮食后出现比较明显的变化。进而我们发现与之前实验结果一致1%低蛋白组在喂20%正常蛋白食物时并没有过度饮食,但是相比之下20%蛋白配对饲喂DMSO处理小鼠再正常给予20%蛋白含量食物时却过度饮食,而20%蛋白配对饲喂雷帕霉素处理小鼠却在喂20%正常蛋白含量食物时并没有过度饮食,其摄食量与1%低蛋白处理组喂20%正常蛋白时的摄食量相似,这两者之间并没有显著差异(图4DEH)。相应的,20%配对饲喂组用雷帕霉素处理之后其下丘脑中p-S6K1表达量显著降低(P=0.023)(图4FG),雷帕霉素是mTOR信号通路的抑制剂,说明抑制mTOR信号通路能够抑制饥饿之后过度饮食的表型。
- 一种基于宏量营养素成分改变和mTOR信号抑制剂的饥饿干预方法和应用
- 一种mTOR信号通路小分子抑制剂在制备肺癌化疗药物中的应用
