一种提高红苞凤梨抗寒性的方法
文献发布时间:2023-06-19 11:49:09
技术领域
本发明属于观赏花卉栽培技术领域,具体涉及一种提高红苞凤梨抗寒性的方法。
背景技术
红苞凤梨又名金边凤梨、艳凤梨,为凤梨科凤梨属多年生地生性常绿草本。红苞凤梨花期持久,植株粗犷奇特,富有野趣,果形如菠萝亦经久耐赏,因此又被誉为“菠萝花”。红苞风梨原产地为阿根廷,喜欢温暖湿润的环境和通风良好的生存条件,喜欢阳光能耐干旱;红苞凤梨对生长地的阳光有一定的要求,如果阳光照射不充足,那么就会影响其正常的生长发育。如果气温偏低红苞凤梨易遭受冷害,导致叶片与花变色,严重时甚至枯萎腐败。短时间的低温或极高温,虽然会对生长造成一定危害,但当温度恢复正常后植株仍可生长良好。目前研究指出最适宜凤梨生长的温度为22-25℃,日温22-28℃,夜温15-18℃,相差6℃以上是最好的日夜温差,而10℃为最佳温差。因此可以看出红苞凤梨对冬季的温度要求很严,当低于3-6℃就不能在室外安全越冬。解决红苞凤梨植株的低温伤害一直是生产上的一个重要课题,并且受到科学工作者的重视,但目前还没有很好的栽培措施来提高红苞凤梨植株的抗寒性,并实现其在冬季温度较低地区的室外栽培。
发明内容
有鉴于此,本发明旨在提供一种提高红苞凤梨抗寒性的方法以解决上述问题。本发明的技术方案为:
一种提高红苞凤梨抗寒性的方法,包括以下步骤:
步骤1,将红苞凤梨组培苗接种到含有低温处理剂的MS培养基培养;
步骤2,培养完成后,再进行低温锻炼处理。
优选地,所述红苞凤梨组培苗高度为3~4cm,具有3-5条根和5-8片叶。
进一步地,当采用ABA为低温处理剂时,所述培养过程的控制参数为:ABA浓度为1~12mg/L,培养温度为25±2℃,光照度为15001x,湿度为80%,培养时间为10~40d。优选控制参数为:ABA浓度为8mg/L,培养时间为30d。
进一步地,当采用SA为低温处理剂时,所述培养过程的控制参数为:SA浓度为1~5mg/L,培养温度25±2℃,光照度为15001x,湿度为80%,培养时间为10~40d。优选控制参数为:SA浓度为5mg/L,培养时间为20d。
进一步地,当采用CaCl
进一步地,所述低温锻炼处理的控制参数为:温度为5℃,湿度为80%,光照时间为10h/d,光照度为1500lx,处理3~7天。
优选地,所述低温锻炼处理的控制参数为:温度为5℃,湿度为80%,光照时间为10h/d,光照度为15001x,处理5天。
本发明的有益效果是:采用本发明处理后的红苞凤梨,可以提高其体内的保护酶系统(SOD、POD、CAT)活性,来减轻低温胁迫对红苞凤梨的伤害,使叶片结构保持完整性,缓解了叶绿素降解,促进了光合作用,从而提高了红苞凤梨的整体抗寒性。
附图说明
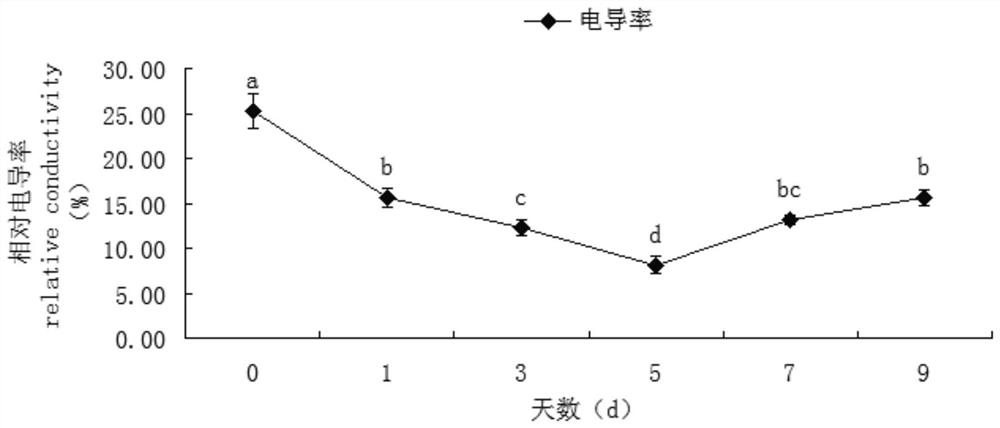
图1为本发明对比例1中处理时间对红苞凤梨叶片膜透性的影响曲线。
图2为本发明对比例1中处理时间对红苞凤梨叶片MDA含量的影响曲线。
图3为本发明对比例1中处理时间对红苞凤梨叶片叶绿素含量的影响曲线。
图4为本发明对比例1中处理时间对红苞凤梨叶片SOD活性的影响曲线。
图5为本发明对比例1中处理时间对红苞凤梨叶片POD活性的影响曲线。
图6为本发明对比例1中处理时间对红苞凤梨叶片CAT活性的影响曲线。
图7为本发明对比例1中处理时间对红苞凤梨叶片可溶性蛋白的影响曲线。
图8为本发明对比例1中处理时间对红苞凤梨叶片可溶性糖的影响曲线。
图9为本发明对比例2中不同ABA浓度及培养时间对红苞凤梨相对电导率的影响曲线。
图10为本发明对比例2中不同ABA浓度及培养时间对红苞凤梨叶片MDA含量的影响曲线。
图11为本发明对比例2中不同ABA浓度及培养时间对红苞凤梨叶片叶绿素含量的影响曲线。
图12为本发明对比例2中不同ABA浓度及培养时间对红苞凤梨叶片可溶性蛋白含量的影响曲线。
图13为本发明对比例2中不同ABA浓度及培养时间对红苞凤梨叶片可溶性糖含量的影响曲线。
图14为本发明对比例3中不同SA浓度及培养时间对红苞凤梨相对电导率的影响曲线。
图15为本发明对比例3中不同SA浓度及培养时间对红苞凤梨叶片MDA含量的影响曲线。
图16为本发明对比例3中不同SA浓度及培养时间对红苞凤梨叶片叶绿素含量的影响曲线。
图17为本发明对比例3中不同SA浓度及培养时间对红苞凤梨叶片可溶性蛋白含量的影响曲线。
图18为本发明对比例3中不同SA浓度及培养时间对红苞凤梨叶片可溶性糖含量的影响曲线。
图19为本发明对比例4中不同CaCl
图20为本发明对比例4中不同CaCl
图21为本发明对比例4中不同CaCl
图22为本发明对比例4中不同CaCl
图23为本发明对比例4中不同CaCl
具体实施方式
在本发明的描述中,需要说明的是,实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
下面结合附图和具体的实施例对本发明做进一步详细说明,所述是对本发明的解释而不是限定。
在本发明的具体实施例中,生理生化指标的测定均以叶片为材料,样品的选取采用随机抽样法进行,重复3次。具体包括以下指标:
(1)外观形态指标:包括叶片颜色,叶片卷曲和枯萎程度。每个指标按叶片受冷害的程度不同将其分为3个等级。分级标准如表1所示。
表1 外观分级标准
(2)叶绿素的测定:使用80%丙酮法(熊庆娥,植物生理学实验教程[M],成都:四川科学技术出版社,2003.8)。
Ca=(12.7OD
Cb=(22.9OD
Ct=Ca+Cb=(20.21OD
式[1]~[3]中,OD为测定波长下的光密度值,下标表示测定波长;V为叶绿素提取液总体积(ml);W为材料鲜重(g);Ca为叶绿素a的浓度;Cb为叶绿素b的浓度;Ct为总叶绿素浓度。
(3)可溶性糖和MDA的测定:参照现代植物生理学实验指南(熊庆娥,植物生理学实验教程[M],成都:四川科学技术出版社,2003.8)。
C1(μmol/l)=11.71OD
C2(μmol/l)=6.45(OD
可溶性糖的含量(μmol/gFW)=C×V×10-3/W, [6]
丙二醛含量(μmol/gFW)=C×V×10-3/W, [7]
式[4]~[7]中,C1:提取液中可溶性糖的浓度(μmol/l);C2:提取液中MDA的浓度(μmol/l);C:提取液中MDA或可溶性糖的浓度(μmol/l);V:样品提取液总体积(ml);W:样品鲜重(g)。
(4)可溶性蛋白的测定:采用考马斯亮蓝G-250法(熊庆娥,植物生理学实验教程[M],成都:四川科学技术出版社,2003.8)。
蛋白质含量(mg/g)=(查得的蛋白质含量(μg)×提取液总体积(ml)×稀释倍数)/(样品质量(g)×测定时用提取液体积(ml)×1000)
(5)SOD活性的测定:参照李合生的氮蓝四唑法(李合生,植物生理生化实验园林和测定技术[M],北京:高等教育出版社,2003.6)。
SOD活性(酶活单位·FW/g)=2(A1-A2)×V/A1×W×Vt, [8]
式[8]中,A1:照光对照管的吸光度;A2:样品管的吸光度;V:样品液的总体积(ml);Vt:测定样品时样品用量(ml);W:鲜重(g)
(6)POD活性的测定:参照愈创木酚法(熊庆娥,植物生理学实验教程[M],成都:四川科学技术出版社,2003.8)。
以每分钟内△A470变化0.01为1个过氧化物酶活性单位,计算其活力。
过氧化物酶活性
式[9]中,△A
(7)CAT活性的测定:采用紫外吸收法,在孔祥生(孔祥生,植物生理学实验技术[M],北京:中国农业出版社,2008.2)的方法上稍加变动,取1cm口径石英比色杯,依次加入0.2ml酶液(以提取液做参比)、2.3ml 0.05mol/L PH7.8磷酸缓冲液混匀,放入比色槽中加入0.5ml0.1MH
过氧化氢酶活性
式[10]中,V
(8)组织浸出液电导率:采用电导仪法(熊庆娥,植物生理学实验教程[M],成都:四川科学技术出版社,2003.8)。
相对电导率(%)=样品煮前电导率(μs/cm)/样品煮后电导率(μs/cm)×100,危害程度=冻害处理的相对电导率/对照的相对电导率。
采用SPSS、Excel等软件对上述指标数据进行处理和分析,并进行方差分析和LSD检验。
实施例1
本实施例提供一种提高红苞凤梨抗寒性的方法,包括以下步骤:
步骤1,将高度为3~4cm、具有3-5条根和5-8片叶红苞凤梨组培苗加入含有ABA的MS培养基培养,培养过程的控制参数为:ABA在所述MS培养基中的终浓度为8mg/L,培养温度为25±2℃,光照度为15001x,湿度为80%,培养时间为30d。
步骤2,培养完成后,转入人工气候培养箱中进行低温锻炼处理,控制参数为:温度为5℃,湿度为80%,光照时间为10h/d,光照度为15001x,处理5天。
对本实施例处理完的红苞凤梨测定其外观分级、叶绿素含量、可溶性糖和MDA含量、可溶性蛋白含量、SOD/POD/CAT活性和组织浸出液电导率,具体如下:
(1)外观形态:叶片颜色A等级,叶片卷曲程度B等级,叶片枯萎程度B等级。
(2)叶绿素含量为0.35mg/gFW,可溶性糖含量为14.10mg/gFW,MDA含量为1.20ug/mgFW,可溶性蛋白含量为2.50mg/Gfw,SOD活性为166.4u/(g·h)FW,POD的活性为6.77u/(min·g)FW,CAT的活性为10.8u/(min·g)FW,组织浸出液电导率为16%。
实施例2
本实施例提供一种提高红苞凤梨抗寒性的方法,包括以下步骤:
步骤1,将高度为3~4cm、具有3-5条根和5-8片叶红苞凤梨组培苗加入含有SA的MS培养基培养,培养过程的控制参数为:SA在所述MS培养基中的终浓度为5mg/L,培养温度25±2℃,光照度为15001x,湿度为80%,培养时间为20d。
步骤2,培养完成后,转入人工气候培养箱中进行低温锻炼处理,控制参数为:温度为5℃,湿度为80%,光照时间为10h/d,光照度为15001x,处理5天。
对本实施例处理完的红苞凤梨测定其外观分级、叶绿素含量、可溶性糖和MDA含量、可溶性蛋白含量、SOD/POD/CAT活性和组织浸出液电导率,具体如下:
(1)外观形态:叶片颜色A等级,叶片卷曲程度B等级,叶片枯萎程度B等级。
(2)叶绿素含量为0.38mg/gFW,可溶性糖的含量为14.00mg/gFW,MDA的含量为1.10ug/mgFW,可溶性蛋白含量为3.20mg/gFW,SOD活性为460.26u/(g·h)FW,POD的活性为7.85u/(min·g)FW,CAT活性为10.93u/(min·g)FW,组织浸出液电导率为16%。
实施例3
本实施例提供一种提高红苞凤梨抗寒性的方法,包括以下步骤:
步骤1,将高度为3~4cm、具有3-5条根和5-8片叶的红苞凤梨组培苗移入含有CaCl
步骤2,培养完成后,转入人工气候培养箱中进行低温锻炼处理,控制参数为:温度为5℃,湿度为80%,光照时间为10h/d,光照度为15001x,处理5天。
对本实施例处理完的红苞凤梨测定其外观分级、叶绿素含量、可溶性糖和MDA含量、可溶性蛋白含量、SOD/POD/CAT活性和组织浸出液电导率,具体如下:
(1)外观形态:叶片颜色A等级,叶片卷曲程度B等级,叶片枯萎程度B等级。
(2)叶绿素含量为0.50mg/gFW,可溶性糖为14.00mg/gFW,MDA含量为0.30ug/mgFW,可溶性蛋白含量为5.00mg/gFW,SOD活性为256.77u/(g·h)FW,POD活性为11.25u/(min·g)FW,CAT活性为12.4u/(min·g)FW,组织浸出液电导率为13%。
实施例4
参数考察过程:
(1)考察了人工气候培养箱中一系列低温处理时间(0d、1d、3d、5d、7d、9d)对红苞凤梨叶片外观形态、相对电导率、叶片MDA含量、叶绿素含量、SOD/CAT/POD、可溶性蛋白、可溶性糖的影响,其他实验条件同实施例1。外观形态结果如表2所示。
表2 不同处理时间对叶片外观形态的影响
通过表2的数据可以看出,第5d开始,红苞凤梨叶片的叶缘开始卷曲,叶尖开始枯萎并偶有褐斑出现,第7d枯萎症状扩大,9d后枯斑面积达到叶面积的20%。
图1显示,在低温处理5d时相对电导率达到最小值。说明低温锻炼5d,在一定程度上缓解了红苞凤梨叶片膜损伤程度,再延长低温时间则膜透性增加(相对电导率是衡量细胞膜透性的重要指标)。
图2显示,红苞凤梨叶片MDA含量在0-5d时逐步下降,到第5d时为0d时的73.73%,之后又逐步上升,到第9d时接近处理0d的水平。这也与相对电导率变化趋势基本一致。
图3显示,红苞凤梨叶片的叶绿素含量在低温锻炼0-5d内缓慢上升,在第5d时显著高于处理0d,比0d提高了27.09%。在5d后叶绿素含量下降,到第9d时达到最低,比处理0d降低了33.49%。
图4显示,SOD活性在处理第1d时无显著升高,到第3-5d显著升高,在第5d时达到最高,为处理0d时的3.6倍。5d后SOD活性开始下降,至第9d时已降为第5d时的51.54%。
图5显示,POD的活性在第1d显著上升,为处理0d的1.77倍,之后1-5d内POD活性无显著变化,在第5d时POD活性最高,是处理0d的2.11倍,在5-9d内POD活性略有下降,但变化不显著。
图6显示,CAT活性在低温锻炼第1-3d内没有显著变化,但到第5d时显著升高,达到处理0d的1.25倍,之后显著下降,在7d时为第5d的53.09%,处理9d后与第7d无显著变化。在整个低温处理期间红苞凤梨叶片SOD活性变化幅度都高于POD和CAT活性。
图7显示,可溶性蛋白含量在处理第1d后即显著上升,到第5d时达到最高,是处理0d的1.66倍。处理第7d时,可溶性蛋白含量显著下降,而7-9d内可溶性蛋白含量没有显著变化。
图8显示,可溶性糖含量在低温锻炼前5d逐渐升高,第5d时为处理0d的1.4倍,5d后逐步下降,在9d时仅为第5d的27.7%,第0d时的67.11%。
因此,综合考虑,将低温处理时间定在3~7d,优选为5d。
同样,对实施例2和实施例3也按照实施例4的方式进行了低温处理的考察,低温处理时间定在3~7d,优选为5d。综上,实施例1、实施例2和实施例3的处理在低温锻炼的基础上进一步提高了红苞凤梨的抗寒性。
(2)考察了不同ABA浓度(1、2、4、8、12mg/L,分别对应A1、A2、A3、A4、A5)及培养时间(10d、20d、30d、40d)对红苞凤梨相对电导率、叶片MDA含量、叶绿素含量、SOD/CAT/POD、可溶性蛋白、可溶性糖的影响,其他实验条件同实施例1。
图9显示,ABA各浓度培养10-40d后的红苞凤梨叶片相对电导率都有显著下降。在培养10-20d后各处理相对电导率下降,且都在20d时下降到最低值,在培养20-40后则缓慢上升。在含ABA培养基上培养20d后,处理A4的相对电导率最低,低于不添加ABA的对照组(CK)91.74%,而且分别比处理A1、A2、A3、A5降低了16.3%、27.47%、36.15%、10.49%。在含ABA培养基上培养30d,40d后,各处理与CK相比都有显著的差异,而且A4的相对电导率一直为最低值。
图10显示,ABA各浓度培养10-40d后的红苞凤梨MDA含量在培养10-30d后无显著变化,而在培养30-40d后,MDA含量显著上升。各处理在培养10-40d的过程中MDA含量始终低于CK,在培养20d后,各处理达到最低值。处理A4MDA含量在20d时仅为CK的42.67%,在40d时为CK的75.73%,均低于其他各处理。在培养10-30d之间不同浓度处理之间差异显著,而在培养30-40d后差异不显著,各处理间MDA含量大小顺序为A3>A2>A1>A5>A4。
图11显示,处理A1-A3在培养10-40d后低温处理的过程中,叶绿素的含量均低于CK,在浓度A3中培养30d时叶绿素含量达到最低值,为CK的69.52%。然而,处理A4、A5的叶绿素含量一直高于CK,在A4培养基上培养20d后,叶绿素含量比A1、A2、A3、A5高39.51%、66.44%、72.92%和7.54%。在A4培养基上培养30d叶绿素含量达到最大值,分别高于CK17.51%和9.09%,在培养40d时达到最小值,但仍然分别高于CK15.15%和2.54%。
表3给出了不同浓度及时间ABA处理对红苞凤梨叶片SOD、CAT和POD活性的影响。
表3 不同浓度及时间ABA处理对红苞凤梨叶片SOD、CAT和POD活性的影响
通过表3的数据可以看出,整体上,经过ABA处理过的红苞凤梨叶片SOD活性显著高于对照。在培养10d时,各处理的SOD活性升高不显著,处理A4的SOD活性是CK的1.14倍,而处理A3只比CK高了0.25%。在培养20-40d时各处理都能维持较高的活性,在30d时,各处理的SOD活性达到最大值,处理A4的SOD活性一直显著高于其他浓度处理,达到CK的4.36倍,而处理A5也达到CK的3.45倍。在A1-A3处理浓度之间,随着浓度的增加,SOD活性下降,但始终高于CK。各处理的SOD活性大小顺序为A4>A5>A1>A2>A3>CK。
在整个处理过程中,各处理都维持了较高的POD活性,均呈现先升高(10-20d)后降低(20-40d)的趋势,与CK相比较都有比较明显提高。在ABA培养20d时,各处理POD活性达到最大值,分别比CK高了67.46%、50.29%、36.21%、98%、91.56%,处理A1-A3之间随着浓度的增加,POD活性下降。处理A4在所有处理中POD活性最高,在10、20、30、40d分别比CK高了95.95%、98%、97.87%、52.77%。各浓度处理间的POD活性也存在着差异,处理A4一直高于其他处理,在20d时,分别比A1、A2、A3、A5高18.23%、31.75%、45.36%、3.36%。
与SOD、POD不同,处理A1、A2、A3的CAT活性在培养10-40d内一直呈现下降趋势,且随着浓度增长下降越明显,在培养30d以后,已全部低于处理CK,在培养30d时,CAT活性是CK的75.57%、64.55%、57.43%。因此,与CK相比,处理A1、A2、A3的差异性不显著。而处理A4、A5一直显著高于CK,提高了红苞凤梨的CAT活性;处理A4在处理30d时CAT活性达到最大值,高于CK 66.64%,处理A5则在20d时达到最大值,高于CK56.82%。
图12显示,处理A1、A4、A5可溶性蛋白含量在整个处理过程中一直高于对照CK,在培养10-40d后,处理A4还一直高于其他浓度处理;各处理的最大值出现在培养30d时,分别高于CK3.28%、26.49%、14.81%。而处理A2、A3在整个处理过程中一直低于处理CK,在40d时达到最小值,分别低于CK15.78%和19.88%。
图13显示,在处理10d时,各处理浓度下可溶性糖含量都高于CK,在处理20-40d时,各处理可溶性糖含量表现出下降趋势,在40d时,已与CK无显著差异。处理A1、A4、A5可溶性糖含量在培养10、20、30d后都显著高于CK,处理A4在培养20d时达到最大值,高于CK58.54%;而在培养40d时差异不显著,处理A1、A4、A5只低于CK6.07%、16.36%和0.16%。处理A2、A3培养20-40d内,可溶性糖含量则一直低于CK。说明8mg/LABA处理20d可显著提高红苞凤梨叶中的可溶性糖含量。
因此,综合考虑,本发明步骤1的培养过程,ABA浓度在6~10mg/L,培养时间在20~30天。并且将ABA浓度8mg/L,培养时间30天作为优选条件。
(3)考察了不同SA浓度(1、2、3、4、5mg/L,分别对应S1、S2、S3、S4、S5)及培养时间(10d、20d、30d、40d)对红苞凤梨相对电导率、叶片MDA含量、叶绿素含量、SOD/CAT/POD、可溶性蛋白、可溶性糖的影响,其他实验条件同实施例2。
图14显示,SA处理后的红苞凤梨相对电导率全都有所下降,呈现出先下降(10-30d)后上升(30-40d)的趋势。在培养10、20、30d时,各处理红苞凤梨叶片相对电导率显著低于不添加SA的对照(CK);培养30d时,各处理的相对电导率值最低,分别低于CK51.98%、34.68%、31.13%、76.69%、77.51%;在培养40d时,各处理与CK相比无显著差异。处理S1、S2、S3随着SA浓度的增加,相对电导率增加;处理S5的相对电导率在培养10、20、30d内一直显著低于CK和其他浓度处理,在30d时,达到最小值,分别低于S1、S2、S3、S4处理14.38%、24.13%、26.13%、0.46%。
图15显示,不同浓度及时间处理下的红苞凤梨叶片MDA含量全都低于对照CK。处理S1、S3、S4、S5随着处理时间的延长,MDA含量稳步降低,与CK相比有显著差异;在SA中培养10d时各处理之间无显著差异;在40d时各处理达到最小值,分别是CK的60.65%、91.33%、45.75%、41.09%;处理S2与CK相比MDA含量无显著差异。处理S5在培养20、30、40d时MDA含量一直显著低于对照及其他浓度处理,在40d时的MDA含量达到最低值,分别比处理S1、S2、S3、S4低了32.24%、47.62%、55.01%、10.18%,因此细胞过氧化产物积累最少。
图16显示,处理S4叶绿素含量显著高于CK,在培养30d时达到最大值,分别高于CK34.82%、12.31%。处理S2、S3在培养10-40d的过程中叶绿素含量都低于CK,处理S3在培养20d时最高,低于对照25.61%,表明叶绿素即使在经过S2、S3处理后也受到了不同程度的破坏。处理S1、S5虽然叶绿素含量一直高于对照,但是与CK相比差异不显著,表明SA处理对提高红苞凤梨叶绿素含量效果不显著。
表4给出了不同浓度及时间ABA处理对红苞凤梨叶片SOD、CAT和POD活性的影响。
表5 不同浓度及时间SA处理对红苞凤梨叶片SOD、CAT和POD活性的影响
从表5可以看出,整体上,经过SA处理的红苞凤梨叶片SOD活性都有所上升,培养20-30d时比培养10-20d略有降低,但都显著高于对照CK。处理S1、S2、S3、S4在培养20d时SOD活性最高,与CK差异显著,但处理间没有显著差异,分别是CK的3.64倍、3.43倍、3.63倍和3.64倍;在培养10、30、40d时SOD活性也有所提高,但提高幅度明显低于20d。处理S5与CK存在显著差异,在培养10、20、30、40d时分别是CK的4.83倍、5.12倍、5.64倍和4.22倍;在培养30d时分别是处理S1、S2、S3、S4的1.36倍、3.43倍、3.38倍和1.22倍。
在整个处理过程中,S1、S4、S5的POD活性与对照相比较都有显著差异;其中处理S5在处理20d和30d时与对照CK相比提高幅度最大,分别提高了84.19%、69.85%,差异显著;处理S2的SOD活性虽有提高,但与对照相比无明显差异,在培养10-40d内分别低于CK2.28%、2.03%、2.02%和2.69%。而处理S3的SOD活性完全低于对照,在培养20d时POD活性值最低,低于CK40.47%。
与SOD相同,经过SA处理后的各处理CAT活性在整个处理过程中都高于处理CK。处理S4、S5一直都显著高于CK,在处理20d时处理S4、S5达到最大值,分别比对照CK高75%、86.36%。处理S1、S2、S3在培养10,20,30,40d虽然CAT活性与处理CK相比有所上升,但无明显差异。各处理CAT活性增加幅度大小的顺序为S5>S4>S1>S2>S3。
图17显示,经过SA处理的可溶性蛋白含量在整个处理过程中都高于CK。处理S1、S4、S5的可溶性蛋白含量与CK相比有显著差异,在培养20d时各处理可溶性蛋白含量急剧下降,分别比CK高23.06%、62.86%、76.81%;在培养30d时可溶性蛋白含量急剧上升,之后稍后略有回落;处理S5的可溶性蛋白含量在培养30d时达到最大值为CK的1.68倍,处理S1、S2、S3、S4为S5的62.72%、56.35%、45.61%、82.09%。处理S2、S3相较于CK,虽然含量有所上升但无显著差异。各处理可溶性蛋白含量多少的顺序为S5>S4>S1>S2>S3>CK。
图18显示,所有SA处理的可溶性糖含量在整个处理过程中都高于对照CK,呈现出先下降(10-20d)后上升(20-40d)的趋势。处理S5可溶性糖含量显著高于CK和其他浓度处理,在处理20d时达到最大值,高于对照59.64%,同时分别比处理S1、S2、S3、S4高19.96%、30.58%、48.19%和12.49%。处理S1、S2、S3、S4虽然可溶性糖含量高于CK,但与处理CK之间差异不显著。
因此,综合考虑,本发明步骤1的培养过程,SA浓度在3~5mg/L,培养时间在20~30天。并且将SA浓度5mg/L,培养时间20天作为优选条件。
(4)考察了不同CaCl
图19显示,经过不同浓度和时间CaCl
图20显示,经过不同浓度及时间CaCl
图21显示,各CaCl
表5给出了不同浓度及时间CaCl
表5 不同浓度及时间CaCl
从表5可以看出,整体上,经过CaCl
在整个处理过程中,所有浓度CaCl
与SOD、POD相同,经过CaCl
图22显示,各CaCl
图23显示,所有CaCl
因此,综合考虑,本发明步骤1的培养过程,CaCl
综上,采用本发明处理后的红苞凤梨,可以提高其体内的保护酶系统(SOD、POD、CAT)活性,来减轻低温胁迫对红苞凤梨的伤害,使叶片结构保持完整性,缓解了叶绿素降解,促进了光合作用,从而提高了红苞凤梨的整体抗寒性。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 一种提高红苞凤梨抗寒性的方法
- 一种彩苞凤梨花营养肥的配制方法
