利用质谱多重反应监测技术检测5、7、55型腺病毒方法
文献发布时间:2023-06-19 11:57:35
技术领域
本发明属于生物医学领域,涉及利用质谱多重反应监测技术检测5、7、55型腺病毒方法。
背景技术
腺病毒(adenovirus)是一种无包膜的直径为70~90nm的颗粒,由252个微粒呈二十面体排列构成。其中,由240个非顶点壳粒构成的六邻体(hexon,120kD)是腺病毒衣壳的主要抗原性蛋白,每个六邻体由3个亚基组成,含有大量特异性抗原表位及中和表位,能够刺激机体产生型特异性中和抗体,也是诊断不同血清型的标准。特定血清型与疾病的严重程度、临床表现密切相关,所以腺病毒的检测分型较为重要。目前,已知能感染人体的腺病毒(HAdv)有67个不同的血清型,其中最常见的致病型为1-8型。55型腺病毒是由人11型和14型腺病毒重组产生的新型病毒,属于B组B2亚组,2006年在陕西首次出现,造成1名患儿死亡。
腺病毒感染时主要侵犯呼吸道黏膜,但也可感染消化道黏膜、眼结膜、泌尿道、心肌和淋巴结。主表现为急性上呼吸道感染(HAdv 1-5、HAdv 7、HAdv 14、HAdv 55),其次为眼部(HAdv 8、HAdv 19、HAdv 37、HAdv 54)和胃肠道(HAdv 40、HAdv 41)感染等。呼吸道感染的腺病毒多发于冬春季节,人群普遍易感,多见于儿童。约半数患者为隐性感染。免疫功能正常的感染者一般愈后良好,2周内症状缓解或消失,统计数据显示,中国健康人群的血清中多种腺病毒抗体阳性率极高,如HAdv 3为80%、HAdv 4为60%、HAdv 5为80%、HAdv 7为60%等,可见腺病毒感染的普遍性。易感人群感染后发生急性呼吸窘迫综合征、失明、肾衰竭等严重疾病甚至死亡的风险更高,基层医院易忽略儿童呼吸道感染者病原检测而经验性使用抗生素治疗,常有延误病情的可能。
腺病毒肺炎约占儿童期肺炎的10%,多由腺病毒3、7型引起,病情重,病死率高。近些年,由55、7和14型腺病毒感染引起的急性呼吸道疾病(acute respiratory diseases,ARD)常在军队的新兵中流行,这一综合征以咳嗽、发热和全身不适为特点,多因压力过大、劳累、聚集等原因所致。研究统计表明,新兵腺病毒感染率通常超过50%,其中20%ˉ40%发展为肺炎且须住院治疗。
《腺病毒感染诊疗指南》中指出腺病毒感染诊断标准为:①发病前8d内与腺病毒感染病例密切接触;②发热伴咽干或咽痛,干咳;③双侧或单侧颈部淋巴结肿大,绿豆或黄豆大小;④咽部充血,咽后壁淋巴滤泡增生,扁桃体表面覆有点、片状灰白色分泌物;⑤双肺听诊基本无干湿啰音,与影像学表现不一致;⑥外周血白细胞正常、升高或降低,分类淋巴细胞比例降低,单核细胞比例升高;⑦胸部影像学表现为结节状、斑片状、小片或大片状实变影,部分出现胸腔积液。符合以上①②③④⑥条者,临床诊断为腺病毒急性上呼吸道感染;全部符合者诊断腺病毒肺炎。确诊病例需临床诊断病例同时具备以下一种或几种实验室检查结果者:①咽拭子实时定量PCR(real-time PCR)法检测腺病毒特异性核酸阳性;②血清腺病毒特异性IgM抗体阳性;③急性期与恢复期双份血清标本腺病毒特异性IgG抗体4倍以上升高。并且由于腺病毒感染的临床表现与其他多种病原体引起的呼吸道感染性疾病类似,需要结合病原学检测阳性,排除能够引起类似临床表现的其他疾病,方可确定诊断。
从上述诊断标准可以看出现今腺病毒感染明确诊断需要在患者发病有临床表现,并且需与其他类似疾病鉴别诊断,然而流行病学调查显示,腺病毒感染潜伏期为3-8d,在潜伏期末至发病急性期传染性最强,并且隐性感染者也同样是最主要的传染源。因此若能提前检测到腺病毒,早期给予隔离和治疗,就可能减少腺病毒传染病的发生,并进行对症治疗的措施有效,且能减少易感人群的风险暴露。为了这一目标,目前已有一些腺病毒检测研究和验证工作,主要以查找新的血清诊断标志物进行早期快速检测,实验证明,六邻体蛋白可作为腺病毒感染的早期预警及诊断标志物。然而迄今为止,检测方法依然主要集中在核酸检测和血清学抗体检测方面。即使出现的一些针对六邻体蛋白的抗原检测试剂研发,但受制于无高效特异的单克隆抗体以及用来评价检测试剂特异性和灵敏度的临床标本,不能用于早期预警腺病毒感染。而近几年建立起来的质谱技术可以直接检测待测分子的分子量,因而应用于生物大分子的鉴定更加精确。尤其是多重反应监测(Multiple ReactionMonitoring,MRM)技术只需将选定的特异性母离子进行碰撞诱导,最后去除其他子离子的干扰,只对选定的特异子离子进行质谱信号的采集,故而具有灵敏、准确、特异和结果稳定等优点,非常适合基于蛋白组学的腺病毒感染诊断标志物的研究。所以,基于MRM技术寻找敏感的5型、7型、55型腺病毒感染前期的病毒特异性肽段,对于早期预警和诊断腺病毒感染前期非常重要。
发明内容
根据以上技术问题,本发明提供一种利用质谱多重反应监测技术检测5、7、55型腺病毒方法,其具体步骤包括:
步骤(1):将腺病毒5型、7型、55型六邻体蛋白特异性肽段基因进行合成;
步骤(2):进行标记肽段混合试剂的制备;
步骤(3):确定诊断标志物的离子峰值;
步骤(4):进行试剂盒的配制;
步骤(5):进行样本的检测。
所述腺病毒5型、7型、55型六邻体蛋白特异性肽段基因合成具体方法为:生物信息学数据库比对腺病毒5型、7型、55型六邻体蛋白序列,选择特异性最佳蛋白序列,通过理论酶切方案,5型六邻体蛋白选择13条标志性肽段,7型六邻体蛋白选择10条标志性肽段,55型六邻体蛋白选择10条标志性肽段-肽段长度在8-15氨基酸残基,COOH端和NH2端为赖氨酸或精氨酸残基;分别通过人工合成腺病毒上述各型六邻体基因全长序列和相应标志性肽段串联基因衔接处增补赖氨酸或精氨酸基因,通过PCR结合分子克隆技术将目的片段出入含有编码谷胱甘肽-S-转移酶GST和泛素结合域的重组质粒的大肠杆菌BL21-DE3细胞进行实验。
所述标记肽段混合试剂的制备具体方法为:通过SILAC策略体内代谢标记培养策略常规诱导表达重组六邻体蛋白,分别在轻标(
所述确定诊断标志物的离子峰值具体方法为:采用Waters公司超高压液相色谱(Nano Acquity Ultra Performance LC,Waters)进行分离,自动进样器进样,上样体积3μL,流速10μL/min。洗脱条件:0-5min,流动相梯度为流动相B(100%ACN+0.1%FA)从3%增长到6%,同时流动相A(2%ACN,0.1%FA,98%H
所述样本的检测具体方法为:
一:将SILAC标记的中标及重标腺病毒5型、7型、55型六邻体蛋白特征性肽段的标准混合试剂以及感染患者样本处理后的待测样本混合,得到混合物;
二:对上述混合物进行质谱多反应监测技术测定,得到质谱检测数据;
三:采用预设的轻中重离子对的定量值,进行对比分析待测样本结果。
所述标准混合试为SILAC标记的中标即:D
所述标准混合试剂置于试剂盒内。
所述步骤(5)一在均相条件下,将SILAC标记的轻标、中标及重标腺病毒5型、7型、55型六邻体蛋白的混合物作为试剂和检测样品混合。
所述质谱检测数据采用MRM技术进行质谱信号采集,通过人工比对是否出现与预先设定的预先标记的腺病毒5型、7型、55型六邻体蛋白标志性肽段中标及重标一致的质谱离子峰,从而判断样品是否感染了腺病毒5型、7型、55型其中的一种。
所述试剂盒通过检测来自所述腺病毒感染者样本中是否出现与预先标记的腺病毒5型、7型、55型六邻体蛋白标志性肽段中标及重标一致的质谱离子峰来完成诊断,如果所述感染者样本中出现与预先设定的腺病毒5型、7型、55型六邻体蛋白标志性肽段中标及重标一致的质谱离子峰,则所述感染患者患有腺病毒5型、7型、55型中的一种。
所述感染患者样本为血清样本和/或咽拭子样本。
所述预先标记的质谱离子峰为腺病毒5型、7型、55型六邻体蛋白特征性肽段的轻中重离子对的定量值。
所述试剂盒包括阳性对照品和阴性对照品。
所述阳性对照品分别为诊断为腺病毒5型、7型、55型感染的患者样本。
SILAC标记的中标及重标腺病毒5型、7型、55型六邻体蛋白标准混合试剂作为腺病毒型、7型、55型感染早期预警及诊断标志物。
本发明的有益效果为:本发明为腺病毒型、7型、55型感染早期的预警和诊断提供了一个新的标记物,具有重要的临床价值。利用质谱结果,证实腺病毒感染前期患者血清样本中出现与预先设定的腺病毒5型、7型、55型六邻体蛋白标志性肽段中标及重标一致的质谱离子峰。SILAC标记的中标及重标腺病毒5型、7型、55型六邻体蛋白标准混合试剂可作为腺病毒型、7型、55型感染早期预警及诊断标志物,且结果准确,操作简便,具有较大的推广应用价值。
本发明用于检测腺病毒5型、7型、55型六邻体蛋白特异性肽段在制备筛查腺病毒感染患者的试剂盒中的应用。所述腺病毒5型、7型、55型六邻体蛋白特异性肽段具体可如图2的序列所示。
本发明保护用于检测SILAC标记的腺病毒5型、7型、55型六邻体蛋白特异性肽段在制备检测或辅助检测待测患者是否为腺病毒感染患者的试剂盒中的应用。所述六邻体蛋白特异性肽段具体可如图2的序列所示。
本发明试剂盒包括用于检测腺病毒5型、7型、55型六邻体蛋白的物质。所述腺病毒5型、7型、55型六邻体蛋白特异性肽段具体可如图2的序列所示。
本发明中SILAC标记的腺病毒5型、7型、55型六邻体蛋白特异性肽段作为腺病毒患者筛查的标记物的应用。所述腺病毒5型、7型、55型六邻体蛋白特异性肽段具体可如图2的序列所示。
附图说明
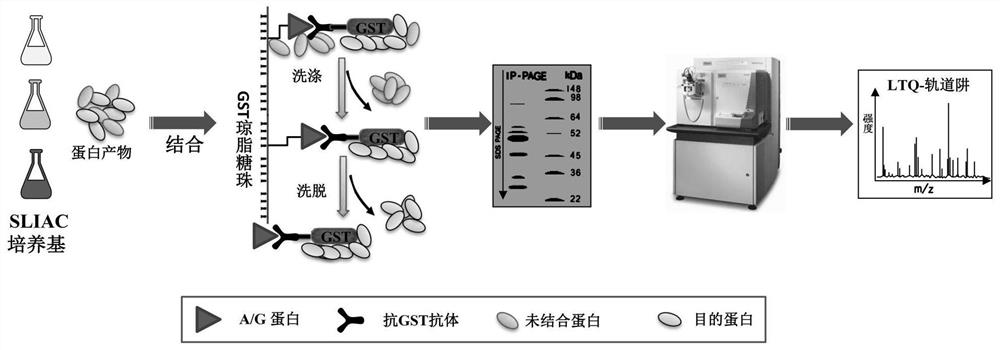
图1为本实验的技术路线图。
图2分别为5型、7型、55型腺病毒六邻体蛋白特异性肽段的蛋白序列。
图3为5型、7型、55型腺病毒特异性肽段的考马斯亮蓝染色结果。
图4、图5分别为实施例轻中重标混合的5型腺病毒特异性肽段的质谱定量图谱及鉴定图谱示例。
图6、图7分别为实施例轻中重标混合的7型腺病毒特异性肽段的质谱定量图谱及鉴定图谱示例。
图8、图9分别为实施例轻中重标混合的55型腺病毒特异性肽段的质谱定量图谱及鉴定图谱示例。
图10、11、12、13、14、15分别为实施例中重标混合的5/7/55型腺病毒特异性肽段的质谱定量图谱及鉴定图谱示例。
如图,M:蛋白Marker;泳道1:腺病毒5型轻标重组蛋白;泳道2:腺病毒5型中标重组蛋白;泳道3:腺病毒5型重标重组蛋白;泳道4:腺病毒7型轻标重组蛋白;泳道5:腺病毒7型中标重组蛋白;泳道6:腺病毒7型重标重组蛋白;泳道7:腺病毒55型轻标重组蛋白;泳道8:腺病毒55型中标重组蛋白;泳道9:腺病毒55型重标重组蛋白;
图5中腺病毒5型轻、中、重标肽段的鉴定质谱离子峰分别为650.33、652.34、654.34;
图7中腺病毒7型轻、中、重标肽段的鉴定质谱离子峰分别为732.37、734.39、736.38。
图9中腺病毒55型轻、中、重标肽段的鉴定质谱离子峰分别为640.32、643.32、645.32。
图11中腺病毒5型中、重标肽段的鉴定质谱离子峰分别为667.86、669.86。图13中腺病毒7型中、重标肽段的鉴定质谱离子峰分别为1303.08、1305.07。图15中腺病毒55型中、重标肽段的鉴定质谱离子峰分别为854.09、855.42。
具体实施方式
为了使本发明所解决的技术问题、技术方案及有益效果更加清楚明白,以下对本发明的具体实施方法进行进一步详细说明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。
实施例1
本发明提供一种利用质谱多重反应监测技术检测5、7、55型腺病毒方法,其具体步骤包括:
步骤(1):将腺病毒5型、7型、55型六邻体蛋白特异性肽段基因进行合成;
步骤(2):进行标记肽段混合试剂的制备;
步骤(3):确定诊断标志物的离子峰值;
步骤(4):进行试剂盒的配制;
步骤(5):进行样本的检测。
所述腺病毒5型、7型、55型六邻体蛋白特异性肽段基因合成具体方法为:生物信息学数据库比对腺病毒5型、7型、55型六邻体蛋白序列,选择特异性最佳蛋白序列,通过理论酶切方案,5型六邻体蛋白选择13条标志性肽段,7型六邻体蛋白选择10条标志性肽段,55型六邻体蛋白选择10条标志性肽段-肽段长度在8-15氨基酸残基,COOH端和NH2端为赖氨酸或精氨酸残基;分别通过人工合成腺病毒上述各型六邻体基因全长序列和相应标志性肽段串联基因衔接处增补赖氨酸或精氨酸基因,通过PCR结合分子克隆技术将目的片段出入含有编码谷胱甘肽-S-转移酶GST和泛素结合域的重组质粒的大肠杆菌BL21-DE3细胞进行实验。
所述标记肽段混合试剂的制备具体方法为:通过SILAC策略体内代谢标记培养策略常规诱导表达重组六邻体蛋白,分别在轻标(
所述确定诊断标志物的离子峰值具体方法为:采用Waters公司超高压液相色谱(Nano Acquity Ultra Performance LC,Waters)进行分离,自动进样器进样,上样体积3μL,流速10μL/min。洗脱条件:0-5min,流动相梯度为流动相B(100%ACN+0.1%FA)从3%增长到6%,同时流动相A(2%ACN,0.1%FA,98%H
所述样本的检测具体方法为:
一:将SILAC标记的中标及重标腺病毒5型、7型、55型六邻体蛋白特征性肽段的标准混合试剂以及感染患者样本处理后的待测样本混合,得到混合物;
二:对上述混合物进行质谱多反应监测技术测定,得到质谱检测数据;
三:采用预设的轻中重离子对的定量值,进行对比分析待测样本结果。
所述标准混合试为SILAC标记的中标即:D
所述标准混合试剂置于试剂盒内。
所述步骤(5)一在均相条件下,将SILAC标记的轻标、中标及重标腺病毒5型、7型、55型六邻体蛋白的混合物作为试剂和检测样品混合。
所述质谱检测数据采用MRM技术进行质谱信号采集,通过人工比对是否出现与预先设定的预先标记的腺病毒5型、7型、55型六邻体蛋白标志性肽段中标及重标一致的质谱离子峰,从而判断样品是否感染了腺病毒5型、7型、55型其中的一种。
所述试剂盒通过检测来自所述腺病毒感染者样本中是否出现与预先标记的腺病毒5型、7型、55型六邻体蛋白标志性肽段中标及重标一致的质谱离子峰来完成诊断,如果所述感染者样本中出现与预先设定的腺病毒5型、7型、55型六邻体蛋白标志性肽段中标及重标一致的质谱离子峰,则所述感染患者患有腺病毒5型、7型、55型中的一种。
所述感染患者样本为血清样本和/或咽拭子样本。
所述预先标记的质谱离子峰为腺病毒5型、7型、55型六邻体蛋白特征性肽段的轻中重离子对的定量值。
所述试剂盒包括阳性对照品和阴性对照品。
所述阳性对照品分别为诊断为腺病毒5型、7型、55型感染的患者样本。
SILAC标记的中标及重标腺病毒5型、7型、55型六邻体蛋白标准混合试剂作为腺病毒型、7型、55型感染早期预警及诊断标志物。
实施例2
技术路线如图1所示。
步骤(1):腺病毒5型、7型、55型六邻体蛋白特异性肽段基因的合成
生物信息学数据库比对腺病毒5型、7型、55型六邻体蛋白序列,选择特异性最佳蛋白序列,通过理论酶切方案,5型六邻体蛋白选择13条标志性肽段,7型六邻体蛋白选择10条标志性肽段,55型六邻体蛋白选择10条标志性肽段(肽段长度在8-15氨基酸残基,COOH端和NH
步骤(2):标记肽段混合试剂的制备
通过SILAC策略体内代谢标记培养策略常规诱导表达重组六邻体蛋白,分别在轻标(
SILAC培养基配制:
步骤(3):确定诊断标志物的离子峰值
采用Waters公司超高压液相色谱(Nano Acquity Ultra Performance LC,Waters)进行分离。自动进样器进样,上样体积3μL,流速10μL/min。洗脱条件:0-5min,流动相梯度为流动相B(100%ACN+0.1%FA)从3%增长到6%,同时流动相A(2%ACN,0.1%FA,98%H
步骤(4):试剂盒的配制
使用等比例混合的5/7/55型中标、重标肽段混合物干粉,得到试剂1。
隐性对照品为无菌双蒸水。
步骤(5):样本的检测
将待测样本与以上得到的试剂置于本试剂盒配套的质谱检测仪中进行检测,检测8小时候得到质谱数据结果。人工分析比对是否出现与预先设定的预先标记的腺病毒5型、7型、55型六邻体蛋白标志性肽段中标及重标一致的质谱离子峰,从而判断待测样本是否感染了腺病毒5型、7型、55型其中的一种。
以上显示和描述了本发明的基本原理和主要特征和本发明的优点。本发明提到的各个部件为现有领域常见技术,本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
- 利用质谱多重反应监测技术检测5、7、55型腺病毒方法
- 一种利用生物反应器制备重组人5型腺病毒毒种库的方法
