CFTR调节剂在治疗脑血管疾病中的应用
文献发布时间:2023-06-19 12:21:13
本发明涉及CFTR调节剂在预防和/或治疗脑血管疾病中的应用以及涉及相应的治疗方法。
在老龄化的世界人口中,患有心脏病的人数正在迅速增长。根本原因是老年人的发病率升高和显著改善生存率的医学进步。在过去的十年中,很明显,寿命的延长与认知能力的显著下降有关(1),并助长了正在出现的认知障碍的“沉默流行病”(2)。影响将是巨大的:除了直接的医疗需求外,认知障碍还严重影响患者应对主要疾病的能力(例如,治疗依从性降低),并对家庭、朋友和整个社会产生重大的社会影响。因此,这种流行病的真正负担无法用简单的经济数字来量化。可以肯定的是,我们的医疗和心理健康网络在结构上或财务上都无法适应即将到来的危机。
心力衰竭(HF)患者的认知能力下降通常归因于“血管性认知损害”,该术语描述了由血管起源引起的多种形式的认知损害(例如,记忆力丧失,执行功能丧失,精神错乱)。笼统地说,血管性认知损害的病因是多种多样和多因素的;临床诊断具有挑战性和不精确性;并且有多种不同且复杂的伤害子类型(1)。大多数心血管和脑血管疾病(包括高血压,缺血性和出血性中风,心脏病和糖尿病)被认为是基于血管的认知功能减退的主要和重要原因(1)。尽管血管性认知损害包括许多复杂的偶然机制,但统一的方面是脑灌注不足:在这方面,发明人的最新工作集中在改善HF和蛛网膜下腔出血(SAH)实验模型中的脑灌注(3-6)。
本发明所基于的问题是提供一种改善脑血管疾病的新方案。
通过如权利要求书、本说明书和附图中公开的本发明的实施方式,提供了上述技术问题的解决方案。
发明人发现了减少HF和SAH中脑灌注的关键分子机制(4-6)。值得注意的是,两种病理都通过相同的基本机制改变了脑血管自动调节,从而改变了脑血流(CBF)。具体来说,HF和SAH会在脑动脉血管壁内诱导强大的肿瘤坏死因子(TNF)表达:平滑肌细胞定位的TNF通过自分泌/旁分泌机制发挥作用,从而刺激鞘氨醇-1-磷酸酯(S1P)的产生,然后鞘氨醇-1-磷酸酯通过S1P
在寻找替代治疗靶标时,囊性纤维化跨膜电导调节剂(CFTR)成为了一个令人感兴趣的候选物。发明人的先前工作证明,HF和SAH下调脑动脉中CFTR蛋白的表达:由于CFTR是参与平滑肌细胞S1P降解的关键转运蛋白(4),因此CFTR下调应增强S1P的生物利用度及其促收缩作用(3,4)。确实,血管TNF的表达、CFTR的表达和肌反应性紧密相关(3,4,6),这催生了根据本发明的机制提出,即通过降低CFTR的蛋白表达来介导TNF依赖性的脑动脉肌源性张力的增强(4)。在这种情况下,CFTR成为纠正大脑微循环内的肌源性反应性的有吸引力且合乎逻辑的治疗靶标,因为尚不知道CFTR治疗剂会损害免疫功能,并且可以使用FDA批准的增加CFTR表达/活性的治疗剂(10)。
本发明提供了CFTR调节剂化合物的应用,即,根据本发明,可以使用一种或多种CFTR调节剂,用于治疗和/或预防脑血管疾病。
根据本发明,“脑血管疾病”是减少、损害或以其他方式使个体(优选人类患者)痛苦的脑血管系统的疾病。更特别地,脑血管疾病是减少或受损害的脑血管灌注。术语“脑血管灌注”也被分别称为“脑血流”和“脑灌注”,并且是它们的同义词。
根据本发明,CFTR调节剂对脑血管平滑肌细胞中分别存在或表达的CFTR蛋白发挥作用。这样,CFTR调节剂可使患有脑血管疾病,优选分别减少或受损害的脑血管灌注的患者中的脑血管Erk1/2磷酸化和鞘氨醇-1-磷酸信号传导和/或脑血管肌源性反应性和/或脑血管血流和/或神经元凋亡和/或脑血管损伤和/或正确的行为和学习缺陷正常化。
通常,具有脑血管疾病状态或疾病状态的患者分别具有原发性疾病状态,通常是依次引起所述脑血管疾病的潜在疾病,或至少与所述脑血管疾病状态相关的疾病状态。根据本发明,分别用所述一种或多种CFTR调节剂治疗或预防了优选的脑血管疾病,所述疾病由心脏病、心力衰竭(HF)、蛛网膜下腔出血(SAH)、突发感音神经性听力减退(suddensensoneurinal hearing loss,SSHL)、血管性痴呆、高血压、缺血性中风、出血性中风、心脏病、糖尿病和阿尔茨海默氏病引起。
根据本发明的“CFTR调节剂”是调节CFTR蛋白功能的化合物,使得它可以发挥其主要功能,即为氯离子(盐的一种成分)流过细胞表面创造通道
在本发明的上下文中,几种有用的CFTR调节剂在本领域中是已知的,并且优选地包括CFTR增强剂(potentiator)、CFTR校正剂(corrector)和CFTR放大剂(amplifier)。CFTR增强剂可增加CFTR通道的活性。CFTR校正剂可增加CFTR细胞表面表达。CFTR放大剂通过增加CFTR mRNA的量来增加表达的CFTR的量。本发明更优选的CFTR调节剂是对CFTR具有蛋白稳态作用的药物,特别是CFTR校正剂和CFTR放大剂,特别优选的是CFTR校正剂。CFTR校正剂也非常优选用于本发明中,因为即使当CFTR丰度低时,它们也具有很好的活性。
用于本发明的特别有用的CFTR校正剂化合物是环丙烷甲酰胺衍生物,例如在WO-A-2005/075435、WO-A-2007/021982、WO-A-2008/127399、WO-A-2009/108657和WO-A-2009/123896中公开的那些。用于本发明的其他优选的CFTR校正剂化合物是氨基杂环基衍生物,例如嘧啶衍生物,优选在WO-A-2010/068863、WO-A-2010/151747和WO-A-2011/008931中公开的化合物;氨基噻唑衍生物,优选在WO-A-2006/101740中公开的化合物;和喹啉/喹唑啉衍生物,优选在WO-A-2012/166654中公开的化合物;香豆素衍生物,优选在WO-A-2014/152213中公开的化合物,和三甲基白芷素衍生物,优选在WO-A-2012/171954中公开的化合物。在WO-A-2014/081821、WO-A-2014/081820和WO-A-2010/066912中公开了在本发明中使用的其他有用的CFTR校正剂化合物。用于本发明的其他CFTR校正剂化合物及其组合物包括转谷氨酰胺酶2(TG2)抑制剂和酪蛋白激酶2(CK2)抑制剂。用于本发明的优选的TG2抑制剂是半胱胺。用于本发明的优选的CK2抑制剂是表没食子儿茶素没食子酸酯(ECGC)。根据本发明的优选实施方式,组合使用TG2抑制剂(优选半胱胺)和CK2抑制剂(优选ECGC)。这样的组合可以体现为同时施用,优选以单一组合物的形式施用,但是也设想了同时施用两种单独的抑制剂,即TG2抑制剂和CK2抑制剂,每种抑制剂依原样或作为药物组合物的成分。在一个替代的实施方式中,TG2抑制剂和CK2抑制剂也可以顺序施用(同样,依原样或包含在合适的组合物中。对于TG2抑制剂和CK2抑制剂的组合,优选半胱胺和ECGC,还参考了US-A-2013/0310329。
用于本发明的CFTR调节剂的具体实例包括但不限于C18(VRT-534)、鲁玛卡托(VX-809)、替扎卡托(VX-661)、4,4’,6-三甲基白芷素、VRT-768、VRT-422、VRT-325、CFpot-532、Copo-22、002_NB_28(DBM228)、DBM_003_8Cl(DBM308)以及此类化合物的任何组合。根据本发明的最优选的CFTR调节剂是C18和鲁玛卡托。应当理解,本发明还涉及药学上可接受的盐、溶剂化物、这些酯的酯盐以及任何其他加合物或衍生物的应用,所述任何加合物或衍生物在施用于有需要的患者后能够直接或间接地提供用于本发明的CFTR调节剂或其代谢产物或残基。
本发明还涉及如上所述的CFTR调节剂,其用于治疗和/或预防上述病症。本发明还涉及如上所述的CFTR调节剂在制备用于治疗和/或预防上述病症的药物中的应用。
此外,本发明提供了一种预防和/或治疗上述病症的方法,该方法是通过向需要这种治疗的患者,优选人类患者,更优选患有脑血管疾病的患者施用至少一种(即,一种或多种)CFTR调节剂来进行的,所述患者分别与选自以下的一种或多种疾病相关或由其引起:心脏病、心力衰竭(HF)、蛛网膜下腔出血(SAH),突发感音神经性听力减退(SSHL)、血管性痴呆、高血压、缺血性中风、出血性中风、心脏病、糖尿病和阿尔茨海默氏病。
根据本发明,一种或多种CFTR调节剂可以以它/它们的游离形式使用。在其他实施方式中,本发明中使用的CFTR调节剂(即,至少一种CFTR调节剂)存在于药物组合物中,所述药物组合物包含所述至少一种CFTR调节剂,通常组合有至少一种药学上可接受的赋形剂、稀释剂、载体和/或载剂。
用于本发明的方法和应用的CFTR调节剂的有效量,即,任何特定患者或生物体的具体有效剂量水平将取决于多种因素,包括所治疗的病症和病症的严重性;所用特定化合物的活性;使用的具体组合物;患者的年龄、体重、总体健康状况、性别和饮食;施用时间、施用途径和所用特定化合物的排泄速率;治疗的持续时间;与所使用的特定化合物组合或同时使用的药物,以及医学领域众所周知的类似因素。
在本发明的上下文中,特别是关于鲁玛卡托和C18,优选的剂量是约0.1至约10mg/kg体重(以下称为“mg/kg”),优选约1至约8mg/kg,更优选约3至约5mg/kg。该剂量通常可以一次或多次施用,例如每天两次或三次。优选地,剂量每天施用一次或两次。
CFTR调节剂的施用途径不是特别关键的,并且所选择的途径取决于施用的个体CFTR调节剂化合物以及所治疗的受试者。优选地,CFTR调节剂全身性地例如口服或通过静脉内施用而施用,其中特别优选口服施用。也可以考虑局部应用,特别优选的局部途径是注射入脑脊液。
如本文所用,术语“患者”是指动物,优选为哺乳动物,最优选为人。
根据本发明使用的优选存在于上述药物组合物中的至少一种CFTR调节剂可以使用有效治疗脑血管疾病的任何量和任何施用途径来施用。根据本发明,应当理解,术语“治疗”是指疾病的严重性与未治疗的疾病相比至少没有进展,优选疾病的严重性没有进展,更优选病情的严重性减轻,甚至更优选病情的严重性实质减轻,并且理想地病情在实质程度上得到了治愈。优选地,本发明病症的严重性降低至少30%,更优选降低至少50%,特别是降低至少70%,甚至更优选降低至少90%,疾病的完全治愈是本发明治疗最优选结果。
关于分别作为本应用和方法的目标的脑血管疾病,通常根据本领域技术人员已知的医学和诊断方法通过对被治疗受试者进行神经学评估来评估脑血管疾病的严重性的减轻程度或治愈程度,这优选在根据本发明的治疗之前,优选在本发明的治疗开始后的典型间隔中进行。这样的评估优选包括基于MRI的脑灌注测量,例如以下实例中所述(可选地适用于被检查的患者,例如当患者是人类患者时)。
本发明还涉及CFTR调节剂(优选如本文公开的那些)在预防和/或治疗以下疾病中的应用:肺部疾病,优选肺动脉高压,更优选继发性肺部疾病,特别是继发性肺动脉高压,它们分别与以下相关或由以下引起:某些原发性疾病,例如动脉硬化、心血管疾病(CVD,例如冠状动脉疾病(CAD)(心绞痛和心肌梗塞(通常称为心脏病发作))、中风、心力衰竭、高血压性心脏病、风湿性心脏病、心肌病、心律失常、先天性心脏病、瓣膜性心脏病、心脏炎、主动脉瘤、外周动脉疾病、血栓栓塞性疾病和静脉血栓形成。本发明还提供了在预防和/或治疗以下疾病的方法:肺部疾病,优选肺动脉高压,更优选继发性肺部疾病,特别是继发性肺动脉高压,它们分别与以下相关或由以下引起:某些原发性疾病,例如动脉硬化、心血管疾病(CVD,例如冠状动脉疾病(CAD)(心绞痛和心肌梗塞(通常称为心脏病发作))、中风、心力衰竭、高血压性心脏病、风湿性心脏病、心肌病、心律失常、先天性心脏病、瓣膜性心脏病、心脏炎、主动脉瘤、外周动脉疾病、血栓栓塞性疾病和静脉血栓形成,所述方法包括对有需要的患者施用有效量的至少一种CFTR调节剂的步骤,优选如本文更具体公开的CFTR调节剂。
附图显示:
图1.在CFTR
(A)相对于野生型(WT)同窝仔对照,在从囊性纤维化跨膜电导调节剂(CFTR)ΔF508突变小鼠中分离出的后脑动脉(PCA)中肌源性血管收缩作用更强。(B)从CFTR
图2.C18通过蛋白稳态机制增加野生型CFTR蛋白的表达和功能
(A)从用C18(每天3mg/kg,持续2天;n=5)治疗过的新生小鼠(
图3.C18恢复心力衰竭中的脑灌注
(A)与从假手术分离的动脉(n=6)相比,从心力衰竭(HF;左前降支冠状动脉结扎后6周)小鼠分离出的脑动脉的囊性纤维化跨膜电导调节剂(CFTR)蛋白表达降低(n=5)。体内C18治疗(每天3mg/kg,连续2天)消除了脑动脉CFTR蛋白表达的这种降低(n=8)。(B)体内C18治疗降低了从HF小鼠分离的后脑动脉的肌源性张力,在从CFTR敲除(KO)小鼠分离的后脑动脉中未观察到效果(C)。在45mmHg(dia
图4.C18不诱发脑水肿
显示的是代表性的定量T
图5.C18恢复蛛网膜下腔出血中的脑灌注
(A)相对于从假手术对照(n=6)分离出的动脉,从蛛网膜下腔出血(SAH;SAH诱导后2天)小鼠分离出的脑动脉中囊性纤维化跨膜电导调节剂(CFTR)蛋白表达降低(n=6)。体内C18治疗(每天3mg/kg,持续2天)消除了动脉CFTR蛋白表达的这种降低(n=6)。(B)体内C18治疗降低了从SAH小鼠分离出的嗅动脉中的肌源性张力,这是从CFTR基因敲除(KO)小鼠分离出的嗅动脉中未观察到的效果(C)。在45mmHg(dia
图6:鲁玛卡托通过蛋白稳态机制增加野生型CFTR蛋白表达,并恢复蛛网膜下腔出血的脑灌注
(A)从用鲁玛卡托(Lum;每天3mg/kg,持续2天;n=6)的新生小鼠中分离出的脑动脉比从载剂对照(n=7)中收集的动脉具有更高的囊性纤维化跨膜电导调节剂(CFTR)蛋白表达。(B)鲁玛卡托不影响脑动脉CFTR mRNA表达(两组均n=5)。(C)鲁玛卡托(6μmol/L;24h)增加稳定表达人CFTR的幼年仓鼠肾成纤维细胞中的CFTR蛋白表达(两组均n=13);(D)鲁玛卡托在该系统中不影响CFTR mRNA表达(两组均n=6)。(E)相对于从假手术的对照中分离的动脉(n=6),从蛛网膜下腔出血(SAH;SAH诱导后2天)的小鼠分离的脑动脉具有降低的CFTR蛋白表达(n=5)。鲁玛卡托体内治疗(每天3mg/kg,持续2天)消除了脑动脉CFTR蛋白表达的这种降低(n=6)。(F)鲁玛卡托体内治疗可降低从SAH小鼠分离的嗅动脉中的肌源性张力。在45mmHg处的平均最大血管直径(dia
图7:CFTR校正减少了蛛网膜下腔出血中的神经元损伤
显示的是皮层细胞的代表性图像,其染色显示经切割的半胱天冬酶-3的表达(顶部),而Fluoro-Jade(底部)则显示了涉及以下的同类物:(A)C18(每天3mg/kg,持续2天)和(B)鲁玛卡托(Lum;每天3mg/kg,持续2天)的治疗方案。蛛网膜下腔出血(SAH;n=13只小鼠)相对于假手术对照组(n=12)增加了(C)半胱天冬酶-3和(D)Fluoro-Jade阳性细胞的数量;C18(n=6)和鲁玛卡托(n=5)都消除了半胱天冬酶-3和Fluoro-Jade染色的增加。(E)与假手术小鼠(n=11)相比,SAH(n=11)小鼠的改良Garcia评分(最高评分=18;在SAH后2天进行盲法评估)较低;C18治疗(n=10)将神经学评分恢复到假手术水平。所有数据均为平均值±s.e.m.*表示对于用Kruskal-Wallis检验和Dunn事后检验与假手术的不成对比较,P<0.05。在图C和D中,与未经治疗的SAH(使用Kruskal-Wallis测试和Dunn事后测试)相比,+表示P<0.05。缩写:Lum-鲁玛卡托;SAH-蛛网膜下腔出血。
图8:FAIR-EPI和分析图像中的感兴趣区域放置
显示的是经历过心力衰竭(上排)或蛛网膜下腔出血(SAH;下排)手术程序的小鼠的代表性解剖学T2加权,流动敏感交互式反转恢复(FAIR)T1加权和FAIR脑血流(CBF)图。使用MIPAV软件在825毫秒的反转时间(TI)上获取的前脑切片FAIR图像上手动绘制感兴趣区域。如图所示,感兴趣的区域在1个半球内包含约1mm
缩写:CBF-脑血流量;EPI-回波平面成像;FAIR-流动敏感交互式反转恢复;SAH-蛛网膜下腔出血。
图9:CFTR敲除小鼠的平均动脉压
相对于野生同窝仔(WT;n=6),囊性纤维化跨膜电导调节剂敲除小鼠(CFTR KO;CFTRtm1Unc;n=6)的平均动脉压较低。*表示对于不成对t检验比较,P<0.05。
缩写:CFTR-囊性纤维化跨膜电导调节剂;KO-敲除;WT-野生型
图10:小鼠提睾肌动脉中的苯肾上腺素反应
苯肾上腺素刺激从野生型和囊性纤维化跨膜电导调节剂敲除小鼠(CFTR KO;CFTRtm1Unc)小鼠分离的提睾骨骼肌动脉中的剂量依赖性血管收缩。(A)体外CFTR抑制(100nmol/L CFTR(inh)-172持续30分钟)或(B)CFTR基因缺失不改变苯肾上腺素的剂量-响应关系。60mmHg(diamax)时的平均最大血管直径为:野生型(图A):72±3μm,n=5,来自4只小鼠的;CFTR KO(图B):88±4μm,n=6,来自4只小鼠;和野生型同窝仔(图B):79±4μm,n=5,来自2只小鼠。将图A中的剂量-响应曲线以成对的双向ANOVA(P=NS)进行比较;将图B中的曲线以不成对的双向ANOVA(P=NS)进行比较。对于图B,KO和野生型diamax值没有不同(t检验P=NS)。
缩写:CFTR-囊性纤维化跨膜电导调节剂;diamax-最大血管直径;KO-敲除;NS-不显著。
图11:体内C18治疗后小鼠后脑动脉中的苯肾上腺素响应
(A)苯肾上腺素刺激从心力衰竭(HF)小鼠和经C18体内治疗的心力衰竭小鼠分离的后脑动脉的剂量依赖性血管收缩(每天3mg/kg腹腔内注射,持续2天)。统计分析鉴定了两条曲线之间的显著差异(即,相对于HF+C18,HF引起的动脉张力明显升高)。但是,(B)当将数据相对于基础张力标准化(张力
缩写:diamax-最大血管直径;HF-心力衰竭;NS-不显著。
图12:体内C18治疗不改变从假手术小鼠分离的后脑动脉的肌源性张力或苯肾上腺素响应
体内C18治疗(每天3mg/kg腹腔注射,持续2天)不改变从假手术小鼠分离出的后脑动脉的(A)肌源性张力或(B)苯肾上腺素响应。图A中45mmHg的最大平均血管直径(diamax):假手术:146±9μm,n=5,来自3只小鼠;假手术+C18:138±9μm,n=7,来自4只小鼠(t检验P=NS);在图B中,假手术:148±7μm,n=6,来自3只小鼠,假手术+C18:130±10μm,n=5,来自3只小鼠(t检验P=NS)。将两个图中的曲线以双向ANOVA(P=NS)进行比较。
缩写:diamax-最大血管直径;NS-不显著。
图13:用C18治疗的CFTR基因敲除小鼠的后脑动脉中的苯肾上腺素响应
苯肾上腺素刺激从囊性纤维化跨膜电导调节剂敲除小鼠(CFTR KO;CFTRtm1Unc)分离出的后脑动脉中的剂量依赖性血管收缩。体内C18治疗(每天3mg/kg腹膜内注射,持续2天)不会改变苯肾上腺素的剂量-响应关系。45mmHg的平均最大血管直径(diamax)为:CFTRKO:142±5μm,n=6,来自3只小鼠和CFTR KO+C18:145±5μm,n=6,来自3只小鼠(t检验P=NS)。将曲线以双向ANOVA(P=NS)进行比较。
缩写:CFTR-囊性纤维化跨膜电导调节剂;diamax-最大血管直径;KO-敲除;NS-不显著。
图14:顶端和基底树突的击穿Sholl分析
(A)显示的是Sholl分析直方图,其绘制了顶端树突的树突交叉点数量(即树突分支)与树突长度(即距神经元胞体的距离)。在假手术(n=13个神经元,来自N=4只小鼠)、心力衰竭(HF;n=11;N=4)和HF+C18(每天3mg/kg,腹膜内,持续2周;n=11;N=4)组中,未观察到分支形态的差异;然而,相对于假手术组和HF+C18组,HF小鼠的顶端树突长度较短。因此,(B)相对于假手术小鼠,HF小鼠的平均顶端树突长度(即,最大半径)显著减小;通过C18治疗可以使这种效果正常化。类似地,(C)基底树突的Sholl分析直方图显示,假手术(n=12;N=4)、HF(n=13;N=4)和HF+C18(n=11;N=4)组之间分支形态不显示差异;然而,相对于假手术组和HF+C18组,HF小鼠的基底树突长度较短。因此,相对于假手术小鼠,HF小鼠中的(D)平均基础树突长度(即,最大半径)显著降低,该效果通过C18治疗来标准化。*表示对于用单向ANOVA和Dunnett事后检验与假手术组进行的非成对比较,P<0.05。
缩写:HF-心力衰竭。
图15:顶端树突的棘密度分析
(A)假手术(n=8个神经元,来自N=4只小鼠)、心力衰竭(HF;n=6;N=3)和HF+C18小鼠(每天3mg/kg,腹膜内,持续2周;n=10;和N=4)中,顶端树突棘密度(即突触密度的量度)在树突的整个长度上相对一致,产生的斜率在统计学上与0没有显著不同。(B)尽管存在趋势,但距胞体60-100μm处的平均顶端树突棘密度测量值没有统计学意义。将各组以单向ANOVA(P=NS)进行统计学比较。
缩写:HF-心力衰竭;NS-不显著。
图16:体内C18治疗后小鼠嗅觉脑动脉中的苯肾上腺素响应
(A)苯肾上腺素刺激从蛛网膜下腔出血(SAH)小鼠和经体内C18(每天3mg/kg腹腔注射,每天2天)治疗的SAH小鼠分离的嗅觉脑动脉中的剂量依赖性血管收缩。尽管存在清楚的分离趋势,但是两条曲线在统计上并没有不同。(B)将数据相对于基础张力标准化(张力
缩写:diamax-最大血管直径;NS-不显著;SAH–蛛网膜下腔出血。
图17:C18不影响假手术小鼠的肌源性张力或苯肾上腺素响应
体内C18治疗(每天3mg/kg,腹膜内,持续2天)不改变从假手术小鼠分离出的嗅觉脑动脉中的(A)肌源性张力或(B)苯肾上腺素的剂量响应关系。在45mmHg(diamax)处的平均最大血管直径为:假手术:113±3μm,n=5,来自3只小鼠;Sham+C18:110±8μm,n=6,来自4只小鼠(t检验P=NS)。将曲线以双向ANOVA进行比较。
缩写:diamax-最大血管直径;NS-不显著。
图18:从CFTR基因敲除小鼠中分离出的嗅觉脑动脉中的苯肾上腺素响应
苯肾上腺素刺激从囊性纤维化跨膜电导调节剂敲除小鼠(CFTR KO;CFTRtm1Unc)分离出的嗅觉脑动脉中的剂量依赖性血管收缩,其类似于野生型(WT)同窝仔。体内C18治疗(每天3mg/kg,腹膜内,持续2天)不改变苯肾上腺素的剂量响应关系。45mmHg(diamax)时的平均最大血管直径为:WT:98±6μm,n=8,来自4只小鼠;CFTR KO:110±8μm,n=5,来自4只小鼠,CFTR KO+C18:96±6μm,n=6,来自3只小鼠(单向ANOVAP=NS)。将曲线以双向ANOVA进行比较。
缩写:CFTR-囊性纤维化跨膜电导调节剂;diamax-最大血管直径;KO-敲除;NS-不显著;WT-野生型。
图19.体内鲁玛卡托治疗后小鼠嗅觉脑动脉中的苯肾上腺素响应
体内鲁玛卡托(Lum)治疗(每天3mg/kg腹腔注射,持续2天)不改变从蛛网膜下腔出血(SAH)小鼠分离的嗅觉脑动脉中苯肾上腺素的剂量响应关系。45mmHg的平均最大血管直径(diamax)为:SAH:86±2μm,n=6,来自3只小鼠;SAH+Lum:87±4μm,n=7,来自4只小鼠(t检验P=NS)。将曲线以双向ANOVA进行比较。
缩写:diamax-最大血管直径;Lum-鲁玛卡托;NS-不显著;SAH-蛛网膜下腔出血。
本发明通过以下非限制性实施例进一步说明。
实施例
方法和试剂
试剂
用于检测幼年仓鼠肾成纤维细胞中的CFTR的抗人囊性纤维化跨膜电导调节剂(CFTR)抗体(抗体596),CFTR校正剂治疗剂“C18”(CF-106951;参见WO 2007/021982;1-(苯并[d][1,3]二噁唑-5-基)-N-(5-((2-氯苯基)(3-羟基吡咯烷-1-基)甲基)噻唑-2-基)环丙烷甲酰胺通过囊性纤维化基金会治疗化学和抗体分配计划(
CFTR突变和敲除小鼠
ΔF508CFTR突变纯合的雄性小鼠(CFTRtm1EUR;在本研究中称为“ΔF508”)(2),CFTR基因缺失(CFTRtm1Unc;指定为CFTR-/-)和互补的野生型对照同窝仔从已在多伦多儿童病医院建立的种群处获得(所有CFTR-/-、CFTRΔF508和野生型同窝仔都是混合品系)。发现CFTR-/-小鼠在麻醉下极易死亡。虽然对于涉及脑动脉隔离的实验(例如,图3C和5C)来说,该死亡率不是问题,但它极大地混淆了脑血流和全身血流动力学测量。与CFTR-/-小鼠不同,CFTRΔF508突变小鼠在麻醉期间不易死亡。由于CFTRΔF508突变会大大减少CFTR向质膜的运输(3),因此CFTRΔF508小鼠模型中的CFTR活性非常低(2,4,5)。因此,CFTRΔF508模型为脑血流和全身血流动力学测量提供了CFTR-/-小鼠的替代品。我们没有寻找CFTR-/-死亡率的根本原因。众所周知,CFTR-/-和CFTRΔF508都会对应激产生不利的反应。例如,居住条件和运输是两个显著的应激源,可以显著增加死亡率(6)。有趣的是,CFTRΔF508小鼠比CFTR-/-小鼠表现出更不严重的表型(5,6):这可能是由于CFTRΔF508动物中存在少量残余CFTR活性所致(2)。在这种情况下,我们怀疑CFTR-/-小鼠可能对我们动物设施中的外部环境应激源(例如,居住条件、噪音和处理)更敏感,其最终表现为麻醉下死亡率增加。作为实验模型,CFTRΔF508小鼠具有与CFTR功能丧失相关的几种异常情况。肠道并发症是CFTR突变的最明显病理学影响:这也是产后死亡率的主要原因(6,7)。常见的胃肠道问题包括浓稠的粘液停留、运动障碍和肠梗阻的强烈倾向。相对于野生型,CFTRΔF508小鼠的体重/大小小40-50%,不过它们可以较好生长至成年(6,7)。相对于野生型小鼠,还观察到其他一些差异,然而,这些似乎相对次要(6,7)。例如,已经注意到某些组织(例如,肾脏、胆囊、鼻上皮)中氯离子电流和/或钠转运发生了变化,但是这些差异的病理学意义尚不清楚,因为这些组织似乎并未受到组织学上的损害(6,7)。值得注意的是,相对于人囊性纤维化,CFTRΔF508小鼠(和一般而言CFTR突变小鼠)具有相当温和的囊性纤维化表型。CFTRΔF508小鼠的下呼吸道基本上是正常的:没有下呼吸道上皮异常,并且在没有激发的情况下不会自发发生肺部炎症(6,7)。胰腺、胆囊、肝脏、胆管、雄性生殖道、泪腺和颌下腺均无明显的组织病理学表现(5-7)。缺乏严重的囊性纤维化表型可部分归因于在某些小鼠组织中可补偿CFTR的丧失的非CFTR,钙激活的氯离子通道(CACC)的表达(7,8)。
总血液动力学参数
如前所述(9-11),超声心动图测量是通过30MHz机械扇形换能器(Vevo 770;Visual Sonics,Toronto,Canada)与平均动脉压(MAP)测量(Millar SPR-671微尖端-小鼠压力导管;Inter V Medical Inc.,Montreal,Canada)结合收集。利用主动脉根部正上方的脉搏波多普勒,测量主动脉血流速度-时间积分(VTI)。由主动脉根尺寸(ARD)计算主动脉横截面积(CSA):CSA=π(ARD/2)2。中风量(SV)、CO和TPR的计算公式为:SV=CSA x VTI;CO=SV x HR;TPR=MAP/CO。
基于MRI的脑灌注测量
如前所述(10-12),我们利用了流动敏感交互式反转恢复(FAIR)磁共振成像(MRI)技术(13)来评估脑血流(CBF)。在成像过程中,通过鼻锥递送的1.8%异氟烷固定了小鼠。为了保持体温,MRI配备了嵌入式管,可对来自外部加热器-泵的水进行对流。用气动枕头(SAInstruments,Stonybrook,USA)监测呼吸;调整异氟烷水平以将呼吸维持在大约50呼吸/分钟。
使用7特斯拉的微-MRI系统(BioSpec 70/30USR,Bruker BioSpin,Ettlingen,Germany)获得FAIR图像,该系统包括B-GA12梯度插入物,用于RF传输的72mm内径线性体积共振器和前部放置的头部射频接收线圈。与非选择性反转准备相比,FAIR将切片选择性分离后的灌注作为加速的T1信号弛豫隔离,按照计算公式:CBF=l(1/T1,ss–1/T1,ns)(ml/(100g*min),其中“ss”和“ns”分别表示切片选择和非选择测量,l是血脑分配系数,定义为每克脑组织和每毫升血液中水的浓度之比。该系数在小鼠中为约90ml/100g(14)。在我们研究中使用的FAIR优化是具有前面绝热反转的单次回波平面成像(EPI)技术,参数包括回波时间12.5ms,重复时间17s,18反转时间范围从25到6825毫秒,以400毫秒为增量,3毫米切片选择性反转板,18x18毫米视场,具有72x72矩阵,面内分辨率为250μm,切片厚度1毫米,10分钟12s数据采集时间。在前脑、中脑和后脑垂直部分重复采集,对应于前循环、混合循环和后循环。通过对半球以下的感兴趣区域(ROI)(将其称为“全球”)和对应于前脑部分的皮层和皮层下实质的局部ROI;中脑部分的皮层和脑室旁实质;以及后脑部分的皮层和中脑实质手动处方(MIPAV,NIH,Bethesda,MD;
细胞培养
如(10)中所述进行分离和培养肠系膜动脉平滑肌细胞的程序。简而言之,分离肠系膜动脉节段,切成小块,并用胰蛋白酶、胶原酶和弹性蛋白酶消化。将所得的细胞悬浮液在磷酸盐缓冲液中洗涤数次,然后铺板在含10%胎牛血清和1%青霉素-链霉素的Dulbecco's Modified Eagle Medium(DMEM)培养基中。将细胞培养物保持在37℃,5%CO
FITC-S1P摄取的基于FACS的测量
如前所述(10),将细胞单层(经处理或未处理)与1μmol/L S1P-FITC温育60分钟;然后通过胰蛋白酶消化分离细胞,用冰冷的PBS洗涤两次,通过35μm细胞过滤器过滤,并使用由FACS DIVA版本6.1软件操作的Becton-Dickinson FACS Canto进行分析。用未标记的S1P处理的细胞单层用作背景对照。分析程序确定了每个细胞群体的平均荧光强度(任意单位),这是摄取的量度。
碘外流(iodide efflux)评估
碘外流测量如前所述进行(18)。简而言之,通过在基于HEPES的上样缓冲液(136mmol/L NaI,3mmol/L KNO
蛋白免疫印迹
如前所述(12,18)完成了CFTR的蛋白免疫印迹。通过在含有50mM Tris(pH 7.3),150mM NaCl,2mM ETDA,0.1%Triton-X-100、0.1%SDS和蛋白酶抑制剂的裂解缓冲液中研磨动脉样品来制备脑动脉裂解物;使用相同的裂解缓冲液来制备细胞培养物裂解物。裂解后,将样品离心(13,500g下10分钟;4℃)以除去不溶物。在聚丙烯酰胺电泳之前,立即添加额外的SDS(至2%的最终浓度),甘油(至2%的最终浓度),β-巯基乙醇(至2%的最终浓度)和二硫苏糖醇(2mM的最终浓度)。蛋白质在7%丙烯酰胺凝胶上进行电泳分离,并转移到聚偏二氟乙烯(PVDF)膜上。将膜在5%脱脂牛奶(在含有1%Tween 20(PBST);137mM NaCl,2.7mM KCl,10mM Na2HPO4,1.76mM K2HPO4;pH 7.4的磷酸盐缓冲液)中封闭30-40分钟。一抗处理包括:(i)兔多克隆抗CFTR(在5%牛奶/PBST中为1:1,000;Cell SignalingTechnology via New England Biolabs Canada;Whitby,Canada;目录号2269);脑动脉和血管平滑肌细胞裂解物。
(ii)小鼠单克隆抗人CFTR(在5%牛奶/PBST中1:20,000稀释度;“抗体596”);幼年仓鼠肾成纤维细胞裂解物。
(iii)小鼠单克隆抗α-微管蛋白(1:5,000在5%牛奶/PBST中;克隆DM1A;CellSignaling Technology via New England Biolabs Canada;目录号3873)。
一抗与过氧化物酶标记的驴抗兔IgG(GE Healthcare Amersham(Piscataway,USA)目录号NA934)或过氧化物酶标记的山羊抗小鼠IgG(GE Healthcare Amersham目录号NA931)偶联。使用标准化学发光程序(Westar ETA C;VPQ Scientific,Toronto,Canada)来曝光X射线胶片或收集数字图像(ChemiDoc;Bio-Rad Laboratories;Mississauga,Canada)。使用“Image J”软件(可从NIH免费获得)以密度方式评估显影的胶片。使用ImageLab软件(Bio-Rad)评估数字图像。
RNA分离和逆转录
按照制造商的说明,使用蛋白酶K消化和DNA去除程序,使用Norgen Biotek(Thorold,Canada)的“Total RNA Purification Micro”旋转柱分离阻力动脉RNA。用Agilent Technologies RNA 6000Pico试剂盒和生物分析仪对洗脱的RNA进行定量;分析证实从动脉组织样品中回收了高质量的RNA(RNA完整性[RIN]:脑=8.4±0.1,n=5;睾提肌=8.2±0.4,n=6)。从幼年仓鼠肾脏成纤维细胞中分离RNA遵循相同的程序,但省略了蛋白酶K的消化步骤。在所有情况下,根据制造商的指导,使用“Superscript III”逆转录试剂盒(Invitrogen Life Technologies;Burlington,Canada)将RNA转化为cDNA。通过将所得的cDNA与RNAse H(0.125U/μl;New England Biolabs Canada;Whitby,Canada)温育,去除残留的RNA。
定量PCR
使用Applied Biosystems ViiA
免疫组织化学和Fluoro-Jade染色的脑固定和玻片制备
与临床观察到的情况(SAH后4-12天)相比,实验小鼠SAH模型(SAH后2-5天)(12,19-21)的延迟血管收缩和脑损伤的发展更为迅速(22,23)。我们基于先前的工作选择SAH诱导后2天的时间点来进行损伤标记评估,先前的工作证明在该时间点存在明显的神经元损伤和行为缺陷(12)。SAH诱导后2天,用异氟烷麻醉动物;它们的大脑分别用磷酸盐缓冲液(PBS)灌注,然后用磷酸盐缓冲的多聚甲醛(4%;pH 7.4)灌注固定,这两者都是通过升主动脉进行的。立即解剖大脑,并在前囟后1mm处切成冠状切片。将这些脑切片在4℃下在4%多聚甲醛(pH 7.4)中后固定48小时,然后在10%蔗糖中温育(3小时),然后在30%蔗糖中温育过夜(4℃)进行细胞保护。然后将脑切片在异戊烷和干冰上包埋在OCT(Sakura FinetekUSA;Torrance,USA)中。在“Tissue Path Superfrost Plus Gold”载玻片(FisherScientific;Whitby,Canada)上收集低温切片(5μm厚的冠状切片),并在-80℃下保存直至使用。
荧光免疫组织化学
所有样品均用10分钟蛋白酶(20μg/ml;Promega;Madison,USA)预处理,然后用PBS中10%正常驴血清(Jackson ImmunoResearch Laboratories;West Grove,USA)或PBS中含1%牛血清白蛋白的10%山羊血清(Invitrogen Life Technologies;Burlington,Canada)进行标准的60分钟封闭程序。将脑切片与单克隆兔抗人活性裂解的半胱天冬酶-3(克隆C92-605;1:1000稀释;D Biosciences Canada;Mississauga Canada)温育,并与AlexaFluor 488山羊抗兔IgG(Invitrogen)偶联。两种抗体均在Can
Fluoro-Jade染色
将脑切片与1%NaOH/80%乙醇(5分钟),70%乙醇(2分钟),蒸馏水(2分钟)和0.06%高锰酸钾(10分钟)连续温育。用去离子水洗涤后,将脑切片用在0.1%乙酸中的0.0004%Fluoro-jade B(Histo-Chem Inc.,Jefferson,USA)染色(15分钟)。然后将样品用去离子水洗涤,干燥并通过浸入二甲苯中1分钟使其澄清。用DPX安装介质(Sigma)来安装玻片。
数字成像和通过细胞计数评估脑损伤
使用Zeiss LSM 710共聚焦激光扫描显微镜结合Zeiss ZEN 2010软件获得数字免疫荧光图像(血管图像)。使用免费提供的ImageJ 1.44p软件(美国国立卫生研究院)构建重叠图。如前所述,两个独立的评估者在盲法条件下对半胱天冬酶-3和Fluoro-Jade阳性细胞进行了计数(12)。对于每只动物,从前囟后1mm的单个冠状脑切片的皮层区域(放大200倍)获得计数,该区域包括左侧和右侧颞叶和顶叶。将每个评估者计数的阳性细胞数平均,得出平均阳性细胞数/动物,然后将其用于统计分析。
树突形态的组织学分析:
通过跨心灌注(transcardiac perfusion)向脑灌注肝素化盐水,使用市售的Rapid GolgiStain试剂盒(FD NeuroTechnologies Inc.;Columbia,USA)进行分离和加工/染色。该试剂盒使用最初由Glaser和Van der Loos(24)描述的改良的Golgi-Cox染色程序。简而言之,将分离的脑组织样品浸入试剂盒提供的溶液中,该溶液包含氯化汞、重铬酸钾和铬酸钾,在黑暗中浸泡8天;然后与组织保护溶液一起温育6天。然后洗脑样品,将其包埋在4%低胶凝琼脂糖中,在冠状平面(150μm厚度;Campden Instruments7000smz-2振动切片机)上切片,并安装在涂明胶的载玻片上。然后根据制造商的说明,使用试剂盒提供的显影/染色试剂完成染色过程。使用基于立体学的NIS Elements AR软件,在具有电动X、Y和Zfocus的尼康Eclipse Ti2显微镜上对神经元和树突节段成像,以获取高分辨率图像(Nikon Instruments Europe;Amsterdam,The Netherlands)。我们使用最初由Sholl(25)描述的定量方法分析了来自额叶皮层的锥体皮层神经元的基底和顶端树突网络。我们将Image J软件与半自动化的Simple Neurite Tracer插件(均可从NIH免费获得)结合使用,以从200倍放大率的超叠图像中识别并数字化隔离单个皮层神经元的树突网络。利用指针工具标记胞体的中心;然后通过Sholl分析(参见https://imagej.net/Sholl_Analysis,版本3.7.4)对树突形态进行表征,间隔为5μm,最大半径为300μm。该分析通过树突交叉点(即分支)和树突长度来表征树突形态。对于每个治疗组,在盲条件下分析来自4只小鼠的每只小鼠2-4个神经元。为了评估树突棘密度(即,在树突上发现的小突起的数量),我们以100x的放大倍率成像了第3个分支顺序的树突节段。棘密度测量为以下节段的每个节段的棘数:距离主体20-50μm;距离主体30-60μm;距离主体50-80μm;距离胞体60-100μm)。这种“滑动测量”方法允许评估在树突分支的整个长度上棘密度如何变化。对于每个治疗组,在盲条件下,从每组3-4只小鼠的每只小鼠的2-4个锥体皮层神经元(每个神经元2-4个三阶分支)中测量棘密度。
如上所述,通过Cystic Fibrosis Foundation Therapeutics化学和抗体分配计划获得了CFTR校正剂C18和抗人CFTR抗体(称为“596”)。如上所述,使用的所有其他试剂是可商购的。
动物:University of Toronto和University Health Network(UHN)的机构动物护理和使用委员会批准了所有动物护理和实验方案。市售的雄性野生型小鼠(2-3个月;C57BL/6N)购自Charles River Laboratories(Montreal,Canada)。从多伦多儿童病医院建立的集落中获得纯合的ΔF508CFTR突变(CFTR
心肌梗塞:HF是由左前降支冠状动脉的手术结扎引起的(3)。简要地,用异氟烷麻醉小鼠,用20号血管导管插管并用室内空气通气。在无菌条件下,打开胸腔和心包,并用7-0丝线永久缝合结扎左冠状动脉前降支(Deknatel;Fall River,USA)。在假手术的对照中,打开胸廓和心包,但左前降支冠状动脉未结扎。手术后,关闭胸部,并在自发呼吸时将小鼠拔管。梗死后4-6周分离出后脑动脉(PCA)。
蛛网膜下腔出血的诱导:使用明确表征的实验SAH模型(6)。简要地说,麻醉每只小鼠(异氟醚)并将其头部固定在立体定向框架中;沿前头皮的中线切开一个7mm的切口,并在前囟前4.5mm的颅骨上钻一个0.9mm的孔。将一根棘针推进到交叉池:在10秒钟内将80μl的动脉血注入颅内腔。注射的血液是在注射前立即从单独的野生型供体小鼠(通过心脏穿刺)获得的,不含抗凝剂。注射后,闭合头皮切口。丁丙诺啡(0.05mg/kg;0.5-1.0ml体积)每天两次施用(在SAH外科手术步骤后立即开始)。假手术动物接受相同的外科手术步骤,注射无菌生理盐水代替血液。SAH诱导后第2天分离出嗅觉脑动脉。
阻力动脉的分离和功能评估:仔细解剖小鼠嗅觉(前脑动脉的第一分支)和PCA,将其插在微量移液管上,拉伸至其体内长度,并加压至45mmHg,如前所述(3,6);从提睾肌切开小鼠骨骼肌阻力动脉,插管并加压至60mmHg。所有功能实验均在37℃的3-吗啉代丙烷磺酸(MOPS)缓冲盐水中进行,无灌注。对苯肾上腺素的血管舒缩反应(后脑动脉为5μmol/L,提睾骨骼肌动脉为10μmol/L)在每个实验的开始和结束时均评估了血管的生存能力。排除不能显示对苯肾上腺素收缩≥25%的动脉。
通过逐步20mmHg增量将跨壁压力从20mmHg逐步增加到80mmHg(嗅动脉)或100mmHg(后脑动脉和提睾骨骼肌阻力动脉),而引起肌源性反应。在每个压力步骤中,一旦达到稳定状态(5分钟),就测量血管直径(dia
将肌源性张力计算为相对于每个各自的跨壁压力下最大直径的收缩百分比:张力(dia
基于磁共振成像的脑血流测量:如前所述,采用非侵入性磁共振成像(MRI)方法(FAIR技术)来评估脑灌注(6)。简而言之,FAIR技术将灌注隔离为加速的T
基于磁共振成像的水肿测量:使用7特斯拉显微MRI系统(Bruker CorporationBiospec 70/30USR;Ettlingen,Germany)通过定量T
神经功能评估:如先前所述(6),使用改良的Garcia评分评估神经功能。神经学评估由6个领域组成:自发活动,所有4个肢体的自发运动,前伸,攀爬,身体本体感受和对触摸的响应。SAH后2天,对两名失明的观察者进行了神经系统评估。最大分数为18,表明神经功能正常。
统计学:所有数据均表示为平均值±SEM,其中n是独立度量(即样本、容器评估或实验对象)的数量。为了进行统计比较,将具有精确p值计算的非参数Mann Whitney检验用于两个独立组的比较。为了比较多个独立组,使用了非参数单向ANOVA(Kruskal Wallis),然后进行了Dunn事后检验。为了评估肌源性响应和剂量-响应关系,我们采用双向ANOVA对数据进行了分析,然后进行了Tukey的事后检验。P<0.05时差异被认为是显著的。图6中显示的所有数据都是在盲法条件下收集的;本研究中提供的所有其他数据均不需要盲法,也不在盲法条件下收集。
在上面的方法和试剂部分中引用了以下参考文献:
1.Cui L,Aleksandrov L,Chang XB,et al.Domain interdependence in thebiosynthetic assembly of CFTR.J Mol Biol 2007;365:981-94.
2.van Doorninck JH,French PJ,Verbeek E,et al.A mouse model for thecystic fibrosis delta F508 mutation.EMBO J 1995;14:4403-11.
3.Van Goor F,Straley KS,Cao D,et al.Rescue of DeltaF508-CFTRtrafficking and gating in human cystic fibrosis airway primary cultures bysmall molecules.Am J Physiol Lung Cell Mol Physiol 2006;290:L1117-30.
4.French PJ,van Doorninck JH,Peters RH,et al.A delta F508 mutation inmouse cystic fibrosis transmembrane conductance regulator results in atemperature-sensitive processing defect in vivo.J Clin Invest 1996;98:1304-12.
5.Zeiher BG,Eichwald E,Zabner J,et al.A mouse model for the deltaF508 allele of cystic fibrosis.J Clin Invest 1995;96:2051-64.
6.Wilke M,Buijs-Offerman RM,Aarbiou J,et al.Mouse models of cysticfibrosis:phenotypic analysis and research applications.J Cyst Fibros 2011;10Suppl 2:S152-71.
7.Lavelle GM,White MM,Browne N,McElvaney NG,Reeves EP.Animal Modelsof Cystic Fibrosis Pathology:Phenotypic Parallels and Divergences.Biomed ResInt2016;2016:5258727.
8.Nilius B,Droogmans G.Amazing chloride channels:an overview.ActaPhysiol Scand 2003;177:119-47.
9.Hoefer J,Azam MA,Kroetsch JT,et al.Sphingosine-1-phosphate-dependent activation of p38 MAPK maintains elevated peripheral resistance inheart failure through increased myogenic vasoconstriction.Circ Res 2010;107:923-33.
10.Meissner A,Yang J,Kroetsch JT,et al.Tumor Necrosis Factor-α-Mediated Downregulation of the Cystic Fibrosis Transmembrane ConductanceRegulator Drives Pathological Sphingosine-1-hosphate Signaling in a MouseModel of Heart Failure.Circulation 2012;125:2739 50.
11.Yang J,Hossein Noyan-Ashraf M,Meissner A,et al.Proximal CerebralArteries Develop Myogenic Responsiveness in Heart Failure via Tumor NecrosisFactor-α-Dependent Activation of Sphingosine-1-PhosphateSignaling.Circulation2012;126:196-206.
12.Yagi K,Lidington D,Wan H,et al.Therapeutically Targeting TumorNecrosis Factor-α/Sphingosine-1-Phosphate Signaling Corrects MyogenicReactivity in Subarachnoid Hemorrhage.Stroke 2015;46:2260-70.
13.Kim SG.Quantification of relative cerebral blood flow change byflow-sensitive alternating inversion recovery(FAIR)technique:application tofunctional mapping.Magn Reson Med 1995;34:293-301.
14.Herscovitch P,Raichle ME.What is the correct value for the brain--blood partition coefficient for water?J Cereb Blood Flow Metab 1985;5:65-9.
15.Foley LM,Hitchens TK,Kochanek PM,Melick JA,Jackson EK,Ho C.Murineorthostatic response during prolonged vertical studies:effect on cerebralblood flow measured by arterial spinlabeled MRI.Magn Reson Med 2005;54:798-806.
16.Foltz WD,Porter DA,Simeonov A,et al.Readout-segmented echo-planardiffusion-weighted imaging improves geometric performance for image-guidedradiation therapy of pelvic tumors.Radiother Oncol 2015;117:525-31.
17.Sharma M,Benharouga M,Hu W,Lukacs GL.Conformational andtemperature-sensitive stability defects of the delta F508 cystic fibrosistransmembrane conductance regulator in post-endoplasmic reticulumcompartments.J Biol Chem2001;276:8942-50.
18.Malik FA,Meissner A,Semenkov I,et al.Sphingosine-1-Phosphate Is aNovel Regulator of Cystic Fibrosis Transmembrane Conductance Regulator(CFTR)Activity.PLoS One 2015;10:e0130313.
19.Lin CL,Calisaneller T,Ukita N,Dumont AS,Kassell NF,Lee KS.A murinemodel of subarachnoid hemorrhage-induced cerebral vasospasm.J NeurosciMethods2003;123:89-97.
20.Parra A,McGirt MJ,Sheng H,Laskowitz DT,Pearlstein RD,WarnerDS.Mouse model of subarachnoid hemorrhage associated cerebral vasospasm:methodological analysis.Neurol Res 2002;24:510-6.
21.Aum DJ,Vellimana AK,Singh I,et al.A novel fluorescent imagingtechnique for assessment of cerebral vasospasm after experimentalsubarachnoid hemorrhage.Sci Rep2017;7:9126.
22.Brilstra EH,Rinkel GJ,Algra A,van Gijn J.Rebleeding,secondaryischemia,and timing of operation in patients with subarachnoidhemorrhage.Neurology2000;55:1656-60.
23.Macdonald RL.Delayed neurological deterioration after subarachnoidhaemorrhage.Nat Rev Neurol 2014;10:44-58.
24.Glaser EM,Van der Loos H.Analysis of thick brain sections byobverse-reverse computer microscopy:application of a new,high clarity Golgi-Nissl stain.J Neurosci Methods 1981;4:117-25.
25.Sholl DA.Dendritic organization in the neurons of the visual andmotor cortices of the cat.J Anat 1953;87:387-406.
结果
CFTR功能不足会导致脑灌注减少
先前的研究表明,CFTR显著调节脑动脉的肌源性肌源性张力,并鉴定了脑动脉CFTR蛋白表达与脑灌注之间的强相关性(4,6)。因此,机械学的概念提出纠正脑血管CFTR活性不足(即,由于细胞表面CFTR表达降低而导致S1P转运减少)是使受损的脑肌响应性和脑血流正常化的可行治疗策略(4)。
为了建立脑动脉CFTR活性与脑灌注之间的因果关系,使用了CFTR突变小鼠。由于CFTR
为了直接比较CFTR
CFTR
总而言之,目前的CFTR
C18增加TNF依赖性下调后的CFTR活性
通过高通量药物筛选鉴定的当前CFTR调节药物已在实验和临床上用于减轻囊性纤维化的影响。根据本实施例,选择C18用于研究,因为较早时已证明它与野生型CFTR直接相互作用并稳定野生型CFTR,从而增加了质膜上的CFTR表达(15)。
根据本发明,首先证实C18能够增加小鼠和人的CFTR表达。相对于用载剂治疗的对照,从注射过C18(每天3mg/kg,持续2天)的新生小鼠中分离出的脑动脉显示出更高的CFTR蛋白表达水平(图2A);CFTR mRNA表达不受C18影响(图2B)。为了证实C18对人CFTR的作用,使用了幼年仓鼠肾成纤维细胞的异源表达系统,该系统稳定表达人CFTR构建体。C18治疗(6μmol/L;24h)使仓鼠肾脏成纤维细胞中CFTR蛋白的表达增加了超过一倍(图2C);C18对该系统中的CFTR mRNA表达没有影响(图2D)。总体而言,这些数据与以前的观察结果一致,即C18对CFTR蛋白表达发挥直接稳定作用(15),并证明了其对鼠和人CFTR的功效。
接下来,评估了在合理模拟相关病理生理机制和细胞环境的细胞培养环境中,C18治疗是否增加CFTR的丰度。如先前所证实(4),TNF(10ng/ml)降低了原代血管平滑肌细胞中CFTR蛋白的表达,因此模拟了在HF(4)和SAH(图2E)(6)中观察到的TNF依赖性CFTR下调。正如预期的那样,CFTR表达的下降与FITC-S1P吸收减弱(即CFTR依赖性过程(4);图2F)和毛喉素刺激的碘外流(即CFTR活性的经典量度(13)2G)相关。C18治疗(6μmol/L;与10ng/ml TNF共温育24小时后,与10ng/ml TNF温育24小时)逆转了CFTR表达的下降(图2E)并完全恢复FITC-S1P摄取(图2F)和碘外流(图2G)。这些结果与本发明在下述条件下的预测完全吻合:其中CFTR被下调,C18的蛋白稳态作用会增加总CFTR表达并恢复其活性。
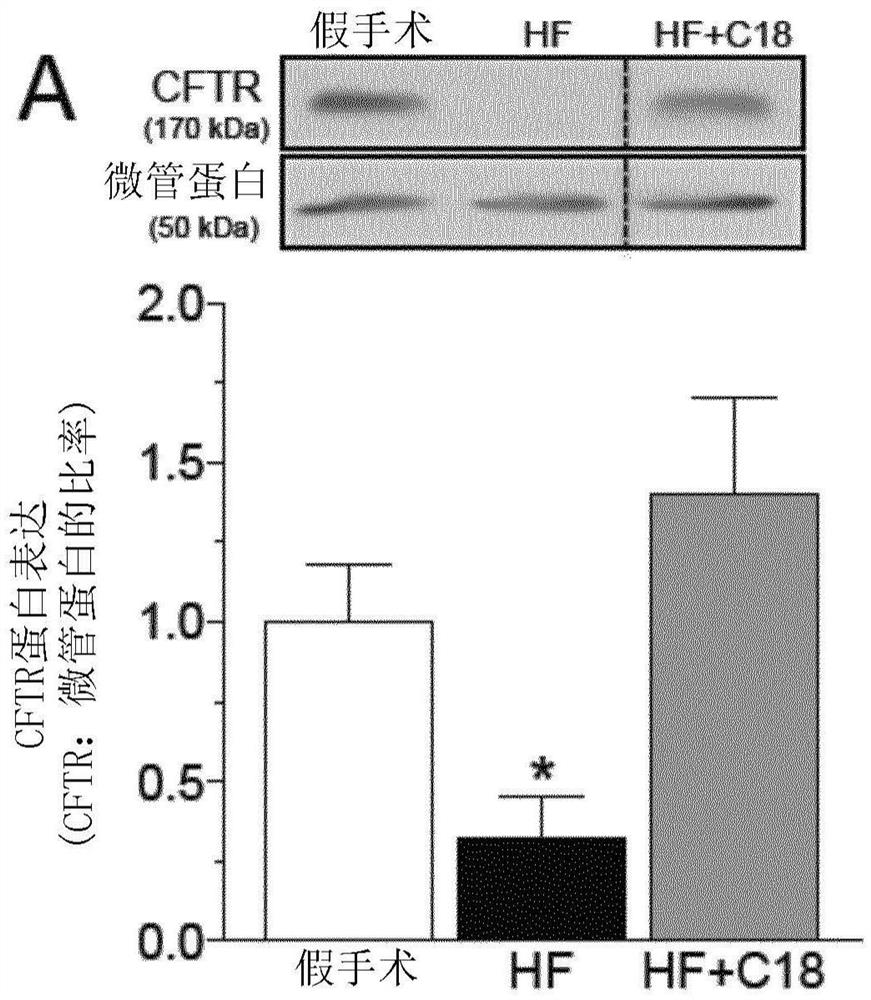
C18治疗纠正心力衰竭中脑血流量不足
如Meissner等人先前所记录(4),HF的诱导刺激了脑动脉CFTR蛋白表达的显著降低(图3A),这与PCA肌源性张力的显著增加相吻合(图3B)。如图2中的数据所预测,体内C18治疗(每天3mg/kg,持续2天)恢复了从患有HF的小鼠中分离出的脑动脉中的CFTR表达(图3A),并同时使PCA肌源性张力正常化(图3B)。由于基础张力的降低,肌源性张力的减弱与苯肾上腺素响应性的预期变化有关。但是EC
在全身水平上,相对于假手术对照,HF的诱导显著降低了CO(图3D;在梗死后6周测量)。TPR作为补偿性响应而增加(图3E),以防止MAP大幅降低(图3F)(3,4)。尽管MAP的降低相对较小,但CBF明显降低(图3G)。体内C18治疗在患有HF的小鼠中恢复CBF(图3G),忠实地与PCA肌源性张力的正常化相关(图3B)。C18不改善由冠状动脉左前降支结扎术引起的心脏损伤:因此,CBF的改善可以明确归因于血管机制。此外,由于C18对TPR或MAP没有影响(图3),因此C18介导的CBF修复必须是局部的微血管作用,与全身血液动力学参数的变化无关。这种治疗方式与先前描述的依那西普干预(3)完全吻合。
除了在系统压力波动时保持恒定的灌注外,肌源性响应还可以保护脆弱的毛细血管床免受压力水平的损害(16),并将毛细血管静水压力保持在使水肿形成最小化的水平(17)。在这种情况下,即使从HF中发生的水平升高,治疗性降低的脑动脉肌源性张力也可能潜在地导致脑水肿形成的适得其反的副作用。因此,使用水肿的非侵入性成像技术来确认在HF的情况下,HF和C18治疗均不在大脑的任何区域引起明显的水肿(图4)。
C18治疗纠正SAH中脑血流不足
先前的工作表明SAH具有与HF相似的脑血管表型,即:(i)脑动脉CFTR蛋白表达降低;(ii)脑动脉肌源性张力增强;(iii)脑灌注减少(6)。与HF(图3)一样,体内C18治疗(每天3mg/kg,持续2天)恢复SAH小鼠脑动脉中的CFTR表达(图5A),并同时使嗅觉脑动脉肌源性张力正常化(图5B)。由于基础张力的降低,肌源性张力的减弱与苯肾上腺素响应性的预期基线变化有关;但是,EC
鲁玛卡托治疗纠正SAH中脑血流不足
C18数据利用CFTR校正剂鲁玛卡托(一种临床相关的C18类似物,其已获得FDA批准用于治疗囊性纤维化)与CFTR增强剂依伐卡托(即
C18和鲁玛卡托减轻SAH中的神经元损伤
SAH诱导的神经元损伤可以通过标准的组织学技术(Fluoro-Jade和活化的半胱天冬酶-3染色)和简单的神经学测试(改良的Garcia评分)容易地表征(6):这些方法用于确定正常肌源性响应性是否恢复以及CBF是否与神经结果改善有关。确实,通过活化的半胱天冬酶3和Fluoro-Jade染色评估,C18和鲁玛卡托均可显著减轻SAH中的神经元损伤(图7);C18治疗的小鼠的神经元损伤减少与神经功能的改善相关(图7E)。具体而言,在改良的Garcia神经功能测试中,SAH小鼠的得分低于假手术的小鼠;然而,经C18治疗的SAH小鼠的神经功能评分可与假手术小鼠相当。
讨论
此前的工作将最初的发现(即CFTR抑制增强了微血管肌源性张力)推进为新的机制概念(4,6):从本质上讲,CFTR关键地调节了S1P的降解,因此在健康和疾病中显著地调节了脑血管张力(4)。本研究将这一知识应用于治疗HF和SAH。通过本发明,引入了心血管药物的新型疗法。本发明在体内证实CFTR是脑血管调节剂,并证实其可被用于改善HF和SAH中的脑灌注。作为多年来出现的第一个新型微血管药物靶标,增强CFTR功能的疗法可能代表着未开发的资源,可用于管理诱发脑血管功能障碍和脑灌注不足的多种病理。
根据本实施例,策略性地选择近端PCA用于本文提出的HF研究,并选择嗅觉脑动脉用于SAH研究,以直接将针对CFTR的干预与此前的研究进行比较(3,4,6)。尽管PCA和嗅动脉起源于大脑微循环的不同区域(即,分别是后部和前部),并且在其基线肌源性张力曲线上显示出差异,但在增强肌源性响应性的病理信号传导机制方面,它们的行为相似(3,4,6)。PCA和嗅动脉中CFTR靶向干预的可比成功表明,CFTR在整个脑微循环中广泛调节血管反应性。
显然,CFTR不调节所有血管床的血管反应性,如以下比较所揭示的:(i)脑和骨骼肌阻力动脉;(ii)TPR测量CFTR突变体和野生型小鼠;以及(iii)C18治疗对TPR的效果的缺乏。通过定量PCR测得的CFTR表达差异,表面上解释了为什么CFTR抑制作用可调节脑动脉的肌源性张力,但在骨骼肌阻力动脉中却没有明显作用。总体而言,本数据表明CFTR疗法将具有对离散的微血管床(例如,脑微循环)特异的受限制作用。该属性是有效血流重新分配的先决条件,并且赋予了相对于一般血管扩张剂显著的治疗优势,一般血管扩张剂可以通过无差别的血管扩张危险地降低血压。
有趣的是,尽管急性/化学CFTR抑制对提睾肌阻力动脉没有影响,但种系CFTR基因缺失却在此特定的微血管床中略微降低了肌源性张力。由于整体CFTR缺失会诱导复杂的心血管表型(18),这种轻度差异可归因于间接和/或适应性响应。发明人之前已经证明CFTR抑制剂在细胞(4)和离体动脉(6)系统中的功效。因此,可以得出结论,CFTR在调节提睾动脉肌的肌源性张力中起着最小的作用。
肌源性响应是CBF自动调节的基础,血管阻力与普遍的透壁压力的连续匹配。因此,旨在增加病理学上降低的CBF的干预措施必须努力恢复正常的肌源性响应性,而不是无差别地抑制血管收缩。通过特异性地使HF和SAH中的肌源性响应性正常化,本发明靶向CFTR的干预预期在体内保留CBF自动调节和对局部血管活性刺激的响应性(例如,神经-血管耦合)。
除了通过自身的调节功能规定脑灌注外,肌源性响应还将毛细血管压力维持在使损伤和水肿形成最小化的水平(16,17)。因此,降低肌源性响应性具有通过允许额外的压力进入毛细血管床而引起水肿形成的潜力。在一个相关方面,由于S1P显著调节血脑屏障通透性(19),因此S1P信号传导的CFTR依赖性变化可能通过屏障功能的改变引起水肿。因此,至关重要的是排除水肿是本干预措施的严重负面影响。实际上,CFTR校正剂治疗(C18)在患有HF的小鼠中不引起水肿。这证实了:(i)静水压力保持在可承受的限度内(这是可以预期的,因为CBF和MAP措施可与假手术动物相当);(ii)在治疗期间保留了血脑屏障功能。
迄今为止,从未在人的脑动脉中评估过脑血管CFTR的表达,在囊性纤维化患者中也未确定过脑灌注。临床上,囊性纤维化与认知损害或缺血性损伤无关;但是,这并不排除大脑灌注减少:如之前所证明的(3,20),大脑可以忍受适度的CBF降低而不会超过明显的损伤阈值。因此,在年轻和其他相对健康的囊性纤维化患者中,认知损害不一定是预期的。尽管毫无疑问的是,灌注不足会严重导致认知能力下降(1)和脑损伤(21),但还需要其他“对系统的打击”,包括由心脏病或SAH引起的衰老和炎症响应,以推动临床上沉默的CBF跨越伤害阈值降低。
获得可行的人脑动脉试样在本质上是困难的:因此,本发明人依靠他们的翻译工作,涉及对系膜和骨骼肌动脉CFTR表达进行系统性人/小鼠比较(22),以确定CFTR是否可能在人脑动脉中表达。在人系膜动脉中,存在CFTR蛋白,其功能抑制导致预期的肌源性响应性增强(22):因此,确认了CFTR是人类阻力动脉肌源性响应性的调节剂。与人系膜动脉相反,人骨骼肌阻力动脉没有可检测到的CFTR蛋白,因此对CFTR抑制不敏感(22)。由于人和小鼠的系膜和骨骼肌动脉的功能曲线重叠(即,CFTR调节系膜,但不调节骨骼肌阻力动脉;图1(4,22)),因此可以推断出,在脑微循环中功能曲线也重叠。在没有直接评估的情况下,这是目前预测CFTR调节剂在人脑血管疾病中的作用的最合理基础。
校正剂化合物目前用于治疗由ΔF508 CFTR突变引起的囊性纤维化:这些化合物有助于将错误折叠的突变CFTR蛋白陪伴到质膜上。缺乏CFTR运输的病理学或伴侣的治疗干预均不适用于HF和SAH,其中会发生基于转录的CFTR表达减少。因此,至关重要的是要确认CFTR调节剂(优选CFTR校正剂,特别是C18和鲁玛卡托)在CFTR蛋白表达下调的实验环境中增加野生型CFTR的丰度。实际上,当前数据显示CFTR调节剂,优选CFTR校正剂,特别是C18和鲁玛卡托,也通过非转录机制增加野生型CFTR丰度。这种蛋白水解作用可稳定细胞表面定位的CFTR免受内化和随后的降解(15)。随着时间的流逝,稳定化细胞表面CFTR会提高总体CFTR表达水平,因为较少的细胞表面CFTR被内化并转移至降解机制。在本发明中使用的疾病模型中,CFTR表达的治疗性恢复与肌源性张力的减弱、CBF的正常化和SAH中的神经元损伤的降低相一致。
由于CFTR是几个器官(最主要是肺)中的关键调节蛋白,因此还必须考虑CFTR治疗剂对非血管组织的影响。值得注意的是,HF下调了肺末端支气管上皮细胞中的CFTR表达(4),因此,CFTR的下降不仅限于这种情况(即,HF引起了有可能驱动多器官衰竭的“囊性纤维化表型”)下的微循环。因此,CFTR治疗剂对HF患者可能具有广泛而实质性的益处,而不仅仅是改善脑灌注。在这种情况下,HF和囊性纤维化均存在几种严重的并存症(co-morbidities)(例如继发性肺动脉高压[24]),这一事实引发了挑衅而投机的争论,即HF的某些继发性病变是由CFTR活性不足引起或加重,因此可以用CFTR治疗剂校正。
结论
本发明提供了CFTR调节脑血管响应性并因此调节脑灌注的首个证据:这将CFTR定位为控制脑灌注的“主开关”。HF和SAH都通过下调脑动脉CFTR蛋白的表达来长期减少脑灌注,从而损害了自动调节的控制。本实施例证实了临床上可获得的CFTR治疗剂可以恢复脑动脉CFTR的表达、血管反应性和脑灌注。值得注意的是,这种治疗作用仅限于脑微循环,因为CFTR确实调节了涉及控制血压的外周动脉的反应性。因此,CFTR疗法成为管理脑血管功能障碍、脑灌注受损和神经元损伤的有价值的临床工具。本实施例显示了CFTR治疗剂预防和改善脑灌注不足、特别是由HF和SAH引起的脑灌注不足的功效。
除了实施例中的上述方法和试剂部分(对于该部分采用了单独的参考文献列表)之外,在本公开中参考以下参考文献。
1.Román GC.Brain hypoperfusion:a critical factor in vasculardementia.Neurol Res2004;26:454-8.
2.Román GC.Stroke,cognitive decline and vascular dementia:the silentepidemic of the21st century.Neuroepidemiology 2003;22:161-4.
3.Yang J,Hossein Noyan-Ashraf M,Meissner A,et al.Proximal CerebralArteries Develop Myogenic Responsiveness in Heart Failure via Tumor NecrosisFactor-α-Dependent Activation of Sphingosine-1-PhosphateSignaling.Circulation 2012;126:196-206.
4.Meissner A,Yang J,Kroetsch JT,et al.Tumor Necrosis Factor-α-Mediated Downregulation of the Cystic Fibrosis Transmembrane ConductanceRegulator Drives Pathological Sphingosine-1-Phosphate Signaling in a MouseModel of Heart Failure.Circulation 2012;125:2739-50.
5.Meissner A,Visanji NP,Momen MA,et al.Tumor Necrosis Factor-αUnderlies Loss of Cortical Dendritic Spine Density in a Mouse Model ofCongestive Heart Failure.J Am Heart Assoc 2015;4:e001920.
6.Yagi K,Lidington D,Wan H,et al.Therapeutically Targeting TumorNecrosis Factor-α/Sphingosine-1-Phosphate Signaling Corrects MyogenicReactivity in Subarachnoid Hemorrhage.Stroke 2015;46:2260-70.
7.Murdaca G,SpanòF,Contatore M,et al.Infection risk associated withanti-TNF-αagents:a review.Expert Opin Drug Saf 2015;14:571-82.
8.Kroetsch JT,Levy AS,Zhang H,et al.Constitutive smooth muscle tumournecrosis factor regulates microvascular myogenic responsiveness and systemicblood pressure.Nat Commun 2017;8:14805.
9.Blankenbach KV,Schwalm S,Pfeilschifter J,Meyer Zu HeringdorfD.Sphingosine-1-Phosphate Receptor-2Antagonists:Therapeutic Potential andPotential Risks.Front Pharmacol 2016;7:167.
10.Boyle MP,Bell SC,Konstan MW,et al.A CFTR corrector(lumacaftor)anda CFTR potentiator(ivacaftor)for treatment of patients with cystic fibrosiswho have a phe508del CFTR mutation:a phase 2 randomised controlledtrial.Lancet Respir Med2014;2:527-38.
11.van Doorninck JH,French PJ,Verbeek E,et al.A mouse model for thecystic fibrosis delta F508 mutation.EMBO J 1995;14:4403-11.
12.Loubinoux I,Volk A,Borredon J,et al.Spreading of vasogenic edemaand cytotoxic edema assessed by quantitative diffusion and T2 magneticresonance imaging.Stroke1997;28:419-26.
13.Malik FA,Meissner A,Semenkov I,et al.Sphingosine-1-Phosphate Is aNovel Regulator of Cystic Fibrosis Transmembrane Conductance Regulator(CFTR)Activity.PLoS One 2015;10:e0130313.
14.Henrion D.Pressure and flow-dependent tone in resistancearteries.Role of myogenic tone.Arch Mal Coeur Vaiss 2005;98:913-21.
15.Okiyoneda T,Veit G,Dekkers JF,et al.Mechanism-based correctorcombination restoresΔF508-CFTR folding and function.Nat Chem Biol 2013;9:444-54.
16.Bidani AK,Griffin KA,Williamson G,Wang X,Loutzenhiser R.Protectiveimportance of the myogenic response in the renal circulation.Hypertension2009;54:393-8.
17.Moien-Afshari F,Skarsgard PL,McManus BM,Laher I.Cardiactransplantation and resistance artery myogenic tone.Can J Physiol Pharmacol2004;82:840-8.
18.Van Iterson EH,Karpen SR,Baker SE,Wheatley CM,Morgan WJ,SnyderEM.Impaired cardiac and peripheral hemodynamic responses to inhaledβ2-agonistin cystic fibrosis.Respir Res 2015;16:103.
19.Prager B,Spampinato SF,Ransohoff RM.Sphingosine 1-phosphatesignaling at the blood-brain barrier.Trends Mol Med 2015;21:354-63.
20.Baron JC.Perfusion thresholds in human cerebral ischemia:historical perspective and therapeutic implications.Cerebrovasc Dis 2001;11Suppl 1:2-8.
21.Jefferson AL,Tate DF,Poppas A,et al.Lower cardiac output isassociated with greater white matter hyperintensities in older adults withcardiovascular disease.J Am Geriatr Soc 2007;55:1044-8.
22.Hui S,Levy AS,Slack DL,et al.Sphingosine-1-Phosphate SignalingRegulates Myogenic Responsiveness in Human Resistance Arteries.PLoS One2015;10:e0138142.
23.Balch WE,Roth DM,Hutt DM.Emergent properties of proteostasis inmanaging cystic fibrosis.Cold Spring Harb Perspect Biol 2011;3:a004499.
24.Roy R,Couriel JM.Secondary pulmonary hypertension.Paediatr RespirRev2006;7:36-44.
- CFTR调节剂在治疗脑血管疾病中的应用
- 野黄芩苷在预防或治疗疾病的药物及调节剂中的应用、药物和调节剂
