一种三重浓度梯度微流控芯片装置及其应用
文献发布时间:2024-04-18 19:52:40
技术领域
本发明涉及微流控芯片技术领域,更具体的说是涉及一种三重浓度梯度微流控芯片装置及其应用。
背景技术
传统的药物浓度梯度试验主要在多孔板上进行,这种方式不仅需要繁琐和重复的步骤,而且需要投入过多的时间和精力。
微流控芯片技术由瑞士科学家Manz和Widmer于20世纪90年代初提出,是本世纪极具代表性的微型分析技术平台之一。微流控芯片作为一种分析技术平台,具有操作简单、高效省时等诸多优点。近年来在疾病诊断、药物筛选、环境监测以及有机合成等领域均有应用。其中,浓度梯度微流控芯片是生物研究中最重要的组成部分之一,浓度梯度微流控芯片可以同时产生各种浓度梯度,而无需手动移液构建浓度梯度。药物筛选和治疗优化等通常需要研究不同药物浓度下的剂量依赖性细胞反应,因此,浓度梯度微流控芯片成为这一领域的有力工具。浓度梯度微流控芯片可以定量、大规模地评估不同药物的毒性和最佳作用浓度,不仅可以提高吞吐量、降低试验成本,而且可以快速、精确地控制和互作,具有更高的梯度分辨率。
然而,现有技术无法实现同时评估不同药物对两种癌细胞的个体效应,即单细胞水平上研究不同剂量的抗癌药物或药物组合对癌细胞的敏感性。但是,单细胞分离和操作的策略在疾病诊断、药物传递和癌症生物学等领域都是十分重要的。同种细胞对特定药物会有广泛的外源性反应,传统的药物筛选方法无法观察到这种异质性,而单个细胞的异质性可能对细胞的生存至关重要。使用群体平均反应的方法通常掩盖了个体细胞的差异。
传统的单细胞分析技术具有处理复杂度高、耗时长的特点,极大地限制了其在细胞异质性研究中的应用。在单细胞水平上快速、可靠地评估药物的耐药性,以及从单个细胞的固有微环境中监测耐药程度的技术仍然缺乏。多组分的高灵敏度检测和大量单个细胞的高通量分析仍然是实现这一目标的关键挑战。同时,在进行单个细胞的生物学行为监测分析时,需要结合其它分析设备和显示设备,在设备集成化方面仍然存在一定困难。
因此,如何提供一种三重浓度梯度微流控芯片装置,用于在单细胞水平抗癌药物筛选是本领域技术人员亟需解决的问题。
发明内容
有鉴于此,本发明提供了一种三重浓度梯度微流控芯片装置及其应用。通过设计了三重浓度梯度微流控芯片装置,并进行了计算机理论模拟和荧光试验验证,保证了装置的可行性,之后基于微流控装置将两种癌细胞(人乳腺癌细胞MCF-7和人肝癌细胞HepG2)和抗癌药物(紫杉醇、顺铂、5-氟尿嘧啶)相结合,进行平面培养条件和单细胞水平上的抗癌药物筛选。
为了实现上述目的,本发明采用如下技术方案:
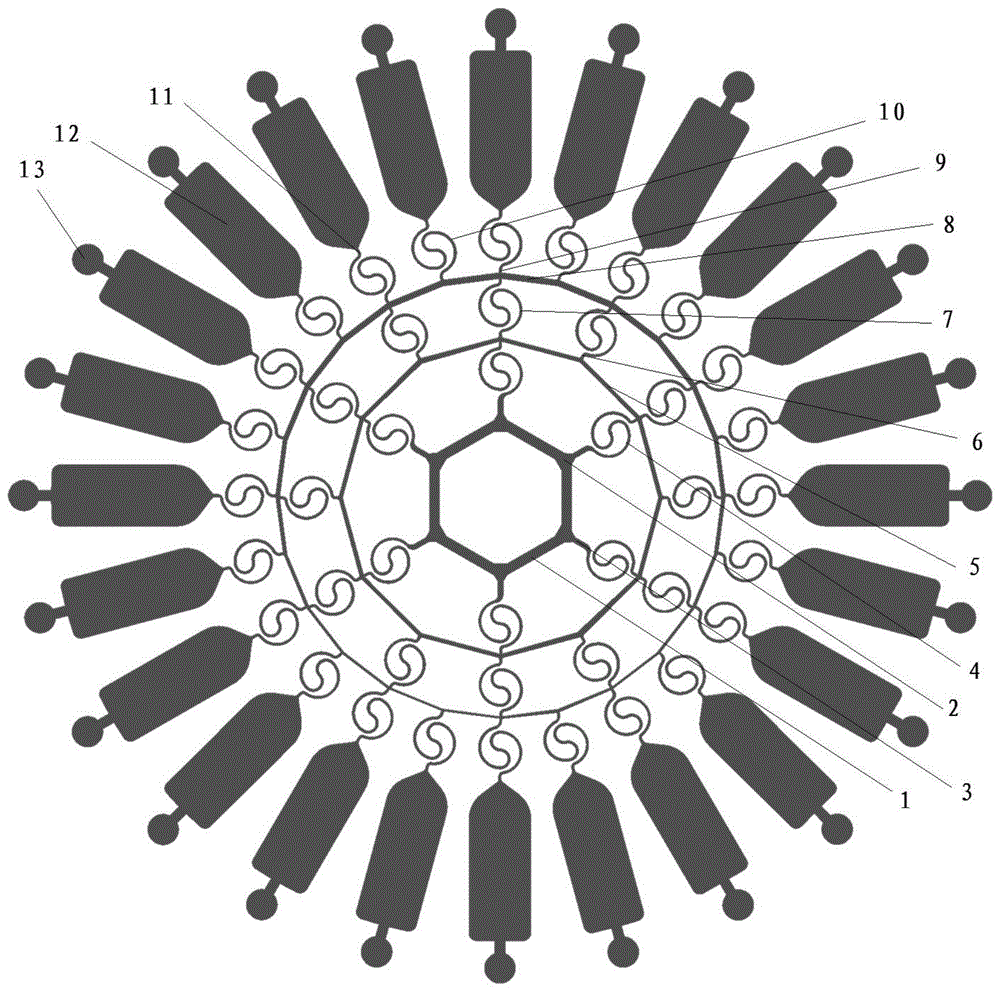
一种三重浓度梯度微流控芯片装置,由上层的流动层与下层的玻璃层构成,流动层上设有浓度梯度结构生成区,其特征在于:浓度梯度结构生成区设有六边形的流体通道(1),六边形的流体通道(1)上等间距设置有3个进样口(2),六边形的流体通道(1)的外周等间距设置有6个第一微通道(3),且每个进样口(2)均与其中一个第一微通道(3)进液端位置相对,每个第一微通道(3)的出液端均连通有第一微环圆圈通道(4),每个第一微环圆圈通道(4)的出液端均连通第一环形通道(5),第一环形通道(5)上等间距设置有12个第二微通道(6),每个第二微通道(6)的出液端均连通有第二微环圆圈通道(7),每个第二微环圆圈通道(7)的出液端均连通第二环形通道(8),第二环形通道(8)上等间距设置有24个第三微通道(9),每个第三微通道(9)的出液端均连通有第三微环圆圈通道(10),第三微环圆圈通道(10)连通有缓冲通道(11),每个缓冲通道(11)的出液端均连通有储液室(12),每个储液室(12)均设有细胞注入口(13);第一微环圆圈通道(4)、第二微环圆圈通道(7)和第三微环圆圈通道(10)内均设置有螺旋式微混合器。
优选的:储液室(12)规格:宽1200μm,长2200μm,高50μm。
优选的:螺旋式微混合器规格:长3000~10000μm,宽50μm,高50μm。
本发明还提供了上述任一的三重浓度梯度微流控芯片装置在药物筛选中的应用。
优选的:还包括组合使用的单细胞捕获装置。
优选的:在单细胞水平上将不同剂量的单一或组合抗癌药物作用于一种或两种癌细胞。
优选的:抗癌药物为5-FU,DDP;癌细胞为MCF-7细胞,HepG2细胞。
优选的:细胞的生物学异质性、耐药性相关联,尺寸小或者变形性大的肿瘤细胞的耐药性比尺寸大或者变形性差的肿瘤细胞强;在相同的药物刺激下,单细胞水平上的细胞活力要低于传统平面培养的细胞。
有益效果在于:设计制备了简单紧凑的三重浓度梯度微流控芯片装置,可以在宽范围的流速条件下快速构建高效和可靠的药物浓度梯度筛选平台。并且可以系统、定量地研究在双螺旋混合器连续调节下浓度梯度形成的动态规律。建立了准确、稳定、可控的三重浓度梯度。能够在与浓度梯度相关的生化研究分析方面,作为一种便携经济的产品,为微流控芯片的发展和生物学研究分析做出贡献。
通过对三重浓度梯度微流控芯片装置内迪恩流效果的探究,进一步验证了不同流速条件对最终形成的系列浓度梯度的影响,确保所设计的浓度梯度微流控装置的可行性。
在不同流速条件下,以0.1的CoV作为可接受混合值的上限,对三重浓度梯度微流控芯片装置形成浓度梯度的能力及范围进行探究,通过计算机数字化模拟软件进行模拟分析。通过对比得知,实际操作得到的结果与计算及模拟结果具有较好的一致性。
基于三重浓度梯度微流控芯片装置制备过程中所使用的PDMS材料的特性,使用50μg/ml的FN溶液对所制备的微流控装置中的通道及微室进行表面修饰,以利于后期的芯片细胞培养以及药物筛选。
经由上述的技术方案可知,与现有技术相比,本发明公开提供了一种三重浓度梯度微流控芯片装置及其应用,取得的技术效果:
1.运用软件Auto-CAD设计三重浓度梯度微流控芯片装置,通过流体力学模型(CFD)进行理论浓度模拟计算,证明了三重浓度梯度微流控芯片装置在宽流速范围内(10~50μL/min)保持稳定有效的线性浓度。
2.对所制备的三重浓度梯度微流控芯片装置进行了不同流速条件下的荧光试验,并对其混合情况、浓度分布及稳定情况等进行了分析,证明制备的三重浓度梯度微流控芯片装置满足研究不同剂量的候选药物对癌细胞的作用。
3.使用纤维连接蛋白对芯片内的储液室进行修饰,使其有利于细胞贴壁生长,之后将MCF-7细胞和HepG2细胞引入储液室内,待细胞正常贴壁、生长状态良好时,持续灌注含有不同剂量抗癌药物的DMEM培养基,使其与储液室内的细胞实现共孵育,最后采用AO/PI荧光双染法对储液室中的细胞进行活力分析,证明了两种癌细胞对抗癌药物呈现出一定的剂量依赖性,同时也证明了该装置是一种简单可靠的药物筛选平台。
4.根据三重浓度梯度微流控芯片装置形成的不同药物的浓度梯度,使用传统的培养瓶培养法和多孔板培养法进行细胞培养并与含有不同剂量药物的DMEM培养基共孵育,之后进行细胞活力鉴定,最后将微流控芯片法与传统方法进行比较,试验结果表明两种方法获得的细胞活力呈良好的线性关系,进一步说明了三重浓度梯度微流控芯片装置可用于进行细胞耐药性试验研究。
5.通过设计单细胞捕获装置,实现单细胞捕获培养,之后结合三重浓度梯度微流控芯片装置研究不同剂量的5-FU和DDP在单一或者组合条件下对MCF-7细胞和HepG2细胞的作用效果。试验结果证明,两种抗癌药物均可有效抑制癌细胞的生长,且组合作用时效果更佳。
6.在相同的药物刺激条件下,进行了平面细胞培养和单细胞水平培养,对药物刺激后的单细胞和平面细胞的活力进行了分析评估,结果表明,相同作用条件下,单细胞水平上的细胞活力要低于平面培养的细胞,这说明平面培养的细胞之间存在细胞互作,具有群体效应,能够在一定程度上抑制抗癌药物对细胞的作用效果,这掩盖了细胞的异质性,单细胞水平上的细胞不受细胞互作的影响,能够更加真实有效地进行细胞的药敏性试验。
7、本发明提供的三重浓度梯度微流控芯片装置能够产生可控、精确和稳定的多重浓度梯度,实现同时评估不同药物对两种癌细胞的个体效应,这有利于大规模定量和准确地评估最佳药物浓度。此外,利用微流控芯片实现了在单细胞水平上研究不同剂量的抗癌药物对癌细胞的敏感性,能够有效筛选单药化疗方案和联合治疗方案。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
图1附图为三重浓度梯度微流控芯片装置示意图,其中,1-流体通道、2-进样口、3-第一微通道、4-第一微环圆圈通道、5-第一环形通道、6-第二微通道、7-第二微环圆圈通道、8-第二环形通道、9-第三微通道、10-第三微环圆圈通道、11-缓冲通道、12-储液室、13-细胞注入口。
图2附图为双螺旋混合器引起迪恩流示意图,其中,A-螺旋混合器通道示意图;B-通道中不同位置以10μL/min的流速进行迪恩流模拟;C-在通道中不同位置以20μL/min的流速进行迪恩流模拟;D-在通道中不同位置以50μL/min的流速进行迪恩流模拟;E-截面迪恩流的定量分析;在图B,C和D虚线所示的位置获得结果。
图3附图为不同流速下浓度梯度的形成图,其中,A-10μL/min;B-20μL/min;C-50μL/min。
图4附图为不同流速下微室内荧光素效果图,其中,A-10μL/min;B-20μL/min;C-50μL/min。
图5附图为线性关系图,其中,A-微室内荧光强度在10μL/min时的线性关系;B-微室内荧光强度在20μL/min时的线性关系;C-微室内荧光强度在50μL/min时的线性关系;D-不同流速条件下各微室内浓度分布情况。
图6附图为每个微室在不同流速下的定量梯度表征图,A-通过试验和计算机模拟获得24个微室在10μL/min流速下的CoV值;B-通过试验和计算机模拟获得24个微室在20μL/min流速下的CoV值;C-通过试验和计算机模拟获得24个微室在50μL/min流速下的CoV值。
图7附图为不同流速条件下的试验值与计算机模拟结果的比较分析图,其中,A-流速为10μL/min时在24个微室内进行浓度值的试验和计算机模拟;B-流速为20μL/min时在24个微室内进行浓度值的试验和计算机模拟;C-流速为50μL/min时在24个微室内进行浓度值的试验和计算机模拟。
图8附图为HepG2细胞在单细胞水平对不同药物浓度梯度5-FU或/和DDP)的反应图,其中,C1~C24:C1:对照;C2~C8即DDP&5-FU组:8.75&12.5μM、7.5&25μM、6.25&37.5μM、5&50μM、3.75&62.5μM、2.5&75μM、1.25&87.5μM;C9~C16即5-FU组:12.5μM、25μM、37.5μM、50μM、62.5μM、75μM、87.5μM、100μM;C17~C24即DDP组:1.25μM、2.5μM、3.75μM、5μM、6.25μM、7.5μM、8.75μM、10μM。
图9附图为B-MCF-7细胞在单细胞水平对不同药物浓度梯度5-FU或/和DDP的反应图,其中,C1~C24:C1:对照;C2~C8即DDP&5-FU组:8.75&12.5μM、7.5&25μM、6.25&37.5μM、5&50μM、3.75&62.5μM、2.5&75μM、1.25&87.5μM;C9~C16即5-FU组:12.5μM、25μM、37.5μM、50μM、62.5μM、75μM、87.5μM、100μM;C17~C24即DDP组:1.25μM、2.5μM、3.75μM、5μM、6.25μM、7.5μM、8.75μM、10μM。
图10附图为在传统平面细胞对不同药物浓度梯度5-FU或/和DDP的反应图,其中,A-HepG2细胞反应图;B-MCF-7细胞反应图。
图11附图为单细胞水平培养和多孔板平面培养细胞活力的比较图,其中A-单细胞水平培养和多孔板平面培养中HepG2细胞活力的比较,B-单细胞水平培养和多孔板平面培养中MCF-7细胞活力的比较。
图12附图为不同大小的细胞活力比较图,其中,A-不同大小的HepG2细胞活力比较,B-不同大小的MCF-7细胞活力比较。
图13附图为三重浓度梯度微流控芯片装置与单细胞捕获装置工作示意图,其中,A:利用双螺旋结构形成三重浓度梯度的微流控装置示意图;B:单细胞捕获装置示意图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本发明实施例公开了一种三重浓度梯度微流控芯片装置及其应用。
实施例中的试剂原料、设备均为市售渠道获得,或现有常用实验设备,例如:PDMS(日本Silicones公司)、荧光素二乙酸酯(FDA,北京索宝来生物公司)、磷酸缓冲液(PBS,北京索宝来生物公司)、FN纤连蛋白(北京索宝来生物公司)、青链霉素(北京索宝来生物公司)、顺铂(DDP,北京索宝来生物公司)、紫杉醇(北京索宝来生物公司)、5-氟尿嘧啶(5-FU,北京索宝来生物公司)、FBS胎牛血清(美国GIBCO实验室)、DMEM培养基(美国GIBCO实验室)、AO吖啶橙(北京索宝来生物公司)、PI碘化丙啶(北京索宝来生物公司)、胰蛋白酶(美国Sigma公司)、荧光微球(上海辉质生物科技有限公司);
CKX41型倒置荧光显微镜(日本Olympus公司)、SZX16型显微镜(日本Olympus公司)、移液枪(德国Eppendorf公司)、AUY220型分析天平(日本岛津公司)、BL-220H型电子天平(日本岛津公司)、AR-100型匀浆机(日本岛津公司)、WS-400B-6NPP型匀胶机(日本岛津公司)、TC20自动细胞计数器(美国Bio-rad公司)、CO
制备工艺:
将通过AutoCAD软件设计所得到的微流控芯片结构打印到透明的掩膜上,再通过光刻机等制备含有微通道结构的PDMS芯片模板,之后进行芯片实物的制备。
(1)流动层的制备
①使用锡箔纸包饰放置模具的器皿,与底部贴平。
②按比例配置A胶和B胶(A胶:PDMS;B胶:固化剂;A胶:B胶=10:1)
③取一小杯与其配平,之后按顺序打开混胶机开关,将小杯放入混胶机中,混胶2min。
④从混胶机中将装有混匀的PDMS胶的纸杯取出,将纸杯中的PDMS胶快速地倒入放置模具的器皿中。
⑤盖好器皿,放入真空箱内抽真空45min。
⑥从真空箱内取出器皿,轻压模具,使其尽量贴紧器皿底部,处理后盖上盖子,在80℃干燥箱中烘干(30min)。
⑦将烘好的PDMS胶从80℃干燥箱内取出,撕去锡箔纸,沿着模具边缘用刀片轻轻划开,将PDMS胶与模具分离。
⑧使用切胶机将PDMS胶切开;使用打孔器对每个微结构进行打孔处理。
⑨使用胶带处理PDMS胶表面的杂质,备用。
(2)载玻片的制备
①配胶(A胶:B胶=15:1)。
②使用混胶机进行离心混胶处理。
③打开真空泵开关,调整转速以及时间(低转速:500转,30s;高转速:1500转,40s),将载玻片居中放置在吸盘上,打开吸附开关。
④确保载玻片吸附在吸盘上后,在载玻片的中央滴胶(1-2滴)。
⑤待甩胶结束后,按解吸按钮,取下载玻片。
⑥将甩好胶的载玻片放入80℃干燥箱内进行热烘处理(30min)。
(3)粘合
①待PDMS胶和载玻片均制备好之后,将芯片正面朝下,粘附在载玻片上,用刀片轻压,排除残留的气泡。
②粘合完成后,将其放入80℃烘箱内,热烘处理3天。
多重浓度梯度芯片通道表面的修饰
在芯片制作完成之后,首先需要对芯片进行紫外灭菌处理,将制备好的芯片放在紫外灯下照射2h。之后使用PBS(0.01M,pH=7.4)缓冲液对微流控芯片装置的通道进行冲洗,再用75%的酒精进行冲洗,最后再使用PBS缓冲液除去残留的酒精。由于PDMS表面不利于细胞进行贴壁生长,因此选用细胞外基质的纤连蛋白(Fibronectin,FN)溶液对芯片内通道的表面进行修饰。利用注射泵向芯片内的微通道中注入50μg/ml的FN溶液,使其充满微流控装置的各个通道,之后将微流控芯片装置放入37℃培养箱中孵育2h,孵育结束后用不含血清的DMEM细胞培养基冲洗掉多余的FN溶液。
实施例1
一种三重浓度梯度微流控芯片装置,由上层的流动层与下层的玻璃层构成,流动层上设有浓度梯度结构生成区,其特征在于:浓度梯度结构生成区设有六边形的流体通道(1),六边形的流体通道(1)上等间距设置有3个进样口(2),六边形的流体通道(1)的外周等间距设置有6个第一微通道(3),且每个进样口(2)均与其中一个第一微通道(3)进液端位置相对,每个第一微通道(3)的出液端均连通有第一微环圆圈通道(4),每个第一微环圆圈通道(4)的出液端均连通第一环形通道(5),第一环形通道(5)上等间距设置有12个第二微通道(6),每个第二微通道(6)的出液端均连通有第二微环圆圈通道(7),每个第二微环圆圈通道(7)的出液端均连通第二环形通道(8),第二环形通道(8)上等间距设置有24个第三微通道(9),每个第三微通道(9)的出液端均连通有第三微环圆圈通道(10),第三微环圆圈通道(10)连通有缓冲通道(11),每个缓冲通道(11)的出液端均连通有储液室(12),每个储液室(12)均设有细胞注入口(13);第一微环圆圈通道(4)、第二微环圆圈通道(7)和第三微环圆圈通道(10)内均设置有螺旋式微混合器。
为进一步优化技术方案:储液室(12)规格:宽1200μm,长2200μm,高50μm。
为进一步优化技术方案:螺旋式微混合器规格:长3000~10000μm,宽50μm,高50μm。
见图1,实施例提供的三重浓度梯度微流控芯片装置包括42个双螺旋混合器、24个储液室、3个样品入口和24个出口。利用三个进口的设计,能够形成三重浓度梯度,满足同时进行单种药物浓度筛选以及两种药物组合筛选的要求。
其中,3个样品入口用于灌注源溶液,双螺旋微混合器主要用于扩散混合不同的源溶液,从而在储液室中成功地形成系列药物浓度梯度。在结构方面具有很高的灵活性,通过双螺旋混合器的扩散混合作用,可以在不同流速条件下实现很好的混合效果,可以用来分析多种液体,研究单种药物和多种药物的可能组合及其最佳剂量,三重浓度梯度微流控芯片装置的构建为后续的细胞耐药性研究分析奠定了基础。
技术效果
不同流速条件下通道内迪恩流的探究
在不同流速条件下,通道内迪恩流场所形成的横向二次流的效果有所不同,对于溶液的混合效果会产生不同的影响,选择10μL/min、20μL/min和50μL/min三种流速进行灌注,对不同流速条件下通道内产生的迪恩流进行模拟分析。
结果表明:通过对相关区域内分布的迪恩流场分布进行分析可知,通道内的迪恩流强度与流速呈正相关,即随着流速的增大,迪恩流强度增加,从而实现了短时间内促进通道内溶液的混合,参见图2。
不同流速条件下浓度梯度芯片微室内的浓度表征
为了验证浓度梯度装置在不同流速条件下所形成的的浓度是否一致,选择10μL/min、20μL/min和50μL/min三种流速进行灌注,测定在三种流速条件下装置中各个微室所形成的浓度以及混合效果是否相同。以证明所构建的浓度梯度微流控芯片装置能够在宽范围流速条件下达到良好的混合效果。首先灌注PBS缓冲液,使其充满微结构通道,排除在灌注过程中微通道内产生的气泡。之后将FDA溶液和PBS溶液通过装置的入口灌注到微通道中,利用倒置荧光显微镜观察各个微室内的混合情况,再通过Image-
1、选择不同的流速条件进行源溶液的混合,观察各个微室最终的混合效果。
结果表明:如图3所示,通过计算机模拟可知,在10μL/min、20μL/min、50μL/min的流速条件下,浓度梯度发生器的24个储液室内形成了三组浓度梯度,且混合效果良好。
2、为了评估操作条件对三重浓度梯度形成的影响,选择在不同的流速条件下通过使用FDA溶液对浓度梯度发生器的梯度形成情况进行验证,探索24个微室中FDA的分布情况。将FDA和PBS通过进口灌注到芯片中,如图4所示。
结果表明:得到的荧光图像表明,在流速分别为10μL/min、20μL/min和50μL/min时,微室内的FDA和PBS均能实现稳定良好的混合,各个微室内的浓度均无显著差异。
3、对于荧光图像进行进一步回归曲线分析处理可知,微室中FDA的平均信号强度与模拟的浓度呈现良好的线性关系,如图5所示,各微室的的FDA和PBS的混合效果稳定有效,说明三重浓度梯度装置在宽流速范围内能够实现不同源溶液的混合,混合状态理想。
不同流速条件下浓度梯度芯片微室内变异系数的探究
将芯片装置置于倒置荧光显微镜下,使用数字注射泵控制流速,分别将FDA和PBS灌注到装置中的微通道中,操作过程中使用到的流速分别为:10μL/min、20μL/min、50μL/min。使用CellSens standard成像软件对整个研究进行实时流量监控。主要测定双螺旋混合器不同位置的混合效果。最后将试验结果与计算机模拟结果进行比对分析,对两种浓度梯度微流控芯片装置的可行性进行进一步的分析比较。
采用CFD软件建立CFD模型,进行微流控模型理论浓度的模拟计算,用于测量区域内溶液的扩散程度。
结果表明:如图6所示,定量分析比较了在10μL/min、20μL/min和50μL/min的流速条件下,每个微室中形成的浓度梯度的试验值和模拟值的CoV值,可以看到,试验值与计算机模拟结果一致,不同微室中的形成浓度的CoV值均小于0.1或接近0.1,符合可接受的上限阈值。
10μL/min、20μL/min和50μL/min不同流速条件下的试验值与计算机模拟结果的比较分析。
结果如图7所示,三重浓度梯度微流控装置能够利用双螺旋混合器在宽流速范围内形成三组稳定有效的浓度梯度系列。通过计算机模型得到的模拟数值和试验结果一致,进一步说明该装置的可行性,说明该装置可用于后续试验中的研究分析。
实施例2
三重浓度梯度微流控装置用于抗癌药物筛选
见图13,单细胞捕获装置是由排列在二维阵列中的5组矩捕获阵列组成。在每个阵列中,每个捕获单元由两个相邻的“H”型微结构组成,实现单细胞捕获,具体结构参见文献“Construction ofsingle-cell arrays and assay ofcell drug resistance in anintegrated microfluidic platform,P Long,W Liu,T Chang,J Xu,T Li,Shu-Wei Chen,J Wang,Lab on a Chip,2016/11/15”
其中,三重浓度梯度管道出口与单细胞捕获装置的试剂进口相连(图中ReagentInlet)。
单细胞捕获与药物刺激
将无菌的50μg/ml的FN溶液灌注到捕获培养细胞的微装置中,37℃条件下孵育2h,促进细胞粘附,多余的FN溶液用PBS缓冲液冲洗。在10μL/min的流速条件下,将细胞密度为1.0×10
停止药物刺激后采用常规的AO/PI染色法进行细胞活性评估。用PBS洗涤后,将AO/PI工作液灌注到单细胞捕获装置中,将芯片置于37℃培养箱中孵育15min,待染色完成后使用PBS进行冲洗。最后,利用荧光显微镜观察并采集荧光图像,以评估细胞在不同浓度的单药物刺激和组合药物刺激后的活力。将采集到的图像与对照组图像进行比较,并通过Image-
细胞活力分析
选择5-FU和DDP作为试验药物。研究两种药物对HepG2细胞的作用效果时,将试验分为三组,5-FU组和DDP组分别测定对单一药物的反应,DDP&5-FU试验用于研究两种药物之间的组合关系。
在第一组试验中,分别选择初始浓度为100μM的5-FU和初始浓度为10μM的DDP,溶于细胞培养基中。将含有5-FU的细胞培养基从进口1灌注,将含有DDP的细胞培养基从进口2灌注,不含药物的普通培养基从进口3灌注,利用浓度梯度发生器装置中的螺旋混合器进行扩散混合,最终在储液室中形成了三组浓度梯度,将其作用于装置中的HepG2细胞(2h)。
同样地,在对MCF-7细胞进行刺激时,将初始浓度为100μM的5-FU溶于细胞培养基后从进口1灌注,将初始浓度为10μM的DDP溶于培养基后从进口2灌注,进口3灌注普通的细胞培养基,三种源溶液通过浓度梯度装置中的螺旋混合器结构,最终形成三组浓度梯度,将不同浓度的含药培养基作用于单细胞捕获装置中的MCF-7细胞(2h)。之后使用AO/PI工作液对微装置和培养板中的细胞进行染色,并对两种培养条件下的细胞活力进行分析比较,观察细胞活力是否存在差异。
如图8所示,可以明显观察到,在微装置中的HepG2细胞,使用单种药物刺激细胞,当作用的药物剂量低时,细胞状态较好,细胞活力佳,当作用的药物剂量高时,细胞活力明显下降,细胞活力和药物剂量呈正相关关系。与此同时,试验结果表明,当两种药物组合作用细胞时,细胞活力均低于单种药物作用,说明两种药物组合形成协同作用,对细胞的抑制作用效果强于单种药物。此外,发现单细胞捕获装置中尺寸大的细胞的死亡程度要高于尺寸小的细胞,说明细胞在处于不同生长阶时,其耐药性存在差异。对MCF-7细胞进行了相同处理,如图9所示,可以观察到MCF-7细胞也呈现出相同的趋势。
对比实验
对HepG2细胞和MCF-7细胞进行了传统多孔板培养,在与实施例2相同的条件下,将不同浓度的含药培养基与两种癌细胞共孵育2h。如图10A、B所示,可以明显看到,在受到药物刺激后,培养板中的HepG2细胞出现了聚团现象,这可能是由于在药物作用下,细胞群体做出的应激反应,高浓度药物作用下的细胞凋亡程度明显高于低药物浓度作用下的细胞,在组合药物作用下效果愈加明显,细胞凋亡程度加剧。同样地,对MCF-7细胞进行了相同条件的处理,得到了类似的结果。
对于药物刺激后的单细胞和传统平面细胞的活力进行了分析比较,如图11A、B所示,可知,在相同的药物刺激下,单细胞水平上的细胞活力要低于传统平面培养的细胞,这说明,传统平面培养的细胞之间存在细胞互作,具有群体效应,能够在一定程度上抑制抗癌药物对癌细胞的作用效果,但是传统平面培养,得到的往往是群体的平均反应,细胞之间存在互作,这在一定程度上掩盖了细胞的异质性;单细胞水平上的细胞不受细胞互作的影响,能够真实有效地进行单细胞对抗癌药物的敏感性研究。平面培养的细胞耐药性要强于单细胞的耐药性。
此外,由于单细胞捕获装置能够进行不同大小的和变形性细胞的分离,选择了阵列中尺寸最小和最大的阵列所捕获的单细胞作为研究对象,将捕获在该阵列中的经药物刺激后的细胞进行荧光染色后,再通过Image-
综上,实施例将生物学适应性分析的单细胞捕获装置,与三重浓度梯度微流控芯片装置结合,实现在单细胞水平上应用三重浓度梯度微流控芯片装置研究不同剂量的5-FU和DDP单一或组合对MCF-7细胞和HepG2细胞的作用效果。试验结果表明,两种药物均能有效抑制癌细胞的生长,组合作用时效果更佳。即利用三重浓度梯度微流控芯片装置可有效研究单细胞水平上不同候选药物的最佳剂量,有效筛选单药化疗方案和联合治疗方案。
使用5-FU和DDP两种抗癌药物,对癌细胞HepG2和MCF-7进行了不同剂量的给药试验,发现两种细胞对两种抗癌药物都具有依赖性,且相同剂量下,两种药物组合的作用效果要强于单种药物作用。
利用AO/PI双染色法对于药物作用后的细胞活性进行了鉴定,并通过对比传统多孔板培养方法,进一步说明了单细胞水平上的细胞耐药性和传统平面培养的细胞在耐药性方面存在差异,为将来进行不同培养方式下抗癌细胞药物筛选提供了理论依据。
本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同相似部分互相参见即可。对于实施例公开的装置而言,由于其与实施例公开的方法相对应,所以描述的比较简单,相关之处参见方法部分说明即可。
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
