一种甲基丙烯酸丁二酸双酯化淀粉及其制备方法与在角膜缺损原位填充剂中的应用
文献发布时间:2024-04-18 20:01:30
技术领域
本发明属于生物医用材料技术领域,具体涉及一种甲基丙烯酸丁二酸双酯化淀粉及其制备方法与在角膜缺损原位填充剂中的应用。
背景技术
角膜疾病是全球导致视力损害和失明最常见的原因之一。对晚期角膜疾病最有效的治疗方法是角膜移植,然而这一治疗方案仅对约5%的患者有效。角膜移植手术除了供体短缺和手术费用高外,同种异体移植物还可能具有免疫排斥和感染的固有风险。此外,该手术需要先进的手术技能,缝合线的使用会导致并发症,如缝合侵蚀、缝合部位浸润、感染性角膜炎、即将发生伤口裂开以及缝合去除后伤口裂开等。角膜缺损愈合中无缝合线植入在结构和功能上模仿天然角膜,是促进角膜内源性再生的潜在方法。
无缝线原位成型角膜填充物应具有以下性能:一方面,在创面处原位成型角膜的方案需要实现无需缝合线即可将角膜替代品紧密地粘附在植床上(原位成型的角膜或者同种异体角膜),这对临床手术有巨大的吸引力。另一方面,支持角膜修复和再生并与角膜基质机械匹配以发挥保护作用。具体来说,替代品应支持间质的细胞外基质(ECM)再生,以及功能性角膜上皮的发育,以保护眼内内容物免受致病性侵袭。同时,替代品应坚固,以承受眼压(IOP)和其他损伤这要求替代品具有良好的力学性能。
目前,尚未出现商用的无缝线角膜原位填充剂,这是因为材料的优良的力学性能,光学性能,黏附性能和良好的生物相容性很难同时实现。但是针对手术缝合线的缺陷,目前已有几种商用的生物粘合剂作为缝线的替代材料以尝试实现角膜移植中的无缝线伤口闭合。当前的商业化生物粘合剂主要分为两类,一类是氰基丙烯酸酯类生物粘合剂,另一类是纤维蛋白胶类生物粘合剂。氰基丙烯酸酯类生物粘合剂具有较高的黏附能力,但具有显著的降解毒性,因此生物相容性极差,而纤维蛋白胶类生物粘合剂生物相容性好,但黏附强度弱,力学性能差。因此,当今市面上仍旧缺乏能够实现用于角膜缺损板层移植的无缝线角膜原位填充剂。
发明内容
为克服目前人供体角膜缺乏,角膜移植手术缝合线妨碍角膜组织正常修复,对角膜组织产生二次损伤并且容易引发炎症的现状,本发明的目的在于提供一种甲基丙烯酸丁二酸双酯化淀粉及其制备方法与在角膜缺损原位填充剂中的应用。该角膜缺损原位填充剂具有强大黏附性,力学性能可控且生物相容性优异。
本发明的目的通过以下技术方案实现。
一种甲基丙烯酸丁二酸双酯化淀粉(StacMA),结构如式VII所示:
以上所述的一种甲基丙烯酸丁二酸双酯化淀粉的制备方法,包括以下步骤:
(1)将淀粉溶液糊化;
(2)糊化结束后降温至60℃以下(0-60℃),随后向溶液中加入丁二酸酐,维持pH=8-10,反应4-24h;
(3)反应结束后向溶液中滴入甲基丙烯酸酐,维持pH=8-10,反应2-8h;
(4)反应结束后进行透析、离心、干燥,得甲基丙烯酸丁二酸双酯化淀粉。
优选的,所述淀粉、丁二酸酐、甲基丙烯酸酐的用量关系为质量比为1:0.5:0.5-1:1:1
优选的,甲基丙烯酸丁二酸双酯化淀粉(StacMA)的制备过程如下所示:
优选的,甲基丙烯酸丁二酸双酯化淀粉(StacMA)的制备步骤:
(1)将马铃薯淀粉以5%(w/v)的浓度溶解于100ml去离子水中,500rpm,90℃糊化1h。
(2)糊化结束降温至40℃,随后向溶液中加入丁二酸酐,维持pH=8-10,500rpm反应6h。
(3)反应结束向溶液中滴入甲基丙烯酸酐,维持pH=8-10,500rpm反应4h。
(4)上述反应结束后将溶液置于透析袋(8000-14000)存放于去离子水中透析5天(换水频率为每天3次)。
(5)透析结束得到产物离心(8000rpm,2min)收集上清液。
(6)产物冷冻干燥,所得样品甲基丙烯酸丁二酸双酯化淀粉保存于室温干燥环境。
步骤(1)由于淀粉不溶于水因此需要预先糊化以增加反应效率。
步骤(2)(3)维持pH=8-10的目的是催化酸酐与伯羟基的反应加速形成酯键。
步骤(4)透析的目的是为了去除步骤(2)(3)溶液中未反应的丁二酸酐,甲基丙烯酸酐,以及反应生成的甲基丙烯酸。
步骤(5)离心的目的是进一步纯化产物除去不溶于水的杂质。
步骤(6)在干燥环境中保存的目的在于防止亲水性的甲基丙烯酸丁二酸双酯化淀粉吸潮。
一种角膜缺损原位填充剂,由甲基丙烯酸丁二酸双酯化淀粉(StacMA)、甲基丙烯酰化明胶(GelMA)、光引发剂和溶剂组成;
所述甲基丙烯酸丁二酸双酯化淀粉的结构如式IX所示:
所述甲基丙烯酰化明胶的结构如式XI所示:
优选的,所述甲基丙烯酸丁二酸双酯化淀粉在角膜缺损原位填充剂中的用量为0.01-0.05g/ml。
优选的,所述甲基丙烯酰化明胶在角膜缺损原位填充剂中的用量为0.1-0.15g/ml。
优选的,所述光引发剂为光引发剂I2959。
优选的,所述光引发剂在角膜缺损原位填充剂中的用量为0.005g/ml。
优选的,所述溶剂为PBS缓冲溶液。
优选的,甲基丙烯酸酰化明胶(GelMA)的制备过程如下所示:
优选的,甲基丙烯酸酰化明胶(GelMA)的制备步骤:
(1)将明胶以10%(w/v)的浓度溶解于100ml PBS缓冲液(1×)中,50℃,500rpm溶解1h。
(2)待明胶完全溶解后以0.2ml/min的速度向溶液内逐滴滴入1ml甲基丙烯酸酐(MA),滴加完毕后50℃,pH=8-10,500rpm反应4h。
(3)反应结束后在32℃去离子水中透析(8-14kDa)。
(4)频繁换水透析5天,冷冻干燥产物,所得样品GelMA保存于室温干燥环境。
步骤(1)与步骤(2)保持50℃的反应温度是防止明胶溶液在反应过程中凝胶,阻碍接枝反应的进行。
步骤(2)中维持pH=8-10的目的是催化酸酐与氨基的反应加速形成酰胺键。
步骤(3)32℃的透析温度与前两步类似,目的在于防止明胶溶液在透析过程中凝胶,导致其中含有的甲基丙烯酸酐小分子未被完全除去。
以上任一项所述的一种角膜缺损原位填充剂的制备方法,包括以下步骤:
(1)将甲基丙烯酸丁二酸双酯化淀粉与光引发剂共同溶解于PBS缓冲溶液中(避光),通过涡旋及搅拌的方式使两种组分充分溶解,得到溶液Ⅰ;
(2)将甲基丙烯酰化明胶与光引发剂共同溶解于PBS缓冲溶液中,于37℃水浴促使溶解(避光),得到溶液Ⅱ;
(3)将溶液Ⅰ与溶液Ⅱ混合均匀,得到角膜缺损原位填充剂。
步骤(1)由于StacMA溶液粘度很高,且其溶解条件与改性明胶不同,故采用分开溶解后混合的策略。
步骤(2)中改性明胶具有溶解温度高的特性故采用加热溶解的策略。
本发明通过一种全新的方法,在以天然高分子为骨架,对天然高分子进行化学改性引入具有特性功能的官能团,其中,改性淀粉组分在原有大分子结构基础上对其部分的结构单元进行了接枝羧化处理,目标是在大分子链上引入羧基增加淀粉水溶性,随后对明胶和改性淀粉接枝双键使其拥有光响应特性,两种改性产物主链均为原大分子主体,并无发生改变,并且保留了淀粉的二级结构。在保证了体系的生物相容性的同时,赋予生物填充剂快速的光响应性,优异的力学性能和强大的黏附能力。该体系能够实现在角膜板层移植缺损处原位填充、成型并牢固的铆钉与角膜植床上,促进受损角膜结构与功能的再生和重建,在角膜组织工程等多种生物医学领域内具有巨大的应用潜力。
相对于现有技术,本发明具有如下优点及有益效果:
(1)本发明的原料来源于天然物质,获取简单,制备甲基丙烯酸丁二酸双酯化淀粉与甲基丙烯酰化明胶的方法具有线路简单操作方便,试剂毒性低,纯化方式简单,产率较高且产物易保存等优点。
(2)本发明的生物填充剂组成成分均为天然高分子基材料,具有良好生物相容性,能够有效促进生物组织缺损部位的损伤修复而不引起严重的炎症反应。
(3)本发明的甲基丙烯酸丁二酸双酯化淀粉与甲基丙烯酰化明胶复合后得到的生物填充剂,其在保持原有的良好生物相容性的同时,具有独特的光响应黏附性能以及良好的力学性能,能够实现角膜板层移植的伤口无缝线填充,并实现填充材料稳定黏附。
附图说明
图1a、图1b分别为本发明实施例1所得甲基丙烯酸丁二酸双酯化淀粉(StacMA)和甲基丙烯酸酰化明胶(GelMA)的合成路线示意图。
图2a、图2b分别为本发明实施例1所得甲基丙烯酸丁二酸双酯化淀粉(StacMA)、甲基丙烯酸酰化明胶(GelMA)的核磁谱图。
图3为本发明实施例3对所得生物粘合剂的力学性能-断裂伸长率结果图(对照组为GelMA)。
图4为本发明实施例3对所得生物粘合剂的力学性能-断裂强度结果图(对照组为GelMA)。
图5为本发明实施例2对所得生物粘合剂的光响应黏附性能测试结果图。
图6为本发明实施例4对所得生物粘合剂生物相容性结果图。
图7为本发明实施例5对所得生物粘合剂透过率结果图。
图8为本发明实施例6对所得生物粘合剂光固化性能结果图。
具体实施方式
下面结合附图和实施例对本发明作进一步详细描述,但本发明的实施方式不限于此。下列实例中原料与试剂均可购买得到。
图1a、图1b分别为本发明中甲基丙烯酸丁二酸双酯化淀粉(StacMA)和甲基丙烯酰化明胶(GelMA)的合成路线示意图。
本发明实施例中,所有黏附实验均按照美国材料试验学会ASTM F2205-05剪切搭接测试方法进行,力学性能测试是根据美国材料试验学会ASTM F2150-19指南,使用万能材料试验机(Instron 5967)进行单轴拉伸测试,使用DMA进行无侧限压缩测试表征材料不同的力学性能表现。
以下的w/v对应的单位为g/ml。
实施例1
淀粉先在90℃,500rpm的环境条件下,以5%(w/v)的浓度分散在100ml去离子水中。待其完全糊化后,降温至40℃,随后向溶液中加入丁二酸酐(淀粉、丁二酸酐、甲基丙烯酸酐的质量比为2:1:1),500rpm,40℃,并不断滴入5M的NaOH溶液维持pH=8-10从而催化淀粉的酯化。反应6h后向溶液中加入甲基丙烯酸酐对淀粉进行二次酯化,反应条件与第一次酯化反应阶段相同,时间为4h。反应结束后,将反应溶液置于去离子水中透析(8-14kDa)5天,冷冻干燥,所得样品StacMA保存于室温干燥环境。
明胶先在50℃,500rpm的环境条件下,以10%(w/v)的浓度溶解在100mlPBS(1×)中。待其完全溶解后,向溶液中加入1%(v/v)的甲基丙烯酸酐,保持50℃,500rpm的反应条件3h。反应结束,将反应溶液置于32℃去离子水中(8-14kDa)5天,冷冻干燥,所得样品GelMA保存于室温干燥环境。
将10mg上述制得的StacMA和GelMA分别溶解于0.6ml氘代水中。本实施例的产物的核磁测试结果见图2a、图2b。
如图2a所示:a峰为丁二酸酐的烷基峰,通过积分可得丁二酸酐取代度为7%,c峰为甲基丙烯酸的甲基峰,b峰为甲基丙烯酸的双键氢的特征峰,通过积分可得甲基丙烯酸取代度为10%。
如图2b所示:a峰为甲基丙烯酸的双键氢的特征峰,b为明胶上的与氨基相邻的亚甲基的特征峰,通过积分可得甲基丙烯酸的氨基的取代度为70%。
设置StacMA和GelMA质量含量不同的组别,配置生物填充剂。使用GS来表示生物填充剂组别,其中G10,G10S1,G10S3,
G10S5,G15,G15S1,G15S3,G15S5成分组成为10%GelMA,0%StacMA;
10%GelMA,1%StacMA;10%GelMA,3%StacMA;10%GelMA,5%StacMA;15%GelMA,0%StacMA;15%GelMA,1%StacMA;15%GelMA,3%StacMA;15%GelMA,5%StacMA;其中,StacMA和GelMA分别与光引发剂I2959(0.5%w/v)通过涡旋超声共同溶解于PBS(1×)中得溶液Ⅰ和Ⅱ,通过控制Ⅰ和Ⅱ的不同浓度来控制复合材料的最终配比。使用时将两溶液等比例混合均匀用于探索生物填充剂的综合性能,包括力学性能,透光率,剪切黏附性能以及生物相容性等性能特点。
实施例2
(1)首先将明胶在50℃,500rpm的环境条件下加热溶解于PBS(1×)中制备浓度为20%(w/v)的明胶溶液,随后将明胶溶液滴加至黏附载玻片表面,待其风干以制得具有明胶涂层的黏附载玻片。
(2)随后向两片含有明胶涂层的黏附载玻片之间滴加50μl实施例1制得的生物填充剂,并将该试样置于紫外光下照射90s以得到用于黏附强度测试的生物填充剂试样(对照组不进行紫外光照)。
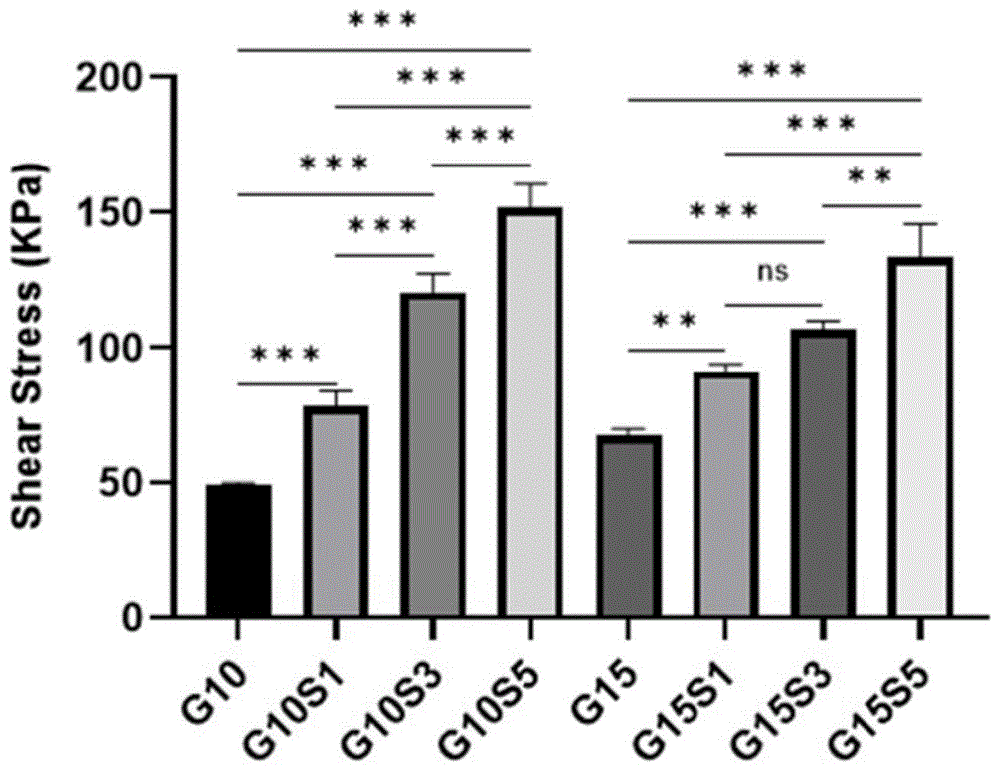
(3)用万能拉伸试验机对生物填充剂进行黏附强度测试,万能拉伸试验机的应变速率为5mm/min,结果见图5,所有组别重复3-4次。
如图5所示:随着改性淀粉StacMA的加入,材料的整体粘附性明显增强,并且黏附性能与StacMA的量呈正相关关系,代表StacMA有极佳的增黏特性。
实施例3
(1)将实施例1制得的生物填充剂滴加至40×5×2.5mm的模具中置于紫外光下照射90s制备成长方体样条。
(2)将样品条两端在滤纸的包裹下固定于万能材料试验机的夹具上。
(3)用万能拉伸试验机对不同成分组成的生物填充剂样条进行单轴拉伸测试,万能拉伸试验机的应变速率为100%/min,结果见图3、图4,所有组别重复3-4次。
如图3、图4所示:随着改性淀粉StacMA的加入,材料断裂强度和断裂伸长率明显提高。当GelMA与StacMA的质量比在3:1时,材料的断裂强度约是纯GelMA的3倍,且断裂伸长率不会降低。
实施例4
(1)将实施例1制得的生物填充剂滴加至模具中置于紫外光下照射90s固化,随后将制得的样块置于超净台紫外曝光过夜灭菌。
(2)灭菌后将制得的生物填充剂在37℃的环境条件下,按0.2g/ml的量浸泡在完全培养基中72h以制备生物填充剂浸提液。
(3)浸泡结束后将制得的浸提液用0.22μm滤膜过滤进行二次灭菌后用于进行兔角膜上皮细胞的培养,分别在第1,3,5天时通过CCK-8试剂进行细胞存活及增殖情况检验,结果见图6。
如图6所示:材料浸提液无细胞毒性,并且G10S3组(GS)显示出明显的促进细胞增殖的效果。证明材料生物相容性极佳。
实施例5
(1)将实施例1制得的生物填充剂滴加至直径10mm高度100μm模具中置于紫外光下照射90s固化;
(2)将制得的100μm厚的水凝胶薄膜铺展到石英比色皿中于紫外-可见光谱仪上测试透过率,结果见图7。
如图7所示:所有组别在可见光区透光率虽相对于纯GelMA组有所降低,但透光率均大于80%,表明材料具有优良的透明度,满足应用于角膜修复领域的使用场景。
实施例6
将实施例1制得的生物填充剂选取最佳组分G10S3组至流变仪的测试台上进行光固化性能测试,具体参数为:扫描距离0.5mm,0s前:剪切应变800%,角频率10rad/s,无紫外光;0s后:剪切应变10%,角频率10rad/s,紫外光强度1.5mW/cm
如图8所示:G10S3组在极低的紫外光能量的照射下1.5mW/cm
上述具体实施例,均为本发明可行的实施方式,对本发明的目的、技术方案和有益效果进行了进一步详细说明。但本发明的实施方式并不受上述实施例的限制,其它的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
